前回の続きです!!初めての方はこちらから読み始めてください!!
蛋白変性のサブテーマが七つもあったので蛋白変性の解説が長くなりましたがやっと脂肪変性に到達しました。蛋白変性のサブテーマが七つもあるので蛋白変性による疾患が細胞変性疾患で一番多いのです。
3)脂肪変性。脂肪が沈着。脂肪肝、動脈粥状硬化症、四塩化炭素中毒。 四塩化炭素中毒の肝毒性とは?四塩化炭素の肝毒性発現には、肝臓で薬物代謝酵素によって生じるフリーラジカルや脂 質の過酸化の過程で生じるフリーラジカルが関与している。四塩化炭素は脂肪組織、 肝臓、血液、脳、 腎臓及び筋肉などの主要臓器に分布し、脂肪組織中 では特に高濃度である。四塩化炭素は 肝臓、腎臓および肺において最も 鋭敏で脂肪変性が最も起こりやすい臓器なのです。
4)糖原変性
グリコーゲンが細胞内に蓄積。糖尿病、糖原病、結核、肝硬変。 糖原病とは何でしょうか?肝を主病変とし、肝臓の組織にグリコーゲンが蓄積する。糖原病は、糖の一種であるグリコーゲンを分解し、エネルギーとする過程で働く酵素の遺伝子に変異が起こり、その酵素の機能が失われることで発症します。
5)病的石灰化
正常では見られない組織にカルシウム塩が沈着する。副甲状腺ホルモン、カルシトニン、ビタミンDの異常などが原因と言われていますがherpesが関与しているのです。 石灰化とは、軟部組織にカルシウム塩が沈着する現象、あるいは沈着した状態である。様々な生物で見られ、その結果として硬化した組織などが形成される。 動物においては、細胞間に体液中のカルシウムイオンが炭酸カルシウムなどの形で細胞間に沈着することで起こるもので、正常な代謝の結果として起こる場合も、異常な状態で起こるものもある。
6)尿酸沈着症
尿酸が沈着。尿酸の代謝障害による。痛風。痛風とは、尿酸という物質が関節の中で結晶になることで、関節に強い痛みを引き起こす病気です。痛風の原因は血液中の尿酸値が上がることです。尿酸値が上がる要因としては、腎臓のはたらきの低下、暴飲暴食、肥満、激しい運動などです。
7)色素沈着
色素が沈着。外来性色素と内因生色素によるものがあり、外来性色素には炭粉(たんぷん)など、内因生色素にはメラニン、ヘモジデリン、ビリルビン、リポフスチンなどがある。炭粉症とは何でしょうか?たんぷんしょうと読み英語でanthracosisです。石炭,油煙,カーボンブラックなどの炭素分の多い物質の粒子が肺胞内,肺胞間質,リンパ節に沈着したために起る病状をいう。肺組織の外見は黒色を呈し,塊状巣を形成し,肺気腫を伴う。肺機能障害は高度で,呼吸困難,心悸亢進,貧血症状などを呈する。炭鉱,コークス工場,黒鉛工場,製墨工場,活性炭工場などで粉塵や煤煙を長期間吸入することによって起る。
ヘモジデリンとは何ですか?ヘモジデリンは、ヘモグロビン由来の黄褐色あるいは褐色の顆粒状あるいは結晶様の色素であり鉄を含む。赤血球やヘモグロビンが網内系やその他の細胞により貪食され分解される過程で生じ、正常な状態でも脾臓や骨髄において認められる。ヘモジデリン沈着症の原因には組織への直接出血後、赤血球が分解されて組織内に鉄が放出されたり、血管内で赤血球が破壊されることによって血液中に鉄が放出され、腎臓で血液の老廃物がろ過される際に腎臓内に鉄が蓄積することがある。
内因生色素の代表はメラニン色素で歯肉、口蓋粘膜、頬粘膜や口唇粘膜に好発する。メラニン色素沈着は粘膜の上皮基底層に多くみられ、直下の粘膜固有層にも認められる。粘膜固有層ではメラニンを貪食したマクロファージ(メラニン貪食細胞 melanophage)がみられる。
リポフスチンとは、細胞質内の不飽和脂肪酸の過酸化により、リソソーム内に形成される不溶性色素です。リソソームによって細胞内で消化された異物の残余物質であり、加齢性色素あるいは消耗性色素とも呼ばれる。ヘモジデリンと異なり鉄を含まない。重度の栄養不良あるいは老齢個体の肝細胞、心筋線維、神経細胞において出現する。
オートファゴソームとはまず細胞質に隔離膜と呼ばれる扁平な膜区画が出現、湾曲しながら伸長し、細胞質や場合によってはミトコンドリアやペルキシソーム等のオルガネラ(小器官)を包み込みます。 最後に隔離膜の末端同士が融合し直径約1μmの閉じた2重膜構造が完成します。それがオートファゴソーム(Autophagosome)でそのオートファゴソームの役割は、細胞内で二重膜に囲まれた球状の構造の中で、 異常な細胞内タンパク質、過剰なまたは損傷した細胞小器官、侵入した微生物などの、細胞質の内容物を分解するシステムであるマクロオートファジーを担うのです。
マクロオートファジーとは細胞質に現れた膜区画が伸長して細胞質成分やオルガネラを取り囲み、これがリソゾームと融合してその内容物を分解してherpesに侵された病気の原因となる異常な細胞内タンパク質、過剰なまたは損傷した細胞小器官、侵入したヘルペスなどの微生物などを処理してしまうのです。
ペルキシソームとは微小体,ミクロボディともいわれる脂質一重膜で覆われた 細胞内小器官(オルガネラ)でペルオキシソーム( peroxisome)は全ての真核細胞が持つ細胞小器官で、多様な物質の酸化反応を行っている。主に脂肪酸の酸化や活性酸素の除去を行います。ペルオキシソームの関わる代謝経路には、長鎖脂肪酸のベータ酸化による分解や、コレステロールや胆汁酸の合成、アミノ酸やプリンの代謝などがありペルオキシソームの内腔に含まれるオキシダーゼ(酸化酵素)によって行われる。
オートファジーにおいてリソソームは自己の異常な細胞を消化するための加水分解酵素の供給の役割をはたしているのです。オートファジーが誘導されると,細胞質に隔離膜と呼ばれる扁平な小胞が現れて細胞質を取り込みながら伸長し,その後にオートファゴソームと呼ばれる小胞が形成される。オートファゴソーム内にはミトコンドリアなどのオルガネラも含まれており,リソソームと融合するとリソソーム酵素により分解され,得られたアミノ酸は栄養源として再利用されることもあるのですが、栄養不足の時代ではないので現代のオートファゴソームの役割は異常な細胞内タンパク質、過剰なまたは損傷した細胞小器官、侵入したヘルペスなどの微生物や、細胞質の異常な内容物を分解します。
リソソームとオートファゴソームが融合した小胞はオートリソソームと呼ばれ,このオートリソソームはチューブ形成を起こした後に多数の小さな小胞となり,成熟後にリソソームとしてまた利用される。オートリソソームの形成にはsoluble NSF-attachment protein receptor(SNARE)タンパク質が関わっています。SNAREタンパク質は,融合する小胞膜の両方に局在しており,各SNAREドメインが結合することにより膜融合を誘導する.オートファゴソームにはSyntaxin 17(Stx17)が局在しており,一方でリソソームにはvesicle-associated membrane protein 8(VAMP8)が局在している.オートファジーが誘導されると小胞体から隔離膜が伸長してオートファゴソームが形成され,その後に完成したオートファゴソームの外膜にStx17が局在します。このStx17と細胞質に存在するSNAREタンパク質であるSynaptosomal-associated protein 29(SNAP29),そしてリソソーム膜上のVAMP8の三者複合体が形成されるとオートファゴソームとリソソームの融合が起こり,オートリソソームが形成されるのです。また,SNAP29にO結合したGlcNAcがSNAREの三者複合体形成を調節しています。このオートリソソーム形成機構はオートファジーにおいて重要なステップであり,病態メカニズムとの関わりを調べることで,オートファジーが関連する疾患に対する新たな治療ターゲットとなることが期待されると言われていますが病態メカニズムもオートファジーが関連する疾患はすべてヘルペスですから新たな治療ターゲットが判明することもなく残念ながら無駄な徒労と無駄な研究費がかかるだけです。
食作用(phagocytosis)とは何でしょうか? 貪食(どんしょく)作用ともいう。菌やヘルペススやその他の固形物を取り込む作用です。食作用は食細胞である好中球、好酸球、単球、マクロファージ、樹状細胞だけに備わった機能であるのに対し、飲作用(ピノサイトーシス)やエンドサイトーシスはすべての細胞に備わった機能です。食作用(phagocytosis)の取り込みにはアクチンが関係し、取込まれると食胞ができる。食胞はリソソームと融合し、リソソーム中の分解酵素によって菌やヘルペスウイルスやその他の固形物が分解される。食胞とは食物胞、または消化液胞とも言い、原生生物などの単純な真核生物に見られる細胞小器官(オルガネラ)です。この食胞と言うオルガネラは本質的にリソソームです。生体防御のための菌やヘルペスウイルスの取り込みと殺病原体と、獲得免疫の始動となる抗原の取り込み、分解、T細胞への提示と、死細胞の除去、などの生理的意義を持つ。
飲作用(Pinocytosis、ピノサイトーシス)とは、細胞が行うエンドサイトーシスの形式の一つであり、細胞外液に懸濁した小粒子が細胞膜の陥入(くぼむこと。 陥没。)によって細胞内に持ち込まれ、その結果、細胞内の小さな小胞内で粒子が懸濁する。この飲小胞は、通常、初期エンドソームと融合し、粒子を加水分解する。初期エンドソームとは何でしょうか?細胞膜を細胞の内側に陥入させることで小胞を形成します。その小胞に外来因子を包み込んで細胞内へと取り込む時にできる小胞は初期エンドソームと呼ばれ、細胞内でその膜脂質や小胞の内腔環境を変化させながら、後期エンドソームへと成熟し、最終的にリソソームと融合して取り込んだ物質の分解が行われます。エンドソームとはピノサイトーシスによって形成された一重の生体膜からなる小胞でほぼ全ての真核細胞が持ち、細胞外の分子の取り込みや、細胞表面の分子の選別(ソーティング)に関わります。その結果エンドソームに取り込まれた一部の分子は再利用され、小胞輸送によって細胞膜へと輸送される。エンドソームとリソソームの違いは何ですか?ファゴソームとエンドサイトーシスの違いは何ですか?ファゴソームの「ファゴ」は「食べる」と言う意味ですから免疫の細胞が細菌やウイルスを「食作用」で殺すことです。一方エンドソームはすべての細胞が持っている機能で細胞表面から外来因子を包み込んで細胞内へと取りこみ細胞内の他のオルガネラへ物質を輸送してリソソームと融合して取り込んだ物質の分解が行われます。
リソソーム(lyso‐some)があらゆる場面で登場しているのが理解できますか?極めて重要な「加水分解酵素」を酸性で多くの分解酵素を含み,物質の消化に重要な役割を持っている細胞小器官(オルガネラ)です。「lysoが加水分解 someが体」の意味があり、日本語ではリソソームは「水解小体」と簡単によばれます。リソソームlysosome)の読み方はリソゾーム、ライソソーム、ライソゾームの4つあります。語源は、“lysis(分解)”と“some(体)”に由来します。生体膜につつまれた構造体で細胞内消化の場である。内部に加水分解酵素を持ち、エンドサイトーシスやオートファジーによって膜内に取り込まれてた生体膜につつまれた生体高分子はリソソームで加水分解される。分解された物体のうち有用なものは、細胞質に吸収される。不用物はエキソサイトーシスによって細胞外に廃棄されるか、残余小体(residual body)として細胞内に留まります。単細胞生物においては、リソソームが消化器として働いている。また植物細胞では液胞がリソソームに相当する細胞内器官である。

左図に典型的な人を含む動物細胞の構成要素の模式図示します。
- 核小体
- 細胞核
- リボソーム (5の一部として点で示す)
- 小胞
- 粗面小胞体
- ゴルジ体 (またはゴルジ装置)
- 細胞骨格 (微小管, アクチンフィラメント, 中間径フィラメント)
- 滑面小胞体
- ミトコンドリア
- 液胞
- 細胞質基質 (細胞小器官を含む液体。これを元に細胞質は構成される)
- リソソーム
- 中心体
リソソームの形成図
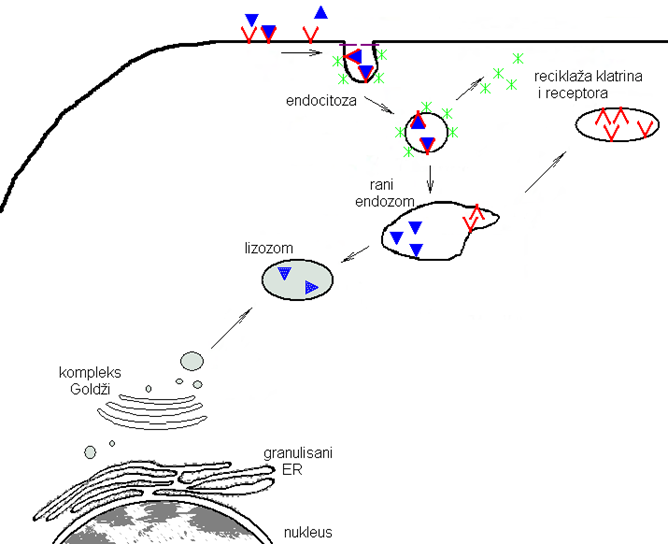
ドイツ語で書かれているのでわかりにくいと思いますが、青い三角形を2つ含む灰色の袋(中央)がリソソーム。細胞膜表面(図中央上)から取り込まれた高分子(青い三角)をくるむ小体、またはゴルジ体(図左下)から出芽した小胞として形成される.矢印の先端をしっかり確認してください。青い三角が取り込まれる分子です。赤いV字がクラスリンです。クラスリンです。クラスリンは細胞外マトリクスの外部の物質(栄養、情報分子、病原ウィルスなど)を取り込むとエンドサイトーシスにより取り込まれる際に形成され、エンドソーム外側を形作る骨格となるタンパク質なのです。
エンドサイトーシスは私達の体の中の多くの細胞に備わる非常に基本的な生命現象であり、細胞が外部から栄養物質や、細胞機能を維持するための情報分子を取り込む機構です。
ゴルジ体によるエンドソーム形成の制御
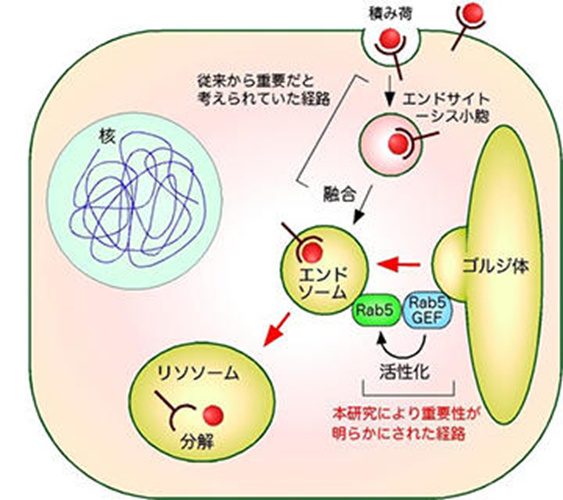
細胞がこれら外部の物質(栄養、情報分子、病原ウィルスなど)を取り込むと、それらはまず細胞内に存在するエンドソームに送られた後、リソソームと呼ばれる細胞内小器官で分解されるか、もしくは細胞膜へとリサイクルされます。細胞が外部から取込む物の中には、病原herpesウィルスも含まれており、エンドサイトーシスにより細胞内に取り込まれたherpesウィルスはエンドソームから細胞内へと侵入し、様々な病気を引き起こすことになるのです。
リソソーム(lysosome; ライソソーム、ドイツ語ではlizozom)は、真核生物が持つ細胞小器官の一つである。リソゾーム、ライソソーム、ライソゾームまたは水解小体(すいかいしょうたい)とも呼ばれる。語源は、“lysis(分解)”+“some(体)”に由来する。生体膜につつまれた構造体で細胞内消化の場である。内部に加水分解酵素を持ち、エンドサイトーシスやオートファジーによって膜内に取り込まれた生体高分子はここで加水分解される。分解された物体のうち有用なものは、細胞質に吸収される。不用物はエキソサイトーシスによって細胞外に廃棄されるか、残余小体(residual body)として細胞内に留まる。単細胞生物においては、リソソームが消化器として働いている。また植物細胞では液胞がリソソームに相当する細胞内器官である。
形成過程とリソソーム種別についてはリソソームの形成段階は前後二段階に分けることが出来る。まず、一次リソソーム(primary lysosome、一次水解小体)と呼称され、分解するべき対象を含有しないリソソームがある。リソソームはゴルジ体(ドイツ語ではgoldzi)のトランスゴルジネットワークからクラスリンにコートされた被覆小胞として出芽した小胞からなり、これが分解するべき物体を含んだ小胞に融合した後のものは二次リソソーム(secondary lysosome、二次水解小体)と総称される。クラスリン は細胞外マトリクスの分子がエンドサイトーシスにより取り込まれる際に形成され、エンドソーム外側を形作る骨格となるタンパク質である。クラスリン分子とは三脚巴(さんきゃくともえ)構造 を取り、エンドソーム形成時は、複数のクラスリンが重合して格子を作り、サッカーボールの様な構造を形作るのです。
さらに、二次リソソームはいくつか異なった経路で形成される。一つは、エンドサイトーシスに由来する。細菌等巨大な異物を取り込んだファゴソーム(食作用)や、ピノソーム(飲作用)と呼ばれる細胞膜近辺のより微視的な分子を含んだ一重の生体膜からなる構造と、一次リソソームとが融合しファゴリソソーム(phagolysosome、食込融解小体)となり、取り込んだ物を分解する。もう一つはオートファゴソームに由来する。オートファゴソームは、ミトコンドリア等の細胞小器官が古くなった場合、あるいは細胞が飢餓状態に置かれたときに、小胞体に由来するとされる二重の生体膜がこれを包むことで形成される。オートファゴソームに一次リソソームが融合し、一重膜の構造体であるオートリソソーム(autolysosome、自家食融解小体)となったあと同様に分解が行われる。二次リソソームは一次リソソームと同様にエンドソーム等に融合し分解酵素の供給源となるのです。このように細胞内には様々なリソソームがあり、その大きさ・形状は様々に異なっている。リソソームは一種類だけではなく多種類存在しているのです。
リソソームが含有する加水分解酵素群は酸性条件下で効率良く働く性質を持っており、リソソーム内部の水素イオン指数はプロトンポンプの働きによって pH5 程度と酸性に保たれている。このことによって、中性状態の他の細胞内区画ではリソソームが含む加水分解酵素は不活性となり、不必要な反応を防いでいる。プロトン(proton)は「陽子」であり「水素イオン」です。プロトンポンプとは生体内でエネルギーを利用して水素イオン(プロトン)を濃度の低いところから濃いところに輸送するタンパク質をプロトンポンプと呼んでいます。 プロトンポンプは分子機械であり、世界最小のポンプです。
リソソームに含まれている酵素群はグリコシダーゼ、リパーゼ、ホスファターゼ、ヌクレアーゼなど様々な加水分解酵素があります。これら酵素群は粗面小胞体で合成された後、マンノースが付加され、ゴルジ体のシスゴルジネットワークに輸送された後に、マンノースにリン酸基が付加される。その結果生じたマンノース-6-リン酸はリソソームに運ばれるシグナルとして膜受容体であるマンノース-6-リン酸受容体に認識される。
マンノース-6-リン酸受容体は膜タンパク質であり、マンノース-6-リン酸を持つ分子を結合させこれを輸送小胞へ取り込むことによってリソソームへのタンパク質輸送を行っている。被覆小胞は一次リソソームと融合しその酸性環境下でレセプター結合蛋白質を乖離する。その後、レセプターは更なる分子輸送のためにトランスゴルジネットワークへと戻る。
リソソームの機能異常によって引き起こされる60もの遺伝病(ライソゾーム病)が存在する原因は妊婦がかかったことのないヘルペスウイルスに初めて感染したときに抗体がないのでライソソームの酵素蛋白を発現する遺伝子がヘルペスのために妊娠中に突然変異を起こされたためです。あらゆる遺伝子病は妊娠中にherpesの初感染で8種類のherpesのどれかによって遺伝子が変異させられたためです。実は先天的な遺伝子病であろうが後天的な遺伝子病であろうがその原因はヘルペスの潜伏感染に際してherpesが自分のゲノムを感染細胞のゲノムに組み込んだときに蛋白がコードされているエキソンの塩基の並びを異常にしたためなのです。多くの遺伝病は、リソソームによって分解されなければならない物質が蓄積することによって60以上もの遺伝病が起こるのです。ライソゾーム病とはライソゾームの中には多くの酵素があり、それぞれ違う物質を分解しています。 この酵素がひとつでも欠けると、老廃物が細胞内に蓄積し、その結果、病気になります。 これが、ライソゾーム病です。 ライソゾーム病の中には、ゴーシェ病、ムコ多糖症、ファブリ病、ポンペ病、ムコリピドーシス、など様々な病気が60種類以上あります。
再度ややこしいリソソーム(ライソソーム)とは何でしょうか?復習しましょう。ファゴソーム(食胞)としてマクロファージ内に取り込まれた細菌やヘルペスウイルスはリソソームと言われるもう一つの小胞と融合します。ところがメサンギウム細胞は食作用を持っているのですがIgA免疫複合体のherpesウイルスはIgA抗体と結合しているのでメサンギウム細胞はIgA免疫複合体(IgA抗原抗体複合体)のherpesウイルスを貪食が出来ないのです。何故ならばあらゆる細胞の食作用は抗体を食べる食作用の機能は持っていないからです。IgA免疫複合体からヘルペスウイルスが離脱できれば可能です。
リソソーム内腔には生体高分子(タンパク質、脂質、糖質など)を構成単位であるアミノ酸、リン脂質、糖、核酸などにまで分解できる約60種類の加水分解酵素が存在しています。リソソームへの物質の輸送は主にエンドサイトーシス経路や細胞内大規模分解システムであるオートファジー経路が担う.60種類の加水分解酵素プロテアーゼ(protease)とは、タンパク質をより小さなポリペプチドや単一のアミノ酸への分解を触媒する加水分解酵素の総称である。ペプチダーゼ やプロテイナーゼとも呼ばれる。それらは、水が反応して結合を壊す加水分解によってタンパク質内のペプチド結合を切断する。グリコシダーゼ(glycosidase)とは、グルコースを含めた糖全般とのグリコシド結合を分解する酵素の総称であり、グルコシダーゼは、グルコースとのグリコシド結合を分解する酵素の個別名でもあります。グルコシダーゼは、α-グルコシダーゼとβ-グルコシダーゼがある。α-グルコシダーゼは糖同士が結合する部分に水が反応し分解する作用(加水分解)を手助け糖類からグルコースを遊離させます。一例として、人が食べ物を食べた時にアミラーゼと呼ばれる消化酵素により糖質を二糖類に分解しますがそのままでは吸収されません。β-グルコシダーゼはセロビアーゼともよばれ,1分子のセロビオースを2分子のグルコースに加水分解する酵素です。リパーゼ(lipase)とは、膵リパーゼでありトリグリセリド(中性脂肪)を分解・消化する加水分解酵素です。 食物から摂取した脂肪は消化の過程で胆汁と混ざりあい、リパーゼによって分解が進められます。分解された脂肪は脂肪酸という物質に変わり、血液に乗って体のエネルギーとして使用されます。ホスファターゼ(phosphatase)とは、リン酸モノエステル加水分解酵素(ホスホモノエステラーゼ)のことであり、リン酸モノエステルまたはポリリン酸化合物を加水分解し、リン酸と、水酸基を持つ化合物とに変換する脱リン酸化酵素である。ヌクレアーゼ(nuclease)とは、DNAやRNAを処理するために利用される。 RNAを分解するものをリボヌクレアーゼ(RNase)、DNAを分解するものをデオキシリボヌクレアーゼ(DNase)という。ヌクレアーゼは、その活性座位によって2種類に大別され、エキソヌクレアーゼは、核酸を末端から消化する。 エンドヌクレアーゼ は、標的分子の途中にある領域に作用する。ホスホリパーゼ(phospholipase)とは、ホスホリパーゼ は、リン脂質を脂肪酸とその他の親油性物質に加水分解する酵素であり触媒する反応の種類によりA, B, C, Dの4種に大きく分類される。例えばホスホリパーゼCはリン脂質をグリセロールとリン酸との間のエステル結合を加水分解する酵素であり、主な基質であるホスファチジルイノシトール4,5-二リン酸を、イノシトール1,4,5-三リン酸とジアシルグリセロールに分解する。スルファターゼ(sulfatase)とは、硫酸エステルをアルコールと重硫酸塩に加水分解を触媒するエステラーゼクラスの酵素の一種です。スルファターゼはステロイド、炭水化物、タンパク質などのさまざまな基質の酵素となっています。硫酸エステルは、さまざまなアルコールおよびアミンから形成されています。
リソソームの加水分解酵素の多くは酸性域に至適pHを持つため、酸性加水分解酵素(acid hydrolase)と総称されます。上に述べたプロテアーゼ(protease)、グリコシダーゼ(glycosidase)、リパーゼ(lipase)、ホスファターゼ(phosphatase)、ヌクレアーゼ(nuclease)、ホスホリパーゼ(phospholipase)、スルファターゼ(sulfatase)の酵素はA-B + H2O → A-H + B-OHという加水分解反応によって基質のA-Bを分解して水のH2O をH とOH にしてA-H と B-OHにするのです。又、リソソームに局在するプロテアーゼ(タンパク質分解酵素)は20種類以上あり、それらはカテプシン(cathepsin)と名付けられ、A-Zまで存在する。リソソームにはカテプシン以外の名称のプロテアーゼも存在するのです。又リソソーム中には活性酸素も含まれています。
カテプシン(cathepsin)とは何でしょうか?古代ギリシャ語の”消化”に由来し、”down”を表す”kata-“と”boil”を表す”hepsein”の語尾のpseinを合わせてカテプシンと名付けられた。リソゾームに局在するカテプシンは酸性プロテアーゼの総称で、高等動物のほぼすべての組織、植物、原生動物にも広く存在する。現在までのところ、カテプシンファミリーに属する20種類のプロテアーゼが知られており、活性部位や基質特異性の違いで分類されています。
カテプシン(cathepsin)とは何でしょうか?古代ギリシャ語の”消化”に由来し、”down”を表す”kata-“と”boil”を表す”hepsein”の語尾のpseinを合わせてカテプシンと名付けられた。リソゾームに局在するカテプシンは酸性プロテアーゼの総称で、高等動物のほぼすべての組織、植物、原生動物にも広く存在する。現在までのところ、カテプシンファミリーに属する20種類のプロテアーゼが知られており、活性部位や基質特異性の違いで分類されています。
エンドサイトーシスは飲食作用 と訳され、細胞が細胞外の物質を取り込む過程の1つですが、細胞に必要な物質のあるものは極性を持ちかつ大きな分子であるため、疎水性の物質から成る細胞膜を通り抜ける事ができない、このためエンドサイトーシスにより細胞内に輸送されるのです。食作用と飲作用の違いは何ですか? 食作用は菌やその他の固形物を取り込む作用で食細胞である好中球、好酸球、単球、マクロファージ、未熟樹状細胞だけに備わった機能であるのに対し、飲作用(ピノサイトーシス)やエンドサイトーシスはすべての細胞に備わった機能である。 取り込みにはアクチンが関係し、取込まれると食胞ができる
飲作用はさらに、①マクロ飲作用、②クラスリン媒介飲食作用などの経路に分類され、これらの経路は全て、飲作用によって形成される小胞の形成のメカニズムおよび生成される小胞のサイズが異なる。クラスリンとは何でしょうか?左図に示したようにクラスリン は細胞外のマトリクスの分子がエンドサイトーシスにより取り込まれる際に形成されるエンドソーム外側を形作る骨格となるタンパク質である。細胞外のマトリクスの分子とは何でしょうか?細胞外マトリクスはExtracellular matrixで、略してECMであり、「細胞外空間」を満たす物質の総称で、すべての組織、臓器中に存在する非細胞性の構成成分です。体の中では結合組織に大量に存在するが組織と組織の境界面にある基底層も特殊化した細胞外マトリクスなのです。ECMは細胞にとって物理的な足場となるだけではなく、組織の形態形成・分化・ホメオスタシスに必要とされる重要な生化学的・生物力学的なシグナルを出す働きもあります。
クラスリン分子は三脚巴(さんきゃくともえ)構造(トリスケリオン) を取り、エンドソーム形成時は、複数のクラスリンが重合して格子を作り、サッカーボールの様な構造を形作る。下図に示したように三脚巴(さんきゃくともえ)は、伝統的な文様のひとつで三本の脚(足)を左図のように(ともえ)にしたものです。「ともえ(ともゑ)」の起りには、弓を射る時に使う鞆(とも)を図案化したもので、もとは鞆絵である。鞆(とも)とは、弓を射る時に左手首の内側につけて、矢を放ったあと弓の弦が腕に当たるのを防ぐ道具である。

クラスリン依存的エンドサイトーシスはすべての真核細胞において見られる現象であり, 成長因子, 栄養物質, 抗原, 病原菌などを細胞内へ取り込むための基本的な機能である. さらに高等生物においては, 細胞増殖の制御やシナプス神経伝達をはじめ, アポトーシス細胞の除去など実に多様な生命現象に関与しているのがクラスリン依存的エンドサイトーシスなのです。

飲作用は、分子機構や取り込まれた分子の運命に応じて様々に分類される。飲作用は細胞自身の栄養行為、細胞シグナル伝達等の、細胞というシステムの基本を構成する機能の1つであり、ほぼすべての細胞がこの機能を持つ。腎臓のメサンギウム食作用が細胞外液である血液に浮遊する粒子など壊れた細胞や病原菌やIgA免疫複合体(IgA抗原抗体複合体)のヘルペスウイルスなどを選択的に細胞内に取り込もうとしたり取り込むことを指すのに対し、飲作用は細胞外液を非選択的に細胞内に取り込むことを指す。つまり食細胞は形のある固形物や粒子を食べることですが飲作用は液体を細胞内に取り込むことです。エンドサイトーシスは「飲・食作用」で「細胞内取込み」をすることですから飲作用と食作用の二つの作用を持っているのです。エンドサイトーシスとエキソサイトーシス(開口分泌)とは何でしょうか?エンドサイトーシスの日本語訳には「細胞内取込み作用」;「 細胞内取込み」; 「細胞内取込み現象」; 「飲食作用」の4つがあります。エンドサイトーシス(細胞内取込み作用または飲食作用)とは、細胞が細胞外の物質を取り込む過程の1つです。細胞に必要な物質のあるものは極性を持ちかつ大きな分子であるため、細胞膜は疎水性の物質から成り立っているので細胞膜を通り抜ける事ができないのです。極性とは原子が互いに電子を出し合う共有結合では、それぞれの原子が共有電子対を引き寄せる強さである電気陰性度によって電荷の偏りが生じる場合を極性を持っている物質と言います。このため様々な種類のエンドサイトーシスにより細胞内に輸送される。これとは逆に、細胞膜の一部から細胞外へ小胞を形成する現象はエキソサイトーシスと呼ばれ、日本語では、開口分泌ともいいます。 エキソサイトーシスの例としては、ホルモン産生細胞によるホルモンの分泌があげられます。 ホルモンには、成長ホルモンやインスリンなどがあります。 ホルモンがその機能を発揮するためには、血中へと分泌される必要があります。エキソサイトーシスの仕組みはどうなっているのでしょうか?細胞内で合成された大きい物質は、細胞膜と同じリン脂質で包まれて存在しています。合成された物質が細胞膜に近づくと、物質を包むリン脂質が細胞膜とくっつき、一体化します。 こうして、物質が細胞膜を透過するのです。 このような現象を、エキソサイトーシスといいます。
エンドサイトーシスは、取り込む物質の種類やその機構の違いから、食作用(しょくさよう、phagocytosis)と、飲作用(いんさよう、pinocytosis)とに大別される。エンドサイトーシスの過程はタンパク質のような大きな細胞外物質(リガンド)が細胞膜上の受容体(レセプター)に結合することにより始まります。この受容体は多くの場合細胞膜表面のすでに説明したようにクラスリンタンパク質に関連づけられている。 クラスリンタンパク質分子とは、トリスケリオンと呼ばれる三脚構造を形成する3つの軽鎖と3つの重鎖から成っている。クラスリンタンパク質は細胞膜表面を覆い窪みを形作っている。受容体がリガンドと結合するとクラスリンに覆われた穴は深くなり細胞質の中に陥入、被覆小胞となる。細胞膜から離れた被覆小胞はすぐにクラスリンを脱離させ、初期エンドソームに融合する。初期エンドソーム内部はリソソーム同様にプロトンポンプの作用によって酸性に保たれている。ここで被覆小胞の膜内側に結合している受容体蛋白質の多くは再利用されるために細胞膜へと回帰する経路に乗る。一方受容体に結合してエンドソーム内腔に取り込まれたリガンドは、酸性条件下で受容体のコンフォメーションが変化するに伴い乖離(かいり)する。この際残りのタンパク質、その他膜構成物質等も遊離し、大半は再利用され再び細胞膜の形成に関わる。
エンドソームは後期エンドソームに成熟した後、リソソームと結合したりゴルジ体からの小胞と合体し、取り込まれたリガンドの消化などが行われる。
食作用(ファゴサイトーシス)とは、死んだ細胞やバクテリアの様な大きな物質を細胞が取り込む過程のことで、大きな小胞に取り込んだ物質を封じ込める。この小胞はそのままリソソームと合体し、物質を加水分解酵素により消化する。消化後は細胞質に放出される。
白血球のうち、自然免疫に属する好中球、単球、マクロファージは、食細胞とも呼ばれ、特にこの食作用が発達している。一般に食作用と呼ぶ場合には、これらの食細胞が細菌やherpesウイルスなどの病原微生物や異物を分解し、排除するための機構のことを指すことが多く、免疫システムの重要な一端を担った、生体の恒常性維持機能の一つです。しかしながらメサンギウム細胞は食作用はあるのですが専門の小細胞ではないのでIgA免疫複合体に結合したヘルペスウイルスを食作用で取り込むことが出来なくて分解排除できないので数多くのIgA免疫複合体がメサンギウム細胞膜に沈着した状態になるのです。しかもIgA免疫複合体についたherpesウイルスをマクロファージが気がついて食べようとするとマクロファージはさまざまな炎症性のサイトカインを放出してメサンギウム細胞などの食作用によって取り込むには、その物質を異物として認識する必要がある。この認識には、(1) 適度な大きさ(数µm程度)であること、ヘルペスウイルスは150nm~200nmで少し小さすぎます。(2) 表面が正に荷電しているか、あるいは疎水性であること、などが条件となっているが、その条件は抗体などによる選択的な認識に比べて極めて緩く、むしろ非選択的であると言える。このため食作用は、体内に侵入した異物をある程度、非選択的に排除することが可能であり、免疫による生体防御の最初の関門として機能している。ついでに言うとメサンギウム細胞はFcレセプターをもっていますからIgA免疫複合体のIgA抗体のFcと結合して刺激されてヘルペスウイルスを猛然としてマクロファージと同じく貪食機能は高まることは無いのです。何故ならばメサンギウム細胞は仮にIgA免疫複合体に結合したヘルペスウイルスを取り込んでもリソソームを持ってはいるのですが実際は無理なのです。ヘルペスウイルスが複合体に結合していないで単独で糸球体に流れ込んできたら可能かもしれませんが。しかし単独であれば直接に血中にいるマクロファージにつかまって処理されてしまうでしょう。にもかかわらずメサンギウム細胞に自然免疫の大食細胞と同じように食作用やFcレセプターやリソソームを進化の中で持たせた理由は何なのかは解明すべきですが粘膜抗体であるIgAにヘルペスウイルスを結合させて血中に流れ込ませかつ絶対炎症を起こしてはならない200万個もある糸球体毛細血管にまで運べるようになったのは何故でしょうか?それは粘膜免疫がストレスや弱くなったり免疫抑制剤を用いられたりして免疫が弱くなりとりわけ粘膜免疫が低下し過ぎて粘膜にいるヘルペスウイルスがIgA抗体に捕まえられて中和抗体として大便や小便やタンや粘液で人体の外に排除できなかったherpesがIgA免疫複合体となって200万個もある糸球体毛細血管にまで運ばれメサンギウム細胞との出会いが生まれたのです。
さらに幼少時に出てはいけない尿に蛋白や赤血球が見られても現代医学ではネフローゼにしろ腎炎にしろ原因はherpesである事は世界中の医学者は誰も知らないのですから免疫を抑える治療を一切しないでストレスをかけない生活指導やりながら観察をするだけで患者の免疫に任せれば治ってしまう症例はいくつも報告されています。しかし行基が治ってしまうと資本主義の目的は達せられませんから葛藤はあるでしょうが。アッハッハ!!!私は腎炎と診断された患者の免疫を上げる唯一の漢方煎じ薬と抗ヘルペス剤で何人も完治させていますので腎炎も自信をもってネフローゼもherpesである事は確信をもって断言できます。それどころか現代の難治な病気や治らない病気の原因のほとんどすべてはherpesなのです。
残念ながらエリオンと言う女性が開発してノーベル賞をもらった抗ヘルペス剤を保険で使わせないのはすべての難病がherpesである事がばれてしまうからです。だからこそ78歳の糞爺になった私は今でも抗ヘルペス剤を使うことができる「自費診療 松本漢方クリニック」をやらざる羽目に落とされてしまったのです。と言うのは息子に任した「松本医院」で健康保険と抗ヘルペス剤を自費でやらざるを得なくなりやりだすと「混合医療」と言う医師会の捏造した冤罪の罪を着せられてしまい苦しんだのですが難病を治した政治家のお力を借りて冤罪の罪は晴れたのですが30年以上もやり数十万人の難病患者さんを診察し、あらゆる医者が治せない病気を免疫を上げる「漢方煎じ薬」と原因療法となる抗herpes剤を用いて癌以外のすべての難病を治してきたのですが今現在は保険のきく「松本医院」を息子に任せて抗ヘルペス剤は保険で使えないので自由に抗ヘルペス剤をつかえる憲法保険で縛られない「自費診療 松本漢方クリニック」を新たに開設したのです。私の新たな作った医院の名称は「免疫で治す松本herpesクリニック」にしたかったのですが保健所が許さなかったのです。
老体に鞭打って治らない病気はすべてヘルペスであるという論文を書き続けながら診療に励んでいるのです。今は時間がとてもかかりますが「絶対に治らないとされている指定難病338種類」の先天性の遺伝子病を含めて殆どの病気の原因はherpesである事を理論的に証明するために論文執筆のためと難病で受診されている患者さんの病を治すという最高の仕事に精を出しています。不思議に思うことは癌は世界中の医者の誰一人も治せないのにしかも死んでいくのですから「難病指定」にして医療費を無料にしてあげるべきではないでしょうか???実は癌も原因は「癌ウイルス」である「ヘルペスウイルス」ですから「癌ウイルス」を殺して100年前にすべての癌を治したロイアル・レイモンド・ライフ博士の「光癌療法があります。ロイアル・レイモンド・ライフ博士についてはここをしっかり熟読してください。
混合医療と言う無実の罪からは解放されたのですがわたしの理論通り世界中の医者が治らないという難病を治した証拠である「患者さんの難病が完治した」と言う生々しい手記が残念ながら法律で消されてしまったので難病はすべて治せるという極上の地上最高の喜びは激減してしまいました。しかし、真実を伝え続ける楽しみは法律で禁止されていませんから思い存分死ぬまで全ての難病はherpesである事を実証し続けることを誓います。
私が苦しんでおられる患者さんの難病にこだわるのは何故だかご存知ですね?無料で読めますから電子書籍の「ドクター松本の電子書籍」に私が15歳から悩んできた病気はヘルペス脳炎であり右目の視覚消滅など様々な病気の原因はherpesだったのです。ヘルペスにこだわるかのいきさつが分かり易く書いています。ここを読んでください。がその当時も今も私の病気を診断できない医者ばかりですが、私が何故三つの大学に入り直して最後は京都府立医科大学に入っても現代医学は100%病気を治せなかったこともお分かりになるでしょう。又、真実の最高の教科書は患者さんであり、私にとって真実の医学書である最高の患者は私自身であったし今もあるということもお分かりになるでしょう。過去も現在も若年性のherpes性のアルツハイマーにもかかわらず進行せずにいる私の病気の原因はherpesであることを関西圏の超一流の大学病院の大先生たちは口に出すことも有りませんでした。それどころかそれとなく私の様々な症状はherpesであるとほのめかすと「絶対ない」と一蹴されるばかりでした。63年今も以上も又今も医者にも家族にも言えないくらいに苦しんでいても大量の抗ヘルペス剤を服用し漢方煎じ薬を服用しているので78歳と言う高齢でも癌にもならずに若い時と変わらず元気に医療もこのような論文執筆もできているのです。治らないとされている患者さんに私のように正しい診断してかつ治せる治療をすればいくらでも病気を進行させなければ私のように元気になっていつまでも仕事が可能になることを知ってもらいかつ患者さんの難病を治したい一心で励んでいます。私は100歳まで真実の医者を続けるつもりです。
現代の標準医療の根本的な誤りはherpesが現代の病気の根源であることを認めないからです。ヘルペスはこの世の人類を苦しめる病原体のなかで類のない特異なウイルスなのです。一言でいうと、最高の免疫を進化させて生物の頂点に君臨できたのも人間を死に追いやるあらゆる敵を打倒してきたからです。その中で人類が最も恐れたのは目に見えない敵である病原体である細菌やウイルスやカビなどであったのですが近世の科学技術の発展で社会の衛生状態を向上させることでかつ免疫のメカニズムが解明されワクチンや抗生物質で病原体による目に見えない感染症で苦しみ死ぬことはほとんど皆無になったのです。ところが長生きが可能になるとともに癌で苦しみ最後は死に至る病は癌という時代になってしまいました。しかもその癌の原因もロイアル・レイモンド・ライフ博士があきらかにしたのが癌の原因は「癌ウイルス」であることを実証してしまったのです。私の仕事は「癌ウイルス」はherpesである事を証明することであったので終わりました。
ところが頭の良い医者たちは自己免疫疾患を捏造したのみならず原因不明の病気や難病を新たに捏造し始めました。というよりも新たなる病名を毎日毎日新しい原因不明であった病気を発見したと言わんばかりに病名つくりと言ってもよい研究に邁進しています。創薬のための研究はやる価値は100%ありません。何故ならば病気を治すのは36億年かかって出来上がった免疫の異常に優れた薬は無いからです。にもかかわらず医薬学者はしかもこれらの病気や病名に対して新しい高価な免疫を抑制する薬を作り始めましたが病気の原因を除去する薬ではないので一向に病気が新しいこの世にない病名を作り出して喜んでいるだけだherpesによる本当の病気はますます増えるばかりで治らなくなったのです。
どんな現象も病気にも必ず原因があります。原因を突き止めないで根本的に病気を治すことが出来ませんが資本主義においては強い権力者が認めた薬は「効く」薬として簡単に認められかつインチキの病名をつけられた患者さんに用いられてしまうのですが専門家の医者も患者も誰一人対抗することが出来なくなってしまい患者さんの苦しみは増えるばかりです。哀しいですね。
わたしも自身も右脳のヘルペス脳炎や右目のherpes性網膜炎で視覚を失ったのですが難病と言われる病気の本当の原因を知るために毎日毎日勉学、勉学だけに明け暮れていますが世界の一流と言われる専門書を英語や日本語で読んでいても全く免疫学の根本とは矛盾するばかりの内容に辟易しています。しかもヘルペスに言及している医学書に出会ったこともないのです。お金儲けのために真実を隠ぺいして患者さんの苦しみを増やすばかりで悲しいことばかりです。
ヘルペスがいかに特異的で人間の免疫よりもはるかに進化した免疫から逃れる術を持った大天才である特徴とその根拠を何十万の難病患者さんを診察して松本医学理論通りに完治させた臨床家の立場から列挙していきましょう。
①ヘルペスは人の免疫ではherpesを殺しきれない、何故ならば核のゲノム(遺伝子)に隠れることが出来るのでプロの免疫細胞のみならず感染細胞自身が持っている防御機構からも逃れることが出来るからです。
②したがってワクチンを作っても細胞内に隠れてしまうからワクチンでherpesに対する特異抗体が作られてもウイルスの一番の活動の目的は細胞内で大量増殖してビリオンを増やすことです。増えたビリオンのいくらかは細胞外に出て次の最奥に新たに感染するときにワクチンによって中和作用で新たな感染を防いだりオプソニン作用によって自然免疫細胞の貪食細胞に食べさせるのですが増えたビリオンの数にはかないません。だからワクチンを作ってもherpesの増殖力には勝ることはできないので最適なヘルペスに対するherpesに対するワクチンを製造しても効果がないのです。言い換えるとヘルペスの増殖力はあらゆるウィルスの中で最大なのです。癌の原因もヘルペスなのですがherpesが癌関連遺伝子を癌化させる勢いはが細胞が増殖する勢いよりも遥かに強いので癌細胞を殺す薬では癌を治すことは不可能で癌を作る原因であるherpesを殺せるロイアル・レイモンド・ライフ博士の「癌光療法」の装置しかないのです。ロイアル・レイモンド・ライフ博士についてはここを読んでください。
③人間の免疫から逃れるために自分のゲノム全体を感染細胞のゲノムにherpesウイルス自身のゲノムを組み込んで相同組み換えと言われる細胞の「DNA組み換え」の機構を利用してherpesの遺伝子を宿主の遺伝子に組み込むのです。
相同組換え(相同的組換え)とは,DNAの塩基配列がよく似た部位(相同部位)で起こる組換えです。一般的組み換えとか正統的とも呼ばれ、主要な「DNA組み換え」の機構です。 様々な化学物質や放射線や組み込まれたherpesウイルスにより切断されたDNAは主に相同組換えによって修復されます。相同組換えは遺伝的組換えの一種であり、2つの類似したまたは同一の核酸分子の間でヌクレオチド配列が交換される過程です。遺伝的組換え(Recombination)は、生物自身が遺伝子をコードするDNA鎖を途中で組み変える現象を指す。また人工的な遺伝子組換えも遺伝的組換えと言われます。相同組換えは、DNA二本鎖の双方の鎖に起こった有害な切断を正確に修復するために細胞で最も広く利用されている手法です。 また,生殖に際して配偶子の精子と卵子を作るときに行われる減数分裂に伴い高頻度で起こり、相同組換えがうまくいかないと配偶子が形成されません。
もう一つのウイルスが利用していると考えられるDNA組み換えは「部位特異的組み換え」でありヘルペスウイルスが細胞のDNAに入り込むときに利用する機構です。部位特異的組み換えとはゲノムの全領域にわたって同じ機構で起こる一般的組換え以外に、ゲノム上の特定の配列を認識し、その部位でのみ起こる部位特異的組換えがある。この反応には、例えば特定の配列を認識するラムダインテグラーゼなどの配列を認識する酵素が行うが、組換え後に元のDNA配列が再生される場合を保存型部位特異的組換え(conservative site-specific reombination)という。ラムダインテグラーゼとは溶原性のラムダファージのゲノムが宿主DNAに組み込まれる際に、宿主DNA上の特異的な組み込み部位に作用し、DNAの組換えを起こす酵素です。ラムダインテグラーゼはリコンビナーゼ(組み換え酵素)のひとつです。インテグラーゼのファージとは、細菌や古細菌に感染して複製するウイルスで、正式にはバクテリオファージと呼ばれる。ファージの基本構造は、タンパク質の外殻と遺伝情報を担う核酸 からなる。ファージが感染した細菌は細胞膜を破壊される溶菌という現象を起こし、死細胞を残さない。溶菌性ファージと溶原性ファージの違いは何でしょうか?
溶菌性ファージは細胞を破壊して次の細胞に感染する。 溶原性ファージは感染した細胞に取り込まれ、細胞の分裂に伴って増える。ヘルペスvirusは溶菌ウイルスであり、同時に溶原ウイルスの二つの性質を持っています。
まとめると遺伝子の組み換えには二通りあります。一つは主な「DNA組み換え」の機構である「相同組み換え」であり組み換え点を境にDNA鎖が入れ替わります。減数分裂時の「乗り換え」の時に用いられます。おそらくこの「相同組み換え」でヘルペスウイルスはDNAの塩基の並びを変えて癌関連遺伝子を癌化させると考えられます。ヘヘルペスが遺伝子の形質転換を起こすのもこの「相同組み換え」によると考えられます。二つ目の「DNA組み換え」は「部位特異的組み換え」ですが細菌に感染するバクテリア・ファージがインテグラーゼなどの組み換え酵素(リコンビナーゼ)を使って組み換えを行うので、ヘルペスウイルスはインテグラーゼなどの酵素を持っていないので不可能であると考えられます。因みに「部位特異的組み換え」と似た「組み換え」をするのが転移因子です。この転移因子が行なう「組み換え」を「転移」と言います。
ヘルペスはどのようにして感染細胞の遺伝子を突然変異をさせるのでしょうか?
ヘルペスウイルスが細胞のゲノムに自分のゲノムを組みこんで細胞のゲノムの遺伝子を組み換えて遺伝子(塩基の並び)を突然変異させるやり方には二つが考えられます。一つ目は相同組み換えであり別名に一般的組み換えとか正統的組み換えと呼ばれるおもな「DNA組み換えの機構」であり減数分裂の乗り換えはこの機構を用いています。おそらく組み換えをherpesは行って遺伝子の形質転換に使っているのです。④しかも潜伏している間に遺伝子を自由自在に変える。
⑤その間に4番目のヘルペスウイルスであるEBVは上咽頭癌、中咽頭癌、胃癌、バーキットリンパ腫の癌を起こすのみならず8番目のヘルペスであるHHVは悪性リンパ腫という癌やカポジ肉腫などの悪性腫瘍を起こしてしまう
⑥あらゆる細胞に感染できる。すべての免疫細胞にも感染できる。
⑦一番感染したがるのは神経細胞でとりわけ自律神経の神経節です。自律神経の神経節の細胞は最も細胞性免役からは見つかりにくいからです
⑧宿主の免疫が上がっているか下がっているか見極めることが出来る。免疫が上がっている時は増殖を止め免疫が上がっているときはいくらでも増殖します。
⑨メラニン色素細胞のみならずメラニンを産生している脳幹の黒質や網膜細胞に住みたがります。
⑩全ての自己免疫疾患と言われる病気のすべてを作り出します。自己の免疫が自分の成分を攻撃することは絶対にありません。
⑪原因不明の病気のすべてはヘルペスが原因です。
⑫ステロイドが一時的に奏効する病気はすべてherpesが原因です。
⑬老人性と言われる病気はすべてヘルペスです。
⑭寛解と再燃を繰り返す病気のすべてもヘルペスです。
⑮外傷でない原因不明の皮膚や内臓の痛みもヘルペスが原因です。
⑯原因が不明と言われる病気もヘルペスです。
⑰先天的遺伝子病の原因も妊娠中に初めてかかったヘルペスが原因です。
⑱原因不明の流産も原因はherpesです。
⑲生まれつきの染色体異常の原因もヘルペスです。
⑳自然流産の原因もすべて妊娠中に初めてかかったヘルペスが原因です。
㉑神経変性疾患も他の変性疾患と言われる病気も後天的遺伝子病であるヘルペスが原因です。
㉒全ての「~炎」と名の付く病気の原因もヘルペスです。「~炎」と付く炎症性疾患は現代の病気もヘルペスです。
㉓同じ病気で「急性」と「慢性」の病期がある病気はherpesです。
㉔どんな病気も炎症の指標となるCRPがわずかでも高くて長く続く病気はherpesが原因です。何故ならばherpesは殺しきれないからです。宿主の免疫があがると宿主の感染細胞のゲノムに自分のゲノムを組み込み隠れ続けます。何故ならば核の遺伝子に隠れると絶対に感染細胞自身にも免疫細胞にも気づかれないからです。しかもゲノムに隠れている間に細胞の遺伝子の組み換えをこっそり行って後天的な遺伝子病や遺伝病である癌を作ってしまうのです。病原体と闘うときに高くなるCRPの完全な正常値は0.00ですがヘルペスは絶対に殺しきることはできないので病気のストレスがある限り免疫が落ちるのでherpesは増殖すると必ず細胞外に出て次の細胞に感染しますから、その時にマクロファージに出会うと炎症が起き始めるとCRPがあがりだすのです。いつまでもヘルペス感染細胞が増え続けるといつまでもCRPは上がり続けるのです。免疫があがるとヘルペスは再び遺伝子の中に隠れて炎症は無くなりCRPも下がりだすのです。原因がわからない病気でCRPの上昇があれば病気の原因すべてヘルペスであると断定できるのです。
㉕herpesが原因である病気にステロイドを用いてherpesを増やし続けると治らない病気になり最後は医者に作った病気で死に至る病気になり癌の原因であるヘルペスを増やすので癌を作って人殺しをやってお金を稼いでいるのが医業です。
㉖ヘルペスはこれだけのすべての病気を起こしているのですが人間の免疫から逃れるのみならず世界中の医者にも気づかれない特別過ぎる病原体ウイルスなのです。
㉗何らかの原因と曖昧に表現される病気もすべてヘルペスです。
㉘病気の原因は(~とされている)と言う表現の(~)はヘルペスです。
㉙㉚は後述します。
ヘルペスが起こすあらゆる変性疾患はどのように生まれるのでしょうか?癌も遺伝子が作る正常な蛋白を異常な変性癌蛋白に変えてがん細胞が生まれるので広い意味では癌もherpesによる変性疾患といえます。
突然変異を起こして癌と言う変性疾患を生み出すのみならずあらゆる細胞の変性疾患や神経変性疾患では、異常なタンパク質の異常な凝集と蓄積があらゆる細胞や神経細胞でみられヘルペスのよる細胞の変性が起こります。癌もヘルペスによる遺伝子突然変異によって異常な変性蛋白によって生まれる変性疾患のひとつなのです。また遺伝子を異常にしなくてもherpesが増殖するときに細胞を利用し過ぎて細胞の正常な機能が停止してしまい正常な蛋白が作れなくなり細胞の死に至ることもあるのです。ではどのようにして具体的にはこの様な変性が起こるのでしょうか?
免疫が落ちた時にかつ細胞が二つに分裂する時にherpesは数十回、数百回、数千回も分裂増殖してしまい増殖し過ぎて役に立たなくなった感染細胞を変性壊死させたりしあらゆる細胞に感染して感染細胞の機能不全を招きあらゆる細胞の変性疾患を生じさせ最悪の場合は変性させた遺伝子が癌関連遺伝子であればたまたま癌細胞になってしまいます。数億個、数十億個も増えたherpesのビリオンは、あらゆる感染細胞のゲノムに自分のゲノムの遺伝子をアット・ランダムに組み込み変えてしまうと細胞の変性を起こし異常な蛋白を作り細胞の機能不全となって死に至こともあるのです。
医者と言う仕事は病気を治した報酬として対価であるお金がいただけるという極めて特殊な最高の職業なのですから医者の身分も稼ぎも健康保険システムで保障されているのですが残念ながら私の治療で病気がすべて治ってしまうと資本主義では病気を作らなければ仕事が無くなりお金も入りませんから免疫を抑えて症状だけを良くするだけの現代医療はすべて崩壊してしまいますから。実は「お金儲け」のために病気を作っても思いっきり嘘を付いても医療については患者さんは100%無知ですから医者は病気を治すためではなく好きなだけ金の儲かる医療に励んでいますね。アッハッハ!!!!人類発生以来の資本主義が崩壊しない限りあらゆる悪は無くならないでしょう。つまりホモサピエンスの種が絶滅しない限りは「悪」は滅びないでしょう。悲しいですね!!!!
飲作用(ピノサイトーシス)は細胞外液を取り込むエンドサイトーシスのことであり、細胞外液を満たした小胞(エンドソーム)を細胞内に形成します。食作用とは異なり、食細胞以外の普通の細胞でも発達した機構の一つであるのは、全ての細胞は細胞外液を細胞質に取り込むことで、細胞に必要な細胞外にある水溶性の栄養分を取り込む、細胞の生存に必須の機構であるからです。ピノサイトーシスは全ての細胞で行われている取り込み機構でありクラスリン介在性エンドサイトーシス、カベオラ介在性エンドサイトーシス、マクロピノサイトーシスが知られている。クラスリン介在性エンドサイトーシスはファゴサイトーシスと同様に取り込んだ物質を分解することを主な働きとする経路である。エンドソームはリソソームによる分解を受ける。カベオラ介在性エンドサイトーシスはカベオラと呼ばれる丸フラスコ様の窪みから物質を取り込み、カベオソームにより物質輸送がおこわなれる。カベオソームは通常のエンドソームとは異なり、pHの低下は起こらず中性を示し、リソソームによる分解は誘導されない。マクロピノサイトーシスとは大量の液体を細胞内に取り込む機構である。マクロピノソームの大きさは0.2~10μmと広い範囲にわたり、その大きさや形は取り込む物質に依存しない。マクロピノソームは必ずしもリソソームとは融合せず、他のエンドソームとくらべても中身が漏出しやすい。
ヘルペスウイルスなどの病原体とエンドサイトーシスとのかかわりはエンドサイトーシスのうち特に一つ目の食作用は、本来は、体内に侵入したウイルスや細菌などの病原微生物を排除するための、重要な生体防御機構である。感染の初期に、侵入した微生物を自然免疫の好中球やマクロファージが貪食することで、病原体が排除される。またマクロファージは、二つ目の抗原提示細胞の役割も持っているのでウイルスや細菌を貪食して細胞内で分解した異物の断片を細胞表面に提示(抗原提示)し、それをヘルパーT細胞が認識する手助けをして、その抗原(異物断片)に特異的な抗体の産生をBリンパ球にさせるという、抗原提示細胞としての役割をも担っており、感染初期だけでなく、もっと多くの病原体が侵入したときにも対処できるように、より高度な免疫システムである適応免疫への情報の橋渡しも行っていいます。
一方、病原体にとっては、食作用によって排除されると不利益であるので、食作用から逃れるさまざまな機構を発達させた病原体が多く存在する。たとえば、一部の病原細菌には、莢膜や粘液層と呼ばれる、多糖類やペプチドなどの分泌物からなる層で自分自身を包んでいるものが存在し、この構造により食細胞による貪食を回避している。このことは病原体の生存にとって有利に働き、ヒトなどの宿主にとってはこのような貪食回避機構を持つ病原体は病毒性の強いものとなり、医学上問題になることが多い。
またherpesを含むすべてのウイルスなどのように細胞に感染して初めて分裂増殖が可能な偏性細胞内寄生体や、宿主細胞内に寄生する一部の細菌である細胞内寄生体とよばれる①赤痢菌、②サルモネラ、③結核菌などは、その増殖の場となる細胞内部に侵入する際に、ずる賢く細胞のエンドサイトーシス作用を利用しているので感染力が強い細菌だと言われるのです。
ウイルスに関しては、アデノウイルスなどのエンベロープを持たないウイルスは一般に細胞に侵入する機構としてエンドサイトーシスを利用する場合が多いのです。ヘルペスウイルスはエンベロープを持っているのでアデノウイルスのように細胞のエンドサイトーシス作用を利用する必要はありません。また、エンベロープを持つウイルスでもインフルエンザウイルスなどは、エンドサイトーシスによる細胞内侵入をも行うのでインフルエンザウイルスは感染しやすいのでインフルエンザによる流行り風邪となってしまうのです。
細菌に関しては、ほとんどの細菌にとっては食細胞に取り込まれることは、その後にリソソームの働きによって殺菌されることにつながりますが、一部の細菌ではエンドソーム膜を溶かして細胞質に逃れたり、エンドソームの性質を変化させてリソソームとの結合を阻害したり、リソソーム中の活性酸素に抵抗性を示すなど、さまざまな手法により殺菌から逃れて、細胞内に侵入して感染するのです。これらの細胞内寄生性細菌には、むしろ積極的にエンドサイトーシスを引き起こすことで、自然免疫の王者であるマクロファージや上皮細胞などに取り込まれようとする機構を有するものもあるのです。しかもヘルペスウイルスのように自分のゲノムを感染細胞のゲノムに組み込んで細胞の遺伝子を突然変異させ癌遺伝子を生み出し癌を作ったりするのみならず癌遺伝子以外の遺伝子をも突然変異を起こして正常な蛋白質を異常なたんぱく質に変えて様々な細胞変性疾患を生み出してしまうのです。原因不明な治らない慢性疾患はすべてherpesが原因なのです。herpesウイルスは病気つくりの天才なのです。
メサンギウム細胞と糸球体毛細血管に存在するマクロファージの相互作用はどうなっているのでしょうか?まずサイトカインとは何でしょうか?免疫細胞から分泌されるタンパク質のことで、免疫細胞間の相互作用に関与し、周囲の免疫細胞に影響を与えるタンパク質のことです。そのサイトカインの働きは①免疫細胞を目的部位に集積する働き、②T細胞やB細胞など、獲得免疫系の細胞の分化を誘導する働き、③獲得免疫系および自然免疫系を活性化し、がんや病原体などの異物やherpesウイルスを排除する働きを持つタンパク質のことをサイトカインと言うのです。
サイトカインとは生理活性物質の総称ですと書かれてあるのは間違いです。サイトカインと生理活性物質とはその意味があまりにもかけ離れ過ぎです。何故ならば生理活性とは、免疫とは直接かかわりのない生体内化学物質が生体の特定の生理的調節機能に対して作用する性質のことであるからです。また、生理活性を持つ化学物質は生理活性物質と呼ばれます。 生体内ではさまざまな生理機能が酵素の活性調節や受容体を介した細胞内シグナル伝達により調節されていると言われるのは生化学や生理学の世界であって決して医学の分野である免疫学とは異なるからです。生理活性物質とは生理活性物質は主に生体機能の調節に働いており人体の細胞間の相互作用に関与し、周囲の細胞に影響を与えるタンパク質のことで、生命現象に微量で関与し、影響を与える化合物です。生理活性物質には①ビタミン②補酵素、③ホルモン、④抗生物質、⑤神経伝達物質、⑥サイトカインなどが例として挙げられますので広い意味で生理活性物質のほんの一部がサイトカインと言っても許されるかもしれません。サイトカインは本来は免疫学専門の術語なのです。
サイトカインの主な役割は何でしょうか?サイトカインは、私たちの身体を異物から守るうえで非常に重要な役割を果たしています。炎症性サイトカインとは何でしょうか?サイトカインの一種で炎症反応を促進する働きがあります。生きた病原体である細菌やウイルスが体に入ってきたときに、炎症反応を促進させて撃退するという重要な役割を担っています。炎症反応とはどういう反応ですか?炎症反応は、体外から体内に侵入した生命体であるherpesウイルスや細菌などの病原体を除去するための免疫の反応であり、戦いで障害を受けた組織を修復したり取り除く生体免疫反応も含まれるのです。
まず、サイトカインとは細胞から分泌されるタンパク質の一種で免疫細胞同士の情報伝達物質のことです。サイトカインは、現在数十種類発見されています。分類としては、①インターロイキン(IL)、②造血因子(CSF、EPO、TPO)、③インターフェロン(IFN)、④腫瘍壊死因子(TNF)、⑤増殖因子(EGF、FGF、PDGF)、⑥ケモカイン(IL-8、CCLなどの細胞接着分子)に分けられます。このようなサイトカインの中で、細菌やウイルスが体の中に入ってきたときに情報を伝達して炎症反応を促進させる働きをするものをまとめて炎症性サイトカインとか炎症メディエ―ターと呼ぶのです。つまり炎症性サイトカインも炎症メディエ―ターも同じ意味です。
糸球体局所において仮に免疫細胞であるマクロファージがヘルペスウイルスを発見して活性化されたマクロファージにより産生,放出される活性酸素,蛋白分解酵素などの炎症メディエイター(炎症メディエ―ター),さらにinter‐leukin-1(IL-1),tumor‐necrosis‐factor(TNF)-αなどのサイトカインは,herpesを取り込んだメサンギウム細胞やメサンギウム基質の増生を促し,糸球体基底膜障害などを修復することにより, ヘルペスウイルスを糸球体から取り除く炎症過程に関りますが悲しいことにherpesを殺し切ることができないので慢性疾患となってしまうのです。いつまでも治すことができない病気の原因もherpesウイルスが原因であるのです。炎症メディエイター(炎症メディエ―ター)の主なものとして①TNF-α、②IL-1、③IL-6④IL-8、⑤IL-12、⑥IL-18があります。 これらの中で、侵襲時に最も速やかに分泌され、最も強力な生体反応に見られる最高のメディエーターの1つがTNF-αです。この最も人体を守るのに貢献しているTNF-αの働きを抑制しているのがあらゆる自己疾患の治療で100%がんを作ることに貢献しているレミケイドです。
TNF-αとは何でしょうか? TNF(Tumor Necrosis Factor腫瘍壊死因子)は、腫瘍の壊死を誘導する活性化マクロファージ由来のサイトカインとして同定された。TNFは炎症、免疫に関与する重要なサイトカインである。 TNFにはTNF-α、TNF-β、リンホトキシン-βがあるが、一般に腫瘍壊死因子といえばTNF-αを指す。TNF-αの前駆体である膜結合型TNF-αが酵素により切断されると、可溶型TNF-αとなり、それがホモ3量体を形成し、血液中を循環する。TNFのは機能は TNFの受容体にはTNFR1とTNFR2がある。TNFR1にTNFホモ3量体が結合すると、デスドメインを介して細胞内シグナル伝達が活性化され、カスパーゼの活性化により細胞死(アポトーシス)が誘導される。一方で、TNFはTNFR1への結合およびデスドメインを持たないTNFR2への結合を介して、転写因子NF-κBを活性化する。活性化されたNF-κBは炎症・免疫反応で誘導される遺伝子の発現を調節するとともに、アポトーシスを抑制する。マクロファージの炎症局所への浸潤にはケモカインであるinter‐cellular‐adhesion‐molecule-1(ICAM-1)をはじめとする細胞接着分子の発現および単球走化性因子の存在が必要です。走化性因子はケモカインの仲間です。
さてIgA腎症の進展・増悪におけるマクロファージとメサンギウム細胞間相互作用がみられます。それはメサンギウム細胞にヘルペスが感染してメサンギウム細胞だけでは増殖して細胞外のメサンギウム基質にもヘルペスが感染するのみならず周辺のメサンギウム細胞にもつぎつぎとヘルペスウイルスのビリオンが感染してしまったので細胞外でherpesを見たら取り込んで殺してもらいために自然免疫細胞の殺しの王者であるマクロファージの幼弱な子供である単球を呼び寄せてさらに成熟させるために早くマクロファージになってもらうために単球走化性因子(monocyte‐chemoattractant‐protein-1略してMCP-1)およびマクロファージ分化誘導因子(macrophage-colony‐stimulating‐factor略してM-CSF)がメサンギウム細胞により産生されます。かつ,IL-1あるいはTNF-aにより,その遺伝子発現が増強されてメサンギウム細胞の周辺のヘルペスウイルスを殺してもらうためにメサンギウム細胞は頑張っているのです。しかしherpesに対してはあらゆる自然免疫も獲得免疫も無力なのです。
メサンギウム細胞やメサンギウム基質が増殖する腎炎では,メサンギウム細胞でのMCP-1(単球走化性因子)もしくはM-CSF(マクロファージ分化誘導因子)の発現増強に伴い糸球体内への単球・マクロファージが動員され蛋白尿の増強が見られるのはメサンギウム細胞のみならず糸球体の血液の濾過を行う糸球体内皮細胞や糸球体基底膜細胞や糸球体上皮細胞(足細胞)にもヘルペスが感染してしまいherpesが分裂増殖を繰り返して感染した細胞を傷つけ感染した細胞の遺伝子に溶原感染して隠れたり、時には増殖して溶解感染でメサンギウム細胞を溶かしたりして近隣の糸球体内皮細胞や糸球体基底膜細胞や糸球体上皮細胞(足細胞)の濾過機能を奪い取り濾過細胞を死に追いやることにもなるので蛋白尿の増強も見られるのです。
なぜこのような炎症性サイトカイン(炎症メディエ―ター)が大量にIgA腎症でみられるのでしょうか?メサンギウム細胞に殺しきれないherpes細胞が感染してしまいメサンギウム細胞でherpesが増殖してしまったのでherpesを退治してもらうためにマクロファージを呼び寄せるために炎症性サイトカイン(炎症メディエ―ター)が増えるのです。
単球とは何でしょうか?単球は、白血球の一種で、最も大きなタイプの白血球である。マクロファージや、樹状細胞に分化することができる。単球は、血中に10~20時間存在したのち、血管内から組織へ遊出する。 組織に入って5倍もの大きさにまで膨らんだ単球がマクロファージと呼ばれる大食細胞になる。単球.は、白血球の3~8%を占め、感染に対する防衛の開始に重要な細胞です。単球は、マクロファージと樹状細胞に分けられます。 マクロファージは、単球が分化した免疫細胞であり、異物を飲み込み消化する働きがあることから貪食細胞とも呼ばれます。 また、異物の情報をヘルパーT細胞に伝える役目も担っています。 樹状細胞も単球が分化した免疫細胞であり、異物が侵入するとその情報をヘルパーT細胞にいち早く伝えます。単球は、骨髄に存在する造血幹細胞(hematopoietic stem cell:HSC)にその起源を発し、さまざまな前駆細胞を経て産生される。単球は20マイクロメートル以上になる最も大きな免疫細胞で、マクロファージや樹状細胞や破骨細胞の三つに分化できます。単球の外観はアメーバ状で、人体の免疫細胞全体の2〜10%を占めます。単球は、身体の感染部位からの炎症シグナル(危険シグナル)に反応して8~12時間以内に患部に移動し、マクロファージや樹状細胞に分化して免疫反応を起こします。骨を食べる破骨細胞も単球から分化した細胞です。成人の場合、単球の半分は脾臓に蓄えられています。
IgA腎炎における糸球体内マクロファージおよび単球走化性因子(MCP-1),マクロファージ分化誘導因子(M-CSF)とヘルペスウイルスとは次のような深い関係があります。
1.糸球体内マクロファージには末梢係蹄内(一本の糸球体の始まりから末梢まで)の糸球体毛細血管壁に存在するものとメサンギウム領域内に存在するものがあるのは糸球体毛細血管の内皮細胞やメサンギウム領域内に感染したヘルペスをマクロファージが貪食して殺すことができるのですがメサンギウム細胞はherpesを食べこんでも殺すことはできないのです。
2.マクロファージの糸球体内への動員および局所での分化・生着には細胞接着分子の発現のみならず,herpesが感染したメサンギウム細胞より産生される単球走化性因子(MCP-1)ならびにマクロファージ分化誘導因子(M-CSF)によりマクロファージを成熟させる必要があるのです。皮肉な言い方をするとメサンギウム細胞が勝てる敵だと思い込んだherpesと闘うために呼び込んだマクロファージさえもherpesを処理できないので糸球体の炎症が広がるばかりなのにもかかわらずです。何故マクロファージはherpesを貪食しても殺しきれないのでしょうか?二つ理由があります。一つ目は糸球体血管の内皮細胞には孔が開いています。この孔を通してメサンギウム領域内に血中に流れ込んできたヘルペスウイルスがメサンギウム細胞に感染してしまうとマクロファージはメサンギウム細胞に侵入することはできません。細胞内にヘルペスウイルスが感染してしまうと自然免疫も適応免疫である液性免疫も細胞性免疫も100%無力です。二つ目は片腎に100万個も存在する糸球体毛細血管の入口から出口までメサンギウム細胞はギャップ結合で繋がった合胞体と言われる長い一個の細胞になっているので細胞膜がないので末梢の次のメサンギウム細胞にherpesは容易く感染出来るので次々と新しいあたらしくメサンギウム細胞に感染したヘルペスは免疫が落ちるたびに増殖を重ねてメサンギウム細胞は変性細胞となり機能不全のみならず細胞崩壊となり様々な糸球体細胞に感染したヘルペスは更に腎機能障害まで引き起こし、腎不全となってしまうのです。何故ならば腎臓の細胞には幹細胞がないので一度崩壊した腎細胞は再生が不可能であるからです。
IgA腎炎に見られる様々な組織学的病変には何があるでしょうか?これらの病変は メサンギウム細胞に感染したヘルペスとの長期にわたる炎症反応結果というよりもherpesはヒトが癌で死なない限りは殺しきることはできないので増殖を永遠に続けるからです。しかも糸球体の濾過機能に直接関わる細胞のすべては幹細胞がないので最後は透析となってしまうのです。透析によって生かされるいわば腎臓になってしまうのです。人工腎臓になってしまうのです。哀しいですね。
①メサンギウム細胞増多。
②メサンギウム基質増加。
③血毛細血管内細胞増多
④毛細血管係蹄(壁)壊死
⑤毛細血管外病変である細胞増殖や細胞性半月体や繊維増殖や繊維性半月体が出現。
⑥毛細血管腔の閉鎖による硬化
⑦糸球体毛細血管係蹄とボウマン嚢が癒着
⑧糸球体の毛細血管に血液が流れなくなる虚血性糸球体
⑨メサンギウム融解
⑩糸球体基底膜二重化などのが糸球体の病変が長い時間の中で見られるのです。
更に糸球体毛細血管病変以外に糸球体に連なる尿細管間質病変も出てくるのはherpes感染がとうとう尿細管まで波及しだしたのです。
①尿細管委縮
②尿細管間質線維化
③間質内炎症性細胞の浸潤④尿細管菅腔の赤血球充満⑤急性尿細管障害
腎臓への栄養血管の病変も出ます。
①弓状動脈や小葉間動脈の血管内膜肥厚性動脈硬化
②細小動脈内膜の硝子様細動脈の病変も見られます。
3.メサンギウム領域内に感染したherpesを貪食するために毛細血管から動員されたマクロファージはメサンギウム細胞の周囲にあるメサンギウム基質(メサンギウム細胞外基質)の産生を亢進させ増殖するのはherpesとマクロファージとの戦いによる炎症によりメサンギウム領域の構造が破壊されそうになったのでメサンギウム領域組織の修復のためです。しかし依然としてヘルペス感染は続いているのでその炎症の煽りを受けて糸球体の細胞にもherpesは感染していくのです。IgA腎炎の進展・増悪にマクロファージとメサンギウム細胞間の相互作用が見られるのはherpesウイルスが仲介しているからです。
4.IgA腎症にはIgG や IgM の沈 着も認めることがあるが,IgA が圧倒的に優位であります。組織の変化としては糸球体メサンギウム細胞と基質の増殖性変化が主体であるが,半月体,分節性硬化などは初期のherpes感染では含まれません。分節状硬化とはひとつの糸球体の中で、増殖性糸球体腎炎の部分的な硬化病変がある場合を言うのです。半月体とは何でしょうか?腎臓の糸球体の毛細血管の内皮細胞にherpesが感染して増殖して細胞外に出ていくときにマクロファージとの激しい炎症を起こすと、血管が破れて、そこから血液中の成分が糸球体の外に出てきます。すると、糸球体を覆っている袋であるボウマン嚢がそれを防ごうとして出現するのが半月体です。半月体は、糸球体の毛細血管を止血のために圧迫してしまうので、毛細血管の濾過機能を障害し、腎臓の正常な働きを更に低下させてしまうのです。
メサンギウム細胞の増殖の定義は何でしょうか?メサンギウム細胞の増殖とは,1つのメサンギウム領域に細胞が4個以上(ループス腎炎では3個以上)みられるものと定義されている。その評価は,厚さ2μmの標本において,糸球体血管極から離れた末梢のメサンギウム領域でなされるのです。1つのメサンギウム領域に細胞が4個以上増えなければメサンギウム細胞の増殖とは言えないのです。つまり4個ぐらいまでのメサンギウム細胞の増殖は正常でもありうるということです。
因みにIgA腎症を除くherpesとIgG抗体の戦いであるIgG腎症と言うべきメサンギウム増殖性糸球体腎炎(Mesangial proliferative glomerulo‐nephritis略して MesPGN)ではBowman嚢との癒着,分節性の硬化を示すことがある。分節状とはひとつの糸球体の中で、増殖性糸球体腎炎の部分的な病変がある場合を言うのです。Herpes性IgG腎症と言うべきメサンギウム増殖性糸球体腎炎(Mesangial proliferative glomerulo‐nephritis略して MesPGN)とは何でしょうか?メサンギウム増殖性糸球体腎炎 (MesPGN) は、他の免疫グロブリンや補体の有無にかかわらず、メサンギウム細胞数の瀰漫性または局所的な増加と糸球体メサンギウム内の細胞外マトリックスの拡大を特徴とする独特の糸球体反応パターンです。実はIgA腎症と言われるのは抗体の100% がIgAではないのです。IgA腎症で見られるIgA抗体の量は40~50%に過ぎないのですから残りはherpes性IgG腎炎やherpes性補体性腎炎なのです。
メサンギウム細胞は腎臓の糸球体を形成するきわめて細い糸球体毛細血管を、内側から繋ぎ合わせているギャップ結合で結びついた極めて極めて長い一本の特殊な細胞がメサンギウム細胞なのです。腎臓には、血液中の老廃物や塩分を濾過して尿として排出させる糸球体がある。この糸球体は、細い毛細血管が毛糸の球のように丸い塊となっていることから糸球体と呼ばれているのですが、この細い長い毛細血管は脆弱で形が崩れやすいのでふにゃふにゃな毛細血管を、きりっとした形に維持するために血管の中から軸のように支えているのがメサンギウム細胞とメサンギウム基質(メサンギウム細胞外基質)なのです。メサンギウム細胞は、糸球体の毛細血管の形状が崩れないように長い連なった一本の束になった形で存在しており、メサンギウム細胞外基質とともに糸球体の構造維持に関与するメサンギウム領域を形成しているのです。メサンギウムの一部は毛細血管の血流と直接触れているので、メサンギウム細胞内で増えたヘルペスがメサンギウム細胞の外に出た時にマクロファージとの炎症を起こすと糸球体の濾過の機能を果たしている血管内皮細胞、糸球体基底膜、血管上皮細胞(足細胞)に大きな孔が開いてしまい本来濾過されない蛋白や血球が孔から漏れ出てしまいタンパク尿や血尿が見られるようになるのです。ヘルペスとの炎症が広範囲に広がると腎機能が障害され、 IgA腎症などのメサンギウム増殖性糸球体腎炎へと進行してしまうのです。
更に糸球体の構造をもっと詳しく観察しましょう。
毛細血管の中の血液は,メサンギウム領域に接する部分を除いて,内皮細胞,糸球体基底膜,血管上皮細胞(足細胞)の3要素から成り立った濾過障壁を隔てて,ボウマン腔に面しています。
1)糸球体の構成。一つの腎臓に100万個ある糸球体(glomerulus)は,毛細血管の糸玉になっているのです。糸玉のまわりをボウマン嚢(Bowman’s capsule)という袋が取り巻き,濾過された原尿を集めているのです。糸球体とボウマン嚢を合わせて,腎小体(renal corpuscle)別名、マルピギー小体とも呼ぶのです。腎小体はいわば球状で,地球のように両極を区別する。輸入細動脈と輸出細動脈の二つの血管が出入りする方を血管極,近位尿細管につながる方を尿細管極と呼びます。糸球体毛細血管を作る内皮(endothelium)は,きわめて壁の薄い管であり,その周の一方の側で,血管内の中心にあるメサンギウム領域(mesangium)というメサンギウム細胞とメサンギウム細胞外基質から成り立っているのがメサンギウム領域であり糸球体の血管組織を支える結合組織と言えるのです。この毛細血管とメサンギウムの両者の外側を,糸球体基底膜(glomerular basement membrane)と足細胞(podocyte)の層、別名、糸球体上皮細胞が取り巻いて糸球体ができ上がっているのです。
糸球体基底膜により形態学的に毛細血管内領域 (endocapillary)と,毛細血管外領域(extracapillary)の二つの領域に区分される。「Endo」は「内側の」であり「extra」は「外側の」であり「capillary」は毛細血管であります。糸球体輸入細動脈と糸球体輸出細動脈は動脈であるので、この動脈圧による外向きの限外濾過圧がかかっていて,毛細血管内領域は解剖学的,機能学的にも閉鎖空間となっている。限外濾過圧とは透析膜の片側の溶液に圧力がかかると、溶液は膜の反対側に押し出されます。これを限外ろ過と呼んでいます。限外ろ過と浸透圧差を限外濾過圧といいます。糸球体の血管基底膜の血管内側の血液(溶液)に圧がかかると、血液(溶液)は膜の反対側に押し出され血液の溶液成分が濾過されますのでこの濾過作用を限外濾過圧による限外濾過と呼んでいます。糸球体濾過の場合、血液側からボーマン腔側へ圧力がかかっており、血液中の水分や塩などが押し出され、体内にたまってしまった水分や塩などを除去することが糸球体の仕事です。総限外濾過圧は8~17mmHgです。
この血管内の閉鎖空間のスペースは血管極の部位で糸球体の内にある傍糸球体領域と連結していて,メサンギウム細胞はギャップ結合により一種の細胞合胞体を形成しているので血管極の部位から糸球体の末端までメサンギウム細胞は一個の糸球体血管にある長い長い一個の細胞とみなしていいのです。傍メサンギウム領域(paramesagiual area)と傍糸球体領域の違いは何でしょうか?傍糸球体領域は糸球体の外の腸液にあるレニンを分泌する細胞でかつ血管を支える細胞でもあるのです。傍糸球体領域は糸球体の内部にある領域にあるのです。勿論一個一個のメサンギウム細胞には一個の核が存在しているのです。つまりメサンギウム細胞はギャップ結合により一種の巨大な一個の細胞合胞体を形成しているのですがギャップ結合は細胞膜ではないのでヘルペスはギャップ結合をメサンギウム細胞領域内で自由に長い長い一個の細胞内を実に簡単に移動できるので一つのメサンギウム細胞にヘルペスが感染すると全てのメサンギウム細胞に感染していることになるのです。ところがマクロファージはこの長い長い一個の細胞の中に侵入はできないので永遠にメサンギウム細胞からヘルペスウイルスを除去することが出来ないので最後はherpesによって糸球体はヘルペスにとって最最高に安全な分裂増殖の場所となりヘルペス感染が糸球体全体に広がり最後は100万個の糸球体が破壊され透析となるのです。
ギャップ結合とは何でしょうか?すでに述べたように隣り合う連なった上皮細胞をつなぎ、水溶性の小さいイオンや分子やherpesウイルスを通過させる細胞間結合のことです。 並んだ2つの細胞の細胞膜にはコネクソンと呼ばれるタンパク複合体の末端が複数並んでおり、細胞の細胞膜と隣の細胞の細胞膜とを橋渡し構造をなしているので細胞膜の役割は無いのと同じことになるのです。細胞合胞体とは何でしょうか?すでに述べたように細胞合胞体は一般的には,複数の核をもつ細胞のことです。血管極の部位で傍糸球体領域と連結しているメサンギウム細胞はギャップ結合で二種の異なった細胞同士が融合して生じる場合と、因みにもう一つは核が分裂する一方で細胞質が分裂しない(細胞質不完全分裂)ために生じる場合との二つがあります。
糸球体の構造をまとめると毛細血管の中の血液は,メサンギウムに接する内皮細胞の一部分を除いて,内皮細胞,糸球体基底膜,足細胞(糸球体上皮細胞)からできた濾過障壁を隔てて,ボウマン腔に面している。糸球体濾過はこの濾過障壁を通して行われる。糸球体には4種類の内皮細胞,メサンギウム細胞、糸球体基底膜,足細胞(糸球体上皮細胞)、に区別される。その第1は,毛細血管の内腔に面する内皮細胞である。その第2は,糸球体係蹄の中軸部に認められるメサンギウム細胞である。閉鎖空間である血管のど真ん中にあるメサンギウム細胞がいかに特異な細胞であるかを理解してください。だからこそヘルペスウイルスは免疫から回避できるのです。内皮細胞とメサンギウム細胞の両者は糸球体基底膜の内側の空間を占める。そして第3は,糸球体基底膜と第4は糸球体基底膜よりも外側にある足細胞です。
上方の血管極には遠位尿細管が付着し,下方の尿細管極ではボウマン嚢の壁をつくるボウマン嚢壁側上皮が近位尿細管につながる。ボウマン嚢壁側にある上皮糸球体表面の足細胞(上皮細胞)から出る複数の一次突起と,一次突起からさらに分かれて糸球体表面を覆う細やかな足突起がある。メサンギウム細胞は毛細管にも向かって突起を伸ばし,メサンギウム角およびメサンギウムの周縁領域で突起を伸ばし,メサンギウム角とメサンギウム突起で糸球体基底膜を固定する。メサンギウム角とは何でしょうか?メサンギウム細胞はアクチン線維束をもつ細胞突起部位で,糸球体基底膜と強く結合している突起部位があります。この部位をメサンギウム角と呼んでいます。「角」で糸球体基底膜から離れないようにしているのです。メサンギウム角の役割は何でしょうか?糸球体の血管の血液は既に述べたように外に向かう限外濾過圧がかかりこの外に向かう血液の圧の膨張力に対抗し,糸球体基底膜を内向きに牽引して糸球体係蹄の形態を保持しているのが糸球体基底膜と強く結合している突起部位であるメサンギウム角の役割なのです。
ボウマン嚢の壁をつくる壁側上皮細胞(parietal epithelial cell)は,尿細管極では近位尿細管の上皮細胞に移行するが,血管極では糸球体表面を覆う足細胞に移行する。ボウマン嚢の壁側上皮は糸球体表面の上皮と一つながりであるのは,発生過程を考えると理解できる。尿細管になるべき管の先端は,やや膨らんで終わっていたが,この袋に握り拳を押しつけたようなもの,と考えると、握り拳(糸球体の本体)にへばりつく袋の内壁が足細胞,その外側にある袋の中身がボウマン腔,外壁が壁側上皮である。
2)濾過障壁の構成。濾過障壁は3層から成る。その最内層は扁平な内皮細胞によって作られている。内皮細胞はメサンギウムに近い側にあり,きわめて薄い細胞質突起を伸ばして,毛細血管の内腔を覆っている。内皮細胞の細胞質突起は孔が数多く開き,そこには他の臓器の毛細血管内皮の孔に見られるような隔膜は認められない。隔膜とは細胞や組織を区切っている膜のことです。濾過障壁の主役は糸球体基底膜である。糸球体基底膜の主成分はIV型コラーゲンであるが,プロテオグリカンの存在によって負の荷電をもち,陰性荷電に対する障壁となっている。アルブミンも陰性荷電ですから糸球体基底膜に近づけないのでましてや濾過されることもないのです。足細胞は,多数の突起を伸ばすタコの足のような形の細胞であるので、タコ足細胞といってもいいのです。たこ足突起をかみ合わせながら,糸球体の表面全体を覆っている。隣り合う足突起の間には幅40 nm(10億分の40メートル)ほどの濾過スリット(filtration slit)が開いている。この隙間を塞ぐように,足突起の底の近くをスリット膜(slit diaphragm)が存在している。過障壁は,血漿中の成分のうち,タンパク質をほとんど通さないという特性を持っている。濾過スリット(filtration slit)とスリット膜(slit diaphragm)とは異なるスリットです。
3)基底膜とメサンギウムの関わりについては、糸球体濾過を行うために,糸球体の内部には約50 mmHgという高い限外濾過圧が封じ込められている。この約50 mmHg圧力を封じ込めるための実質的な障壁は,糸球体全体を外から包む糸球体基底膜と足細胞であり,血圧による外向きの膨張力を受ける。これに抗して基底膜を内向きに牽引し,糸球体の複雑な形態を維持している主役がメサンギウム細胞でありメサンギウム角とでメサンギウム突起です。特に,糸球体基底膜が内皮の表面からメサンギウムの表面に移行するメサンギウム角mesangial angleのところで,メサンギウム細胞から出た突起が糸球体基底膜と接触しており,メサンギウム細胞の突起の中に豊富なアクチン線維が含まれ突起が内側に糸球体基底膜を引っ張って限外濾過圧に対抗しているのです。
メサンギウム細胞の構造と機能の細胞特性は何でしょうか?
メサンギウム細胞は糸球体の血管の中心部である軸部に位置し,腎糸球体の構造と機能維持に重要な役割を担う細胞である。糸球体血管内皮細胞が有窓であることからメサンギウム細胞は血液からの影響を受けやすく,ヘルペス感染による増殖性炎症像を呈したり,herpesから自分自身を守るために異常な細胞外基質成分を産生し,herpes感染の結果として原発性および続発性糸球体腎障害を起こしてしまうのです。
メサンギウム細胞は糸球体全細胞数の 30~40 %を占めていて,二種類のメサンギウム細胞に分けられます。主要な細胞は,平滑筋細胞と類似したミクロフィラメントをもつ収縮性のある細胞である。もう一つは,メサンギウム細胞数の 5~15 %を占める貪食細胞の性格をもつ細胞である。一方,血管極にある緻密斑と輸入・輸出細動脈に囲まれた傍糸球体領域にもメサンギウム細胞と形態的・機能的に同種と捉えられる細胞が存在し,糸球体外メサンギウム細胞と呼ばれています。傍糸球体領域のメサンギウム細胞と糸球体外メサンギウム細胞とは異なる細胞です。傍糸球体領域のメサンギウム細胞は糸球体の中にあります。
平滑筋細胞あるいは線維芽細胞に似ているメサンギウム細胞は,陥凹のある核と少量の細胞小器官であるミトコンドリア,リソソーム,リボゾーム,粗面小胞体,ゴルジ装置などの一般の細胞が持っている細胞小器官以外に,平滑筋細胞が持っている豊富なアクチン線維束,ミクロフィラメント構造をもっています。アクチンのみならずミオシン,トロポミオシンなどの収縮関連機能蛋白も保有している。メサンギウム細胞は不規則な細胞突起をもち,メサンギウム基質および糸球体基底膜と連結し,内皮細胞とも接触していることは既に書き記しその目的も説明しました。また,細胞突起を血管腔内に伸ばしている所見も見られます。
1 .メサンギウム細胞の発生については、後腎由来の間葉系細胞が上皮細胞集団へと形質転換し,S 字状の管構造を呈する時期,S 字管陥凹部に原始毛細血管が入り込んで初期の糸球体形成が始まります。後腎とは何でしょうか?腎臓は中間中胚葉から発生し、前腎、中腎、後腎の3段階を経て形成される。前腎、中腎のほとんどは後に退行変性し、哺乳類成体において機能する腎臓は後腎である。前腎は1つのネフロンからなる非常に単純な構造である。中腎はその尾側に発生し、数十のネフロンからなる。この一部は男性生殖器となるが、腎臓としての中腎は退行する。我々哺乳類の腎臓、すなわち後腎は、中腎管(ウルフ管)の最も尾側に尿管芽と呼ばれる突起が出現し、その周りに間葉組織が集合して生じる。この尿管芽と後腎間葉との相互作用によって、数百万ものネフロンをもつ後腎が完成する。尿管芽の周りに間葉細胞が凝集し、それが上皮化してS字体といわれる状態を経て、糸球体、近位及び遠位尿細管が発生する。尿管芽は分岐を重ね、集合管、尿管となる。つまり、腎臓としての機能を司るそのかなりの部分が後腎間葉から発生することになり、尿細管には10種を超える細胞が存在するため、後腎間葉は多能性をもった前駆細胞集団ともいえる。
メサンギウム細胞は,この侵入した微小血管(動脈系)の周皮細胞として捉えることができ,このことはメサンギウム細胞の各種機能,メサンギウムおよび糸球体再生過程を理解するうえで多くの示唆を与えてくれる。糸球体内皮細胞の産生する血小板由来成長因子(platelet‐derived growth factor:PDGF)B がメサンギウム細胞の補充に重要なシグナルとなっている。メサンギウム細胞がヘルペス感染のために崩壊してしまうとPDGFがメサンギウム細胞の補充を行えと刺激を与えてくれメサンギウム細胞の補充ができるのです。つまり10種類の腎臓の細胞で幹細胞を持っているのは糸球体の支持組織であるメサンギウム細胞だけなのです。だからこそ慢性腎炎が進めば進むほど幹細胞を持っているメサンギウム細胞の増加が目立つのです。herpes感染によって傷ついたメサンギウム細胞の再生は幹細胞によって可能であることと、同時にIgA腎炎の責任は異常になったヘルペスによって痛めつくされたメサンギウム細胞ではなくherpes感染症である事を免疫学的に証明していきましょう。従ってherpesが感染したメサンギウム細胞がherpesとの戦いによって生まれた腎障害をIgA腎症と言うべきではなく炎症で生まれたのですからIgA腎炎と言うべきなのです。何故ならばIgA腎症はヘルペスウイルス感染症であるからです。
1 )メサンギウム細胞はherpesによる感染のために傷害され,herpes増殖のための溶解感染の結果、メサンギウム融解を引き起こすこともありますが、その後,herpesによる感染のための傷害は糸球体外メサンギウム細胞あるいは残存する軸部メサンギウム細胞が増殖再生して糸球体の末梢に至るまでのメサンギウム構造の修復が行うことが出来ます。メサンギウム細胞はヘルペスに傷つけられようが一部が溶解感染してしまっても更にherpesの増殖のために細胞の生存機構を完全に利用されつくされて崩壊しても、残った糸球体外メサンギウム細胞あるいは残存する軸部メサンギウム細胞が増殖し末梢に至るまでのメサンギウム構造の修復が行うことができるのです。この様に本来メサンギウム細胞は強靭な細胞でありますがherpesに殺しきれないherpesにはまた隠れ家である細胞のゲノムに自分のゲノムを組み込んで遺伝子の組み換えを自由自在に可能な天才herpesにはどの細胞も敗北以外にないのです。従ってワクチンですべての感染症は制圧されてしまった現代でも癌を含めて現代に残されている病気の原因のすべてはherpesとなってしまったのです。
IgA腎症の始まりはメサンギウム細胞が糸球体毛細血管に流れ込んできたIgA免疫複合体のFabに結合したherpesをメサンギウム細胞のFcR部位と結合してとり込んだために間違いが起こり始めたのです。それも二種類のメサンギウム細胞は機能的に二つに分けられ、主要な細胞は,平滑筋細胞と類似したミクロフィラメントをもつ収縮性のある細胞であり、もう一つは,メサンギウム細胞数の 5~15 %を占める貪食細胞の性格をもつ細胞であるので、メサンギウム細胞に付与されたこの免疫機能がヘルペスと闘うことをさせてしまったのはメサンギウム細胞の責任ではないのです。何故ならばどんなに優れた人の免疫もherpesを打ち負かす力はないのですから最後はヘルぺスの遺伝子を癌化させる力で癌になって死んでしまうのですからどうにもならないことなのです。だからこそヘルペスを増やさないことしかヘルペスに対する防御方は無いのですが世界中の医学はステロイドで免疫を抑制するのが最高の治療になっているのは許せないことですがお金が世界を牛耳っているので社会制度を変えない限りどうにもならないことばかりです。医学のみならずすべての分野は嘘で塗り固められていますが金の力に勝てる人間は誰もいません。哀しいですね!!!!
IgA抗体のFabレセプターに捕まえられたヘルペスウイルスとのIgA免疫複合体になった抗体のFc部分にメサンギウム細胞が持っているFcR(Fcレセプター)が結合する意味は何でしょうか?
FCAMRはFc Alpha And Mu Receptorの略で正しくは Fcα/μRとも呼ばれます。
FCAMRはFc Alpha And Mu Receptorの略ですがFcα/μRとも呼ばれる意味は一体何でしょうか?Fcα/μRは正確にはFcαR and FcμR です。FcαRのFcは抗体のFc部分でありαRのαはIgAのαなのです。Rはレセプター(Receptor)のRです。FcμRのFcは抗体のFc部分でありμRのμはIgMのμなのです。A Rはレセプター(Receptor)のRです。
FCAMR は、IgM および IgA に結合する Fc 受容体です。FCAMR は IgM に対して高い親和性を持ち、IgA に対しては中程度の親和性を持っています。FCAMRはB細胞、メサンギウム細胞のFcレセプターマクロファージ上で発現します。メサンギウム細胞のFcレセプターがIgA のFc部分に対しては中程度の親和性を持っていることが分かったのです。それでは何故FCAMR は IgM に対して高い親和性を持っているのにも関わらず、糸球体でIgM免疫複合体のIgM抗体のFc部分とメサンギウム細胞のFcレセプターとが結合しないのでしょうか?それは分泌IgM抗体は感染の初期に用いられることも有りますが本来分泌IgM抗体は5量体になって自然免疫の補体と結合して補体を活性化することが主な仕事であるのです。補体についてはここを読んでください。IgM抗体についてはここを読んでください。しかもIgM抗体はBリンパ球の膜抗体として生まれ分泌抗体となって液性抗体として働きだすのですが同じ敵に対してIgM抗体をクラススイッチしてIgG抗体になったほうが細菌やヘルペスのような病原体とに戦いがしやすいのです。
IgM抗体の特徴は細菌やヘルペスウイルスに感染した時に一番最初に作られる抗体です。 発症してから1週目の中頃から後半に生成が開始され、検査で検出可能になるのは発症後2週目頃からとされています。IgMとは免疫グロブリンの主要な5つのクラスの中の一つであり、初期免疫(一次抗体反応)で重要な役割を果たしている。 抗原が侵入するとまず最初に産生される抗体がIgMである。 IgMは細菌同士を結び付けて凝集させる作用や、補体を活性化させる作用が強いのですがとされる。IgA は非常に弱い補体活性化抗体です。そのため、補体系を介した細菌細胞溶解を誘発しません。
エンドサイトーシスと微生物死滅の誘導を媒介します。Fcα/μR / FCAMR 転写物は、胸腺、脾臓、肝臓、腎臓、小腸、大腸、胎盤などのさまざまな造血組織および非造血組織で発現されます。転写物とは何でしょうか?転写産物とも言います。タンパク質の生合成に関する情報を含んだDNA鋳型(テンプレート)から転写によって生成されたRNAの配列が、転写産物(転写物)なのです。つまり転写物とはRNAポリメラーゼによって合成されたmRNAのことです。Fcα/μR / FCAMRはIg様ドメインに保存されたモチーフを持ち、IgAおよびIgMのFcに結合します。Fcα/μR / FCAMR は、IgM でコーティングされた微生物病原体のエンドサイトーシスを媒介します。Fcα/μR / FCAMR は、食作用を刺激することによる微生物感染に対する防御や、抗原プロセシングおよびヘルパー T 細胞への提示にも関与しており、その結果、自然免疫応答から適応免疫応答への連鎖が生じます。
Fc受容体とは何でありどんな役割があるのか?
Fc受容体は、免疫系のherpesウイルスのような病原体から人体を保護する機能に寄与する免疫グロブリンスーパーファミリーに属するタンパク質である。免疫グロブリンとは抗体のことです。スーパーファミリーとは同じドメインを持つタンパク質のグループです。ドメインとは タンパク質の構成単位で、アミノ酸配列、立体構造、機能、進化などの面で同じようなまとまった領域です。通常50~200個のアミノ酸残基からなり、空間的に独立したコンパクトな構造を持っています。
免疫グロブリン(抗体)のFc受容体は、①Bリンパ球、②ナチュラルキラー細胞、③マクロファージ、④好中球および⑤マスト細胞を含む免疫関連の特定の細胞の表面上やメサンギウム細胞にも見出されます。Fc受容体の名称は、Fc部分(部位、フラグメント)として知られている抗体の尻尾に対する結合特異性に由来するのです。Fc受容体(Fcレセプター)は感染細胞または侵入病原体に付着した抗体に結合する。認識する抗体の尻尾の種類に基づいて多くの種類の特異的なFc受容体が存在する。この特異性によって抗体の種類が5つに分けられているのです。Fc受容体の活性化は、貪食細胞または細胞傷害性細胞を刺激し、抗体媒介性の食作用または抗体依存性細胞毒性(ADCC)によって微生物または感染細胞を破壊できるのです。ADCCとはantibody dependent cellular cytotoxicity(抗体依存性細胞傷害)の略です。細胞や病原体に抗体が結合すると,その抗体のFc領域を認識するFc受容体を持ったマクロファージやNK細胞といった免疫細胞が呼び寄せられ,抗体が結合している細胞や病原体を殺傷することを指す.
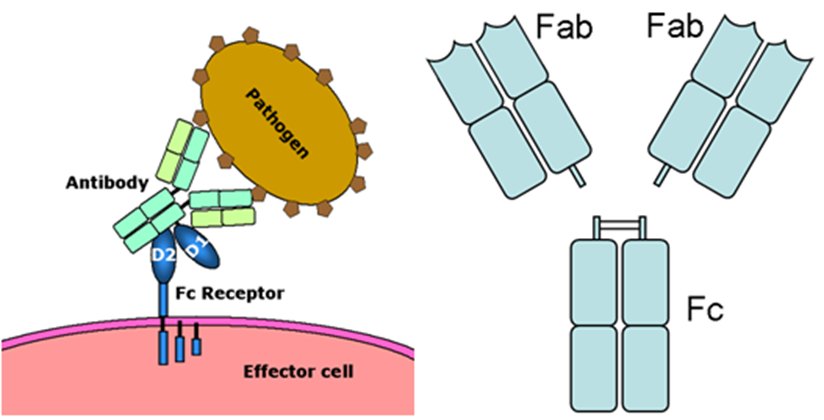
上の図のAntibodyは抗体。Pathogenは病原体。Fc receptorはFc受容体。上の右の図は抗体をFabフラグメント(部分)とFcフラグメント(部分)に分けたものです。抗体のFabフラグメント(部分)とFcフラグメント(部分)とを混同しないようにしてください。またFcフラグメント(部分)とFc受容体と混同しないで下さいね。マクロファージのFc受容体が抗体のFcフラグメント(部分)と結合するのです。
Fc受容体は、免疫系のherpesウイルスのような病原体から人体を保護する機能に寄与する免疫グロブリンスーパーファミリーに属するタンパク質である。Fc受容体は、抗体のFc部分に結合することができるのです。抗原を認識する5種類の抗体の種類に基づいて多くの種類のFc受容体が存在する。
Fc受容体は、Bリンパ球、ナチュラルキラー細胞、マクロファージ、好中球、マスト細胞などの特定の免疫細胞の膜に存在する抗原認識に関与する抗体受容体以外にメサンギウム細胞も持っています。このようなFc受容体は抗体のFcフラグメントを認識することからFc受容体の名前が付けられています。上の図に示したように例えばヘルペスが感染した細胞または病原体であるヘルペスに付着した抗体に結合する Fc 受容体は、免疫系の人体保護機能に貢献します。このようなFc 受容体の作用は、Fc 受容体を持っている貪食細胞またはナチュラルキラー細胞などを刺激して、ヘルペスウイルスなどの微生物やまたは抗体媒介食作用または抗体依存性細胞媒介によって感染細胞を破壊します。Fc受容体は、マクロファージや単球などの食細胞、好中球や好酸球などの顆粒球、自然免疫系(ナチュラルキラー細胞)または適応免疫系(B細胞など)のリンパ球などの免疫系の多くの細胞上に見られることは既に述べました。それらは、これらの細胞が微生物または微生物に感染した細胞の表面に付着した抗体に結合できるようにし、これらの細胞が微生物病原体を特定して排除するのを助けます。食細胞の活性化は、Fc 受容体が抗体の尻尾にあるFc部分と結合することによってもたらされる最も一般的な機能なのです。
Fc受容体の種類、認識する抗体の種類に応じていくつかの種類があります。IgGを認識するFc受容体はFcγ受容体(FcγR)と呼ばれます。IgAのFcを認識するFc受容体をFcα受容体(FcαR)といいます。IgEのfc部分を認識するFc受容体をFcε受容体(FcεR)と呼びます。Fc受容体の最も一般的な機能は食細胞の活性化です。
Fcα受容体の機能は何でしょうか? Fc α 受容体は、2 つの細胞外 Ig 様ドメイン、α 鎖と γ 鎖で構成されています。Fc α 受容体 I γ 鎖には、いわゆる ITAM (免疫受容体チロシンベースの活性化モチーフ) シグナル伝達モチーフが含まれています。ITAMを伴うFcα受容体Iは、srcファミリーチロシンキナーゼおよびsykファミリーチロシンキナーゼを連続的に活性化し、エンドサイトーシスや、ADCCを媒介します。
ADCCとは何でしょうか?Antibody Dependent Cellular Cytotoxicity(ADCC)は抗体依存性細胞傷害と訳し抗体に結合した細胞や病原体が、抗体を介して標的細胞の表面抗原に結合した抗体のFc部位がナチュラルキラー細胞のみならず、マクロファージ、好中球、好酸球などのエフェクター細胞のFc受容体と結合する事で、抗体依存的に誘導される細胞傷害活性で細胞や病原体が破壊されてしまいます。
Fcγ(ガンマ)受容体の機能は何でしょうか?Fc ガンマ受容体 (FcγR) は、IgG抗体の尻尾のFc部分に結合する Fc 受容体の一種です。Fcγ受容体は受容体の親和性に応じて、高親和性受容体FcγRI、低親和性受容体FcγRII、FcγRIIIに分類されます。FcγRII は、免疫複合体の食作用とエンドサイトーシス、および B 細胞の活性化を可能にします。FcγRIII は、NK 細胞および活性化単球で発現される膜貫通分子であり、上で述べた抗体依存性細胞傷害 (ADCC) を媒介します。
Fcイプシロン受容体の機能は何でしょうか?Fc イプシロン受容体は、顆粒球で発現され、IgE に結合する Fc 受容体です。Fc γ 受容体と同様に、Fc ε 受容体は高親和性受容体 FcεRI と低親和性受容体 FcεRII に分類できます。そのうち、FcεRI はアレルギー反応と寄生虫感染に対する防御に関与しています。適切なアレルギー抗原または寄生虫が存在する場合、顆粒球の表面で少なくとも 2 つの IgE 分子とその Fc 受容体の架橋が引き起こされ、細胞はその顆粒からあらかじめ形成されたメディエーターを迅速に放出します。ほとんどの FcεRII は B リンパ球に存在します。FcεRIIは、Bリンパ球によるIgE-抗原複合体のエンドサイトーシスおよびIgEでコーティングされた粒子の食作用を媒介します。
他の種類の Fc 受容体にはいくつかあります。①新生児Fc受容体はMHCクラスI受容体の一種です。新生児 Fc 受容体は FCGRT とも呼ばれます。ヒトでは新生児 Fc 受容体が胎盤を越える母体 – 胎児 IgG 輸送を媒介します。②FCRL は Fc受容体ホモログ(FCRH)とも呼ばれ、Fc 受容体様タンパク質であり、5 つの Ig スーパーファミリー メンバーからなるサブファミリーです。③FCRL は、IgG の古典的な Fc 受容体と配列相同性を持っています。④FCAMR は、IgM および IgA に結合する Fc 受容体です。FCAMRはFc Alpha And Mu Receptorの略で正しくは Fcα/μRとも呼ばれます。FCAMR は IgM に対して高い親和性を持ち、IgA に対しては中程度の親和性を持っています。FCAMRはB細胞、メサンギウム細胞、マクロファージ上で発現し、エンドサイトーシスと微生物死滅の誘導を媒介します。
Fc α 受容体 (FcαR) は、IgA に特異的な受容体であり、低親和性で IgA に結合します。Fc α 受容体サブグループに属するタイプは 1 つだけしかなく、Fc αRI (CD89) と呼ばれます。Fc α 受容体 I は、好中球、好酸球、単球/マクロファージ、樹状細胞、およびクッパー細胞で発現されます。IL-1β、IL-8、TNF-αなどの多くのサイトカインおよび他の薬剤がFcα受容体Iの発現を調節します。他の Fc 受容体とは対照的に、Fc α受容体 I の発現はポリマー IgA によって下方制御されます。ポリマー IgAとは二量体 IgAで、粘膜で働き二個のIgAの四個のFabに結合した同じ四個の病原体であるヘルペスウイルスなどを便として排泄するのです。FcとFc α 受容体 (FcαR)が結合できません。
Fcガンマ受容体(FCGR /FcγR)とは何でしょうか?FcγRは、IgGのFc部分の受容体である。Fcガンマ受容体には例えば、 CD64(FCGRI /FcγRI)、 CD32(FCGRII /FcγRII)、CD16(FCGRIII /FcγRIII)という3つの主要なクラスがある。全てのFcガンマ受容体(FcγR)は免疫グロブリンスーパーファミリーに属する。Fcガンマ受容体は、オプソニン化された食作用、炎症性メディエーターの放出および抗体依存性細胞傷害作用(ADCC)のような多くの免疫系エフェクター機能では不可欠である。Fc ガンマ受容体 I (FcγRI、CD64) は、単球と好中球に存在します。FcγRI の最も特徴的な特性は、リガンドに対する比較的高い親和性です。
Fc ガンマ受容体 I は、免疫複合体を形成していない単量体免疫グロブリンに結合します。Fc ガンマ受容体 I は、単量体リガンドの結合を直接測定できる唯一の IgG Fc 受容体です。FcvRI の発現は、ガンマ インターフェロン (IFN-γ) によって 20 倍も増強されます。
Fc ガンマ受容体 II (CD32) は、NK 細胞を除くすべての FcγR を持つ細胞で見つかります。Fc ガンマ受容体 II のリガンドに対する親和性は非常に低いため、単量体リガンドの結合を直接測定することはできません。単量体(たんりょうたい)とは?重合反応で重合体をつくるときの出発物質となる低分子量の化合物で、天然にある高分子化合物の基本の単位になっている化合物にもいう。リガンド とは 特定の受容体(レセプター)に特異的に結合する物質。リガンドは、受容体の中のある決まった部位(リガンド結合サイト)に特異的に結合する。
Fc ガンマ受容体 II の機能は免疫複合体の食作用とエンドサイトーシス、および B 細胞の活性化を可能にします。免疫複合体とは抗体のFabに抗原が結合している抗体のことです。
Fc ガンマ受容体 III (CD16) は、マクロファージおよびNK 細胞、骨髄前駆細胞、および好中球細胞株でのみ見られます。細胞株(Cell Line)とは、ガン化によって無限の増殖性を持った不死化細胞を指します。マクロファージ上の Fc ガンマ受容体 III の発現は、IFN-γ によって調節されます。機能に関しては、Fc ガンマ受容体 III は抗体依存性細胞傷害 (ADCC) を媒介します。
Fcイプシロン受容体(FcεR)は、アレルギー抗体であるIgEに結合するFc受容体です。εはイプシロンと読み、ギリシャ文字で英語のΕと同じで、エプシロンとも発音します。免疫系の細胞には2種類のFcεRがある。高親和性受容体のFcイプシロン受容体I (FcεRI/ FCERIは、単量体IgEに結合することができる。低親和性受容体のFcイプシロン受容体II(FcεRII/ CD23 / FCERII)は複合体IgEと優先的に相互作用する。Fc イプシロン受容体 I は、表皮に常在しているランゲルハンス細胞、好酸球、マスト細胞、好塩基球に存在します。古典的な Fc イプシロン受容体 I は四量体です。これは、IgE の結合部位を提供する α 鎖、β 鎖、およびモノダイマー γ 鎖で構成されます。Fcε受容体Iのβ鎖は受容体の成熟を促進し、細胞内のFcεRI表面発現とシグナル伝達能力の増加をもたらします。γ鎖サブユニットは、細胞内に最初のシグナルを伝達する役割を果たします。Fc イプシロン受容体 I は、アレルギー反応と寄生虫感染に対する防御に関与しています。アレルギー抗原または寄生虫が存在する場合、顆粒球の表面で少なくとも 2 つの IgE 分子とその Fc 受容体の架橋が引き起こされ、細胞はその顆粒からあらかじめ形成されたメディエーターを迅速に放出します。ほとんどの Fc イプシロン受容体 II は B リンパ球に存在します。Fc イプシロン受容体 II は、膜結合受容体または可溶性(分泌性)受容体として複数の機能を持っています。Fc イプシロン受容体 II は、B 細胞の増殖と分化を制御し、好酸球、単球、好塩基球の IgE 結合をブロックしてしまいます。
新生児Fc受容体(FCGRT)は、MHC クラスI受容体の一種である。新生児Fc受容体(FCGRT )は、げっ歯類に最初に発見された。げっ歯類では、新生児の腸上皮および胎児の卵黄嚢における新生児Fc受容体は母IgGを新生児へ輸送し、また、母から胎児へ胎盤を越えるIgGの輸送を媒介する。
Fc受容体様タンパク質(FCRL / FCRH)とはFc受容体様タンパク質であり、5つのIgスーパーファミリーメンバーのサブファミリーである。 FCRL はFc受容体ホモログ(FCRH)とも呼ばれる。FCRLは、IgG、FCGRI、FCGRIIおよびFCGRIIIの古典的Fc受容体と配列ホモログを有する。FcRH1-5サブファミリーのメンバーは、免疫受容体チロシンベースの活性化モチーフ(ITAM)、阻害モチーフ(ITIM)またはその両方を有するレセプターのネットワークに属する。FCRLの機能に関しては、B細胞における活性化コレセプターであり、B細胞の活性化および分化を促進することである。コレセプター( co-receptor)は、リガンド認識の促進や病原体の宿主細胞への進入などのため、主要な受容体(primary receptor)に加えてシグナル伝達分子が結合する細胞表面受容体である。 共受容体、共同受容体、補助受容体とも訳される。B細胞の補体のレセプターはコレセプター( co-receptor)の代表です。
ITAM(immunoreceptor tyrosine-based activating motif)とITIM(immunoreceptor tyrosine-based inhibitory motif)とは何でしょうか?ITAM と ITIM は免疫細胞(B 細胞・T 細胞・樹状細胞・マスト細胞など)の受容体に存在するアミノ酸配列モチーフである.ITAM はチロシン残基を二つ含むアミノ酸配列モチーフであり,活性化型レセプターまたはそれと会合するアダプター分子の細胞内領域に存在する.アダプタータンパク質(Adaptor Protein)とはシグナル伝達に関与するタンパク質の一種である。アダプター分子(Adaptor Molecule)とも呼ばれ、アダプタータンパク質自体は基本的に酵素活性を有していないが、他のタンパク質との結合に関与するドメインを複数有しており、SH2ドメインやロイシンジッパー、Znフィンガーなどの構造がそのドメインの例である。アダプタータンパク質はこれらのドメイン構造を介してシグナル伝達分子と結合し、そのリクルートを行うと共に、受容体とシグナル伝達分子の会合を仲介する役割を持ち、チロシンキナーゼや酵素などのシグナル伝達分子を受容体の近くに集めることでシグナル伝達分子の活性化を促進させている。従ってITAMの場合は活性化型レセプターの刺激により ITAM のチロシン残基がリン酸化されると,Syk ファミリーキナーゼなどがリン酸化された ITAM に結合して活性化シグナルを伝達する.一方,ITIM はチロシン残基を一つ含むアミノ酸配列モチーフであり,抑制型レセプターの細胞内領域に存在する.抑制型レセプターの刺激に伴い ITIM のチロシン残基がリン酸化されると,ホスファターゼがリン酸化された ITIM に結合して活性化シグナルを抑制する.Syk は IgE 受容体活性化を介したマスト細胞のヒスタミン放出やサイトカイン産生,マクロファージのファゴサイトー シス,破骨細胞の活性化,さらに B 細胞の分化や活性化に必須の役割を担っている。SH2 (Src-homology 2) ドメインとは、約100アミノ酸残基からなるモジュールで、特異的なリン酸化型チロシン (pY) ペプチドモチーフに結合します。SH2ドメインの役割はSH2ドメインは、標的タンパク質のチロシンリン酸化配列に結合する機能を持つ。 SH2ドメインとチロシンリン酸化された標的との結合は、受容体の活性化を下流のシグナル伝達へと導き、核での遺伝子発現の制御や細胞質全体へのシグナル伝達へとつながる。ロイシンジッパーとはタンパク質の二次構造のモチーフの1つで、平行に並んだ二本のαヘリックスを結び付けるジッパーのような接着力を持つのです。専門用語では遺伝子発現の調整に関わるタンパク質などの二量化したドメインに共通して見られるといいます。ロイシンジッパー真核生物の特徴である。
ロイシンジッパーの構造
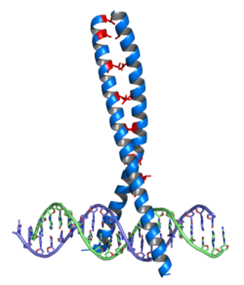
ロイシンジッパーとは何でしょうか?左図のロイシンジッパー(青)がDNAと結合している。赤で示したロイシン残基が二本の蛋白をつなぎ合わせるジッパーの働きをしているのでロイシンジッパーと言われロイシンがジッパーを閉める働きをしているのです。
ロイシンジッパーはタンパク質二量化ドメインとして機能する超二次構造であり、二本の平行αヘリックスの接着力を生みだして一本にしているのです。ヘリックスは「螺旋」の英語です。
ロイシンジッパーの構造上の特徴は、7残基の繰り返しの4番目の位置にアミノ酸のロイシンが配列することである。ロイシンジッパーは始めに、7残基おきに現れるロイシンで識別される転写因子の共通配列として同定され、これらのロイシンはコイルドコイルの疎水核を形成しているのです。
二本のロイシンジッパーの半分は短いαヘリックスからなっている。通常のαヘリックス1巻きが3.6残基となっているのに対し、ロイシンジッパーのαヘリックスの場合は1巻きあたり3.5残基となっている。ロイシンは2巻きごとにもう一方の鎖のロイシンと直接接触している。
bZip(ベーシックジッパープロテイン)と呼ばれる転写因子のファミリーは塩基領域を持ち、水素結合を介してこの部分がDNA分子の主溝と結合する。ロイシンジッパーの領域がこの二量化を担っているのです。
Fc 受容体様タンパク質 (FCRL / FCRH) は5 つの Ig スーパーファミリー メンバーからなるサブファミリーです。FCRLは、Fc受容体ホモログ(FCRH)とも呼ばれます。FCRL の遺伝子は、免疫グロブリン スーパーファミリー受容体転座関連 (IRTA) 遺伝子、SH-2 ドメイン含有ホスファターゼ アンカー タンパク質 (SPAP) 遺伝子としても同定されています。SH2(Src-homology 2) ドメインは、約100アミノ酸残基からなるモジュールで、特異的なリン酸化型チロシン (pY) ペプチドモチーフに結合します。(pY))のpはリン酸でありYはアミノ酸であるチロシンの一文字略語です。SH2(Src-homology 2) ドメインは、約100アミノ酸残基からなるモジュールで、特異的なリン酸化型チロシン (pY) ペプチドモチーフに結合します。アンカー タンパク質とは何でしょうか?細胞膜にあるべきタンパク質を細胞膜の正しい位置に繋ぎ留めておく機構であり代表としてはグリコシル‐ホスファチジル-イノシトール(glycosylphosphatidylinositol略してGPI)アンカーがあり細胞表面に存在する、様々な機能を持つタンパク質を細胞膜につなぎ止める錨(アンカー)の役割をしている糖脂質です。このような構造のタンパク質の一群をGPI(グリコシル‐ホスファチジル-イノシトールアンカー)型タンパク質と呼び、多くの遺伝子が関与する複雑な反応で作られます。それらの遺伝子の一つに 変異 があるとGPIアンカーが十分に作られないので重要な機能を持つタンパク質が膜表面に存在することが出来ず、分泌されたり細胞内で壊れたりしてしまいます。GPI(glycosylphosphatidylinositol)アンカーが十分に作られないとその結果、神経細胞の働きや内臓の形成過程に異常が起こり様々な症状がでます。
現在、不明とされている病気の原因はherpesが細胞のゲノムの塩基の並びを変えて遺伝子が正常に働かくなって生じた病気しかありません。現在のすべての病気の原因はherpesのなせる悪魔的な業なのです。善かれ悪しかれ生命のすべての現象は遺伝子が支配しているのです。原因が不明な症状や病気の原因はすべてヘルペスがDNAの塩基の並びを変えてしまったからです。
GPIアンカーとは(glycosyl-phosphatidyl-inositol) のことを頭文字をとってGPIアンカーと呼び、グリコシル‐ホスファチジル-イノシトールによってタンパク質のC末端に取り付けられる糖脂質である。イノシトールは、米ヌカ由来の糖アルコールの一種で母乳にも含まれるビタミン様物質(ビタミンB群)。GPIアンカーを含むタンパク質は、多種多様な生物学的過程において重要な役割を果たしている。GPIアンカーに繋ぎ止められるものには、酵素、受容体、免疫系タンパク質、認識抗原などがある。イノシトールとは、シクロヘキサンの各炭素上の水素原子が1つずつヒドロキシ基に置き換わった構造を持つ、シクリトールの1種である。シクリトール(Cyclitol)は、3つかそれ以上の環の原子のそれぞれにヒドロキシル基が付加したシクロアルカンである。広義にビタミンB群の1種とも言われており、ヒトの場合、糖尿病などが原因で体内でイノシトールが不足すると、神経症状が起こるなどの様々な症状がでます。イノシトールは糖アルコールの一種で、体内でグルコースから合成されるビタミン様物質です。
FCRL (Fc receptor-like)は、IgG、FccRI、FccRII、および FccRIII のFc 受容体と配列相同性を持っています。FcRH1-5 サブファミリーのメンバーは、免疫受容体チロシンベースの活性化モチーフ(immunoreceptor tyrosine-based activating motif ITAM)、阻害モチーフ (immunoreceptor tyrosine-based inhibitory motif ITIM)、またはその両方を有する受容体のネットワークに属します。それらの機能は、B 細胞の活性化コレセプターとして、B 細胞の活性化と分化を促進することです。コレセプターとは何でしょうか?B 細胞のリガンド(抗原)認識の促進や開始のため、主要な受容体に加えて補体のようなシグナル伝達分子が結合するB細胞表面受容体(レセプター)であり、共受容体、共同受容体、補助受容体などと訳される。リガンド(ligand)とは何でしょうか?特定の受容体(レセプター)に特異的に結合する物質で例えば抗体のレセプターに結合する抗原がリガンドとなります。リガンドは、受容体の中のある決まった部位(リガンド結合サイト)に特異的に結合する。
FCRL1(Fc receptor-like)タンパク質の発現はプレ B 細胞(B 細胞の前駆体)で始まり、ナイーブ B 細胞でピークレベルに達し、B 細胞が活性化されて胚中心を形成すると下方制御(抑制)されます。胚中心とはどこにありますか?胚中心(germinal centers )は二次リンパ系臓器(リンパ節、回腸パイエル板、脾臓など)の濾胞と呼ばれるB細胞領域内に形成される一過性の構造である。この FCRL1(Fc receptor-like)の下方制御は、前胚中心細胞の劇的な拡大、細胞周期の開始、および CD80 および CD86 の上方制御(活性)や免疫グロブリン D (IgD) 下方制御を含むその他の明白な活性化の兆候と同時に起こります。CD80はB細胞、CD86は単球や樹状細胞といった特異的な抗原提示細胞(antigen presenting cell;APC)上に発現し、T細胞上のCD28と結合する。FCRL1機能は、BCR 誘導性の活性化を増強する固有の活性化分子で補体もその一つです。BCRはB cell レセプターのことです。IgM型ナイーブB細胞は抗原に出会うと胚中心B細胞へ分化し、一部が抗体産生細胞に分化する。一方、IgG型メモリーB細胞は、抗体産生細胞へ迅速に大量に分化するのです。
さあー、ここからは何故、糸球体毛細血管の血流の中心に存在して血管の軸としての役割を果たしているメサンギウム細胞にヘルペスがどのようにして感染したかの説明となります。
Fcα/μR (FCAMR)は、IgM抗体およびIgA抗体が持つFc部分に対するFcレセプターであります。Fcα/μRは、脾臓にある大部分のB-リンパ球およびマクロファージ、二次リンパ組織の中心に構成的に発現されるFcレセプターであります。Fcα/μ受容体(Fcα/μR / FCAMR)は、IgAおよびIgMのFc受容体です。Fcα/μR / FCAMRはIg様ドメインに保存されたモチーフを持ち、IgAおよびIgMのFcに結合します。Ig様ドメインとは免疫グロブリン様ドメイン(Igドメイン)のことでありIgドメインを分子内に有する多種多様なタンパク質群を総称して、免疫グロブリンスーパーファミリー(Immunoglobulin superfamily略して IgSF)と呼びます。免疫反応において抗体分子(免疫グロブリン)のIgドメインが抗原の認識と結合を制御するように、多くのIgSF(Immunoglobulin superfamily)分子群はそれらのIgドメインを介して他の分子との接着や認識を行っている。IgSF分子群は神経系のみならず、免疫系や他の生体システムにおいても、細胞間の接着や認識などの重要な役割を担っている。多くのIgSF(Immunoglobulin superfamily)分子群は膜貫通領域あるいはGPIアンカー構造によって細胞形質膜に局在している。GPIアンカーとはグリコシルホスファチジルイノシトール のことをGPIアンカーと呼び、翻訳後修飾によってタンパク質のC末端に取り付けられる糖脂質である。神経系においてIgSF分子群は、細胞外マトリックスタンパク質群や他の細胞接着分子群などと結合して、軸索の伸長・標的領域へのガイダンス、樹状突起の形成、さらにはシナプス構造の形成・成熟・可塑的変化など、様々な神経発達過程に関与している。IgSF分子群の細胞内領域には多様な機能ドメイン(酵素活性ドメイン、特異的分子結合ドメインなど)が存在し、細胞外でのリガンド分子との結合情報を細胞内シグナルに変換する働きや、アクチンなどの細胞骨格系と相互作用して神経突起の形成を促進するはたらきを持っている。IgSF分子群はプラナリアからヒトに至るほとんどすべての動物種において存在し、最も多様な分子ファミリーの1つを形成している。プラナリア(Planarian Flatworm)は、扁形動物門有棒状体綱三岐腸目(さんきちょうもく)に属する動物の総称。モチーフとドメインの違いはモチーフとはタンパク質中で局所的に非常に良く保存されているアミノ酸配列のことであり、多くは機能と対応づけられている。 一方、タンパク質はその立体構造がいくつかの構造単位に分かれていることがあり、これらの構造単位をドメインとよび、アミノ酸配列上も類似性を示すものが多い。
Fcα/μR / FCAMR は、IgM やIgAに認識されたヘルペスウイルスなどの微生物病原体のエンドサイトーシスを媒介します。Fcα/μR / FCAMR は、食作用を刺激することによるヘルペスウイルスなどの微生物感染に対する防御や、抗原プロセシングおよびヘルパー T 細胞への提示にも関与しており、その結果、自然免疫応答から適応免疫応答への連鎖が生じるのです。
それではIgAと同じく IgMもメサンギウム細胞の持つFcレセプターはIgM抗体のFcフラグメント(部分)と結合するのになぜIgM腎症は起こらないのでしょうか?
血清 IgM(免疫グロブリン IgM クラス) は、人も含めて哺乳類において五量体として存在し、正常ヒト血清 Ig 含量の約 10% を占めます。じつはIgMの単量体もありますが血中には流れていません。それは、IgM は単量体として B リンパ球の細胞膜上に膜抗体として存在しているだけです。この形態では、B細胞抗原受容体がH鎖とともに細胞膜上に発現しており、それぞれには膜に固定するための付加的な疎水性ドメインが含まれます。
血清 IgM の各単量体は、ジスルフィド結合および結合 (J) 鎖によって互いに結合しています。IgMほとんどの抗原に対して最も優れた一次免疫応答を示し、最も効率的な補体固定能を持つ免疫グロブリンです。
五量体構造内の 5 つの各単量体は、2 つの軽鎖 (κ または λ) および 2 つの重鎖から構成されます。IgG (および上記の一般構造) とは異なり、IgM 単量体の重鎖は、1 つの可変領域と 4 つの定常領域(Fc領域)からなり立っています。IgM は侵入した微生物上のエピトープを認識し、B細胞凝集を生じさせます。エピトープ( epitope)とは、抗原決定基( antigenic determinant)とも呼ばれ、免疫系、特に抗体、B細胞、T細胞によって認識される抗原の一部である。抗体は、病原微生物や高分子物質などの抗原と結合する際、その全体を認識するわけではなく、抗原の比較的小さな特定の部分のみを認識して結合する。この抗体結合部位を抗原のエピトープと呼ぶびます。エピトープは病原体の抗原を認識できる最小単位である。その後、この抗体-抗原免疫複合体は、補体固定またはマクロファージによる受容体媒介エンドサイトーシスによって破壊されます。IgM は、最初に新生児で合成される免疫グロブリンクラスであります。免疫グロブリン M(IgM抗体)は、五つの抗体の中で3番目に多い血清 Ig抗体 です。次の 2 つのうち 1 つの形態を取ります。一つが全ての重鎖が同一であり、全ての軽鎖が同一である五量体であり、二つ目が単量体で 、B 細胞受容体として B リンパ球上に見られますが血清には存在しません。つまり分泌IgMは存在しないので、血中に流れている単量体のIgMはありません。大きな五量体構造では、連結可能な距離にある、より小さい IgM 抗体の分子上のエピトープ間で架橋が構築されています。抗体の架橋(Cross-link, クロス・リンク)とはB細胞(Fab)と抗原(エピトープ)が橋であるIgM抗体によって結合することです。IgM は、免疫応答の間に形成される最初の抗体です。理論上、その五量体構造には 10ヵ所の遊離抗原結合部位があり、高い結合活性を持つことから、IgM は凝集や細胞溶解反応が得意です。しかし10 個の Fab 部分の間には立体配座の制約があるため、IgM の抗体価は 5 価しかありません。また、IgM は IgG ほど汎用性がありません。しかしながら、書記官背に於いてIgM は補体活性化および凝集に極めて重要です。
IgM は主にリンパ液と血液中に見られ、疾患の初期段階における非常に効果的な中和剤です。中和剤とは侵入した病原体や毒素などの抗原に結合し、毒性を失わせて無力化することで中和作用とも言います。IgM レベルの上昇は、最近の感染または抗原への曝露の兆候をしめしています。IgMは初期の感染や新たな感染に対する免疫応答を示す重要な免疫グロブリンです。IgMは、体内に侵入した病原体に対して最初に産生される免疫グロブリンであり、感染初期の免疫応答を担当します。ヘルペスウイルスは乳幼児に家族から初感染を経験しています。しかも5量体IgM抗体は仮にメサンギウム細胞にまで運ばれてメサンギウム細胞のFcレセプターと5量体IgMのFc領域と結合しても大きすぎてメサンギウム細胞は取り込むことはできません。
抗体には5種類ありますがそれぞれの抗体には特性があります。人体に最も多いIgA抗体は人体の粘膜をherpesウイルスや細菌などの病原体から守ることです。IgA抗体には2種類ありIgA1抗体とIgA2抗体でIgA2抗体が2量体になって一番広い腸管の粘膜にいる病原体と免疫複合体になって大便として処理します。ところがIgA1抗体は単量体として血清に流れておりこのIgA1抗体がたまたまherpesと免疫複合体となり糸球体に流れ着いてメサンギウム細胞に取り込まれてしまったのですがIgA免疫複合体のherpesウイルスはリソソームで溶かし切れないで生き残りherpesはメサンギウム細胞に感染してしまいシミそこでherpesは増殖して長い時間かかって糸球体のあらゆる細胞に感染して腎不全となったのです。
なぜIgM腎症は起こらないのかという疑問はherpesを5量体IgM抗体のレセプターのFabで捕まえてIgM免疫複合体にして血液に運ばれて糸球体に流れ着いてメサンギウム細胞に感染できるかという問いになります。メサンギウム細胞膜にはIgM抗体のFc部分に対して結合できるFcレセプターがあるのでIgM免疫複合体がメサンギウム細胞に取り込まれます。つまりherpesとIgMとの免疫複合体が糸球体まで流れ着けばIgM腎症は起こります。しかしIgM腎症という言葉もないのでherpesと5量体IgMとの免疫複合体が糸球体まで流れ着くこともないことになります。それではherpesとIgMとの免疫複合体がメサンギウム細胞にまで流れてこないのでしょうか?一番大きな可能性はherpesとIgMとの免疫複合体のFc部分に貪食細胞や補体が結合して処理してしまっているので血中にはherpesとIgMとの免疫複合体は消滅してしまっているかどうかです。標準的なIgM抗体の大きな働きは三つあります。
①補体結合反応。補体は抗原抗体複合体に結合する性質がある。補体は抗原抗体複合体に結合する性質がある。「抗体の働きを補完する」という意味で、「補体」と名付けられた。 補体系ともいう。IgM抗体のFc部分に補体が結合すると補体は活性化すると、貪食細胞を呼び寄せ(細胞遊走)、貪食細胞を活性化させる働きがあります。補体についてはここを読んでください。
② 貪食細胞は、ヘルペス抗原と抗体が結合した免疫複合体のFc部分と結合することによっても活性化します。このように 補体や抗体が抗原に結合することによって、抗原が貪食細胞によって捕らえやすくなる現象を「オプソニン化(オプソニン効果)」と言います。貪食細胞の貪食作用を促進する物質を「おいしい味を付けてあげる」という古代ギリシャ語の意味で「オプソニン」と言うのです。
③抗体の中で一番最初に作られる初期感染性の抗体です。
すでに述べたのですが結論は血液内にあるIgM抗体は5量体IgM抗体しかないので大きすぎるherpesと結合した5量体IgM免疫複合体はメサンギウム細胞は取り込めないのでヘルペス感染が起こらないのでIgM腎炎は起こりえないのです。更にいえることは「IgA腎炎」は病気の原因から病名をつけると正しくは「ヘルペス性メサンギウム細胞感染症」です。
以上でFc受容体とIgM抗体(5量体IgM抗体)の詳しすぎた話は終わります。Fc受容体についてはIgA腎炎の専門家は興味を持っていないので研究家レベルの深い話をしました。研究家レベルの深い強をしたのでどうしてメサンギウム細胞のFcRにIgAのFc部分と結びつきやすいかを発見することが出来ました。それはメサンギウム細胞のFcRにIgAのFc部分と結びつくことが出来るからです。
すでにFCAMRについては説明をしたのですが研究家レベルのFCAMRについてもう一度見なおしましょう。FCAMRはFc Alpha And Mu Receptorの略で正しくは Fcα/μRと表記されます。FCAMR は、IgM および IgA に結合する Fc 受容体です。FCAMR は IgM に対して高い親和性を持ち、IgA に対しては中程度の親和性を持っています。FCAMRはB細胞、メサンギウム細胞、マクロファージ上で発現し、エンドサイトーシスとヘルペスウイルスのような微生物死滅の誘導を媒介します。従ってたまたま血中のヘルペスと結合した血中に流れているIgA1抗体はherpesとIgA1免疫複合体を形成してメサンギウム細胞に発見されてIgA1抗体のFcフラグメント(部分)にぴったり合うメサンギウム細胞のFcR(レセプター)で捕まえてIgA1免疫複合体のherpesを取り込んだのですがherpesを殺しきれなくなりherpesは合法体である巨大なメサンギウム細胞に感染増殖してしまいいつの間にか100万本もある糸球体の機能を障害して最後は糸球体を破壊しつくして透析となるのです。
Fcα/μR (FCAMR)について説明しましょう。
Fcα/μレセプター(Fcα/μR )は、IgM媒介性免疫防御に関与する可能性があるIgMおよびIgA(FCAMR)の新規Fcレセプターである。Fcα/μRは、遺伝子が第1染色体上のFc受容体遺伝子クラスター中の高分子免疫グロブリン受容体(poly-IgR)に密接に位置するFc受容体の新しく見つけられたのがIgA 抗体のFcのレセプターであるのです。このIgA 抗体のFcのレセプターをFcαRと表現するのです。FcμRは、IgM 抗体のFcのレセプターを示します。
Fcα/μR / FCAMR 転写物は、胸腺、脾臓、肝臓、腎臓、小腸、大腸、胎盤などのさまざまな造血組織および非造血組織で発現されます。転写物とはRNAポリメラーゼによって合成されたmRNAのことですから、Fcα/μR / FCAMR 転写物とIgA抗体とIgM抗体のFc部分と結合可能なFcレセプター蛋白を作れというmRNAによって胸腺、脾臓、肝臓、腎臓、小腸、大腸、胎盤などのさまざまな造血組織および非造血組織でIgA抗体とIgM抗体のFc部分と結合できるFcレセプター蛋白をもっている自然免疫細胞などの細胞が多く作られているということです。従って以上のような造血組織および非造血組織で簡単にヘルペスウイルス‐IgA抗体免疫複合体を処理できるのにもかかわらず処理できなかった数少ないヘルペスウイルス‐IgA抗体免疫複合体は糸球体メサンギウムまで流れ着いてメサンギウム細胞のIgA抗体のFcレセプターで捕まえられるという極めてまれ可能性が生じた結果、IgA腎炎に罹患してしまうのは患者さんにとってはとても不運なことだったのです。
Fcα/μR / FCAMRはIg様ドメインに保存されたモチーフを持ち、IgAおよびIgMのFcに結合します。Fcα/μR / FCAMR は、IgM やIgAのレセプターで捕獲されたヘルペスウイルスなどの微生物病原体のエンドサイトーシスを媒介します。ファゴサイトーシスではなくてエンドサイトーシスによってメサンギウム細胞は取り込むことになるのでメサンギウム細胞にある加水分解酵素が50種類以上もあるソソームと融合しにくいので取り込まれたヘルペスウイルスは生き延びてしまいます。しかもメサンギウム細胞は一個一個細胞膜を持った独立した細胞ではなく、一個の糸球体に連なって存在しているすべてのメサンギウム細胞は連続的にギャップ結合で巨大な合胞細胞になってしまっているのでメサンギウム細胞に取り込まれ、生き延びたherpesウイルスは細胞膜がなくギャップ結合だけで連続した巨大な一個の細胞になったメサンギウム細胞に連続的に感染して免疫が下がった時には好きなだけウイルスビリオンを増殖させて周辺のメサンギウム基質や更に内皮細胞、基底膜細胞、上皮細胞と次々に感染していくのです。ヘルペスはあらゆる細胞に感染できるのであらゆる病原体の中で最も感染力が強いウイルスなのです。合胞細胞体は隣接する細胞の細胞膜を融合させ多核の巨細胞様の巨大な一個の細胞体構造物を形成し、これを合胞体またはシンシチウム(syncytium, pl. syncytia)とい言います。合胞体とシンシチウム(syncytium, 複数形は. syncytia)の違いは何でしょうか?多核巨細胞(シンチチウム)はRSウイルスが産生する融合蛋白質によって複数の感染細胞が融合して形成されたもので、合胞体あるいは合胞体性多核巨細胞とも呼ばれる。 好酸性細胞質内封入体を伴った多核巨細胞の出現は本病の特徴病変であり、病理診断指標となる。 主として多核巨細胞化した細気管支上皮細胞にRSウイルス抗原が観察される。一方合胞体とは一般的には,複数の核をもつ細胞のこと. 核が分裂する一方で細胞質が分裂しない(不完全分裂)ために生じる場合と,細胞同士が融合した結果生じる場合とがある.
Fcα/μR / FCAMR は、食作用を刺激することによる微生物感染に対する防御や、抗原プロセシングおよびヘルパー T 細胞への抗原の提示にも関与しており、その結果、自然免疫応答から適応免疫応答への連鎖が生じてすべての病原体を処理できるのですが特異な殺しきれないヘルペスウイルスだけには100%無力なのがひとの自然免疫であり適応免疫なのです。だからこそ生き延び続けるヘルペスウイルスは最後の最後は癌を作り人と一緒に滅びてしまうのです。
herpesを殺しきれなくてherpes感染症が始まっただけでメサンギウム細胞がヘルペスとの感染で傷ついても溶解感染を起こしてメサンギウム細胞が壊死してもかならずメサンギウム細胞増殖と再生が可能であり、かつ輸入細動脈からはじまる一本の糸球体血管は末梢端の輸出細動脈に至るまでの巨大な合法体になった一本の血管の軸となったメサンギウム細胞構造の修復も可能ですからメサンギウム細胞自身の問題でIgA腎症が起こったのではなく癌をも簡単に作れるヘルペスがたまたまメサンギウム細胞体に感染したからです。IgA抗体免疫複合体に運ばれてきたherpesがメサンギウム細胞に感染してIgA抗体免疫複合体から離れたヘルペスがメサンギウム細胞で分裂増殖していつも存在している近隣の糸球体内皮細胞,糸球体基底膜,足細胞(糸球体上皮細胞)の糸球体濾過を直接行う三つの重要な糸球体細胞要素に感染して障害を与えていきます。つまりメサンギウム細胞に感染したherpesが正常な糸球体ろ過装置の濾過機能を障害してしまって徐々にIgA腎症へと進行してしまっただけです。何故ならば糸球体内皮細胞,糸球体基底膜,足細胞(糸球体上皮細胞)の三つの濾過細胞は血管支持細胞である骨髄由来のメサンギウム細胞のように細胞増殖と再生と細胞構造の修復ができないので糸球体の構造を維持できなくなるのです。この三つの濾過細胞はあくまでも「血液の濾過」に特化したいわば普通の幹細胞を持たない細胞であるから修復もできずにヘルペスによる溶解感染に対して対抗もできずに崩壊していくのを眺めるだけであらゆる細胞に感染できるずる賢いherpesには手をだせないのです。
メサンギウム細胞は骨髄幹細胞由来の細胞ですから白血球の持っている免疫の力を少しは持っていますが免疫機能に特化したプロの免疫細胞ではないので取り込んだヘルペスが糸球体に流れつくとは思いもよらなかったのです。感染したherpesが増殖しだしたら本格的なヘルペスの戦いは自然免疫の王者であるマクロファージに任しているのです。より高等な獲得免疫で働くリンパ球であるT細胞やB細胞は二次リンパ組織でもない糸球体では必要ではないのです。何故ならばIgA腎症を起こすのはherpesですからherpesを認識するのに必要なのは抗原提示細胞(APC)であり適応免疫のリンパ球ではないのです。しかも他のIgGによる腎炎も存在しているのですがIgG抗体のFc部分にメサンギウム細胞のFcレセプターは結合できないのでメサンギウム細胞にエンドサイトーシスで取り込まれることはできないのでヘルペスが感染することもできないのです。更にIgA腎炎を起こすのはherpesウイルスである事は分かっているので敵であるヘルペスの特異的な抗原を判別して認識する獲得免疫関連の免疫細胞始め様々なサイトカインも必要ないのです。
メサンギウム領域に炎症が全くない生理的条件下でもメサンギウム領域のメサンギウム細胞やメサンギウム基質の新陳代謝のためのみならず、血液に侵入してきた病原体から糸球体血管細胞を守るために骨髄由来細胞であるメサンギウム細胞が存在しているのです。メサンギウム細胞が持っているFcレセプター(受容体)はあらゆる抗体のFc フラグメント(部分)に結合できるのではなくIgMかIgAのFc フラグメント(部分)だけなのです。好中球や大食細胞が持っている貪食能を,もち合わせていますがファゴサイトーシスではなくエンドサイトーシスで貪食するのでヘルペスを融解できるリソソームと融合できにくいので取り込んだherpesをリソソームの加水分解酵素で融解して殺すこともできないのです。
しかもメサンギウム細胞は元来糸球体血管の軸になる役割を果たしているにもかかわらず一本の糸球体血管の中心にある一本に連なった巨大な合胞細胞であるので糸球体全構成細胞数の30~40%をも占めているのですがその中で貪食細胞の性格を持つメサンギウム細胞は5~15%なのですから糸球体全構成細胞数ほんのわずかで約 2 %~3%に過ぎないのです。こんなわずかな貪食作用を持っているメサンギウム細胞だけで糸球体を守るために人類に最後に残された世界一恐ろしい全ての病気の原因となってしまったヘルペスvirusに対抗できるわけは無いのです。
メサンギウム細胞には機能の異なった二種類のタイプがあります。一つは糸球体の支持細胞の役割を持つものと、もう一つは少ない数なのですがIgA抗体が持っているFc部分と結合できるFcレセプターを持っているメサンギウム細胞です。このFcレセプターを持っているメサンギウム細胞はFcレセプターを持った数多くの自然免疫細胞や適応免疫細胞であるBリンパ球などのFcレセプターと結合して食作用でとりこんでしまうのです。ヘルペスを運んでくる免疫複合体がIgGであれば簡単に処理できてしまうのですが、herpesがIgA免疫複合体で運ばれてくると敵が血清の単量体であるIgA1であると状況が異なるのです。それでもIgGで運ばれてきたherpesの処理に困ってIgA腎炎でないIgG腎炎が起こることがあるのです。何故ならば敵が殺しきれない上にワクチンが効かず遺伝子のゲノムに隠れてしまうからです。
現代のすべての病気の原因は人間の免疫よりもはるかに勝った天才herpesしかいないのです。ロイアル・レイモンド・ライフ博士が見つけて治したすべての癌の原因は癌ウイルスであるヘルペスウイルスなのです。60億個のからできた遺伝子の塩基からできた細胞の23本の二倍体の染色体に細胞が二分裂する際に遺伝子の複製が必要ですから二倍体の染色体をして一倍体の46本の染色体になったゲノムに、herpesは自分の15万個の塩基でできたゲノムを細胞分裂に際して一倍体の46本の染色体にならざるを得ないのでこのチャンスに自分のゲノムを相同組み換えや部位特異的組み換えのいずれかを利用して宿主のDNAに入れ込んでしまうのです。組み込んでしまうのです。何故ならば人の細胞が増殖・分裂する時に必要な時間はherpesウイルスが二倍になる時間の何十倍もかかってしまうのでherpesウイルスは何十倍も何百倍もヘルペスビリオンを増やすことができるチャンスを利用するのです。このようにherpes感染細胞が分裂する時に宿主細胞の遺伝子が一倍体の46本になった時に一倍体46本の遺伝子にアット・ランダムに自分の遺伝子を組み込んで遺伝子の相同組み換えや部位特異的組み換えによって遺伝子の形質転換を起こし癌を作る現がん遺伝子を癌遺伝子に変えて癌を作る癌蛋白を作ることにもなるどころかあらゆる遺伝子の突然変異を起こす可能性を高めてげんいんふめいとされているけれども遺伝子が異常になったと分かっている後天的な遺伝子病を作ってしまうのですが世界中のお偉い医学者は絶対に認めないのです。herpesが感染細胞に潜伏感染する部位は細胞のゲノムの遺伝子です。ゲノムの遺伝子に入りこむときの必然的に細胞のゲノムの「DNA組み換え」をやらざるを得ないのです。言い換えると癌現遺伝子を癌遺伝子に突然変異を起こすのは特別な遺伝子を作ることではなく単に自然に「DNA組み換え」が起こり「DNA組み換え」がおこったDNAの部位に「癌関連遺伝子」が偶然にあったというだけのことです。
癌のみならず自己免疫疾患で遺伝子異常が見つけられているものはヘルペスが自分の遺伝子を組み込んで細胞の遺伝子の形質転換を起こし遺伝子の突然変異を起こしたためです。癌ウイルスについてはロイアル・レイモンド・ライフ博士のここを読んでください。ヘルペスについてはここを読んでください。
IgA腎炎の原因もヘルペスであるので抗ヘルペス剤ですべて治るのにステロイドを使うと免疫が落下してしまいherpesが増えるだけですからIgA腎炎の原因であるヘルペスが増えるだけですからIgA腎炎は悪化するだけで最後は腎透析を早めるだけなのです。いかなる病気も原因をすべて除去しない限りあらゆる病気は絶対に治らないことを世界中の医者の誰一人気も付いていないのです。残念です。私はIgA腎炎や他の腎炎を抗ヘルペス剤で何人か完治させたことがあるので100%自信を持ってIgA腎炎をはじめとする全ての糸球体腎炎はherpesであると言い切れるのです。今、書いている論文はすべての腎炎の原因はherpesであるという理論を免疫学を駆使して展開しているのです。いやすべての現代病の原因はヘルペスが絡んでいることを理論的に証明するために78歳のくそ爺になっても病気の真実を知りたいために勉強を続けているのです。15歳から63年間も苦しみ誰も直せなかったどころか診断さえできなかった自分の病気の原因はヘルペスであることをじぶんで発見できたのも自殺を止めて三つ目の大学である京都府立医科大学に進んだのですがどの診療科の教授たちもわたしのあらゆる症状はヘルペスと免疫が戦っていることも知りませんでした。いまも私の右目が視覚ゼロになった原因もherpesであることを知りません。いや知っているのですが認めてしまうとすべての最後に残された病気の原因は誰もがかかっているherpesであることがばれてしまうので大学の医学部の学生には教えないからです。ちょうど現代のあらゆる犯罪をはじめとするすべての諸悪の根源は資本主義体制が人間よりも金が大事である社会システムであるにもかかわらず口にしないのと同じです。アッハッハ!!!
因みに腎癌と言われる腎臓にできる癌の殆どが尿細管癌であり糸球体癌がないのは皮肉な話になりますがメサンギウム細胞が頑張って腎炎で癌になるべき細胞が糸球体腎炎となって壊れてしまうからなのです。尿細管癌の原因もやはり尿細管の細胞に感染したヘルペスであるのは言うまでもないことです。
糸球体傷害が起こると,骨髄由来細胞が動員されメサンギウム細胞になります。糸球体内にリクルートされた骨髄由来細胞は,生来のメサンギウム細胞と同様,血管作動物質アンジオテンシンⅡの作用により収縮反応を示します。この骨髄由来のメサンギウム細胞にもさまざまなホルモン,成長因子,血管作動性因子および細胞外基質の受容体が発現しており,メサンギウム細胞の形態維持,機能制御に重要な役割を担っています。
メサンギウム細胞が発現している種々の受容体には何がありどのような作用が生まれるのでしょうか?①メサンギウム細胞を増殖させる因子であるPDGF,TGF-βに対する受容体②メサンギウム細胞にherpesが感染した時に対抗できる炎症を高める炎症因子であるサイトカインであるTNF-α,各種 interleukinに対する受容体③メサンギウム細胞を血管内を遊走させやすくするための血管作動性物質であるangiotensin Ⅱ,endothelinに対する受容体があります。PDGF とはなんでしょうか?PDGFは血小板中に存在し, 主として間葉系細胞に対し増殖・遊走刺激活性を有する因子でメサンギウム細胞はまさに間葉系細胞なのです。TGF-βとは何でしょうか? 細胞増殖・分化を制御し、細胞死を促すことが知られているサイトカイン(細胞の働きを調節する分泌性蛋白の一種)です。哺乳類においてそのファミリー分子は約40種類報告されており、TGF-βスーパーファミリーを構成しています。TGF-βスーパーファミリーは、細胞の増殖・分化を制御し、生体の恒常性を維持する重要なサイトカインの一つで、その異常が様々な病気の進展に関っています。エンドセリン(Endothelin)とは何でしょうか?血管内皮細胞由来のペプチドで、強力な血管収縮作用を有するオータコイドの一種である。オータコイドとはヒスタミン、セロトニン、エイコサノイド(プロスタグランジンなど)、アンジオテンシン、ブラジキニン、エンドセリン、一酸化窒素(NO)などの生理・薬理作用を示す生理活性物質のうち、ホルモン(特定の器官で分泌され体液で輸送されて他の器官に作用する)および神経伝達物質(シナプスでの情報伝達に与る)以外のものの総称です。 オータコイドは、身体に異常が加わったとき、それに対処するように動員され、これが動員されること自体で新たな病態を生じることがあります。TGF-βとTNF-αと混同しないで下さい。TNF-αは侵襲時に最もすみやかに分泌される代表的な最も強力な炎症性サイトカインであり炎症を増強する作用がある.TNF-αはtumor necrosis factor-αの略で 腫瘍壊死因子と訳します。
一方TGF-βもサイトカインですがTGF-βは細胞外マトリッ クスタンパク質の産生やプロテアーゼ阻害剤の産生を促進したり,逆にプロテアーゼの産生を阻害するなど多彩な逆の生理活性を有し,血管新生,動脈硬化,癌,線維化,免疫抑制,発生などさまざまな疾病や生理現象に深く関わっている多機能性サイトカインである。TGF-β の作用は複雑でがんの進行にとっては時には悪玉タンパク質となり、時には善玉タンパク質となります。TGF-βはβ 型トランスフォーミング増殖因子の略です。
メサンギウム細胞が発現している細胞外基質に対する受容体には各種基質成分に対する受容体を発現している。基質とは、化学反応において他の物質と反応して生成物を作る化学種の1つである。特にβ1 integrin およびαvβ3 integrin は細胞と細胞外基質の相互作用において主要な分子である。メサンギウム細胞外の基質成分はメサンギウム細胞表面の基質受容体を介してメサンギウム細胞の phenotype(遺伝子の表現型),細胞増殖,遊走などを制御しているのです。メサンギウム細胞は大食細胞と同じように食作用に加えて遊走できるので免疫の働きを持っているのです。メサンギウム細胞は糸球体の唯一の住民となっている免疫細胞なのです。遊走または細胞遊走とは、細胞などが個体内のある位置から別の位置に移動することを指し、多細胞生物の発生と維持における中心的過程であり、胚発生、創傷治癒および白血球が免疫応答時には全て、細胞が特定の方向や場所へ協調的に移動することができるのです。メサンギウム細胞も既に述べたように糸球体傷害が起こると,骨髄由来の白血球の前駆細胞が動員され遊走して糸球体まで流れ着いてメサンギウム細胞にまで分化したのです。メサンギウム細胞を詳しく知れば知るほど免疫細胞の仲間と思わざるを得ないのです。
メサンギウム細胞は血糖と結びついてグルコース輸送細胞(Glucose transporter)の役割も果たしているのです。メサンギウム細胞は 2 種類のグルコース・トランス・ポーター,すなわち facilitative and sodium-coupled transporters および brain type glucose transporter(GLUT-1)を発現している。GLUT-1 の発現レベルはメサンギウム細胞の細胞外基質産生と関連していて,外基質産生亢進によりherpesの感染によって傷ついた糸球体の再構築を図る修復機転なのです。糖尿病状態における免疫低下を細胞外グルコースの細胞内取り込みで免役活動のエネルギーをつくりだしているのです。
本来、GLUT-1とはグルットワンと読みグルコース・トランスポーター1の略で脳の毛細血管内皮細胞に存在し、血中のグルコースを脳内に輸送する蛋白質(輸送体タンパク質)です。GLUT1は、全身の臓器にも発現しており、細胞内グルコース濃度の調節を行っているのです。因みに、ヒトにおいては、赤血球に最も多く、また血液脳関門の上皮細胞にも存在しています。
グルコース輸送体(Glucose Transporters)とは何でしょうか? ブドウ糖(glucose)は動力を供給するエネルギーとなる。私たちが食べたブドウ糖は解糖系(glycolysis)を通して分解され、細胞で行われるさまざまな活動の動力源として利用される。そのため、各細胞に対しブドウ糖を安定的に供給し続けることが不可欠である。ブドウ糖は血液によって体中の細胞に運ばれ、細胞はグルコース輸送体(glucose transporter)を使って必要なグルコースを集めます。
グルコース輸送体は細胞膜を通るブドウ糖の流れを管理しているのです。2つの状態を繰り返しながら細胞膜を通るブドウ糖の流れを管理しているのです。まず最初に、細胞の外側に向かって開き、ブドウ糖分子を血液から取り込む。次に、細胞の内側が開いた形に変化し、細胞内にブドウ糖分子を放出する。しかしグルコース輸送体は自発的に働いているのではないのです。何故なら、ブドウ糖は細胞質にあるヘキソキナーゼ(hexokinase)によって速やかにリン酸化されるので、血液中の方が高濃度となりその濃度差を使って細胞外から細胞内に輸送ができるからである。ヘキソキナーゼ(hexokinase)は、D-グルコース、D-マンノース、D-フルクトースなどのヘキソース(六単糖)をリン酸化するキナーゼの一種であり、ヘキソキナーゼはATPの末端のリン酸基を一般のヘキソースのヒドロキシル基に転移させる。ヘキソキナーゼはすべての生物のすべての細胞に存在する。
ヒトのゲノムには似たグルコース輸送体が14種類コードされていて、ブドウ糖やその他の糖をそれぞれ異なる種類の細胞に運びます。
GLUT1は基底状態におけるブドウ糖の取り込みを管理していて、赤血球では極めて一般的に見られるタンパク質である。基底状態とは原子・分子などのもつエネルギーが最も低く安定した状態で、電子が最もエネルギーの低い軌道にある標準状態です。
GLUT2は肝臓細胞でブドウ糖の出入りを制御しています。また、膵臓のインスリン(insulin)を作るβ細胞における血中ブドウ糖濃度の監視にも使われ、血中ブドウ糖濃度が上がったことを検知するとインスリン(insulin)が放出されます。
GLUT3は脳内の神経細胞は常にブドウ糖を必要とするので、ブドウ糖濃度が低くてもよく機能する型のGLUT3が使われています。
GLUT4はインスリンによって活性化され、食後に脂肪細胞や筋肉細胞がブドウ糖を集めるのに使われます。
糖尿病の合併症はどうして起こるのでしょうか?糖尿病でない正常な人が食事をすると、すぐにインスリンが膵臓から血中に放出され、ブドウ糖が使える状態になったことを各細胞に伝えます。この放出されたインシュリンに反応して、脂肪細胞や筋肉細胞は多数のGLUT4輸送体を細胞膜へと移動させ、ブドウ糖が豊富にある間は備蓄用としてかき集めます。ところが、2型糖尿病(type II diabetes)患者の場合、インスリンを作る能力の低下とイインシュリンが作用する細胞でインシュリンに対する応答が低下するという両方でインスリンの作用に抵抗性を持つようになってしまう。この結果、食後の筋肉細胞においてGLUT4の細胞膜への移動が減り、ブドウ糖を血液から取り込む量が少なくなってしまう。そして血中のブドウ糖濃度が急激に上昇してしまいます。なぜなら通常は骨格筋が多くのブドウ糖を消費するからである。
GLUTファミリーはより大きな輸送体グループの一部であり、まとめて主要促進剤スーパーファミリー(major facilitator superfamily、MFS)と呼ばれています。この主要促進剤スーパーファミリーに属する各分子には、細胞膜を越えて内外に揺れ動く2つのドメインを持つという共通のしくみがある。ところが、異なる2つの分子を連携させて運ぶ輸送体の多くは、一方の分子の大きな濃度差を使ってもう一方の分子の輸送の動力源としているのです。
GLUT5はフルクトース輸送体(fructose transporter)です。フルクトースは六単糖で果糖のことです。
血圧を制御しているレニン・アンギオテンシン・アルドステロン系は英語でRenin-angiotensin-aldosterone系で略してRAA系です。レニン・アンギオテンシン・アルドステロン系とは何でしょうか?
血圧の制御を行うレニン-アンジオテンシン-アルドステロン系の図
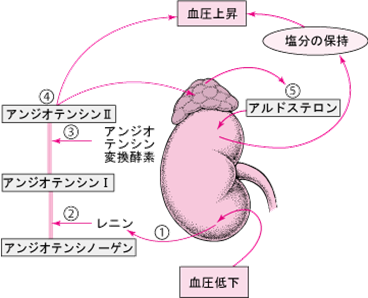
レニン-アンジオテンシン-アルドステロン系の概略を説明しましょう。レニン-アンジオテンシン-アルドステロン系は、血圧を調整するための一連の反応です。収縮期血圧が100mmHg以下に低下すると、腎臓の傍糸球体細胞からレニンという酵素が血液中に分泌されます。
レニンは、血流中を循環している大きなタンパク質、アンジオテンシノーゲンを分解します。分解されたタンパク質の1つはアンジオテンシンIといいます。
アンジオテンシンIは比較的活性が低く、アンジオテンシン変換酵素(angiotensin converting enzyme略してACE)によって分解されます。アンジオテンシンIが分解されて、非常に活性の高いアンジオテンシンIIというホルモンができます。
アンジオテンシンIIは、平滑筋という筋肉でできた細動脈の壁を収縮させることにより、血圧を上昇させます。またアンジオテンシンIIは、副腎を刺激してアルドステロンというホルモンを分泌させ、また下垂体を激してバソプレシン(抗利尿ホルモン)を分泌させます。
アルドステロンおよびバソプレシンにより腎臓はナトリウム(塩分)を保持します。アルドステロンは、腎臓に作用してカリウムも排出させます。ナトリウムの上昇は水分を貯留させるため、血液量が増加して血圧が上昇します。バソプレシンは尿量を少なくする作用を有するホルモンなので、抗利尿ホルモン(Antidiuretic Hormone, ADH)とも呼ばれます。 血液中のバソプレシンが少なくなると尿量が増加し、逆にバソプレシンが増加すると尿量が減少します。アルドステロン は、副腎皮質の球状帯から分泌されるホルモンである。鉱質コルチコイドの一種です。
Renin-angiotensin-aldosterone(RAA)系についてもう少し詳しく説明しましょう。
RAA系に関するAngiotensin Ⅱ受容体がメサンギウム細胞に存在しています。何故糸球体毛細血管の支持組織に過ぎないメサンギウム細胞は血圧の制御に関わっているのでしょうか?メサンギウム細胞には少量の細胞小器官以外に毛細血管の柔軟性を維持するための豊富なアクチン線維線維の束、ミクロフィラメント構造、のみならずミオシン、トロポミオシンなどの収縮関連の機能蛋白を持っています。糸球体の毛細血管と繋がっているメサンギウム細胞は収縮関連の機能蛋白で毛細血管の収縮にも関わり血圧に影響を及ぼしているのです。
angiotensin Ⅱの受容体にはⅠa とⅠbの二つがあり,メサンギウム細胞の収縮およびメサンギウム細胞外基質産生に関わっています。Renin-angiotensin-aldosterone(RAA)系とは何でしょうか?レニン-アンジオテンシン-アルドステロン(RAA)系と読み血圧や体液量、血清電解質の調節に関わる、内分泌系の調節機構の1つである。血中のNa濃度の変化や体液量の減少、カテコラミン刺激に応じて、腎臓の傍糸球体細胞からレニンが分泌される。レニンによって、アンジオテンシノーゲンから、10個のアミノ酸よりなるアンジオテンシンⅠ(AⅠ)が生成される。このアンジオテンシンⅠはACE(アンジオテンシン変換酵素)の作用により、アンジオテンシンⅡ(AⅡ)となる。アンジオテンシンⅡは、その特異的受容体であるアンジオテンシンII受容体(ATR)は、血圧の調節において重要な役割を担うGタンパク質共役受容体(GPCR)です。 ATRには、血圧を上げる1型受容体(AT1R)と血圧を下げる2型受容体(AT2R)の二つの受容体が存在しています。 血圧は、これらの二つの受容体が協力し合うことで調節されます。さらにアンジオテンシンⅡは副腎皮質球状層に作用して、アルドステロンの分泌を促進します。アルドステロンは鉱質コルチコイドの1つで、腎臓の遠位尿細管などに作用し、Na貯留を通じて循環血液量を増加させ、結果的に血圧を上昇させる。一方、循環血液量の増加による血圧の上昇は、腎臓の細動脈の圧受容体に感知され、このシグナルが傍糸球体細胞に伝わることにより、レニン分泌は抑制される。これがネガティブフィードバック機構である。
メサンギウム細胞にはRenin/prorenin 受容体(レニン・プロレニンの受容体)も存在し,細胞表面の renin/prorenin の cofactor(補助因子)として,renin および prorenin の酵素活性による angiotensinogenの分解作用を促進する一方で,レニンはこの受容体を介してメサンギウムにおける TGF-βの発現を誘導し,PAI-1,fibronectin,collagenⅠなどの発現を促進します。
何故メサンギウム細胞には血圧にかかわるRenin/prorenin 受容体(レニン・プロレニンの受容体)も存在しているのでしょうか?詳しくは後述しますが結論から言うと「糸球体毛細血管のど真ん中にあってこの毛細血管を構成している血管内皮細胞と血管基底膜細胞と血管上皮細胞を構造的に支える役割に加えて血液と接触している収縮できる機能を持っているメサンギウム細胞が血圧を制御するのは当然のことなのです。
Cofactor(補助因子)とは何でしょうか?補因子(cofactor)とも呼ばれる補助因子は、酵素の活性(反応)に必要なタンパク質以外の物質のことです。 補助因子は3つのグループがあり、①補酵素、②補欠分子属、③金属に分けることができる。補酵素はタンパク質ではないので注意が必要です。補因子とは、酵素の触媒活性に必要なタンパク質以外の化学物質である。 補因子は「補助分子、またはイオン」であると考えられ、生化学的な変化を助けている。酵素に固く結合したとき、補因子は補欠分子族と呼ばれる。 一方、緩く結合した補因子は基質と同じように結びつくので、 これらは 補酵素 と表現され、基質として酵素反応に直接参加する有機物質である。補酵素は酵素が反応を触媒するのに必要な低分子の有機化合物です。同じく低分子でも補酵素と呼ばれないものは、金属イオン補因子です。マンガンや亜鉛などと言った金属イオンも酵素反応を進行させるのに必要な低分子として重要です。
補酵素があるおかげで機能を発揮できる酵素がたくさんあります。このように補酵素を必要とする酵素をアポ酵素といってアポ酵素と補酵素が結合した状態を「ホロ酵素」といいます。酵素に組み込まれた形で存在する補酵素も存在し、「ビルトイン酵素」と呼ばれます。ビルトイン(built-in)とは、内蔵(の)、組み込み(の)、作り付け(の)、生来の、固有の、などの意味を持つ英語です。
糸球体正常構造の維持はどのようにされているのでしょうか?細胞収縮・弛緩による糸球体の血行動態調節にはメサンギウム細胞の収縮能が関与しています。血管細胞壁である血管係蹄の支持構造の軸はメサンギウムです。糸球体における蛋白や赤血球などの巨大マクロ分子の主要な障壁は糸球体基底膜とスリット膜を備える足細胞であり,この両層が糸球体係蹄(糸球体血管壁)全体を外から包み込んでいる。糸球体基底膜は糸球体血管壁の外にあります。糸球体毛細血管とメサンギウムの間には効果的な障壁がなく,毛細血管内腔とメサンギウム基質にはほぼ等しい高い内圧がかかっています。この内圧は,係蹄壁(血管壁)を外向きに膨張させるように働く。メサンギウム細胞はアクチン線維束をもつ細胞突起部位で,糸球体基底膜と強く結合して(この部位をメサンギウム角と呼んでいる)この膨張力に対抗し,糸球体基底膜を内向きに牽引して糸球体係蹄(糸球体血管壁)の形態を保持しているのがメサンギウム角なのです。
メサンギウム細胞外基質の turn-over(合成と分解に)が、どのように行われているのでしょうか? メサンギウム細胞はⅣ型コラーゲン,フィブロネクチン,ラミニン,糖タンパクであるプロテオグリカンなどから成るメサンギウム細胞の外にある基質(メサンギウム基質とかメサンギウム細胞外基質とも言われます。)に囲まれています。フィブロネクチン(Fibronectin、略して FN、Fn、fn、FN1)とは、巨大な糖タンパク質で、細胞接着分子である。ラミニン(laminin)とは、細胞外マトリックスの基底膜を構成する巨大なタンパク質である。多細胞体制・組織構築とその維持、細胞接着、細胞移動、細胞増殖を促進し、がん細胞と関係が深いタンパク質です。メサンギウム細胞はこのメサンギウム基質の分解酵素であるメタロプロテアーゼとその酵素活性を阻害する因子(tissue inhibitor of metalloproteinase:TIMP)を産生していて,両者によりメサンギウム基質の合成と分解のバランスをとっています。
細胞外マトリックスとは何でしょうか?メサンギウム細胞外基質とは何でしょうか?
多細胞から成り立っている人間では体の中にある細胞にとっては細胞の外という空間が生じます。その細胞外空間にある物質が細胞外マトリックス(細胞外基質)と言われるたんぱく質や多糖たんぱく質や多糖などの物質なのです。「マトリックス」は「基質」と訳します。この細胞外マトリックス( Extracellular matrix略 ECM)(細胞外基質)と言う物質は細胞が自ら作り出し細胞外に分泌したものなのです。つまりメサンギウム細胞が作って分泌したのがメサンギウム細胞外基質なのです。しかも細胞を隣の細胞や細胞外マトリックス( Extracellular matrix略 ECM)にくっつけるために細胞接着分子(cell adhesion molecules)が付着しているのです。結合組織と細胞外マトリックスとの違いは何でしょうか?結合組織も細胞外マトリックスそのものであるのですが線維芽細胞と言われる細胞以外にはほとんど細胞が存在していない細胞外マトリックスなのです。従って糸球体毛細血管の支持組織であるメサンギウム細胞とメサンギウム基質(メサンギウム細胞外基質)は結合組織と言ってもよいのです。
細胞外マトリックスは体の中では結合組織に大量に存在しますが因みに組織と組織の間にある基底層も特殊化した細胞外マトリックスなのです。基底層とは、薄い膜となって表皮の下にある真皮と接合している層です。 たがいに絡み合うように波形を描き、真皮から毛細血管を通じて栄養を吸い上げながら細胞分裂を繰り返し、新しい皮膚を生成しています。基底層の役割は基底層には「メラノサイト(色素細胞)」があり、紫外線から体を守る色素「メラニン」を合成します。触覚に関係する細胞や、免疫細胞もあります。
細胞外マトリックスを構成する物質はその性質と役割から三タイプに分けられます。
一つ目はECMの構造の強度の基盤になる線維やシートを形成する「コラーゲン」を中心とするタンパク質です。「弾力」のもとになる「エラスタチン」があります。コラーゲンにはⅠ型から始まる27種類以上もあります。
二つ目はECMに保水性を高めて潤いと柔軟性を与えるプロテオグルカンと言う糖タンパク質です。このプルテオグルカンはグリコサミノグリカンから作られる糖タンパクですがプロテオグルカンには糖が多い糖タンパクです。
三つめは細胞と細胞マトリックスをくっつける役割があるフイブロネクチンやラミニンです。フイブロネクチンやラミニンがあります。フイブロネクチンは細胞の表面にある細胞接着分子であるインテグリンを介して細胞に結合する。ラミニンは表皮組織と真皮組織とを接合している層である基底層と細胞をくっつけます。
メサンギウム細胞はherpesに感染すると各種の炎症性のサイトカインや炎症性因子の他に血管作動性物質を産生します。この血管作動性物質の主な作用は,血管平滑筋またはその他の機構を,緊張または弛緩し,血管径を縮小または拡大して,血管抵抗を変動することができるのです。メサンギウム細胞増殖およびメサンギウム細胞外基質合成に関与する PDGF と TGF-βのレセプターも持っており増殖因子であるPDGF と TGF-βと結合するとメサンギウム細胞増殖とメサンギウム細胞外基質の合成を開始し始めます。メサンギウム細胞外基質は細胞外マトリックスと言われメサンギウム細胞が合成するのです。
さらにへルペスとの戦いで生ずる炎症など病的な状態では,メサンギウム細胞は TNF-α,IL-1,6,8,10 などのサイトカインを分泌する。また,血管作動性物質であるレニン,endothelin,一酸化窒素,prostaglandins,thromboxanes,superoxide anion (超酸化物)なども産生する。superoxide anion (超酸化物)とは活性酸素の一で、 酸素分子が電子1個を取り入れた陰イオン 高い反応性を有する。 生体内では水素イオンと結びつき、過酸化水素が生成され、免疫系においてその毒性により強い殺菌作用を示す。これらメサンギウム細胞から産生される因子は,糸球体微小循環機能を含めた糸球体機能の維持,さらにはherpesによる各種糸球体障害の発症,進展および修復の過程で重要な役割を果たしている。IL-1とは何でしょうか? IL-1および IL-1受容体(IL-1R)スーパーファミリーは,11種のサイトカイン(IL-1,IL-18,IL-33,IL-37,IL-38 等)と10 種の受容体より構成され,自然免疫と呼ばれる炎症性および宿主防御特性を担い,非特異性を特徴とする。IL- 5とは何でしょうか?好酸球の分化、成熟、アレルギー性の炎症に関わる液性免疫を制御するTh2サイトカインである。IgA産生促進も行います。IL- 6とは何でしょうか?炎症性サイトカインの一種で、感染症、外傷などで上昇します。IL- 8とは何でしょうか?CXCL8としても知られ、CXCケモカインファミリーに属する因子です。単球、マクロファージ、T細胞、好中球、線維芽細胞、内皮細胞、および腫瘍細胞系を含む様々な細胞種において、炎症性刺激に応答して分泌されます。IL- 10とは何でしょうか?ヒトサイトカイン合成阻害因子としても知られるインターロイキン10は、抗炎症性サイトカインです。主に2型ヘルパーT細胞5(Th2)が産生します。インターロイキン10は、抗炎症性サイトカインというよりも非炎症性サイトカインと言うべきです。
インターロイキン10が存在しているので化学物質であるアレルゲンに対して免疫寛容を起こしてアレルゲンと共存できるのです。
ヘルペスウイルスという感染性の病原体である異物の処理はどのように行われているのでしょうか?糸球体内皮細胞は有窓で,高い血管内圧がかかり,糸球体係蹄(糸球体血管壁)の内皮下腔とメサンギウムが交通していることから,比較的大きな蛋白分子を含む血漿成分,組織液成分の通路となっているのが糸球体内皮細胞なのです。メサンギウム細胞はIgA抗体のFc部分に結合できるFcレセプターも持っている上に、貪食能を有しているので,IgA免疫複合体に運ばれてきたherpesなどを除去する働きも持っているので、ヘルペスを取り込んで処理するつもりだったのですがヘルペスを殺しきることができずに逆にメサンギウム細胞にherpesが感染してしまう羽目になってIgA腎炎を起こすことになってしまったのです。
メサンギウム細胞はIgA抗体のFc部分に対するFc 受容体以外に,動脈硬化の原因となるlow density lipoprotein(LDL)に対する受容体や,終末糖化産物(adavanced glycation end products略してAGE)の受容体など持っており血液に流れている抗体と結合した病原体や LDLや,AGEなど をメサンギウム細胞内に取り込んで糸球体毛細血管の血液の浄化作用処理する機構をも持っているのです。終末糖化産物とは何でしょうか?AGEとは終末糖化産物(Advanced Glycation End Products)、すなわち「タンパク質と糖が加熱されてできた物質」のことで、強い毒性を持ち、老化の原因物質なのです。AGEが血管に蓄積すると心筋梗塞や脳梗塞、骨に蓄積すると骨粗しょう症、目に蓄積すると白内障の一因となります。AGEは、2通りのしくみで体内に溜まっていきます。一つ目は、体内でつくられるAGEは、糖尿病などで血中のブドウ糖が過剰になると、人間の体の細胞や組織を作っているタンパク質に糖が結びつき、体温で熱せられ「糖化」(Glycation)が起きます。糖化(Glycation)とは何でしょうか?糖化反応とも言います。糖化とは、身体に中でタンパク質と余分な糖が結びついて、タンパク質が変性、劣化してAGEs(蛋白糖化最終生成物)という名の老化物質(悪玉物質)を生成する反応です。この老化物質であるAGEsは分解されにくく、このAGEsの蓄積は肌や髪、骨など全身の老化を進行させ、さらに体調不良やさまざまな疾患(糖尿病、高血圧、がん等)の温床となります。
糖化反応はメイラード反応とも呼ばれ、フルクトースやグルコースなどの糖の分子が有するケトン基やアルデヒド基が酵素の働きなしにタンパク質または脂質などのアミノ残基やヒドロキシ基に結合する事を起点に起こる一連の化学反応の事である。こうして「タンパク質と糖が加熱されてできた物質=AGE」ができるのです。
体内のタンパク質が糖化しても、初期の段階で糖の濃度が下がれば元の正常なタンパク質に戻ることができます。しかし高濃度の糖がある程度の期間さらされると、毒性の強い物質に変わってしまい元には戻れなくなります。
もう一つは食べ物から体内に入るAGEがあります。タンパク質と糖が加熱されてできた物質はいろいろな食べ物・飲み物の中にも含まれ、私たちは食事や間食として取り込んでいるのです。例えば、小麦粉(糖)と卵や牛乳(タンパク質)をミックスして加熱すると、ホットケーキが焼けます。そして、ホットケーキ表面のこんがりキツネ色になっている部分こそが糖化した部分で、ここにAGEが発生しているのです。こうした飲食物に含まれるAGEの一部は消化の段階で分解されますが、約7%は排泄されずに体内に溜まってしまいます。
糖化反応はメイラード反応とも呼ばれます。フルクトースやグルコースなどの糖の分子が有するケトン基やアルデヒド基が酵素の働きなしにタンパク質または脂質などのアミノ残基やヒドロキシ基に結合する事を起点に起こる一連の化学反応とも言えます。adavanced glycation end products(AGE)とは何でしょうか?終末糖化産物とか蛋白糖化最終生成物と呼ばれこのAGEと結合する受容体を終末糖化産物受容体(Receptor for Advanced Glycation End Products略してRAGE)と言います。ブドウ糖(glucose)は私たちの各細胞にエネルギーを供給する上で絶対欠かせないものであるため、生き延びるには食物を摂取して継続的な供給を行うことが必要となる。しかしそれをやり過ぎると、過剰となったブドウ糖が深刻な問題を引き起こし糖尿病(diabetes)になってしまいます。血液中に糖が過剰にある状態が長年続くと、体中のタンパク質を傷つけ生命をおびやかす病気を引き起こしてしまいます。
ブドウ糖およびブドウ糖からできる分子はゆるやかな活性のある化合物で、あらゆる種類のタンパク質に含まれる傷つきやすいアミノ酸に付加されます。2つの段階を経て起こる。最初に糖がタンパク質に作用し、比較的不安定な結合を作る。そして時間をかけて更なる化学変化を起こし、終端糖化産物(Advanced Glycation End Product、略してAGE)と呼ばれるより安定した修飾となる。私たちの細胞は細胞表面にある受容体でこのAGE修飾を認識してAGEに対抗して処理してくれるのが終末糖化産物受容体(Receptor for Advanced Glycation End Products略してRAGE)なのです。この終末糖化産物受容体(Receptor for Advanced Glycation End Products略してRAGE)を持っているのが糸球体のメサンギウム細胞なのです。
グルコースをはじめとする糖は生体にとって重要なエネルギー源です。糖尿病のように体内に糖が過剰に存在する状態では末梢組織に障害が生じ、心筋梗塞や失明、人工透析が必要となるような重度の腎症といった合併症につながることもあります。つまり糖は身近な栄養素ですが、生体内ではその厳密な量(濃度)のコントロールが必要なのです。
糖化産物は、糖がタンパク質や核酸、脂質などの生体高分子に非酵素的に結合することで生じる物質の総称です。1912年にフランスの化学者 Louis-Camille Maillardによって発見されたこの反応は、彼の名前にちなんで「メイラード反応」と呼ばれています。当初は試験管の中で起こる化学反応の一つと認識されていましたが、20世紀後半に生体サンプル(尿や血液など)や食品中に糖化産物が含まれていることが次々に明らかになりました。生体内で確認された糖化産物の例として、赤血球に含まれるヘモグロビンに糖が結合することで生じるヘモグロビンA1cが挙げられます。
これまでに最も研究が進んでいる糖化産物の一つが、多様な構造をもつ終末糖化産物 (advanced glycation end products, AGEs) であり、終末糖化産物は老化とともに体内に蓄積され、糖尿病や神経変性疾患、がんなどの多くの疾患の発症に深く関与しています。体内で生じた終末糖化産物は、それ自体が生体にとって有害な活性酸素種を産生するだけでなく、細胞表面に存在する終末糖化産物受容体 (the receptor for AGEs, RAGE)に結合し、細胞内部に炎症シグナルを発生させます。この炎症シグナルは、終末糖化産物受容体の転写を促進する、すなわち細胞膜上における本受容体の量を増やすことで、終末糖化産物に起因する炎症シグナルを増幅します。このような複数の作用により、終末糖化産物は過剰な炎症シグナルが関与するような疾患、すなわち糖尿病やがんなどを引き起こし、悪化させるのです。
実は糖化産物は我々の食生活と密接に関連しています。食品の加熱や醸造の過程において、茶色くなる現象、「褐変」が起こりますが、この褐変も食品中の糖とアミノ酸が反応し、糖化産物が生じた結果です。このような食品中の糖化産物、食品科学の分野ではメラノイジンと呼ばれることもありますが、メラノイジンは食品の風味やうま味には欠かせません。また、日本人にはなじみ深い味噌や醤油にもメラノイジンが含まれており、それらには抗酸化作用などの体に良い作用があります。
糖化産物は様々な構造をもつため、その構造と生体に及ぼす影響との相関については不明な点が多く残っています。現状では、バランスの良い食生活を通じて糖と糖化産物の両方とうまく付き合っていくことが大切です。
メサンギウム細胞はherpesに感染された病的状態下でherpesがメサンギウム細胞の遺伝子にゲノムを組み込んで形質転換させるのです。後天的遺伝子病はヘルペスが感染した細胞のゲノムに自分のゲノムを組み込む時に細胞の遺伝子の組み換えをやることによって遺伝子の突然変異を起こし様々の形質転換を生じるのです。すなわち embryonic phenotype(胚性表現型) に戻り筋線維芽細胞(myofibroblast)様細胞となり,平滑筋型α-アクチン(α-smooth muscle actin),胎児型平滑筋ミオシンなどを発現するようになるのです。正常では産生しないⅠ・Ⅲ型コラーゲンも産生するようになります。
形質転換はherpes感染によるメサンギウム傷害後に,細胞増殖を行い、メサンギウム細胞の形質転換(transformation)後にメサンギウム細胞外基質産生亢進により糸球体の再構築を図る修復機転なのですが、実はヘルペス感染により無理やり、させられてしまったのです。つまりヘルペスによる遺伝子の突然変異によって形質転換させられたために本来の正常なメサンギウム細胞の働きが出来なくなった結果、embryonic phenotype(胚性表現型) や、筋線維芽細胞(myofibroblast)様細胞や,平滑筋型α-アクチン(α-smooth muscle actin),胎児型平滑筋ミオシンなどを発現するようになるのです。いわば正常なメサンギウム細胞が機能不全に陥ってしまったのです。形質転換の結果、慢性化するIgA腎炎メサンギウムを含むすべての増殖性糸球体腎炎や進行性糸球体硬化の出発点はメサンギウム細胞のherpesに対する不完全な免疫機構とherpesウイルスの特異性によってヘルペスを殺しきることが出来なかったことから始まりメサンギウム細胞で増殖したherpesが徐々にメサンギウム細胞が分裂増殖するときにherpesビリオンも増えて免疫が落下した時にメサンギウム細胞外に放出されて糸球体係蹄(糸球体壁)を構成する糸球体内皮細胞,糸球体基底膜,足細胞(糸球体上皮細胞)の糸球体濾過を直接行う三つの他の細胞要素に新たに感染したヘルペスの溶原感染や溶解感染による3要素の糸球体傷害後の糸球体再生不全の影響を受けた濾過機構が障害され、その結果IgA腎炎が生じたのです。
結論はIgA腎炎の根本原因は糸球体に感染したヘルペスのなせる業であってあらゆるタイプの腎炎はherpes感染なのです。昔も今も全ての病気は病原体から始まるのですがワクチンと抗生物質の発見により古来からの病気は壊滅してしまったのです。しかし残念ながらherpesだけはワクチンも作れず絶対に殺しきれないので病原体による病気はすべてなくなってしまいましたというわけにはいかないのです。しかしこの世からherpesを完全に除去できる方法が一つだけあります。癌を100年前に完治させたロイアル・レイモンド・ライフ博士の「光癌療法」の装置を復活させれば癌どころかIgA腎炎も極めて簡単に完治できます。「光癌療法」の装置を腎臓に充てれば極めて簡単に治るのです。ロイアル・レイモンド・ライフ博士の「光癌療法」はここをしっかり読んでください。
Fc受容体とは何でしょうか?Fc受容体は、免疫系の保護機能に寄与する免疫グロブリンスーパーファミリーに属するタンパク質である。Fc受容体は、Bリンパ球、ナチュラルキラー細胞、マクロファージ、好中球およびマスト細胞を含む特定の細胞の表面上に存在します。Fc受容体の名称は、Fc部分として知られている抗体の一部に対して特異的に結合します。Fc受容体は、感染細胞または侵入病原体に付着した抗体に結合する。認識する抗体の種類に基づいて多くの種類のFc受容体が存在する。Fc受容体の活性は、貪食細胞または細胞傷害性細胞を刺激し、抗体媒介食作用または抗体依存性細胞媒介性細胞毒性によって微生物または感染細胞を破壊する。
Fc受容体の機能は何でしょうか?Fc受容体は、マクロファージおよび単球のような食細胞、好中球および好酸球のような顆粒球、および自然免疫系のリンパ球(ナチュラルキラー細胞)または適応免疫系(例えば、B細胞)を含む免疫系の多数の細胞に見出される。Fc受容体はこれらの細胞が微生物または微生物感染細胞の表面に付着した抗体に結合することが出来、これらの細胞が微生物病原体を同定および除去するのを助ける。食細胞の活性化が起こるのは、Fcレセプターに結合すると生じる機能です。
Fc受容体の種類には何があるのでしょうか?Fc受容体は単離されており、認識する抗体のタイプに基づいて異なるタイプに分類される。
①Fcアルファ受容体(FCAR / FcαR)。Fcアルファ受容体(FcαR)は、低親和性でIgAに結合し、IgAに対して特異的な受容体である。FcαRI(CD89 / FCAR /FcαR)と呼ばれるFcアルファ受容体サブグループに属するタイプは1つだけである。Fcアルファ受容体Iは、好中球、好酸球、単球/マクロファージ、樹状細胞およびクッパー細胞、糸球体メサンギウム細胞に存在します。
②Fcガンマ受容体(FCGR /FcγR)。Fcガンマ受容体(FcγR)は、IgGのFc部分の受容体である。Fcガンマ受容体には、 CD64(FCGRI /FcγRI)、 CD32(FCGRII /FcγRII)、CD16(FCGRIII /FcγRIII)という3つの主要なクラスがある。全てのFcガンマ受容体(FcγR)は免疫グロブリンスーパーファミリーに属する。Fcガンマ受容体は、オプソニン化(味付け)された食作用、炎症性メディエーター(サイトカイン)の放出および抗体依存性細胞傷害作用(ADCC)のような多くの免疫系エフェクター機能では不可欠である。免疫系エフェクター機能は抗体のエフェクター機能ともいわれ抗体のFc領域が担う機能で,抗体クラスに大きく依存している。 補体を活性化する機能はIgMとIgGクラスの抗体に限られ,抗体の可変領域が結合した細胞を溶解させる機能を特にCDC(補体依存性細胞障害)と呼ぶ.
③Fcイプシロン受容体(FCER /FcεR)。Fcイプシロン受容体(FcεR)は、IgEに結合するFc受容体である。免疫系の細胞には2種類のFcεRがある。高親和性受容体のFcイプシロン受容体I (FcεRI/ FCERIは、単量体IgEに結合することができる。低親和性受容体のFcイプシロン受容体II(FcεRII/ CD23 / FCERII)は複合体IgEと優先的に相互作用する。
④新生児Fc受容体(FCGRT)。新生児Fc受容体は、MHC クラスI受容体の一種である。新生児Fc受容体(FCGRT )は、げっ歯類に最初に発見された。ヒトにも同様の受容体がある。げっ歯類では、新生児の腸上皮および胎児の卵黄嚢における新生児Fc受容体は母IgGを新生児へ輸送し、また、母から胎児へ胎盤を越えるIgGの輸送を媒介する。
⑤Fc受容体様タンパク質(FCRL / FCRH)。FCRLは、Fc受容体様タンパク質であり、5つのIgスーパーファミリーメンバーのサブファミリーである。 FCRL はFc受容体ホモログ(FCRH)とも呼ばれる。FCRL遺伝子は、ヒト第1染色体およびマウス第3染色体上に位置する。FCRL遺伝子は、免疫グロブリンスーパーファミリー受容体転座関連(IRTA)遺伝子、SH-2ドメインを持つホスファターゼアンカータンパク質(SPAP)遺伝子としても同定されている。FCRLは、IgG、FCGRI、FCGRIIおよびFCGRIIIの古典的Fc受容体と配列ホモログを有する。FcRH1-5サブファミリーのメンバーは、免疫受容体チロシンベースの活性化モチーフ(ITAM)、阻害モチーフ(ITIM)またはその両方を有するレセプターのネットワークに属する。FCRLの機能に関しては、B細胞における活性化コレセプターであり、B細胞の活性化および分化を促進することである。
⑥Fcα/μR (FCAMR)。Fcα/μレセプター(Fcα/μR )は、IgM媒介性免疫防御に関与する可能性があるIgMおよびIgA(FCAMR)の新規Fcレセプターなのです。
粘膜免疫機構はまずIgAの産生誘導を行う誘導組織でIgAの産生が行なわれ、次に,IgAが分泌され、分泌されたIgAが機能する実効組織、そして最後はそれらをつなぐ帰巣循環経路の三つから構成され、これら三つを合わせて共通粘膜免疫機構(Common Mucosal Immune System略してCMIS)と呼ぶ。誘導組織において粘膜面に存在する抗原提示細胞(APC)はリンパ球を活性化させ、遊走させる働きを持っている。Bリンパ球はリンパ節で分化した後に実効組織に到達し、IgAを産生する。この際、一度誘導組織を離れたリンパ球は再び同じ組織に戻ってくる傾向を持ち、これをリンパ球のホーミング(帰巣現象)と呼ぶのです。
IgAはどこで作られますか?IgAは実効組織の粘膜固有層に存在するIgA産生形質細胞(IgA産生プラズマ細胞)により二量体の粘膜抗体として産生され、分泌される。IgAは、初乳や鼻汁、唾液、十二指腸分泌液などに多く存在し、粘膜免疫における中心的な防御因子となっています。 他にも喉や腸、気管支などの粘膜にも存在します。 さまざまな粘膜で作られる IgA は、特定のウイルスや細菌だけに反応するのではなく、粘膜に見られる多種多様な病原体にくっつくことができ、守備範囲の広さが特徴です。形質細胞はリンパ球のB細胞から分化し抗体産生能を持つ細胞であり、形質細胞に分化する前にIgMを産生する能力を持っている。この細胞がIgA産生能を獲得するためにはヘルパーT細胞が産生するサイトカインの刺激を受ける必要があり、B細胞が一型ヘルパーT細胞(Th1)が産生するトランスフォーミング増殖因子-β((transforming growth factor β略してTGF-β、訳して形質転換増殖因子β)やⅡ型ヘルパーT細胞(Th2)が産生するインターロイキン-4の作用を受けることにより免疫グロブリンのクラススイッチが誘導されます。クラススイッチの最後にはB細胞はさらにインターロイキン-5およびインターロイキン-6の刺激を受けてIgA産生能を持つ形質細胞に分化するのです。IgA産生形質細胞への分化とクラススイッチにはTh2サイトカインであるインターロイキン-5およびインターロイキン-6が絶対に必要なのです。
TGF-βは多様な形質転換活性を持つ線維芽細胞に対する増殖因子として精製されたサイトカインの一種であるが、その後、種々の細胞に対する増殖抑制、分化、遊走、接着、炎症、免疫など、さまざまな作用の発現に関与しているサイトカインがTGF-βなのです。る。
IgAは形質細胞により産生されるJ鎖と結合し2量体として分泌される。2量体IgAはその後粘膜上皮細胞の基底膜側に発現している分泌成分( Secretory Component, SC)と結合して上皮細胞内へ取り込まれ、管腔側へと分泌される。このSecretory Componentという分泌成分は上皮細胞が持っているタンパク質分解酵素による分解からIgAを保護する役割を有しているのです。
このようにして形質細胞から産生されたIgAは粘膜面への微生物の侵入を防ぐ重要な役割を果たしているにもかかわらず、粘膜とは全くかかわりのない糸球体にどのようにして単量体のIgAが血流に糸球体まで運ばれIgA糸球体腎炎を、引き起こしてしまうのかを明らかにするための序章を今長々と書いているのです。
単量体IgAが持っているFcに対する受容体であるFcαR(CD89)は好酸球やマクロファージなどの免疫細胞等の細胞表面のみならずメサンギウム細胞にも存在しています。免疫細胞ではないメサンギウム細胞に何のためにIgAとIgMが持っているFcに対する受容体を持たせたのでしょうか?血液にあるIgAは糸球体毛細血管に侵入してきた細菌やウイルスなどの病原体にくっつくことで貪食して無力化するためです。 IgM抗体は感染の最も初期にIgG 抗体よりも素早く病原体にくっつくことで無力化することができるためです。
ところが病原体がIgA免疫複合体で運ばれてきたヘルペスであると単純にヘルペスだけではないのでメサンギウム細胞はFcレセプターでは取り込めないので何百個もあるFcレセプターにIgA免疫複合体がメサンギウム細胞に沈着してしまいそのうちにヘルペスだけがIgA免疫複合体から乖離してヘルペスがメサンギウム細胞に感染してしまいヘルペスの増殖がメサンギウム細胞の分裂に歩調を合わせて始まり、増えたヘルペスは合胞体であるあらたなるメサンギウム細胞に次々とギャップ結合を介して次々と感染が起こってしまうのです。最後はヘルペス性メサンギウム細胞感染症となりヘルペス性メサンギウム細胞糸球体腎炎となってしまうのです。
腎臓の糸球体を構成する内皮細胞、基底細胞、上皮細胞がヘルペス感染によって溶解感染になって壊死してしまうと二度と再生することが難しいのです。何故ならば幹細胞がないからです。幹細胞とは自己複製能および多分化能を持つ細胞と定義されます。幹細胞が自己複製能および多分化能を持つ細胞とは具体的にはどのような意味をもつのでしょうか?人体が絶えず入れ替わり続ける組織を保つために、私たちは失われた細胞を再び生み出して補充する能力を持った細胞を持っています。 また、組織が怪我をしたりダメージを受けたりしたときも失われた組織を補充する能力を持った細胞が必要となります。 こうした能力を持つ細胞を「幹細胞」と呼びます。ところが腎臓においてはこの 2 つの特徴である自己複製能および多分化能を有する幹細胞はないのです。何故ならば生まれたときの腎臓の細胞は終末分化細胞であるからです。終末分化細胞とは何でしょうか?胎児期に分化の最終段階に到達した細胞は,もはや異なる系列の細胞へと分化することはなく、また多くの組織では細胞分裂もせず静止期にある. このような細胞を終末分化した細胞といい,神経細胞・筋細胞・肝細胞・腎細胞などが典型的な例である。ところが細胞分裂もせず静止期にある肝細胞や腎細胞はウイルスによって傷つくと修復のために分裂して新しい細胞を作れることがわかっています。
IgA腎症は,慢性糸球体腎炎のうちのひとつです。慢性糸球体腎炎のなかで、IgA腎症が最も多く、約40%を占めています。慢性糸球体腎炎(chronic glomerulonephritis:CGN)とは何でしょうか?①IgA腎症(メサンギウム増殖性糸球体腎炎)、②膜性腎症、③膜性増殖性糸球体腎炎④紫斑病性腎炎などがあります。腎臓の中の糸球体という、血液から尿を作る部分のメサンギウム細胞や血管皮細胞に感染したherpesのために持続的に炎症を生じている病態です。慢性糸球体腎炎は糸球体に炎症を生じる疾患の総称で主にどの細胞に、herpesが感染しているかによってその中にIgA腎症、膜性腎症などが含まれます。 血尿や蛋白尿を生じ、持続することで次第に腎機能が低下していきます。④の紫斑病性腎炎は何故紫斑病性と言うのでしょうか?IgA腎症と紫斑病性腎炎の間の唯一の違いは,紫斑病性腎炎では皮膚に点状出血斑が認められることであり,糸球体病変から両疾患を鑑別することは困難であるのです。IgA血管炎は触れることのできる皮膚の紫斑がみられ、関節痛や腹痛・下血などの消化管症状、腎障害を合併することがある全身性の小型血管炎です。 IgA血管炎は免疫複合体血管炎に分類され、IgAという抗体を含む免疫複合体が小血管に沈着することで炎症が生じます。
慢性糸球体腎炎の共通の経過は血尿や蛋白尿が持続する腎臓の病気です。腎臓の見た目,形や大きさはほとんど変わらないのですが顕微鏡レベルで糸球体という腎臓の血液濾過装置に炎症が起こっています。その炎症は何十年にもわたり続きます。糸球体とは,腎臓の最も大切な構造物で,血液を濾過する装置です。1個の腎臓に約100万個の糸球体があります。心臓が1回ドクンと脈をうてば,その約4分の1は腎臓に流れ込み,それらは糸球体に到達します。糸球体では血液の中の老廃物や不要物を中心に濾過します。それゆえ,腎臓を通過した血液は綺麗になるのです。
その濾過装置である糸球体に炎症が続くのが慢性糸球体腎炎です。炎症が続けば,糸球体は再生できないので、糸球体はやがて耐えられなくなりつぶれてしまいます。生まれたときに200万個あった糸球体は徐々に数を減らしていきます。
そして,最終的に機能する糸球体の数が10%程度になれば末期腎不全となり透析療法が必要となります。
慢性糸球体腎炎のうち40%~50%を占めているIgA腎症とは何でしょうか?単量体の免疫グロブリンIgAがFab部分で捕まえたherpesとメサンギウム領域で免疫複合体を形成します。
さらにメサンギウム細胞は食作用を持っている上に糸球体毛細血管と接触しているので血液からIgA免疫複合体の一部でありしかも異物の病原体であるヘルペスウイルスを見つけると無謀にも貪食してしまうのです。さらに血管に侵入したヘルペスが毛細血管の塊である糸球体のメサンギウム細胞で食作用で細胞内に取り込まれてしまい、ヘルペスウイルスは殺せないので細胞外の免疫は手も足も出なくなってメサンギウム細胞に感染してしまうことになるのです。勿論取り込めないヘルペス性IgA免疫複合体が取り込めないときはメサンギウム細胞の膜に沈着するヘルペス性IgA免疫複合体が増えていきます。さらにメサンギウム細胞はFcレセプターを持っていますからヘルペスウイルスとIgA抗体の免疫複合体が腎臓の糸球体毛細血管に流れ着くと毛細血管の血液と連絡しているメサンギウム細胞のFcレセプターと免疫複合体のIgA抗体のFc部分と結合してメサンギウム細胞はIgA抗体の免疫複合体に取り込んでしまうのです。IgA抗体のFabレセプターとherpesウイルスとの結合力はあまり強くないのでIgA抗体のFabレセプターから簡単にはがれてしまいこの時点でherpesウイルスのメサンギウム細胞内への感染が成立するのです。このようにしてメサンギウム細胞に感染したherpesウイルスは免疫が弱いときに感染細胞内で増殖を始めてしまうのです。感染したherpesは免疫が落下した時やメサンギウム細胞が分裂する時にこれ幸いと言わんばかりにherpes自身も分裂増殖を始め子孫であるherpesビリオンを数十個から数千個も一回の細胞分裂に際して増やしてしまうのです。
増えたビリオンはメサンギウム細胞から飛び出て片腎だけで100万個もある毛細血管の内皮細胞に感染してしまうのです。糸球体を形成している四つの要素であるメサンギウム細胞はもとより糸球体毛細血管内皮細胞や糸球体基底膜細胞や糸球体上皮細胞(足細胞)のすべての細胞に長い時間をかけて徐々に徐々に感染してしまいヘルペス性腎炎となってしまうのです。従ってあらゆる腎炎の病名は腎性ヘルペス感染症と変えるべきかメサンギウムヘルペス感染症にすべきです。
IgA腎炎は自己免疫疾患とされていますが誤りですし,そもそも自己免疫疾患は存在しないのです。ヘルペスとの戦いによる免疫反応の炎症をいち早く抑えるために,まずはステロイドを中心とした治療を行われるのも大間違いなのです。まず抗ヘルペス剤を投与すべきなのです。ステロイドを用いて治る病気はこの世には何もありません。免疫を抑えている間に腎炎の原因であるherpesが増えるばかりですからステロイドを使い始めた時点で、腎炎を治せない治療の始まりとなるのです。残念です。
病態的にはIgAとherpesとの免疫複合体のうちのいくつかは糸球体メサンギウム領域であるメサンギウム細胞とメサンギウム基質にメサンギウム細胞のFcレセプターとIgAのFc部分の結合したまま沈着する場合もあるでしょうし又メサンギウム細胞に感染したヘルペスの増殖のために傷ついてしまい修復するために、正常では細胞分裂する必要がない一個であったメサンギウム細胞が細胞分裂を行い二つ、三つ、四つ、五つと細胞増殖して行き細胞数を増やしたメサンギウム細胞に合わせてと同時にメサンギウム細胞作って増えた細胞内の基質の増生と拡大が進んでいくのです。IgAとherpesとの免疫複合体が多ければ多いほど上記の事態が急速に進むので急性の糸球体腎炎となるのですがIgAとherpesとの免疫複合体自体が少ないので両腎で200万個もある糸球体のメサンギウム細胞に取り込まることも極めて少ないので糸球体腎炎が知らぬ間に慢性化して慢性糸球体腎炎になったり腎不全になるのは極めて長い時間がかかるのです。
にもかかわらず知らぬ間に腎臓病になるのは何故でしょうか?IgA腎症と免疫複合体の関係をもっと詳しく書きましょう。IgA腎症の原因は上で説明し始めたようにherpesが関わっているにもかかわらず今なお不明とされているのですが実は免疫複合体とはIgA抗体がオプソニン作用を持つFc部位に捕まえている病源体はherpesウイルスでありherpesウイルスがIgAのFcαに結合して膨大な数の毛細血管から成り立っている莫大な量の血液のろ過を行う糸球体の毛細血管に運ばれてきたヘルペスウイルスと免疫グロブリンIgAとの免疫複合体が腎糸球体メサンギウムに取り込まれて腎糸球体メサンギウム領域に沈着したのです。言うまでもなくメサンギウム細胞は糸球体基底膜(glomerular basement membrane略してGBM)と接触しているだけでなく糸球体の毛細血管とつながりを持っているので糸球体濾過などの機能に関与している。
毎日、腎臓には心臓から血液がいくら運ばれてくるのでしょうか?毎日濾過されるべき血液が約150ℓ(お風呂1杯分)流れています。 そこで血液が濾過され、そのうち1%の1.5ℓが尿になって、体の外に排泄されます。150ℓの1%なので、1日の尿量は1.5ℓになります。何故ならばメサンギウム細胞は貪食作用と抗原提示能を持っておりかつ糸球体毛細血管と接触しているのでヘルペスを毛細血管から取り込めるのですがherpesを殺しきることが出来ずにherpesはメサンギウム細胞の遺伝子に隠れ潜んでいる間に長い時間をかけて遺伝子の形質転換も行いメサンギウム細胞の遺伝子異常も起こしてしまうことにもなるのです。取り込み過ぎたherpes性の免疫複合体ためにメサンギウム細胞は反応性に大きくなりながら処理できなくなったIgA免疫複合体を吐き出したりしているうちにとりこんだ糸球体へのIgA免疫複合体がメサンギウム細胞基質に沈着していくのです。
元々メサンギウム領域は血液のろ過には直接かかわりのないない糸球体の結合組織に過ぎないので線維芽細胞や平滑細胞に似ているのです。又、血液に流れている単量体の血清IgA抗体は極めて微量なのですが 粘膜関連リンパ組織には外からのヘルペスウイルス感染が多いので粘膜の血管の血液に流れ出たherpesと微量の単量体の血清IgA体がたまたまIgA免疫複合体となり感染した病原体の一部とIgAが免疫複合体を作って血液中に入り、腎臓の毛細血管の100万個もある 細い毛細血管が毛糸の球のように丸まってできているので球体に流れ着きます。 腎臓に流れ着いたherpes性IgA免疫複合体(IgAのFabレセプターで捉えたherpes)糸球体のメサンギウム領域に沈着します。ここで注意しておきますがherpesウイルスとぴったり合致するIgAのレセプターは極めて少ないのでIgA腎炎も極めて少ない病気であることを知っておいてください。しかも大食細胞に似てはいますが自自然免疫細胞ではないのでメサンギウム細胞で処理できなかったherpesはメサンギウム細胞で増殖すると接触している毛細血管の内皮細胞に感染して血管から運ばれてきた自然免疫細胞にとの出会いがあって見つけられて免疫細胞と闘って炎症が更に波及していきます。メサンギウム細胞からherpesとの炎症がジワジワと炎症のために、徐々に糸球体が障害され破壊されていくのです。その結果糸球体基底膜や糸球体の血管の孔が大きくなって濾過されない大きな分子である血球や蛋白が孔から漏れ出てしまい原尿になるのですが尿細管で血球や蛋白は再吸収することが出来ないので尿検査では、血尿、蛋白尿を認められ、血液検査では、糸球体腎炎となり腎機能が悪化するため、クレアチニン値が上昇します。クレアチニン値とは何でしょうか?クレアチニンとは血液中の老廃物のひとつであり、通常であれば腎臓で濾過され、尿細管でクレアチニンは再吸収することが出来ないのでほとんどが尿中に排出されます。 しかし、糸球体濾過機能という腎臓の機能が低下しているので、尿中に排出されずに血液中に蓄積されます。 この血液中のクレアチニンを「血清クレアチニン値」といいます。
血管内皮細胞で増殖したherpesが免疫細胞に発見され戦いが始まると炎症を起こし、CRPという炎症反応が陽性になります。多くの場合、ANCA、抗基底膜抗体などの自己抗体が陽性になると言われますが自己免疫疾患は存在しないのでこれらの自己抗体は自然抗体のIgMであるかIgGである場合はたまたま自然抗体のIgMを産生しているBリンパ球の周りにいたTh1のヘルパーT細胞がつくるサイトカインであるINF‐γやTNFやIL‐2がBリンパ球の自然抗体のIgMをたまたまIgGにクラススイッチさせただけなのです。純粋な自己抗体はこの世にはあり得ないのです。何故自己免疫疾患は存在しないについてはここを読んでください。
ヘルペスに感染したメサンギウム細胞を増殖させる主なサイトカインとして,インターロィキン(IL)-1,IL-6,腫瘍壊死因子α(TNFα),血小板由来増殖因子(PDGF),低濃度トランスホーミング増殖因子β(TGF-β),塩基性線維芽細胞増殖因子(b-FGF)や上皮増殖因子(EGF)などがメサンギウム細胞自身から作っただけでなく血中からメサンギウム領域に流れ込んできた免疫細胞からもどんどんつくられます。それらのうち代表的なTGF-βは,細胞外基質の産生促進や,分解酵素の抑制や,tissue-inhibitor-of-metallo-proteinase(TIMP)の産生亢進作用によりメサンギウム基質の増生による糸球体硬化に促進酌に働くのです。この様なメサンギウム領域の変化が血尿,蛋白尿,高血圧から尿毒症にいたる多彩な臨床症状を呈するようになるのです。免疫は36億年間正しい免疫が支えてきた王国を支配し生命を守ってきた正義の絶対君主ですから絶対に免疫は人体に害をなすことをしないのです。悪の王国を支配しているのは無限に欲望を支配して悪の限りを尽くしている資本主義のお金と真逆なのは免疫なのです。免疫を懲らしめるのはお金だけなのです。残念です。免疫の敵は病源体のherpesですが実はもっと怖い敵は資本主義の根幹であるお金なのです。哀しいですね。
腎臓の糸球体の毛細血管の炎症と硬化と免疫 の働きとはどのように関わっているのでしょうか?病原体に対する生体防衛反応である「炎症」は「免疫」の出現をもって開始され完成すると,さらにこの免疫状態は再度の同一侵襲に対応して,免疫記憶によってほとんど気づかれない「炎症」を惹き起して病原体を簡単に退治します。ところが一つだけ例外的な病原体がいます。ヘルペスです。免免疫と病原体の初めての出会いがあればかならず殺しきって免疫はこれら敵の病原体を覚えて二度目からは見かけに症状を起こさず敵を簡単に処理できます。この免役の働きを獲得免疫と言われます。ところがherpesが糸球体の血管の内皮細胞に感染した時は殺しきれないので,内皮細胞は溶解感染で壊死してしまうと細胞の蛋白のゴミが残ります。ましてや糸球体の細胞にはメサンギウム細胞を除いては幹細胞が存在しないのですから炎症で崩壊した糸球体は再生できないので線維化してしまい最後はガラクタとならざるを得ないので時に過剰線維増殖硬化に向かうことがあるのです。
何故過剰線維増殖硬化が起こるのでしょうか?過剰線維増殖硬化は過剰なマトリックス合成(細胞外基質合成)を惹き起こして最終的には臓器組織の回復不能な機能不全を来たして,いわゆる代謝されにくい硬い繊維だけが残り硬化線維化症をおこします。
herpesが血管内皮細胞に感染した時に起こしやすい硬変症(肝硬変症)の発生メカニズムについて説明しましょう。血管とくに動脈と腎糸球体の毛細血管, 肝類洞壁(肝内皮細胞壁)の血管に共通していることは,いずれも内皮で覆われた血管腔の周囲に,平滑筋,メサンギウム細胞、伊東細胞といった,それぞれ機能は異なってもその共通の働きとして繊維芽細胞の細胞骨格の主成分であるα-actin-myosin複合体を有し,その収縮能によって血流の調節に一役買っている細胞骨格で裏打ちされているのです。メサンギウム細胞はまさにその収縮能によって糸球体の血流の調節に一役買っている細胞なのです。類洞(るいどう、sinusoid)とは、肝細胞板間に存在する拡張した毛細血管で、肝細胞板(hepatic lamina)とは肝小葉内の肝細胞が板状に配列した構造で、洞様毛細血管(どうようもうさいけっかん)とも呼ばれる。その壁は有窓性の内皮細胞から構成される。管腔内にはクッパー細胞が存在する。伊東細胞とは、肝臓を構成する微小組織の一つで、類洞周囲腔(ディッセ腔)に存在する線維芽細胞の一つで、類洞周囲脂肪細胞、肝星細胞(Hepatic Stellate Cell、HSC)とも呼ばれる。肝類洞とは何ですか?肝特有の血管網で肝臓の血管のことです。類洞(血管)を構成する内皮細胞が肝類洞なのです。また、他の血管内皮細胞との違いとして類洞内皮細胞の細胞体には有窓構造または篩(ふるい)板構造と呼ばれる無数の穴が空いています。篩(ふるい)とは粒状や粉末状のものを入れて揺り動かし、網の目を通る細かいものを下に振り落として選り分けるための道具です。 このような類洞の特徴が血液と肝細胞間の効率的な物質交換を可能にしています。肝臓の類洞は他の臓器の血管とは異なり、基底膜を有しません。基底膜とは上皮細胞、筋細胞、脂肪細胞、シュワン細胞、神経などの組織を取り囲んでいて、結合組織との境界面に見られる細胞間物質からなる非常に薄い膜のことを基底膜といいます。また基底膜(basement membrane)は、上皮細胞層と間質細胞層などの間に存在する薄い膜状をした細胞外マトリックスでもある。膜といっても、生体膜とは異なり脂質は含まれない。細胞側から順に、透明板、緻密板、線維細網板の3層構造からなる。代表的な成分は、IV型コラーゲン、ラミニン、ヘパラン硫酸プロテオグリカン(パールカン)、エンタクチンなどである。 細胞の足場となっているような層で、細胞膜や細胞内の膜とは全く構造が異なり、基底板とも呼ばれます。また、他の血管内皮細胞との違いとして類洞内皮細胞の細胞体には有窓構造または篩(ふるい)板構造と呼ばれる無数の穴が空いています。 このような類洞の特徴が血液と肝細胞間の効率的な物質交換を可能にしています。
細胞外マトリックスとは何でしょうか?細胞外マトリックス(Extracellular Matrix略してECM)とは細胞の外に存在する不溶性物質であり、細胞外基質、細胞間マトリックスともいう。細胞外マトリックスの種類①繊維状のタンパク質②構造タンパク質グリコサミノグリカンの三種類がある。多細胞生物(動物、植物)の場合、細胞外の空間を充填する物質であると同時に物理的な支持体の役割(例えば動物の軟骨や骨)、細胞と基質接着における足場の役割(例えばコラーゲンやフィブロネクチン)を担う。植物における代表的な細胞外マトリックス成分は、セルロースである。わかりやすく表現すると、多細胞生物を構成する細胞の多くは、細胞外マトリックス(細胞外基質)のベッドあるいは巣に埋もれて生活している。それにより細胞は安定した生存環境を得ているのです。しかもそのベッドを作ったのは細胞そのものです。メサンギウム領域はメサンギウム細胞とメサンギウム細胞外基質であり細胞外基質の成分(ベッド)を産生したのはメサンギウム細胞自身であるのです。
よく話題になる平滑筋と動脈と静脈の収縮・拡張との関係と血管の構造と血管の病気を見ましょう。動脈の構造は内膜、中膜、外膜の3層構造になっています。 内膜は血液に接する一層の内皮とそれを支える結合組織からなります。 内皮の働きにより、血液は血管内で凝固せず、血管内腔も適度な大きさに保たれます。 中膜は平滑筋(収縮可能な細胞)と弾性線維(丈夫でしなやかな繊維)からなっているので、血管は収縮や拡張ができます。動脈、静脈、毛細血管、血管吻合の構造とは何でしょうか?
動脈とは、心臓から末梢に向けて血液を送り出す血管で、大動脈から枝分かれして細い動脈になります。動脈壁は、内皮細胞と結合組織からなる内膜、平滑筋と弾性線維からなる中膜、疎性結合組織からなる外膜の3層の構造です。血圧に耐えられるように中膜は、伸縮性と弾性に富み、血圧が低下しても丸い形状が保てるようになっています。動脈のなかでも大動脈は、中膜に豊富な弾性線維を含んでいるために弾性動脈とも呼ばれています。一方、細い動脈では平滑筋が発達しているため、筋性動脈と呼ばれています。
図1動脈と静脈
静脈とは、全身からの血液を心臓へ戻す血管で、動脈に比べて血管壁は薄く軟らかく、弾性に乏しい血管です(図1)。これは中膜の平滑筋がすくないためです。また、四肢の太い静脈には、重力による血液の逆流を防ぐために静脈弁があります。
毛細血管は、細動脈と細静脈を結ぶ、太さは5〜10μmと細い網目状の血管です。血管壁は単層の内皮細胞からなっています。この血管壁の細胞間隙を通して、血液中と組織で、酸素と二酸化炭素の受け渡しや、栄養素の供給と老廃物の回収など物質交換を行っています。
血管吻合とは血管どうしの連絡を血管吻合といいます。小動脈と小動脈との吻合では、片方の動脈が閉塞しても、他方から血液が送られるため血流を維持することができます。部位によっては、毛細血管を通らずに動脈と静脈が直接連絡することがあります。これは動静脈吻合と呼ばれ、指先や腸絨毛などで見られます。
これに対して、小動脈どうしの吻合が見られないものを終動脈といいます。心臓や肺、脳、腎臓などに見られ、血管に閉塞が起こると、虚血性壊死(梗塞)になります。
動脈中膜の平滑筋は,ヘルペスが原因である膠原病の動脈炎である多発性動脈炎,SLEの動脈炎,PSS(進行性全身性強皮症)の動脈炎,悪性関節リウマチの動脈炎以外に,ヘルペスが原因である川崎病動脈炎,高安動脈炎,肺高血圧症などにおいて,とくにその慢性期あるいは末期に,中膜の平滑筋は中膜から内膜に遊走し,そこで分裂増殖すると共にα-アクチンフィラメントが消失し,代わりにコラーゲン,ファイブロネクチンなどのマトリックス(基質⦆合成能を獲得して,いわゆる細胞線維型の内膜肥厚を来たす。この状態の引き金は内皮細胞に感染したヘルペスによる内皮細胞の傷害にあり,平滑筋の増殖と平滑筋の遺伝子の形質転換を来たすのは,まさにherpesなのです。その結果主としてherpesによる遺伝子形質転換した平滑筋に付着した血小板や,再生する内皮細胞,そして増殖する平滑筋細胞自身から出る種々の増殖因子,即ちPDGF,TGFαの産生とそれに対応するレセプターのherpesに感染した血管内皮細胞の遺伝子の形質転換を起こした平滑筋上の発現に依存しているのです。血管病変の中で最も治療困難なこの進行性の細胞線維性内膜肥厚はherpesによる「平滑筋の形質変換」が生じた結果なのです。いかなる形質転換で生まれた細胞の異常は最も治療困難な病気となるのはヘルペス性の後天的遺伝子病であるからです。
肝の伊東細胞に関連した腫瘍に対するherpesに対するモノクローナル抗体を作製したところ,肝臓の伊東細胞の内外にある線維成分の一部と特異的に反応します。今はやりのモノクローナル抗体とは何でしょうか?モノクローナル抗体(monoclonal antibody、略してmAbまたはmoAb)は、単一の抗体産生細胞をクローニングして作られた抗体であり、このようにして人工的に遺伝子を改変して得られた後続の抗体は、すべて単一の同じ抗体、つまりクローン抗体となるのです。この抗体は親細胞までさかのぼれます。しかもこの抗体は同時に,唾液腺,汗腺などの外分泌腺の導管の基底膜,消化管の粘膜筋板と共に,腎糸球体のメサンギウムマトリックスとも特異的に反応し,これらの細胞が共通の性格を有することが実証されたのは、この抗体はherpesに対する抗体ですから唾液腺,汗腺などの外分泌腺の導管の基底膜,消化管の粘膜筋板と共に,腎糸球体のメサンギウムマトリックスにherpesが感染していることを示しているだけのことです。
さらに伊東細胞は肝硬変症の際にマトリックス合成型となり増殖することが知られており,糸球体メサンギウム細胞はマトリックス合成能を増すと糸球体硬化を来たすことも知られているのはこれらの細胞に感染したヘルペスがこれらの細胞が増殖するときに23対の染色体もばらばらになって複製して倍加する必要があるときに感染しているherpesも自分のゲノムを倍加することを数回繰り返すときにばらばらになった一倍体の染色体に組み込んで23対の染色体の塩基のならびをランダムに変えてしまう結果様々な形質転換を引き起こしてしまうからです。
このherpesのモノクーロナル抗体の諸硬化症・線維症における硬化態度を見ると,先づ「肝」においては肝硬変の初期,とくにうっ血性肝硬変においては明らかに洞壁の伊東細胞の増殖とヘルペス性の形質転換に伴う線維成分の増殖部分に一致して陽性反応が見られる。また,herpesが原因であることで知られている間質性肺炎による肺胞細胞の崩壊の最終的なガラクタが「肺線維症」であり「肺線維症」の一部の肺胞壁にherpesに対するモノクローナル抗体に強く反応する細胞とマトリックスの証明される例があるのは当然のことなのです。
何故ヘルペスの増殖によって破壊された組織の崩壊の最後に線維症が起こるのでしょうか?組織の線維化は、コラーゲンを中心とする細胞外マトリックスが組織に過剰に産生・蓄積されることにより生じる。組織は、herpes、酸化ストレス、低酸素状態、炎症、アポトーシスなどにより損傷を受けて組織の細胞の再生が不可能になった場合、損傷組織を細胞外マトリックスで置換して修復を図るが、損傷が重度の場合には細胞外マトリックスの蓄積が過剰となり、組織がその機能を十分に果たせなくなる機能不全になります。線維化は、肝、膵、肺、腎、骨髄、心臓などの各種臓器にみられ、筋線維芽細胞等のコラーゲン産生細胞が主に病態に関与しているのです。線維化は不可逆的な現象であり、いったん線維化した組織が元に戻ることはないからです。
「腎臓」においては,不思議なことにSLEやIgA腎症においては,この抗体に反応する正常のメサンギウム細胞外マトリックスは,あまり変化せず,慢性糸球体腎炎や動脈硬化性腎硬化症において正常のメサンギウム細胞外マトリックス(メサンギウム基質)には存在しないのは正常のメサンギウム細胞外マトリックスにはherpesが感染していなかっただけです。増加が認められたのは,糖尿病性腎硬化症の例のメサンギウム領域と細尿管周囲,そして,免疫型腎炎のBowman嚢の細胞や被膜の一部であったのはたまたまherpesに感染していただけのことなのです。
伊藤細胞( Ito cell)とは何でしょうか?伊東細胞とは、肝臓を構成する微小組織の一つで、類洞周囲腔(ディッセ腔)に存在する線維芽細胞の一つで、類洞周囲脂肪細胞、肝星細胞(Hepatic Stellate Cell、HSC)とも呼ばれる。伊藤細胞は類洞周囲脂肪細胞と言われるくらい脂肪の取り込みが強く、ビタミンAを貯蔵する機能を有するのです。Herpes性の肝臓の線維化に関与し、肝硬変の成因や肝癌の原因になっているのです。癌の原因もherpesによる二つの癌関連遺伝子の遺伝子の突然変異による癌化に過ぎないのです。また、血栓性血小板減少性紫斑病の発因として知られているのは血栓性血小板減少性紫斑病の原因もherpesが血管の内皮細胞に感染して傷ついた内皮細胞からの出血を血小板が止めようとするのですが内皮細胞の損傷のためにherpesは血栓が多く産生されしかもherpesは殺しきれないのでいつまでも損傷が続き血小板が消費され続けて血小板減少性紫斑病も生じることがあるのです。
血管炎のすべての疾患や血管性の一群の自己免疫疾患のすべてもherpesが血管内皮細胞に感染したために発症するのです。顕微鏡的多発血管炎も腎臓、肺、皮膚、神経などの臓器に分布する小型血管(顕微鏡で観察できる太さの細小動・静脈や毛細血管)の血管の内皮細胞に感染したヘルペスが血管壁に炎症をおこし、出血したり血栓を形成したりするために、臓器・組織に血流障害や 壊死 がおこり臓器の働きが損なわれる病気です。とくに、腎臓の糸球体と呼ばれる毛細血管の塊の崩壊による腎糸球体腎炎および肺の 肺胞 を取り囲む毛細血管の壊死をともなう間質性肺炎もherpesが原因である炎症がそれら幹細胞が無い細胞に特徴的なのです。免疫の異常が病気の成り立ちに重要な役割を果たしているわけではないのです。ヘルペスと闘って炎症を起こすのは免疫が異常になったためではなく最後に残った人間の病気のすべての原因であるヘルペスとの戦いを真っ向から戦いを挑んでいるのは正常な免疫なのですがヘルペスを殺しきれないにもかかわらず様々な炎症症状は免疫がherpesを殺そうとしている時に見られる正しい戦争なのですから免疫を助けるべきなのに反対にステロイドホルモンを用いて免疫を抑制するのは正に敵であるヘルぺスに「塩」を送っているだけで、原因であるherpesを助けるだけですから永遠に治らない病気になってしまうのです。抗ヘルペス剤と漢方の煎剤を大量に投与して免役を助ければ治るのです。残念です!!!
ANCAと言う病気が巷に多く作られ一生治らない病気に仕立て上げられているので、この病気もヘルペスが原因なので説明しておきましょう。ANCAは英語でAnti-Neutrophil Cytoplasmic Antibodyで略して「ANCA(アンカ)」とよばれ訳して「抗好中球細胞質抗体」という抗体の一種ですが病名にされています。好中球細胞質は様々な細胞質の数多くの小器官から成り立っているのですがどの小器官が抗原であるかについても一言も言及されていないのですよ!さらに細胞質には人体の成分はあらゆる物体の中で最も安全なので自然免疫が発するdanger signal(危険信号)を認識することもできないどころか自分の成分のペプチドと主要組織適合抗原Ⅱ複合体(MHCⅡ)を結び付けた抗原提示細胞(APC)を自己抗体を作らせるTリンパ球に提示しても自己と認識できても敵と認識できるわけはないのです。しかもその自分を敵と認識できないT細胞がBリンパ球に同じ自己成分と自分のMHCⅡを提示されてそれに対して自己抗体ができるわけはないのです。又にT細胞は自己と非自己とを見分ける教育するのは胸腺で行われるというウソをつきそれではBリンパ球は自己と非自己とを見分ける教育は何処でされるのかは解らないとほざいている医学者はドンナ頭をしているのでしょうか?おそらく彼らは真実と嘘を見分ける頭もないのでしょうか?患者さんの病気を治す気は全く持っていない輩の集団なのでしょうか?
にもかかわらずANCAは、体内に侵入した異物ではなく、免疫の役割を果たす“仲間”であるはずの好中球を標的にしてしまう異常な抗体(自己抗体)ですというだけなのですよ!自己免疫疾患は絶対に無いについてはここを読んでください。
ANCAとは 抗好中球細胞質抗体(anti-neutrophil cytoplasmic antibody: ANCA)は、白血球の一種である好中球の細胞質内顆粒とリソソームを対応抗原とする自己抗体の総称と勝手に言われるのですが、この世には自己免疫疾患は存在しないので当然自己抗体の総称も糞も何もないのです。しかもANCAは低レベルのIgMですからBリンパ球はこの世の生命や自分自身が作る3億にも及ぶ有機物質を敵である異物と出会わなくともBリンパ球は生まれたときに膜抗体として持っているので診断価値は何もないのです。
顕微鏡的多発血管炎(MPA)、多発血管炎性肉芽腫症(Granulomatosis with polyangiitis略して GPA)、好酸球性多発血管炎性肉芽腫症(EGPA)などで陽性になる3疾患はANCA関連血管炎と呼ばれ、治療には糖質コルチコイドに加え免疫抑制剤がしばしば用いられる。糖質コルチコイドを使われる疾患のすべてはherpesが原因なのです。
多発血管炎性肉芽腫症は、以前はウェゲナー肉芽腫症と称されていた疾患でしたが現在は多発血管炎性肉芽腫症(Granulomatosis with polyangiitis略して GPA)になりました。生命誕生以来36億年かかって進化した免疫は糖質コルチコイドで無価値な36億年に堕落させられてしまいました。残念です。悲しいですね。
「腎炎」とは何でしょうか?病病原体と免疫が闘うのを炎症と言うわけですから「腎症」と言う言葉は使うべきではないのです。しかし使っている学者は腎臓の症状は「ヘルペス」であることを知らないからです。病原体であるヘルペス免疫が闘って「腎臓の炎症」、つまり縮めて「腎炎」が糸球体で起こるのです。腎臓の糸球体で起こっているので正式には「糸球体腎炎」といいます。それでは「糸球体腎炎」を起こさせる敵は何でしょうか?この世に最後に残った人類の敵である『ヘルペスウイルス』なのです。それではこのヘルペスウイルスに対して免役はどんな武器を用いているかによって腎炎を大きく二つに分けられます。IgA抗体を用いて起こる炎症をIgA腎炎と呼びます。もう一つは腎臓はIgA抗体ではなく一般に用いる武器であるIgG抗体を使って闘っているのですが「IgG腎炎」とは言わなくて単純に「腎炎」と表現しています。本来IgA抗体は粘膜抗体と言われるくらい粘膜で病原体と闘うための特殊な抗体であるのに何故糸球体と言う毛細血管の塊である糸球体で生じたのかと言う最大のかつ最後の難問にも答えを出していきましょう。
まず粘膜表面ではなくではなく血管表面で何故IgA腎炎が生じたのかの謎を解いていきましょう。何故粘膜免疫抗体であるIgA抗体が腎臓の糸球体に流れ着いてherpes性IgA腎炎が起こったかについて最後になりましたが答えを出します。
炎症の場である糸球体は四つの要素成分から構成されます。一つ目は糸球体内皮細胞、二つ目は糸球体基底膜、三つめは、糸球体上皮細胞(足細胞)、四つ目はメサンギウム細胞とメサンギウム基質、の四つです。四つの内、四つ目のメサンギウム細胞とメサンギウム基質だけが異質なのです。
一つ目の糸球体内皮細胞、二つ目の糸球体基底膜、三つめの糸球体上皮細胞(足細胞)が作る毛細血管壁は、難しく糸球体係蹄壁とも呼ばれ糸球体の濾過膜として働きます。糸球体係蹄壁は内側から糸球体血管細胞、糸球体基底膜、糸球体上皮細胞の3層からなりてっています。糸球体上皮細胞は糸球体の最も外側です。
ところが四つ目のメサンギウム細胞とメサンギウム基質は毛細血管の間を埋めるようにして毛細血管の構築がずれないように糸球体構造を保持しているのです。つまりメサンギウム細胞とメサンギウム基質は直接には糸球体の血液ろ過には関わっていないのですが毛細血管にherpesが流れ込んできたときにherpesが糸球体内皮細胞に感染してしまうと炎症が起こり始め炎症など病的な状態では,メサンギウム細胞は TNF-α,IL-1,6,8,10 などの炎症性サイトカインを分泌するのでherpes性の腎炎が起こり始まるのです。
糸球体内皮細胞は有窓で,高い血管内圧がかかり,内皮下腔とメサンギウムが交通していることから,比較的大きな蛋白分子を含む血漿成分,組織液成分の通路となっている。メサンギウム細胞はその通路の駆動役としてだけではなく貪食能を有していて,一種の浄化作用をしていることはよく知られています。メサンギウム細胞に存在するとされるFc 受容体,low density lipoprotein(LDL),adavanced glycation end products(AGE)などの受容体を介して免疫複合体や LDL,AGE を細胞内取り込みをして処理する機構もメサンギウム細胞の役割なのです。さらにメサンギウム細胞はherpes感染による病的状態下でherpesによって遺伝子を形質転換させられてしまうのです。すなわち embryonic phenotype に戻り筋線維芽細胞(myofibroblast)様細胞となり,平滑筋型α-アクチン(α-smooth muscle actin),胎児型平滑筋ミオシン(SMemb)などを発現するようになる。正常では産生しないⅠ型とⅢ型コラーゲンも産生する。
何故メサンギウム細胞は病的状態下で形質転換してしまうのでしょうか?形質転換はherpesによるメサンギウム傷害後,細胞増殖,細胞メサンギウム細胞の形質転換(transformation)を起こしてしまうのです。ヘルペスの形質転換(transformation)とは感染したヘルペスウイルスに由来するDNAをメサンギウム細胞のゲノムに取り込み、自身のDNAと組換えることにより、その遺伝的なメサンギウム細胞の性質を変化させることです。
この形質転換はメサンギウム傷害後にメサンギウム細胞外基質産生亢進により糸球体の再構築を図る修復機転とも捉えられていますが実はヘルペス感染によるものなすのです。メサンギウム細胞は糸球体の内部と糸球体の外部にもあり糸球体の外部の外基質成分は外部にあるメサンギウム細胞表面の基質受容体を介してメサンギウム細胞の phenotype(遺伝子の表現型),細胞増殖,遊走などを制御しているのです。
糸球体内皮細胞とは何でしょうか?有窓の毛細血管の内皮細胞であり内径70~100nmの多数の窓が開いておりこれより大きな血球などはろ過されません。もちろん毛細血管に流れ込んできたherpesの直径は150~200nmですから濾過されません。また陰性に荷電しているので陰性荷電物質は反発するため通りにくいのです。血中蛋白で一番多いのは血液の膠質浸透圧を維持するアルブミンですがアルブミンも陰性荷電物質ですからどんな状況でも漏れないようにするために糸球体内皮細胞は陰性荷電になっているのです。
糸球体基底膜とは何でしょうか?内径3~4nmの小孔が開いており小分子のみを通過させるので糸球体の透過性(濾過性)を左右する最も重要な構造物であります。herpesによって生ずる糸球体腎炎が進行すると糸球体基底膜が崩壊していき孔が大きくなり蛋白や血球が濾過されてしまい尿検査でも異常な血尿や蛋白尿も見られるのです。糸球体内皮細胞と同じくアルブミンを濾過できないように陰性荷電になっています。
糸球体上皮細胞(足細胞)とは何でしょうか?上皮細胞から足突起を伸ばし下の糸球体基底膜の周囲を取り巻いています。足突起間はろ過スリットと呼ばれ20~40nmの間隙が開いており足突起間同士は薄いスリット膜で繋がっています。
メサンギウム細胞とは何でしょうか?メサンギウム細胞とは腎臓の糸球体を形成する毛細血管を、内側から繋ぎ合わせている特殊な細胞で濾過に血液の濾過には直接かかわりは無いのです。
メサンギウム基質とは何でしょうか?メサンギウムはメサンギウム基質(メサンギウムマトリックス)とそれの中に埋まっているメサンギウム細胞よりなっている.メサンギウム細胞は複雑な細胞突起を出しており,突起の断面が基質の中に島状にみられる.基質は基底膜と同じ密密度(density)なので,どこまでが糸球体基底膜でどこからメサンギウム基質かわからないのです。
メサンギウム細胞とメサンギウム基質の役割は何でしょうか?メサンギウム細胞とメサンギウム基質を合わせてメサンギウム領域と言います。腎臓の血液の濾過を行う糸球体を形成する毛細血管を、メサンギウム領域は内側から繋ぎ合わせている特殊な仕事をしています。腎臓には、血液中の老廃物や塩分を濾過して尿として排出させる糸球体がある。この糸球体は、毛細血管が毛糸の球のように丸い塊となっていることから糸球体と呼ばれている。メサンギウム細胞は、糸球体の毛細血管を束ねる形で存在しており、細胞外基質とともに糸球体の構造維持に関与するメメサンギウム領域を形成しています。いわば糸球体の毛細血管の支持組織なのです。メサンギウム領域の一部は毛細血管の血流と直接触れているので、メサンギウム領域がヘルペスと闘って炎症を起こすと大きすぎて本来糸球体の小さい毛細血管の孔から濾濾できない蛋白や血球までもが尿に出てしまい尿検査でタンパク尿やタンパク尿が見られるようになってしまうのです。炎症が広範囲に広がって糸球体の毛細血管が破壊されていくと広がると腎の濾過機能が障害され、 IgA腎炎などのメサンギウム細胞が分裂増殖してしまいメサンギウム増殖性糸球体腎炎へと進行してしまうのです。
何故herpesが支持細胞であるメサンギウムに感染すると一個であったメサンギウム細胞は2個、3個、4個・・・と増えていくのでしょうか?
メサンギウム細胞は糸球体全細胞数の 30~40 %を占め,主要な細胞は,平滑筋細胞と類似したミクロフィラメント(マイクロフィラメント)をもつ収縮性のある細胞である。ミクロフィラメントとは、微小線維、微細線維とも呼ばれ、細胞内にあって、細胞の形を維持したり、形を変化させたり、細胞内の物質移動を担っている細胞骨格を構成する線維のうちのひとつです。もう一つは,メサンギウム細胞数の 5~15 %を占める貪食細胞の性格をもつ細胞である。一方,緻密斑と輸入・輸出細動脈に囲まれた傍糸球体領域にもメサンギウム細胞と形態的・機能的に同種と捉えられる細胞が存在し,糸球体外メサンギウム細胞と呼ばれている。糸球体外メサンギウム細胞とは何でしょうか?糸球体外メサンギウム細胞は遠位尿細管の緻密斑と輸入細動脈の傍糸球体細胞とともに傍糸球体装置を形成する。この糸球体外メサンギウム細胞 も輸入・輸出細動脈に囲まれた傍糸球体領域で傍糸球体メサンギウム領域と言ってよいのです。この傍糸球体装置はレニン-アンギオテンシン-アルドステロン系を通して血圧を調節する。 糸球体外メサンギウム細胞の特別な機能についてはよくわかっていないが、エリスロポエチンの分泌に関係しています。エリスロポエチンは赤血球を増やすはたらきのあるホルモンで 主に腎臓の間質線維芽細胞から分泌され、骨髄での赤血球の生産を促進させる。腎臓の間質はどこにありますか?腎臓内の糸球体や尿細管をとりまく組織を間質と呼び、この部分に炎症が起こることで腎機能低下をきたす病気を間質性腎炎といいます。間質性腎炎の原因も間質線維芽細胞に感染したherpesによるものです。
平滑筋細胞あるいは線維芽細胞に似ているメサンギウム細胞は,陥凹のある核と少量の細胞小器官であるミトコンドリア,リソソーム,リボゾーム,粗面小胞体,ゴルジ装置や,細胞骨格である豊富なアクチン線維束,ミクロフィラメント構造をもっている。細胞骨格(cytoskeleton)は、細胞を支持して安定化させる三次元ネットワークです。すべての細胞は、たとえバクテリア(細菌)でさえ、細胞骨格を持ちます。細胞骨格とはなんでしょうか?細胞骨格は、細胞の形状とその機械的特性に関り、細胞運動、細胞分裂、細胞内輸送、細胞シグナル伝達等、多くの動的な細胞プロセスが細胞骨格と連動します。そのため、細胞骨格は、いくつかの細胞質タンパク質や細胞小器官と相互作用して機能します。細胞骨格ネットワークは、フィラメントと呼ばれる3つの異なるタンパク質構造からなります。それらは、微小管、マイクロフィラメント(アクチンフィラメント、ミクロフィラメント)、中間径フィラメントの3種類です。フィラメントとは「長い繊維」と言う意味です。アクチンとは何か?アクチンは螺旋状の多量体を形成しているマイクロフィラメントの1種であるアクチンフィラメントを形作る球形のタンパク質である。このアクチンフィラメント繊維は真核生物の細胞内部で3次元の繊維状構造を作る3つの細胞骨格の中では最も細いものである。アクチンフィラメントは細胞の形を決定している。細胞質流動と、細胞分裂での収縮に関与している。マイクロフィラメントとはなにか?微小線維、微細線維とも呼ばれ、細胞内にあって、細胞の形を維持したり、形を変化させたり、細胞内の物質移動を担っている細胞骨格を構成する線維のうちのひとつ。これらのタンパク質は、相互に依存して異なる機能を果たす独自のネットワークを細胞内に形成します。アクチンのみならずミオシン,トロポミオシンなどの収縮関連機能蛋白も保有している。ミオシンは何か?アクチン上を運動するタンパク質である。ミオシンはATPase活性を持ち、ATPを加水分解しながら、-端から+端に向かってアクチンフィラメント上を移動するモータータンパク質である。2本のαヘリックスからなるコイルドコイルの構造をとり、特に筋収縮を行う上で重要な働きをしている。コイルドコイルとはタンパク質の構造モチーフの1つで、2つから7つのαヘリックスがロープのように巻いた形をしている。 コイルドコイル構造を持つタンパク質には、遺伝子発現を制御するものや転写因子など、重要な生物学的機能を持つものが多い。トロポミオシンとは何か?トロポミオシンは、アクチンの働きを調節する線維状のアクチン結合タンパク質である。トロポニン複合体が筋線維中のトロポミオシンに結合し、ミオシン結合を調節することで、筋収縮を調節している。
メサンギウム細胞は不規則な細胞突起をもち,メサンギウム基質および糸球体基底膜と連結し,内皮細胞とも接触している。また,細胞突起を血管腔内に伸ばしています。
メサンギウム細胞の発生は後腎由来の間葉系細胞が上皮細胞集団へと形質転換し,S 字状の管構造を呈する時期,S 字管陥凹部に原始毛細血管が入り込んで初期の糸球体形成が始まる。メサンギウム細胞は,この侵入した微小血管(動脈系)の周皮細胞として理解すると。メサンギウム細胞の各種機能をもち,かつメサンギウムおよび糸球体再生過程を理解するのに役立ちます。
IgA腎症の病因はなんでしょうか?IgA腎症はIgA腎炎と言うべきなのですがヘルペスウイルスが血清IgA複合体を作ってメサンメサンギウム細胞の貪欲作用によって取り込むのですがマクロファージでもないので逆にヘルペス感染を起こされてしまうのです。
IgA腎症の疫学を見てみましょう。此の疫学はどの国が一番herpesが増える社会環境であるかストレスの強い社会か、医者が病気でいかに多くのステロイドを使ってIgA腎症の原因であるヘルペスをどの国が増やすのが優れているかを示す指標になります。アッハハ!!
IgA腎症は,我が国で最も多く認められる慢性糸球体腎炎であり,成人では慢性糸球体腎炎の30%以上,小児でも20%以上を占める。日本以外には,アジア太平洋地域の諸国とフランスその他の南欧諸国でも本症が多発し,北欧や北米では比較的少ないことが知られている。発見時の年齢は成人では20歳代,小児では10歳代が多いが患者層はすべての年齢にわたっている。 1993年に至って本症の20年予後が日本とフランスから相次いで発表され、その結果は従来想定されていたよりも不良であって、 両国ともに腎生検後20年間の予後として38%前後が末期腎不全に陥ると報告された。長期予後の正確な数字を決定するためには今後も各国からの追跡調査結 果の集積が必要であるが、日本においては本症の症例数が極めて多いことと、長期予後が比較的不良であることが明らかになってきたために、今後は全国的な共通基準のもとに症例の診断、予後判断及び治療を行うことが重要であると認識されるようになった。
症状としては急性上気道感染症・消化管感染症や過労時に,褐色調(ワインレッド色)の肉眼的血尿が見られる。しかし実際は,特にわが国では学校健診や職場健診における検尿で無症候性に顕微鏡的血尿を指摘されて偶然に発見されることが最も多い(約70%)。小児期IgA腎症の約10%の症例は血尿・蛋白尿に高血圧・腎機能低下を伴う急性腎炎症候群,高度蛋白尿とその結果起こる低蛋白血症を伴うネフローゼ症候群で急性発症する。病態の進行の程度は個人によりさまざまであるが,小児,成人ともに無治療では数年から数十年で20~40%が末期腎不全へと進行するのです。
病因・病態はヘルペスがメサンギウム細胞に感染して増殖したヘルペスが糸球体の様々な細胞に感染して起こったにもかかわらず、IgA腎症の発症機序はいまだに不明な点が多いと言われていますが,ヘルペスの永続的なメサンギウム細胞の結果、IgAを主体とする免疫グロブリンが糸球体メサンギウムのIgA免疫複合体のFc部分に対するFcレセプターに特異的に結合して沈着した結果生じるヘルペス感染症がメサンギウム領域に生じてメサンギウム細胞の増殖やメサンギウム基質の増生を特徴とするメサンギウム増殖性糸球体腎炎なのです。ヘルペスがメサンギウムに感染した結果、メサンギウムの過剰産生が起こり,IgA分子の異常も加わって長い時間の中でヘルペス性IgA免疫複合体が時に生じて糸球体に運ばれて同じようにあちこちの糸球体で繰り返されてヘルペスが新たな糸球体のメサンギウムに感染が形成される。すでに説明した機序でこのherpes性IgA免疫複合体が糸球体メサンギウム領域に沈着し,メサンギウム増殖を起こし,IgA腎炎を引き起こすのです。
実は初期のIgA腎症の治療でステロイドを用いられると免疫が低下してしまうのですでに糸球体に感染しているメサンギウム細胞や他の細胞に感染してしまっているヘルペスはどんどん巨大な一本の合胞体で出来たメサンギウム細胞のギャップ結合を簡単に乗り越えてギャップ結合で仕切られた次のメサンギウム細胞に次々と感染しまくるのです。従ってIgA腎炎の治療でステロイド使用は禁忌とすべきなのです。何故ならばIgA腎炎はヘルペス感染症ですから感染症でステロイドを使いますか?????
扁桃をはじめとする病巣粘膜で抗原を認識したリンパ球がIgA抗体を産生すると考えられおり,また、IgA腎症の一部では明らかな家族内発症が見られるのは家族的に咽頭喉頭などの粘膜感染が多い家庭であるからです。
IgA腎炎の診断には腎生検が不可欠であり,蛍光抗体染色にてメサンギウム領域へのIgAの沈着が必須項目となるのは間違っています。何故ならば一回の腎生検で20本の糸球体を傷つけてherpesを周辺にまき散らすことになりIgA腎炎を人為的に進行悪化させることになるからです。
2009年に発表されたCKD(慢性腎疾患)治療ガイドラインでは,腎生検の適応として,血尿と尿蛋白/クレアチニン比0.2以上の蛋白尿がともに持続する症例,あるいは腎機能障害やネフローゼ様の高度蛋白尿を伴う急速進行例などがあげられているがIgA腎炎の診断に入りません。IgA腎炎の診断に必要なのはヘルペス感染を証明するPCRだけです。さらに治療診断となる抗ヘルペス剤の点滴治療が最高で肉眼的血尿を呈する活動’性のIgA腎症では,赤血球円柱や穎粒円柱がみられる場合が 多い。また,尿中の糸球体上皮細胞(podocyte)の存在も糸球体疾患の存在を示唆する有用な所見であり,活動性の強い糸球体腎炎では尿中への著明な脱落が認められる。血液検査所見として,血清IgA値はIgA腎炎が進行している成人例の約半数で400mg/dL以上の高値を呈するが,進行していない小児例では高値となる症例は比較的少ない。また,年齢によるIgAの基準値が異なることに考慮が必要である。ヘルペス感染症がIgA腎炎であるので腎生検の病理所見も必要がないと考えます。参考に上げておけば典型的な病理所見としてメサンギウム増殖性糸球体腎炎像を呈し,光顕PAS染色所見で,メサンギウム領域の細胞増殖および基質の増生を認めるが,小児ではメサンギウム細胞増殖が優位な場合が多い。また,活動性の強い病変では半月体形成や,急性糸球体腎炎に類似した糸球体血管内増殖’性変化を伴うことが多い。電顕所見ではメサンギウム基質への免疫複合体沈着(paramesangial deposit)を認める。蛍光抗体染色で糸球体メサンギウム領域にIgAの顎粒状沈着が認められる。IgGやC3の沈着を伴う場合が多い。IgGやC3の沈着を伴う場合が多いのはなぜでしょうか?
IgA腎炎の治療で東京女子医科大学でよく行われるのは扁桃腺摘出術+ステロイドパルス療法ですがこの治療法は大学病院でよく行われるのですが99%間違っています。
それでは何故、IgA腎症で扁桃摘出するのでしょうか?東京女子医科大学の考え方は扁桃腺を含む口腔内感染によって、IgA腎症を起こす異常なIgAが産生されると考えられており、その原因を除去するために行っているようですがこれが現在の大学病院のIgA腎炎に対する考え方です。99%間違っています。1%だけは正しいのは何故でしょうか?
腎臓が悪いのに、なぜ離れたところにある扁桃腺を摘出するのでしょうか?扁桃腺を含む口腔内感染によって、空気感染や飛沫感染でherpesが口腔内の粘膜細胞感染したために産生された粘膜でつくられた抗体であるIgA抗体が血流に流れて腎糸球体のメサンギウム細胞まで流れ着いて既になんかいも繰り返し述べたようにメサンギウム細胞にヘルペスが感染してIgA腎炎を起こしたのです。にもかかわらずに異常なIgAが産生されると考えられており、その原因を除去するために行われるのは間違いです。何故ならば異常なIgAは存在しないからです。異常なIgAが仮に存在するならばIgA腎炎は遺伝子病となります。アッハッハ!!!
IgA腎炎に対する現代の間違った治療法を向学のために勉強しておきましょう。
成人では組織学的重症度や病期により治療手段は変化する。すべての病気に対する正しい治療は病気の原因除去治療です。小児IgA腎症は学校検尿などにより比較的早期に発見され,病理所見上はメサンギウム基質の増生は少なく,メサンギウム細胞増殖が有意である。
メサンギウム基質とは何でしょうか?小児IgA腎症はメサンギウム基質の増生は少なくメサンギウム細胞増殖が有意であるのは何故でしょうか?メサンギウム基質はメサンギウム細胞外基質が正式な名称です。細胞外基質とは英語で Extracellular matrix略して ECMで基質は英語でmatrixと言います。メサンギウム細胞で作られた基質(matrix)がメサンギウム細胞の外の細胞外の空間に放出された物質の総称です。メサンギウム細胞外基質には細胞はないので基質である物質はメサンギウム細胞で作られた物質しかありません。
小児IgA腎症はヘルペスがメサンギウム細胞に感染する度合いは少ないので細胞がヘルペス感染のために崩壊するメサンギウム細胞も減るのですが細胞外マトリックスがそれほど増えないのです。ところがヘルペス感染が進行すると正常なメサンギウム細胞が減るのでメサンギウム細胞が増殖することで対応するのです。
日本小児腎臓病学会の示す小児IgA腎症治療ガイドラインでは,基質が増加し硬化性病変を形成する前の早期に治療を開始すべきとしており,病理所見上の重症度によって異なる治療を提示している)。軽症例では,漢方煎じ薬の柴苓湯やACE阻害薬による治療を,中等症以上の症例に対しては副腎皮質ステロイド薬を主体として,抗血小板薬(ジピリダモール,塩酸ジラゼプ),抗凝固薬(ワーファリン),免疫抑制薬(ミゾリビン,アザチオプリン)を組み合わせた多剤併用療法(カクテル療法)が行われますが漢方煎じ薬いがいのくすりは使用すべきではありません。 一方,成人例に多くみられる糸球体硬化や尿細管間質線維化など慢性病変の進行した例では,ACE阻害薬やアンジオテンシン受容体拮抗薬(ARB)を主体とした治療が行われる。 また,急性上気道炎,とくに扁桃腺炎の反復によりIgA腎症が惹起されるという考えに基づき,扁桃腺摘出+ステロイドパルス療法が成人例を中心に,国内の一部施設で積極的に行われているのも大間違いです。だからこそ,有効性を客観的に示す学術論文がないため国際的評価は定まっていないのは当然です。
予後
小児例,成人例とも無治療では20年の経過で20~40%前後が末期腎不全へと進展すると報告されている。しかし,特に本邦では,小児IgA腎症治療研究会が行ったランダム化比較試験から,上述の多剤併用療法が確立しており,予後が改善されている。どのように予後が改善されているかについては統計の取り方で大きな違いが出るのです。正確な統計とは一体何でしょうか?
最後に糸球体腎炎全般について現代医学の考え方や治療法について向学のために追記しておきます。
糸球体腎炎は、糸球体という小さな穴が多数あいた微細な血管でできた球状の腎組織で、それらの穴を通して血液がろ過する臓器が侵される病気です。糸球体腎炎は、むくみ(浮腫)、高血圧および尿中での赤血球の検出を特徴とします。糸球体腎炎は、感染症、遺伝性疾患、自己免疫疾患など、様々な病気が原因で発生します。診断は、血液検査と尿検査の結果に基づいて下され、場合によっては画像検査や腎臓の生検も行われます。腎機能が改善するまでは、塩分やタンパク質の摂取を控え、利尿薬や抗菌薬を服用する必要がしばしばあります。
糸球体腎炎は以下のように分けられます。
短期間で発生する急性腎炎ものや緩やかに発生し、ゆっくり進行していく慢性腎炎については急性糸球体腎炎の患者では、小児で1%、成人では10%の割合で、急速進行性糸球体腎炎と呼ばれる状態へ発展しますが、その場合には大半の糸球体が破壊され、最終的には 腎不全に至ります。
糸球体腎炎の原因は以下のように分けられます。原発性は腎臓から発生するものであり二次性は様々な病気によって発生するものです。二次性糸球体腎炎の原因になる病気には、腎臓以外の部位が侵されるものもあります。
急性糸球体腎炎は、ほとんどの場合、細菌の一種であるレンサ球菌による咽頭または皮膚の感染症(レンサ球菌咽頭炎など)の合併症として発生します。 レンサ球菌の感染後に発生する急性糸球体腎炎(溶連菌感染後糸球体腎炎)は、典型的には2~10歳の小児が感染症から回復した後に発症します。ブドウ球菌や肺炎球菌などのその他の細菌感染症、 水痘などのウイルス感染症、 マラリアなどの寄生虫感染症もまた、急性糸球体腎炎の発生につながることがあります。このような何らかの感染によって発生する急性糸球体腎炎は、感染後糸球体腎炎と呼ばれています。
急性糸球体腎炎は感染以外の原因によって起こることもあり、膜性増殖性糸球体腎炎、IgA(免疫グロブリンA)腎症、 IgA関連血管炎、 全身性エリテマトーデス、 クリオグロブリン血症、 グッドパスチャー症候群、 多発血管炎性肉芽腫症などが挙げられます。急速進行性糸球体腎炎に発展する急性糸球体腎炎は、そのほとんどが異常な免疫反応に関係した病態によって発生したものです。
慢性糸球体腎炎の多くは、IgA腎症や膜性増殖性糸球体腎炎など、急性糸球体腎炎の原因である一部の病態から発生すると考えられています。ときには、急性糸球体腎炎が治癒しないまま、長期化(慢性化)する場合もあります。慢性糸球体腎炎はまた、遺伝性の病気である 遺伝性腎炎が原因で引き起こされることもあります。しかし多くの場合、慢性糸球体腎炎の原因は特定できません。(勿論原因はヘルペスが糸球体に感染したためです。)
糸球体腎炎の主な原因を一覧表にしておきます。
| ・感染症 ・細菌感染症(レンサ球菌、 ブドウ球菌、 肺炎球菌など) ・真菌感染症 ・寄生虫感染症(マラリアなど) ・ウイルス感染症(B型肝炎、 C型肝炎、 HIV感染症など) ・血管炎(血管の炎症) ・クリオグロブリン血症 ・好酸球性多発血管炎性肉芽腫症 ・多発血管炎性肉芽腫症 ・顕微鏡的多発血管炎 ・免疫疾患 ・グッドパスチャー症候群 ・全身性エリテマトーデス ・その他の原因 ・遺伝性腎炎 ・薬剤(キニーネ、ゲムシタビン、マイトマイシンC、特定の化学療法薬など) |
| HIV = ヒト免疫不全ウイルス。 |
糸球体腎炎の症状については急性糸球体腎炎の人の約半数では、何の症状もみられません。症状がみられる場合は、体内への水分の蓄積によるむくみ(浮腫)、尿量の減少、血液の混入による尿の黒色化などが最初に認められます。浮腫は最初のうちは顔面やまぶたのむくみとして現れることが多いものの、その後は脚のむくみが目立つようになります。腎機能が低下してくると、血圧の上昇がみられるようになります。眠気や混乱が起こる場合もあります。高齢者では、吐き気や全身のだるさ(けん怠感)といった特徴のない症状の方が多くみられます。
急速進行性糸球体腎炎では、筋力低下、疲労および発熱が最もよくみられる初期症状です。そのほかに食欲不振、吐き気、嘔吐、腹痛、関節痛などもみられます。約50%の患者は、腎不全を発症する1カ月ほど前にインフルエンザに似た症状を経験しています。このような人では、浮腫がみられるほか、通常は尿がほとんど出なくなります。高血圧になることはまれで、みられたとしても重度の高血圧が起こることはめったにありません。
慢性糸球体腎炎では、ごく軽微な症状しか生じないのが通常であるため、ほとんどの人は病気に気づかないまま長期間が経過します。浮腫がみられることがあり、 高血圧はよくみられます。この病気は腎不全に進行することがあり、その場合はかゆみ、食欲不振、吐き気、嘔吐、疲労、呼吸困難などが生じます。
糸球体腎炎診断については血液検査と尿検査と腎生検の三つがあります。
急性糸球体腎炎を疑わせる症状がみられた場合、医師はこの病気の可能性を検討します。また、臨床検査の結果から腎機能障害や血尿の可能性が示唆された場合にも医師はこの病気の可能性を検討します。臨床検査では、尿中にタンパク質と血球が様々な量で検出されるほか、しばしば腎臓の機能障害が老廃物である尿素およびクレアチニンの血中濃度の上昇として 確認されます。
急速進行性糸球体腎炎では、尿のサンプルを顕微鏡で観察すると、しばしば赤血球や白血球が凝集した尿円柱が確認されます。血液検査では、通常は 貧血が認められます。糸球体腎炎が疑われる場合は、通常は 腎生検を実施して診断を確定するとともに、原因を調べ、瘢痕化の程度と治癒の可能性を判定します。腎生検では、超音波検査またはCT(コンピュータ断層撮影)検査の画像を見ながら、片方の腎臓に針を刺して、腎臓の組織を少量だけ採取します。腎生検は体に負担をかける侵襲性の高い検査であり、ときに合併症が発生する可能性がありますが、通常は安全な検査法です。
慢性糸球体腎炎は徐々に発症するため、正確な発症時期を特定できない場合があります。健診の一環として行われた尿検査において、腎機能は正常で何の症状もみられない健康そうな人の尿にタンパク質や血球が検出され、慢性糸球体腎炎と判明する場合もあります。通常は腎臓の画像検査である超音波検査、CT検査などが行われます。
慢性糸球体腎炎とそれ以外の腎疾患を鑑別する上では、腎生検が最も信頼性の高い検査法です。ただし、進行した段階では生検はめったに行われません。このような場合には、腎臓の組織が萎縮して瘢痕も形成されているため、原因の特定につながる情報を得られる可能性が低くなるからです。腎機能が不良な状態が長期間続いていて、画像検査で腎臓が異常に小さく見える場合には、腎臓の萎縮と瘢痕の形成が疑われます。
糸球体腎炎の原因の特定についてはこのほかにも原因の特定に役立つ検査があります。例えば感染後糸球体腎炎の診断では、のどの粘液を用いた培養検査(咽頭培養検査)で、レンサ球菌の感染を証明することができます。レンサ球菌に対する血液中の抗体の量が正常値よりも高くなっていたり、数週間にわたって継続的に増加したりする場合があります。レンサ球菌咽頭炎以外の感染症に続いて発生する急性糸球体腎炎では、感染症の症状が残っているうちに急性腎炎症候群の症状が現れる場合が多いため、その診断は比較的容易です。ときには診断を確定するために、感染症の原因菌を特定するための培養検査と血液検査が必要になることもあります。
糸球体腎炎の原因として自己免疫が疑われる場合、自己抗体(自身の組織の一部に向けられた抗体)について血液検査を行うとともに、補体系(身体の免疫系に関与しているタンパク質のシステム)を評価する検査も実施します。(自己免疫疾患は存在しないので無駄な検査です。)
予後であるこれから先の経過の見通しについては溶連菌感染後急性糸球体腎炎は、ほとんどが完全に治癒し、小児では特にその可能性が高いものの、小児の約1%と成人の10%では 慢性腎臓病の発生につながります。
急速進行性糸球体腎炎の予後である経過の見通しは、糸球体組織の線維化の程度と基礎疾患である感染症などが治療可能かどうかによって変わります。早期の数日から数週間以内に治療が行われた場合には、腎機能が保持され、透析は必要ないことがあります。しかし、初期症状が軽微で漠然としているため、急速進行性糸球体腎炎の人のほとんどは、背景にある病気である基礎疾患に気づくことなく、腎不全に発展するまで医療機関を受診しません。
治療の開始が遅れれば、腎不全を伴う 慢性腎臓病に発展する可能性がより高くなります。腎不全は気づく前に進展している傾向があるため、急速進行性糸球体腎炎では、80~90%の人が 透析に依存することになります。予後は、原因、年齢、別の病気の有無などの要因によっても変わります。原因不明の場合と高齢の場合には、予後はあまりよくありません。(原因不明の場合と高齢者の場合の原因はヘルペスです。)
急性糸球体腎炎から完全に回復しない小児および成人の一部では、 無症候性タンパク尿・血尿症候群や ネフローゼ症候群などの別の種類の腎疾患が発生することがあります。また急性糸球体腎炎から慢性糸球体腎炎に移行することもあり、特に高齢者で多くみられます。
糸球体腎炎の治療については原因疾患の治療と急速進行性糸球体腎炎には、免疫機能の抑制と慢性糸球体腎炎には、アンジオテンシン変換酵素(ACE)阻害薬またはアンジオテンシンII受容体拮抗薬(ARB)と食塩摂取量の制限の三つがあります。
急性糸球体腎炎については多くの急性糸球体腎炎では、病気そのものに対する特別な治療法はありません。可能であれば、糸球体腎炎を引き起こしている病気を治療します。腎機能が回復するまで、タンパク質とナトリウムを制限した食事療法が必要になります。また腎臓で過剰なナトリウムと水分が排泄されるようにするため、利尿薬が処方されることもあります。高血圧がみられる場合は治療が必要です。
急性糸球体腎炎の原因として細菌の感染が疑われる場合、腎炎は感染の1~6週間後(平均2週間後)に発症し、それまでに感染症は治癒していることが多いため、抗菌薬は通常効果がありません。ただし、急性糸球体腎炎と診断がついた時点でまだ細菌感染症の症状が持続している場合は、抗菌薬療法が行われます。原因がマラリアである場合は、抗マラリア薬の使用が有益です。
糸球体腎炎を引き起こす自己免疫疾患の一部は、コルチコステロイド、免疫抑制薬、またはこれらの薬剤の併用により治療します。(自己免疫疾患は存在しませんからすべて間違いです。自己免疫疾患の原因はヘルペスですから抗ヘルペス剤と漢方煎じ薬で治ります。)
急速進行性糸球体腎炎の治療については急速進行性糸球体腎炎の場合は、速やかに免疫抑制薬の投与が開始されます。通常は高用量でのコルチコステロイドの静脈内投与を約1週間継続した後、内服薬に切り替えます(内服薬の服用期間は人によって様々です)。免疫抑制薬のシクロホスファミドを投与する場合もあります。さらに、血液中の抗体を取り除くために血漿交換が行われる場合もあります。治療を早く開始するほど、腎不全に進行する可能性や透析の必要性は少なくなります。腎不全を伴う慢性腎臓病に移行した人には、ときに 腎移植が検討されますが、移植された腎臓で急速進行性糸球体腎炎が再発する場合もあります。
慢性糸球体腎炎の治療についてはACE阻害薬とARBのどちらかを服用することで、しばしば慢性糸球体腎炎の進行を遅らせることができ、血圧が低下して尿中へのタンパク質の排泄量が減少する傾向がみられます。血圧を下げることとナトリウムの摂取量を減らすことも有益であると考えられています。またタンパク質の摂取量を制限することが、腎機能の低下を遅らせるのにある程度有用です。末期腎不全は 透析か 腎移植で治療します。
