いつものごとく詳細に書き加えていくうちに長文になったので何分割に区切っています。以下にリンク先を貼っておきます。
「アミロイドーシスの原因はすべてヘルペス感染によって溶解感染のために崩壊して壊死してしまった細胞のあらゆる蛋白質の最終的なゴミがアミロイドです。Part2」
「アミロイドーシスの原因はすべてヘルペス感染によって溶解感染のために崩壊して壊死してしまった細胞のあらゆる蛋白質の最終的なゴミがアミロイドです。Part3」
アミロイドの本体は何でしょうか?クロスβ構造を持つタンパク質が繊維状に重合したアミロイド線維である。クロスβ構造とはアミロイド線維を形成するポリペプチド鎖が,線維軸と垂直方向にβ鎖構造をとり,さらに線維軸方向にβシート構造が連なり,互いに水素結合で結合して紙を細く折りたたんだような構造をクロスβ構造という.重合とは一種類または二つ以上の単位物質の分子が、化学的に結合して、元のものより分子量の大きい化合物をつくることです。それではアミロイドーシスとアミロイド線維との違いは何でしょうか?一般的なアミロイド線維に認められる特徴的な構造がクロスβ構造なのですが、このアミロイド線維と言われる微細繊維に重合した異常構造タンパク質が沈着した臓器に障害が引き起こされる一群の疾患群をアミロイドーシスと言うのです。ところが「クロスβ構造を持つタンパク質が不溶性の繊維状に重合したアミロイド線維」がなぜ生じるのかについては誰も知らないのです。実はヘルペスウイルス感染による細胞壊死によるものなのです。
アミロイド線維が全身の臓器に沈着する全身性アミロイドーシスと、ある臓器に限って沈着する限局性アミロイドーシスの二つに分けますが二つに分ける意味は全くありません。というのは限局性アミロイドーシスも免疫が低下するとヘルペスの感染が徐々に全身に波及して最後は全身性アミロイドーシスになるのです。
全身性アミロイドーシスとは何でしょうか?全身性アミロイドーシス(amyloidosis)は線維構造をもつ蛋白質であるアミロイドが、全身臓器に沈着する ことによって機能障害を引き起こす一連の疾患群です。アミロイドは正常な蛋白の構造が無くなり不溶性のガラクタの線維の蛋白になり、正常な人体の如何なる強力な分解酵素でも処理できない人体の産業廃棄物になってしまうからです。ちょうど「永遠の化学物質」である何千年も分解されず発がん性もある焦げ付かない有機フッ素化合物(PFAS)に似ています。フライパンや撥水スプレーなど、生活の身近で便利に使われてきた有機フッ素化合物(PFAS)。この有機フッ素化合物(PFAS)が米軍基地や工場から流出し、沖縄、東京、大阪のみならず全国の水がPFAS によって汚染しているのです。同じように人体でも免疫を抑制することで増えすぎたherpesによって細胞が汚染されてアミロイドーシスと言う原因不明の病気が蔓延しているのです。勿論癌もherpesが作った病気なのです。(癌についてはここを読んでください。)
全身性ALアミロイドーシスは、治らない病気です。完全に治ることが難しい病気ですが、免疫を抑えて治療効果が得られれば長期間のコントロールが可能で、 治療により、症状を改善し、病状の落ち着いたより良い状態(寛解状態)を保ちながら、治療の効果がみられることを『奏効』といいますが、病気と付き合うことが大切ですと言われていますが「病気と付き合うことが大切です。」とは医者が言うべき言葉ではありません。免疫を抑えれば症状は消えますが原因であるヘルペスは増えるばかりで最後には癌となってしまうのです。哀しいですね。
全身性アミロイドーシスの代表的なものとしては、 ①免疫グロブリン性アミロイドーシス(AL アミロイドーシス)。ALアミロイドーシスのALの「A」はアミロイド(Amyloid)、「L」は免疫グロブリン軽鎖(light chain)の頭文字からとった名前です。骨髄でBリンパ球が成熟するときに感染したヘルペスが異常なBリンパ球に変えてしまい異常なリンパ球が作る免疫グロブリン軽鎖由来のアミロイドが全身諸臓器に沈着して機能障害を生じる病態である。 沈着臓器は主として腎臓、心臓、肝臓、消化管、神経であるが、全身のどの臓器も障害されうる。つまり骨髄の中にある白血球の一種からできたherpesが感染した形質細胞が異常なタンパク質である免疫グロブリン軽鎖を過剰につくり出すことが原因となります。②野生型トランスサイレチンアミロイドーシス、遺伝子変異によらないもの(野生型)は、多くは加齢に伴うものでherpesが感染した様々な細胞がherpesの増殖によって機能が破壊されて、細胞の蛋白がアミロイドになってしまって「老人性全身性アミロイドーシス」となるのです。③遺伝性トランスサイレチンアミロイドーシス、常染色体優性遺伝するといわれ日本の集積地では20~40歳代が多いと言われていますが常染色体優性遺伝であれば生まれた時から発現しているはずですから先天的な常染色体優性遺伝ではなく20歳ころに感染していたヘルペスが後天的に遺伝子を突然に組み替えて起こしたので、ヘルペス性後天的常染色体突然優性組換え遺伝子病と言うべきなのです。④AAアミロイドーシス、AAアミロイドーシスは,血清アミロイドA(SAA)というタンパク質から作られるアミロイドが様々な臓器に沈着する病気です. 原因はherpesによる関節リウマチなどによる慢性の炎症が長期間持続することが原因です.ヘルペス性の炎症によってたくさんのSAAが肝臓から血液中に分泌され,破壊された細胞からアミロイドが形成されて全身臓器に沈着します.⑤透析(Aβ2M)アミロイドーシス。Aβ2Mアミロイドーシスは,アミロイドベータ2ミクログロブリン(Aβ2m)というMHC1タンパク質のガラクタから構成されるアミロイドが様々な臓器に沈着する病気です.ベータ2ミクログロブリンはベータ2マイクログロブリンともいわれます。 原因は長期間の透析が原因です。というのは免疫に関わるMHC1タンパク質の Aβ2mは透析で除去される物質の中ではもっとも大きいものの一つなので透析で除去されにくいため,血液中のβ2mの濃度が高くなり,アミロイドを形成して沈着します.しかもそもそも透析が必要な腎不全の原因は腎臓に感染したヘルペスですからherpesと闘うために免疫に関わるMHC1タンパク質の Aβ2mは作られ続けられますから透析(Aβ2M)アミロイドーシスは透析が長期になればなるほど透析患者さんには必発の「透析アミロイドーシス」となるのです。因みに、透析患者の現状 については現在、国内の透析患者数は30万人以上です。 透析アミロイド症の症状は透析開始から10年で患者の2〜3割、20年を超えると半数以上に現れます。 長期透析患者さんの増加とともに、透析アミロイドーシスによる合併症が益々大きな問題になってきているのです。
トランスサイレチンはトランスサイレチンまたはトランスチレチンは、甲状腺ホルモンサイロキシンとレチノールを肝臓へ運搬する血清または脳脊髄液中の運搬体タンパク質である。トランスサイレチンという名称は、トランスは「運搬」でありサイロキシンのサイロとレチンはレチノールのレチを結合したのです。トランスサイレチンは肝臓から血中へ分泌され、脈絡叢から脳脊髄液へ分泌されます。従ってトランスサイレチンの役割は、主に肝臓で作られ、脳脊髄液や血液に乗って、甲状腺ホルモンである「サイロキシン」や、ビタミンAである「レチノール」を、体の必要な部分に運搬する役割を担っています。
一方、限局性アミロイドーシスとしては、①アルツハイマー病、②脳アミロイドアンギオパチー、③プリオン病などの脳アミロイドーシスが代表的ですがすべてヘルペスが原因なのです。これらの全身性アミロイドーシスや限局性アミロイドーシスがどのように何故ヘルペスウイルス感染による細胞機能不全や細胞壊死によって生じるのかを詳しく説明していきましょう。須らく病名などは全くどうでもいいのです。現代の医療の最終目的は「すべての現代の病気の原因がherpesである事を認めて」かつ「病気を治すこと」です。現代の病気の原因はワクチンを作れないherpesなのです。

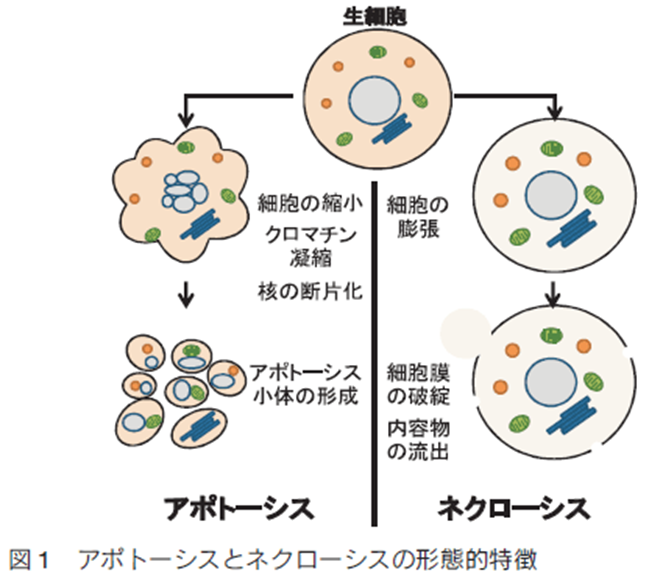
ネクローシス(壊死)とアポトーシスの違い。アポトーシスの訳は「管理・調節された遺伝子に組み込まれた細胞の自殺」つまり「遺伝子にプログラムされた細胞死」です。
ネクローシス(necrosis) とは、身体の一部分を構成する細胞・組織・器官等の死を指す語であり、ネクローシス(壊死)による細胞死の形態的特徴として、細胞核の崩壊をはじめとする細胞内小器官を構成する膜の崩壊、細胞の膨化、細胞膜の破壊などです。ヘルペスウイルス感染、物理的破壊、化学的損傷、血流の減少などによって細胞膜の破壊、内容物の漏洩が起こります。病原体であるヘルペスウイルス感染による壊死は組織の炎症の原因となり様々なアミロイドーシスや神経変性疾患などの後遺症を起こします。血流減少によるものを特に梗塞と呼ぶ。高温、毒性物質、酸素欠乏、栄養欠乏など、非生理学的な要因で細胞が破壊し、herpesによる炎症を伴う細胞融解が起きる現象はherpes性細胞融解として有名なネクローシスです。
一方アポトーシス(プログラムされた細胞死)も細胞の死ですが、幹細胞をもっている血球、皮膚、消化管の粘膜上皮のように寿命が決まっている幹細胞をもった細胞や、組織が補充され機能的な障害において見られる、組織学的異常を残さない死で後遺症も残さない遺伝子に支配された自然で納得の死です。このように遺伝子に制御された細胞除去機能による細胞死の様式はアポトーシスと呼ばれ、ネクローシスとは全く異なります。
20 世紀の後半に入って、多細胞生物が正常な発生や恒常性の維持のために、必要に応じて特定の細胞を細胞死に導く機構を備えている「プログラムされた細胞死」が発見され、“アポトーシス” という言葉が生まれました。
アポトーシスとネクローシス
アポトーシスとネクローシスの最も重要な違いは、アポトーシスがプログラムされた細胞死で、ネクローシスがプログラムされていない細胞死という点です。言い換えれば、アポトーシスは制御可能であるが、病原体であるヘルペスウイルスの炎症によるネクローシスは制御困難なのです。というのはherpesに無理やり細胞を融解されて殺されてしまうからです。
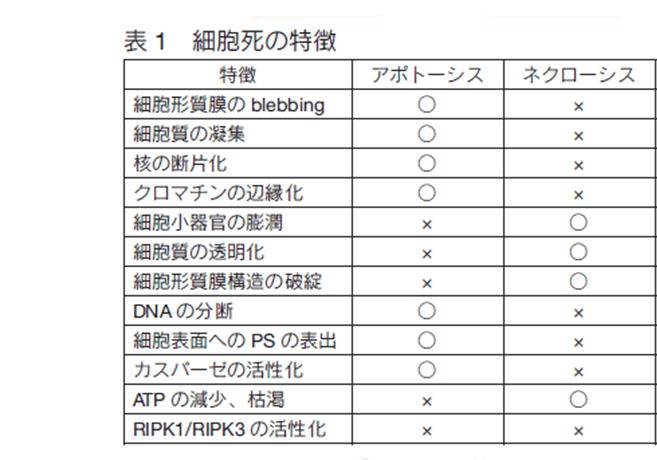
アポトーシス細胞は、細胞膜表面の突出(blebbing)、細胞質の凝縮、核の断片化、そして核のクロマチンの辺縁化などがみられる。ネクローシス細胞では、細胞小器官の膨潤、細胞質の透明化、核の凝縮、そして細胞膜の破綻などが観察される。これら形態学的な特徴に加えて、生化学的、細胞生物学的アプローチにより、アポトーシスとネクローシスの特徴が明らかにされている。
アポトーシス細胞では、 DNA の分断、細胞膜表面へのホスファチジルセリン(PS)の表出、そして種々のカスパーゼの活性化がおこる。カスパーゼ(Caspase)とは何でしょうか?カスパーゼ(Caspase)とは、細胞にアポトーシスを起こさせるシグナル伝達経路を構成する、一群の蛋白分解酵素であるシステインプロテアーゼである。 システインプロテアーゼは活性部位にシステイン残基をもつタンパク質分解酵素であり、カスパーゼは基質となるタンパク質のアスパラギン酸残基の後ろを切断する。さらにネクローシス細胞では細胞内の ATP が減少するが、アポトーシスでは減少はない。
しかし細胞の中に特殊な膜構造体が形成される場合があることが判明した。これをオートファゴソームと名づけて、オートファゴソームが形成される細胞死をオートファジー(autophagic cell death)と呼ぶようになった。オートファジーもまたプログラムされた細胞死として認められている。
オートファジーとは何でしょうか?オートファジーの役割は、飢餓状態を生き抜くために自己消化することで栄養源を確保していると一般には理解されていますが、通常の環境下でもユビキチン・プロテアソーム系と並んで、細胞成分の代謝に働いていることがわかっています。
プロテアソームとは何でしょうか?真核生物の細胞内には進化的に保存された二つのタンパク質分解系、ユビキチン・プロテアソームシステム(UPS)とオートファジー・リソソームシステムが存在している。UPSは選択的タンパク質分解を担う中心的な酵素系であり、一方、オートファジー・リソソームシステムは一般に非選択的なタンパク質分解を担っているが、最近障害されたタンパク質凝集体、異常・過剰オルガネラ、細胞内に侵入した細菌等を特異的に排除する選択的オートファジーが注目されている。プロテアソームは、ユビキチン化されたタンパク質を選択的に分解する巨大で複雑なタンパク質分解酵素複合体である。ユビキチン化されたタンパク質の除去により、細胞周期・アポトーシス・シグナル伝達・転写制御・品質管理・シナプス可塑性などに関与する。これらの破綻により異常タンパク質の細胞内蓄積を来たし、神経変成疾患の発症につながる。
ユビキチンプロテアソーム系とは何ですか?英語でUbiquitin(Ub)-Proteasome(PSM)系ユビキチンプロテアソームシステムと言います。Ubiquitin(Ub)-Proteasome(PSM)系は、タンパク質に付加(目印)されたUb(ユビキチン)鎖をPSM(プロテアソーム)が認識し、ATP依存的で迅速かつ不可逆に標的タンパク質を分解するシステムです。ユビキチンとはユビキチンがついたタンパク質は、巨大酵素「プロテアソーム」へと運ばれます。 そこでタンパク質はアミノ酸へと分解され、新しいタンパク質の原料としてリサイクルされるのです。つまり ユビキチンという目印がついたタンパク質をプロテアソームが食べて、小さいアミノ酸へと分解するのです。 このアミノ酸は新しいタンパク質へと再生される。
プロテアソームがユビキチン化されたタンパク質を標的として選択的に分解するのに対し、オートファジーでは細胞内で取り込んだ空間をまるごと消化するため、オートファジーはバルク(巨体)分解系と呼ばれています。また、ミトコンドリアやペルオキシソームなどの細胞小器官をオートファジーによって選択的に分解する機構が存在します。その分解機構は総じて「選択的オートファジー」と呼ばれ、ミトコンドリア(マイトコンドリアを選択的に分解する機構を特に「ミイトファジー(マイトファジー)」、ペルオキシソームの選択的分解を「ペキソファジー」と呼びます。
ペルオキシソームとは何でしょうか?ペルオキシソーム( per-oxisome)はほぼ全ての真核細胞が持つ細胞小器官で、多様な物質の酸化反応を行っている。一重の生体膜に包まれた直径0.1-2マイクロメートルの器官で、多くは球形を成す。哺乳類の細胞では数百から数千個が一細胞内に存在する。環境や細胞によって必要とされる機能が異なるため、数、大きさ、構造等様々に異なる。ペルオキシソームの関わる代謝経路には、超長鎖脂肪酸のベータ酸化、コレステロールや胆汁酸の合成、アミノ酸やプリンの代謝などが知られ、これらは内腔に含まれるオキシダーゼ(酸化酵素)によって行われる。オキシダーゼの働きによって活性酸素の一種である過酸化水素が発生するが、これは同様に内腔に含まれるカタラーゼによって分解される。
オートファジーは細胞が飢餓条件下におかれると、細胞質に隔離膜と呼ばれる扁平な小胞が現れます。この極めて重要な隔離膜がどのように出現し、また膜成分が供給されるのかはいまのところわかっていません。その後、膜は細胞質を取り込みながら伸長し、先端どうしが融合して、オートファゴソーム(AP)が形成されます。オートファゴソーム( AP)内にはミトコンドリアなどの大きなオルガネラも含まれます。APがリソソームと融合すると、内包物は分解されます。自己消化で得られたアミノ酸は栄養源として再利用されます。オートファゴソームの研究でノーベル賞をもらった大隅良典らは、オートファジー関連遺伝子群( Autophagy related gene : APG/ATG) のクローニングに成功しました。
アミロイドーシスとは何か? アミロイドーシスは,異常凝集したタンパク質から成る不溶性線維の細胞外蓄積を特徴とする多様な疾患群である。これらのタンパク質は局所に蓄積してほとんど症状を引き起こさない場合もあるが,全身の複数の臓器に蓄積して,重度の多臓器不全をもたらすこともある。アミロイドーシスは原発性の場合と,種々の感染症,炎症,または悪性疾患に続発する場合とがある。診断は罹患組織の生検によるが,アミロイド原性タンパク質の病型の判別には種々の免疫組織学アミロイドーシスとは何か? アミロイドーシスは,異常凝集したタンパク質から成る不溶性線維の細胞外蓄積を特徴とする多様な疾患群である。これらのタンパク質は局所に蓄積してほとんど症状を引き起こさない場合もあるが,全身の複数の臓器に蓄積して,重度の多臓器不全をもたらすこともある。アミロイドーシスは原発性の場合と,種々の感染症,炎症,または悪性疾患に続発する場合とがある。診断は罹患組織の生検によるが,アミロイド原性タンパク質の病型の判別には種々の免疫組織学的および生化学的手法が用いられる。治療はアミロイドーシスの病型によって異なる。
素因となる炎症性疾患としては以下のものがある。素因とはもととなる原因。根本的な原因。ここではアミロイドーシスになる元になる病気を以下に5つ列挙するとヘルペスが原因である4つ自己免疫疾患と5つめは家族性地中海熱などの遺伝性周期熱症候群と間違って遺伝性と言われている実はherpesが原因である周期熱症候群です。遺伝によって熱が出るという病気はあり得ません。何故ならば発熱のメカニズムは遺伝とは全く関係がないからです。この遺伝性周期熱の原因もherpesです。外因性発熱と内因性発熱のメカニズムについてはここを読んでください。
- 関節リウマチ
- 若年性特発性関節炎
- クローン病
- キャッスルマン病
- 家族性地中海熱などの遺伝性周期熱症候群
これらの疾患で産生されるまたは腫瘍細胞により異所性に分泌される炎症性サイトカイン(例,インターロイキン1[IL-1],腫瘍壊死因子[TNF],IL-6)は,ヘルペスと免疫との戦いで肝臓でCRPや血清アミロイドA(SAA)などが合成される炎症性の急性期反応タンパクなのです。CRPとはC反応性蛋白(C-reactive protein、略してCRP)は、環状の5量体タンパク質であり、体内で病原体であるヘルペスによる炎症反応や組織の破壊が起きているときに血中に現れ急性期反応タンパクの一つです。肺炎球菌のC多糖体やと結合するためこの名がありますが、ヘルペスウイルスとも結合します。アミロイドA蛋白(SAA)とは、分子量約12,000の、ヘルペス感染があると主に肝細胞で合成される急性期タンパク質の一種であります。ヒトのSAA遺伝子には、現在まで少なくともSAA1~SAA4までの4種類が知られている。 SAA検査では、SAA1とSAA2のタンパク質が同時に測定されます。 両者は構造が非常に類似しており、相同性は約95 %であるからです。SAAとCRPの違いはSAAは、その鋭敏度、増幅の程度からCRPと並ぶ第一級の急性期蛋白として的確に炎症活動性を反映します。 SAAは、一般的傾向としてCRPに比べて種々の疾患、とりわけヘルペス感染で感度が高く、一般的にCRPの上昇程度が低いウイルス感染症、自己免疫疾患と嘘で言われている実はヘルペス感染であるSLEなどで良好な反応を示すのは当然です。
自己免疫疾患は自分の免疫が自分の成分を敵とみなすことはできないのでしかも人間は病原体ではないので炎症は絶対起こらないのでSLEという病気ではSAAやCRPという急性の炎症性の蛋白が肝臓で作られて増加することは絶対に無いのです。現代の医学は嘘が満ち溢れすぎます。資本主義でも人の命は金よりもどんなものよりも大切なのに心が痛みます。
悲し過ぎます。世界中には80億人の中に2000万人近くの医者がいるのですが現代の医療は間違いだらけであることを知っているのですが誰も口にしません。私のような15歳からherpes脳炎で阿呆になった人間でも自分の病気を治すために阿保になっても頑張って医者になって自分が持っている数多い病気の原因はすべてherpesであることを自分が見つけて抗ヘルペス剤も漢方煎じ薬も大量に服用して100歳まですべての病気を治せる医療を赤字でもやり続けるつもりです。最後に残ったすべての病気の原因はワクチンがつくれないherpesである事を知ってしまったのです。この病気の真実を他のまともな賢い医学部の大学の教授が知らないと思いますか?知らないはずはないのです。偉い医者たちは間違いに気が付いているのですが言えないのです。何故でしょうか?自分で考えてください。残念ですね。悲しですね。患者が治せない病気、つまり私が治せない病気、つまり原因が不明な病気はこの世には何もないのです。癌もherpesが遺伝子を癌化させるだけですが癌が見つかった時には何百億個いや千億以上にも増えているのみならず癌細胞を増やし続けるherpesも無限に増えるので抗ヘルペス剤で増殖を抑えることや免疫を上げるだけでは癌完治は不可能です。が、ロイアルレイモンドライフ博士の「癌光周波数治療」で癌ウイルスであるヘルペスウイルスを殺せば100%たちどころに完治させることが出来ます。ロイアルレイモンドライフ博士についてはここを読んでください。しかもすべて現代の病気の原因のすべてはherpesですからこの世から完全に病気が無くなってしまうのでこの世は「天国」となるのですが医薬業界はこの世の「地獄」になってしまうでしょう。この論文も難病の一つであるアミロイドーシスのあらゆる症状も偉大な免疫が憎きherpesと闘っている人間の命を医者から守るための神々しい姿であることを証明しようとしているだけなのです。しかもヘルペスは人間の命を奪うという阿呆なことは絶対にしないのです。その証拠はいまだかって人の死は「ヘルペス感染症による死」である死に方をいまだかつて耳にしたことが無いでしょう!!!!!!!herpesに癌以外の病気で殺された人は誰もいないのです。皮肉なことに癌死はherpesがもたらすのですが免疫を抑える薬が生み出した最後の病気ともいえるのです。皆さん免疫を抑えすぎると最後は遅かれ早かれherpesによる癌で死ぬことになるのです。
全ての病気にかかりたくなければ心にストレスをかけないように免疫を抑えないように常に心がけるべきです。なぜ全ての現在残っているすべての病気の原因はヘルペスであるのに癌だけが人間の命を奪い取ってしまうのでしょうか?さらに何故他のすべての病気の原因もherpesであるのに絶対に死なないのでしょうか?答えは極めて簡単です。生死を決めるのは遺伝子です。正常な遺伝子が無くなればなくなるほど死に近づきます。不死化した異常な遺伝子を持った癌細胞は無限に増えて正常な細胞の機能を果たせなくなっていくどころか、増えた癌細胞は他の組織に転移してその組織ですごいスピードで増え続けて正常な細胞の何倍も多くなり多くなった癌細胞に住んでいるヘルペスも増えてある多くなった転移した組織の細胞の遺伝子に侵入して癌化させて新たなる癌細胞に仕立ててしまうのです。その結果その組織の細胞も癌になってしまうとその組織の細胞の正常な機能を奪い取ってしまう悪循環が繰り返されるのです。
このように癌細胞が癌細胞である所以は癌細胞を転移させて自分の癌細胞だけを増殖させるだけでなく転移した組織の正常な細胞も癌化させてしまうことです。同時に正常な細胞の機能もなくなってしまうのです。一方他のすべての病気の原因となっているヘルペスは感染した細胞の遺伝子を変えても、癌細胞の様に不死化させて無限に増殖させることは一切ないからせいぜいその細胞の正常な機能を奪い取るだけなのです。
人の遺伝子は総計で23500個ありますが癌化にかかわる癌関連遺伝子はそのうち800個ありますがこの遺伝子がヘルペスによって突然に癌化してしまい無限に増え続ける異常な癌細胞を死ぬまで増やし続けるのは癌細胞だけであるのです。しかも癌細胞だけはherpesは生命の根源である遺伝子を人を死に追いやる突然変異をおこし続ける異常細胞が永遠に増え続けるので命を守る正常な遺伝子がどんどん少なくなって最後の最後はherpesが作った癌細胞の遺伝子異常か心臓を正常に拍動させる自律神経の神経節に感染したヘルペス性心不全でこの世からおさらばせざるを得なくなるのです。人が癌で死ぬことは結局は癌の原因であるherpesが無限大に増えて自律神経の神経節にも感染して心臓を止めてしまうからです。ヘルペスが感染して癌関連遺伝子を突然変異させなければたとえ他の遺伝子が変異しても死ぬことは絶対ないのです。だからこそあらゆる病気に用いられるステロイドを止めさせて免疫のリバウンドを乗り越えさせ自分の免疫であらゆる難病を治すことができたのです。免疫のリバウンドで人は絶対に死ぬことはありません。免疫こそ人の命を救う力があるのです。
アミロイドーシスの要点
①アミロイドーシスは,特定のミスフォールディングタンパク質が凝集して不溶性の線維となり,それらが臓器に沈着して機能障害を引き起こす疾患群である。特定のミスフォールディングタンパク質とは何でしょうか?ミスフォールドとは タンパク質が折りたたまれる過程で特定の立体構造をとらず、生体内で正しい機能や役割を果たせなくなることです。特定の蛋白とは線維性タンパク質がヘルペスが感染した細胞で増殖しすぎてウイルス感染細胞から子孫ウイルスであるビリオンが細胞外に放出されるときに細胞が崩壊してしまう溶解感染に際して線維性の蛋白が溶解しきれずに凝集して不溶性の線維がアミロイドなのです。この解けきれないアミロイドが凝集して不溶性の線維のゴミとなったのです。線維性の蛋白で一番多いのは組織の立体構造の基盤となるコラーゲン繊維でありついで組織に弾力を与える弾性繊維であるエラスチンであり更に蛋白を中心棒の幹として枝状にグリコサミノグリカンと呼ばれるムコ多糖が結合してプロテオグリカンが生まれるのです。「ムコ」は「粘性のある」という意味でアミロイドを凝集しやすくさせているのがグリコサミノグリカンなのです。プロテオグリカンにはデコリン、バールカン、アグリカン、シンデカン、グリピカンがあります。線維を形成するコラーゲン繊維はⅠ型、Ⅱ型、Ⅲ型があります。
②ミスフォールディングを起こしやすい線維性タンパク質にはうえに上げたように多数の様々な種類があります。こうした線維タンパク質は,herpesが原因である自己免疫疾患や原因が不明であるじつはヘルペスによる難病に見られる病態により溶解した細胞の線維蛋白の崩壊産物で,骨髄でBリンパ球に分化した未熟なBリンパ球に感染して遺伝子をとつぜん変異させられたB細胞が癌化して単クローン性形質細胞またはその他のB細胞性リンパ増殖性疾患である骨髄腫により産生される免疫グロブリン軽鎖であるλ鎖やκ鎖などの糖タンパクなのです。
③アミロイド原性タンパク質によりアミロイドの病型および疾患の臨床経過が決まるが,異なる病型の臨床像が重複する場合もある。アミロイド原性分子とかアミロイド原性蛋白とはアルツハイマー病におけるAβ(アミロイドβ)やタウタンパク質,あるいはパーキンソン病におけるαシヌクレインのように,βシートを二次構造として線維状に重合しうる分子や蛋白のことです。これらの分子の異常をもたらす遺伝子突然変異が家族性神経変性疾患の原因となることも知られている。タウタンパク質とは何でしょうか?タウタンパク質(Tau protein)は、三つの細胞骨格のである一つである微小管を安定化するタンパク質である。微小管はチューブリンという蛋白からできており二種類のサブユニットであるαチューブリンとβチューブリンが交互につながって繊維状になるのです。その繊維を横に13本並べてすだれ状のシートにしてこれをくるりと回して管にしたものです。細胞分裂の際にできる紡錘体や鞭毛や繊毛は微小管からできています。
④αシヌクレインとは何でしょうか?α-シヌクレインの機能についてはα-シヌクレインのミスセンス変異は、家族性パーキンソン病の原因として同定されています。ミスセンス変異はミスセンス突然変異のことでありコドン(アミノ酸に対応する3つの塩基配列 )内の一塩基の置換によって異なったアミノ酸残基が合成中のポリペプチド鎖に入り、異常蛋白質が産生されることで、点突然変異の一種である。 鎌状赤血球貧血症がその例である。コドンとは、核酸の塩基配列が、タンパク質を構成するアミノ酸配列へと生体内で翻訳されるときの、各アミノ酸に対応する3つの塩基配列のことで、特に、mRNAの塩基配列を指す。レビー小体は、主に凝集した高リン酸化型のα-シヌクレインによって形成されています。本来、リン酸化は、リン酸化タンパク質の立体構造を変化させることにより、タンパク質機能と細胞シグナル伝達の調節を行うのです。α-シヌクレインは、ドーパミン作動性経路の調節に関与しています。α-シヌクレインは、種々のアポトーシス刺激に対するニューロンの応答性を低下させ、カスパーゼ3の活性化を抑制しアポトーシスを阻止します。α-シヌクレイン中間体オリゴマーであるプロトフィブリルは、モノマーが重合および凝集して形成される線維(フィブリル)の前段階である物質の総称です。 αシヌクレインやタウ蛋白質、アミロイドβ(Aβ)、フィブリノゲン、インスリン、セルロースなど様々な物質が線維(フィブリル)の前段階を終えてから形成されます。エーザイのアルツハイマーの薬であるレカネマブは抗Aβプロトフィブリル抗体です。ヘルペス溶解感染により脳の海馬体の細胞崩壊したがらくたがα-シヌクレインなのに そのがらくたの前駆物質に対する抗体であるレカネマブを投与してアルツハイマー(AD)が治るわけはありません。α-シヌクレイン中間体オリゴマーであるプロトフィブリルが原因ではないのにレカネマブをADに投与して何の意味があるのでしょうか???
三つの細胞骨格も細胞を内側から支えている繊維状の構造をとっています。細胞骨格というとまるで骨のようですが実は線維タンパク質なのです。細胞の形を維持するためには柱や梁に相当するのが微小管とミクロフィラメント(アクチンフィラメントとも呼ぶ)と中間径フィラメントの三つが細胞骨格なのです。
細胞骨格と細胞外マトリックスの関係はどうなっているのでしょうか?細胞外マトリックスとは何でしょうか?細胞外マトリックス(Extra―Cellular Matrix略してECM)とは生物において、細胞の外に存在する不溶性物質である。通常ECMと略され、細胞外基質、細胞間マトリックスともいう。人は多細胞生物ですから細胞の外は細胞にとっては細胞外空間となりますから何らかの物質で埋める必要があります。この物質にあたるのが細胞外マトリックス(Extra―Cellular Matrix略してECM)で細胞自身が自ら作り分泌した不溶性の線維性の蛋白なのです。さらに細胞を隣の細胞やECMにくっつけるために細胞膜に細胞接着分子(cellad-hesion-molecule)というツールが付加されるのです。
細胞骨格とは細胞内で合成される線維状のタンパク質で、細胞の形態維持や細胞運動, 細胞内における物質の輸送など多くの事象に関わっている。一方、細胞外マトリックス(extra-cellular-matrix, ECM)は同じく線維状の構造を持つタンパク質であるが、細胞内で合成された後に細胞の外に分泌されて機能しているのです。ECMタンパク質は結合組織に豊富に存在し、組織の形態維持に必須である。細胞はECMを足場としてその上を移動し、特定のECMと接着することで組織内の定められた位置に配置される。このように、細胞骨格と細胞外マトリックスは、存在部位こそ異なるもののその形状や機能の多くが共通しており、細胞運動や多細胞体制の維持に不可欠な分子群である。細胞接着の足場とは何ですか?細胞に他の成分を定着させるための接着剤のようなものです。 細胞は周囲の環境に定着するため生体の中ではタンパク質によって接着しています。 この生体内の環境を維持しないと、細胞は機能を維持できず、変質したり細胞死につながったりします。
ECMは細胞の外の結合組織を構成する主要なタンパク質であり、組織が損傷を受けた際はまずコラーゲンなどのECMが大量に産生されることで傷が埋められる。しかし、ヘルペスによる慢性的な炎症などにより細胞が崩壊した後を埋め合わすために細胞外にECMが過剰に産生されると、臓器の硬化や機能不全が引き起される。これを線維化と呼び、肝硬変や間質性肺炎、腎線維化などの様々な硬化症という病気となってしまうのです。
MRTFによる細胞骨格の発現量制御と、ECMの発現制御はどのように行われるのでしょうか?細胞骨格やECMタンパク質は多細胞生物である人体にとっては根源的な分子であり存在量も非常に豊富である必要があります。しかし、殺しきれないヘルペスウイルスと免疫の戦いによる炎症によって生ずる様々な疾患において、これら細胞骨格の線維タンパク質やECMタンパク質の発現量が大きく変化します。これらの発現を制御する転写因子としてmyocardin-related transcription factor(MRTF)が存在しています。MRTFが100以上もの細胞骨格、ECM関連遺伝子の発現を統括的に制御することで、細胞運動や発生過程に深く関与しているのです。又転写因子のMRTFの活性を制御する因子としてthymosin-ß4(Tß4)があります。MRTFのN末端には単量体アクチンとの結合部位が3カ所存在し、アクチンと結合したMRTFは細胞質に留まり活性を持たないのです。アクチン重合などにより細胞質中の単量体アクチン量が減少すると、アクチンと解離したMRTFは核内へと移行して転写因子SRFと共にターゲット遺伝子の発現を強力に誘導してしまいます。Tß4は単量体アクチンと結合することでMRTFとアクチンとの結合をブロックし、その結果MRTFの核内移行と活性化を誘導します。Tß4-MRTFシグナルが様々な疾患に関与しているのです。Tß4-MRTFと疾患との関わりについては細胞骨格やECMが細胞運動と密接に関係していることは既に述べたが、これは正常な発生過程だけでなくヘルペスが起こすガン細胞の浸潤・転移過程においても同様にTß4-MRTFが関わっているのです。様々なMRTFの活性化がガン細胞の転移を促進することが報告されており、実際に幾つかのヒトの癌種では、がん患者の予後とMRTFの発現量との間に明確な相関関係があるのです。Tß4もまた多くの癌種において発現亢進の見られる遺伝子でありますが、Tß4がMRTFの活性化を介してガン悪性化に寄与しているのです。アミロイドーシスもアミロイドβも癌もすべてヘルペスウイルスが関わり原因となっているのです。
以上をまとめると、ECMは結合組織を構成する主要なタンパク質であり、組織がヘルペスによって損傷を受けた際はまずコラーゲンなどのECMが大量に産生されることで傷が埋められる。しかし、ヘルペスウイルスは殺しきれないので死ぬまで続く、免疫が落ちれば細胞内で増殖し免疫が上がると細胞外に出たヘルペスと免疫との戦いによる慢性的な炎症などにより炎症の波及により傷を埋め合わせるためにECMが過剰に産生されると、臓器の硬化や機能不全が引き起されます。これを線維化と呼び、肝硬変や間質性肺炎、腎線維化などのあらゆる組織の硬化症が生まれるのです。コラーゲンの産生もまたMRTFによる制御を受けており、MRTFの活性を阻害することで線維化を抑制できる可能性があるのですが世界中の医者はヘルペスとの戦いを止めさせないあらゆる種類の線維タンパク質の残骸による病気を治すことはできないのです。現代の病気のすべては免疫がいくら頑張ってもherpesには絶対に勝てないことを誰も知らないからです。逆に免疫を抑制することに専念するばかりで病気つくりの医療に堕落してしまっているのです。悲しいですね。
⑤ベータギリシャ文字の τ(タウ)を用いて、τタンパク質と表記される。タウタンパク質は中枢神経系の神経細胞に豊富に存在するが、他の部位の末梢神経や他の組織の細胞には一般的には見られません。中枢神経系のアストロサイトやオリゴデンドロサイトでも極めて低レベルで発現している。アルツハイマー病やパーキンソン病のような神経系の病理や認知症は、適切な微小管安定化能を失ったタウタンパク質と関係している。
⑤ベータギリシャ文字の τ(タウ)を用いて、τタンパク質と表記される。タウタンパク質は中枢神経系の神経細胞に豊富に存在するが、他の部位の末梢神経や他の組織の細胞には一般的には見られません。中枢神経系のアストロサイトやオリゴデンドロサイトでも極めて低レベルで発現している。アルツハイマー病やパーキンソン病のような神経系の病理や認知症は、適切な微小管安定化能を失ったタウタンパク質と関係している。 タウタンパク質の役割は何でしょうか?神経細胞で生成されるタウ・タンパク質は、細胞の構造を保ち細胞内の物質の輸送経路としても使われる細長いフィラメント(筒状の線維)である「微小管」に結合し、集合体を形成する「重合」に役立ちます。 通常、タウ・タンパク質は、微小管に結合した状態で存在するか、細胞の中を埋める液体中に溶けこんでいます。微小管と何でしょうか?微小管は真核生物の主要な細胞骨格の一つで、タンパク質のαチューブリンとβチューブリンがつながったダイマー(二量体)を基本構成単位とする管状の構造体です。 微小管は、細胞の形態形成や染色体分離に重要な役割を果たしています。
タウタンパク質の役割は何でしょうか?神経細胞で生成されるタウ・タンパク質は、細胞の構造を保ち細胞内の物質の輸送経路としても使われる細長いフィラメント(筒状の線維)である「微小管」に結合し、集合体を形成する「重合」に役立ちます。 通常、タウ・タンパク質は、微小管に結合した状態で存在するか、細胞の中を埋める液体中に溶けこんでいます。微小管と何でしょうか?微小管は真核生物の主要な細胞骨格の一つで、タンパク質のαチューブリンとβチューブリンがつながったダイマー(二量体)を基本構成単位とする管状の構造体です。 微小管は、細胞の形態形成や染色体分離に重要な役割を果たしています。
ヘルペスによる炎症は多数の臓器を障害してしまいますが,心障害は特に予後不良であるのは当然であります。何故ならば心臓が動かなくなると死にます。アミロイド心筋症を発症すると,典型的には拡張機能障害,心不全,ならびに心ブロックおよび、または不整脈に至ります。人が死ぬのはヘルペスが心臓や心筋を支配する自律神経の神経節に感染したためです。
アミロイドーシスの診断には生検によると言われますがアミロイドーシスの病型を満すために必要と言われますが何のために病型が必要なのかが判然としません。というのはアミロイドはヘルペス感染による溶解感染で崩壊した細胞の細胞骨格や細胞外マトリックスを形成していた不溶性の線維たんぱくの残骸ですから臓器や組織や細胞などの種類によって細胞が作った細胞マトリックスの線維たんぱく質の違いによって大きく変わるのは当然であるからです。
ここで細胞骨格の繊維状のタンパク質の構造が如何なるものかまた細胞外マトリックスの線維性たんぱく質にどんな物質があるかを詳しく見てみましょう。細胞骨格とは細胞を内側から支える繊維状の蛋白で出来た構造をとっています。細胞骨格には微小管(microtubule)とミクロフィラメント(microfilament、アクチンフィラメントとも呼ぶ)と中間径フィラメント(intermediate filament)の3タイプがありそれぞれ独特な機能を持った線維性のタンパク質です。したがってヘルペスにより溶解感染のために細胞が崩壊する時に細胞骨格のみならず細胞を支えている細胞外マトリックスも溶解してしまうと不溶性のアミロイド線維だけが残骸として残るのです。
正常な細胞の中は実はドロドロした液体でその中に細胞小器官や無数の線維性でないタンパク質が浮遊しているのですが、いわばこの細胞質ゾルの空間には線維タンパク質がぎっしり張り巡らされており、タンパク質の80%がこの細胞骨格の」タンパク質に付着して安定を保っているのです。水分子でさえその20%~40%は線維性の蛋白で出来た細胞骨格に補足されているのです。
細胞骨格の役割には四つあります。第一は細胞を内側から支えることです。第二は細胞小器官を細胞内の適切な場所に配置してその状態を維持します。第三に細胞のあらゆる動きを可能にします。この動きには筋収縮や鞭毛のダイナミックな動きやアメーバ運動のような穏やかな動きも可能にさせます。第四は細胞内での物資であるタンパク質や小胞を輸送するためのレールの役割もあります。これらの仕事は生きた細胞では生きた線維タンパク質しかできない強さなのです。
繊維状タンパク質とは何でしょうか?
繊維状で水に溶けにくいタンパク質が、アルツハイマーやアミロイドーシスの原因となっているアミロイド線維なのです。
アミロイド線維は、タンパク質が繊維状の立体構造を取ったまま残骸になってしまったたんぱく質のなれの果てであり、herpes感染細胞がヘルペス溶解感染で崩壊した細胞骨格や細胞外マトリックスに最も多い繊維状タンパク質の残骸なのです。アミロイド線維が体内に蓄積するとアミロイドーシスなど重篤な疾患を引き起こすのではなくherpesによる重大な細胞死の結果なので重篤な疾患は終わってしまって細胞の死骸だけが残っているだけなのです。 アルツハイマー病患者の脳の記憶を司る海馬体に感染したヘルペスが原因で海馬体の細胞が壊死したガラクタがアミロイド線維の一つであるアミロイドβなのです。繊維状タンパク質のherpes性炎症産物であるアミロイドは強固で水に溶けにくいため、一度蓄積してしまうと取り除くことは困難です。ちょうど人を火葬した後に残った骨なのです。
因みに繊維状のたんぱく質の代表であるコラーゲンの中のⅠ型コラーゲンは鋼鉄よりも強いのです。人体の蛋白質の30%以上を占めている鋼鉄よりも強靭であるコラーゲンは一体何者なのでしょうか?
コラーゲン線維 [collagen fiber]
膠原線維ともいう.コラーゲン線維の最小単位であるコラーゲンは、おもに線維芽細胞で合成され、前駆体のプロコラーゲンとして細胞外に分泌される.その後、余分な部分が酵素により切断されてコラーゲン分子となり、互いに規則正しく会合し、さらに架橋形成してしだいに細い線維となる.これらがさらに結合し合って線維束となったものがコラーゲン線維である.組織学的に観察したとき、真皮のほとんど全層に絡み合って、うねったような線維構造に見える.
皮膚のコラーゲン線維
コラーゲン線維は真皮結合組織成分の90%以上を占めている.皮膚のコラーゲン線維は真皮結合組織成分の90%以上を占めています。線維芽細胞が産生し、線維を形成するのはおもにI型、III型、V型コラーゲンである.真皮網状層や、骨、腱、歯のような支持体として張力や強度を必要とする組織ではI型コラーゲンが主体の太い線維であり、他方、胎児期の皮膚や血管、真皮乳頭層など柔軟性を必要とする組織では、III型やV型コラーゲンを多く含む比較的細い線維から形成されている.なお、III型やV型コラーゲンが働いて、I型コラーゲンのつくるコラーゲン線維の太さを調節、制御している.
機能
真皮は皮膚構造の支持体として、また力学的役割を担っており、その機能を果たすのがコラーゲン線維とエラスチン線維(弾性線維)である.真皮の90%以上がコラーゲン線維、数%がエラスチン線維からなるので、コラーゲン線維の状態が真皮の構造と機能の状態を反映しているといっても過言ではない.加齢とともに真皮層は薄くなるが、これはコラーゲン線維の減少によるものである.光によってダメージを受ける光老化は、コラーゲン線維の形成を不全とし、断裂や扁平化などの変化を起こす.また、皮膚が硬化してくるがこれもコラーゲン線維の架橋・変性によるものと考えられている.なお、最近、コラーゲン線維は組織の支持体としての役割だけでなく、真皮の細胞機能にも影響することがわかってきた.真皮の線維芽細胞は、コラーゲン線維によって細胞の周辺を囲まれているため、細胞間同士の接触は少なく、ほとんどがコラーゲン線維と結合する.すなわち、コラーゲン線維の状態やコラーゲン線維がつくる細胞環境は線維芽細胞の機能(コラーゲンを含む細胞外マトリックス成分の合成・分解、線維構築や細胞増殖など)に大きく影響しているというわけである.
コラーゲンはどうやって作られるのか?コラーゲンはアミノ酸とビタミンCを材料に、鉄分のサポートを受けて合成されてできるため、体内に十分な鉄分を保持しておくことで、効果的にコラーゲンを合成することができます。皮膚や腱・軟骨などを構成する繊維状のたんぱく質で、人体のたんぱく質全体の約30%を占める。全身の約20%はタンパク質で、そのうちコラーゲンは約30%を占め ゼラチンの原料になります。
コラーゲンの主な機能は、繊維性の強くしなやかな構造や膜状の構造を形成しながら、体の形態や機能を維持する働きを担っています。 コラーゲンの主な効能には、①「肌に潤いや弾力を与える」②「丈夫な骨を形成する」③「関節の動きをよくする」④「丈夫な腱や筋肉をつくる」の4つがあります.コラーゲンは網目状に交わった繊維状の構造をしています。網が交差した部分がゴム状の物質「エラスチン」によって結びつくことで肌の弾力がうまれます。 人の皮膚・血管・じん帯・腱・軟骨などの組織を構成する繊維状のたんぱく質です。コラーゲンは骨の重量の約20%、体積の50%を占め、老化によってコラーゲンが少なくなったり構造が変わったりすると、骨がもろくなり骨粗しょう症の要因にもなることがあります。体内に取り込まれたアミノ酸はコラーゲンやエラスチンなどのタンパク質を作る材料となり、コラーゲンペプチドはコラーゲンやエラスチン、ヒアルロン酸を作る働きを促進します。コラーゲンとは、繊維状のタンパク質で繊維のような作りをしていて、細胞や組織をくっつける役割があります。これらの作用により、コラーゲンペプチドの摂取が、肌、骨、関節などの機能を改善する。コラーゲンは熱によってほぐすとゼラチンになりゼラチンが分解されるとコラーゲンペプチドとなり更に分解されてアミノ酸になります。
人の体を作っているコラーゲンは、三重らせん構造をしており約30種類の異なるポリペプチド鎖の組み合わせにより、19種類の型が存在します。Ⅰ型、Ⅱ型、Ⅲ型というように分類されています。コラーゲンには線維を形成するタイプと非線維性のシートを形成するタイプがある。線維タイプが代償的で全コラーゲンの90%を占めます。体内に最も多いⅠ型は、骨や皮膚の強さを生み出し、皮膚のコラーゲンの90%を占めます。非線維性コラーゲンであるIV型コラーゲンは皮膚の表皮と真皮をつなぎとめる役割を持った基底膜に存在するコラーゲンです。Ⅱ型とⅪ型は軟骨を構成する線維の主成分で主に軟骨に存在しています。Ⅲ型は血管や子宮などに存在するコラーゲンなので女性が摂ると特にいいといわれています。このように、コラーゲンは多くの可能性を秘めた注目の成分です。体内で生成される以外にも、ゼラチン、コラーゲンペプチド、トリペプチドコラーゲン、アミノ酸混合物といった、原料や分子構造の異なる4種類のコラーゲンがあり、中でもトリペプチドコラーゲンが最も美肌効果が高いとされています。非線維性コラーゲンでは、コラーゲン線維の表面に結合するFACIT(Fibril Associated Collagens with Interrupted Triple helices)や基底膜構造の主成分となる非常に細い網目構造を作るものや、細胞膜に結合して存在するコラーゲンもある。トリペプチドコラーゲンとはコラーゲン・トリペプチド(CTP)とも言われ、アミノ酸3個で構成されたコラーゲンの最小ユニットです。 これまでのコラーゲンとは違い、腸管からそのまま吸収されるため、効率よくコラーゲンを増やすことができます。コラーゲンペプチドとコラーゲントリペプチドの違いは何ですか?コラーゲンは分子量の大きなタンパク質ですが、これを加熱処理などで小さく分解したものがコラーゲンペプチドです。 ペプチドとはタンパク質を構成する最小単位であるアミノ酸が2個以上つながった化合物のことで、アミノ酸が2個の場合はジペプチド、3個の場合はトリペプチドといいます。
コラーゲン繊維は細胞外マトリックスも長くて大きいのでこんな大きいコラーゲン繊維を細胞はどのように分泌するのでしょうか?実は細胞が分泌する「三重らせん」は「コラーゲン繊維」のほんの1ピースの「三重らせん」に過ぎないのです。「三重らせん」は300nmの断片として分泌され細胞の外で組み立てられるのです。「三重らせん」の断片が橋を架けられるように束ねられて「原繊維」ができます。その「原繊維」はさらに束ねられて一つにされて大きくなっていき巨大なコラーゲン繊維になるのです。完成したコラーゲン繊維の直径は当初の「三重らせん」の300~2000倍になります。
各型のコラーゲンの 主な分布と役割をI型コラーゲン~Ⅴ型コラーゲンまでまとめます。
I型コラーゲン(線維性コラーゲン)体内に最も大量に存在するコラーゲン。骨や皮膚を形成し、弾力性を持たせる働きがある。
II型コラーゲン(線維性コラーゲン)関節・軟骨に主に含まれているコラーゲン。眼の角膜、子体の成分でもある。
III型コラーゲン(線維性コラーゲン)臓器に主に含まれているコラーゲン。細い線維で、組織に柔軟性を与える。
IV型コラーゲン(非線維性コラーゲン)皮膚の表皮と真皮をつなぎとめる役割を持った基底膜に存在するコラーゲン。
Ⅴ型コラーゲン(線維性コラーゲン)血管、平滑筋、胎盤に主に含まれている。I型、III型コラーゲンの含まれている組織に、極少量含まれている。
細胞外マトリックス (extracellular matrix略してECM)とは何でしょうか?
細胞間物質、細胞外基質、あるいは単にマトリックスともよばれる.生体組織において細胞間隙に存在し、網目構造、ゲル状を呈したタンパク質と糖質からなる複雑な不溶性の高分子会合体のことでECMと略記される.会合体とは強い分子間力のある物質は室温で、また、分子間力が弱い場合でも低温では、かなり多数の分子が塊をつくる。これを分子会合体という。構成成分の分子の化学的特徴からコラーゲン、プロテオグリカン、フィブロネクチンやラミニンを典型とする糖タンパク質、およびエラスチンやヒアルロン酸などこれらに含まれない物質の四つに大きく分けられる.
細胞外マトリックス (extracellular matrix略してECM)はタンパク質と糖質からなる複雑な不溶性の高分子会合体ですから基本の糖質とはなにかを復習しましょう。単糖の代表はグルコースがですが糖の基本単位は単糖でありそれ以上、加水分解されない糖の事です。分子式は(CH2O)nで表される。普通の単糖のnは3~7の範囲内です。Nの数によって三炭糖、四炭糖、五炭糖、六炭糖、七炭糖に区分されます。単糖の化学式の末端の化学の種類からアルドースとケトースに区分されます。多糖とはグリコシド結合で多数つながったものです。グリコシド結合とは環状で示した炭糖がアノマー炭素のーOH基のところで別の物質であるアグリコンと繋がる結合です。したがって結合する相手は糖でなくてもよいのです。単糖同士のOを介しての結合であるO-グリコシド結合の他に糖たんぱく質に見られる蛋白の質のNを介してのN―グリコシド結合があります。
糖のーOH基は化学変化を受けやすく化学変化を受けて変化してしまうと糖の誘導体になります。例えばグルコースの末端にあるーOH基が参加されるとグルクロン酸という誘導体になります。フイッシャー投影式のグルコースの6番目のCが参加されてカルボシキ基になったものでウロン酸という誘導体のひとつです。糖の誘導体は細胞外マトリックス粘性の物質である人体のかなりの部分を占めるムコ多糖体の成分になるのです。このムコ多糖体の成分はN-アセチルグルコサミンやグルクロン酸と同類の糖の誘導体なのです。
N-アセチルグルコサミンという糖の誘導体は何でしょうか?「アミノ糖」という糖の誘導体の一つなのです。グルコースのC―2の―OH基がアミノ基(-NH2)に置き換えられてグルコサミンになり、更にアミノ基の水素がアセチル基(CH3CO-)で置き換えられてN-アセチルグルコサミンになったのです。「アミノ糖」はアミノ基のーH基がアセチル基(CH3CO―)と入れ替わって生まれるのです。
糖の分子にはーOH(水酸基)やーCHO(アルデヒド基)のように反応性の高い部位が多くこの部位いくつかの反応がおきて組み合わさって豊富なバリエイションの糖の誘導体が生まれるのです。
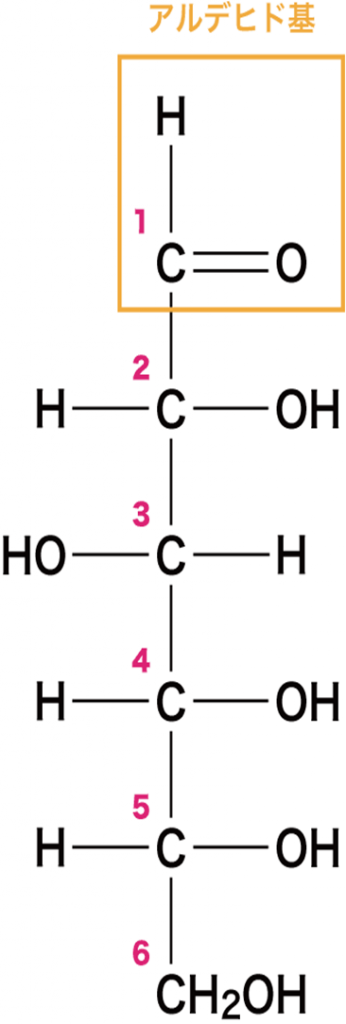
糖タンパク質とは何でしょうか?糖の基本単位である単量体(モノマー)が鎖状につながって重合体(ポリマー)の高分子が多糖である。多糖は炭糖がグリコシド結合で数千、数百万個の糖が直線状あるいは数百万個の糖が直線状あるいは枝分かれしてつながるのです。しかし一分子の多糖に3種類以上の糖が含まれていることは少なく、1種類の糖だけでできたものをホモ多糖と言い2種類の糖が交互に並んだヘテロ多糖がほとんどです。糖分は細胞のエネルギー源として重要でありますが細胞の構成成分としては圧倒的に多いのは細胞の外に存在する多糖であります。多糖は丈夫な構造体を形成するだけでなく細胞外空間を埋めるゲル状の物質や軟骨や腱のクッションにもなります。結合組織や関節で細胞と細胞の間を満たしている柔らかいねばねばした細胞間物質の大半がムコ多糖なのです。人のムコ多糖の主成分であるグルコサミノグルカンは様々な糖の誘導体が2個つながった二糖の繰り返し構造になっているのです。糖の誘導体とは何でしょうか?単糖の一部が変化した化合物を糖の誘導体とか誘導糖といいます。 誘導糖には①アミノ糖、②ウロン酸、③糖アルコール、④アルドン酸糖、⑤デオキシ糖、⑥配糖体があります。配糖体とは配糖体(はいとうたい)とかグリコシド(glycoside)ともいわれるのですが、糖がグリコシド結合により様々な原子団と結合した化合物の総称である。又グルコースなどの糖が結合している形のものを配糖体ともいいます。また、配糖体から糖が外れたものをアグリコンと呼びます。配糖体の元となる糖をグリコン (glycone)と呼び、残りの原子団に水素を結合させたものをアグリコン (aglycone)と呼ぶのはアグリコンの「ア」は否定語ですからグリコンではない部分ですという意味です。配糖体とは糖に配られたアルコールやフェノールなどの水酸基をもつ有機化合物とが結合した化合物という意味です。実はグリコシドは配糖体なのですが糖がグルコースのときに用いられるのです。というのもグルコースは地球上で最も大量に存在する炭糖であり食べ物の炭水化物は、まずグルコースまで消化され、それ以外の単糖もいったんグルコースに変換されてからエネルギー代謝が始まるからです。したがってグリコシドは、最も多く存在している配糖体です。つまりグリコシドは配糖体のひとつですが最も多く存在している配糖体です。因みにグルコースの大半は植物の光合成で作られます。光合成の主目的は三炭糖のグリセルアルデヒド3リン酸を作ることであり植物の代謝系はグリセルアルデヒド3リン酸を中心に回っているのです。グルコースは植物が余剰分を貯蔵する手段に過ぎないのです。光合成ができない人や他の動物はその余剰分であるグルコースに依存して生きているだけです。
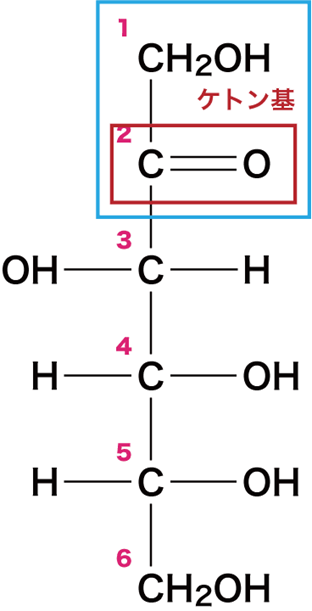
下図のように、ケトン基と5個のヒドロキシ基を有するものを(フルクトースの)鎖状構造という。大きな四角で囲まれた部分以外はグルコースと同じ構造になっている。
グリコサミノグリカン(glycosaminoglycan)は、長鎖の通常枝分れがみられないグリカン(多糖)です。 グリカンの訳は多糖なのです。動物の結合組織を中心にあらゆる組織に普遍的に存在する。 狭義のムコ多糖です。 GAGと略される。ムコ多糖は別名グルコサミノグルカンともいわれますが正確ではありません。グルコサミノグリカンとは何でしょうか?プロテオグリカンとは何でしょうか?グルコサミノグリカンは糖の誘導体の一つであるアミノ糖です。「グリカン」は「多糖」です。「グルコサミン」はグルコースのC2のーOH基がアミノ基(-NH2)に置き換えられたもので語尾が「~アミン」となります。ついでに言えばこの「グルコサミン」のアミノ基の水素がアセチル基(CH3CO-)でおきかえられたのが(N-アセチル)であり、N-アセチルグルコサミンという「アミノ糖」という糖の誘導体になるのです。糖の誘導体であるアミノ糖の特徴は何でしょうか?なまえの語尾が「~アミン」となります。三つの主要なアミノ糖があります。①N-アセチルグルコサミン②N-アセチルガラクトサミン、これは硫酸化誘導体でもあります。アミノ基とは別の部位であるC-4やC―6が硫酸化されます。③N-アセチルノイラミン酸で別名シアル酸です。N-アセチルノイラミン酸は9個の炭素を含みます。C-2ではなくC-5にアミノ基が付く点が他の二つとは異なります。アミノ糖はムコ多糖や糖たんぱく質や糖脂質の糖鎖に多く含まれます。何故N-アセチルグルコサミンが有名な「アミノ糖」になるのでしょうか?地球上でセルロースに次いで多い糖は何だと思いますか?昆虫や甲殻類の殻に含まれるキチンです。このキチンの成分はN-アセチルグルコサミンという糖であります。
コアタンパク質+グリカン=プロテオグリカンとなります。コアタンパク質とは何でしょうか?芯となる1本のペプチド鎖をコアタンパク質と言います。プロテオグリカンとは人を含めて動物細胞が産生するプロテオグリカンは、芯となる1本のペプチド鎖(コアタンパク質)にグリコサミノグリカンとよばれる糖鎖が1本以上共有結合した複合糖質の総称です。
プロテオグリカンは、コアタンパク質(=プロテオ)にグリカン(=多糖)が共有結合した物質です。「グリカンの中でも、グリコサミノグリカンと呼ばれるアミノ糖を構成成分とする多糖がタンパク質に結合した物質をプロテオグリカンと呼ぶ。主要なプロテオグリカンには①デコリン②パールカン③アグリカン④シンデカン⑤グリピカンの5つがあります。グリコサミノグリカンは糖の誘導体の一つであるアミノ糖ですが、さまざまな種類があり、①コンドロイチン硫酸、②デルマタン硫酸、③ケラタン硫酸④ヒアルロン酸⑤ヘパラン硫酸、⑥ヘパリンの6つのみがプロテオグリカンを構成できるプロテオグリカンであると定義できます。以上の6種類の糖が二糖になりこの二糖がグリコサミノグリカンの構成単位となり直線状につながりグリコサミノグリカンとなるのです。ややこしいでしょう。
保湿成分として知られるヒアルロン酸もグリコサミノグリカンの一種だが、プロテオグリカンとして存在することはないといわれます。プロテオグリカンは、ヒトやマウスといった哺乳類だけでなく、アフリカツメガエルやショウジョウバエ、線虫、ヒドラといった幅広い種に分布していますが、植物には存在していないのです。
プロテオグリカンは特定の分子構造を持たないのです。ただ、一口にプロテオグリカンといっても、特定の分子構造は定義されていません。コアタンパク質の種類、グリコサミノグリカンの種類によって多様なプロテオグリカンが存在するのです。
例えば、ビタミンCやグルコサミンは分子構造が特定されている。プロテオグリカンはコアタンパク質の種類によって分子構造が異なる。コアタンパク質には、アグリカン、ニューロカン、バーシカンなどがあり、それぞれアグリカンプロテオグリカン、ニューロカンプロテオグリカンなどと呼ばれることもあります。
代表的なグリコサミノグリカンがコンドロイチン硫酸である。基本構造は、アミノ糖の一種であるN-アセチルガラクトサミン(GalNAc)とグルクロン酸を1セット(この構造を二糖単位と呼ぶ)にして、それらが鎖状に結合している状態である。二糖の特定部位に硫酸基と呼ばれる分子構造が結合し、基本構造を修飾している。硫酸基の結合がない「O構造」、硫酸基の結合箇所が異なる「A構造」「C構造」、2~3個の硫酸基が結合する「B構造」「D構造」「E構造」「T構造」などが知られています。
糖鎖の長さは二糖がワンセットになって50~200セットから成り立っており、以上、述べたように硫酸基の結合は不均質なのです。これらの組み合わせでコンドロイチン硫酸は構成されるため、長さも構造も多様な分子となる。その結果として、プロテオグリカンも多様な集合体となる。これが均一な配列を持つDNAやRNAとの大きな違いといえます。
細胞外マトリックスは、細胞により合成され、あるいは分解されるなど生化学的な代謝作用を受けるだけではなく、マトリックス構築の編成においても細胞からの影響を受ける.以前は単に体を支持する構造物質であると考えられていたが、現在では細胞が正常な代謝、維持を行うために不可欠なものと考えられ、細胞の代謝、形態、増殖、分化、移動などのさまざまな活動に影響を与えるといった動的な役割を担うことが明らかにされている.
プロコラーゲンは細胞外でプロコラーゲンペプチダーゼによって末端の数個のアミノ酸が切断され、トロポコラーゲンとなります。プロコラーゲンとは何でしょうか?プロコラーゲンは,コラーゲンの合成過程における前駆体で,ペプチド鎖のN末端とC末端にプロコラーゲンペプチドを有している。 細胞内で作られたプロコラーゲンは細胞外に分泌され,両末端のペプチドがプロコラーゲンペプチターゼにより特異的に切断されコラーゲンとなる。トロポコラーゲンとは何ですか?コラーゲンの基本的な構造単位は分子量約30万のトロポコラーゲン(三重らせんコラーゲン)である。この分子は3本のペプチド鎖から成り,それらがより合わさって3本鎖右巻き超らせんを構成しています。つまりトロポコラーゲンは三重らせんなのでトロがついているのです。 トロポコラーゲンはさらに並列し架橋結合によって重合して微細な線維をつくります。人の成長とともに分子間に橋かけ構造が生じ不溶性になる。 膠原繊維は集まり、しだいに太くなって膠原繊維(collagen fiber)となります。膠原繊維とは何でしょうか?結合組織の細胞間基質中に多くみられる繊維。分子量約30万のコラーゲンというタンパク質の繊維が規則正しく配列されており、電子顕微鏡では20~100ナノメートルの膠原繊維が集合してできていることがわかる。膠原繊維は熱や酸で処理したり、ペプシンで消化すると消失する。煮沸して水溶性にしたものがゼラチン(膠にかわ)である。膠原繊維は成体中で結合組織に強度を与える。その成分はコラーゲンで,これはグリシン,プロリン,ヒドロキシプロリンを豊富に含む。1本の膠原繊維は膠原繊維と呼ばれる無数の細い繊維の集まりであり,これはさらに細い幅の膠原細繊維の集まりからなる。膠原細繊維を電子顕微鏡で見ると横紋がみられる。膠原細繊維はトロポコラーゲンと呼ばれる棒状のタンパク質分子がその長さの1/4ずつ交互にずれながら横に並んで束を形成したもので,640Åの横紋はそのために作られる。トロポコラーゲンは繊維芽細胞によって作られ,細胞体外へ出されてから重合し,膠原細繊維となる。トロポコラーゲン同士によるらせん構造の形成、また酵素の働きにより架橋されコラーゲン線維ができます。 真皮にはⅠ型コラーゲン(COL1)が多く存在し、肌のハリや弾力を与え、シワを作りにくくします。一方 線維芽細胞内で合成されたトロポエラスチンはマイクロフィブリルと結合、さらに架橋を形成しエラスチン線維となります。
エラスチン線維とは何でしょうか?コラーゲンは強度を司るタンパク質で、伸びたり縮んだりしない反面、引っ張りに強い「膠原(こうげん)線維」です。一方、エラスチンはしなやかで伸縮性(弾性)があり、力を外すと元へ戻る性質を持つ「弾性線維」です。つまりコラーゲンは強さ、エラスチンは弾力性が特色です。例えば、伸び縮みが必要な血管や肺などの組織には、エラスチンの弾性がその特性を与えているのです。もちろん、どちらも必要な成分であり、エラスチンがコラーゲンを束ねているという共存関係があります。「線維芽細胞」はコラーゲンやエラスチン、ヒアルロン酸などの成分を作り出す機能を持っており、エイジングケアには欠かせない細胞となっています。
線維芽細胞とは何でしょうか?線維芽細胞とは、肌の奥深くである「真皮」と呼ばれる組織に存在している細胞で、若々しい肌に必要不可欠な「コラーゲン」や「エラスチン」、「ヒアルロン酸」などの成分を生成する役割を持っています。線維芽細胞は我々の身体同様、年齢と共に衰えていき、分裂することやコラーゲンやエラスチンを生成する力も徐々に弱まっていきます。そうすることにより、肌のたるみやシワが発現する原因の1つになるのです。線維芽細胞が生成する主な3つの成分は①コラーゲン②エラスチン③ヒアルロン酸であり、コラーゲンは、肌のハリを保つためには必要不可欠な成分で、たんぱく質の1種です。線維芽細胞が生成するコラーゲンはコラーゲン繊維となり、我々の皮膚の強度を保つ役割も果たしています。コラーゲン繊維を生成できるのは線維芽細胞だけなのです。エラスチンは、コラーゲンと同じ、肌のハリや弾力を保つために必要な要素です。コラーゲンよりもあまり注目度が高くない成分ではありますが、コラーゲンよりも肌の弾力やハリを保つために必要な要素ともいえる成分です。エラスチンは皮膚だけではなく、血管などにも必要な成分で、血管においては線維芽細胞と平滑細胞、皮膚においては線維芽細胞がエラスチンを作る役割を担います。そのため、線維芽細胞が衰えるとエラスチンも少なくなってきます。また、人の身体には元々エラスチンを分解する酵素があります。紫外線や老化によってこの分解酵素が働きを強めるとエラスチンの働きが弱くなり、これもシワやたるみの原因になります。ヒアルロン酸は、保水性が高く身体のいたるところにある成分です。ヒアルロン酸は肌の潤いには欠かせない成分です。
繊維状タンパク質(せんいじょうタンパクしつ、Fibrous protein)は、球状タンパク質と並んでタンパク質の四次構造の主な2つのうちの1つである。4次構造をとっている繊維状タンパク質の“かたち”が変わると病気になるのです。その一つの病気がヘルペスによって増殖に利用され過ぎて溶解の壊死してしまった線維タンパク質の成れの果てがアミロイドーシスなのです。
私たちの生命活動は、いろいろなタンパク質がそれぞれの機能を忠実に果たすことで維持されています。例えば、ヘモグロビンというタンパク質は酸素分子を体の隅々まで運搬する働きを持っています。タンパク質は20種類のアミノ酸からなる高分子であるのですが、実は、タンパク質がその機能を果たすには、それぞれに決まった固有の“かたち”である立体構造をとる必要があります。立体構造のかたちが間違っていると、タンパク質はうまく働かなかったり、あるいは、他のタンパク質の働きを乱したりして、生命活動は脅かされます。特に、ヘルペスが脳の海馬体に感染して生ずるアルツハイマー病などに代表されるすべての神経変性疾患と呼ばれる神経難病では、あるタンパク質の立体構造が変わって不溶性の役立たずの「繊維タンパク質」のように凝縮して寄り集まり、神経細胞の機能がなくなり記憶も失われてしまうのです。
神経変性疾患はその症状(認知症状や運動失調など)に基づいて分類され、線維化するタンパク質の種類は疾患によって異なるのはヘルペスが感染して破壊してしまう細胞の種類によって線維たんぱくの違いがあるからです。例えば、ハンチントン舞踏病は、ハンチンチン(HTT)と呼ばれるタンパク質にあるグルタミン繰り返し領域が異常に長くなることで引き起こされることが知られており、神経細胞の核内にHTTからなる線維が蓄積します。正常なHTTは様々な生理機能を持っており、実際、HTT遺伝子を破壊したマウスは胎児の段階で死んでしまいます。ただ、神経細胞には微量のHTTしか存在しないので、それらの構造や物性を調べようとしても、単離することが非常に困難です。そこで、遺伝子組換え技術を応用して大腸菌にヒトのHTTタンパク質を大量に発現させて精製します。そのようにして得たHTTは徐々に不溶性の沈殿となり、その沈殿を透過型電子顕微鏡で観察すると、およそ10 nmの幅を有した線維状の形態であることが分かりました。さらに、HTTのグルタミン繰り返し領域がβ-シートと呼ばれる構造に変化することで線維になることも物理化学的な手法により明らかとなっています。しかし、なぜタンパク質であるHTTなどの構造が突如に変化して線維状に凝集するのか、タンパク質が線維化するから神経細胞が死ぬのか、あるいは、神経細胞が死にそうだからタンパク質が線維構造に変化するのか、などの本質的な問題が実は未解明のままですと言われていますが実はヘルペス感染により崩壊してリソソームの蛋白分解酵素によって処理できなかった線維タンパク質だけが不溶性の線維として残った塵にすぎないのです。HTTに限らず、様々なタンパク質の線維化プロセスを試験管内で再現することで、その制御メカニズムや毒性発現のメカニズムの解明が進められていますが試験管内にherpesを持ち込まない限り答えは出ないでしょう。アッハッハッハ。
繊維状タンパク質は、棒や針金の様な形をした長い繊維状の構造を作る。これらは通常不活性であるが貯蔵用のタンパク質である。水には溶けず、疎水性のアルキル基を外側に向けて凝集している。アミノ酸配列には短い残基の繰り返しがしばしば見られ、またコラーゲンの三重らせんのような珍しい二次構造を取ることがある。ケラチンのジスルフィド結合の様な主鎖間の架橋構造が見られることもある。
繊維状タンパク質は球状タンパク質に比べて変性しにくい。繊維状タンパク質は結合組織、腱、骨、骨格筋などを作っている。例としてはケラチン、ミオシン、コラーゲン、エラスチンなどがある。ミオシンとは何でしようか?ミオシン(myosin)は、アクチン上を運動するタンパク質である。ミオシンはATPase活性を持ち、ATPを加水分解しながら、-端から+端に向かってアクチンフィラメント上を移動するモータータンパク質である。
それでは三つの細胞骨格が線維タンパク質としてそれぞれ上に挙げたどんな働きをしているかをさらにどんな構造をしているかを見てみましょう。正常な三つの細胞骨格の違いが崩壊した時にどんなに違った残骸になるかを理解できることになるでしょう。従ってアミロイドーシスの診断には生検によってアミロイドーシスの病型を見ても意味もないことがお判りになるでしょう。さらに細胞のみならず組織もヘルペスの炎症と増殖に利用され過ぎた細胞の崩壊と細胞を支える細胞外マトリックスの線維タンパク質の残骸としてアミロイドになったことを理解するために正常な細胞外マトリックスについても詳しく説明を順次やります。正常な細胞マトリックスの多くの線維性タンパク質の成り立ちも理解できれば更にアミロイドーシスはヘルペスの炎症や増殖による溶解感染によって潰れた線維タンパク質がアミロイドになったということが100%納得できるはずです。ヘルペスの溶解感染とは何でしょうか?
Epstein-Barr ウイルス溶解感染によって細胞内の環境がどのように変化しEBV感染細胞が癌化したり崩壊壊死していくかを見ましょう。
Epstein-Barr ウイルス(Epstein-Barr virus; EBV)は,γ- ヘルペスウイルス亜科に属する DNAウイルスで,最初に発見されたヒト癌ウイルスでもある.8種類の4番目のherpesウイルスの仲間なのです。EBV は他のherpesウイルスと同じように潜伏感染(ゲノムに潜伏感染)と溶解感染(ウイルス産生感染)の 2 つの感染様式を持ち,基本的に宿主の免疫が正常である限り潜伏感染を続行するが,時にステロイドホルモンを医者に使われて免疫が低下すると溶解感染へと移行し,莫大な数の子孫ウイルスであるビリオン産生したり自分の遺伝子を複製したり続く粒子形成するときに感染細胞の複製機構や蛋白質や酵素を思う存分利用つくして細胞が生きられなくするのです。利用できなくなった細胞を見捨てて役立たずの瀕死の細胞から別の元気な細胞へと感染し続けて増殖を繰り返すのです。見捨てられた細胞はまるで細胞が溶けて解体するようにヘルペスに殺されて壊死してしまうのです。
溶解感染ではヘルペスウイルスの約 80 個のウイルス遺伝子が秩序立って発現し,短時間の内にウイルスゲノム複製と,が協調的になされる.因みに人の遺伝子は23500個があります。潜伏感染から溶解感染へと変化するときに,宿主細胞内でどのような変化が起きているのでしょうか?はじめにEVウイルスのみならず他のherpesウイルスの仲間たちは宿主細胞内で短時間に爆発的に増殖し,感染細胞あたり数百から数万の子孫ウイルスが産生される.この非常に効率的な増殖には,時間と場所の制御が必須である.例えば,必要な“時”に“必要な遺伝子産物である蛋白質”が必要な“量”だけ提供可能となる秩序だったウイルス遺伝子発現や,反応に必要な因子が密に存在し,反応速度を最大化する“場”が必須なのです。さらに,ウイルスは宿主細胞にとって異物であるため,宿主細胞は侵入した異物(ウイルス)を排除しようとする.これを巧みに回避する最高の機構もヘルペスウイルスは持っています。このように,ウイルスは多重かつ多階層的に宿主細胞内の環境をコントロールしながら,宿主細胞内で増殖するのです。
Epstein-Barr ウイルス(EBV)は,γ- ヘルペスウイルス亜科に属する DNA ウイルスで,成人の約 9 割が抗体陽性とされ,最も広く浸淫しているウイルスのひとつである.EBV の初感染の多くが無症候性であるのは細胞に感染すると細胞のゲノムに自分のゲノムを組み込んでしまい免疫が落ちるまで素早く潜伏感染してしまうためです。思春期以降では特に女性は生理が始まるので胎盤を作るために黄体ホルモンを作り出すと妊娠しなければ代謝されてステロイドホルモンであるコルチコステロンになってしまうので免疫のリバウンド現象が出て免疫が上昇してしまうのでEpstein-Barr herpesとの戦いが始まり女性の伝染性単核症(infectious mononucleosis, 略IM)の原因となり女性が多いのです。一方で、EBVはヒト腫瘍ウイルスでもあり,バーキットリンパ腫や上咽頭癌,胃癌など EBV 関連腫瘍の新規発症者は全世界で年間 200,000人にものぼるのはEBVは細胞ゲノムに遺伝子を潜伏感染のために組み込むときに細胞ゲノムの遺伝子を変えたり感染細胞で増殖する時にも遺伝子を突然変異を起こし癌関連遺伝子を癌化させてしまうからです。EBV は T リンパ球や上皮細胞や粘膜細胞にも感染するが,自然宿主は B リンパ球である。
自然宿主とは何でしょうか?「自然宿主」は統一された定義がなく、例えば、ほとんどのインフルエンザAウイルスの主要な自然宿主は水鳥(水禽類)で、2002年から2003年にかけて流行した重症急性呼吸器症候群(SARS)の原因ウイルスであるSARSコロナウイルスの自然宿主はコウモリです。ウイルス学研究においては、とあるウイルスの自然宿主とは「そのウイルスが長期間、感染し続けることができる生物」などとされることがあります。
スピルオーバーとは?自然宿主から自然宿主でない生物へウイルスが直接うつることを、スピルオーバーと呼びます。スピルオーバーは、ウイルス感染症発生の一因です。
細胞周期とは何でしょうか?細胞が増殖を開始し、下図に示すように①DNA複製、②染色体の分配、③核分裂、④細胞質分裂などの事象を経て二つの娘細胞となって出発点に戻るまでのサイクルを細胞周期という。 形態的あるいは生化学的な違いから、G1期、S期、G2期、M期の4期に分けられる。細胞周期ごとに染色体の複製と分離が行われる。細胞周期(さいぼうしゅうき; cell cycle)は、一つの細胞が二つの娘細胞を生み出す過程で起こる一連の事象、およびその周期のことをいう。細胞周期の代表的な事象として、ゲノムDNAの複製と分配、それに引き続く細胞質分裂がある。
下図の英語の訳を書き添えます。DNA replication (DNA複製)、Mitosis(有糸分裂)、Two diploid cells(二倍体細胞)
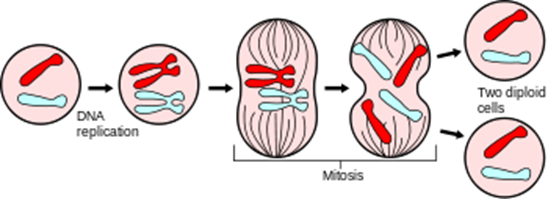
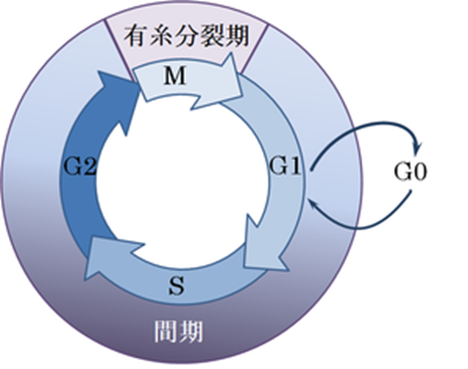
細胞周期は、左図のように光学顕微鏡での観察に基づき、大きく間期(interphase)とM期(M phase)の二つに分けられます。間期はさらにG1期、S期、G2期に分けられます。M期は分裂期であり有糸分裂と細胞質分裂によって構成されています。有糸分裂では姉妹染色分体が細胞の両極に分かれ、引き続く細胞質分裂では細胞質が割れて2つの細胞が生み出される。 姉妹染色分体とは何でしょうか?DNA複製後にできる、同じ遺伝情報をもつ2本の染色分体のことをいう。複製後の染色体は一対の姉妹染色分体から構成されています。Two diploid cellsの訳は「二倍体細胞」ですが「一対の姉妹染色分体を持つ細胞」と言ってもよいのです。一時的に、もしくは可逆的に分裂を停止した細胞は、G0期と呼ばれる静止期に入ったのです。
複製されたウイルスゲノムは,EBNA1 を介して宿主染色体と結合し細胞分裂時に宿主染色体と共に分配される.ゲノムと染色体との違いは何ですか?ゲノムとは、遺伝子をはじめとする遺伝情報の全体を意味します。 人の遺伝情報は、DNA上に4つの塩基の頭文字である”G”、”A”、”T”、”C”という約30億個の塩基の文字で書かれていますが、全てがひとつながりのDNAに書き込まれているのではなく、染色体と呼ばれる23本の単位ごとに折りたたまれています。
EBNA1 を介した分配機構は,娘細胞に等しくウイルスゲノムを分配することを可能になり,細胞のゲノムのみならずウイルスゲノムも感染細胞内で維持され続けられます。 EBNA1とは何でしょうか?エプスタインバー核抗原(1 Epstein–Barr nuclear antigen 1 略EBNA1)は、エプスタインバーウイルスの多機能の二量体ウイルスタンパク質です。 EBNA1は、いくつかのEBV関連悪性腫瘍に見られる唯一のEBVタンパク質です。 EBVに感染したときに細胞がとる変化した状態を確立し維持する上で重要なのがEBNA1です。 EBNA1 には、タンパク質をアミノ末端ドメインとカルボキシ末端ドメインに分離するグリシン-アラニンの繰り返し配列があります。このグリシン-アラニンの繰り返し配列はタンパク質を安定化させ、細胞のプロテアソームによる分解を防止するだけでなく、抗原プロセシングやMHCクラス I 制限抗原提示を阻害するのです。抗原プロセシングとは何でしょうか?抗原が抗原提示細胞内で十数個のアミノ酸からなるペプチドになるまで分解され,MHC分子とともにT細胞に認識されるようにする現象であり、ウイルス感染細胞に対するCD8拘束性細胞傷害性 T 細胞応答が阻害されます。CD8拘束性細胞傷害性 T 細胞応答とはCD8拘束性(陽性)キラーT細胞はリンパ球の一種で、感染細胞やがん細胞を特異的に殺傷する。 CD8は、T細胞受容体の共受容体として働く、膜貫通糖タンパク質で、MHCクラスIに結合する。 細胞のプロテアソームとはプロテアソームはタンパク質分解酵素の集合体でありユビキチンがついたタンパク質は、巨大酵素「プロテアソーム」へと運ばれます。 そこでタンパク質はアミノ酸へと分解され、新しいタンパク質の原料としてリサイクルされるのです。 ユビキチンという目印がついたタンパク質をプロテアソームが食べて、小さいアミノ酸へと分解。 アミノ酸は新しいタンパク質へと再生される。
EBNA1 は、すべての潜伏感染プログラム中に Qp プロモーターから発現されます。 Qp プロモーターとは何でしょうか?エプスタインバーウイルス(EBV)のプロモーターの異なる活性化は、EBV核抗原(EBNA)の明確な発現パターンをもたらし、さらに細胞の病因におけるEBVの役割をさらに決定します。 プロモーターとは転写の開始に関与する遺伝子の上流領域を指し、プロモーターに基本転写因子が結合して転写が始まるのです。 Qプロモーター(QP)はEBNA1が発現する唯一のEBNA遺伝子です。
潜伏感染細胞ではウイルスゲノムは環状 DNAとして維持される.一方,溶解感染では短時間で大量のウイルスゲノムを複製する必要があるため,ウイルスゲノム複製は7種のウイルス複製蛋白質から構成される ウイルス複製装置により実行される.ローリングサイクル型の複製が起き,中間産物として長い head to tail concatemer ができる.ローリングサイクル型の複製とは環状2本鎖DNAをゲノムとするプラスミドやウイルスゲノムの複製様式で、リーディング鎖が環に沿って移動し、直鎖上の新生DNAが派生する。 head to tail concatemerコンカテマーとは、コンカテマーは短いゲノムDNAがいつくか直鎖状に連結したもの.頭から尻尾(head to tail)まで直列に連結された同じ DNA 配列の複数のコピーを含む長く連続した DNA 分子をコンカテマー(concatemer)と言います。これらのコンカテマー(concatemer)のポリマー分子は通常、端と端が結合された後、分離されたゲノム全体のコピーです。これは後に,ユニットサイズに切断され,カプシド内へパッケージされる。溶解感染への移行に伴う細胞内環境変化については、 潜伏感染から溶解感染への移行は,BZLF1 タンパク質の発現により規定される.BZLF1 タンパク質とは,ウイルスゲノムの複製開始部位に結合してウイルスのコードする複製タンパク質群の会合を誘導するとともに,転写因子としても機能して溶解感染関連ウイルス遺伝子群の発現を誘導する.EBV複製サイクルが誘導されると経時的に前早期タンパク,後早期タンパク,後期タンパクが産生される。前早期タンパクとしてはEBVのBZLF1,BRLF1およびBMRF1遺伝子からの遺伝子産物が確認されているが, BZLF1遺伝子発現だけがEBV複製サイクルの引き金となっています。さらに,BZLF1 タンパク質は p53 などの宿主タンパク質の溶解感染の進行に応じた緻密な制御にも関わる。 溶解感染ではウイルス粒子産生に細胞内資源を集中させるため,EBV は細胞周期もコントロールする.溶解感染では,ウイルスゲノム複製に適した late-G1 から S 期の細胞周期環境に細胞内環境が整えられる.BZLF1 タンパク質は活性化状態ではない低リン酸化状態の p53 と DNA との結合を増強することで,p53 の下流にある細胞周期調節因子p21Cip1/Waf1 の発現を誘導し,溶解感染の初期には細胞周期を G1 期付近に止めてしまうのです。ウイルスゲノム複製が爆発的に大量に行われると,ウイルスゲノムは異常 DNA として検知され,宿主 DNA 損傷応答が誘導される 。なお, EBVに限らず,ヘルペスウイルスゲノム複製で宿主 DNA 損傷応答が惹起されることはherpes以外の様々なウイルスで見られます。宿主 DNA 損傷応答はゲノムの完全性(genome integrity)を維持するための機構で,傷害 DNA は取り除き,修復される.修復が困難な場合には細胞死が誘導される.この宿主 DNA 損傷応答でも p53 は中心的な役割を果たすが,ウイルスにとっては p53 の活性化による細胞死の誘導は不都合なのです。そのため,これを巧みに回避する機構を EBV のみならず他のherpesウイルスはすべて持っているのでワクチンが出来ないのみならず最後は何百億個~何千億個増えたherpesによってあらゆる癌を作られて人類は最後は癌で一生を終えることになるのです。
溶解感染で宿主 DNA 損傷応答が惹起されると,ATM がリン酸化し,下流の Chk2 へとシグナルを伝える. ATM とは何でしょうか?ATM(ataxia telangiectasia mutated)は、DNAの二本鎖切断によってリクルートされて活性化されるセリン/スレオニンキナーゼである。ATMは、DNA損傷チェックポイントの活性化を開始する重要なタンパク質をリン酸化し、細胞周期の停止、DNA修復やアポトーシスを引き起こすのです。p53、CHK2、BRCA1、NBS1、H2AXを含む、ATMの標的となるタンパク質のうちのいくつかは癌抑制因子である。細胞周期を通じて、常に損傷は監視されている。DNAの損傷は複製時のエラーや代謝の副産物、有毒な薬剤や電離放射線やherpesウイルスによって生じる。細胞周期にはさまざまなDNA損傷チェックポイント(阻止地点)が存在し、細胞周期の次の段階への移行を阻害したり、現在の段階にとどまらせたりしている。細胞周期の主要なチェックポイントとしてはG1期からS期に行くチェックポイントとG2期からM期に行くチェックポイントがあり、細胞周期の正確な進行を維持している。ATMはDNA損傷後、特に二本鎖切断後に細胞周期の進行を遅らせる役割がある)。ATMとは何でしょうか?MRN複合体などの二本鎖切断を検知するタンパク質によって二本鎖切断部位にリクルートされる。MRN複合体は、MRE11、RAD50、NBS1の3つから構成されるタンパク質複合体で頭文字をとってMRN複合体というのです。真核生物では、MRN複合体は相同組換えや非相同末端結合による修復過程に先立って行われます。MRN複合体はDNA二本鎖切断修復の開始段階に重要な役割を果たすための二本鎖切断後のATMの活性化には機能的なMRN複合体が必要なのです。このMRN複合体は哺乳類細胞ではATMの上流で機能し、CHK2やp53などの基質に対するATMの親和性を増大させるようなコンフォメーション(形態)変化を誘導する。その後、ATMはMRN複合体の一つであるNBS1や他の二本鎖切断修復タンパク質をリン酸化する。こうして修飾された媒介タンパク質はDNA損傷シグナルを増幅し、CHK2やp53などの下流のエフェクターにシグナルを伝達する。ATM遺伝子のATMという名称は、ATM遺伝子の変異(mutation)が毛細血管拡張性運動失調症(ataxia–telangi-ectasia)の原因であることに由来する。 CHK2(checkpoint kinase 2)とは何でしょうか?セリン/スレオニンキナーゼCHK2のことです。CHEK2(checkpoint kinase 2)は、セリン/スレオニンキナーゼCHK2をコードするがん抑制遺伝子であり、CHK2は、DNA損傷に応答したDNA修復、細胞周期の停止やアポトーシスに関与している。
CHEK2遺伝子の変異はさまざまな癌と関係している。これらのキナーゼはp53をリン酸化し,活性化状態にするが,溶解感染の中期以降では p53 の下流にシグナルが伝達されない。これは,p53 が E3ユビキチンリガーゼの一種である Elongin B/C-Cul2/5-SOCS-box protein(ECS)複合体と BZLF1 タンパク質を介して結合し,p53 がユビキチン化され,分解されるためである。BZLF1 タンパク質を介した ECS リガーゼ複合体との結合は,Chk2 による p53 の C末端のリン酸化により増強する。ウイルスタンパク質-ECS E3リガーゼ複合体によってリン酸化されたp53の減少がもたらされます。従って,EBV は活性化状態の p53はEBウイルスにとってアポトーシスへと導く可能性がある危険な p53であるのでこの危険な53を優先的に分解することが可能となる。何故ならばp53タンパク質はウイルスにとってアポトーシスへと導く可能性がある危険なタンパク質であるからです。 一方で,宿主 DNA 損傷応答はEBウイルスにとって不都合な宿主反応とは限らない。それは,ウイルスゲノムの完全性の維持および効率的なウイルスゲノム複製に,EBV は宿主 DNA 損傷応答をも利用しているからである。

ATMからのシグナルは MRN 複合体へと伝えられて,相同組換え修復酵素をウイルスゲノム上にリクルートする。これらのMRN複合体により,ウイルスの DNA ポリメラーゼによって複製された不完全なゲノムが補完され,効率的なウイルスゲノム複製が達成される。 このように,宿主 DNA損傷応答はウイルスにとって重要である。これをさらに確実なものにするため,EBV は宿主 DNA 損傷応答を増幅する機構も備えている。その中心を担うのが,EBVのコードする唯一のプロテインキナーゼ BGLF4 タンパク質である。BGLF4 キナーゼは,ヒストン H2AX をリン酸化し,宿主DNA損傷応答を増幅させる。BZLF1 タンパク質と同様に,BGLF4 キナーゼタンパク質も溶解感染のための細胞内環境調整に多面的に機能する。BGLF4 キナーゼはコンデンシンやトポイソメラーゼ II をリン酸化し,宿主染色体を凝集させる。 コンデンシンとは、細胞の分裂期の染色体凝縮と分離に中心的な役割を果たすタンパク質複合体である。細胞分裂期の染色体を構成する主要なタンパク質です。 トポイソメラーゼ IIとは人の各々の細胞には長さ約2mのDNAが含まれている。一つの細胞には約2mのDNAが含まれているのですよ!!!!40兆個の細胞のそれぞれに存在する2mのDNAの全てが核内の小さな空間へと折りたたまれて百万分の1の大きさになっているのです!!!!
この長すぎる細い鎖は核内の狭い混雑した環境下では極めて簡単にもつれ(縺れ)てしまう。更に事態をややこしくしているのが、DNAが二重らせんであるということである。遺伝情報を正確にすべての塩基を読み取るにはこの螺旋をほどかなければならない。このもつれ(縺れ)の問題に対処するため、各細胞はDNA鎖の縺れをほどいて緩ませる数種類のトポイソメラーゼ(topoisomerase)を作っている。さらに,宿主の染色体複製開始に関わるMCM複合体のMCM4のリン酸化を介して,MCM 複合体のヘリカーゼ活性を抑制する。MCM 複合体(mini-chromosome maintenance protein complex訳してミニ染色体維持複合体)とは、ゲノムDNAの複製に必要不可欠なDNAヘリカーゼである。DNAヘリカーゼとはDNAヘリカーゼはATPのエネルギーを使って、DNA二重らせんに含まれる2本の鎖を分離する。ヘリカーゼは核酸のリン酸エステル骨格に沿って動きながら絡み合う核酸をほどく酵素の総称である。すべての生物に必須である。真核生物のMCMはMCM2からMCM7までの6つのサブユニットから構成され、ヘテロ六量体を形成する。そのため,溶解感染では宿主のゲノム複製が抑制され,ウイルスゲノム複製のみが実施される。BGLF4 キナーゼは細胞周期調節因子 p27Kip1 の Thr-187 をリン酸化する 。リン酸化された p27Kip1 は SCFSkp2 によって,ポリユビキチン鎖を付加され,分解へと誘導される.これも,溶解感染でのS期CDKの活性化に貢献する.BGLF4キナーゼとは何でしょうか?さらに,BGLF4キナーゼは,細胞内のdNTPの量を制御する因子であるSterile alpha motif and HD domain 1(SAMHD1)をリン酸化します。dNTPとは何でしょうか?dNTPsの正式名称はデオキシヌクレオシド三リン酸(dNTPs)です。リン酸化によりSAMHD1 の dNTPase 活性は低下し,新たに複製されるゲノムの原料となる dNTP プールが増加することで,効率的なウイルスゲノム複製が可能となる。SAMHD1とは何でしょうか?SAMHD1は細胞内酵素であり、ホスホヒドロラーゼ(リン酸加水分解)活性を示す酵素であり、ヌクレオチドはヌクレオシドにリン酸基が付いた核酸ですからデオキシヌクレオシド三リン酸(dNTP)はdATP、dCTP、dGTP、dTTPのヌクレオチド4つからなり、DNA鎖の基本単位です。オキシ-ヌクレオシド-三-リン酸(dNTP)を無機三リン酸(iPPP)と2′-デオキシヌクレオシド(リン酸基を持たないデオキシヌクレオシド)へ変換する。SAMHD1はこの反応によってdNTPのプールを枯渇させ、SAMHD1加えて,BGLF4 キナーゼは核膜の裏打ちタンパク質であるラミンAとラミンC のリン酸化を介して,核膜構造の再構成を促し,EBVカプシドの nuclear egress にも関与する。nuclear egressとは、核内で形成されたヌクレオカプシドは,細胞質において感染性のウイルス粒子として成熟するために,核内から核外に輸送される必要がある.この過程は,ヌクレオカプシドの Nuclear Egress と呼ばれます。Egressの意味は「囲いから出ていく」です。また,BGLF4キナーゼは後期遺伝子転写を正に制御もします。 多機能ウイルスタンパク質による宿主タンパク質の制御が幾重にも重なってウイルス複製に適した環境が形成されていく.このように整えられた細胞内環境は,S期 CDKs(Cyclin A- および Cyclin E-CDKs)は高い活性を示すが,宿主のゲノム複製は起きないという S 期に類似した状態で S 期様環境と呼んでいる 。CDK( Cyclin-dependent Kinase略してCDK)とは何でしょうか?サイクリン依存性キナーゼと訳し,細胞がいつ分裂し、いつ分裂すべきでないのかを制御しているのはサイクリン(cyclin)とサイクリン依存性キナーゼ(cyclin-dependent kinase、CDK)である。制御なき増殖はがんの特徴の一つなので、制御は絶対に欠かすことはできないのです。
EBV の溶解感染では,ほぼすべてのウイルス遺伝子が秩序立ったカスケードによって発現する.まず,転写因子をコードしている前初期遺伝子BZLF1とBRLF1が発現し,溶解感染が開始する.BZLF1タンパク質とBRLF1タンパク質は,ウイルスゲノム複製に必要なウイルス遺伝子群(初期遺伝子)の発現を誘導する.初期遺伝子産物がウイルスゲノムを複製すると,新規に合成されたウイルスゲノムを鋳型として,ウイルス粒子形成に必要な遺伝子がコードされている後期遺伝子が発現する.S 期様環境はウイルス遺伝子発現にも適した環境である.S 期 CDK(サイクリン依存性キナーゼ)の 活性が高い状態であるため,Rbタンパク質 は高リン酸化状態となり,E2F 転写因子が遊離する.Rb遺伝子とはがん抑制遺伝子の一つであり、網膜芽細胞腫の原因遺伝子として初めて発見された。細胞周期がS期へ移行するのを抑制しているほか、現在では多くの癌の発症に関与しているのがRbタンパク質なのです。E2F-1 は宿主の複製タンパク質の発現を誘導するとともに,EBV の DNAポリメラーゼを含む初期遺伝子の転写も誘導する.E2F-1とは転写因子で、ヒトではE2F1遺伝子によってコードされるタンパク質です。E2F-1 は宿主 DNA 損傷応答によっても活性化するため,EBV 溶解感染では少なくとも 2 つの制御系により活性化されている.さらに,S 期 CDK(サイクリン依存性キナーゼ)の 活性は後期遺伝子発現の時間的な制御にも関わる。EBV を含む β- および γ- ヘルペスウイルスではウイルス後期遺伝子の転写が,ウイルスのコードする転写調節因子複合体(viral pre-initiation complex; vPIC)によって制御される.この vPIC 複合体(viral pre-initiation complex; vPIC)の構成因子である BDLF4 は,S 期 CDKsの基質であり,ウイルス複製の進行とともに BDLF4 は高度にリン酸化される.低リン酸化状態の BDLF4 は不安定で,すぐにユビキチン化され,分解されてしまう.ユビキチン化とは何ですか?
ユビキチンがついたタンパク質は、巨大酵素「プロテアソーム」へと運ばれます。 そこでタンパク質はアミノ酸へと分解され、新しいタンパク質の原料としてリサイクルされるのです。 ユビキチンという目印がついたタンパク質をプロテアソームが食べて、小さいアミノ酸へと分解。 アミノ酸は新しいタンパク質へと再生される。プロテアソームとは、ユビキチン化されたタンパク質を選択的に分解する巨大で複雑なタンパク質分解酵素が多数集まった複合体である。ユビキチン化されたタンパク質の除去により、細胞周期・アポトーシス・シグナル伝達・転写制御・品質管理・シナプス可塑性などに関与する。ヘルペス感染とherpes増殖による細胞溶解により①細胞周期・②アポトーシス・③シグナル伝達・④転写制御・⑤タンパク質の品質管理・⑥神経シナプス可塑性などの破綻により異常タンパク質の細胞内蓄積を来たし、神経変成疾患の発症が見られるのです。herpes増殖による細胞溶解のために用いられるEBウイルスの遺伝子の数はほぼすべての80種類のすべてがEBウイルスの遺伝子複製増幅装置がフル回転してローリングサイクル型の増幅で100倍~1000倍以上にEBウイルスが増え恐ろしくなるほどに増えていくのです。この時に細胞変性効果と言われる現象が起こるのです。細胞変性効果(Cytopathic effect略して CPE )は、ウイルスの侵入とウイルス増殖によって引き起こされる宿主細胞の形態変化のことです。 ウイルス感染により、宿主細胞が文字通り溶解して細胞が壊死してしまう場合や、細胞の複製が阻害され溶解しなくても細胞が死滅する場合がある。 これらの現象はどちらも細胞変性効果(CPE)が原因で発生するのです。
ローリングサイクル型(輪転がし)増殖とは何でしょうか?環状の二本鎖DNAをゲノムとするプラスミドやherpesウイルスゲノムで用いられるゲノム複製様式で、リーディング鎖が環に沿って移動し,直鎖状の新生DNAがつくられる。反復DNA配列が同様な機構で複製増幅されます。一方、組換えによってゲノムに挿入され増幅する機構も存在します。
しかし,BDLF4 はリン酸化により安定化し,vPIC(viral pre-initiation complex) が形成可能となる。そのため,溶解感染の後期に BDLF4 が安定化し,後期遺伝子の発現を誘導するという時間的な制御が可能となる。このように,EBV は溶解感染の進行に伴う宿主環境の変化を巧みに利用し,ウイルス遺伝子発現の時間的な制御を行っている(図 2)。ウイルス遺伝子発現は時間的な制御だけでなく,空間的な制御も受けている。溶解感染細胞の核内には Replication-compartment(複製区画)と呼ばれる核内構造体が出現し,ウイルス複製工場として機能する.Replication compartment (複製区画)には複製と転写に関わる宿主タンパク質とウイルスタンパク質 が高密度に局在しています。溶解感染の初期には核内に点在するように存在する Replication compartment は,ウイルス産生に伴って,最終的には核内の大部分を占めるまで成長する。免疫染色と3 次元再構成解析により,Replication compartment はウイルスタンパク質 BMRF1 で形成されるコア構造が存在し,コア構造の内と外でウイルス前期遺伝子と後期遺伝子の転写がそれぞれ起こることを明らかにした.Replication compartment は膜構造を持たないオルガネラ様の構造体であるが,その形成には液 – 液層分離が関与している。したがって,EBV はウイルス遺 伝子の転写を時空間的に制御することで,効率的な子孫ウイルス産生を達成する.
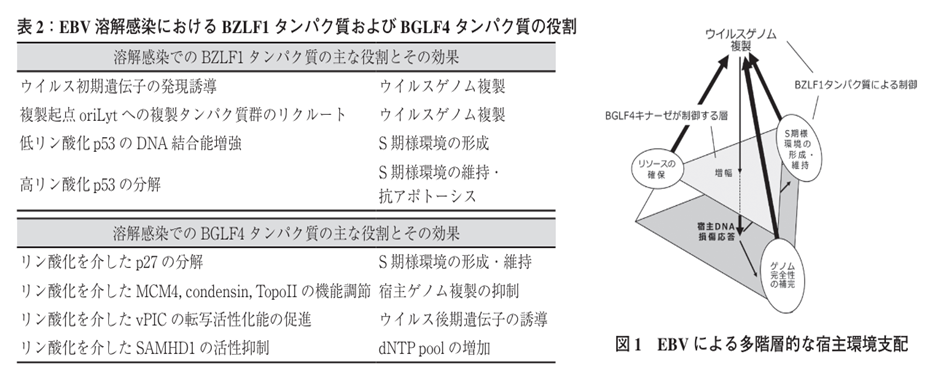
次元再構成解析により,Replicationcompartment(複製区画) はウイルスタンパク質 BMRF1 で形成されるコア構造が存在し,コア構造の内と外でウイルス前期遺伝子と後期遺伝子の転写がそれぞれ起こる。上の表2の複4行目の複製起点oriLytとは何でしょうか? ヒト腫瘍ウイルスEBVウイルスの 2本鎖DNAウイルスは約180 kbでつまり18万bで、 潜伏感染と増殖感染で異なる複製起点で潜伏感染でoriP, 増殖感染でoriLyt となります。EBVゲノム䛿宿主染色体に結合し、持続感染する。
oriPとはorigin of plasmid replication でplasmid 宿主染色体とは独立に自律複製して遺伝できる染色体外遺伝因子です。oriLytとはorigin of lytic replicationでエプスタイン・バーウイルスの溶解性複製起点と訳し、複製エピソームと前骨髄球性白血病タンパク質の核小体および複製コンパートメント(Replicationcompartment)との関連を媒介するのです。
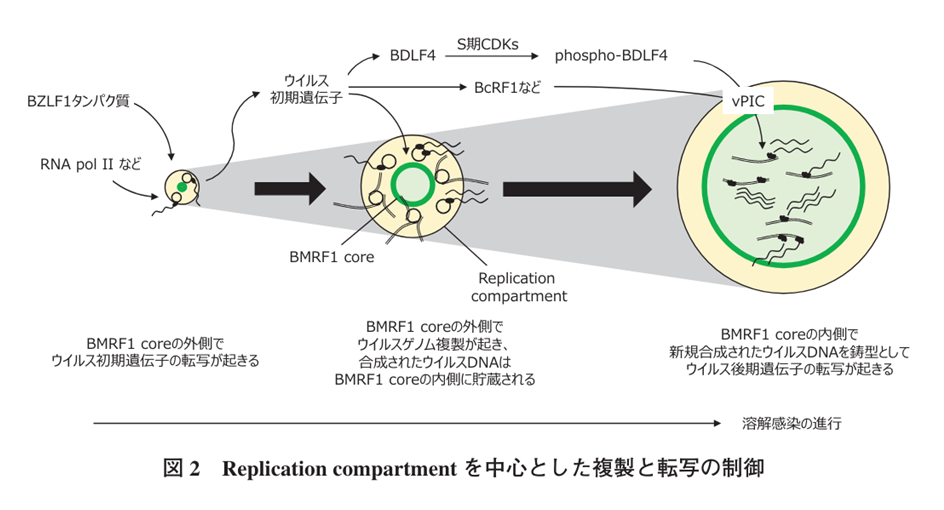
Replication compartment(複製区画) は膜構造を持たないオルガネラ様の構造体であるが,その形成には液– 液層分離が関与している。複製区画とは遺伝子複製工場のことです。したがって,EBV はウイルス遺伝子の転写を時空間的に制御することで,効率的な子孫ウイルス産生を達成する.
EBV 溶解感染細胞内の環境がウイルスによって,多重かつ多階層的に,そして,緻密に制御されていることを紹介した.溶解感染は子孫ウイルス産生に必須であるが,溶解感染関連遺伝子(溶解感染時に発現するウイルス遺伝子)の一部は,ウイルス産生時の他にも発現し,機能を果たしている.例えば,EBV が B リンパ球へ初感染する場合にも一部の溶解感染関連遺伝子が発現し,感染細胞のアポトーシスを抑制していることや,潜伏感染の成立までの間に不完全な溶解感染を経由することもあります。
EBVのゲノムが感染した細胞に組み込まれ潜伏感染の間に細胞のゲノムの組み換えが起こって癌関連遺伝子が癌化して発がんとなるのです。個体でのウイルス発がんは潜伏感染だけでなく,EBVが何十億単位で増殖する溶解感染でしばしばみられるのです。更に臨床検体を使用した EBV 関連腫瘍の溶解感染でも、特に不完全な溶解感染であるウイルス複製は起きますが粒子形成が完結しないEBV 関連腫瘍もあります。したがって,溶解感染による細胞内の環境変化はウイルス産生に留まらず,EBV 関連癌疾患と密接に関連している。さらに,組織中でのウイルス感染を考えると,感染細胞の隣には必ず非感染細胞(未感染細胞)が存在し,EBVそれらの未感染細胞にも感染してしまうとそれらの細胞のゲノムに組み込まれたEBVが細胞のゲノムを組み替えて新しい癌細胞を作り続けることになるのです。
もっともっとと書き加えていくうちに長文になってしまったのでここで一旦区切りを入れます。続きはここを読んでください。
