IgA腎炎はじめあらゆるタイプの腎炎の原因はherpesですからヘルペス性腎炎と言うべき感染症ですから完治させることが出来ます。IgA腎炎はなぜ起きるのか?またIgA腎炎以外の一般の腎炎はどのようにして起こるのか?
膨大な量の論文になってしまったのでPart1、Part2と2つに分けましたがまた付け加えることがあるので増えると思います!アハハ!!1つにまとめたものはPDF形式で掲載させていただきます。
IgA腎炎はなぜ起こるのか?Part2
【PDF形式】IgA腎炎はなぜ起こるのか?
IgA腎炎とは何でしょうか?何故、糸球体にヘルペスウイルスを血清IgA抗体のFabで捕まえたIgA抗体性免疫複合体になりこれが血液に流れて糸球体メサンギウム領域のFcレセプターをもったメサンギウム細胞にIgA抗体複合体のFc部分と結合してメサンギウム細胞の食作用によって取り込まれることがIgA腎炎という感染症の始まりとなるのです。そこでメサンギウム細胞に感染したherpesと免疫細胞と炎症を起こし始め更に殺されきれなかったherpesが合胞体細胞である巨大な一本のメサンギウム細胞に次々と感染増殖していきます。増殖した膨大な数のherpesビリオンは更に糸球体の濾過の機能を果たしている三要素である糸球体基底膜細胞、血管内皮細胞、血管上皮細胞(足細胞)に感染してIgA腎炎が生じるのです。どのようにしてIgA腎炎はじめ全ての種類の腎炎がヘルペスと免疫の戦いによる炎症によって起こるのかを詳しく根本から説明しましょう。
免疫グロブリンA( Immuno‐globulin A略して IgA)とは、何でしょうか?五種類の抗体の免疫グロブリンの一種であり、免疫グロブリンの抗原結合部位(Fab)を形成する2つの重鎖(α鎖)と2つの軽鎖(κ鎖かλ鎖)から構成されます。IgA分子は2つの抗原結合部位を有しているが、気道や腸管などの粘膜の分泌液中ではJ鎖(Joining Chain略してJ鎖)と呼ばれるポリペプチドを介して二本のIgA分子を結合することにより2量体を形成して存在しているため4箇所の抗原結合部位を持つので四つの抗原やherpesをはじめとする病原体と結びつくことができる分泌型IgAであり英語でsecretory immuno‐globulin Aで略してSIgAと書きます。この二量体の分泌型IgAは粘膜免疫の主役であり粘膜抗体と言われ、消化管や呼吸器や泌尿器における粘膜免疫機構の最前線の適応免疫として機能していますが、腎臓の糸球体は毛細血管からできているので粘膜ではないので何故毛細血管の塊である糸球体にIgA腎炎が生じるのか100年以上もかかっても誰も解明していないのです。が実はIgA腎炎は糸球体メサンギウム細胞に感染したherpesが原因であるのです。つまりIgA腎炎はメサンギウム細胞に感染したherpes性の感染症であることを証明したいためにこの長い長い論文を書いているのです。
IgA抗体をコード(暗号)する遺伝子にはIgA1とIgA2の2種類が存在します。これらのIgA1とIgA2の2種類サブタイプは、抗体の重鎖の分子量と血清における濃度が異なるので分類されています。血清中に存在する単量体IgAあるいは2量体IgAは少ないのですが血清中にはIgA1が約90%と圧倒的に多いのです。IgA2は二量体IgA2として腸管の粘膜に非常に多いのでIgA2は粘膜抗体と言われるのです。一方ヘルペス性IgA腎炎はIgA1を主体としたIgA1免疫複合体の形成とそれに基づくメサンギウム細胞性糸球体腎炎であるIgA1腎炎発症の主な原因でありますが、IgA免疫複合体にはIgA1型とIgA2型の二つが存在しているのです。
ヒトのIgA抗体にはIgA1型と IgA2型の2つのアイソタイプがあり、血清中の90%以上はIgA1型であるのに対し、粘膜上ではおよそ半分はIgA2型である。 IgA2型はある種の病原性細菌の産生するプロテアーゼによっても分解されない耐性をもち、IgA1型と合わせて様々な病原体に対する防御機構を備えています。
IgA サブクラスにはIgA1とIgA2がありその違いは何でしょうか?
IgA1 は血清中の総IgA濃度の約 85% を占めます。IgA1 はいくつかのプロテアーゼに対して広い耐性を示しますが、ヒンジ領域で切断されるものもあります。ヒンジ(蝶番)領域とは、抗体の軽鎖(L鎖)と重鎖(H鎖)の C 領域ドメイン間のH鎖領域であり、ジスルフィド結合によって両鎖共に保持されます。IgA1 は、タンパク質抗原に対しては良好な免疫応答を示し、多糖類およびリポ多糖類に対しては低い免疫応答を示します。プロテアーゼ (protease)とは、何でしょうか?タンパク質をより小さなポリペプチドや単一のアミノ酸への分解を速める触媒作用を持つ加水分解酵素の総称である。ペプチダーゼ (peptidase) やプロテイナーゼ(proteinase)とも呼ばれる。それらは、水が反応して結合を壊す加水分解によってタンパク質内のペプチド結合を切断する。プロテアーゼは、摂取したタンパク質の消化、タンパク質の異化作用 (古いタンパク質の分解)、細胞シグナル伝達など、多くの生物学的機能に関与しています。プロテアーゼのような酵素の助力機構がない場合、タンパク質分解は非常に遅く、何百年もかかる反応なのです。
IgA2 は血清中の総 IgA の最大 15% しかなく、気道、眼および胃腸管の粘膜における多糖抗原およびリポ多糖抗原と戦う重要な役割を果たします。また、タンパク質分解や多くの細菌の持つプロテアーゼに対して良好な耐性を示すことから、IgA2 は細菌感染防御に重要であるのです。
IgA2は加水分解酵素が詰め込まれているライソソーム(リソソーム)にあるいくつかのプロテアーゼに対して広い耐性を示すのです。仮に糸球体血管に流れ着いてメサンギウム領域のFcレセプターをもったメサンギウム細胞にIgA2抗体複合体のFc部分と結合してメサンギウム細胞の食作用によって取り込まれても、ライソソーム(リソソーム)で加水分解されるためには抵抗性のあるプロテアーゼで分解されないIgA2 はライソソーム(リソソーム)の加水分解酵素で分解されにくいのです。従ってIgA2免疫複合体に捕まったヘルペスウイルスは分離されにくいのでいつまでもメサンギウム細胞の中で生き続けることになります。生き残ったherpesは最後はメサンギウム細胞の中で蘇り増殖するようになり新たなるherpes感染症を糸球体の毛細血管の支持軸となっている長い一本の合胞体となったメサンギウム細胞全体で引き起こしてしまいそこでも増殖を繰り返し増えたherpesビリオンはメサンギウム細胞外の糸球体のろ過のかなめの三要素の糸球体基底膜細胞、血管内皮細胞、血管上皮細胞(足細胞)に感染していき溶解感染により三要素の機能不全が起こり濾過機能が障害されてしまうのです。
このようにIgA は、ヘルペスウイルスのようなタンパク質抗原に対しては良好な免疫応答を示し、ヘルペスウイルスはIgA 抗体のFabに捕まりやすいので咽喉頭粘膜から侵入したherpes結合性IgA免疫複合体は組織に出てから一部はリンパ管に吸収されたり一部は毛細血管の血液に取り込まれ糸球体まで流れ着いてしまったのです。そこまで流れ着くまでにherpes結合性IgA1免疫複合体のFc部分に結合する補体や大食細胞との出会いがなかった数少ないIgA免疫複合体は最後は糸球体メサンギウム細胞のFcレセプターに出会い取り込まれたりメサンギウム細胞に沈着したりしてしまったのです。IgA免疫複合体に生き残ったヘルペスウイルスが原因なのです。本来IgAは二量体の分泌型IgAとして粘膜に存在するherpesや他の病原体と結びついて大便やタンや唾液や尿として体外に排出するために存在しているのです。その2量体IgA2である分泌型IgA2ではIgA2の割合が30-50%と血清型IgA1型に比べて多くなっています。血清中の90%以上はIgA1型であるのに対し、粘膜上ではおよそ半分はIgA2型なのです。
ヒトIgA1抗体に比較してIgA2抗体は主に粘膜系組織に分布し、二量体を形成しています。IgA2型は病原性細菌の産生するプロテアーゼによっても分解されない耐性をもち、IgA1型と合わせて様々な病原体に対する防御機構を備えているのですがそのほとんどが二量体の分泌型IgA2に結びついた細菌やヘルペスウイルスなどの腸管に存在している抗原を便として排出する仕事が二量体の分泌型IgA2の役割なのです。つまり単量体として用いられるIgA2抗体は少なく、粘膜免疫のための二量体を作るための原料としてIgA2抗体は用いられているだけなのにIgA1腎炎のIgA1抗体は珍しく単量体として利用されそれがヘルペスを捕まえてIgA1免疫複合体になったのです。勿論IgA2免疫複合体も存在しているのですがIgA腎炎のIgA抗体は血管に多いIgA1抗体であることは何を意味するのでしょうか? IgA1免疫複合体のIgA1がヘルペスを見つけて捕まえたのは咽喉頭粘膜からリンパや血液に出てきたものだけではなく、血管の内皮細胞に感染して炎症を起こしているヘルペスが血中に出たのをたまたま抗体IgA1のレセプターとherpesの抗原が合致して捕まえてできたIgA1免疫複合体が血流にのって糸球体毛細血管まで運ばれメサンギウム細胞のFcレセプターに出あい捕まえられたのがIgA1腎炎の始まりと考えられます。
IgA血管炎はヘルペスが血管の内皮細胞に感染して分裂・増殖して大量に増えたherpes粒子であるビリオンが血液に多いIgA1とぴったり結合してIgA1免疫複合体となり炎症細胞の王者である大食細胞に貪食され隣接する無限にある血管内皮細胞に感染した時に大食細胞に見つかり炎症が生じてIgA1血管炎が発生したのです。IgA1腎炎もIgA1血管炎も原因は全く同じherpesで病気の原因は同じことなのです。IgA2血管炎も存在しているのは言うまでもありません。
IgA血管炎とは何でしょうか? IgA血管炎は触れることのできる皮膚の毛細血管の内皮細胞にherpesウイルスが感染して免疫との戦いの結果、炎症が起こって毛細血管の内皮細胞が傷ついたり破壊された血管の内皮細胞から出血が起こり紫斑がみられ、更にあちこちの組織の血管の内皮細胞に感染したヘルペスによる炎症のために関節痛や腹痛などの痛みや下血などの消化管症状、例の腎障害を合併することがある全身性の小型血管炎です。紫斑とは何でしょうか?紫斑は皮膚や粘膜の肉眼的に観察可能な赤血球の血管外漏出による出血を紫斑と言います。透明なガラス板での圧迫による硝子圧で消退しません。紫斑は、成因により①紫斑病、②血管炎、③血行障害の3つに分けられます。紫斑はその大きさによっても、①点状紫斑、②中間型紫斑、③斑状紫斑の三つに分けられます。
IgA血管炎はherpesと結合したIgA免疫複合体血管炎であり、herpesと結合したIgA抗体を含む免疫複合体のFc部分と小血管の血管内皮細胞に沈着するナチュラルキラー細胞(NK細胞)のFcレセプターとが結合して抗体依存性細胞傷害 (Antibody Dependent Cellular Cytotoxicity略してADCC)によりNK細胞がヘルペス感染細胞である血管内皮細胞を破壊してしまうので紫斑病が生まれるのです。IgA血管炎に伴う腎症(紫斑病性腎炎)はIgA腎症と区別のつかない糸球体腎炎を呈するため、腎症に関してはIgA腎症と同一範疇の腎炎なのです。
人工的な抗体がつくられた抗体薬が抗がん剤として用いられます。この抗体薬はすぐ上で説明したADCCの作用を利用しているのです。しかもすべての癌の原因はヘルペスですからこの抗体薬はどのように癌細胞と結びついてADCC(Antibody-Dependent-Cellular-Cytotoxicityの略で抗体依存性細胞傷害)として抗ガン薬に用いられているのでしょうか?癌が持っている抗原に対する人工の抗体(薬)が殺すべきがん細胞の表面にこの抗体薬が結合すると、その抗体薬がマクロファージやNK細胞といった免疫細胞を呼び寄せます。呼び寄せられ結合した免疫細胞は癌細胞を攻撃し破壊するのです。故に、ADCC活性を有す抗体製剤が腫瘍細胞表面の抗原に結合すると、従来のシグナル伝達経路による抗腫瘍効果とは別に、ADCC活性による抗腫瘍効果が発揮できる可能性があります。抗腫瘍効果とは抗がん効果ともいわれ、がんの増殖と浸潤を抑制し、がん細胞を減弱させたり死滅させる効果のことをいいます。それでは従来のシグナル伝達経路による抗腫瘍効果とはなんでしょうか?癌の分子標的薬は癌細胞のみを標的とする薬剤で、小分子化合物とモノクローナル抗体の2種類が存在する。 小分子化合物の一般名には「nib(ニブ)」と付けられ、モノクローナル抗体の場合では「mab(マブ)」と付けられる。小分子化合物の一般名には「nib(ニブ)」と付けられ、モノクローナル抗体の場合では「mab(マブ)」と付けられる。
癌化した細胞内シグナル伝達経路の遮断を基盤としたがん小分子標的薬は、癌細胞では恒常的に活性化されたシグナル伝達経路を,グリベックやイレッサのような分子標的癌治療薬で遮断することによって,癌細胞に効果的に細胞死 を誘導することが可能となります。
一方ADCCを活性化することによってADCC活性を有す抗体製剤が腫瘍細胞表面の抗原に結合すると、その抗体薬がマクロファージやNK細胞といった免疫細胞を呼び寄せてADCC効果によって呼び寄せられ結合した免疫細胞は癌細胞を攻撃し破壊するのです。
過去にはヘノッホ・シェーンライン紫斑病、アナフィラクトイド紫斑病、アレルギー紫斑病などと呼ばれていたが現在はIgA血管炎の病名となり現在は紫斑、関節痛、腹痛、腎障害を特徴とするherpesと結合したIgAの関与する小血管炎であることがわかりIgA血管炎として統一され小血管内の内皮細胞周辺に主にIgA1の沈着を伴う血管炎として定義されました。血管に多いのはIgA1ですからIgA1血管炎となるのです。この血管炎の原因も血管内膜に感染したヘルペスが感染したことが原因であるのです。急に下肢に紫斑が広がり関節痛、腹痛、腎障害をきたすherpesによる炎症性免疫疾患であります。病初期のIgA上昇や小血管でのIgA1型免疫複合体沈着を特徴とします。粘膜抗体は二量体の分泌型IgA2であります。IgA1腎炎やIgA1血管炎のIgA1抗体は珍しく単量体として利用されているのです。
IgA血管炎の症状はIgA血管炎は小児に好発するため、全体の約半数は5歳以下で発症します。17歳未満の発症率は年間10万人あたり10~20人であり、性差は男児に多く、女児の1.2~1.8倍になります。症状は触れることのできる紫斑、関節症状、消化管症状、腎障害がIgA血管炎の4徴です。皮膚症状はほぼ100%の症例で認められる症状で、関節症状は60~80%の症例、消化管症状は60~70%の症例、腎障害は報告自然寛解によりばらつきがありますが20~60%の症例に腎炎を合併し、そのうち80~90%は自然寛解あるいは適切な治療にて改善します。なぜならば濾過の役割を持つ糸球体の毛細血管にヘルペスが感染して糸球体の毛細血管が破壊されてしまうと再生しないので腎炎が起こりますが、血液を運ぶだけの一般の毛細血管は破壊されて自然に血管が再生されてしまうので自然寛解で治ってしまうのです。しかし、ステロイドを投与するなどの間違った治療を行うと原因であるヘルペスが増えていくので3~20%は治療抵抗性あるいは治療に反応するが再燃を繰り返し、末期腎不全に至る症例もあります。これも医原病の一つなのです。
病理組織検査の皮膚組織所見は好中球破砕像を特徴とする壊死性血管炎の所見を認め、血管に沿ってIgAの沈着を認めます。
腎組織所見は血尿や蛋白尿を認める症例や腎機能障害を呈する症例では、他の腎炎との鑑別や腎症の重症度判定のため腎生検を行うことが重要となると言われていますが無駄なことです。腎組織所見は多彩ですが、IgA腎症と鑑別することが難しい組織像を呈します。
IgA血管炎の治療アルゴリズムはIgA血管炎の多くの症例は自然寛解あるいは対症療法で改善します。治療アルゴリズムとは何でしょうか?アルゴリズムとは問題を解く一連の手順、計算方法です。 臨床においては、大まかな診断や治療の手順のことですが原因がわからずにアルゴリズムを利用するのは間違っています。病気を治すのに治療アルゴリズムはいりませ必要ありません。原因がヘルペスですからは治療アルゴリズムは必要ないのです。
成人発症の腎症を合併する症例では末期腎不全に至る症例もあり、副腎皮質ステロイドや免疫抑制療法を要する場合があるのはステロイド投与すると、herpesとの戦いが見かけは無くなるので良くなったと患者に思わせるためです。しかし原因であるヘルペスは増え続けるのでステロイドは人殺し医療の最悪のくすりです。消化管症状の中には腸重積や大量下血、腸管穿孔を呈する重症例もあるのは間違った医療の結果です。
免疫グロブリン IgA クラス(IgA抗体)についてもっと詳しく見ましょう。
IgA は、血清中に単量体および二量体の形態で存在し、総血清 Ig の約 15% を占めています。二量体である分泌型 IgA は、粘膜分泌物 (腸液や唾液および涙) 中に豊富に存在するため、一部の局所感染に対する一次防御機構となります。分泌型 IgA の主要な機能は、抗原を破壊することではなく、循環系への異物の侵入を防ぐことであり、肛門から病原体を大便として排泄することが主な仕事です。
IgA の構造とIgA の特性を詳しく見ましょう。
①分子量:320,000 (分泌性)
②H 鎖のタイプの分子量(molecular weight略してMW): α 鎖 (55,000)
③血清濃度:1 ~ 4 mg/dL
④血清中の総免疫グロブリンに占める割合:15%
⑤グリコシル化 (重量 %): 10%。グリコシル化 (Glycosylation)は、タンパク質もしくは脂質へ糖類が付加する反応である。 糖鎖付加(とうさふか)とも言う。 この反応は、細胞膜の合成やタンパク質分泌における翻訳後修飾の重要な過程の1つであり、こういった合成の大部分は粗面小胞体で行われる。
⑥分布は血管内およびリンパ管内やあらゆる粘膜の分泌物に見られます。
⑦主な機能は 粘膜をヘルペスウイルスや細菌などの病原体からの保護ですが他に血液やリンパ液に侵入した侵入したヘルペスウイルスや細菌などの病原体から守ることです。
免疫応答における IgA の役割を見ましょう。
IgA は、健康な血清中の総免疫グロブリンの約 15% を占めます。ヒトには 2 つの IgA サブタイプ、IgA1 および IgA2 が存在します。これらIgA1 および IgA2のサブタイプは、重鎖の分子量と血清における濃度が異なります。機能は変わりません。
血清中の IgA は主に単量体ですが、唾液、涙、初乳、粘液、汗および胃液などの分泌物中では IgA は連結ペプチドによって結合した二量体の分泌型として存在します。大部分の IgA は二量体の分泌型で存在します。これは、人体の腸管などの中空臓器などの管の上皮表面に付着し体内に侵入する病原体を防ぐ特性が発揮できるからです。IgA は非常に弱い補体活性化抗体です。何故ならば病原体とIgAと結合して大便として排泄するだけで役割は終わるからです。そのため、補体系を介した細菌細胞溶解を誘発しません。しかしながら、細菌と結びついた分泌型 IgA は分泌液に多くの存在しているリゾチーム と、共に作用し、細菌細胞壁中の糖鎖を加水分解することによって、免疫系による感染除去を可能にします。
IgA は主に上皮細胞表面に見られ、中和抗体として作用します。中和抗体とは何でしょうか?中和抗体は、ウイルスなどの病原体が細胞に対して及ぼす生物学的な毒素の影響を中和して、細胞を防御する抗体です。中和によって病原体や感染性粒子は感染性や病原性を失う。中和抗体は、ウイルス、細胞内細菌、微生物毒素に対する適応免疫系の体液性応答の一部です。リゾチームとは、リゾチーム(Lysozyme、別名は ムラミダーゼ)は糖質加水分解酵素ファミリーに分類される酵素であり、真正細菌(バクテリア)の細胞壁を構成するペプチドグリカンを加水分解する機能を持つ。ペプチドグリカン(Peptidoglycan)とは、細菌の細胞壁にあるペプチドと糖からなる高分子化合物の一種。具体的には、ペプチドグリカンを構成するN-アセチルムラミン酸とN-アセチルグルコサミンとの間に形成されるβ-グリコシド結合を加水分解する。グリコシド結合とは、ヘミアセタールとアルコールなどの有機化合物のヒドロキシ基との間の結合である。単糖のヘミアセタール(Hemiacetal)とは、アルデヒドとアルコールから形成するのがヘミアセタール、ケトンとアルコールから形成するのがヘミケタールの二種類があります。何故、単糖の化合物にヘミアセタールとヘミケタールの二つがあるのでしょうか?単糖であるグルコースには単糖にはブドウ糖分子の末端部の形によって二タイプに分かれアルデヒドになったのがアルドースでありグルコース(ブドウ糖)がその代表であり、もう一つが末端の分子がケトンになったのがケトースであり、その代表がフルクトース(果糖)の2種類あるからです。ヘミの意味は「半分」であり「半分似ている」という意味で使われているのです。本来アセタールの定義は同一炭素原子が2個のエーテル結合をしたような構造を含む化合物の総称なのです。エーテル結合とは1個の酸素原子に2個の炭化水素基が結びついている時に、酸素と炭素の間に見られる結合は(-C-O-C-)ですから「コックのエーテル結合」と覚えておきましょう。一般に化学的に安定な結合がエーテル結合なのです。
(-C-O-C-)というエーテル結合とはアルデヒドもしくはケトンに酸触媒下でアルコールを縮合させると得られるので、 かつてはアルデヒドから得られるものをアセタール、ケトンから得られるものをケタールと呼んで区別していましたが、現在はいずれもアセタールと呼びます。縮合(しゅくごう)とは、同じ種類、または異なる種類の2つの分子から水やアルコールなどの 簡単な構造の分子が離脱して、残った2つの分子が結合する反応のことです。 付加離脱反応とも呼びます。 水(H₂O)が離脱する場合を特に脱水縮合とも呼びます。ヘミアセタールとはアルデヒドとアルコールから形成するのがヘミアセタール、ケトンとアルコールから形成するのがヘミケタールなのです。
リゾチーム(lysozyme)は別名ムラミダーゼであり、自然界に広く分布し、鶏卵を始め人間の体液や涙、唾液、鼻汁、血液等や植物に至るまで広範囲に存在する細菌から生体を防御できる酵素です。病原菌の細菌を保護している細胞壁(cell wall)を攻撃して分解する小さな酵素です。細菌の細胞壁を構成するムコ多糖類を加水分解することにより細胞壁の強度を低下させ、細菌を破裂させる作用のある酵素で溶菌酵素ともいう。ムコ多糖類とは何でしょうか?グリコサミノグリカンの名称で呼ばれることが多い。「ムコ多糖類」の「ムコ」は粘液の意の英語のムコイド( mucoid )から名付けられた粘液質の多糖類で、糖質とアミノ酸やウロン酸、またはその硫酸エステルからなる。エステルとはアルコールとカルボン酸の脱水縮合反応で作られる有機化合物です。ウロン酸(uronic acid)とは、単糖を酸化して得られる誘導体のうち、主鎖の末端のヒドロキシメチル基 (-CH2OH) がカルボキシ基 (-COOH) に変換された、カルボン酸の総称です。ヒアルロン酸、コンドロイチン硫酸、ヘパリンなどがある。ヘパリンとは、豚などの腸粘膜から原料を採取された薬剤で、抗凝固薬として血液凝固を防止する作用を持っている粘液質の多糖類。糖質とアミノ酸やウロン酸、またはその硫酸エステルからなる。ヒアルロン酸、コンドロイチン硫酸、ヘパリンなどがある。リゾチームはこの炭水化物の鎖を分解し、細胞壁の構造的強度を損なわせる。そして細菌は自分自身の内圧によって破裂する。
リゾチームを発見したのは誰でしょうか?世界で最初の抗生物質を発見したアレクサンダー・フレミング(Alexander Fleming)でした。彼は、医療用の抗生物質(antibiotic)を念入りに調べる中でリゾチームを発見しました。彼は私たち自身が持つ、感染に対抗する自然防御の1つのリゾチームを発見したのであった。残念ながら、リゾチームは大きな分子なので、薬としてあまり使いやすいものではない。リゾチームは局所的に使うことができるが、身体全体の病気を取り除くことはできない。なぜなら人体の細胞間を移動するには分子が大きすぎるからである。
疾患における IgA 欠損症については、最も一般的な抗体欠損は、選択的 IgA 欠損症 (Selective immunoglobulin A (IgA) deficiency 略してSIgAD) です。IgA1 と IgA2 の比率の変化は、多くの場合、気道の再発性感染症または IgA 腎症と呼ばれる腎障害などの特定の疾患状態と関連しています。体内の免疫グロブリン A(IgA)レベルの低下を導くさまざまな重篤な健康状態が存在していますが、そのうちの 1 つは淋病です。淋病は淋菌(Neisseria gonorrhoeae)という細菌に感染することで、生殖器を中心に炎症を起こす性感染症の一種です。 性行為により男性の尿道や女性の子宮頚管のほか、咽頭粘膜(喉の粘膜)などに感染します。淋菌は、IgA 抗体を Fc 断片および Fab 断片の二つにスプライスする酵素を生成します。Fab部分は細菌を依然として認識できますが、Fc 断片がなければ食細胞が付着できません。体内に十分な量の IgA がない場合、その人は選択的IgA欠損症と診断される可能性があります。選択的 IgA 欠損症患者は、他の抗体は正常レベルで、T 細胞、食細胞、および他の免疫系成分は完全に機能します。選択的 IgA 欠損症(SIgAD)患者は、関節リウマチ、ループスなどのherpesによる自己免疫疾患により罹患しやすくなり、又アレルギーおよび喘息などのアレルギー疾患にもより罹患しやすい傾向があります。自己免疫疾患は存在しないので、かつ自己免疫疾患の原因はヘルペスでありアレルギーの原因は化学物質ですからIgAは他の四つの抗体が持っていない特性を持っているかもしれませんね。この特性はIgA 腎症と何か関わりがあるかもしれませんね。IgG腎症やIgM腎症は存在しないからです。
なぜIgG腎症は存在しないのでしょうか?IgG抗体のFab領域にヘルペスウイルスが捕まえられたIgG免疫複合体が作られ糸球体のメサンギウム細胞まで血流に乗って運ばれてもIgG抗体のFc領域に結合できるFcレセプターをメサンギウム細胞にはないのでヘルペスウイルスを取り込むことが出来ないのでメサンギウム細胞にはヘルペスウイルス感染は起こりえないからです。因みにIgG抗体の半減期(体内で半分に消失する期間)は約3週間程度です。
なぜIgM腎炎は存在しないのでしょうか?それではIgM抗体のFc領域に結合できるFcレセプターをメサンギウム細胞は持っているのでIgM抗体のFc領域に結合できるメサンギウム細胞のFcレセプターと結合してエンドサイトーシスで取り込めるのに何故メサンギウム細胞にヘルペスが感染出来ないのでしょうか?IgAの半減期は約5日です。一方IgM抗体の半減期は一日です。免疫グロブリンの中で最大の分子量を持ち、感染症で最も早期に増加する抗体である。IgMは、分子量約900,000ダルトンの糖蛋白で通常は五量体構造をとっており、単量体で存在するのは極めて少ないのです。五量体のIgMでherpesと免疫複合体を作って糸球体のメサンギウム細胞に取り込まれることは絶対にありません。
免疫グロブリンの中で最も分子量が大きく、五量体のIgMは通常5対の10本のHeavy chain(IgMではμ鎖)と、5種類の全ての抗体(免疫グロブリン)に共通なLight chain(κ鎖とλ鎖のいずれかを2本)より構成されている。Heavy chainがμ1、μ2の2種類存在しているため、μ鎖の違いによってIgM1とIgM2の2つのサブクラスに分類される。
IgMは抗原刺激により最初に産生される抗体で、IgGと比べると産生量も少なく、半減期も約Ⅰ日と極めて短いのでヘルペスとIgM抗体と免疫複合体を形成してメサンギウム細胞まで旅をする余裕もありません。また、感染初期の補体結合性やオプソニン活性が非常に強く、細菌などに対する迅速な免疫防御反応や赤血球の凝集に強力な作用をおよぼしていますがヘルペスウイルスは急性感染を起こすウイルスではありません。しかしヘルペスはヒトの細胞に感染すると細胞にまず隠れてしまい、宿主の免疫が落ちかつ潜伏感染で隠れている細胞が分裂増殖するまでは増殖しないので増えたヘルペスビリオンも組織や血液やリンパ液には感染後すぐにはでてこないのです。
IgA サブクラスについて。
①IgA1。IgA1 は血清中の総IgA濃度の約 85% を占め、従ってIgA2 は血清中の総 IgA の最大 15%を占めています。IgA1 はいくつかのプロテアーゼに対して広い耐性を示しますが、ヒンジ領域で切断/スプライスするものもあります。IgA1 は、タンパク質抗原に対しては良好な免疫応答を示し、多糖類およびリポ多糖類に対しては低い免疫応答を示します。
②IgA2。IgA2 は血清中の総 IgA の最大 15% しかないのですが、気道、眼および胃腸管の粘膜における多糖抗原およびリポ多糖抗原と戦う重要な役割を果たします。また、タンパク質分解や多くの細菌プロテアーゼに対して良好な耐性を示すことから、IgA2 は細菌感染防御に重要であります。
全IgA中における血清IgAの占める割合は10%程度であり、90%近くのIgAのほとんどは二量体として主に腸管粘膜に存在しているのです。しかも人体の抗体としては腸管粘膜のIgAは血液に一番多いIgGよりもはるかに多いIgAが腸管に存在しています。人体に最も多い抗体はIgGではなくてIgAなのです。IgG は血液に一番多いだけの話なのです。IgA腎炎を起こしている分泌型ではない血清型IgA1単量体のIgA1であり、そもそも糸球体では2量体IgA(分泌型IgA)は存在していませんし、2量体IgA(分泌型IgA2)が血液に流れることはほとんどないのです。しかしherpesがIgGと免疫複合体を形成して糸球体毛細血管まで流れ着いて糸球体でIgGのFc部分と結合した大食細胞に食われて炎症が起こり軽い一過性の腎炎が起こることもありますがメサンギウム細胞に取り込まれることは無いのでIgG腎炎は生じません。
因みに、二量体の分泌型IgA2は初乳中に含まれ、新生児の消化管を細菌感染やherpesウイルス感染から守る働きを持っています。この分泌型IgAを母子免疫抗体と言います。母子免疫抗体にはIgG抗体(免疫グロブリンG)も関与していますが、免疫グロブリンGは胎盤を介して胎児に移行して胎児を細菌感染やウイルス感染から守るのです。IgA抗体はヒトにおけるIgGの血清中の5種類の免疫グロブリンの中でIgGに次いで2番目に多いのですが、粘膜ではIgAの産生量は一番多いので腸管粘膜ではIgAはIgGよりもはるかに多いどころか人体で最も多い抗体はIgAなのです。IgAの分子量は血清型の単量体では16万ダルトンの糖蛋白です。IgGは、血液中に最も多く存在し、血液においては量的には免疫グロブリン全体の約80%を占め、液性免疫の主役で、IgGは分子量約15万ダルトンの糖蛋白です。IgMは、5個のIgMのサブユニットから構成された分子量約90万ダルトンの巨大な免疫グロブリンなので、マクログロブリンとも呼ばれます。単量体のIgMの分子量は約16万ダルトンですから16万×5ですから5量体は約90万ダルトンとなる糖タンパクです。
IgGのIgとは何でしょうか?Immuno‐globulinの頭文字の透字後の略がIgで「免疫グロブリン」と訳し「免疫に関わるグロブリン」であり「抗体としての機能を持ったタンパク質」のことです。それではグロブリンとは何でしょうか?グロブリンの元の意味は「球状タンパク質」であったのですが、現在は球状をした単純タンパク質の一種となり、動植物の組織および体液中にアルブミンとともに広く存在する。グロブリンは、α1、α2、β、γの4つに大きく分類される。血清蛋白の多くは、肝臓で合成されるが、γグロブリンは免疫グロブリンであり、免疫細胞(B細胞、形質細胞)で合成される。glob-は、球状を表す接頭語で、globe(球・地球)、glomerular(糸球体)などに使われています。したがって、球状蛋白という意味合いであるが、アルブミンも球状であるため、必ずしもグロブリンの特徴を表しているわけではない。血清グロブリンは電気泳動により、α、β、γの3つにわけられます。α‐グロブリンはビタミンやホルモンなどの運搬にあたり、β‐グロブリンはビタミン、ホルモンおよび銅の運搬にあたります。γ‐グロブリンは免疫抗体を含み、血清免疫学的に重要な分画で、抗体産生細胞である形質細胞で作られ、免疫グロブリンと呼ばれIgG、IgA、IgM、IgD、IgEの5種に大別されます。
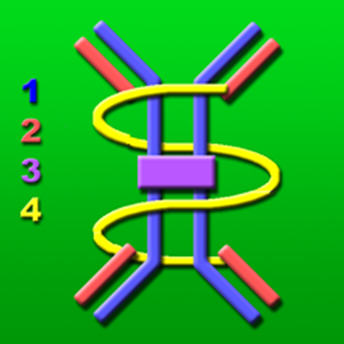
左に二量体の分泌型IgAを図示します。赤色の2のJ鎖(joining鎖)を介して2分子のIgAが結合し、それに対してさらに黄色の4の分泌成分( Secretory Component, SC)が結合している。
1.重鎖(H鎖)
2.軽鎖(L鎖)
3.J鎖(joining鎖)
4.SC( Secretory Component, 略して
SC訳して分泌成分です。何故分泌成分と言われるのでしょうか?それは腸管粘膜の上皮細胞の基底膜側に存在している分泌されたタンパク質なので分泌成分( Secretory Component,略して SC)と呼ばれるのです。この分泌成分はIgA抗体と左上の図のように結合して粘膜の上にある粘膜上皮細胞内へ取り込まれ、粘膜上皮細胞の中を通って腸管腔側へと分泌されるのです。この分泌成分(SC)の役割りは二量体のIgAが粘膜の上皮細胞内を通り過ぎるときに上皮細胞内にあるタンパク質分解酵素による分解から保護する役割をしているのです。)
本来粘膜分泌抗体であるIgAは形質細胞により産生されるJ鎖と結合し2量体として分泌される。図に示したように2量体IgAはその後、粘膜上皮細胞の基底膜側に発現している分泌成分( Secretory Component,略して SC)と結合して粘膜上皮細胞内へ取り込まれ、腸管腔側へと分泌される。分泌成分(SC)はIgAを粘膜上皮細胞内を通り過ぎるときに上皮細胞内にあるタンパク質分解酵素による分解から保護する役割をしているのです。
分泌型IgAの機能は何でしょうか?腸粘膜は常時、抗原や微生物やヘルペスウイルスなどにさらされているので、これらからあらゆる粘膜面を防御することです。とりわけ腸管粘膜という広くて長い消化器の粘膜において特別な免疫機構が存在しています。これを粘膜関連リンパ組織( Mucosa-associated Lymphoid Tissue, 略してMALT)と呼び、分泌型IgAが最も大切な粘膜抗体です。代表的なMALTとして①腸管関連リンパ組織.(Gut-Associated Lymphatic Tissue.略してGALT)、②気道関連リンパ組織(Bronchus-Associated Lymphoid Tissue 略してBALT) ③鼻咽頭関連リンパ組織(naso‐pharyngeal associated lymphoid tissue略してNALT)の腸、気道、鼻咽頭の主なる三つの部位の粘膜を感染から守っているのです。泌尿器や生殖器も粘膜から成り立っています。粘膜とは、消化器や呼吸器、泌尿器、生殖器などの管状あるいは袋状の器官の内側の表面にある膜をいいます。この膜からは粘り気のある液体(粘液)が分泌されます。分泌された粘液により微生物などの外敵の侵襲を防ぐ粘液層が形成されています。
粘膜組織の構造は、粘膜上皮、粘膜固有層、粘膜下組織の三層から成り立っています。 ただし、消化管の場合には、粘膜固有層と粘膜下組織の間に、粘膜筋板という平滑筋の層があります。 粘膜固有層は、粘膜固有の特有の層で毛細血管やリンパ管やリンパ節を含んでいます。 粘膜下組織には、大きな血管やリンパ管、神経叢が分布しています。この粘膜下組織にある大血管に体外から腸管や気道や鼻咽頭に侵入したherpesが粘膜関連リンパ組織に捉えられなかったわずかなヘルペスが大血管の血液に流れている多くは無い少量の単量体のIgA1のFabレセプターに認識されたherpesウイルスが結合してしまいIgA1抗体複合体になりこれが大血管から腎臓の腎動脈から糸球体の輸入細動脈まで運ばれ糸球体の毛細血管まで運ばれるのです。IgA1抗体複合体のIgA1抗体にはFc部分があります。しかも糸球体の毛細血管はメサンギウム細胞の一部と繋がっています。メサンギウム細胞にはFcレセプター(FcR)がありますのでIgA抗体のFc部分と結合する機会も出てくるのです。
更にメサンギウム細胞は食作用を持っていますのでIgA抗体複合体に結合しているヘルペスをみつけるとすぐさまメサンギウム細胞に食べるように取り込むのですが専門の免疫細胞ではないので生きたヘルペスを殺しきれなくてIgA抗体複合体からherpesは離れてしまい自由になると潜伏感染でメサンギウム細胞のゲノムに自分のゲノムを組み込んで溶原感染したりまた宿主の免疫が落ちると溶解感染してメサンギウム細胞が分裂するたびにherpes自身も分裂増殖して数多くの子孫であるビリオン10個や100個や1000個単位で増やしてしまうのです。
ヘルペスにherpesが増殖するために細胞の機構が利用され過ぎたメサンギウム細胞は崩壊することもありその時は骨髄から骨髄由来の新しいメサンギウム細胞を補充することもできるのです。メサンギウム細胞は骨髄由来の細胞ですから免疫細胞の性格も持っているのです。ヘルペス自身の子供である増えたビリオン粒子は免疫が落ちた時に近隣のメサンギウム細胞のみならず糸球体の濾過の機能を果たしている三要素である糸球体基底膜の細胞、血管内皮細胞、血管上皮細胞(足細胞)などの血管内皮細胞にも感染していくのです。しかしか片方の腎臓に100万個の糸球体があるので腎臓の濾過機能がherpesとの戦いで障害が仮にいくつか生じても濾過機能障害はまるで気が付かれないのです。又IgA抗体複合体に結合しているヘルペスを糸球体毛細血管に流れこんでいるマクロファージが見つけてFcレセプターとIgA抗体のFc部分と結合して猛然とIgA抗体複合体のヘルペスを貪食して殺してしまうこともあるのです。いずれにしろprofessionalな免疫細胞でないメサンギウム細胞にherpesが感染したことがIgA腎症の始まりとなり極めて長期の時間をかけてIgA腎症による腎不全が発症するのです。従って実は「糸球体腎炎」の最もふさわしい病名は「メサンギウム腎炎」と言うべきなのです。
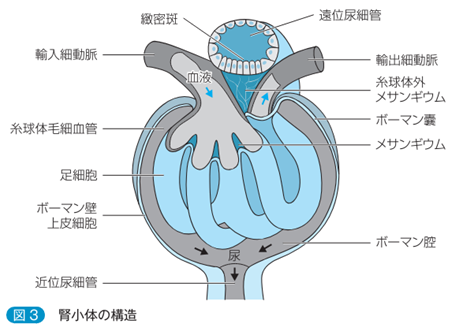
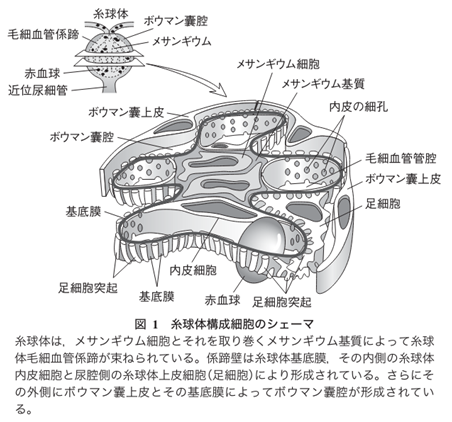
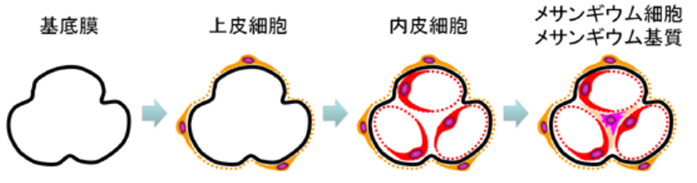
左の右端の図のメサンギウム細胞とメサンギウム基質を合わせてメサンギウム領域と言います。IgA腎症はこのメサンギウム領域へのIgA沈着を伴うメサンギウム細胞の増殖とメサンギウム基質の拡大を基本的な特徴とする糸球体腎炎です。腎炎の「炎」が付くのは病原体であるヘルペスウイルスの感染による炎症であるからです。
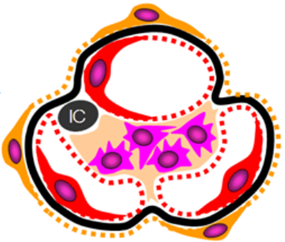
「メサンギウム領域」と「傍メサンギウム領域」は何処にあるのでしょうか?左図の糸球体の中に黒色の円にICと書かれていますがこのICは「Immune commplex」の略語で「免疫複合体」と言う意味です。もっと正確には「IgA Immune commplex」であり「IgA免疫複合体」が沈着していることを示しているのです。もっともっと正確に言えば「ヘルペスを捕まえたIgA免疫複合体なのです。この沈着部位を「傍メサンギウム領域」を言います。英語で「para‐mesagiual area」と言い「メサンギウム領域の外周部」のことで専門用語で「傍メサンギウム領域」と訳すのです。電顕写真でIgAの顆粒状の沈着が「メサンギウム領域」にも観察されます。つまりIgA腎炎ではメサンギウム細胞に取り込めなかった「ヘルペスIgA免疫複合体」は「メサンギウム領域」と「傍メサンギウム領域」にも沈着しているのです。通常のIgGの抗体のサイズが15 nmですがヘルペスウイルスの大きさはIgG型の抗体お大きさの10倍の150nmですがIgGがヘルペスを認識しているのは特定のエピトープだけでありエピトープは6~10個のアミノ酸の並びだけで成り立っています。
IgA腎炎ではしばしば補体のC3やC4やIgGもIgAと同じパターンを示すことも有りますがあくまでもIgAの陽性度が最も強いことがIgA腎炎の特徴です。IgA腎炎ではしばしば補体のC3やC4やIgGもIgAと同じパターンを示すことも有るのはなぜでしょうか?自然免疫の補体蛋白であるC3やC4はメサンギウム細胞の周辺にいるヘルペスと結合して大食細胞や好中球にファゴサイトシス(貪食)しやすいように大食細胞や好中球にオプソニン作用(味付け作用)を実行しようと目論んでいるのです。
獲得免疫のIgGは同じようにヘルペスと結びついてオプソニン作用で大食細胞や好中球にherpesを食わせようとしているのです。抗体の「IgA」が単独ではなく「IgA免疫複合体」として沈着しているのはメサンギウム細胞が「IgA免疫複合体」を貪貪食できなかったことを証明しているのです。
又、IgA腎炎ではしばしば補体のC3やC4やIgGもIgAと同じパターンを示すことがあるのは当然なのです。というのはIgA腎炎は「IgA免疫複合体」として糸球体に運ばれメサンギウム細胞が取り込めなかったので生じた腎炎で有ります。しかし補体のC3やC4やIgGで血液に流れてきたherpesは自然免疫である補体系や血液に大量に存在しているマクロファージに貪食されつくされるのでメサンギウム細胞に食べられる必要がないのです。しかし時には完璧な免疫細胞ではないメサンギウム細胞に「IgG免疫複合体」として貪食されると時に見られる「IgA免疫複合体」ではない「IgG免疫複合体」による軽度な腎炎が見られる事もあるのですがIgGはIgAに比べて血中には無限に存在しているのでヘルペスは簡単に処理できるのですが更に、IgG腎炎が起こらないのはIgG抗体のFabにヘルペスが結合してIgG免疫複合体がメサンギウム細胞に出会ってもIgG免疫複合体のIgGのFc部部分にぴったり合うFcレセプターはメサンギウム細胞は持っていないので結合できないのでのIgG免疫複合体をメサンギウム細胞は取り込むことが出来ないのです。
血液や組織に存在するherpesはIgG抗体の四つの働きで処理できるのです。それは①中和作用②オプソニン作用(味付け作用)③補体の活性化④自然免疫の貪食作用の強化です。ところがherpesが「IgA免疫複合体」になってファゴサイトーシスではなくエンドサイトーシスでメサンギウム細胞に捕獲貪食されてしまうとリソソームと融合しにくくなりリソソームの様々な加水分解酵素で「IgA免疫複合体」は分解されなくなってしまうのです。大食細胞がこの「IgA免疫複合体」を先にファゴサイトーシスで捕獲貪食してくれればライソソームとの融合も簡単に起こり「IgA免疫複合体」は加水分解酵素により影も形も無くなりIgA腎炎は問題にはならないのです。
何故IgG腎炎は問題にはならないのに何故IgAだけがIgA腎炎を起こすのでしょうか?
すぐ上で説明したように血管の中に存在する極めて特異的なメサンギウム細胞に「IgA免疫複合体」がマクロファージに取り込まれる前にメサンギウム細胞に取り込まれてしまったherpes結合IgA免疫複合体がたまたまいたからです。その結果、取り込んだherpesがメサンギウム細胞内でIgA抗体から脱離してその結果ヘルペスがメサンギウム細胞に感染した形となります。しかもメサンギウム細胞は糸球体の血管内で極めて特殊な細胞集団として毛細血管の支柱になっているのです。
メサンギウム細胞は糸球体全細胞数の30~40%を占めており二種類の細胞に分けられます。主要な細胞はメサンギウム細胞の85~95%を占める平滑筋細胞や結合組織の線維芽細胞と類似したミクロフィラメントを持つ収縮性のある細胞です。このミクロフィラメントを持つメサンギウム細胞は血流に合わせて収縮弛緩して血管に柔軟性を与えて血管を支えているのです。もう一つはメサンギウム細胞の5~15%を占める貪食細胞の性格を持つ不完全なマクロファージの真似をして IgG腎炎をもたらす細胞です。メサンギウム細胞のたった5~15%を占める細胞にどうして中途半端な貪食細胞の性格を持たせたのは何故でしょうか?まさか人間の免疫をはるかに勝る殺しきれないherpesがメサンギウム細胞に「IgA免疫複合体」で運ばれてくるというのは免疫の遺伝子の進化の中では想定外であったのでしょう。だからこそ100年前から知られていた IgA腎炎は頭の良い研究者にも手に負えない原因不明の病気になってしまったというよりも IgA腎炎の治療でステロイドを用いるという阿呆なことをやってherpesを増やし続けて最後は「透析」によって患者さんの人生を地獄に追いやっていることに今も気付かないのです。残念至極ですね。最後に残った治らない病気の原因はherpesしかいないのです。
メサンギウム細胞の微細な構造の特徴を見ましょう。
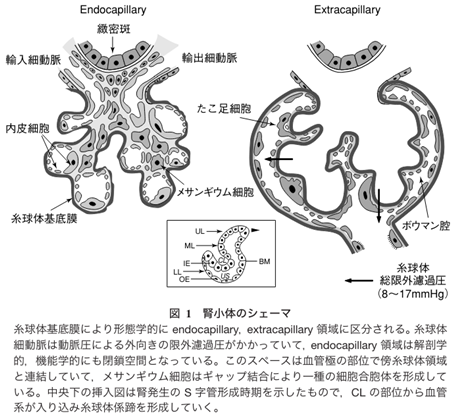
メサンギウム細胞は糸球体の毛細血管内にあるだけではなく糸球体外メサンギウム細胞と言われる血管外のメサンギウム細胞が存在しています。糸球体の毛細血管の軸にはなっていない傍糸球体領域にも糸球体内に存在するメサンギウム細胞と形態的にも機能的にも同種と考えられる細胞が存在しているのです。それは糸球体血管が出入りする輸入細動脈と輸出細動脈と緻密班に囲まれた領域を傍糸球体領域と呼ぶのです。従って傍糸球体領域には二種類あります。一つは血管極領域で輸入細動脈と輸出細動脈と緻密班に囲まれた傍糸球体領域と糸球体血管内のメサンギウム基質の外側の傍らにある傍糸球体領域の二つです。メサンギウム細胞は血管極領域では輸入・輸出細動脈の血管中膜平滑筋と接触しているのです。又メサンギウム細胞は輸入細動脈から輸出細動脈までの糸球体の毛細血管を支えているメサンギウム細胞は細胞同士がギャップ結合で連結しているのです。つまり糸球体血管極から糸球体係蹄(糸球体壁)末梢に至るまでギャップ結合により上下左右のメサンギウム細胞の隣同士のさいぼうが連結して一種の合胞体を形成しているのです。従ってヘルペスウイルスが一個のメサンギウム細胞に感染するとメサンギウム細胞は細胞同士がギャップ結合で連結している一個の巨大な合胞体細胞に感染することになります。
合胞体(ごうほうたい)とは何でしょうか?合胞体は英語でsyncytium(シンシチウム)で、syncytium(シンシチウム)は、動物に見られる、複数の核を含んだ細胞のことです。これに対して原生生物や菌類に見られる、一つの細胞に多数の核を持つ状態のものは多核体と呼ばれ、区別される。合胞体は、メサンギウム細胞集団のように数個から数千個もの核を含んだ細胞質の塊で、一つの巨大な細胞になっています。
心筋や平滑筋の合胞体を見てみましょう。心筋や平滑筋では隣接する筋線維の細胞膜は多くの部分で細隙結合(ギャップ結合 gap junction)しています。すなわち、両細胞膜が非常に近接し(約3nm)、みかけ上密着した構造をとっている。メサンギウム細胞と同じようにこのギャップ結合部位には両細胞膜を貫通するコネクソンチャネルがあり、イオン以外にも分子量約1000までの物質を通過させるので、この結合は活動電位の伝播に重要な役割を担っているのです。このギャップ結合によって心筋線維は互いに細胞の原形質のつながりがないにもかかわらず、あたかもシンシチウム(合胞体)のように働くことができるのです。
合胞体が形成されるメカニズムは大きく二つに分けられる。一つは不完全な細胞分裂によって一個の細胞内に複数の核が作られる場合、もう一つは正常に形成された細胞同士が細胞融合を起こして複数の核を持つ巨大な細胞になる場合である。前者には昆虫の初期胚形成が、後者には骨格筋繊維の形成や哺乳類の胎盤、ウイルス感染細胞が、それぞれ代表的な例として挙げられる。勿論、骨格筋繊維の形成や哺乳類の胎盤と同じくメサンギウム細胞集団は正常に形成された細胞同士がギャップ結合によって細胞融合を起こして複数の核を持つ巨大な一個の細胞になったのです。この巨大な 合胞体(ごうほうたい)のメサンギウム細胞に herpesが感染すると細胞膜を破って感染しなくてもかんたんにギャップ結合を乗り越えて無限にと言ってもよいくらいに合胞体細胞の中で増殖し続けて長い時間をかけて気が付かない内に訳の分からないメサンギウム細胞ヘルペス炎症性 IgA腎炎になってしまうのです。ギャップ結合によって核は分断されていますのでそれぞれ核を持っている一個のメサンギウム細胞自身は必要に応じて分裂できるのでこのチャンスにherpesも何回も増殖分裂してherpesの子供であるビリオン粒子を増やし続けるのです。細胞膜の代わりにギャップ結合で繋がっている一個一個の小さいメサンギウム細胞のすべてで構成されている巨大な一個の 合胞体(ごうほうたい)細胞ではありますが構成単位である一個一個の小さいメサンギウム細胞はいつでも定期的に必要な時は分裂しているのです。巨大な一個の核を多数持っている 合胞体(ごうほうたい)細胞が一挙に分裂するわけではありません。
ギャップ結合とは何でしょうか?ギャップ結合は、隣り合う上皮細胞やメサンギウム細胞をつなぎ、水溶性の小さいイオンや分子を通過させるギャップ性細胞間結合のことです。 並んだ2つのギャップ結合細胞の細胞膜にはコネクソンと呼ばれるタンパク複合体の末端が複数並んでおり、橋渡し構造をなしているのです。下の図で示したようにメサンギウム細胞の一部は細胞膜があり一部はギャップ結合チャンネルで合胞体になって繋がって巨大な一本のメサンギウム細胞が糸球体毛細血管の中心で血管の安定性を維持しているのです。
ギャップ結合〈gap junction〉の図
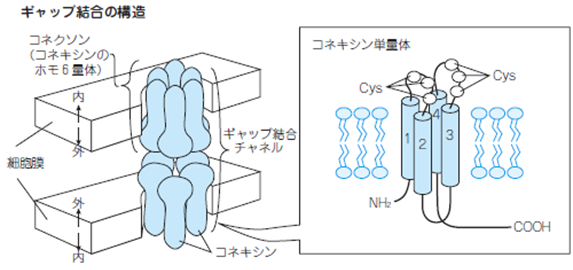
ギャップ結合は細胞の介在板にみられる構造で、最小の半導体のチップの幅と同じ直径2nm(10憶分の二メートル)の通路を隣接するメサンギウム細胞のような細胞間で形成することにより、その通路をイオンや小分子が通過し、心臓でも心筋の横紋筋のように同期性収縮に寄与しているのです。ギャップ結合は、左上の図のように隣接する細胞膜上の「コネクソン(connexon)」同士が接合した 「ギャップ結合チャネル(gap junctional channel)」が数百個~千個数千個集合したものであり、コネクソンは「コネキシン(connexin略してCx)」と呼ばれる蛋白のホモ6量体で構成されています。細胞膜と細胞膜の間にメサンギウム細胞のギャップ結合があるのです。このギャップ結合で結合した巨大な合胞体となったメサンギウム細胞が長い糸球体毛細血管の軸となり細い毛細血管を支えているのです。 細胞の介在板とは何ですか?介在板(intercalated disk)とは心臓の心筋の横紋の間に存在する構造です。心筋細胞同士を連結させ、筋細線維の張力を細胞から細胞へと伝える装置です。 心筋細胞が連続して連結している状態を心筋線維と呼びます。
メサンギウム細胞に発現しているギャップ結合蛋白であるコネキシン(connexin略してCx)はメサンギウム細胞同士をギャップ結合で連結させメサンギウム細胞間のCa2+イオンシグナル伝達とメサンギウム細胞間の同期協調的収縮を支配して糸球体毛細血管を一定状態を維持するためにメサンギウム細胞に発現しているギャップ結合蛋白であるコネキシンは活躍しているのです。
コネキシンは分子量により複数のアイソフォームに分類されており、心筋でみられる代表的なアイソフォームは、分子量がそれぞれ40、43、45kDaのCx40、Cx43、Cx45である。細胞間伝導速度はCx43>Cx40>Cx45の順に速い。また、心房筋や心室筋などの作業心筋においてはCx43の発現が最も多い。洞房結節や房室結節の中心部ではCx45が主な構成因子となっています。ギャップ結合チャネル(コネキシン)を介しては無機イオンの他に、環状アデノシン一リン酸(cAMP)、Ca2+、イノシトール三リン酸(IP3)、アデノシン三リン酸(ATP)などの小分子も通過する。これらの物質の透過性は、細胞内pH、Ca2+濃度、cAMP、環状グアノシン一リン酸(cGMP)などによって調節されているのです。
因みに筋肉には大きく分けて3種類がある。骨格筋と内蔵筋、心筋の三つです。 筋肉を収縮させる蛋白質が緻密に秩序正しく配列しているため、骨格筋や心筋では縞模様がみえるため、横紋筋と呼ばれる。一方、内蔵筋は縞模様がみえないため、平滑筋とも呼ばれる。骨格筋は自分の意志で収縮させることができるので随意筋であり、心筋と内蔵筋は意志とは無関係に収縮調節されるので不随意筋である。骨格筋はいくつかの細胞が融合した巨大な多核(融合した細胞の核がたくさん入っている)細胞である。心筋や内蔵筋では細胞は融合することなく基本的に単核であるが、心筋ではいくつかの細胞が融合することがある。
平滑筋細胞や線維芽細胞と類似したメサンギウム細胞は陥凹のある核と少量の細胞小器官をもっています。少量の細胞小器官にはミトコンドリア、リソソーム、リボゾーム、粗面小胞体、ゴルジ装置があります。 リボソームとは、生体タンパク質合成を行う。数本のRNA分子と50種類ほどのタンパク質からなる巨大なRNA・タンパク複合体です。 ゴルジ装置とは、へん平な袋状の膜構造が重なっており、細胞外へ分泌されるタンパク質の糖鎖修飾や、リボソームを構成するタンパク質のプロセシングを行う。 粗面小胞体という名は、平たい袋状に拡がった小胞体の2 枚の膜表面にリボソーム顆粒が付着していて、電子顕微鏡で表面がリボソーム顆粒のために粗く見えるからである。 滑面小胞体にはリボソームの付着はなく、平たい膜ではなくむしろ管状構造をしている。粗面小胞体の働きは、リボソームで合成されたタンパク質を取り込み、濃縮・貯蔵することです。 また、滑面小胞体の働きは各種の細胞内代謝で、とくにステロイド合成、脂質・糖などの代謝に関係しています。両者の小胞体の管腔は連続している。
メサンギウム細胞には少量の細胞小器官以外に毛細血管の柔軟性を維持するための豊富なアクチン線維線維の束、ミクロフィラメント構造、のみならずミオシン、トロポミオシンなどの収縮関連の機能蛋白を持っています。 ミクロフィラメントとは、マイクロフィラメントとも言われ、微小線維、微細線維とも呼ばれ、細胞内にあって、細胞の形を維持したり、形を変化させたり、細胞内の物質移動を担っている細胞骨格を構成する線維のうちのひとつです。 トロポミオシンとは、アクチンの働きを調節する線維状のアクチン結合タンパク質である。2本のαヘリックスからなるコイルドコイルの構造をとり、特に筋収縮を行う上で重要な働きをしている。トロポニン複合体が筋線維中のトロポミオシンに結合し、ミオシン結合を調節することで、筋収縮を調節している。 コイルドコイルとはタンパク質の構造モチーフの1つで、2つから7つのαヘリックスがロープのように巻いた形をしている。 コイルドコイル構造を持つタンパク質には、遺伝子発現を制御するものや転写因子など、重要な生物学的機能を持つものが多い。 αヘリックス(α螺旋)とはタンパク質の二次構造の共通モチーフの1つで、ばねに似た右巻き螺旋(らせん)の形をしている。 α螺旋の骨格となるアミノ酸の全てのアミノ基は4残基離れたカルボキシ基と水素結合を形成して αヘリックス(α螺旋)のタンパク質の二次構造を支えています。
メサンギウム細胞は不規則な細胞突起を持ちメサンギウム基質および糸球体基底核と連結し、内皮細胞とも接触し内皮細胞の下腔に孔が開いているので糸球体の血液とも接触しこの血液から運ばれてきたヘルペスと結合したIgA免疫複合体と出あいがあり、これがIgA腎症の始まりとなるのです。
糸球体メサンギウム細胞の機能特性は何でしょうか?
1 .細胞収縮・弛緩による糸球体の血行動態調節と血圧の調整が役割にはあります。
2 .メサンギウム細胞のすべては細胞膜ではなくギャップ結合で仕切られたというよりも連結した長い長い一本の合胞体なのです。メサンギウム細胞は糸球体血管極から糸球体係蹄(糸球体壁)の終わりまでの末梢部まで一つ一つのメサンギウム細胞はギャップ結合により隣同士の細胞が連結して一種の一本の言種の巨大な合胞体を形成して巨大な一個の連結細胞と言ってもいいのです。とりわけ一個のメサンギウム細胞に感染したヘルペスにとっては増殖して増えた子供のビリオンは外部の新しいメサンギウム細胞に細胞膜を破って感染しなくてかんたんな仕切りに過ぎないギャップ結合を通じて巨大な数多くの核を持っている無数に連結した同一細胞とみなせる合胞体でここのメサンギウム細胞が分裂増殖するたびごとに容易に増殖を繰り返すことが出来るのです。しかも増殖したビリオン粒子は自由に周囲の糸球体を構成するすべての細胞に感染していくのです。
3 .糸球体正常構造の維持。①血管係蹄の支持構造。しかしヘルペスがいくつかの糸球体のメサンギウム細胞に感染して溶解感染を起こしてしまうと、複数の毛細血管が微小血管瘤を形成してしまい、この微小血管瘤内には赤血球が停滞して鬱血が起こり腎機能障害をもたらしてしまうのです。②メサンギウム細胞外基質の新陳代謝( turn-over)の制御。 メサンギウム細胞外基質とは何でしょうか?メサンギウム細胞外基質とは, メサンギウム細胞組織中の細胞と細胞の間 を満たしている物質で、細胞の支持や,組織の構造の維持機能があります。メサンギウム細胞外基質はメサンギウム細胞の外側からメサンギウム細胞の移動・分化・形態・増殖・代謝に大きな影響を及ぼしており,腎糸球体における細胞外基質の特徴的な機能は濾過障壁として働いている。腎糸球体細胞外基質はⅣ型コラーゲンを主体とするコラーゲン,ラミニン・フィブロネクチン等に代表される。糖蛋白とプロテオグリカンなどの複合糖質より構成され、これらの巨大分子は,自己分子同志、あるいは異種分子間で相互作用し結合します。
4 .サイトカイン・炎症性因子・血管作動性物質の産生。メサンギウム細胞は各種の細胞性因子を産生する。特に代表はメサンギウム細胞増殖およびメサンギウム細胞外基質合成を促進させる PDGF と TGF-βである。 PDGFとはPlatelet-Derived Growth Factorの略で血小板由来成長因子と訳します。その作用は、主に間葉系細胞である線維芽細胞、平滑筋細胞、グリア細胞等の遊走および増殖などの調節に関与する増殖因子であり、主に骨髄の巨核球によって産生されるほか、血小板のα顆粒にも含まれるので血小板由来成長因子と訳されるのです。 血小板のα顆粒とは何ですか?血小板は、α顆粒、濃染顆粒、加水分解酵素が詰まったリソソームの3種類の放出顆粒をもつ。 α顆粒は、ひとつの血小板に数十個含まれ、比較的α顆粒はフィブリノゲンやフォンビルブランド因子など大きな分子が含まれている高分子のタンパク質因子であり,特に血小板の周囲環境を調節する因子となる凝固因子・線溶因子,成長因子を含有しています。 フォンビルブランド因子とはvon Willebrand因子(VWF)は分子量約50万から2000万に及ぶマルチマー構造(超巨大分子構造)を形成する高分子量の糖蛋白質であり、血管内皮細胞や骨髄巨核球から産生される。 マルチマー構造とは VWFは血管損傷部位において血小板を内皮下結合組織へ粘着させる機能を有し、一次止血において極めて重要な役割を果たす。 濃染顆粒はδ顆粒とも呼ばれアデノシン二リン酸(ADP)やATP、セロトニン(5-hydroxytriptamine)、カルシウムイオンなど比較的小さな分子が含まれています。 リソソームは細胞内小器官の一つで、膜に囲まれた内部は酸性化されており、様々な分解酵素を含んでいる。 リソソーム経路は細胞内の不要物の分解のための主要な経路の一つであり、エンドサイトーシスやオートファジーによって運ばれた物質をリソソームで分解する。
メサンギウム細胞はherpesの感染による炎症など病的な状態では, TNF-α,IL-1,6,8,10 などのサイトカインを分泌する。TNF-α(Tumor Necrosis Factor-α)とはサイトカインの一つで腫瘍壊死因子と呼ばれ, TNF-αは悪性腫瘍の原因であるヘルペスをやっつける極めて重要なサイトカインです。又このサイトカインである TNF-α(Tumor Necrosis Factor-α)が自己免疫疾患の代表と言われているが実はヘルペスが起こしている関節リウマチの関節ではヘルペスを破壊するために大量に産生され,腫れや痛みなどの炎症に大きく貢献しているのは自己免疫疾患の原因であるherpesですから炎症性サイトカインであるTNF-αが高値になるのは原因である病原体であるヘルペスが減るので最高によいことなのです。
TNF-αの役割は何でしょうか?癌関連遺伝子の二種類が癌化して起こる悪性腫瘍にしろ、一種類だけが癌化して生ずる良性腫瘍にしろ、遺伝子の突然変異を起こしたのは「癌ウイルス」である膨大な数のヘルペスですからそのヘルペスを殺すために生れたのが腫瘍壊死作用を持つサイトカインである TNF-αです。つまりあらゆる癌も肉腫もヘルペスによる炎症性疾患ですから炎症性サイトカインである TNF-αが炎症性疾患である癌(腫瘍)で高値となるのは当然のことなのです。勿論、herpes感染の急性期蛋白であるCRPもSAA(血清または血漿中アミロイドA蛋白)も高値になりますが、その鋭敏度、増幅の程度からCRPと並ぶ第一級の急性期蛋白として的確に炎症活動性を反映する SAAは、一般的傾向としてCRPに比べて種々の疾患で感度が高く、CRPの上昇程度が低いウイルス感染症、SLEなどでも良好な反応を示します。
腫瘍壊死因子(TNF)は、腫瘍壊死作用を有する活性化マクロファージ由来のサイトカインとして見出され、その後、悪液質誘発因子であるカケクチン(cachectin)と同一物質であることが明らかとなったタンパク質である。悪液質誘発因子であるカケクチン(cachectin)は TNF-αですから悪液質誘発因子という呼び方は間違いなのです。悪液質を引き起こすのは癌細胞だけではなく莫大な量に増えてしまったherpesが癌患者さんの5大栄養物質を利用するため消費しており、増えすぎた癌細胞とherpesウイルスが共に増殖するために栄養素を奪い取ってしまった結果なのです。 悪液質(cachexia)とは,栄養不良により衰弱した状態を指す言葉として古くから用 いられてきましたが、悪液質はがんに限らず,種々の慢性消耗性疾患における栄 養不良の終末像であり,治療抵抗性で患者の予後や QOL を悪化させることは当然のことなのです。
因みに、このTNFに構造的な相同性を示す活性化リンパ球由来の物質にリンフォトキシンがある。両者は標的細胞の同一のレセプターに結合し、生理活性の点でも共通性が高いのです。
現在、腫瘍壊死因子(TNF)は、腫瘍壊死作用を有する活性化マクロファージ由来のサイトカインとしてのTNFをTNF-αと呼び、TNFに構造的な相同性を示す活性化リンパ球由来の物質にリンフォトキシンをTNF-βと呼び、単にTNFという場合はTNF-αを意味する。その生理活性はきわめて多彩であり、IL-1やPGE2、コラゲナーゼなどの産生を介して発熱や種々の炎症反応を惹起することから、炎症性メディエーター(炎症性サイトカイン)に分類されます。免疫が治療行為で低下し過ぎてヘルペスが過剰に増えすぎたときに見られるTNFの過剰産生は、自己免疫疾患、結合組織病、膠原病、および類縁疾患、川崎病、髄膜炎、悪液質、AIDS、多臓器不全などの病態に見られるのは膠原病および類縁疾患である自己免疫疾患、結合組織病、川崎病、髄膜炎、癌悪液質、多臓器不全にも見られますがこれらの病気の原因はherpesであるのでヘルペスを殺すための炎症性メディエーター(炎症性サイトカイン)過剰に増えるのは間違った免疫抑制剤を自己免疫疾患で用いられたためなので自己免疫疾患と言われる病気に多いのは当たり前なのです。自己免疫疾患の原因は今更語る必要はないのですがヘルペスですからね。
腫瘍壊死因子(TNF)が高値を示す疾患には細菌感染症,後天性免疫不全症候群,腸管寄生虫症,非感染性胃腸炎,関節リウマチ,川崎病,全身性エリテマトーデス,癌悪液質,多臓器不全があります。腫瘍壊死因子(TNF)が高値を示すのはヘルペス性自己免疫疾患のみならず細菌感染症でも上昇するのは当然です。 多臓器不全とは、肺や腎臓、脳など生命の維持に欠かすことのできない複数の重要臓器にherpesによる癌や自己免疫疾患や脳変性疾患が生じてそれらの臓器の働きが著しく低下した状態を指します。 多臓器不全が起こる原因はヘルペスはあらゆる臓器に感染するのでヘルペスがそれらの臓器で増えすぎて細胞の機能不全が多臓器に生じると多臓器不全となるのです。
膠原病や結合組織病は自己免疫疾患と同じ病気で原因はヘルペスであるのに病名が異なるだけですからこの世にあり得ない架空の起こりえない病気です。上の表をしっかり読めば難解ですがTNFの働きがいいことずくめであることがお判りになるでしょう。あらゆるherpesウイルスなどの病原体から人体を守ってくれるTNFは最高の炎症性サイトカインなのです。しかし現代の医学はTNFを敵視しています。残念ですね!!!
IL-1とは何でしょうか?IL-1 はインターロイキン-1 と読み(Interleukin-1略IL-1) はサイトカインと呼ばれる生理活性物質の一種であるインターロイキンの中で最初に見つかった分子である。炎症反応に深く関与し、炎症性サイトカインと呼ばれるグループに含まれる。IL-1には現在IL-1αとIL-1βの2種類が同定されている。IL-1はもともと内因性発熱物質やリンパ球活性化因子などとして発見され、IL-1α及びβの2種類が存在する。これらが同一のインターロイキン-1受容体に結合して生理作用を発現する。2種類のIL-1の間に生理作用の差はない。IL-18もIL-1ファミリーに含まれる。ヘルペスによる炎症や感染防御に重要な役割を果たす。もともと内在性発熱因子やリンパ球活性化因子、胸腺細胞増殖因子、破骨細胞活性化因子など、多様な生物活性を持つ。IL-1はマクロファージや単球、滑膜表層細胞など多様な細胞によって産生され、滑膜細胞や、血管内皮細胞、リンパ球、マクロファージなどを活性化する。活性化の結果、これらの細胞でIL-1自身や、IL-6、TNFα、IL-17,IL-8、シクロオキシゲナーゼ(Cox-2)などの種々のサイトカイン、ケモカイン、炎症性メディエーターなどの発現が誘導され、その作用によって血管の透過性が亢進したり、発熱したり、あるいは種々の炎症性細胞の浸潤を招き、炎症を引き起こすのです。また、滑膜細胞の増殖を促進すると共に、メタロプロテアーゼ(金属を含む蛋白分解酵素)やコラゲナーゼ(コラーゲンをペプチド断片に切断するメタロプロテアーゼ)や破骨細胞分化因子(RANKL)などの発現を誘導し、骨、軟骨破壊に関与しているのです。関節リウマチ患者の関節滑膜細胞では高レベルのIL-1が作られている。RANKLはReceptor activator of nuclear factor-kappa B ligand の略称で、TNF スーパーファミリーに属する膜貫通タンパク質です。 骨芽細胞・骨細胞などの骨芽細胞系譜の細胞 に高発現しています。
IL-1はもともと内因性発熱物質として発見されたのですが内因性発熱物質(内在性発熱因子)とは何でしようか?外因性発熱物質は、グラム陰性菌の細胞膜成分のLPSである。外因性発熱物質は、単球やマクロファージを刺激して内因性発熱物質を産生する。
内因性発熱物質は、血液-脳関門( blood-brain barrier略してBBB)にCOX-2を誘導して脳内にプロスタグランジンを産生する。プロスタグランジンは、体温調節中枢の視床下部に作用してセットポイントを上昇させて発熱を起こさせる。解熱薬は発熱物質の産生を阻害して発熱を抑える。発熱は免疫機能を賦活して病原体を殺すのでするので解熱薬の使用は免疫の作用を落とすので使うべきではありません。
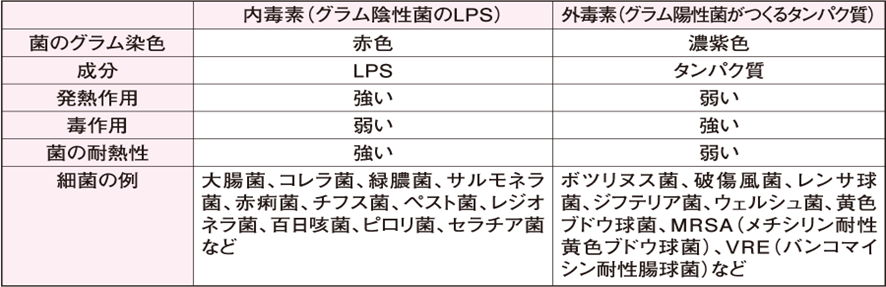
内毒素の実体は、グラム陰性菌の細胞膜の構成成分であるLPS(Lipopolysaccharide)である。 LPSとは、グラム陰性細菌の成分で、グラム陰性細菌の細胞壁の外側にぎっしりと埋め込まれた形で存在しています。糖と脂質が結合した構造をしているので、日本語で「糖脂質」や「リポ多糖」と呼ばれ、英語では「リポポリサッカライド(Lipopolysaccharide略してLPS)と呼ばれます。外毒素の実体は、タンパク質系の毒素である。内毒素は、発熱作用が強いが、毒作用は弱い。外毒素は、発熱作用は弱いが、毒作用が強い。 毒素(toxin)とは、生きた細胞あるいは生体内で産生される有毒物質である。因みに 地球上で最強の毒素とはボツリヌス菌(Clostridium botulinum)が産生するボツリヌストキシンAである。 1gで1,000万人以上の命を奪うことも可能である。 ボツリヌス菌の兄弟ともいえる破傷風菌(Clostridium tetani)も強毒を産する。
生体内に侵入した外因性発熱物質 (exogenous pyrogen )は、体外から由来するウイルス、細菌、真菌などの微生物自身や菌体成分、あるいはそれらから産生される物質を外因性発熱物質といいます。外因性発熱物質の代表的な物質は、グラム陰性菌の細胞膜成分のLPSである。
外因性発熱物質は、単球やマクロファージを刺激して内因性発熱物質を産生する。内因性発熱物質は、BBBにCOX-2を誘導して脳内にプロスタグランジンを産生する。 BBBとはBlood-brain barrierの略語で血液脳関門と訳します。BBBの解剖学的実体は脳毛細血管であり、脳室周囲器官を除いては、内皮細胞同士が密着結合で連結しています。BBBは脳に必要な物質を血液中から選択して脳へ供給し、逆に脳内で産生された不要物質を血中に排出する「動的インターフェース」であるのです。密着結合はタイトジャンクション( tight junction)と言い、隣り合う上皮細胞をつなぎ、さまざまな分子が細胞間を通過するのを防ぐ、細胞間結合のひとつです。
プロスタグランジンとは、体温調節中枢の視床下部に作用してセットポイントを上昇させて発熱を起こさせる。 セットポイントとは、体温調節中枢には、体温を一定に保つ働きがあります。こうして設定された体温を「セットポイント」といいます。
生体内に侵入した外因性発熱物質 (exogenous pyrogen )は、体外から由来するウイルス、細菌、真菌などの微生物自身や菌体成分であり単球 (monocyte)、マクロファージ( macrophage) などの食細胞 (phagocytes) に取り込まれると、インターロイキン (1interleukin-1略IL-1)、腫瘍壊死因子( tumor necrosis factor略TNF)、インターフェロン (interferon略INF)、コロニー刺激因子( colony-stimulating factor略CSF)、マクロファージ炎症ペプチド( macrophage inflammatory peptide-1 略MIP-1)などの内因性発熱物質 (endogenous pyrogen) を分泌するようになります。
内因性発熱物質は血液-脳関門 (blood-brain barrier略BBB)を通過し、脳内でアラキドン酸カスケード arachidonic acid cascadeを経てプロスタグランジン( prostagrandinI) を産生する。これが、体温調節の中枢である視床下部 hypothalamus に働いて体温調節の基準値(セットポイント)を移動させ、熱産生を起こさせるのです。
アラキドン酸カスケードでプロスタグランジン類を産生する反応はシクロオキシゲナーゼ cyclooxygenase (COX;コックスとよばれる)によって進行する。アスピリン aspirin やインドメタシンなどの非ステロイド系抗炎症薬(nonsteroidal antiinflammatory drug 略してNSAIDでエヌセイドと読む)はCOXを阻害するので解熱薬として使われる。
非ステロイド系抗炎症薬のなかで酸性を示さないものは、塩基性抗炎症薬 (basic-non-steroidal anti-inflammatory drug )とよばれ、COX阻害作用は弱い。IL-1、TNF、INF、MIP-1などの内因性発熱物質が免疫賦活物質であることから分かるように、発熱は免疫作用を活性化させる。したがって、発熱に対する解熱薬の使用は慎重でなければならないのは病原体が人体に侵入したことを自然免疫に伝える事ができなくなって自然免疫を活性化させることができなくなるからです。。
代表的な外因性発熱物質は、グラム陰性細菌 gram-negative bacterium 表層のペプチドグリカンとリン脂質層を取り囲む外膜の重要な構成成分で、これをリポ多糖 lipopolysaccharide (LPS)という。LPSは、内毒素 endotoxin ともよばれる。内毒素に対してグラム陽性菌 (grampositive bacterium) が産生するタンパク質を外毒素 exotoxin という。内毒素と外毒素を比較すると表1のようになる。
IL-6とは何でしょうか?IL-6(インターロイキン-6)は多彩な生理作用を有するサイトカインと呼ばれる物質の一種で、免疫応答や炎症反応の調節において重要な役割を果たしています。 サイトカインとは、さまざまな刺激によって免疫細胞などから産生されるタンパク質で、主に身体に侵入した細菌やウイルスなどの異物を排除するための役割を担っています。IL- 6 は,T 細胞,B 細胞,単球,線維芽細胞,ケラチノサイト,内皮細胞,メサンギウム細胞,脂肪細胞,および一部の腫瘍細胞を含むさまざまな細胞によって産生される.IL- 6 レセプター(IL-6R)は,主に T 細胞,単球,活性化 B 細胞,好中球などの造血細胞に発現している. Il-6の作用機序はIL-6刺激により、T細胞及びB細胞の増殖、分化、生存及びアポトーシスが促進され、肝細胞が活性化され CRPや血清アミロイドAなどの急性期タンパク質、並びにRA患者での疾患活動性を反映するバイオマーカーが産生されます。CRPは代表的なヘルペスとの戦いの有無を知らせてくれる最も敏感な急性期タンパク質であり慢性期でも上昇します。Herpes感染により急性期でも慢性期にでも血清アミロイドA(serum amyloid A略して SSA)は肝臓で合成され、感染症、悪性腫瘍、自己免疫疾患、組織壊死などの炎症状態で血中濃度が上昇します。ヘルペス感染で敏感に高値になります。病原体であるヘルペスの侵入やヘルペスによる組織壊死により活性化されたマクロファージから産生される腫瘍壊死因子(TNF)、インターロイキン-1、インターロイキン-6 などの炎症性サイトカインの作用で、主に肝臓で産生されます。
血清アミロイドたんぱく(SAA)とは何でしょうか?
アミロイドA蛋白(SAA)は、分子量約12,000の、主に肝細胞由来の急性期タンパク質の一種である。 ヒトのSAA遺伝子には、現在まで少なくともSAA1~SAA4までの4種類が知られている。ヘルペス性による炎症による組織破壊の後の組織内沈着物から最初に抽出されたアミロイド(類澱粉)の前駆体である。血清リポたんぱくの一種であるHDL を構成するアポたんぱくの一種として同定され、アミロイドA蛋白(SAA)は急性期反応で増加するとアポ A-I を排除して、全たんぱく質成分の 80%を占めるに至る。ヒト血漿中には十数種のアポ 蛋白が存在する。アポ A-Iとは何でしょうか?脂質と結合し血中運搬を行うタンパク質であり、脂質代謝異常の把握に用いられる。
アミロイド(類澱粉)とは、元々 Virchow により病理学的に、ヨード反応陽性で、コンゴ―レッドで赤橙色に染色され、偏光顕微鏡で青緑色に光って見える硝子様の沈殿物(変性物)として定義されたものである。アミロイド(類澱粉)は電子顕微鏡で見ると 8-15nm の線維構造(原線維)であり、X 線解析ではクロス(交叉)したβシートの平板構造をとり、折りたたまれたタンパク質で、分解酵素の作用を受けにくいのです。アミロイド(類澱粉)は細胞がヘルペスによって破壊された細胞内のタンパク質がすべて分解酵素で処理され終わった最終代謝産物でありガラクタなのです。
血清アミロイド A 蛋白は英語でserum amyloid A protein略してSAAです。SAAはヘルペスによる炎症所見としてCRPよりも鋭敏であったのでかつては頻繁に臨床検査で用いられたのですが現在は何故か健康保険の中では使えなくなっています。
アルツハイマー病ではアミロイド前駆たんぱく質であるベータアミロイド、タウたんぱく質などが蓄積する。アルツハイマー病の原因もherpesです。タウたんぱく質とは何でしょうか?タウたんぱく質はヘルペスが感染した脳神経の機能が変性して崩壊してしまった脳神経の蛋白の残骸の一つなのです。脳細胞の蛋白にも機能の異なる蛋白から成り立っているのでそれぞれ機能によって立体構造が異なります。蛋白の立体構造についてはここを読んでください。
アルツハイマー病はヘルペスによって単純に脳の海馬体の細胞の機能が侵されただけでなく、ヘルペスによって脳の海馬体の遺伝子が変異遺伝子となり変異たんぱく質の産生、架橋形成、糖化などによってさらに異常たんぱく質が蓄積し、細胞障害・細胞死を起こすのがアルツハイマー病なのです。脳神経変性疾患についてはここを読んでください。
アミロイド前駆たんぱく質は英語でAmyloid-beta Precursor Proteinで略して APP は第 21 染色体にある遺伝子の変異で起こるのです。この遺伝子の変異もヘルペスが感染した第 21 染色体にある遺伝子の突然変異によるのです。あらゆる後天的な遺伝子病はヘルペスが感染した細胞のゲノムの遺伝子にherpesのゲノムが組み込まれ細胞のゲノムの遺伝子の組み換えが起こったためです。
この組み換えは2種類あります。一つは 相同組み換えとか一般的組み換えとか正統的組み換えとよばれ主要な「DNA組組み換え」の機構です。減数分裂の乗り換えはこの機構を利用しています。相同組み換えは乗り換えだけではなくヘルペスウイルスによる形質転換やプラスミドの遺伝子の組み込みにも使われています。プラスミドとは大腸菌に感染する性質をもった一種のウイルスであり環状のDNAであるのがプラスミドです。
もう一つのDNA組み換えは 部位特異的組み換えと呼びウイルスが宿主のDNAに入り込むときに用いる機構です。λ(ラムダ)ファージが大腸菌DNAに入り込むときに用いる機構でありλインテグラーゼと言うリコンビナーゼ(組み換え酵素)を用います。リコンビナーゼとはDNA組換え反応を触媒する酵素の1つで、バクテリオファージ(細菌に感染するウイルス)が持っている酵素です。部位特異的組み換えによってウイルスが宿主のDNAに入り込むときに用いる機構です。ヘルペスvirusはこの部位特異的組み換えの機構を用いて感染細胞にherpesのゲノムを組み込んでDNAの組換えをやっているのです。
さらにウイルスが宿主のDNAに入り込むときに用いる部位特異的組み換えの機構のもう一つの例として大腸菌に感染するP1ファージと言われるウイルスが大腸菌のloxPというDNA配列部分の遺伝子を組み換える例があります。この時にはP1ファージはCreと言うリコンビナーゼ(組み換え酵素)を用いて、塩基から成るDNAに結合し、部位特異的組換えを起こすのです。
さらに転移因子が行なう遺伝子組み換えは部位特異的組換えに非常によく似ています。転移因子はある遺伝子の部位から別の部位に移動(転移)して移動しながら同じ仲間をどんどん増やしていくのです。転移因子はタンパク質の遺伝情報を持ち組み換え酵素であるトランスポザーゼや核酸配列の内部(endo-)で核酸を切断する酵素であるエンドヌクレアーゼや逆転写酵素などを産生する。 逆転写酵素とはRNA(リボ核酸)からDNA(デオキシリボ核酸)を合成する酵素を逆転写酵素と呼びます。この転移因子はウイルスと似た寄生体の姿をしており具体的な役割が分からないのにもかかわらずに遺伝子の中での存在量が圧倒的に多いのです。人の転移因子はゲノムの約45%を占めており人のタンパク質遺伝情報を担っている1.2%コード領域に比べてその40倍もある。転移因子は生物界全体にぶんぷして種類が極めて多いのです。人のゲノムにも多様な転移因子がある。中でも多いのが約50万コピーがあるLINE1と約100万コピーがあるAluと言う2種類のレトロトランスポゾンです。転移遺伝子は二つの点で興味がある。第一はヒトのゲノムの歴史を知る化石様な存在であるという点です。第二は直接的あるいは間接的に人の遺伝子の機能を左右する点です。例えばLINE1やAluがヒトの遺伝子に入り込む挿入突然変異といわれる突然変異が疾患を引き起こすことも有るのです。この点もherpesが人のゲノムに組み込まれて遺伝子の組換えを自由自在にやり放題をやりつくしてあらゆる先天性の遺伝子病や後天性の遺伝子病を起こしてしまうに似ていますね。因みに転移因子が最初に1950年に発見したのは植物のトウモロコシで見つけたのはマクリントックでありトランスポゾンの発見により1983年にノーベル生理学・医学賞を受賞している。
変異遺伝子による変異たんぱく質の産生、架橋形成、糖化などによって異常たんぱく質が蓄積し、細胞障害・細胞死を起こすのがアルツハイマー病なのです。脳神経変性疾患についてはここを読んでください。
アミロイド前駆たんぱく質は英語でAmyloid-beta Precursor Proteinで略して APPとは何でしょうか?アミロイドβ前駆体タンパク質(amyloid-beta precursor protein略APP)は大きな膜タンパク質で、通常は神経の成長と修復に欠かせない役割を果たしているがこの APPタンパク質の遺伝子が海馬体の細胞の遺伝子にヘルペスが感染して遺伝子の突然変異を起こされて異常なたんぱく質が産生され海馬体の神経の成長と修復が不可能となり神経細胞が機能不全となり最後は海馬体の神経細胞が破壊され思考と記憶が失われるアルツハイマー病(Alzheimer’s disease)を引き起こすのです。海馬体の神経細胞の破壊のガラクタがアミロイドβなのです。つまりアルツハイマー病は第 21 染色体にあるアミロイド前駆たんぱく質 APP遺伝子の変異で起こるのです。
アミロイド関連疾患には何があるでしょうか?リウマチ性疾患や脊椎・骨髄炎、そして粥状動脈硬化との関連が示唆されているが、生理的・病因論的な機作は未だ明らかでないと言われていますがherpesが原因です。
IL-8とは何でしょうか?インターロイキン8は、CXCL8としても知られ白血球である好中球、単球、マクロファージ、T細胞や、血管内皮細胞、線維芽細胞などが、炎症の病変局所で産生する炎症性のサイトカインで、上記の白血球が炎症をおこしている敵がいる炎症病変局所へ免疫細胞を呼び寄せるサイトカインを(細胞遊走機能)をケモカインと呼び訳して走化性因子です。ケモカインは「助けに来てくれ」と知らせるサイトカインであるIL-8はToll様受容体を持つ細胞から分泌され、他の細胞を炎症部位によびよせるケモカイン(呼び寄せて走らせる走化性因子機能)を持っています。
CXCL8は特に好中球を引き寄せる走化性因子として作用し、CXCL8に対する受容体を有する好中球および他の顆粒球類を血流から炎症局所に誘導するのです。 さらに食作用(ファゴサイトーシス)も誘導し、細菌などの異物を細胞内に取り込み、加水分解酵素が詰まったリソソームが含有する酵素などで分解殺菌し、宿主防御機能である病原微生物の侵入を阻止・排除する機能に寄与しているのです。
IL-8遺伝子は、ウイルス感染による一般的な呼吸器疾患として知られる細気管支炎にも関与しています。また、IL-8は、血管新生の強力なプロモーターであることも知られています。IL-8は、腫瘍における血管新生、転移、乳癌に関連します。
IL-10とは何でしょうか?ヒトサイトカイン合成阻害因子としても知られるインターロイキン10は、抗炎症性サイトカインです。ヒトでは、インターロイキン10はIL10遺伝子によってコードされています。 IL-10は、2つのIL-10受容体-1および2つのIL-10受容体-2タンパク質からなる受容体複合体を介してシグナルを伝達します。私たちの体には生まれながらにして免疫システムが備わっており、外部から侵入してきた病原体などを攻撃して、異物から体を守っています。この免疫システムは、炎症性サイトカインを誘導することによって、免疫反応を増強させます。一方、この反応が過剰になると、自己を構成する正常な成分までも攻撃してしまう自己免疫疾患を引き起こしてしまいますと言われていますが自己免疫疾患は殺しきれないherpesと闘っているので免疫は過剰な攻撃に見えるだけです。
免疫システムは、無駄な化学物質との戦いでは化学物質と共存するために免疫寛容を起こすために無駄な戦いを抑制するメカニズムも持ち合わせています。炎症反応の抑制性サイトカインのIL-10は、さまざまな種類があるT細胞、主に2型ヘルパーT細胞(Th2)が産生しますが、NKT細胞や記憶型T細胞、一部の制御性T細胞、1型ヘルパーT細胞(Th1)も産生することが知られていますがその目的は化学物質との戦いであるアレルゲンに対して免役寛容を起こして化学物質と共存するためですが世界中の医者は誰も知らないのです。
残念ですね!!!
4) メサンギウム細胞はまた,血管作動性物質であるレニン,endothelin,一酸化窒素,prostaglandins,thromboxanes,superoxide anion なども産生する。これらメサンギウム細胞から産生される因子は,糸球体微小循環機能を含めた糸球体機能の維持,さらには各種糸球体障害の修復で重要な役割を果たしている。 レニンとは、腎臓の糸球体でつくられるタンパク質分解酵素の一種で、血液中のアンジオテンシノーゲンというタンパク質に働きかけ、アンジオテンシンⅠというホルモンを作る。 ここにアンジオテンシン変換酵素が働くことでアンジオテンシンⅡに変わるが、このアンジオテンシンⅡのホルモンが血管収縮、血圧上昇などの作用をもつ。 Endothelinとは,エンドセリンと読み、血管内皮細胞由来のペプチドで、強力な血管収縮作用を有するオータコイドの一種である。 オータコイド(autacoid)とは生体内で局所的に生成されて作用する生理活性物質の総称で ヒスタミン、セロトニン、プロスタグランジンなどを指し、局所的ではない他の器官で作用するホルモンは除かれる。 一酸化窒素とは血管拡張物質で,血管中膜にある平滑筋に作用して、その結果、平滑筋の緊張がゆるんで血管が広がり血圧が下がります。 Prosta-glandinsとは,プロスタグランジンと読み略してPGでリン脂質の構成成分であるアラキドン酸から誘導されるエイコノサイドの一つで、分子中に5員環をもつ生理活性脂肪酸で痛みや炎症などを引き起こす炎症性脂質メッセンジャー(サイトカイン)として働く。鎮痛剤の多くは、プロスタグランジン分子群の合成阻害に関与する。プロスタグランジン合成の過程で働く重要な酵素がシクロオキシゲナーゼ(cyclooxygenase、COX)で、これには2つのアイソフォーム(COX-1、COX-2)があり、それぞれ構造、組織分布、発現が異なっている。COX-1は胃、血小板、腎臓、内皮細胞など多くの組織で発現し、腎機能、血小板凝集、消化管粘膜の維持に重要な役割を果たす。一方、COX-2は炎症性刺激による誘導型でありマクロファージ、白血球、線維芽細胞、滑膜細胞に発現しています。 Thromboxanesとは,トロンボキサンと読み、血小板の凝集や、血管壁の収縮を引き起こす物質である。リン脂質からホスホリパーゼによって遊離したアラキドン酸は、アラキドン酸カスケードによって代謝される。このアラキドン酸カスケードで主にシクロオキシゲナーゼからプロスタグランジン 類とトロンボキサンが産出される。superoxide anionとは超酸化物とは、スーパーオキシドアニオンを含む化学物質の総称である。自然界では酸素分子の一電子還元により広範囲に生成している点が重要であり、1つの不対電子を持つ。 スーパーオキシドアニオンは、超酸化物と訳し、自然界では酸素分子の一電子還元(一個の電子が奪われている状態)により広範囲に生成しており、1つの不対電子を持つフリーラジカルであり、常磁性を有する。「スーパーオキシドアニオン」とも言われ活性酸素の一種で、酸素分子が電子1個を取り入れた陰イオン。高い反応性を有する。生体内では水素イオンと結びつき、過酸化水素が生成され、免疫系においてその毒性により強い殺菌作用を示す。
5 )メサンギウム細胞は異物の処理もできます。
糸球体内皮細胞は有窓で,高い血管内圧がかかり,内皮下腔とメサンギウムが交通していることから,比較的大きな蛋白分子を含む血漿成分,組織液成分の通路となっている。メサンギウム細胞はその通路の駆動役としてだけではなく貪食能を有していて,血液の浄化作用をしているのです。メサンギウム細胞に存在するFc 受容体,low density lipoprotein(LDL)受容体,終末糖化物質(adavanced glycation end products略AGE)などの受容体を介して免疫複合体や LDL,AGE を細胞内取り込みをして処理する機構でもあるのです。しかし,AGE を過剰にメサンギウム細胞内に取り込みをし過ぎると糖尿病腎症を起こすことになるのです。
以下,生理的・病的条件下において発現している受容体分子,その他の機能分子について簡単に説明します。
メサンギウム細胞は細胞増殖因子・炎症因子・血管作動性物質に対する受容体には重要な細胞成長因子(PDGF,TGF-β),炎症因子(TNF-α,各種 interleukin),および血管作動性物質(angiotensin Ⅱ,endothelin)などの受容体を発現しており,メサンギウム細胞の増殖,肥大,収縮,遊走および細胞外基質産生調節と深く関わり合っているのです。一本の長い合胞体となったメサンギウム細胞がヘルペスによって個々のメサンギウム細胞が崩壊させられるとの細胞成長因子(PDGF,TGF-β)受容体と結びついて分裂増殖しすぎるとメサンギウム増殖性腎炎となっていきます。ヘルペスが増殖しすぎるとすると炎症因子(TNF-α,各種 interleukin)の受容体と結合してherpesとの戦いを細胞内で繰り広げ過ぎて炎症反応がひどくなり細胞自ら自滅していくのみならず他の内皮細胞や基底膜細胞や上皮細胞までにも炎症が波及してしまい腎炎が進行していくことにもなってしまうのです。
細胞外基質に対する受容体については メサンギウム細胞は各種基質成分に対する受容体を発現しています。特にβ1 integrin およびαvβ3 integrin は細胞と細胞外基質の相互作用において主要な分子です。細胞外基質成分はメサンギウム細胞表面の基質受容体を介してメサンギウム細胞の phenotype,細胞増殖,遊走などを制御しています。細胞外マトリックスである細胞外基質成分は元来メサンギウム細胞によって産生された物質なのですが Phenotypeとは表現型は「ひょうげんがた」と読み、phenotypeの語源はギリシャ語であり、phenoは「表示」と意味でtypeは型に由来しており、生物の複合的で観察可能な特徴や形質を表すのです。このように個体の形質は表現型(phenotype)といい、一方遺伝的構成は遺伝子型(genotype)といいます。
Glucose transporterについてはヒトのゲノムには似たグルコース輸送体が14種類コードされていて、ブドウ糖やその他の糖をそれぞれ異なる種類の細胞に運ぶ。グルコーストランスポーター(glucose transporter、略してGLUTあるいはSLC2A)またはグルコース輸送体又は糖輸送体と呼ばれますが、大部分の哺乳類の細胞に見出される一連の膜タンパクファミリーである。 グルコーストランスポーターの機能についてはグルコースは、ほとんどの細胞の代謝に不可欠な物質である。グルコースの分子は極性を有するため、生体膜を通過するのには特別な膜輸送タンパク質を必要とする。メサンギウム細胞は 2 種類のグルコース・トランスポーター,すなわち facilitative and sodium-coupled transporters および brain type glucose transporter(GLUT-1)を発現している。GLUT-1 の発現レベルはメサンギウム細胞の細胞外基質産生と関連していて,糖尿病状態における細胞外グルコースの細胞内取り込みとの関連もあります。糸球体に毎日、循環血流量の25%も運ばれるので過剰な血糖をメサンギウム細胞は取り込み過ぎて処理できなくなって糖尿病性腎症になるのです。
Renin-angiotensin-aldosterone(RAA)系に関する受容体については1 )Angiotensin Ⅱ受容体があります。メサンギウム細胞には angiotensin Ⅱの受容体(Ⅰa とⅠb)が存在し細胞の収縮および細胞外基質産生に関わっている2 )Renin/prorenin 受容体もあります。 メサンギウム細胞にはレニン・プロレニンの受容体も存在し,細胞表面の renin/prorenin の cofactor(補助因子)として,renin および prorenin の酵素活性による angiotensinogenの分解作用を促進する一方で,レニンはこの受容体を介してメサンギウムにおける TGF-βの発現を誘導し,PAI-1,fibronectin,collagenⅠなどの発現を促進します。腎局所における renin-angiotensin‐aldosterone 系と腎疾患進行との関連があります。上述の受容体が深く関わっていると予想され,従来からの ARB,ACEI によるアンジオテンシンⅡ阻害による腎保護作用に加え,レニン,プロレニン,アルドステロンなどの阻害による機構もあります。
Mineralo-corticoid 受容体もありミネラロコルチコイド受容体が培養ラットメサンギウム細胞に強く発現していることや、アルドステロンが培養メサンギウム細胞の細胞増殖や基質産生を促進させることも報告されています。血行動態を介さず線維化を引き起こす機構があるのはヘルペス感染によるメサンギウム細胞の完全崩壊によるものです。
メサンギウム細胞に高発現するメグシン(Megsin)については,新規 serpin superfamily に属し,セリンプロテアーゼの抑制因子としての作用をもつ。megsin mRNA は糸球体メサンギウム細胞に正常でも発現し,糖尿病性腎病および IgA腎症では発現が増強する。
糸球体メサンギウム細胞とは一体何でしょうか?糸球体メサンギウム細胞の機能特性は何でしょうか?メサンギウム細胞基質とは何でしょうか?
メサンギウム細胞は人体の細胞の中でも極めて独特な細胞なのです。その一つの特性は毛細血管の血液という流体の中に住んでいるので遊走作用も持っていますがウイルスなどの病原体による感染がない限りは定常状態では固定された細胞がメサンギウム細胞なのです。いざとなった時には動き回ることが可能で、かつ傷ついたり瀕死の時には骨髄由来の新しいメサンギウム細胞が骨髄から血液に乗って補充してくれるのです。他の普通の動脈毛細血管は一本だけの毛細血管の中腔を裏打ちしているのは血管内皮細胞だけなのですが糸球体の毛細血管の血管内皮細胞では血液の濾過の仕事に専心しなければならないので細い長い糸球体の毛細血管を固定するための軸になって固定させているのがメサンギウム細胞なのです。 何故、片方の腎臓に100万個もある糸球体毛細血管の揺れ動く血流の中心に固定されたメサンギウム細胞が生まれ免疫細胞様のサイトカインを産生できるようになったのでしょうか? 結論を言うとメサンギウム細胞は免疫細胞である白血球を作る骨髄由来の細胞であることです。しかも100万個もある糸球体毛細血管の中に特別に存在して血管の軸となっているのです。正に糸球体の毛細血管の血液をろ過する目的は血管に偶然に流れてくるウイルスや細菌をも濾過すべきである任務をメサンギウム細胞が一手に担っているのです。固定された自然免疫の食細胞の役割と適応免疫のヘルパーT細胞の働きを持たされて、herpesウイルスなどの病原体が出入りする汚れた糸球体の毛細血管を感染から守るための細胞がメサンギウム細胞であるともいえるのです。
よく似た細胞に皮膚に多い色素細胞に感染しやすいherpesから皮膚を守るランゲルハンス細胞がありますが、ランゲルハンス細胞は皮膚に定住した一種のプロのマクロファージ(表皮マクロファージ)であり、表皮のみならず、口腔、食道、膣、真皮、毛包、脂腺、さらにリンパ節、胸腺などでも認められます。
ランゲルハンス細胞とはどんな細胞なのでしょうか?
ランゲルハンス細胞はメラノサイト(メラニン細胞)やメサンギウム細胞と同様、樹状の突起を持つので「樹状細胞」とも呼ばれますが、メサンギウム細胞は専門の自由に動き回って抗原をT細胞に提示できる免疫細胞ではないので「樹状細胞」とは言われません。
因みにメサンギウムはメサンギウム基質(Mm)とそれの中に埋まっているメサンギウム細胞(Mc)よりなっている.メサンギウム細胞は複雑な細胞突起を出しており,突起の断面が基質の中に島状にみる.メサンギウム基質は基底膜と同じdensity(密度)で,どこまでが基底膜でどこからメサンギウム基質かわからないのですが,少しdensityの高いdepositと言われる沈着物質がメサンギウム基質に沈着すると境界不明なメサンギウムの部分も毛細血管の部分と同じ厚さの基底膜で被われていることがわかります。
ランゲルハンス細胞は一種のマクロファージで表皮マクロファージとも呼ばれで、表皮のみならず、口腔、食道、膣などの粘膜や真皮、毛包、脂腺やさらにリンパ節、胸腺などの免疫組織でも認められます。骨髄に由来し、血管やリンパ管で運ばれます。
ランゲルハンス細胞は血球が作られる赤色骨髄由来の非常に強力な抗原提示細胞ですが、表皮のどの層にも存在しますが、特に皮膚では有棘層の中~上層に、1平方ミリメートル辺り、400~1000個、表皮細胞の2~8%が孤立性に存在しています(表皮全体では1~3%)。ランゲルハンス細胞の核は不規則な形をしており、細胞質はほとんど透明です。細胞体から全ての層の表皮細胞の間に細胞質突起が伸びて、かなり密度の高いネットワークを形成しています。ランゲルハンス細胞の働きはその樹状の細胞質突起で、表皮表面と表皮細胞間の環境をE-カドヘリンを介して角化細胞と結合して存在し、常に敵を監視しており、皮膚に敵を発見すれば細胞性免疫反応を強力に促進します。ランゲルハンス細胞は、多くの炎症性の皮膚疾患、特に化学物質が原因であるアレルギー性接触皮膚炎において、活性化された数が増えます。皮膚は体表を包むので、絶えず多くの抗原分子に直接に接触しており表皮のこのような抗原分子が自然免疫と獲得免疫に関わり、皮膚全般の保護機能に対して免疫学的なバリアーとなっていますがメサンギウム細胞は抗原提示細胞でもないのでメサンギウム細胞の主要な役割はあくまでも糸球体毛細血管の中に定住した毛細血管を固定する軸になる細胞なのです。
ランゲルハンス細胞は皮膚より進入した抗原を効率よく取り組む能力を持ち、多数の細胞突起を持ち、抗原を取り込んだ後は、その突起が縮んで真皮へ遊走し、所属リンパ管へ入ります。ランゲルハンス細胞は、他の臓器で見られる免疫系樹状細胞の働きと同様、抗原を認識し、結合し、細胞内で分解処理した後、T細胞(Tリンパ球)に提示する働きを持っています。これによって活動を停止しているヘルパーTリンパ球を刺激し、一次免疫応答が開始され、獲得性免疫応答の引き金を引き、戦闘を開始すべきことを伝えるのですが、メサンギウム細胞には不可能なことです。糸球体組織にウイルスなどの病原体が侵入して時に敵を処理するのはやはり毛細血管に存在するマクロファージやIgG抗体なのですが、すでにIgA抗体複合体でIgA抗体に捕まえられたヘルペスvirusには関わることはできないのです。
赤色骨髄由来の非常に強力な抗原提示細胞で、表皮のどの層にも存在します。赤色骨髄とは造血幹細胞が 存在し造血が盛んに行われる骨髄を赤色骨髄と呼びます。 ランゲルハンス細胞とメサンギウム細胞の違いは何処にあるのでしょうか?ランゲルハンス細胞は表皮に存在する樹状細胞の一つで、骨髄で造られ、表皮全体の細胞数の2〜5%を占め、樹枝状の突起があり、皮膚免疫を司る沢山のレセプター(受容体)を持ち、Fcレセプターも、持っています。外部から侵入する細菌やherpesウイルスを監視して皮膚を感染から防いでいるのです。遊走性で、抗原を樹枝状の突起で取り込むとリンパ管を通って特定のリンパ節に移動する免疫専門の抗原提示細胞であり、リンパ節で抗原をT細胞に提示し敵を認識したT細胞が皮膚に移行して抗原に出会うとサイトカインを放出し、病原体を殺傷したり炎症を引き起こすはプロの免疫細胞であるンゲルハンス細胞なのです。
一方 メサンギウム細胞が活躍するのは免疫細胞の通り道であるリンパ管ではなく血管内であり炎症を引き起こしてヘルペスなどの病原体を殺傷することはできないのです。メサンギウム細胞が毛細血管の集まりである糸球体で炎症を引き起こしてしまうとすべての人が腎炎になってしまうことになります。従って糸球体にはリンパ管やリンパ節は存在しないのです。プロの免疫細胞はかならずリンパ管とリンパ節と繋がっていますからherpesを殺せるのですが毛細血管としか繋がりのないメサンギウム細胞は免疫細胞ではないのでherpesを殺す事はできないのです。にもかかわらず何故メサンギウム細胞に細胞突起やFcレセプターやリソソームがあるのでしょうか?
糸球体の正常構造はどのように維持され血管係蹄(血管壁)を支持しているのでしょうか?このメサンギウム細胞の突起は糸球体の正常構造の維持どんな働きがあるのでしょうか?勿論、ヘルペスなどを捉えて抗原を提示する樹状細胞の突起と違って、糸球体基底膜を内向きにけん引して糸球体壁である糸球体係蹄の形態を保持するためのものです。糸球体構造を維持している外部から守る障壁は①糸球体基底膜と②スリット膜を備えている足細胞の二つでありこの二つの層が糸球体係蹄(糸球体壁)を包み込んでいるのです。糸球体毛細血管糸球体とメサンギウムの間には障壁がないので毛細血管内腔とメサンギウム基質にはほぼ等しい血液の内圧がかかっているのです。当然この内圧は係蹄壁(糸球体壁)を外向きに膨張させるように働きます。メサンギウム細胞は筋肉の収縮を行なうタンパク質であるアクチン線維束を持つ細胞突起のメサンギウム角と呼ばれる部位で糸球体基底膜と強く結合してこの膨張力に対抗して糸球体基底膜を内向きにけん引して糸球体係蹄の形態を維持しているのです。又ヘルペスによって溶解した糸球体では複数の糸球体優毛細血管は微小血管瘤を形成して一本の血管の構造この微小血管瘤内では赤血球が停滞し、うっ血してしまうのです。 アクチンの機能は何でしょうか?細胞が動く原動力が、アクチンです。アクチンは、ミオシンとともに筋肉の収縮を行なうタンパク質ですが、実は筋細胞だけでなく、体にある全ての細胞に含まれているタンパク質です。 細胞の形を保ち、細胞が運動する力の元となる繊維状の構造を細胞骨格と呼びますが、この主成分の一つがアクチンが作る繊維、アクチンフィラメントです。
メサンギウム細胞の周囲を取り囲んでいるメサンギウム細胞基質(メサンギウム基質)とは何でしょうか?又メサンギウム領域(para-mesagiual area)とは何でしょうか?メサンギウムとメサンギウム領域(para-mesagiual area)とはどう違うのでしょうか?IgA腎症は、メサンギウム領域へのIgAの沈着を伴うメサンギウム細胞の増殖とメサンギウム基質の拡大を基本的な特徴とする糸球体腎炎です。更に傍メサンギウム領域(para‐mesagiual area)というメサンギウム領域の外周部にIgA免疫複合体(immune complex: IC)が沈着する事によって発症するのですが メサンギウム細胞基質と傍メサンギウム領域(paramesagiual area)とはどう違うのでしょうか?
①メサンギウムとはメザンギウムとはどういう意味ですか?メサンギウムのメサ (mesa) はテーブル上の台地のような語源をもっており、アンジウム (angium) は脈管などの意味を含んでいます。 つまり、メサンギウムは「血管周囲の平らな場所」のような意味合いを持ちます。メサンギウムはメサンギウム基質(Mm)とそれの中に埋まっているメサンギウム細胞(Mc)よりなっている.メサンギウム細胞は複雑な細胞突起を出しており,突起の断面が基質の中に島状にみられる.基質は基底膜と同じdensityで,どこまでが基底膜でどこからメサンギウム基質かわからないが,少しdensityの高い物質がメサンギウム基質に沈着すると(これをdepositという.)メサンギウムの部分も毛細血管の部分と同じ厚さの基底膜で被われていることがわかる.
②メサンギウム領域とは糸球体組織内には、毛細血管と毛細血管の間にメサンギウム領域と呼ばれる血管を支える結合組織が存在します。 メサンギウム細胞はその領域中に存在し、血管の収縮を調節することで血圧をコントロールしています。メサンギウム領域はメサンギウム細胞とメサンギウム細胞の結合組織であるメサンギウム基質の二つの組織を含んだものです。メサンギウム基質はメサンギウム細胞の細胞外マトリックスです。細胞外マトリックスとは「細胞外空間」を満たす物質の総称です。
③メサンギウム細胞基質はメサンギウム基質とおなじことです。
④傍メサンギウム領域(para-mesagiual area)とは何でしょうか?傍メサンギウム領域(para-mesagiual area)とはIgA腎炎で見られるメサンギウム領域の外周部に出現する新たなる領域です。
細胞外基質の機能 と構成成分についてみましょう。細胞外基質とは,組織中の細胞と細胞の間を満たしている物質である。長い間ただ単なる細胞の支持や,組織の構造の維持という静的な機能しか知られていなかった。しかし,細胞外基質は細胞の外側より細胞の移動・分化・形態・増殖・代謝に大きな影響を及ぼしており,その動的な機能も明らかにされてきた。腎糸球体における細胞外基質の特徴的な機能は濾過であり,GBMはglomerular-basement-membraneの略で糸球体基底膜のことでありmain-filtration-barrierとして働いている主なる濾過障壁.です。腎糸球体細胞外基質はⅣ型コラーゲンを主体とするコラーゲン,ラミニン・フィブロネクチン等に代表される。
細胞外基質からみた糖尿病性腎症とは何でしょうか?糖蛋白とプロテオグリカンなどの複合糖質より構成されている.これらの巨大分子は,自己分子同子あるいは異種分子間で相互作用し,結合する.
糸球体細胞外基質の構成成分とその主な機能とは何でしょうか?Ⅳ型コラーゲンはこれらの中で最も主要な構成成分でありGBM(glomerular-basement-membrane)では全層に分布している.Ⅳ型コラーゲン分子は,中央の不連続な3重らせん部分と,より短い非らせん部分の非コラーゲンドメイン(NC1,2)からなっており,NC2ドメインは7Sドメインと結合している.各分子は7Sドメインにおける結合で4量体を形成し,さらに2つのNC1ドメイン同士が結合してネットワークを形成する.生体内では,Ⅳ型コラーゲンはさらに微細な3次元のネットワークを形成して基底膜の基本骨格を形成している.GBM(糸球体基底膜)において,Ⅳ型コラーゲンは粗なネットワークを形成し,それに結合するラミニン等の糖蛋白がさらに密なネットワークを形成する。Ⅳ型コラーゲンのみでも直径3~4nmの微細なネットワークを形成することを電顕的に証明されています.その径がアルブミン分子の短径より,やや小さいことより,Ⅳ型コラーゲンの微細ネットワークがGBMのsize-barrierとして働いているのです.GBMのヘパラン硫酸プロテオグリカンは側鎖の硫酸基やカルボシル基のために陰性荷電を有しており,charge-barrierとして糸球体の透過性を規制している.ポリエチレンイミンやルテニウムレッド等のcationic-probeを用いて染色するとGBMの内外透明層にanionic-siteとして規則的に染色される.
糖尿病性腎症における細胞外基質構成成分の変化については糖尿病性腎症における細胞外基質の構成成分の変化に関してはGBMは不溶性であり,水解して分析する際,その病変の程度により不均一になったり,GBMに混在している内因性・外因性の蛋白に依存しているからです。
ヘパラン硫酸プロテオグリカンの変化については糖尿病性腎症の成因としてヘパラン硫酸プロテオグカンの減少が注目されている.糖尿病性腎糸球体硬化症の進展に伴いヘパラ酸プロテオグリカンの減少と蛋白尿の増加を認めた.糖尿病性腎症における蛋白尿の成因の1つは,GBMのヘパラン硫酸プロテオグリカンの減少に伴うchargebarrierの破綻によると考えられる.
遺伝子工学の応用による検討については近年の遺伝子工学の進歩により腎疾患における細胞外基質成分のmRNAレベルでの測定が可能となった. コラーゲンの変化については糖尿病性腎症の発症・進展において細胞外基質主要成分であるコラーゲン代謝の異常は重要である.細胞外基質からみた糖尿病性腎症については免疫組織学的にも,糖尿病性腎症においてはⅣ型コラーゲンの増加が報告されている.特に,腎症の初期・中等度の病巣ではメサンギウムを主体に増加している.しかし,糸球体が完全に硬化に陥るとⅣ型コラーゲンはもはや殆ど染色されなくなる.金コロイドを用いた免疫電顕により糖尿病性腎症患者のGBMにおけるⅣ型コラーゲンの密度は正常コントロールに比し低くなっているが,GBMが3~4倍肥厚しており全体としてはⅣ型コラーゲンの増加がある。Ⅳ型コラーゲンのネットワークが粗になりGBMのsizebarrierの破綻をきたすからです.細胞外基質に特異的に存在するⅣ型コラーゲン分子は通常は2本のα1(Ⅳ)鎖と1本のα2(Ⅳ)鎖が3重らせん構造をとっている.近の研究によりα1,α2鎖以外にα3,α4,α5鎖の存在が明らかにされてきた.糖尿病性腎症患者の腎組織蛍光抗体法により拡大したメサンギウムにはα1,α2鎖を認めこれに対し肥厚したGBMにはα3,α4鎖を認めた.α1,α2鎖の合成には内皮・メサンギウム細胞,α3,α4鎖の合成には糸球体上皮細胞が関与していると考えられる.
糖尿病性腎症の進展にはこのようなⅣ型コラーゲンのみでなく,他のtypeのコラーゲンの関与も知られている.Ⅰ型・Ⅲ型コラーゲンは正常では間質に存在し,腎糸球体細胞外基質には殆ど存在しない.糖尿病性腎症を始め他の硬化型腎炎のメサンギウムにⅢ型コラーゲンが認められる.メサンギウム細胞を培養するとⅣ型コラーゲンのみでなくⅠ・Ⅲ型コラーゲンを産生することが知られている.
糖蛋白の変化については糖尿病性腎症におけるラミニンの動きに関してはラミニンは腎症発症早期には増加するが,糸球体硬化に陥ると減少すると考えられる.接着蛋白であるフィブロネクチンはメサンギウムを主体に局在するが,メサンギウム領域の拡大と共に増加する.
細胞外基質からみた糖尿病性腎症についてはグリケーション(非酵素的糖化)による細胞外基質の変化についてみましょう。 グリケーション(非酵素的糖化)とは,グルコースが蛋白中のアミノ基と酵素作用を介さず化学的に結合する現象である.糖尿病性腎症の成因の1つに,高血糖による組織高分子蛋白のグリケーションによるadvanced glycosylation endproduct(AGE)の形成があげられている.AGE蛋白はマクロファージ受容体と結合しTNFやIL-1などのサイトカインを放出する.内皮細胞ではサイトカインの刺激により程々の成長因子が放出され,細胞増殖や細胞外基質の増加をきたす.細胞外基質のグリケーション(非酵素的糖化)によりⅣ型コラーゲンの結合が弱まり,GBMのⅣ型コラーゲンのネットワークが粗になる。透過性が亢進し蛋白尿を生じる機序も考えられている.また,グリケーションを受けたⅣ型コラーゲンのコラゲナーゼによる分解遅延も報告されている.このコラゲンの分解障害は細胞外基質の蓄積をきたし,糸球体硬化を導くと考えられる.このように糖尿病性腎症においては,細胞外基質構成成分の相互作用がグリケーションにより障害され,合成,分解の異常をひきおこし構造的・機能的異常をきたすと思われる.
リソソームは真核生物の細胞小器官の一つであるのでどの細胞ももっています。免疫細胞に少し似ているメサンギウム細胞の力では殺しきれないherpesウイルスが糸球体の毛細血管にIgA免疫複合体に運ばれてメサンギウム細胞に取り込まれて感染してしまうと潜伏感染し続けて免疫が弱くなったときにのみ増殖してしまうのです。しかもIgA免疫複合体という極めて特殊な形で感染する病原体ウイルスはherpesしかいないのです。
IgA抗体は粘膜抗体なので腎臓の100万個の糸球体の毛細血管に流れてそこで炎症を起こすのは糸球体にとってもは腎臓専門家にとっても想像を絶する事態なのです。だからこそ世界中の優秀な腎臓専門家がIgA腎症の原因を長年かかって解明できなかったのです。今わたしがやっとIgA腎症の原因はヘルペスであると答えを見つけることができたのです。しかも腎炎を治した経験がありますので自信は満々で私が見つけた「IgA腎症の原因はヘルペスであるので腎炎は治すことが出来る」理論を展開しているのです。
ところが血液に流れているわずかな単量体のIgA抗体の中にさらに数少ないIgA抗体の抗原の受容体となるレセプターのFabが認識する抗原のherpesをIgA免疫複合体の中に見つけてIgA抗体のレセプターと結合したIgA免疫複合体の一部としてわずかでありますが血中を流れて糸球体の毛細血管にやってきます。しかもメサンギウム細胞の食作用とFcレセプターは機械的にこのIgA免疫複合体を取り込んでしまうのです。ここでFcレセプターとは何かについて詳しく説明しましょう。
腎臓には心臓からの血液の何%が流入するのでしょうか? 腎臓の最も大きな役割は、尿をつくることですが、腎臓には心臓から送りだされる血液の約4分の1(約25%)が毎日流れ込み、毎日糸球体で濾過されます。個の血流の中に食細胞の働きとIgA抗体のFabレセプターに結合したヘルペスが流れ込んできたのです。メサンギウム細胞は嫌が応でも取り込まざるを得なかったのです。でしまったのです。なぜ腎臓糸球体毛細血管の血中に一番多いIgGにherpesは結合しないのでしょうか?それはすでに結合すべきFabにはIgA抗体にはすでにherpesが結合してしまっているので無理なのです。
さて免疫グロブリン(抗体)はIgA抗体以外に残り4種類の、IgG、IgM、、IgD、IgEの合計5種類に分類され、それぞれ異なった働きをします。 抗体の働きは何でしょうか?補体や貪食細胞を持つマクロファージ、好中球などの活性化してヘルペスウイルスなどの病原体を排除します。抗体はFabレセプターで病原体を捕まえてしまうと三つ抗体の働きが発揮されます。①病原体の中和作用、②貪食細胞の食作用を促進させる。③補体を活性化させる。
抗体のFabレセプターと貪食細胞のFcレセプターの違いは何でしょうか?すべての抗体のしっぽ(テイル)にあるFc部分(フラグメント)に結合するFc受容体(FcR)は、どんな細胞が持っており、どんな作用があるのでしょうか?Fc 受容体は、①B リンパ球、②濾胞樹状細胞、③ナチュラルキラー細胞、④マクロファージ、⑤好中球、⑥好酸球、⑦好塩基球、⑧ヒト血小板、⑨肥満細胞⑨補体➉メサンギウム細胞などの特定の細胞の表面に見られます。以上のFc 受容体は抗体のFcフラグメントと結びつくと、貪食細胞の食作用が強まり抗体のFabレセプターにつかまったヘルペスウイルスなどの病原体を貪食して殺してくれるのです。Fc 受容体という名前は、抗体のFc (Fcは結晶化可能なフラグメント) 領域として知られる抗体の尻尾(英語でtail)のFc部分(領域)と結合するのでFc 受容体と名付けられました。Fc受容体は、感染細胞または侵入病原体に結合した抗体のFc領域にだけに特異的に結合します。Fc受容体の作用は、Fc受容体を持っている上記の貪食細胞を刺激興奮させてナチュラルキラー細胞(NK細胞)を興奮させて、抗体依存性細胞傷害(ADCC)によってもヘルペスが感染している細胞も破壊できるのです。
Fc受容体(FcReceptor略してFcR)は抗原と抗体からなるIgA免疫複合体のような免疫複合体を認識し,エフェクター細胞の活性化を行うことで生体防御を行う重要な分子群です。 エフェクター細胞とは「活性化された効果的な力を出せる細胞」でありリンパ球に対する抗原刺激により、ナイーブB細胞、ナイーブキラーT細胞、ナイーブヘルパーT細胞などのリンパ球が抗原特異的に活性化され、増殖できるリンパ球のことです。このようにナイーブな細胞が活性化して増殖した細胞を「エフェクター細胞」とよぶのです。エフェクターとは「効果器」と言う意味です。一方、「ナイーヴ」とは「未熟な」という意味です。
免疫複合体は、以上のように貪食作用のあるマクロファージが取り込んで免疫複合体に結合しているherpesのような病原体ウイルスを殺してしまいますがメサンギウム細胞は食作用は持っておりファゴゾームで取り込みかつマクロファージのようにIgA抗体複合体のFc部分に結合していきり立ってIgA抗体複合体のFc領域とメサンギウム細胞のFcRと結合して貪食しても何故なのかリソソームの加水分解酵素でもherpesを殺すことはできないのです。 何故メサンギウム細胞のリソソームで溶かし殺せないのでしょうか?メサンギウム細胞はマクロファージのようなプロの殺し屋の貪食細胞ではないのであくまでも糸球体の毛細血管の中にある毛細血管の支柱ですからたまたまヘルペスを運んできたIgA免疫複合体を機械的に取り込んだだけでherpesウイルスを殺すリソソームも持っているのですがIgA免疫抗体複合体を全体として処理するだけの装置は持っていないのがメサンギウム細胞と考えられます。殺しきれないどころか逆にherpesはメサンギウム細胞の細胞内でIgA抗体複合体から生きたまま離脱できたヘルペスウイルスに感染してしまい潜伏感染されてしまいメサンギウム細胞のゲノムに隠れてしまったherpesのゲノムを組み込まれてしまうのです。しかも寄生主である人の免疫が下がるとヘルペスは分裂と増殖を始め自分の子供であるビリオンを増やすこともできるのです。増えたビリオンは周辺のメサンギウム細胞のみならず糸球体の濾過の機能を果たしている三要素である糸球体基底膜の細胞、血管内皮細胞、血管上皮細胞(足細胞)などの細胞にも感染していくのです。ヘルペスウイルスは細胞内にひとたび感染状態で入り込むと感染細胞が自殺(アポトーシス)してヘルペスと一緒に死なない限りヘルペスを殺すことは不可能なのです。ヘルペスが細胞に感染して分裂増殖して数を増やしていくばかりで感染細胞の外にいる免疫細胞は100%無力なのです。どんな場合にも細胞免疫が働くのは細胞外にヘルペスがいるときだけなのです。
メサンギウム細胞は平滑筋細胞あるいは線維芽細胞に似ていて,陥凹のある核と 少量の細胞小器官のミトコンドリア、リソソーム,リボゾーム,粗面小胞体,ゴルジ装置を持っている細胞です。 リソソームとは何でしょうか?リソソームには約60種類の加水分解酵素があり, プロテアーゼ, ヌクレアーゼ, グリコシダーゼ, リパーゼ,ホスホリパーゼ, ホスファターゼ, スルファターゼなどを含みます。 これらはいずれも 酸性加水分解酵素で,最適の活性を示すには、プロテアーゼによる切断が必要です。
何故メサンギウム細胞は食作用があるのでIgA抗体にherpesが抗原として結合したIgA免疫複合体を取りこめるはずなのですが実はherpesウイルスだけであれば食作用で取り込んでメサンギウム細胞が持つリソソームには約60種類の加水分解酵素があり, プロテアーゼ, ヌクレアーゼ, グリコシダーゼ, リパーゼ,ホスホリパーゼ, ホスファターゼ, スルファターゼなどでタンパク質、脂質、糖質、拡散のすべてを分解できる酵素でherpesだけであれば簡単に溶解できるのです。 これらはいずれも 酸性加水分解酵素で, 溶解して殺せるはずなのに殺せないのは何故でしょうか?
答えはherpes単独では簡単に食作用で取り込めることができれば、細胞小器官であるリソソームには約60種類の加水分解酵素でherpesを溶かしきれるはずなのですが IgA抗体IgA抗体にはメサンギウム細胞が持っているFcレセプターと結合できるFc領域は空っぽですからメサンギウム細胞が持っているFcレセプターと結びついたIgA免疫複合体の形では大食細胞ではないメサンギウム細胞は完全に取り込んでherpesを処理できないのです。その証拠は何でしょうか?
IgA腎炎ではメサンギウム細胞が取り込めなかったIgA免疫複合体がメサンギウム細胞の基質に大量に沈着してしまっているのです。如如何なる免疫細胞の持つ貪食作用は抗体を取り込む機能は持っていないからです。ましてやこのIgA抗体はIgA免疫複合体になった一部であるので敵であるヘルペスウイルスを捕まえ続けている正常な働きをしている抗体ですからガラクタやゴミになった糖タンパクでもないので食作用で取り込んでごみの処理をする必要もないので取り込めなかった IgA免疫複合体がメサンギウム細胞の基質に大量に蓄積して糸球体の血流を妨害して糸球体基底膜の細胞、血管内皮細胞、血管上皮細胞(足細胞)などの濾過機能を妨害していくので徐々に長い時間の経過の中で腎機能障害が起きてしまうのです。
リソソームの内腔はpH5前後に酸性化されており、種々の加水分解酵素を含むのですが、にもかかわらずメサンギウム細胞はherpesウイルス単独ではherpesを貪食した後でメサンギウム細胞が持っているリソソームに含まれている多種類の加水分解酵素でヘルペスを加水分解して溶かし殺すことができるはずなのにメサンギウム細胞は何故ヘルペスに感染してしまうのでしょうか?
一つ例を出して説明しましょう。人体に侵入してきたherpesウイルスや細菌から人体を守るもっとも優秀な自然免疫の防御細胞はマクロファージです。代表的な貪食作用を持っているマクロファージは組織でherpesウイルスを見つけるとファゴソームと言われる袋のような小胞を作るために細胞の表面を丸め込んで袋状にしてその袋の中にヘルペスウイルスを囲い込み切り取ってherpesウイルスをマクロファージの細胞内に取り込みます。このプロセスをファゴサイトーシスと言い食作用とか貪食(どんしょく)作用と訳します。食作用はphagocytosisで読み方はファゴサイトーシスであり、細胞がその細胞膜を使って大きな粒子(0.5 μm以上)を取り込み、ファゴソーム(食胞)と呼ばれる細胞の内部に袋のような小胞を形成するプロセスであり、これはエンドサイトーシスの一種です。食作用を行う細胞を食細胞(ファゴサイト)と呼びます。ファゴソームは食胞とか小胞とも言います。さらにこのファゴソーム(食胞)は細胞内のあらゆる種類の強力な化学物質である加水分解酵素を持っているリソソーム(ライソソーム)と融合されます。
エンドサイトーシスとは何でしょうか?エンドサイトーシスまたは飲食作用 と訳し、細胞が細胞外の物質を取り込む過程の1つで、大きい物質を、細胞の内側に取り込む働きです。更に細胞に必要な物質のあるものは極性を持ちかつ大きな分子であるため、疎水性の物質から成る細胞膜を通り抜ける事ができないので、エンドサイトーシスにより細胞内に輸送されるのです。
リソソーム(ライソソーム)とは何でしょうか?リソソーム酵素を含む可溶性のリソソームタンパク質は,生合成経路およびエンドサイトーシス経路を介してリソソームに輸送される。リソソームは,酸性に保たれた細胞内オルガネラの一つであり,複合糖質や脂質などの細胞内基質の分解に関わっている。細胞外からの物質の取り込みは、エンドサイトーシス(飲食作用)と呼ばれ、多くの場合、直径が100nm程度の比較的小さな細胞膜の構造形成を通じて行われます。エンドサイトーシス(飲食作用)とは細胞外から細胞内に物質を取り込む現象です。死んだ細胞やバクテリアなど大きなものを取り込む食作用と、分子や液体など比較的小さなものを、受容体などを介することなどで選択的あるいは非選択的に取り込む飲作用に分けられますところが、病原体などは通常輸送される微少領域よりも格段に大きく、どのように大きな病原体や異物が取り込まれるための生体膜の構造が形成されるか不明でしたリソソーム内部には酸性pH条件下で働く種々の加水分解酵素(リソソーム酵素)が存在し,エンドサイトーシスやオートファジーにより細胞内外から取り込まれた生体分子を加水分解する.分解されて生成したアミノ酸,糖そして脂質は再利用される.このことから,リソソームは細胞内の「リサイクル工場」であるといえる.
エンドサイトーシス(飲食作用)とファゴサイトーシス(食作用)の違いは何ですか?
菌やその他の固形物を取り込む作用がファゴサイトーシス(食作用)であり食細胞(好中球、好酸球、単球、マクロファージ、未熟樹状細胞)だけに備わった機能であるのに対し、エンドサイトーシスや飲作用(ピノサイトーシス)はすべての細胞に備わった機能であり、ファゴサイトーシス作用(食作用)は免疫細胞だけが持っているのです。エンドサイトーシスの取り込みにはアクチンが関係し、取込まれると食胞ができる。取り込みの物質が水溶液の場合を飲作用(ピノサイトーシス)と言います。
食胞とはアメーバ・ゾウリムシなどの原生動物に見られる 細胞器官の一種で 細胞 内にとりいれた食物のまわりに消化液を分泌したもので,これによって食物を消化する。
ファゴソーム(食胞)としてマクロファージ内に取り込まれた細菌やヘルペスウイルスはリソソームと言われるもう一つの小胞と融合します。ところがメサンギウム細胞は食作用を持っているのですがIgA免疫複合体のherpesウイルスはIgA抗体と結合しているのでメサンギウム細胞はIgA免疫複合体のherpesウイルスを直接、貪食が出来ないのです。何故ならばメサンギウム細胞はマクロファージのような免疫細胞ではなく普通の毛細血管の支柱になるあらゆる細胞の食作用は抗体を食べる食作用の機能は持っていないからです。IgA免疫複合体からヘルペスウイルスが離脱できれば可能です。
リソソーム内腔には生体高分子(タンパク質、脂質、糖質など)を構成単位のアミノ酸、リン脂質、糖、核酸などにまで分解できる約60種類の加水分解酵素が存在する。プロテアーゼ(protease)、グリコシダーゼ(glycosidase)、リパーゼ(lipase)、ホスファターゼ(phosphatase)、ヌクレアーゼ(nuclease)、ホスホリパーゼ(phospholipase)、スルファターゼ(sulfatase)などがあり、多くは酸性域に至適pHを持つため、酸性加水分解酵素(acid hydrolase)と総称されます。これらはA-B + H2O → A-H + B-OHという加水分解反応によって基質を分解するのです。又、リソソームに局在するプロテアーゼ(タンパク質分解酵素)は20種類以上あり、それらはカテプシン(cathepsin)と名付けられ、A-Zまで存在する。リソソームにはカテプシン以外の名称のプロテアーゼも存在するのです。又リソソーム中には活性酸素も含まれています。
プロテアーゼ(またはペプチダーゼ)とは、何でしょうか?タンパク質分解反応を触媒する酵素の中心的なファミリーであり、標的タンパク質のペプチド結合を加水分解し、タンパク質をより小さなペプチドまたはアミノ酸に分解します。すべてのヒト遺伝子の約2%を構成するプロテアーゼは、多くの生理学的および発生プロセスに関与する酵素の最大のファミリーを構成しています。細胞内での消化やタンパク質のリサイクルに関与する一部のプロテアーゼは比較的非選択的ですが、ほとんどのプロテアーゼは特定のペプチド配列のセットを認識するように進化しています。
実際上に挙げたリソソームに含まれている60種類の強力な加水分解酵素は膜で囲まれているリソソームという小胞の中から出てしまうとマクロファージも酸性加水分解酵素という化学物質によって殺されてしまうので小胞という膜の袋の中に閉じこまれているのです。リソソームはすごいと思いません。
もう一度凄すぎるリソソームとは何でしょうか?リソソームには様々な酵素が含まれており、これらの酵素がリソソームへ取り込まれた物質の消化を行っています。また、リソソームには活性酸素も含まれており、殺菌に役立っています。リソソームは,酸性に保たれた細胞内オルガネラの一つであり,複合糖質や脂質などの細胞内基質の分解に関わっています。 オルガネラとは細胞内にあって、真核細胞や原核細胞の細胞質に存在する小さな細胞内構造です。より複雑な真核細胞では、オルガネラは、多くの場合、独自の膜に囲まれています。各オルガネラは、臓器/器官が身体で働くのと同じように、その細胞に特化した機能を担っている一定の機能を持つようになった小器官の総称です。 細胞内小器官、細胞小器官などとも呼ばれ、核、ミトコンドリア、エンドソーム、ゴルジ体、リソソーム、リボソーム、微小管、小胞体などが例として上げられる。 小胞体(endoplasmic reticulum略してER)とは、核膜と連結したもう1つの膜システムで、脂質やタンパク質の合成や分解のプロセシングに関与しています。免疫細胞の小胞体は病原体を殺すためにあります。筒状の小胞体槽とシート状の小胞体があり、細胞によっては細胞全体の体積の約10%を占める場合があります。小胞体には、粗面小胞体(リボソームが付着し、タンパク質産生に関与する)と滑面小胞体(リボソームが付着せず、脂質代謝に関与する)に分類されます。リソソーム内部には酸性pH条件下で働く種々の加水分解酵素(リソソーム酵素)が存在し,エンドサイトーシスやオートファジーにより細胞内外から取り込まれた生体分子を加水分解する.分解されて生成したアミノ酸,糖そして脂質は再利用される.このことから,リソソームは細胞内の「糖、蛋白、脂肪のリサイクル工場」であるのであらゆるリサイクルのためにあらゆるリサイクルのために必要な酵素を持っているのです。
リソソームの重要な生理機能の一つにオートファジーがあります。細胞が細胞自身のタンパク質を分解・再生するオートファジー (自食作用)というメカニズムを解明した大隅良典先生にノーベル生理学・ 医学賞が贈られた今を時めく オートファジーとは何でしょうか?オートファジーは,飢餓状態などで誘導され,細胞内の自己タンパク質などをリソソームで分解することで栄養源を確保する生理作用です。また,通常の環境下でもプロテアソーム経路と並び,細胞成分の代謝に働いています。 プロテアソームとは、ユビキチン化されたタンパク質を選択的に分解する巨大で複雑なタンパク質分解酵素複合体です。 ユビキチン とは76個のアミノ酸からなるタンパク質で、他のタンパク質の修飾に用いられ、タンパク質分解、DNA修復、翻訳調節、シグナル伝達などさまざまな生命現象に関わる。至る所にあることから「偏在的にある」という意味の ユビキチンの名前が付いたのです。進化的な保存性が高く、すべての真核生物でほとんど同じアミノ酸配列をもっている。ユビキチンがついたタンパク質は、巨大酵素「プロテアソーム」へと運ばれます。 そこでタンパク質はアミノ酸へと分解され、新しいタンパク質の原料としてリサイクルされるのです。 ユビキチンという目印がついたタンパク質をプロテアソームが食べて、小さいアミノ酸へと分解され、アミノ酸は新しいタンパク質へと再生されるのです。 ユビキチン化されたタンパク質の除去により、細胞周期・アポトーシス・シグナル伝達・転写制御・品質管理・シナプス可塑性などに関与する。オートファジーが発がん,神経変性疾患,2型糖尿病等の生活習慣病,感染症,各種の炎症など,さまざまな疾患の発症・進展が見られるのは細胞に感染したヘルペスが遺伝子の突然変異を起こしたためです。また,発生・分化,老化,免疫などの重要な生理機能を持つことが明らかになり,オートファジー研究は大きな発展を遂げ,2016年に大隅良典先生がノーベル賞を受賞された。しかし大隅良典先生はオートファジーが阻止されたときに発がん,神経変性疾患,Ⅱ型糖尿病等の生活習慣病,感染症,各種の炎症など,さまざまな疾患の発症・進展が見られる原因はherpesである事をご存じないのです。細胞に感染したヘルペスウイルスが細胞のゲノムに組み込まれて突然変異を起こさせて異常な蛋白が作られてしまい、この異常なタンパク質がオートファジー経路を阻害して神経変性を誘発することがわかり、細胞は一過性に神経細胞のオートファゴソームが活性化して細胞を守ろうとするのですが力尽きて、やがて正常なオートファジーを維持できず様々なherpesが感染した細胞の変性を引き起こすからです。変性という言葉はあいまいですからヘルペス性神経変性疾患というべきです。 変性(Degeneration)とは何でしょうか?病理の用語で、細胞、組織のなかに、生理的には存在しない異常の物質、あるいは生理的に存在する物質でも、異常の部位に、ないしは異常な量に認められる状態を言います。退行性病変の一つで、細胞や組織に正常では存在しない物質が沈着ないし、正常でも存在するが沈着量や場所が異常なものをさす。 変性にはどんなものがあるでしょうか?変性(Degeneration)を大分類すると大きく七つに分けられます。一番多いのはやはり蛋白変性です。変性の大分類は、1)水腫性変化2)タンパク変性3)脂肪変性4)糖原変性5)病的石灰化6)尿酸沈着症7)色素沈着の七つに分けられます。
1)水腫性変化。①空胞変性(水様変性)。細胞質内の水分増加が起こり、その後空胞が生じるもの。病気には膠質浸透圧ネフローゼがあります。 ネフローゼ症候群はなぜ浮腫みが出るのでしょうか?ネフローゼ症候群とは、突然、あるいはじわじわと全身の浮腫に気付かれ、強い蛋白尿が見られる病気です。尿に蛋白(アルブミン)がたくさん出てしまうために、血液中の蛋白が減り、低蛋白血症となり、その結果、むくみ(浮腫)が起こる疾患です。 むくみは、低蛋白血症が起こるために血管の中の水分が減って血管の外に水分と塩分が増えるために起こります。ネフローゼ症候群では、糸球体の毛細血管に機能障害が起こり、蛋白質が尿中に漏出し、血中の蛋白質も減少してしまう。 よって低蛋白血症が必ずみられる。
2)タンパク変性。
①角質変性。角化が亢進します。
②硝子滴変性。細胞質内にタンパク質の小顆粒が出現します。 硝子滴とは間質内タンパク質沈着の1つで、タンパク質の一種であるヒアリンが、形態に不可逆的に変化し、本来その部位には存在しない場所に沈着することです。ヒアリンは電顕像ではアミロイドよりもさらに細かな細線維ないしは無構造物質。 既存の組織が変化して無構造な物質に変化したときヒアリン化とよぶ。病気は水銀中毒、ネフローゼです。近位尿細管上皮の硝子滴変性は蛋白尿,ネフローゼ症候群例で見られ,迂曲部から直部にかけて拡がる。硝子滴変性は巣状分節状糸球体硝子化,硬化などでは病変部に一致したネフロンの近位尿細管上皮に顕著に認められる。
③ラッセル小体。抗体を産生する形質細胞に過剰産生された免疫グロブリンが沈着。 ラッセル小体は、一般に免疫グロブリンの過剰産生を経た形質細胞で観察される均一の免疫グロブリンを有する巨大な好酸性の構造物。ラッセル小体は腫大した小胞体を特徴とする。 多発性骨髄腫で観察される細胞変化の1つがラッセル小体です。
④粘液変性。 粘液変性(mucoid degeneration)とは 間質内タンパク質沈着の1つで、タンパク質の一種である糖タンパク質であるムコ多糖が、本来の形態が不可逆的に変化し、ムコ多糖が存在しない部位には沈着すること。糖タンパク質(glyco‐protein)とは、タンパク質を構成するアミノ酸の一部に糖鎖が結合したものである。 ヒトを含む動物においては、細胞表面や細胞外に分泌されている粘液のタンパク質のほとんどが糖タンパク質である。
⑤硝子様変性。 ヒアリン変性(hyalin degeneration)とは?間質内タンパク質沈着症の1つで、タンパク質の一種であるヒアリンが、本来その部位には存在しない形に不可逆的に変化し、沈着すること。 小動脈内皮細胞にherpesが感染すると小動脈内皮に変性ヒアリンが沈着すると、細動脈硬化症を起こす。動脈硬化症の原因も動脈の内皮細胞に感染したてherpesが原因なのです。均一無構造のタンパク質である硝子質(ヒアリン)が変性して結合組織に沈着することを硝子様変性といいます。筋肉変性症である舌筋線維の硝子様変性を伴う舌筋の変性と再生も観察されています。
硝子質とはヒアリン(hyaline)という一種のタンパク体(リポタンパク)で、均質かつ無構造であるため、組織標本の染色としてもっともしばしば用いられる酸性色素であるエオジンで淡赤色に染まり、その状態が不透明な「曇りガラス」に似ているのでこの名称がつけられている。となれば最も正しい名称は「曇りガラス様変性」であるべきです。リポタンパクの例としてはコレステロールは血漿中ではリポタンパク(HDL,LDL,VLDL)の形コレステロールが含まれているのが最も有名です。 ヒアリンの正常なもとの蛋白は何でしょうか?誰もわかってはいません。
電顕像ではヒアリン(hyaline)はアミロイドよりもさらに細かな細線維ないしは無構造蛋白物質です。又、既存の組織が変化して無構造な物質に変化したときにヒアリン化とよぶ。硝子様変性を呈する病気や症状には瘢痕組織、結核、高血圧があります。
⑥アミロイド変性。 アミロイドとは,人体を構成しているタンパク質の形や性質がherpes感染により変わり,水や血液に溶けにくい線維状の塊となった物質です. アミロイドが体に沈着することにより引き起こされる病気をアミロイドーシスと言います.アミロイド―シスには、原発性、続発性、透析による限局性のアミロイド変性が見られますがこれらのアミロイド―シスを伴う病気はすべてherpesが原因であります。ヘルペス感染した細胞がアミロイド変性を起こして自己免疫疾患である慢性関節リウマチ、細菌感染症である結核も結核病巣にherpesが感染して続発性のアミロイド変性を起こしアミロイド―シスなります。さらにアミロイド変性症ではないのですが、続発性の上皮細胞に感染した癌ウイルスであるherpesが遺伝子を突然変異させて変性した癌蛋白を作って癌の塊を産生してしまいます。さらに同じよう血液癌である多発性骨髄腫は、白血球の中のリンパ球のうち、B細胞から分化(未熟な細胞が成熟した細胞になること)した形質細胞にherpesが感染して形質細胞の遺伝子をがん化させて出来上がった変性した癌蛋白が作られると造血細胞の癌細胞である骨髄腫細胞になり、骨髄腫細胞が主に骨髄で増える病気となる多発性骨髄腫を起こします。多発性骨髄腫もherpesが形質細胞の遺伝子に感染していわばヘルペス性の続発性のアミロイド変性を起こした結果、癌蛋白を作ったのでアミロイド変性疾患の一つであると言えるのです。というのは多発性骨髄腫とは、血液細胞の1種である抗体を作る形質細胞からできる血液のがんの一つですが、Herpesが形質細胞に感染してherpesのゲノムが形質細胞のゲノムに組み込まれて遺伝子や染色体の突然変異という異常を引き起こし癌蛋白という変性蛋白を生じさせ多発性骨髄腫という血液癌となったからです。
アルツハイマーの原因と言われているアミロイドβは、脳内で作られた正常なタンパク質が変性分解されたもので、40個前後のアミノ酸からできています。 分解される時の微妙な切れ目の差で、無害で排出されやすいものと、毒性が強く、たんぱく質同士が互いにくっついて脳に溜まりやすいものに分かれます。 アミロイドβになる前の正常なたんぱくは何でしょうか?何なのかはヒアリンと同じく誰も知らないのです。知っていても誰も口にしないのです。
⑦フィブリノイド変性。タンパク質であるフィブリノイドが沈着。悪性高血圧、膠原病(PN、SLE)、自己免疫疾患があると言われますが膠原病(PN、SLE)や、自己免疫疾患という病気はこの世には存在しません。herpesが原因です。 PNはpolyarteritis nodosaの略で結節性多発動脈炎で中型血管を主体として、血管壁に炎症を生じる疾患です。 SLEは、Systemic Lupus Erythematosusの略で全身性エリテマトーデスです。 フィブリノイドとは何でしょうか?フィブリノイド(フィブリン様物質)は、herpesが感染したに感染して変性した血管内皮細胞のコラーゲン、基質、フィブリン(線維素)なども変性してしまい増殖したherpesに対抗するために、免疫が働きだし免疫グロブリンや補体などの血漿成分がにじみ込んで形成される変性物である。 類線維素変性、線維素様変性、フィブリン様変性とも呼ばれ、血管炎によって起こる変性物質です。アミロイドとよく似ています。語尾に「~オイド」が付くと「~に似た」と、いう意味を持ちます。
因みに嘘ですがアルツハイマーの原因と言われているβアミロイドの アミロイドとは何でしょうか?アミロイドとは私たちの体を構成しているタンパク質の形や性質がヘルペス感染のために変わり,水や血液に溶けにくい線維状の塊となった物質です。 アミロイドが体に沈着することにより引き起こされる病気をアミロイドーシスと言います.「アミロイド」の名称は、元々は、この物質がヨウ素でんぷん反応と似た反応をすることから、デンプン(ラテン語ではamylum)と関係があるとの誤解により付けられたものである。ヨウ素でんぷん反応は食品中にデンプンがあるかないかを検出するための検査です。“アミロ”は「でん粉に似た」を意味するので「類デンプン質」という意味で”amyloid”と名付けられましたが間違っていたのです。この大間違いをした アミロイドの名付け親はかの有名すぎる現代病理学の父 Rudolph Virchow です。現代病理学の父でドイツ人の医師であったルードルフ・ルートヴィヒ・カール・フィルヒョウが大間違いをしでかしたのです。というのは、科学者たちはアミロイドが脂質なのか炭水化物なのかの議論をしていましたが、実はそのどちらでもなく、herpesが感染した細胞の蛋白を変性させた結果生じたタンパク質の屑であったのでした。
フィブリン(線維素)とは何でしょうか?フィブリン(fibrin)は、血液凝固に関わるタンパク質である。繊維状タンパク質で、傷などが原因となって血小板とともに重合し、血球をくるみこんで血餅を形成する。止血や血栓形成の中心的な役割を担っている。繊維素あるいは線維素とも呼ばれる。因みに「フィブリノーゲン」は「線維素原」と訳します。
悪性高血圧とは何でしょうか?血圧が異常に高くなることにより、全身の血管の抵抗が急上昇して特定の臓器に障害が生じた状態を「高血圧緊急症(悪性高血圧)」です。血圧は 「180/120mmHg」の場合が多く、降圧剤を飲んでも効果がほとんど見られません。原因としては長期にストレスがかかり続けたために交感神経の神経節に感染したherpesが免疫に発見されて炎症が急に生じて血圧が急に高くなったのです。従って 悪性高血圧はヘルペス性悪性高血圧というべきです。血管を支配するのは血圧を上げる交感神経だけで副交感神経は血圧には一切かかわらないのです。頭痛以外に、障害が出やすい臓器としては「脳」・「腎臓」・「心臓」で脳卒中・脳出血や腎不全・尿毒症や心不全・心筋梗塞が出ることがあります。 尿毒症とは何でしょうか?尿毒症とは 本来腎臓では、体の中で不要になった老廃物や毒素を尿の中に排出するのですが、腎臓がヘルペスによって障害を受けて十分に機能しなくなると、老廃物や毒素が体内に蓄積し、様々な障害を生じてしまうようになります。 これが尿毒症です。尿毒症とはどんな症状が出ますか?尿素窒素(BUN)、クレアチニン(Cr)、リン(P)、カリウム(K)等の尿毒症性物質が体内にたまり、疲れやすい、息切れがする、尿量が減る、浮腫、食欲低下などの症状や、高血圧、高カリウム血症、貧血を尿毒症症状といいます。尿毒症とは、腎臓の働きが極度に低下して起こる全身の変化をいい、急性あるいは慢性の腎臓障害が進行した状態です。 これは、腎臓の働きが、正常の10分の1程度まで著しく低下している末期腎不全の状態であり、そのまま治療をしなければ、生命にかかわるような深刻な事態となります。
詳しく詳しく論述しているので一旦ここで区切ります!!
続きはPart2へ行ってください!!
