筋萎縮性側索硬化症(Amyotrophic Lateral Sclerosis,略して ALS)の原因もherpesである。原因がヘルペスであることがわかっているので抗ヘルペス剤で治すことが出来ます。私はALSも良くした臨床経験があります。
ここではALSの原因として言われている間違った5つの説はすべてまちがいです。本当の原因はherpesが大脳の一次運動野に感染したからです。
①グルタミン酸仮説ではグルタミン酸の再取り込みの障害によってグルタミン酸が過剰になりシナプスの隙間に過剰に溜まって、運動ニューロンがダメージを受けるから。
②遺伝についてはALSは多くの場合遺伝せず、約9割が遺伝と無関係に発症しますが、残りの1割は家族性ALSとされています。スーパーオキシド・ジスムターゼ(SOD1)という活性酸素を解毒してくれる遺伝子の突然変異が見られるからと言われていますが間違いです。
③環境については紀伊半島の発症者数が多い地区では全国平均の50~100倍にもなるからです。
④ストレス類粒については、神経細胞の中に存在するRNA-タンパク質複合体を多く含んだ構造体で、細胞が感染や熱ショックなどのストレスを受けた際に形成される凝集体です。ストレス類粒が消失せずに過剰に蓄積することで、筋萎縮性側索硬化症や精神変異性疾患、がんなどの原因となると考えられています。ストレス類粒とは何でしょうか?英語でstress granuleで略してSGです。細胞が低酸素、herpes感染、異常蛋白質の蓄積、熱ショックといったストレス状態下に置かれた際に、ストレスに応答し、細胞質中に生じる100nmから200nm程度の凝集体です。ストレス類粒は翻訳開始時に翻訳を停止したmRNAを含む非翻訳メッセンジャーリボ核蛋白質(mRNP)で構成される。ストレス顆粒はherpes感染によって細胞質に生じると、一過性の翻訳抑制などが生じ、異常蛋白質の蓄積を防いだり、シグナル伝達経路を調節したりし、ヘルペスによる細胞損傷を回避するのです。
近年、運動ニューロンがヘルペス感染によって障害される筋萎縮性側索硬化症(ALS)など、すべての神経変性疾患やすべての癌において、疾患関連の蛋白質がストレス顆粒に局在することや、herpes感染の影響を逃れるために持続的に異常なストレス顆粒の形成が認められます。ストレス顆粒は神経変性疾患や癌などで生ずるストレス顆粒に局在する疾患関連蛋白質を除去する治療薬の創製の研究開発が行なわれていますが無駄です。何故ならば筋萎縮性側索硬化症(ALS)の原因は一次運動野に感染したヘルペスであり、かつストレス顆粒は一次運動野の神経細胞に感染したヘルペスから脳細胞を守るためなので真逆の薬を作るなどとはとんでもないことです。
全ての病気はherpesから細胞を守るための免疫の正しい反応として症状が出ているのにもかかわらずステロイドをはじめとする免疫抑制薬を治療薬として許可するのはすべて禁止すべきです。とりわけ最悪の薬であるステロイドは絶対に禁止すべきです。ステロイドは治療薬ではなく炎症が酷くて生死を彷徨うときの蘇生薬なのです。ステロイドが癌ウイルスであるヘルペスを最高度に増やして最終的には癌を作成して人間の命を奪っているからです。
⑤神経栄養因子欠乏説があります。神経栄養因子欠乏説とは、神経を成長させるために必要な栄養成分や、傷ついた細胞を回復させるために必要な栄養成分などが足りなくなってしまうことにより、運動ニューロンが破壊され、ALSの発症に繋がるというものです。
以上がALSの原因として考えられている主な仮説ですが、前述したように現時点では五つの仮説はすべて明確な原因が解明されていませんので意味のない仮説にすぎません。真実のALSの原因はherpesが大脳の一次運動野にヘルペスが感染して上位運動ニューロンの機能が無くなって生ずる神経変性疾患の一つです。これを詳しく証明するための論文です。乞うご期待を!!!
それでは筋萎縮性側索硬化症(ALS)の真の原因とは何でしょうか?
現在、上で述べたように筋萎縮性側索硬化症になる原因は詳しくは分かっていません。自然に発症すると言われることがあるのはherpesが原因であるのを世界中の医者は何故か認めないので非科学的な「自然」と言う言葉を使っているのです。皮肉を言えば全人類は自然に、知らない間に、症状も出ない間にherpesに感染しているのでALSは確かに自然に発症したのでしょう。ワッハッハ!!!
まれに遺伝的要素によって発症するケースがあり、筋萎縮性側索硬化症を発症した者のうち約5%が家族に病歴があるのはherpes感染によってたまたま遺伝子にも入り込んだherpesは好き放題に遺伝子をいわゆる何の意味もない突然変異をさせてしまうので家族性の遺伝子病と決めつけたのでしょう。家人のすべての人に大量に感染したヘルペスこそが元の元の原因であるにも関わらずにです。病気の原因が不明である時に遺伝病を持ち出すのは医薬研究業界の常套手段です。ワッハッハ!!!未だ結論は出ていませんが実はヘルペスこそが原因なのです。
しかし最近、酸化ストレスやグルタミン酸過剰によるグルタミン酸毒性が神経障害を起こすといった原因説が提唱されだしたので勉強しましょう。
グルタミン酸とは何でしょうか?グルタミン酸は記憶や学習に関係する神経伝達物質ですが大脳の運動野からのグルタミン酸の指令をグルタミン酸受容体が受けとります。このグルタミン酸受容体の種類の中でAMPA受容体を構成するGluR2という物質がALSに関係しているというわけです。AMPA受容体とは何でしょうか?AMPA受容体は脳内にある最も一般的な興奮性グルタミン酸受容体である。AMPA型グルタミン酸受容体 (AMPA受容体) の役割は、ニューロン同士の連絡場所であるシナプスで興奮性神経伝達を担っています。脳内の情報処理の中心的な役割を担う神経伝達物質であるグルタミン酸の受容体の一つであり、シナプス膜上にイオンチャネルを形成しています。 グルタミン酸が結合すると、受容体にトンネルが形成され、ナトリウムやカルシウムイオンが細胞内に入って、ニューロンが興奮することで、シグナルが隣のニューロンに伝わります。
このグルタミン酸受容体のAMPA受容体を通常ではCa2+(カルシウムイオン)が大量に通過することがありませんが、大量に通過することで細胞が死滅することでALSに関連性があります。特にグルタミン酸受容体の中のGluR2が正常な状態で機能していない場合はCa2+(カルシウムイオン)が大量に通過しまい、運動ニューロンという神経細胞が死んでしまいます。GluR2は英語でglutamate ionotropic receptor AMPA type subunit 2の略語です。 しかし、何故異常な状態に変化するのかといったメカニズムについては現在も分かりません。これは、1つの仮説であり、ALSの原因を説明する仮説にすぎません。この原因もherpesがGluR2の遺伝子の塩基を突然変異をさせるからです。とにかくヘルペスウイルスは神経細胞に感染すると核の中にエピソウムという裸の遺伝子として侵入して遺伝子の中にプロウイルスとして感染して思うままに、自由自在に遺伝子を構成する四つの塩基の並びを変えてしまうのです。このherpesの特技を形質転換とか遺伝子突然変異と言うのですが世界中の医学研究者は誰も言わないのです。哀しいですね。
筋萎縮性側索硬化症の遺伝的原因については既に述べましたが 筋萎縮性側索硬化症については家族に同じ病気がある場合、遺伝子異常が原因となるケースも多くあります。現在遺伝子についての異常については、30種類ほどの遺伝子の異常による原因が確認されています。この意味は一体何でしょうか?この30種類ほどの遺伝子の異常はどのようにして起こったのでしょうか?真上の段落で説明したようにヘルペスウイルスは神経細胞に感染すると核の中にエピソウムという裸の遺伝子として侵入して神経細胞の遺伝子の中にプロウイルスとして感染して思うままに、自由自在に遺伝子を構成する四つの塩基の並びを変えてしまうのです。このherpesの特技を形質転換とか遺伝子突然変異というのです。因みに人口の1%以上の人が突然変異をしてしまった塩基の並びが遺伝子を変えてしまった遺伝子型を遺伝性多型性と呼び1%以下の突然変異をまさに「遺伝子突然変異」と言い慣わしているのです。遺伝子突然変異と遺伝子組み込みと遺伝子組換えとゲノム編集の違いは何でしょうか?
遺伝子組換えは、目的とする遺伝子を取り出し、必要に応じて改変を加え、受け手となる生物(宿主)に再び導入することです。遺伝子組換えは、外から新たに遺伝子を挿入する技術です。
ゲノム編集は、ゲノムの情報を利用して遺伝子を切ったりつなげたりすることを指します。ゲノムとはある生物がもつ全ての遺伝情報です。特定できた重要な遺伝子の情報を利用して遺伝子を切ったりつなげたりすることで自然に突然変異を待つのではなく人為的に変異を起こすことで人間に都合の良いように変えることをゲノム編集と言います。ゲノム編集は、その生物が持っている遺伝子を変える技術です。
遺伝子組み込みとはHerpesウイルスは自由自在に自分の遺伝子を感染細胞に入れ込んで細胞の遺伝情報を突然変異的に変えてしまい時には癌遺伝子に変えることも出来るのです。
主なものしては、SOD1といった抗酸化ストレスに対する遺伝子やリン酸化されたTDP-43遺伝子などは代表的なもののひとつです。こういった遺伝子的な異常については、家族に同じ病気を持っている人に多い傾向にある、以外にも特に家族にそういった病気がない人でもあるものもあります。また、ある遺伝子の異常と住んでいる地域との関係性といったこともあります。SOD1とは何でしょうか?SOD1は英語のsuper‐oxide dismutaseの略語です。スーパーオキシドを酸素と過酸化水素へ不均化する抗酸化酵素です。スーパーオキシドは超酸化物と訳します。超酸化物とは、スーパーオキシドアニオンを含む化学物質の総称で、自然界では酸素分子の一電子還元により広範囲に生成している点が重要であり、1つの不対電子を持つ。スーパーオキシドアニオンは、二酸素と同様にフリーラジカルであり、常磁性を有する。一般に活性酸素と呼ばれる化学種の一種である。常磁性とは、外部磁場が無いときには磁化を持たず、磁場を加えるとその方向に弱く磁化する磁性を指す。熱ゆらぎによるスピンの乱れが強く、自発的な配向が無い状態である。ALS患者で高頻度に見られる原因遺伝子であり、160種類以上の遺伝子変異が報告されているのはherpesがALSの原因であるのでヘルペスウイルスは脳の運動野の神経細胞に感染すると核の中にエピソウムという裸の遺伝子として侵入して神経細胞の遺伝子の中にプロウイルスとして感染して思うままに、自由自在に自分の遺伝子を組み込んだりして細胞の遺伝子を構成する四つの塩基の並びを変えてしまっただけで遺伝子的な意味は全くなくherpesが遺伝子の中で戯れていただけの痕跡に過ぎないのです。勿論herpesが変えてしまった160種類以上の遺伝子変異の中には原因遺伝子の変異があるかもしれませんが変異の根本原因はherpesなので大金をかけて遺伝子治療をやったところで完治はしないのです。
このヘルペスウイルスの遺伝子の組み込みや組み換えによって癌を引き起こす遺伝子の突然変異を引き起こすことも有るのです。このherpesの遊びを形質転換とか遺伝子突然変異というのですがALSを引き起こす根本原因ではないのです。自然にかつ自発的に病気を起こす遺伝子の突然変異は簡単には起こらないのです。何故ならばたとえ自然の突然変異が生じてもそれ以上に優れたDNAの修復装置が備わっているからです。DNAの修復装置で修復できなければ最後の手段であるアポトーシス弟子の細胞もろとも自滅できるのです。しかもたった一個の神経細胞の遺伝子がALSを起こす変異を起こしても他の細胞が正常であれば絶対にALSはおきないのです。ALSは癌ではないので変異した遺伝子を持った神経細胞が無限に増えるわけでもないからです。
長年かけて起こった遺伝子の突然変異こそ人類の進化の元ですが偶然に病気を引き起こすわけでもない遺伝子の異常が人間の極めて短期間に起こって様々な病気が起こるほど人間の遺伝子は脆弱ではないどころかその素晴らしい遺伝子の突然変異も積み重ねの結果、人類は霊長類のトップに上り詰めたのです。人間の遺伝子にはDNAに異常が起これば極めて精巧な修復装置があり、人間の遺伝子は一日に2万5千個のDNAの塩基が誤って入れ替わっているのをせっせと修復できるシステムを持っているのです。従ってALS患者で高頻度に見られる原因遺伝子でないのにも拘らず、160種類以上の遺伝子変異が報告されているのはherpesウイルスが塩基を変える遺伝子を特別に持つようになった結果に過ぎないのです。
一次運動野の働きが無くなってALSになるのはやはり大脳の一次運動野の神経細胞に感染したヘルペスが細胞で増殖するために利用しつくした細胞は生きることが出来なくなって変性脱落したか、または運動神経細胞に感染したherpesを見つけ出した大脳の大食細胞であるミクログリアが炎症を起こして細胞の機能障害が起きたのか、ミクログリアに貪食されたかのいずれかが原因なのです。もちろん同時に起こっている場合もあり得ます。この様にherpesが原因であるならば一次運動野の神経細胞にどのように感染できたのかの説明も詳しく後述します。乞うご期待!!!
必ず家族に同じ病気がいる場合でも遺伝するといったことではなく、遺伝性するものも原因となるといったことで現在のところ、遺伝子の異常による原因も筋萎縮性側索硬化症の原因のひとつとして有力なものと言われていますが大きな誤りです。
原因として考えられる要因について現代医学の唱えるつまらないですがALSの原因を批判的に見ていきましょう。
さらにいくつか筋萎縮性側索硬化症となる病気の原因として①興奮性細胞死②RNA構造調整機構異常などやその他の説も多数あります。 現在のところ、これらの説の単独で筋萎縮性側索硬化症の病気の原因を完全に説明できる裏づけがある説はありません。病気の原因の要因ではありますが、必ずその要因だけで病気が発症するといったわけではありません。しかしロイヤル・レイモンド・ライフ博士の「光療法で癌の原因である癌ウイルスを殺せば癌は治せる」治療法を受け継いでいる私の治療法は癌ウイルスはherpesであると特定までしているので完璧な治療法なのです。ロイヤル・レイモンド・ライフ博士についてはここを読んでください。②のRNA構造調整機構異常ではすでに述べたGluR2のRNA編集異常以外にTDP-43タンパク代謝異常があります。TDP-43蛋白とは何でしょうか?TDP-43は英語のTAR DNA-binding protein of 43 kDaの略語です。TDP-43は核に局在するRNA結合タンパク質であり、様々な遺伝子の転写やスプライシングに関与している。筋萎縮性側索硬化症(ALS)や一部の前頭側頭葉変性症(FTLD)の神経細胞やグリア細胞に認められるユビキチン陽性封入体の主要な構成タンパク質としてTDP-43が同定された。前頭側頭型認知症はfrontotemporal dementia で略してFTLD です。前頭側頭葉変性症(FTLD)は主として初老期に発症し、大脳の前頭葉や側頭葉を中心に神経変性を来たすため、人格変化や行動障害、失語症、認知機能障害、運動障害などが緩徐に進行する神経変性疾患である。
ALSやFTLDで同定されたTDP-43は神経細胞やグリア細胞に認められるユビキチン陽性封入体の主要な構成タンパク質でありTDP-43凝集体も神経細胞脱落との関連があるのですが実は封入体もTDP-43凝集体も神経細胞脱落もherpesのなせる業なのです。最近では、TDP-43凝集体のプリオン様性質が注目されており、凝集体が細胞間を伝播し、伝播した先の細胞内で凝集のシードとして機能し、その結果異常病変が経時的に拡がるという新たな病態メカニズムが考えられているようですが実はプリオンもヘルペスなのです。プリオンとは何でしょうか?プリオンは、タンパク質から成る感染性因子であると言われていますが感染性と言う限りは遺伝子を持った生命体であるべきです。プリオンはあくまでも蛋白ですから何らかの形で遺伝子の発現で生まれた一つの蛋白ですから絶対に感染が起こることはないのです。従ってプリオンは理論上の蛋白の感染単位として認められているのですが反論する学者も今なお研究を続けています。いずれにしろ蛋白が細胞に感染することはないので感染単位と言うのは間違いです。プリオンの実態は人畜共通に感染できるヘルペスウイルスの仲間の一つです。これについては詳しく後述します。乞うご期待!!!プリオンの科学的表記でPrPCは多くの組織に認められる内因型の正常なプリオンタンパク質を指し、他方、PrPSCは神経変性を惹起するアミロイド斑形成の原因となるミスフォールド型のPrPを指します。神経変性を起こすのはherpesの仲間しかいません。
始めにALSの原因はherpesですから、グルタミン酸が関わっていないのにグルタミン酸の話をしました。つまり、グルタミン酸は記憶や学習に関係する神経伝達物質ですが大脳の運動野からのグルタミン酸の指令をグルタミン酸受容体が受けとるのですが、このグルタミン酸受容体の種類の中でAMPA受容体を構成するGluR2という物質がALSに関係しているというわけです。ALSの患者さんは最後はALSのために死ぬのですがグルタミン酸受容体の過剰刺激による興奮細胞死が近頃言い出されましたので紹介します。
グルタミン酸受容体であるAMPA受容体を構成するGluR2という物質がALSに関係しているのは既にご紹介しましたがこのAMPA受容体を過剰刺激してしまうと刺激され過ぎた神経細胞はネクローシス(壊死)を起こして死んでしまうのですがこれは過興奮性毒性のためと呼ばれ、虚血やてんかんなどの病態にも深く関連しているのです。これはグルタミン酸受容体の持続的な活性化が神経細胞の膨張をもたらしてネクローシスが引き起こされてしまうからです。
興奮性毒性(過興奮性毒性)とは何でしょうか?
興奮毒性(excitotoxicity)とは、正常範囲では必要かつ安全なグルタミン酸などの神経伝達物質がヘルペスが原因で病理学的な高濃度状態となり、受容体の過剰刺激によって興奮させ過ぎると神経細胞に過剰な負荷がかかり受容体の要求に細胞が応えきれずに損傷したり最後は死滅したりする現象を興奮毒性(excito‐toxicity)と言います。例えば、NMDA受容体やAMPA受容体などのグルタミン酸受容体が興奮性神経伝達物質であるグルタミン酸の過剰量存在下に置かれると、神経細胞には大きな損傷が生じる可能性がある。NMDA受容体とは何でしょうか?中枢神経系を中心に生体内に広く分布し、リガンドであるグルタミン酸の結合を経て、陽イオンを透過させるイオンチャネル共役型受容体である。リガンドのグルタミン酸を受容した NMDA受容体が透過させる陽イオンには特に選択性がなく、ナトリウムイオン (Na+) やカリウムイオン (K+) の他に、カルシウムイオン (Ca2+) も通すことができる。Herpes感染症のために過剰になったグルタミン酸は、細胞内に高濃度のカルシウムイオン(Ca2+)を流入させる。細胞内に流入したCa2+は、ホスホリパーゼ、エンドヌクレアーゼ、プロテアーゼ(カルパインなど)を含む多数の酵素を活性化する。これらの酵素は、細胞骨格の構成要素や、細胞膜や、DNAなどの細胞構造を損傷させます。
生命のような進化した単純でかつ複雑適応系では特定の機構が単純かつ直接的なものであるように進化したのです。例えば、毒性量以下のグルタミンのNMDAへの曝露は未来の毒性量のグルタミン酸に対する神経細胞の生存を誘導する準備もしておくことが出来るように進化したのです。このような、一見複雑な応答が観察されるのはherpes感染などの生死にかかわる非常事態が起こったときはさらに細胞が生き続けるために様々な工夫が出来るように進化したのです。人の生命のような進化した高等な適応系では未来の非常事態に対して単純かつ直接的な明確な特定の機能を持った機構が生れたのです。
興奮毒性は、細胞が組織が臓器が致命傷を避けるための非常事態に対応して生まれるのです。一つ目はherpesに対抗するためです。がん、聴覚障害、中枢神経系の神経変性疾患である多発性硬化症、アルツハイマー病、筋萎縮性側索硬化症(ALS)、パーキンソン病)、二つ目は外部から過剰な力を加えられて危害を加えられる事故や暴力です。外傷性脳損傷、脊髄損傷などです。三つめは自分自身が快楽を求めすぎて起こす病気です。脳卒中、アルコール依存症、アルコール離脱症候群などです。
グルタミン酸の歴史を語りましょう。
中枢神経系に対するグルタミン酸の有害な影響はグルタミン酸の直接投与によって発作が引き起こされることや「致死量よりやや少ない」の皮下投与量で新生児マウスの網膜内層の神経細胞が破壊されたり網膜に限らず脳全体で神経細胞の破壊起きていることが知られ、興奮毒性(excitotoxicity)という言葉が生まれた。また、グルタミン酸による興奮毒性(excitotoxicity)による細胞死がシナプス後神経細胞に限定されていることや、グルタミン酸アゴニストはグルタミン酸受容体の活性化能と同程度の神経毒性を有し、またグルタミン酸アンタゴニストは神経毒性を止めることができることがわかりました。アゴニストとアンタゴニストとは何でしょうか?薬物受容体と相互作用して全活性の細胞内シグナル伝達を引き起こす物質をアゴニスト(作動剤),アゴニストと拮抗的に作用してその作用を減弱させる物質をアンタゴニスト(拮抗剤)とよぶ。 アンタゴニストのうち,受容体に作用して,弱いながら部分活性を発現させる物質をパーシャルアゴニストとよぶ。
2002年、Hilmar Badingらは興奮毒性がシナプス結合の外部に位置するNMDA受容体の活性化によって引き起こされることを発見した。このシナプス外NMDA受容体による有毒なシグナル伝達の分子基盤もHilmar Badingらによって明らかにされ、シナプス外NMDA受容体とTRPM4からなる細胞死シグナル伝達を促進する複合体について記載がなされ、NMDAR/TRPM4相互作用面阻害剤(NMDAR/TRPM4 interaction interface inhibitor)を用いてこの複合体を破壊することで、シナプス外NMDA受容体の毒性は消失してしまいます。
興奮毒性は体内で産生される物質(内因性興奮毒)によって生じることもある。グルタミン酸は脳内の興奮毒の最も典型的な例であり、哺乳類の中枢神経系における主要な興奮性神経伝達物質でもある。正常条件下では、グルタミン酸濃度はシナプス間隙で最大1 mMまで上昇し、数ミリ秒後には迅速に低下する。シナプス間隙周辺のグルタミン酸濃度が低下しなかったり、より高いレベルに達したりした場合には、神経細胞はアポトーシスと呼ばれる過程で自ら死を引き起こす。
この病理学的現象は、脳損傷や脊髄損傷の後にも生じる。脊髄損傷後数分以内に、グルタミン酸は傷害部位の損傷した神経細胞から細胞外空間へ漏れ出し、シナプス前グルタミン酸受容体を刺激してさらなるグルタミン酸の放出を引き起こす。細胞外のグルタミン酸レベルの上昇はミエリン鞘やオリゴデンドロサイトに位置するCa2+透過性のNMDA受容体の活性化を引き起こし、オリゴデンドロサイトはCa2+の流入とその後の興奮毒性の影響を受けやすい状態となる。細胞質基質(細胞質マトリックス)の余剰なカルシウムによって引き起こされる有害な影響の1つは、切断型カスパーゼによるプロセシングを介したアポトーシスの開始である。他の影響としては、ミトコンドリア膜透過性遷移孔の開口が挙げられる。ミトコンドリアの膜に位置するこのポア(開口)は、ミトコンドリアが過剰量のカルシウムを吸収した際に開く。ポアの開口によって、ミトコンドリアの膨潤と活性酸素種やアポトーシスにつながる他のタンパク質の放出が引き起こされるのです。また、ポアはミトコンドリアからのさらなるカルシウムの放出も引き起こす。さらに、アデノシン三リン酸(ATP)の産生は停止し、ATP合成酵素はATPの産生ではなく加水分解を開始するのです。この現象はATPの産生が出来なくなりエネルギーの減少が抑うつへの関与が示唆されている。
外傷性脳損傷による不十分なATP産生は、特定のイオンの電気化学的勾配の消失を引き起こす。グルタミン酸トランスポーターが細胞外空間からグルタミン酸を除去するためには、こうしたイオン勾配の維持が必要である。イオン勾配の喪失はグルタミン酸の取り込みを停止させるだけでなく、トランスポーターの逆送も引き起こす。神経細胞やアストロサイトのNa+-グルタミン酸トランスポーターはグルタミン酸の輸送を逆転させ、興奮毒性を誘発する濃度のグルタミン酸を分泌し始める。その結果、グルタミン酸は蓄積し、グルタミン酸受容体の活性化はさらに損なわれます。
分子レベルでは、カルシウムの流入は興奮毒性によって誘導されるアポトーシスを担う唯一の因子ではない。グルタミン酸曝露や低酸素や虚血状態によって引き起こされるシナプス外のNMDA受容体の活性化はCREBタンパク質の遮断を引き起こし、ミトコンドリアの膜電位の喪失とアポトーシスを引き起こす。CREBタンパク質は英語のcAMP response element binding protein略語であります。CREBは転写因子であり、cAMP応答配列と呼ばれる特定のDNA配列に結合し、遺伝子の転写を増加させたり低下させたりして、細胞の増殖や分化,適応の過程などやTリンパ球の分化や増殖,成 長ホルモンの産生や発育などに重要な役割を果たす。一方、シナプスのNMDA受容体の活性化ではCREB経路が活性化され、脳由来神経栄養因子(BDNF)が活性化されてアポトーシスは活性化され起こらないのです。
神経毒として他に外因性興奮毒があります。通常体内に存在しない外因性興奮毒はシナプス後細胞に作用する神経毒です。こうした外因性毒素は、創傷、摂食、空気拡散などを介して環境から生物の体内に進入する。一般的な興奮毒としては、AMPA受容体やNMDA受容体などのグルタミン酸受容体におけるグルタミン酸の作用を模倣するグルタミン酸アナログなどがある。
BMAAとは何でしょうか?グアムのチャモロ人に多くみられる筋萎縮性側索硬化症/パーキンソン-認知症複合(ALS/PDC、リティコ・ボディグ病)と最初に関連づけられたL-アラニン誘導体であるβ-メチルアミノ-L-アラニン(英語の略がBMAA)は古くから神経毒として同定されており、広範囲に存在するBMAAは、シアノバクテリアによって窒素ストレス下の複雑な反応の結果として産生されたものであります。BMAAの作用機序は興奮毒性である可能性が高く、グルタミン酸のアゴニストとしてAMPA受容体やNMDA受容体を活性化し、10 μMという比較的低い濃度でも細胞損傷を引き起こすのです。その後の無制御なCa2+の流入によって、筋萎縮性側索硬化症/パーキンソン-認知症複合疾患の病理が引き起こされる。MK801などのNMDAアンタゴニストがBMAAの作用を遮断するので、BMAAが興奮毒であるのです。BMAAは、L-セリンに代わってヒトのタンパク質に誤って取り込まれることも示されている。BMAAの毒性に関する研究のかなりの部分は齧歯類に対して行われたものであるが、2016年にapoE4(APOE-ε4)アレル(これはヒトではアルツハイマー病の危険因子である)をホモ接合型で持つ、セントクリストファー島のベルベットモンキーChlorocebus sabaeusに対して行われた研究では、BMAAを経口投与されたサルは、アミロイドβプラークや神経原線維変化(英語版)の蓄積など、アルツハイマー病に特徴的な病理組織学的特徴がみられた。apoE4(APOE-ε4)アレルはヒトではアルツハイマー病の危険因子であることはよく知られています。APOE(アポイー)遺伝子とアルツハイマー型認知症群の関係について説明しましょう。アルツハイマー型認知症(アルツハイマー病)は、アミロイドベータペブチドという老廃物が脳に蓄積し、 神経細胞に障害を与えることが原因で発症するとされているのですが、アミロイドベータペブチドの蓄積や凝集に関わる物質のひとつが、アポリポタンパク質Eです。それを司るAPOE(アポイー)遺伝子には、主にε(イプシロン)2、ε3、ε4の3種類あり、 2つ一組で遺伝子型を構成しています。ε4の有無とアルツハイマー病発症との関係を調べると、ε4を全く持たない遺伝子型に対して、 ε4を1つないし2つ持っている遺伝子型のアルツハイマ一病発症リスクは、約3倍~12倍高くなると言われています。
より低用量のBMAA(β-メチルアミノ-L-アラニンの略)が投与された試験では、こうした病理学的特徴が相関的に減少することが明らかにされた。この研究では、環境毒であるBMAAは遺伝子と環境の相互作用の結果として神経変性疾患を引き起こすことが示された]。死去したALS/PDCの患者の脳組織ではBMAAが検出されるが、ヒトの神経変性疾患であるALS/PDCとBMAAを結びつける決定的証拠はまだありません。にはさらなる知見が必要である。PDCとはなんでしょうか?紀伊半島南部の牟婁(むろ)地方の和歌山県人とグアム島のチャモロ人は、筋萎縮性側索硬化症 (ALS) の世界的な多発地域として知られている。これらの地域には、パーキンソニズムと認知症を主症状とする特異な神経変性疾患であるパーキンソン認知症複合 (parkinsonism-dementia complex、PDC) が多発している。ALSとPDCは、密接な関連があり、同一疾患の異なる表現型と考えられ、両者はまとめて牟婁病(むろ病) (ALS/PDC) と呼称される。
筋萎縮性側索硬化症(Amyotrophic Lateral Sclerosis, ALS)は、運動に関係する神経がダメージを受けて、脳から筋肉へのシグナルが伝わらなくなる病気であります。手足のほか、呼吸に用いられるのど・舌など、全身の随意筋である骨格の筋肉がやせてだんだん弱くなって委縮していく進行性の神経難病です。日本における患者数は約10,000人で、最も発症しやすい年齢は60〜70代。発症からの余命はだいたい2〜5年だが、なかには十数年にわたってゆっくりと進行する場合もあり、個人差がある。さらに、高齢化が進む社会では増加の傾向にあるという。
筋萎縮性側索硬化症(Amyotrophic Lateral Sclerosis,略して ALS)の臨床的な観点から易しく標準医療的で一般向きの常識的な説明を一応しながら批判も加えた説明をしましょう。
1. 筋萎縮性側索硬化症とは、手足・のど・舌の筋肉や呼吸をするのに必要な筋肉がだんだんやせて衰えて力がなくなっていく病気です。しかし、筋肉そのものの病気ではなく、筋肉を動かし、かつ運動をつかさどる上位ニューロンである中枢の一次運動ニューロンが主に障害をうけます。脊髄から下の下位末梢ニューロンの障害は少ないのです。その結果、脳から「手足を動かせ」という命令が伝わらなくなることにより、力が弱くなり、筋肉がやせていきます。その一方で、体の感覚、視力や聴力の感覚機能、自律神経が大きく支配する内臓機能などはすべて保たれることが普通です。それは一般体性感覚神経や視力や聴力の特殊感覚神経や神経の中で最も多い自律神経にはherpesが感染していないからです。上位運動ニューロンである中枢の運動ニューロンだけにherpesが感染しているだけであるからです。
2. この病気の患者さんはどのくらいいるのですか
1年間で新たにこの病気にかかる人は人口10万人当たり平均2.2人です。全国では、令和2年度の特定医療費(指定難病)医療受給者証所持者数によると10,514人がこの病気にかかっており、徐々に増えています。資本主義が高度になればなるほどストレスが多くなりherpesが増えてしまうからです。
3. この病気はどのような人に多いのですか
性別では男性が女性に比べて1.3~1.5倍であり、男性にやや多く認めます。ストレスの多い金を稼げる仕事についている人は男性のほうが女性よりも多いからです。この病気は中年以降いずれの年齢の人でもかかることがありますが、最もかかりやすい年齢は60~70代です。定年になると年金だけで食えますからストレスが減り免疫があがり始めると増やしたherpesとの戦いが始まるからです。まれにストレスが極めて強すぎるともっと若い世代での発症もあります。
4. この病気の原因はわかっているのですか?わかっています。herpesが原因です。
原因はherpesが大脳の運動をつかさどる上位ニューロンである中枢の一次運動ニューロンのみならず大脳の運動野に細胞に感染したからです。神経の老化との関連や興奮性アミノ酸の代謝異常、酸化ストレス、タンパク質の分解障害、あるいはミトコンドリアの機能異常といったさまざまな学説がありますがすべて間違っています。遺伝性と言われる 家族性 ALSでは30を超える原因遺伝子の変異が見つかっていますがこれが家族性ALSの原因ではありません。
5. この病気は遺伝するのですか?遺伝子しません。
スーパーオキシド・ジスムターゼ(SOD1)の遺伝子に原因が見つかりますと言われています。家族性ALS患者にCu,Zn-スーパーオキシドジスムターゼ (SOD1) というタンパク質をコードする遺伝子の異常が見つかり、以来、SOD1の変異とALSとの関連性が指摘されていますが間違いです。SOD1は1分子当たり1個のCuと1個のZnを含む2量体タンパク質で、生体内では癌の原因となるスーパーオキシドを除去することにより、活性酸素毒性から生体を防御する役割を担っています。この様に極めて大切なスーパーオキシド・ジスムターゼ(SOD1)の遺伝子を変異させたのもherpesなのです。この様にあらゆる遺伝子を自由自在に遊びのつもりで変異させるのはherpesの特技なのです。しかし癌が生ずるのは癌原遺伝子とがん抑制遺伝子の二つだけが変異するときにのみ癌が起こるのです。60億対の塩基が少々変異して二万三千個の遺伝子の塩基の並びが変異したからと言って癌遺伝子とは全くかかわりがないので癌にはならないのです。同じように変異SOD1遺伝子がALSを引き起こす詳細なメカニズムは未だ不明なのは当然のことなのです。ALSの原因はherpesが大脳の運動をつかさどる上位ニューロンである大脳の運動野の細胞に感染してミクログリアが炎症を起こしその細胞が変性壊死して脱落してしまい運動の命令が出せなくなったためです。因みにスーパーオキシド・ジスムターゼ(SOD1)は1分子当たり1個のCuと1個のZnを含む2量体タンパク質です。 生体内ではスーパーオキシドを除去することにより、活性酸素毒性から生体を防御する極めて重要な役割を担っています。
6. この病気ではどのような症状がおきますか
骨格筋を動かす随意運動が出来なくなるので手指の使いにくさや肘から先の筋肉がやせ、力が弱くなることで始まります。話しにくい、食べ物がのみ込みにくいという症状や、足の筋肉がやせて力が弱くなる症状で始まることもあります。通常左右いずれかから症状が出現しますが、両側の肩周りの筋肉がやせ、力が入らない症状から始まることもあります。どこから症状が始まった場合でも、やがては呼吸の筋肉を含めて全身の筋肉がやせて力がはいらなくなり、身体を動かすことが難しくなります。のどの筋肉に力が入らなくなると発音しにくくなり(構音障害)、水や食べ物の飲み込みも難しくなる 嚥下障害 が起こります。また、唾液(よだれ)や痰(たん)が増えることがあります。呼吸筋が弱まると日常の動作でも息切れをおぼえ、呼吸も十分にできなくなります。一方、進行しても通常は運動神経とはかかわりがない特殊感覚神経の視力や聴力、体の感覚などは問題なく、目やまぶたを動かす筋肉や主に自律神経に支配されている排尿・排便に必要な筋肉の症状は発症早期には出にくいのです。herpesが記憶のかなめである海馬体に感染していない時には物忘れは目立ちませんが、言語(ことば)や行動の症状を中心とした認知症状がみられる場合があります。
7. この病気にはどのような治療法がありますか?原因は大脳の運動野に感染したヘルペスですから抗ヘルペス剤を大量に投与し同時に大脳のherpesが次の細胞に感染しないように大量の漢方生薬を服用すれば確実に進行が止まり症状も必ず良くなっていきます。
現在の間違った医療の治療を見てみましょう。
①ALSの進行を遅らせる作用のある飲み薬にはリルゾール、あるいは点滴注射薬のエダラボンが使われています。リルゾールは 筋萎縮性側索硬化症(ALS)の神経細胞を保護して、病状の進行を遅らせるようですが原因であるヘルペスから守ることはできませんし進行を遅らせる作用が本当にあるかどうかもわかりません。アッハッハ!!!エダラボンは脳保護剤であり、急性の脳虚血発作や脳梗塞後の血流再開時に発生する活性酸素であるラジカルを捕えて脳神経を保護する働きを持つだけですのでALSの病気とまるでかかわりがありません。抗酸化剤であり強力なラジカル捕捉剤で商品名ラジカットで有名です。言うまでもなく特効薬ではありません。ALSの特効薬抗ヘルペス剤のアシクロビルと漢方煎じ薬です。
②呼吸困難に対しては、鼻マスクによる非侵襲的な呼吸の補助であるNIVを用います。NIVは英語でnoninvasive ventilationの略で非侵襲的換気療法と訳します。苦痛を伴う気管内チューブを使用しない安全な換気を助けてくれます。しかも気管内挿管を行わないため、喉を傷つける機械換気による潜在的な合併症を避けることができます。現代の医学は治せない医者だけが稼げる医学なのでALSは進行していくので最後は一般的には気管切開が必要な時期になると定期的に痰(たん)の吸引が必要になってしまうのです。
③呑み込みにくさ、つまり飲食物を嚥下できなくなると腹の皮膚から胃に管を通す胃ろうや、鼻から食道を経て胃に管をいれて流動食を補給したり、点滴による栄養補給などの方法がありますが抗ヘルペス剤のできる限り早い投与によりALSは進行していくことは避けられるのです。しかし患者さんの心のストレスがある限りは免疫が落ちていくのでherpesが増えていくのです。ALSをはじめとするあらゆる難病の原因はherpesですからherpesを自分の心のストレスでいかに増やさないようにするのがあらゆる難病を治す一番重要なポイントとなります。herpesは自分の免疫では絶対に殺しきることはできないので、自分の免疫でできることはALSを進行させないようにherpesを増やさないことしかできないのです。しかし最悪の事態であるALS になって1年ほどの速い経過で呼吸不全となって死ぬことは避けられるのです。
8. この病気はどういう経過をたどるのですか
この病気は現在の医学では常に進行性で、一度この病気にかかりますと症状が軽くなるということはありませんが私の医療は原因治療ですからherpesが増えないように抗ヘルペス剤を服用しかつ免疫を抑えないようにするしかありません。しかも脳神経細胞は一度死んでしまうと再生が極めて困難です。しかし例外が一つだけあります。脳の記憶を司る海馬の歯状回の顆粒細胞にherpesが感染してアルツハイマーを起こすのですが海馬の歯状回の顆粒細胞には幹細胞があるのでたとえherpesのために顆粒細胞が変性壊死を起こしても新たに記憶を回復させる顆粒細胞が生まれるのでアルツハイマーの治療で抗ヘルペス剤を飲めば確実によくなるのです。
一方ALSになると体のどの部分の筋肉から始まってもやがては全身の筋肉が侵され、最後は呼吸の筋肉(呼吸筋)も働かなくなって大多数の方は自力で呼吸をすることが困難となります。人工呼吸器を使わない場合、病気になってから死亡までの期間はおおよそ2~5年です。なかには人工呼吸器を使わずにゆっくり10数年にわたって進行する経過をたどる例もある一方、1年ほどの速い経過で呼吸不全となる例もあります。とくに高齢での発症、話しにくい・のみ込みにくい症状や呼吸の筋肉からの発症、そして早い時期に体重が大きく減ったり首の筋力が弱ったりする患者さんでは、進行が速いことがわかっています。このように、ALSは発症のしかたや経過には大きな個人差があります。
9. 今後の治療法の開発に必要なこと
2022年1月現在でALS患者さんの登録症例は2094名となり、2000名を超えました。ALSを解明するためにさまざまな臨床情報と遺伝子を併せた大規模な調査研究を行われていますがすべて無駄なじかんとおかねを捨てているだけです。生命誕生以来、あらゆる病気の原因は人体に感染するウイルス、細菌などの生きた増殖する病原体だけですがherpesウイルスだけはワクチンが作られないので最後まで残る病原体はherpesだけとなったのですがこの最後に残ったherpesがなんと癌の原因であったのです。癌についてはここを読んでください。にもかかわらず世界中の医薬業界は一言もherpesについては絶対に口にしないのです。何故ならば医薬業界自身がherpesを増やして癌を作っているからです。哀しですね。ただ残念なことには無責任な金儲けのための科学技術の発展により化学物質が増えすぎてアレルギーが多くなったのですがアレルギーは免疫寛容で治せます。それ以上に地球の空気と水が汚れ過ぎて気温も上がり過ぎて人類が地球上に住めなくなる日が近づいています。人間よりも金が大事な世界は滅びて当然ですね。残念ですね。
筋萎縮性側索硬化症(ALS)の食事・栄養については何を食べても構わないのは言うまでもないことです。何故ならばALSの原因は食事に100%関りのないherpesウイルスだからです。
最後に何故herpesがめったに感染することのない大脳の運動野にどのルートを通じてどのようにして感染したかの考察を説明しましょう。ALSが発生し始める年齢に関わらず常に長期にわたって極度に強いストレスをかけながら貪欲に快楽を求めすぎて頑張って大脳にさらにストレスをかけ続けている間に免疫が低下させ続けた人は何らかのルートを通じてherpesを大量に増やし大脳の運動野の細胞し感染したヘルペスをミクログリアやマクロファージが攻撃します。炎症を起こして運動神経細胞の壊死脱落が起こり運動を命令する機能が無くなりALSが生じるのです。
問題はこのherpesはどのように大脳の運動野の細胞に感染したのかという極めて難解な謎です。
一番可能性が高いのは運動と快楽を司る大脳基底核の黒質とから大脳皮質の運動野とは大脳基底核の黒質とが深く連携しています。黒質は快楽をもたらすドパミンを人体の細胞の中で一番多く産生している細胞です。運動は快楽をもたらすので運動と快楽を同時にもたらしてくれる仕事を仲介することが大脳基底核の役割なのです。この機能を果たすためには大脳皮質のヘルプが必要なので「大脳皮質 − 大脳基底核ループ」の運動ループを作って大脳皮質の運動野の細胞との連絡が必須なのです。
それでは大脳基底核の黒質緻密部にどのようにヘルペスが感染したかも説明する必要があります。黒質は脳幹中脳被蓋腹側部の核で,大脳脚の背側に接して存在する黒くみえる部分で.快楽を生み出すドーパミンと,神経の興奮を抑制するGABAが多く存在する.忘れないうちに書き加えますが快楽を生み出すドパミンが運動に関わるようになったのか知りたいでしょう。それは不随運動であろうが随意運動であろうが運動が思うように巧みにできることは最高の快楽の一つであることはすべての人が認めざるを得ないでしょう。生きる喜びの源泉は「動ける」「運動できる」ことであり動きのない人生は死んでいるのと変わりはありません。だからこそ「大脳皮質 − 大脳基底核ループ」の運動ループを作って精緻で複雑で巧みな運動が出来るようにドパミンと言う快楽の報酬をたっぷり感じさせるためにまさに大脳皮質の運動野に至るまでの経路を運動をさせることによって快楽を高めて自由自在に動かすエンジンのスウィッチのオンオフを100%支配しているのは正に脳幹中脳被蓋腹側部にある黒質の神経核なのです。
この黒質にherpesが感染してヘルペス性脳幹脳炎のみならずあらゆる脳の病気の原因となっているヘルペスがどのようにして末梢の神経や末梢の組織や末梢の血管や生命神経と言われる末梢にある自律神経節から大脳の運動野だけに感染していくかを説明する必要があります。これからの説明はすべての他の脳の神経変性疾患のみならず他の脳疾患も病名は異なっても根本原因はherpesが脳に感染したために起こったわけですから末梢神経に感染したherpesがどの経路を通じて脳への感染していく経路は同じなのですからすでに書いた論文である「癲癇」「パーキンソン病」「統合失調症」「アルツハイマー認知症」「ギランバレー症候群」「多発性硬化症」も読んでいただければより深く理解できます。
脳に感染したヘルペスはいかなる脳の部位に感染したヘルペスは最終的には脳神経細胞変性疾患を起こしてしまいます。黒質に感染したヘルペスが脳の様々な部位に感染するのは大脳基底核からのサーキットになっている神経回路(神経ループ)ですから下図に四つの神経回路(神経ループ)である①運動回路(運動ループ)②眼球運動回路(運動ループ)③前頭前野回路(前頭前野ループ)④辺縁回路(辺縁ループ)を示します。
herpesが一番感染したがるのは神経核であり、とりわけとメラニン色素細胞の多い黒質の神経核です。大脳基底核の中心的な役割を果たすのは下図の運動ループの入力の開始点である黒質の緻密部です。この黒質の緻密部に異常があれば運動ループの機能は異常を起こすことになるのです。この黒質の緻密部に異常を起こしたがるのは黒質の緻密部に一番感染したがるのは正にherpesなのです。
この中脳の黒質に感染したヘルペスは黒質から出ていく神経線維はドパミン作動性投射神経であり灰色の矢印で示されているように線条体にドパミン作動性投射神経線維を通じてherpesをまず神経核である線条体に感染させます。線条体の神経核に潜伏感染している間に免役が落ちると増殖して隣の神経核である淡蒼球外節に感染します。同じように矢印に沿って視床下核、淡蒼球内節、視床、大脳皮質と次々と大脳基底核の神経核に感染するのです。青チルトドパミン作動性神経線維に乗って大脳基底核にある神経核に長い時間をかけて徐々に感染していくのです。脳にherpesが感染してする一大ルートであるのは黒質の緻密部に感染した下の図の黒質の緻密部は
ここで大脳基底核のすべてについて復習しましょう。
大脳基底核の四つの神経回路(神経ループ図)
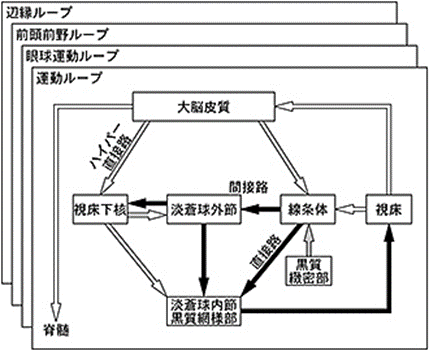
大脳基底核は、ハイパー直接路・直接路・間接路より成り立っている。グルタミン酸作動性の興奮性投射を白い矢印、GABA作動性の抑制性投射を黒い矢印、ドパミン作動性投射を灰色の矢印で示す。上図には運動ループ高しか詳しく書かれていませんが後ろの隠れている残りの三つの眼球運動ループと前頭前野ループと辺縁ループについてはどこを探しても運動ループで図示されている図はありませんでした。つまり大脳基底核を中心としたループ理論はまだ誰も解明できないほど脳は錯綜した込み入った生命を操っているからなのでしょう。大脳基底核は筋肉の随意運動を開始し、その動きを滑らかにし、不随意運動を抑え、姿勢の変化を調整する神経細胞の集まりであります。因みに上の図の視床は筋肉の動きに関する情報を大脳皮質との間でやりとりしています。
大脳基底核疾患では身体症状の疾患による運動機能の障害が強調されますが、このような運動ループの機能障害から生ずる変化はヘルぺスが原因となる運動ループ以外の他ループにも起こっており、眼球運動ループが支配する眼球運動、前頭前野ループが支配する大脳の高次機能、辺縁ループが支配する情動なども障害されて様々な脳疾患が生じているのですがまだ誰も完全には解明していないのです。
現代に残された病気の最後の原因はherpes以外にほかにないので、例えば必ず最後には死んでいく病気は癌ですが癌は遺伝子が癌化するのもherpesが200種類の組織のすべての細胞に感染して核の遺伝子に侵入して遺伝子を突然変異させ癌を起こすのもherpesだからなのです。ロイアル・レイモンド・ライフ博士が証明した癌は癌ウイルスによっておこり極めて簡単で安くしかも痛みがない「光療法で癌ウイルスを殺せば癌は治せる」という癌ウイルスは100%herpesウイルスなのです。ロイアル・レイモンド・ライフ博士についてはここを読んでください。
ヘルペス性脳幹脳炎は脳幹に中脳被蓋には滑車神経や動眼神経の起始核があり、不随意運動に関係する赤核(せきかく)、意識の機序(メカニズム)に関係する網様体、また、脊髄から大脳半球に上行する神経路などがある。中脳被蓋と狭義の大脳脚との境の部分には、不随意運動に関係する黒質(こくしつ)がある。黒質の傷害はパーキンソン症候群に関係があります。パーキンソン病と黒質の関係についてはドパミンは脳内の大脳基底核の中脳被蓋にある黒質で作られますが、パーキンソン病ではヘルペス感染症とヘルペスの増殖のために黒質神経細胞が利用されつくされ細胞の蛋白が変性して細胞が崩壊して脱落してしまうので黒質神経細胞も減ってしまい役に立たなくなった蛋白質が蓄積した屑がレビー小体であります。その結果、作られるドパミンが減少するのであってレビー正体が原因でパーキンソン病が起こるのではないのです。 ドパミンが減ると、上の図で示したように「大脳基底核―大脳皮質の運動ループ」の神経回路の神経伝達に障害が生じ、運動の調節がうまくできなくなります。 その結果、手足が動きにくくなったり、震えたりする症状が出現します。パーキンソン病にかかると、大脳の下にある中脳の黒質ドパミン神経細胞が徐々に減少します。ドパミン神経細胞の中にherpesが感染増殖して黒質の蛋白が変性して黒質細胞が崩壊した後のガラクタがαシヌクレインというタンパク質の凝集し固まったものがレビー小体です。レビー小体が脳の機能の低下の原因ではなくherpesが原因なのです。それはアルツハイマー認知症はアミロイドβが原因ではなくherpesが海馬体の歯状核に感染したために海馬体の機能が障害されたために記憶ができにくくなったのです。
ドパミン神経細胞が減ると、動作がゆっくりになり、筋肉の緊張が高くなったり(筋強剛)、手足のふるえ(振戦)が出たりします。黒質のドパミン神経細胞以外にも青斑核のノルアドレナリン神経細胞、縫線核のセロトニン神経細胞、マイネルト基底核のコリン作動性神経なども変性するため、運動症状のみならず多彩な非運動症状が高頻度に合併する全身疾患です。マイネルト基底核(Nucleus basalis of Meynert略してNBMと省略)は、大脳新皮質へ広く投射する前脳基底部無名質にあるニューロン群である。 アセチルコリンとその合成酵素であるコリンアセチルトランスフェラーゼを多く含んでいる。 無名質の中にマイネルト基底核が存在する.
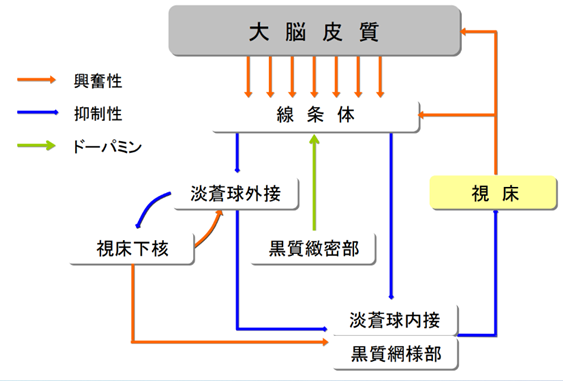
正常な大脳基底核の機能について復習しておきましょう。黒質緻密部にherpesが感染していない時には下の図で赤矢印の興奮性は矢印に向かう神経の刺激を受け取った矢印の先端にある神経を興奮させ、青矢印の抑制性は矢印に向かう神経の作用の刺激は抑制させ、黒質緻密部からの緑矢印はドパミンを最初に線条体に送ります。ところが黒質緻密部にヘルペスが感染してドパミンが産生できなくなり始めると徐々に更に大脳基底核の異常による病気がどのようにして何故起こるのかをすべて解明してあげましょう。すべての大脳基底核の専門家の研究者や学者は直接路と間接路のバランスが崩れることが大脳基底核の異常による病気の原因とかほざいていますが実は黒質緻密部にヘルペスが感染したためなのに一切herpesに触れずに展開される理論はすべて誤りです。論理が合わない間違いだらけの理論を開陳するだけで事足れりの説明をするだけで満足していますが誤りであることも証明しましょう。
「大脳皮質と大脳基底核から成り立っている運動ループ」の簡略図
大脳基底核は大脳皮質下に位置する神経細胞体の集まりである神経核群でありその構成神経核は下図に示しているように① 線条体(被殼、尾状核)② 淡蒼球(外接、内接)③ 視床下核④ 黒質(緻密部、網様体)の四つから成り立っています。
大脳基底核の 入力は大脳皮質のあらゆる領野と視床から線条体に入ります。
大脳基底核の出力は淡蒼球内接・黒質網様体と視床から出ます。
中継路には直接路と間接路の二つがあり① 直接路は線条体→淡蒼球内接・黒質網様体の中継路であり② 間接路は線条体→淡蒼球外接・視床下核→淡蒼球内接・黒質網様体の中継路であります。
「大脳基底核―大脳皮質の運動ループ」を構成する大脳の構成成分は大脳基底核の四つの神経核である①線条体②淡蒼球外接・淡蒼球内接③視床下核④黒質網様部・黒質緻密部に加えて⑤大脳皮質⑥視床の六つから成り立っています。
「大脳皮質と大脳基底核から成り立っている運動ループ」の簡略図
大脳基底核の役割は
① 随意運動の制御系で主に時系列情報の処理を担う
② 報酬予測系で報酬に動機づけられた学習に関わるので運動をやれば快楽を得られる運動ですから黒質緻密部神経がドパミンを産生して初めて作動が可能になるのです。ところがこの黒質緻密部神経にherpesが感染してしまうと最後は上の図で示すような大脳基底核の作用が破壊されてしまうのが運動不全 (hypokinetic disorder)である 運動をしにくくなる パーキンソン病などの症状や多動障害 (hyperkinetic disorder)である 不随意運動が現れたり ハンチントン病などの病気起こってしまうのです。
大脳基底核の入力は大脳皮質のあらゆる領野と視床から線条体に入る
大脳基底核の出力は淡蒼球内接・黒質網様体と視床から出る
中継路には直接路と間接路の二つがあり① 直接路は線条体→淡蒼球内接・黒質網様体の中継路であり② 間接路は線条体→淡蒼球外接・視床下核→淡蒼球内接・黒質網様体の中継路であります。
「大脳基底核―大脳皮質の運動ループ」を構成する大脳の構成成分は大脳基底核の四つの神経核である①線条体②淡蒼球外接・淡蒼球内接③視床下核④黒質網様部・黒質緻密部に加えて⑤大脳皮質⑥視床の六つから成り立っています。
「大脳皮質と大脳基底核から成り立っている運動ループ」の詳細図
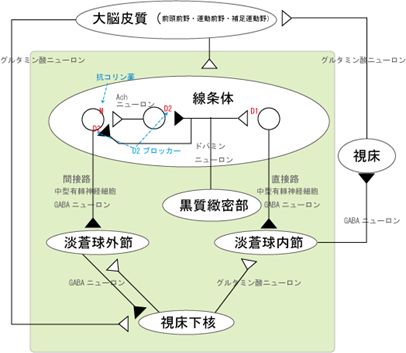
上図の運動ループの詳細図はもう一つ上の図の運動ループの簡略図よりは複雑なので説明しましょう。
大脳皮質の運動を支配する領野には前頭前野、運動前野、補足運動野の三つがあります。
上図で白い三角形は興奮性の作用で黒い三角形は黒い三角形は抑制性の作用です。
脳幹の中脳にある腹側被蓋野の黒質緻密部の興奮性ドパミンニューロンから大脳皮質と大脳基底核の運動ループが開始されます。黒質緻密部から投射される線条体には三つに白い丸がありますが神経核が三つありその丸(神経核)のすぐ近くには赤色でD1、D2印が書かれていますがそれぞれ三つの神経核が持っているドパミン1と言われるレセプターであり、又ドパミン2のレセプターの略字です。ドパミンのレセプターには興奮性と抑制性の二種類があります。赤色のD1は興奮性のレセプターであり赤色のD2は抑制性のレセプターであります。つまり線条体には三つに白い丸で描かれた神経核がありその役割がそれぞれ異なり興奮したり抑制されたりしているのですが、線条体から淡蒼球外節と淡蒼球内節へ出ていく神経線維は二つとも抑制性のGABAニューロンです。つまり大脳基底核の入力は黒質緻密部から興奮性のドパミンニューロン線条体に運動ループを活動し始めろと命令するのですがしかも線条体から出るときは抑制性のGABAニューロンが出ていく意味が理解できますか?それは運動ループは興奮と抑制によって絶妙にコントロールされていることがわかります。しかも淡蒼球外節は次の神経核である視床下部に対しては抑制性のGABAニューロンを出しながら一方では視床下部には大脳皮質からは興奮性のグルタミン酸ニューロンが支配するという見かけは矛盾に満ちたシステムです。さらにこの「大脳皮質と大脳基底核から成り立っている運動ループ」のシステムが理解困難なの淡蒼球内節から視床に出ていくニューロンは抑制性のGABAニューロンであり、さらに視床からすべての運動の最終決定を行う大脳皮質に行くニューロンは興奮性のグルタミン酸ニューロンですから何が何だかさっぱり理解できないシステムなのです。それほど巧緻で微妙でかつ複雑な人間の運動を支配していることは分かりますが現在のところこの矛盾を完全にした学者は誰もいません。「運動ループ小野大脳基底核の難解な働きが正常であるので人間は毎日完璧な動き・運動をやれるので思い道理に体を動かせるのです。だからこそ「大脳基底核―大脳皮質の運動ループ」の中心を担う神経核である黒質緻密部にherpesが感染して快楽と運動をセットで支配しているドパミンが作れなくなると治らないと言われる運動障害が出現してしまうのです。中継路には直接路と間接路の二つがあるのですが、その二つの中継路の経路の開始点となるのです。
大脳基底核内のルートは複雑なので直接路と間接路に分けています。直接路は黒質緻密部から線条体→淡蒼球内接・(黒質網様体)へ繋がる中継路であり最後に大脳基底核を出て、視床から大脳皮質にいきループは完結します。間接路は黒質緻密部から出て線条体→淡蒼球外接・視床下核→淡蒼球内接・(黒質網様体)へとつながり最後に大脳基底核を出て、視床から大脳皮質にいきループは完結します。残念ながらそれぞれの神経核で旦那仕事がされているかについては一切不明です。言うまでもなく視床や大脳皮質でどのような判断がされているかも不明です。
遅ればせながら、付け加えますと大脳基底核(尾状核,被殻,淡蒼球,視床下核,および黒質)は錐体外路系を形成します。これらは前脳の深部および中脳吻側に位置する。大脳基底核の最後の神経核である淡蒼球内接(内節)から大脳基底核外の視床を経て大脳皮質へと出力を向けるのは上の基底核(大脳基底核)の図を見てください。筋萎縮性側索硬化症(ALS)は錐体路の脳疾患ですから大脳基底核疾患とは全く関係ないのです。
大脳基底核の異常によって引き起こされる病気の根本原因は黒質緻密部に感染したherpesであることを理解されたはずですから大脳基底核の病気のすべてを下に羅列しましょう。その前にどんな症状がどのようにして起こるかを簡単に説明しましょう。やはり「運動ループ(経路)」の障害ですから運動機能障害の症状が出ます。
因みに随意運動には,皮質脊髄路(錐体路),基底核(錐体外路),および小脳(協調運動の中核)の複雑な相互作用が必要であり,それにより円滑かつ無関係な筋収縮のない,意図された運動を確実に行うことが可能となるのです。
錐体路(pyramidal system)は延髄の錐体を経て,大脳皮質と下位の運動中枢である脳幹および脊髄とを結ぶ神経経路です。錐体路は、大脳皮質から発生し、運動線維を脊髄と脳幹に運ぶ経路です。 体や顔の筋肉を随意的に制御する役割を担っています。 運動野(大脳皮質にある随意運動の引き金となる信号が発生する領域)から伸びている運動機能に主に関わる下行性白質路で、前角で脊髄の運動神経とシナプスを形成します。
錐体路症状は例えば、脳卒中などで体が麻痺して自分の意思通りに動かないのは、錐体路が障害されている状態です。
錐体外路(extrapyramidal system)とは、錐体路以外の運動指令を行うための経路を総称したものである。 錐体外路中枢(大脳皮質)や、大脳基底核、視床腹部、脳幹などと微調整しながら姿勢や運動に対する指令を骨格筋へ伝える。 筋緊張や筋群の協調運動を、反射的、不随意的に行う。
錐体外路症状とは、錐体外路の障害により出現する症状である。広義には錐体外路は、錐体路以外のすべての中枢神経系の経路を指すが、錐体外路症状という場合には、大脳基底核を中心とする大脳皮質との神経回路(大脳皮質―大脳基底核ループ)のことを錐体外路と言います。
錐体外路は姿勢を維持するための筋肉の緊張や平衡感覚など、体が反射的に行う運動の情報を伝えます。つまり、錐体外路症状とは、大脳皮質―大脳基底核ループの障害に由来する症状です。錐体外路症状を呈する代表的疾患は、パーキンソン病です。ALSは錐体外路や錐体外路症状とは全く関係ありません。
運動障害疾患の原因となる大部分の神経病変は錐体外路系に生じるため,ときに運動異常症は錐体外路疾患と呼ばれる。つまり錐体外路疾患とは大脳基底核疾患であるので錐体外路疾患の原因も大脳基底核疾患も原因はherpesが黒質緻密部に感染したからです。
大脳基底核疾患は機能が障害されるタイプによってまず二種類に分けられます。一つは運動をしにくくなる運動不全 (hypokinetic disorder)でその代表がパーキンソン病です。二つ目は大脳基底核は不随意運動を統括する錐体外路ですからその機能不全になると多動障害 (hyperkinetic disorder)が現れるので子供に最近非常に多くなってきたAD・HD(注意欠如・多動性疾患)は大脳基底核の黒質緻密部にherpesが感染したからです。実はAD・HDも黒質緻密部にherpesが感染したためなのです。何故AD・HDが子供たちに増えているのでしょうか?子供たちも一見豊かになって幸せそうに見えてもストレスが多くなり免疫が落ちたためにherpesが脳に増えたためです。物質的な豊かさは決して心を満足させていないからです。哀しいですね。敢えて言うとハンチントン病なども多動疾患なのです。ハンチントン病は舞踏病とも言われます。
錐体外路症状とは、錐体外路の障害により出現する症状である。広義には錐体外路は、錐体路以外のすべての中枢神経系の経路を指すが、錐体外路症状という場合には、大脳基底核を中心とする大脳皮質との神経回路(大脳皮質―大脳基底核ループ)のことを錐体外路と考えてよい。つまり、錐体外路症状とは、大脳皮質―大脳基底核ループの障害に由来する症状である。錐体外路症状を呈する代表的疾患は、パーキンソン病である。
大脳基底核疾患の病態
大脳基底核疾患は、運動の多寡によって、パーキンソン病(Parkinson’s disease)のように無動・寡動を来す運動減少症(hypokinetic disorder)と、ヘミバリスム(hemiballism)、ハンチントン病(Huntington’s disease)、ジストニア(ジストニー、dystonia)などのように不随意運動を伴う運動過多症(hyperkinetic disorder)とに大別される。
すべての大脳基底核の専門家の研究者や学者は直接路と間接路のバランスが崩れることが大脳基底核の異常による病気の原因であると惚けていますが黒質緻密部にヘルペスが感染したためなのに一切herpesに触れずに展開される理論はすべて誤りです。この世に残っている癌や自己免疫疾患を含めて難病のすべてはherpesなのです。癌はherpes感染症だからがんの転移はherpesの感染拡大に過ぎないのです。あらゆる細胞に感染したヘルペスが細胞の遺伝子を癌遺伝子にさせただけなのです。herpesが実は癌ウイルスであるについてはここを読んでください。
ヘルペス脳炎の感染経路は?
Herpesウイルスが中枢神経系に移行する経路は、上気道感染から嗅神経を介してのルート、血行性ルート、感染した神経節からのルートの3通りがあります。 新生児の場 合は全脳炎のパターンをとることが多いが、年長児、成人においては、上記のルートを介して好発部位である大脳辺縁系や黒質支配する大脳基底核の神経節に感染してさらに大脳皮質にも感染していくのです。
herpesウイルスや他のウイルスはどこから脳に入るのか?
herpesウイルスが脳に入るには、いくつかのルートが知られています。その中で最も多いのは血液を通じて入るルートです。消化管や気道などを侵入門戸として、あるいは蚊など節足動物に媒介されて体内に入ったウイルスは、多くの場合血液中に入り込んで体内を循環し(この状態をウイルス血症 viremia と言います)、その過程で脳にも侵入して行きます。その他のルートとして、末梢神経線維を伝わって侵入するルート(狂犬病などがこの経路を取ります)や、鼻の粘膜から嗅神経を経て脳に入るルートがあります。エイズウイルスの場合は少し特殊で、ウイルスが白血球の一種である単球の中に入り込み、それによって様々な免疫学的な監視の目を巧妙にすり抜けながら、脳の中に運ばれていきます。
一般に病原微生物がヒトの体内に入ると、「免疫反応」が働いて、それを体外に排除したり殺そうとしたりします。この免疫反応を含む病原微生物に対する生体の一連の反応過程を「炎症」と呼んでいますが、その微生物がウイルスであり、炎症反応が脳を主な舞台として起こった場合、それを「ウイルス脳炎」と呼びます。herpesウイルスが細胞に寄生あるいは感染する場合、細胞の種類をあまり選り好みせず、種々の細胞に無差別的に感染したり、中には神経細胞やグリア細胞など、脳内の細胞に感染するherpesウイルスもあります。
ALS〈筋委縮性側索硬化症〉」もパーキンソン病の違い?ALS〈筋委縮性側索硬化症〉」もパーキンソン病も体が動かなくなる神経の進行性疾患ですが、同じ病気ではありません。 ALSは筋肉を動かす運動神経の病気であり力が入らなくなっていきます、パーキンソン病は体の動きを滑らかになるよう調節する神経の病気であり、手足が震え体が硬くなっていきます
ALSと筋ジストロフィーの違いは何ですか?
ALSは筋肉自体に原因があるのではなく、筋肉に指令を出す運動神経に原因があるとされています。 一方で筋ジストロフィーは、筋肉の細胞自体の変異によって筋力の低下が起こるという違いがあり、2つの病気は区別されています。
神経免疫疾患 (多発性硬化症・慢性炎症性脱髄性多発神経根炎(CIDP)・重症筋無力症など)とは何でしょうか?免疫とは、本来、細菌などの外敵から身を守るための機能ですが、それが自分に向けられた状態を自己免疫疾患と総称します。神経内科領域においても多発性硬化症、慢性炎症性脱髄性多発根神経炎、重症筋無力症などがその範疇に入ります。
多発性硬化症は中枢神経線維を覆う髄鞘が壊される病気です。症状は、障害される部位により視力障害から運動麻痺、感覚障害、排尿障害などさまざまです。治療は、急性期にはステロイドの治療(点滴→内服)、慢性期にはリハビリテーションや対症療法、再発予防にはインターフェロンβを行います。多くは再発・寛解を繰り返し、一部は次第に進行性の経過をとります。
慢性炎症性脱髄性多発根神経炎(CIDP)は末梢神経線維を覆う髄鞘が壊される病気です。手足の感覚障害や運動麻痺などをきたします。治療はステロイド療法、免疫グロブリン静注療法、血漿交換療法、免疫抑制療法などがあります。
重症筋無力症は筋肉と末梢神経の接合部が障害される病気です.症状は筋肉の易疲労性や筋力低下です.眼に限局するタイプと全身に症状が及ぶタイプがあります.治療は対症療法としてのコリンエステラーゼ阻害薬の内服や,免疫療法として胸腺摘出術やステロイドや免疫抑制剤の内服,血漿交換療法などがあります.治療により約半数の方が発症前と同じ状態に回復します。
脊髄小脳変性症(Spino-Cerebellar Degeneration SCD)
小脳、脳幹や脊髄に障害をきたし、小脳性運動失調を主症状とする、神経変性疾患の一群の総称です。“変性”とは、原因がわからないものの、神経細胞が徐々に障害されて死滅していくことを示します。我が国の人口10万人あたり5-10人の患者さんがいるとされています。
多系統萎縮症(Multiple System Atrophy MSA)
かつて、線条体黒質変性症(SND)・オリーブ橋小脳萎縮症(OPCA)・シャイ・ドレーガー症候群(SDS)として別々に診断されていた3つの疾患を、病理学的に同じ系統が障害されることから統一したものです。人口10万に数人程度の患者さんがいます。
ALSの症状の特徴は何ですか?「眼球運動障害・膀胱直腸障害・感覚障害・床ずれ」といった4つの症状はみられません。 ALSでは全身の運動機能に障害が起きますが、目を動かす筋肉は維持され、視神経も障害は受けないため、視覚に異常は起こりません。
最後にもう一度ALSという病気の概略を復習しておきましょう。筋萎縮性側索硬化症は、身体を動かすための神経系(運動ニューロン)が変性する病気です。変性というのは、神経細胞あるいは神経細胞から出て来る神経線維が徐々に壊れていってしまう状態をいい、そうすると神経の命令が伝わらなくなって筋肉がだんだん縮み、力がなくなります。しかもALSは進行性の病気で、今のところ原因が分かっていないため、有効な治療法がほとんどない予後不良の疾患と考えられています。
外国ではルー・ゲーリック病(アメリカ)とか、シャルコー病
(フランス)とも呼ばれています。
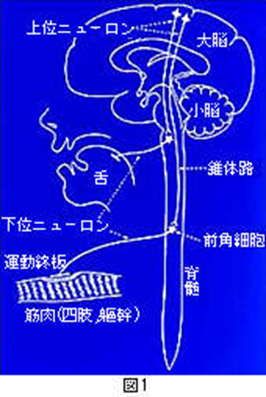
ALSではどこが障害されてくるかについて、図1で説明します。
脳で「口や手を動かしたい」と考えると、頭の中の運動神経細胞(上位ニューロン)からその命令が神経線維を伝わって下りてきて(この線維の束を錐体路といいます)、脳幹あるいは脊髄で次の神経細胞(下位ニューロン)に命令を伝えます。そしてこの命令は実際に口や手につながっている下位ニューロンの神経線維を伝わって行き、筋肉に到達します。ALSで障害される場所は、命令の乗り換えの場所(前角細胞)から始まる下位ニューロンと、脳から下りてくる上位ニューロンの両方です。両方が障害されると、結果的に筋肉を動かすことが出来なくなってしまいます。
ALSの意味ですが、Aはアミオトロフィック(Amyotrophic)の略で筋肉が縮むこと(筋萎縮)を云い、一般にこの病気がアミトロと呼ばれるのはここから来ています。Lはラテラール(Lateral)の略で側部を意味し、脳から下りてくる上位ニューロンの束(錐体路)が脊髄の左右の側面(側索という場所)を通ることから来ています。つまり側索は、脳から脊髄に運動をするようにという命令が下りてくる通り道のことなのです。Sはスクレローシス(Sclerosis)の略で壊れたあとが硬くなって働かなくなってしまうという意味です。したがって、ALSは筋肉自身の病気ではないし、手足に行っている細かい神経の病気でもありません。主に脊髄と脳の運動神経が変性し、脱落するために起こるものです。その結果、手が握れなくなる、舌がしわしわになって呂律が回りにくい、飲み込みにくい、立ち上がりにくい、歩きにくいなどという症状から始まり、徐々に手足が痩せていくことになります。
一般的には、はじめに手足が動きにくくなるタイプと、しゃべったり飲み込んだりという、口の中が先に動かなくなるタイプとがあります。手足から先に動きにくくなる場合が4分の3くらい、4分の1くらいの方は口から始まります。最終的には手足と口の両方に障害が進みます。
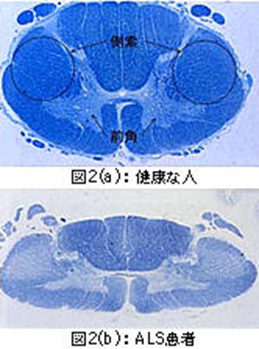
次に脊髄の断面写真を示します。図2(a)は交通事故で亡くなった正常な40歳の男性の脊髄(頸髄)です。組織は染色してあるので、神経線維があるところが青く見えます。脊髄というのは首から腰のところまで脊椎という骨に囲まれていて、太さは親指くらいです。命令は脊髄の側索を伝わって来て、前角で一度神経を乗り換えて手足に行っています。脊髄の真ん中から左右の下側あたりに広がっている部分を前角といいます。図2(b)の脊髄は50代のALS患者さんの頸髄です。側索がかなり白く見えるのは、運動ニューロンが壊れて硬くなっているからです。正常な人では脊髄の前角は蝶の羽を広げたように大きく左右に広がって見えますが、患者さんでは白くなって縮んできているのが分ります。脊髄全体の太さも、細くなって小指くらいになってきています。
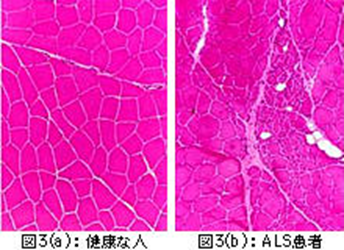
図3は筋肉の横断面を染色して比較したものです。図3(a)の正常な方の筋肉は、同じ太さの細い筋肉の束(筋線維)が集まっているのが分かります。図3(b)はALSの方の筋肉です。ひとまとまりの筋線維がグループになって細くなっているのが分かります。正常なところも残っていますが、集団で細くなったところはさらに細くなって壊れていってしまうので、力が出なくなります。もし、筋肉自身に何か問題があるなら、いいところも悪いところも全体的にバラバラにいろいろな太さの筋線維が見えるはずですが、筋肉に命令を伝えている神経はグループの筋線維を支配しているので、もし神経が壊れるとその先にある筋線維のグループが細くなり、筋肉は縮んでいくことになります。
症状の典型的なパターンとしては、どちらかの足の力がだんだん弱くなってきて、反対側の足に広がり、次に手の力がなくなってくるというものと、手から始まって徐々に足に広がるものがあります。しかも手足では、からだから遠い部位の筋肉の力がまず弱くなってきて痩せて来ます。そして、そのうちに食物を飲み込みにくくなってくる、しゃべりにくくなってくる、という症状が出てきて、からだ全体の筋肉の力が2-4年くらいで弱くなるために息苦しさを感じるようになります。さらに進行すると、呼吸が困難になり、人工呼吸器をつけるというのが一般的な経過です。また、手足の力がなくなるのと同時くらいに言語障害、飲み込みが悪くなるという場合もあります。
ALSは全身が動きにくくなる病気ですが、出にくい症状というものが6つほどあります。そのうち4つを4大陰性徴候といいます。筋肉の問題では、手足やからだ・顔が全く動かなくなっても目を動かす筋肉が最終的にある程度は残ることが挙げられます。また、尿道や肛門をキュッと締める括約筋も筋肉ですが障害は受けにくいのです。すなわち尿や便が勝手にもれて、垂れ流しにはなりにくいということです。動き以外では、知覚障害・感覚障害が起こりにくいことが挙げられます。すなわち見たり聴いたり、あるいは冷たさや痛さなどを感じる感覚は最後まで残ります。ですから自分では動けないけれども全て周囲の状況が分かってしまうということで精神的なストレスは大きくなります。ただ、徐々に寝たきりになって行きますが、いわゆる“床ずれ”が出来にくいという特徴もあります。
ALSの推定人数は、今のところ日本で大体6,000名から7,000名くらい、難病登録をしている患者さんの数は、平成16年度末のデータでは7,000名くらいと言われています。発症年齢は平均59歳、男性の方が1.5倍くらいの割りで多いという統計が出ています。以上、ALSの概略を述べました。
2.ALSの診断
ALSは、手足の先の方の筋力が徐々に低下し動かし難くなり、それが他の部位にゆっくり拡大進行する場合に疑われます。これらは下位運動ニューロンの症状です。筋肉の表面が小さく痙攣するのも症状のひとつです。これは筋線維束攣縮といいます。さらに、手足だけでなく、しゃべりにくい、飲み込みにくいと云った、舌や口の中の筋肉の動かしにくさ(球症状といいます)が見られてくるとALSがかなり疑わしくなります。この場合、舌の表面がさざ波のように勝手に動いているのが見られます。これらの下位運動ニューロンの症状に加えて、神経内科医が診察し、手足の反射が正常よりも非常に出やすい状態になっている場合(上位運動ニューロンの障害があると現れるものです)は、ほぼALSと考えられます。つまり、臨床的に、下位と上位の運動ニューロンが障害されている可能性が高い場合にALSが強く考えられます。ただ、早い段階では部分的な症状だけですから、例えば片手の筋力低下のみというような場合は、診察だけでは診断は困難です。
ALSを特異的に診断するための検査法はありません。下位運動ニューロンの障害は、筋肉に細い針を刺して筋肉の電気的な活動を調べる筋電図(針筋電図)で証明できます。また、この検査では、明らかに筋力が低下してきていない筋肉においても、異常があるかどうかを調べることが可能です。ALSの場合は、症状が出ていない手足や舌の筋肉でも異常を認めますから、比較的早期で症状が強くない場合でも異常を検出することが可能です。
ALSの場合、筋電図以外に血液検査、脊髄・脳のMRI、髄液、場合によっては筋生検(筋肉の一部をとって組織を染色して調べます)などを行いますが、これらはいずれもALSと似た病気を除外するために行われます。変形性頸椎症、脊髄空洞症、ミオパチー(筋肉自体の病気)など多くの病気の可能性を検討する必要があります。ALSでは、血液中のCKという物質が多少増える方もいますが、一般的な血液検査や画像所見では明らかな異常が認められないことが特徴です。
したがって、症状、診察所見、検査を組み合わせて診断していくことになります。
ALSはからだのいろいろなところに変化があらわれますが、多くの患者さんに末期まで「この症状はあらわれにくい」というものが4つあります。 それは、(1)眼球運動障害、(2)膀胱直腸障害、(3)感覚障害、(4)床ずれ(褥瘡) の4つです。
眼球運動障害 眼の動きは障害されないことが多い。ALSでは、眼球の運動に必要な筋肉は侵されにくいので、目の動きで自分の意思を伝えることができます。声が出なくなり、手や指が動かなくなっても、「瞬きワープロ」を使ってまぶたと眼球の動きだけで意思表示し、原稿を書いている患者さんもいます。
膀胱直腸障害 眼膀胱直腸障害はほとんどない。
排泄に必要な膀胱、直腸の筋肉は、ALSによって侵されません。尿意や便意の感覚も正常なので、介助してもらって自分で用を足すことができます。
感覚障害。
感覚障害はあらわれにくい。ALSでは、視覚、聴覚、臭覚、味覚、触覚などの知覚神経は侵されず、正常なまま維持されます。患者さんたちは、この正常な機能を生かして絵画鑑賞を楽しんだり、音楽を聴いたりしています。
床ずれ。 床ずれ(褥瘡-じょくそう-)になりにくい。ずっと寝たきりになった患者さんは、床ずれがよく起こります。しかし、ALSでは褥瘡(床ずれ)が起こりにくいのです。この理由として、患者さんの皮膚のコラーゲンに変化が起こるためではないかという説があります。
「一次運動野の神経細胞にどのように感染できたのかの説明も詳しく後述します。乞うご期待!!!」と書いたことがあるのですがやっと答えが出ました。脳幹網様体系の神経路から直接に一次運動野に感染することが出来るのです。網様体系には二つの経路があり下行性網様体系の経路と上行性網様体系の経路とに分けられます。どちらの経路からでもherpesは大脳の運動野に感染出来ます。
下行性網様体系の機能にも二つがあります。①自律神経の中枢である視床下部からの神経信号を自律神経系の節前ニューロンに伝える。②錐体外路系の神経信号を錐体系随意運動支配性の下位運動ニューロンに伝える。錐体外路系と錐体路系はこの様に繋がっているのです。錐体外路系と錐体路系は独立した経路ではないのです。近頃、多くの神経学者の間で錐体外路系という医学用語を廃止したほうが混乱を招かないので無くしてしまおう言い出し始めました。
脳幹網様体系とは何でしょうか?脳幹網様体は、中脳・間脳・延髄にまでわたっている。網様体を上行するインパルスは、大脳皮質に投射されて皮質を活性化するのが上行性網様体系の経路のはたらきです。
一方、視床下部と脳幹、脊髄、末梢との線維連絡は繋がっていくのですが視床下部と脳幹への連絡は主に内側前脳束と背側縦束によって行われ脳幹の下行性網様体系の神経核へと繋がるのです。視床下部以外の大脳からの大脳基底核の淡蒼球、黒質、視床下核から発せられる神経線維群や、平衡機能を司る神経線維の一部も下行性網様体系の神経核に信号を伝えるのです。この内側前脳束と背側縦束からの神経信号は、視床下部および他の大脳基底核の中枢部位からの出力を脳幹において統合し、目的のある順序だった行動(摂食行動、飲水行動、性行動、攻撃行動など)の遂行に関与するのです。
何故網様体と呼ばれるのですか?脳幹網様体は延髄、橋、中脳の被蓋に位置している。 様々な方向に乱雑に入りこんで走る神経線維網とその網目を充たす神経細胞体とからなっているから、いわば灰白質と白質との混成体である極めて珍しい構造をしています。 そのうち神経細胞群だけを指すときにはこれをとくに網様核と呼びます。網様体(reticular formation )とは、脳幹の背側部分に散在する構造物であります。散在する神経核があり、まばらな神経細胞体の間をまばらな網目状の神経線維が結んでいるので網様体(reticular formation )と呼びます。神経細胞体も神経線維もまばらで分散しているので白質にも灰白質にも分類されないという特徴を持っています。呼吸および循環の中枢であり、生命維持に不可欠な機能を担っている。
網様体は延髄から橋さらに中脳まで、すなわち脳幹の全体に広がり、ミクロな構造の違いからいくつかの小部分に分けられる。網様体から出た線維は、まばらではあるが脳末梢神経への核と間脳(視床、視床下部)の上行性と下行性の両方の諸核に達している。
上行性網様体系は脳幹賦活系としてよく知られています。意識の覚醒や睡眠の調節に関野しています。この上行性網様体系をなしているのは下行性網様体系と同じく延髄、橋、中脳にある境界不鮮明な複数の網様体核と、それらを相互につなぐ比較的短い神経線維群しかしこの場合の線維軍も明確なたばをつくらずに雑然とした網目状配列を示す構造となっているだけであるので網様体と言われるのです。
上行性網様体系の経路から網様体に入る感覚伝導路にはこの伝導路より出て上向系脳幹網様体にお合わる分束が存在しているのです。その分束から感覚信号を受けた網様体ニューロンは他の感覚伝導路のシナプス性の上向経路沿いに並行して信号をリレーしながら最後に上行性網様体系の信号は視床の正中核にバトンタッチされます。視床は多くの感覚性伝導路と運動性伝導路における中継地点であると同時に脳幹賦活系の中継地点としての役割をも兼ねているのです。
この脳幹賦活系の役割は視床正中核からさらに大脳皮質に向かう脳幹賦活系の信号伝達によって意識の覚醒の度合いや睡眠の深さを決めているのです。が残念なことに意識の覚醒の度合いや睡眠の深さを決めるための大脳皮質に行く信号伝達経路はいまなお不明なのです。何故でしょうか?何故ならば意識と睡眠は好一対の真逆の現象ですから「意識とは何か?」が解明されない限り意識と睡眠の神経系路をすべてを解明するのは極めて困難であるからです。
感覚伝導路神経線維では、脊髄を通ってきた痛覚線維のほか、視神経・内耳神経・三叉神経に由来する線維が視覚・聴覚・前庭覚(いわゆる平衡感覚)・顔面の触覚の情報を伝えます。そのほか、大脳皮質、小脳、赤核、淡蒼球からの線維も網様体に入るのは既に説明しました。
網様体から出ていくまばらな神経線維は、脊髄、間脳の視床、延髄の迷走神経核、舌咽神経の核である疑核・孤束核などに向かう。第9脳神経である舌咽神経は混合神経で知覚、運動、味覚の3種類の神経線維を含む。舌咽神経の核は延髄中に存し、大部分、第10脳神経である迷走神経核と共通である。舌の後方で味わえば、頚動脈の分岐部にある頚動脈小体は、米粒大の末梢化学受容器(頚動脈球)でありこの 頚動脈球で味がわかります。頸動脈小体(頚動脈球)からの情報は孤束核に入る。舌咽神経が支配する茎突咽頭筋のためのニューロンが疑核にある。茎突咽頭筋は,咽頭挙上の他に,喉頭蓋谷の粘膜 を動かすことで,喉頭蓋谷から梨状陥凹への食塊排出 に関わります。 口蓋咽頭筋の浅層筋束 は軟口蓋を下制するが,軟口蓋が挙上位に固定される と咽頭挙上に働き,また,嚥下時の梨状陥凹から食道 への食塊移送に関わります。口蓋咽頭筋は咽頭の全長を走る咽頭の筋肉です。 と同時に、軟口蓋の筋肉でもあり、その場面は咽頭口蓋筋とも呼ばれています。 口蓋咽頭筋は、主に軟口蓋から生じます。舌咽神経が損傷することにより、咽頭反射に問題が生じます。脊髄に向かった線維は運動機能の調節に関わる。視床に向かった線維は覚醒状態に関わる。迷走神経核、舌咽神経核に向かった線維は、それらの脳神経の調節を介して、呼吸と循環の調節にも関わります。
網様体の機能は主に迷走神経を介して呼吸・心拍数・血圧を調節する中枢である。この機能は生命維持に不可欠なので、網様体が傷つくことは直ちに命に関わる。脳幹が生命維持の中枢と言われる理由の多くは、脳幹の全体に広がる灰白質でもあり白質である網様体が担っています。
網様体は視床を介して覚醒と睡眠の調節にも深く関わっている。痛みで目が覚めるなどの反応は、痛覚線維から伝わった刺激が網様体に入り、網様体の活動を促して意識や運動機能を活発にします。この様子は脳波の測定により観察できますが、詳しい機序には不明な部分も今尚多いのです。何故ならば神経細胞や神経線維が少なすぎるからです。
何故今尚明確にされていないややこしい網様体系の話を持ち出したと思いますか?それは末梢神経に感染したヘルペスウイルスがどのように大脳の皮質の神経核、とりわけ運動野にまでに感染していくのかという疑問に対する最終的な答え出すためであったのです。末梢の神経に感染したヘルペスが脊髄の白質の神経線維に感染して脳へと順行して脳幹の網様体を上向する神経路にも感染して最後は大脳の一次運動野まで長い長い時間をかけて患者の免疫が下がるたびに運動神経にも感染して到達するためにはヘルペス感染の大脳皮質の運動野までいける「大道」が絶対にあるはずなので追求した結論が脳幹の「脳幹網様体の神経系路」であったのです。
脳幹網様体の神経系路解剖学をまとめます。
脳幹網様体は延髄、橋、中脳の被蓋に位置している。種種の方向に入りこんで走る神経線維網とその網目を充たす神経細胞とからなっているから、いわば灰白質と白質との混成体である。そのうち神経細胞群だけを指すときにはこれをとくに網様核と呼ぶ。網様核は脳幹の長軸に平行な3本の柱を成して配列している。すなわち、縫線核群「無対」、内側核群「有対」、外側核群「有対」である。縫線核群は正中矢状面に、内側核群は被蓋の中央部に外側核群は外側部に位置する。
脳幹網様体は上行性網様体賦活系を通じて大脳皮質に影響を及ばし、意識レベルの調節にとって重要である。縫線核は睡眠、覚醒のリズムの調節にも関与している。網様体は横紋筋の緊張と反射活動の制御に関与している。網様核は原始的な核で、諸種の運動伝導路に関係していて、呼吸の調節中枢や咳、クシャミ、嚥下、嘔吐などの反射中枢はこの網様核内に存している。
網様体と縫線核の形態学について述べます。
脳網様体の縫線核はセロトニンの神経核群であり、ここにセロトニンの細胞体が存在し、各部位へとニューロンを伸ばしている。セロトニンは受容体だけでもサブタイプを含めて14種類あるため、その作用は非常に多様・複雑、そして今尚わかりづらいです。セロトニンはどんな物質?とは一言で言えないのです。EC細胞(腸クロム親和性細胞)より供給されたセロトニンは、知覚神経終末の5HT3受容体を介してマイスナー神経叢の求心性の迷走神経細胞体を刺激し、アウエルバッハ神経叢の介在ニューロン→運動ニューロンへと伝わり、胃腸運動を調節するとともに、延髄・脊髄へ投射して、遠心性の自律神経を介して再びアウエルバッハ神経叢へ投射され、胃腸運動を調節する。
嘔吐中枢は延髄網様体に存在していて、求心性の迷走神経の入力を受けると、孤束核、迷走神経背側運動核、疑核等に出力して遠心性迷走神経による胃の逆蠕動運動や腹圧の上昇等の嘔吐反射を引き起こす。嘔吐中枢→視床VPL核→大脳皮質へと入力されて、嘔気を引き起こす。
脊髄に出入りする末梢神経をいう。前後の2根をもってそれぞれ脊髄に接続している。後根は皮膚や筋肉からの刺激を脊髄に伝える感覚神経線維から成り,椎間孔内に脊髄神経節を有する。前根は前柱細胞から出る運動神経線維から成る。前根,後根はそれぞれの高さの椎間孔で1本に合して混合神経となり,椎間孔を出るとすぐ前枝と後枝に分れる。一般に前枝は太く,頸部や体幹の前半,上肢,下肢に分布し,後枝は細く,頸部や体幹の後半の皮膚や筋肉に分布する。その数は 31対あって,頸神経8対,胸神経 12対,腰神経5対,仙骨神経5対,尾骨神経1対である。
脊髄神経は機能的には求心性(感覚性)の神経(体性感覚神経、臓性感覚神経)と遠心性(運動性)の神経(骨格筋を支配する体性運動神経と血管や内臓の筋を支配する臓性運動神経)を含んでいる。
末梢神経から脊髄に入った感覚神経が脳幹までに達する上向経路をまとめましょう。
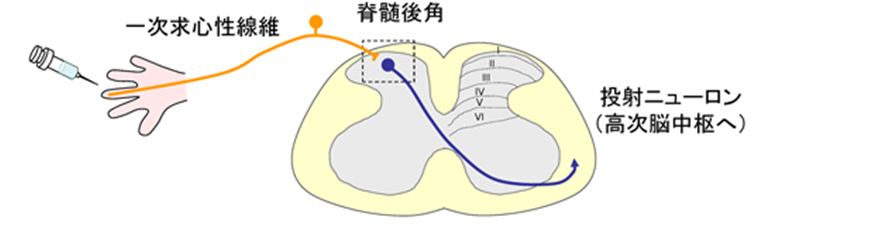
触覚,痛覚,温度覚等の体性感覚を介して我々はさまざまな情報を外界から受け取る.体性感覚刺激は脊髄後根神経節(dorsal root ganglion : DRG)に細胞体を持つ一次求心性線維の末梢終末により受容され,脊髄後角へと伝達される.この感覚情報はさらに脊髄後角の投射ニューロンを経て視床,中脳,橋,延髄などの高次脳中枢へと伝えられる.
脊髄後角は感覚情報の中継点であるだけでなく,多様な介在ニューロンを介した感覚情報処理にも関与しています。
一次求心性線維により受容された体性感覚情報は脊髄後角を経て高次脳中枢へと伝達される.ソマトスタチン陽性興奮性介在ニューロンはAδ/C線維を介した興奮性入力と,非侵害性機械刺激を伝達するAβ線維および抑制性介在ニューロンを介した抑制性入力を受ける.これら二つの入力のバランスにより疼痛刺激を投射ニューロンに伝達するかどうかが決まります。I層投射ニューロンは侵害性機械刺激または侵害性熱刺激を伝達するAδ/C線維より直接入力を受けるだけでなく,興奮性介在ニューロン(vertical cell)を介した間接的な入力も受ける.介在ニューロンを介した入力は感覚情報の増幅に関与しています.
脊髄の灰白質は神経細胞体の構造の違いにより10層に区分される.下図に示しているように10層うち脊髄後角は背側の六つの層(I~VI)から成り,これらの層に存在する神経細胞が体性感覚の情報処理に関与する.脊髄後角の層構造は一次求心性線維の投射パターンとの相関が認められる.侵害性機械刺激または侵害性熱刺激を伝達するAδ, C線維は脊髄後角の浅い層(I, II層)に入力するのに対して,非侵害性機械刺激を伝達するC, Aδ, Aβ線維は深い層(II~V層)に入力する.脊髄後角ニューロンのうち高次脳中枢へと感覚情報を直接伝達する投射ニューロンはわずか数パーセントであり,それ以外は脊髄後角の局所神経回路を構成する介在ニューロンである.これら介在ニューロンは体性感覚の情報処理に重要な役割を果たしている。介在ニューロンは、所属する部位に軸索が限局し、近傍の神経細胞にのみ情報を伝達するニューロンのことを指す。大脳や脊髄などの中枢においては中枢ニューロンの近傍の神経細胞にのみ情報を伝達する介在ニューロンの手助けがなければがなければ中枢ニューロンは複雑すぎる仕事の重圧で 脳の仕事を果たすことが出来ないのです。
それではあらゆるウイルスの中で神経に対して感染性が最強であるにもかかわらずherpesはこんな「脳幹網様体の上行性の多くの神経が脳まで走っていくと思われている系路という大道」があったにもかかわらず何故この大道を通って末梢神経に感染したヘルペスは免疫が最弱である大脳神経や脊髄神経ですよ。何故中枢神経の塊である大脳や脊髄に感染してヘルペス脳炎だらけにしなかったのでしょうか?考察に値する難問です。しかも免疫が人体の末梢に比べて遥かに弱い大脳や脊髄ですよ。
そのひとつひとつの疑問に答えを出していきましょう。何故貪欲なヘルペスができなかったのでしょうか?又する必要もなかったのでしょうか?herpesは何のために感染を広げるのでしょうか?herpesはどのような細胞に感染したがるのでしょうか?herpesはどんな状況で最も分裂して増殖して子孫であるビリオンを増やすのでしょうか?などなどの疑問に答えを出していきましょう。現代のすべての病気の原因はherpesなのですよ。癌もherpesが天疱瘡のウイルスと同じように絶滅できればがんも根絶できるのですよ!!!!!癌についてはロイアル・レイモンド・ライフ博士の癌ウイルスのここを是非是非読んでください。
因みにherpesがおこす脳の炎症や脳変性疾患と言われるすべての脳疾患を書き上げておきましょう。①海馬炎②扁桃炎③網膜炎④ベル麻痺⑤髄膜膜炎⑥脊髄炎⑦無菌性髄膜炎⑧急性網膜壊死⑨ラムゼイ・ハント症候群⑩顔面神経麻痺⑪ホルネル症候群⑫網膜症脳症神経変性疾患には、⑬パーキンソン病⑭アルツハイマー病⑮脊髄小脳変性症⑯筋萎縮性側索硬化症⑰進行性核上性麻痺⑱大脳皮質基底核変性症⑲ハンチントン病などのいわゆる神経難病が含まれます。
因みに⑲のハンチントン病は正に遺伝子病ですからじつはヘルペスが遺伝子を突然変異を起こした病気ではないのです。訂正してお詫びします。それでは何故、ハンチントン病はではあるにもかかわらず成人してから発症するのでしようか?それは「遅発優性遺伝子病」であるからです。つまり人は生まれたときに父親と母親のそれぞれから2万3千種類の遺伝子を受け継ぎます。この2万3千種類の遺伝子一種類ずつが合わさって一対になって染色体を形成し全部で23対の染色体となります。対をなしている遺伝子ではあるのですが全く同じ遺伝子でないので一対になったそれぞれを似ているけれども違いがあるのでそれぞれ対立遺伝子と言い英語でアレルと言います。二つの対立遺伝子の一つを優性の対立遺伝子と言い残りを劣性の対立遺伝子と言います。
優勢と劣性の違いは何でしょうか?遺伝子は一つの蛋白質を作るため命令書ですから父親からと母親からの二つの遺伝子のうち最初に作る順序を決めておかないと喧嘩になるので必ず最初に蛋白を作る命令を実行する遺伝子を優性と呼ばれる対立遺伝子でありこの遺伝子の命令で決められ蛋白を優先的に作るように決められています。もちろん、この優性遺伝子は父親からの遺伝子か母親からの遺伝子かはわかりません。優性と言う名がつく遺伝子にも4種類があり①優性②不完全優性③共優性④遅発優性があるのです。この④遅発優性に相当するのがハンチントンという遺伝子病を生み出す蛋白を作ってしまうのです。つまり優性ではありますが成人期になって遅れて初めて遺伝子を蛋白にしてしまうのです。これを発生の遅い時期に形質が発現するので遅発優性遺伝子病というのです。従って代々家系に伝わる遺伝子病は確かにあるのです。
先祖代々継承される遺伝子病は大きく三つに分けられます。①常染色体優性遺伝子病。②常染色体劣性遺伝子病。③X連鎖劣性遺伝病。の三つです。
①常染色体優性遺伝病。常染色体とは、ヒトの細胞にある46本の染色体のうち、男女の性を決定する遺伝子をもたない44本のことです。この男女の性を決めない44本の常染色体に遺伝病の遺伝子があり上で述べた優性アレルが病気の原因になるのです。常染色体優性遺伝病は、今までに2,000種類以上見つかっています。 2,000種類といってもさまざまで、生活に大きな支障 があるものからそれほど影響のないものまであります。
②常染色体劣性遺伝子病。常染色体突然変異による劣性遺伝病は、両親から同じ突然変異をした遺伝子をもらった場合だけに出る病気です。突然変異した遺伝子を1つだけしかもたない場合、みかけ上は正常な人と変わりありません。しかし、その遺伝子が子孫に伝わる可能性はあります。このような人を「保因者」といいます。 常染色体劣性遺伝病は、一般には生命や生活能力に重大な問題がある場合が多いようです。この遺伝病は今までに600種類以上みつかっています。たとえばフェニールケトン尿症や、色をまったく識別できない色覚異常がこれにあたります。ふつうの色覚異常というと赤緑の区別ができない異常であり、これは原因となる遺伝子がX染色体上にあります。これに対し、色がまったく分からないいわば白黒の世界にいる人は、常染色体に異常があります。
フェニールケトン尿症は、アミノ酸の一つであるフェニルアラニンの代謝に問題があり、これが体内に蓄積します。すると脳の細胞に有害な作用を与え、精神薄弱や神経症状を起こすのです。常染色体突然変異による劣性遺伝病は、両親から同じ突然変異を した遺伝子をもらった場合だけに出る病気です。 突然変異した遺伝 子を1つだけしかもたない場合、みかけ上は正常な人と変わりありません。 しかし、その遺伝子が子孫に伝わる可能性はあります。 こ のような人を「保因者」といいます。
③X連鎖劣性遺伝病。女性はX染色体を2本持ち、男性はX染色体を1本とY染色体を1本を持っています。X連鎖性とは、変異遺伝子がX染色体の1本に乗っているものを指します。X染色体の遺伝子に突然変異が起きた場合にかかる病気を、X連
鎖遺伝病といいます。これはほとんど男性だけがかかります。なぜなら男性の性染色体はXYであり、Xを1つしかもっていないので、この突然変異を受け継げば必ずそれが出てくるのです。これに対して女性は、両親とも突然変異した遺伝子をもつ「保因者」でなければ出てこないので、ごくまれにしか出ないのです。 この型の遺伝病としてよく知られているのが血友病です。前世紀から今世紀にかけてイギリス、ドイツ、ロシア、スペインの4つの王家にあらわれ、帝政ロシア最後の皇太子アレクセイがこの病気に
かかっていたことは有名です。ある種の筋ジストロフィーもこのタイプの遺伝病です。
このタイプの遺伝病は200種類ほどみつかっていて、症状の比較的穏やかなものから死にいたるものまであります。
突然変異を起こした遺伝子や異常な染色体が次世代以降に伝えられることによって、遺伝による病気や奇形が起こります。遺伝的な要因で起きる体と心の病気は多く、名前がつけられているものだけでも数千あります。また、遺伝病や先天性奇形の頻度は意外に多く、成人するころまでに症状があらわれるものを含めると、出生児10
人当たり1人くらいあるといわれています。
遺伝病は、①遺伝子突然変異によるもの、②染色体異常によるもの、そして遺伝と環境の影響がからみあった③多因子病の3種類に分類されています。奇形は必ずしも病気とはいえませんが、遺伝的要因によって発生するものが数多く知られています。これらの遺伝病のもととなる突然変異や染色体異常が起きる原因としては、物理的、化学的、生物学的な要因などがあるとされています。それぞれがどの程度寄与しているかということになると、ほとんど解明されていません。また父親の年齢が上昇すると子孫に伝わる優性遺伝病が増え、近親結婚によって劣性遺伝病が増えることなども知られています。
①の遺伝子突然変異による遺伝病 とは何らかの外的作用によって遺伝子のDNA塩基配列に変化が起きて、通常は修復酵素によって元通りに修復されるのですが、それがうまくいかず、遺伝子がもととは異なった状態になることを意味します。遺伝子突然変異のことを、略して単に突然変異ということもあります。 遺伝情報はDNAの塩基配列によって伝えられるので、塩基配列に異常が起きると遺伝情報が狂います。その結果、この遺伝子によって決められている物質が子どもの体の中でまったく作られなかったり、性質の違ったものになって機能が変わったりします。
②染色体異常による遺伝病はどのようにして起こるのでしょうか?染色体異常が起こる原因は何ですか?染色体異常とは染色体の数や構造の変化であり突然変異の一種です。塩基置換と違って染色体にある大量の遺伝子が一挙に何百個、何千個と言うレベルで増減したり遺伝子の順序や場所が変わったりします。染色体異常の発生頻度は高いのです。女性が妊娠すると15%は自然流産するが原因の半分はこの染色体異常です。さらに出生児の150人に一人はなんらかの染色体異常を持っています。確かにであり染色体異常の原因は、卵子や精子をつくるときに同じ染色体が離れずに2本ついてきて多くなる、あるいは2本とも他方にいってしまって減るなどがあります。 出産時の母の年齢が高くなると、染色体異常の子どもが生まれる率は高くなります。herpesによる遺伝子突然変異によっておこる染色体異常が自然流産をもたらすことも有るほど胎児の生死にかかわるほどの重症になることもいくらでもあるので染色体異常について書きだすと幾らでも書けますが皆さんの理解を超えるのでやめます。問題はこの染色体異常が持っている人が子孫を作るときにてきめんに大きな影響が出るのです。つまり生殖に際して男親の精子と女親の卵子がそれぞれの遺伝子を子供に伝達するときに減数第一分裂と減数第二分裂によって男の精子と女の卵子が配偶子と言う細胞に変わりはじめて二つの配偶子が一つに対合することによって一個の受精卵が出来上がります。減数分裂を完全に理解することもそれなりにややこしいので説明は省きますが父親からの23本の染色体をもらいかつ母親からも23本の染色体をもらって似た染色体同士を一対にすることを相同染色体を対合させる必要があるのです。それのよって胎児は父と母に似た子供として生まれてくるのです。染色体の数や構造や順序が変わってしまうと相同染色体同士がついになって父と母の相似た同じ種類の遺伝子どうしをぴったり合わせることが出来なくなってしまい減数分裂が異常となりまともな配偶子が出来なくなってしまうのです。
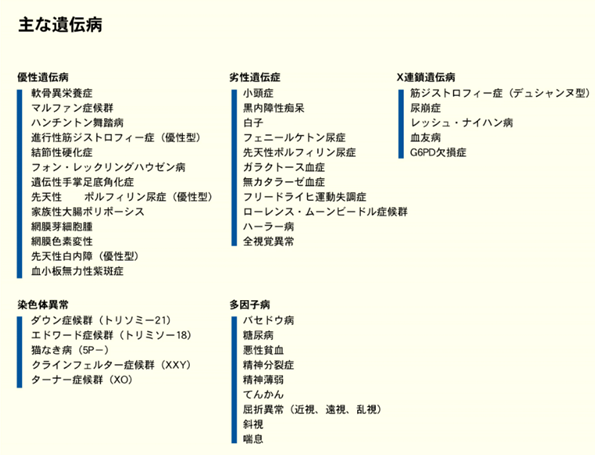
上表に常染色体優性遺伝子病、常染色体劣性遺伝子病、X連鎖遺伝子病、染色体異常,多因子病による五つの原因に分けた遺伝病を示します。此の遺伝病の中にはherpesウイルスによって遺伝子を突然変異させられて遺伝病になったものが含まれています。遺伝病と遺伝子病の明確な定義がされていないからです。子孫代々続いている本物の遺伝病は治せませんがherpesが原因であるのにもかかわらず見かけは治らないとされている遺伝病が含まれているのは世界の医療はherpesが癌を含めてすべての現代の病気であることを絶対に認めないからです。認めてしまうと免疫を抑えて症状だけを楽にするインチキ医療がばれてしまうどころかヘルペスをふやすことによって「癌」まで作っていることが医療に100%無知なかんじゃに暴露されてしまうと医薬業界は消滅してしまうからです。病気を治すのは薬でもなく医者でもなく患者さんの免疫だけです。もちろん医者の仕事は患者の免疫を手助けはできます。
ヘルペス脳炎の感染経路は?
HSVや他のherpesウイルスが中枢神経系に移行する経路は、①皮膚感染、②粘膜感染、③上気道感染から嗅神経を介してのルート、④血行性ルート、⑤リンパ性ルート⑥末梢神経ルート⑦自律神経ルート⑥潜伏している神経節からのルート⑦12対の脳神経HSV は世界的に広く浸透したウイルスで、感染様式はHSV による皮疹や口唇ヘルペスを発症した患者の唾液との密接な接触、性器ヘルペスからの母子感染あるいは性的感染によるなどがあります。 新生児の場合は生後6か月は母親から貰ったIgG抗体が無くなりかつ母乳が終わると粘膜抗体であるIgA抗体も無くなるので免疫を新生児が立ち上げるまでの間極端に落ちている器官がありこの時にherpesが上記のルートを通って脳に感染すると全脳炎のパターンをとることが多い。全脳炎とは年長児、成人においては、上記のルートを介して好発部位である大脳辺縁系にウイルスが到達し、病変を起こすとされている。新生児ヘルペスの場合は産道で感染した HSV が血行性に全身に広がり、血液脳関門を通過して中枢神経系に到達するが、年長児や成人の場合は血液からウイルスが検出されないことから、神経行性にウイル スが脳に進入し、好発部位である側頭葉、大脳辺縁系に病変を呈するため、と考えられている。小児期と年長児・成人の違いは、小児の場合はHSV の初感染に伴って発症することが多いのに比して、成人や年長児の場合はそのほとんどが再活性化によることである。
新生児ヘルペスは全身型、中枢神経型、表在型の大きく3つのカテゴリーに分類され、脳炎の症状を呈するのは全身型と中枢神経型である。頻 度的には全身型が36%、中枢神経型が36%、表在型が28%であり、発症時期は、全身型が生後平均4.6 日、中枢神経型が平均11.0日、表在型が平均6.0日とされている。母親の性器ヘルペスから産道感染することが最も多い抗ウイルス剤が開発されるまでの予後はきわめて不良で、小児のヘルペス脳炎の致命率は70~80%、成人のヘルペス脳炎においても30%の致命率である と報告されていた。抗ウイルス剤が開発されてからは致命率は10%程度に低下したものの、いまだ3分の1の症例においては重度の後遺症を残す重篤な疾患で あることに変わりはない。
ヘルペス脳炎の治療と予防については、一刻も早く抗ウイルス剤の投与を開始すべきである。第1選択はアシクロビルで、10mg/kg を一日3回緩徐に点滴静注する。10mg/kg を一日3回緩徐に点滴静注する。新生児とは生後4週間までの赤ちゃんを指します。誕生日を0日とすると28日未満、それ以降は乳児と呼ばれます。幼児と呼ばれるのは離乳後が一般的です。最近では、投与量を15mg/kg~20mg/kg/回に増量した方が治療成績が良いとの報告、投与期間も従来の14 日間より21日間の方が再燃の割合が少ないなどの報告もみられ、今後の検討課題である。また、治療終了時には、必ずPCR 法によるHSV DNA の陰性化を確かめることが重要である。
ヘルペスウイルスの潜伏部位は?
単純ヘルペスウイルス(HSV)は、生物学的、物理化学的、免疫学的差異からHSV-1とHSV-2の2型に分類されます。 初感染後、知覚神経節の神経細胞の核内に遺伝子の形態で潜伏し、HSV-1は顔面、特に口唇に再発し、HSV-2は下半身、特に性器に再発を繰り返します。
帯状疱疹後神経痛とは
帯状疱疹後神経痛とは、帯状疱疹の皮疹(水疱など)が消失し、帯状疱疹が治癒した後も続く痛みのことで、帯状疱疹の合併症としては最も頻度が高く、3ヵ月後で7~25%、6ヵ月後で5~13%の人が発症しているという報告もあります1)。
帯状疱疹後神経痛の代表的な症状は、“持続的に焼けるような痛みがある”、“一定の時間で刺すような痛みを繰り返す”といったものです。ほかにも、ひりひり、チカチカ、ズキズキ、締めつけられる、電気が走る、と表現されるような痛みを感じることがあります。感覚が鈍くなる状態(感覚鈍麻)や、触れるだけで痛みを感じる状態(アロディニア)もよく見られます。
脊髄近くの神経節と呼ばれる部分に潜み、疲れやストレスなどで身体の免疫力が低下したときに再び活性化することで、神経を通って皮膚に水疱ができます。日本人では5~6人に1人がかかるといわれています。
また、帯状疱疹の名前は、神経に沿って赤い斑点(疱疹)が皮膚に帯状にできることに由来しています。
帯状疱疹後神経痛は、帯状疱疹を発症したときには正常であった神経線維が、ウイルスによって傷つけられてしまうことで発症する
帯状疱疹後神経痛は、ウイルスによって神経が傷ついた結果、神経の過剰な興奮や自発痛、痛みを抑制する経路の障害などが起こり、これが原因となって、痛覚過敏やアロディニアなどが起こる
帯状疱疹に関連する痛みには、皮疹(皮膚症状)が出現する前に起こる「前駆痛」、皮疹が出現しているときに起こる「急性帯状疱疹痛」、そして皮疹が治癒した後も続く「帯状疱疹後神経痛」があります。
前駆痛や急性帯状疱疹痛は、主に皮膚の炎症による痛み(侵害受容性疼痛)ですが、帯状疱疹後神経痛は神経が傷ついたことによる痛み(神経障害性疼痛)であり、この2つの痛みは発症のしくみも治療法も異なります。
次のような人は、帯状疱疹から帯状疱疹後神経痛に移行しやすいとされており、帯状疱疹を発症した初期から痛みの対策を行なうことが重要です。
高齢者や女性で皮疹が発現する前から痛みや異常感覚がある帯状疱疹の初期症状が重症
(皮疹がひどい、痛みが激しい)間欠的な(一定の時間で繰り返す)刺すような痛み
ヒリヒリする、チカチカする、ズキズキする痛み針で刺すような痛み締めつけられるような痛み灼熱痛:持続的な焼けるような痛み
治療法は帯状疱疹後神経痛には、万人に当てはまる絶対的な治療法というものはありません。患者さんの生活背景、治療に対する反応性などにより、痛みが異なるため、薬物療法を中心に、神経ブロックや理学療法などを組み合わせて実施します。治療を進めるうえでは、帯状疱疹後神経痛を完全に取り除くのは難しく、また治療は長期にわたります。このため、いかに痛みをコントロールしてうまく付き合っていくか、という観点で治療に取り組むことが大切です。薬物療法には、神経障害性疼痛治療薬、三環系抗うつ薬、下行性疼痛抑制系賦活型疼痛治療剤、オピオイドが用いられます。主に整形外科、麻酔科やペインクリニックで実施されており、局所麻酔薬やステロイド薬で痛みの伝達をブロックする治療法です。
予防・改善のためには帯状疱疹後神経痛は主に薬物療法で治療しますが、痛みを完全に取り除くのは困難です。しかし、生活習慣を工夫することで痛みと上手に付き合っていくことができます。また2016年3月より、50歳以上を対象に帯状疱疹発症予防のためのワクチンが接種できるようになりました。
日常生活の注意点は好きなことに熱中する、外出する(痛み以外のことに注意を向ける)
入浴してよく温める身体を冷やさないようにする疲労やストレスをためない、睡眠を十分にとる患部を刺激しない(患部にサラシなどを巻いて衣服がこすれないようにする、など)
脳幹網様体は延髄、橋、中脳の被蓋に位置している。種種の方向に入りこんで走る神経線維網とその網目を充たす神経細胞とからなっているから、いわば灰白質と白質との混成体である。そのうち神経細胞群だけを指すときにはこれをとくに網様核と呼ぶ。網様核は脳幹の長軸に平行な3本の柱を成して配列している。すなわち、縫線核群「無対」、内側核群「有対」、外側核群「有対」である。縫線核群は正中矢状面に、内側核群は被蓋の中央部に外側核群は外側部に位置する。
脳幹網様体は上行性網様体賦活系を通じて大脳皮質に影響を及ばし、意識レベルの調節にとって重要である。縫線核は睡眠、覚醒のリズムの調節にも関与している。網様体は横紋筋の緊張と反射活動の制御に関与している。網様核は原始的な核で、諸種の運動伝導路に関係していて、呼吸の調節中枢や咳、クシャミ、嚥下、嘔吐などの反射中枢はこの網様核内に存するものと考えられる。
この論文の元々のテーマは「筋委縮性医師側索硬化症(ALS)は原因がヘルペスであるので治る。」ですがそれではどのようにしてherpesは大脳皮質にまで感染出来るのかの根拠を明示する必要があります。成人になって発症する極めて少ない病気であるALSもherpes感染症の一つですから何故、どのようにして長い時間かかって特定の少数の患者の脳の大脳皮質の「一次運動野」に感染するのか最後に明確に示します。
全ての脳炎や脳変性疾患のすべてはherpesによって起こされたものでありherpesウイルスによって炎症が生じて「ヘルペス性脳炎」になり脳細胞の機能が障害された結果なのです。
この恐ろしいherpesは新生児、年長児、成人のすべてに感染しています。新生児から乳幼児の間に感染したヘルペスが原因の急性脳炎が新生児、年長児にかかったヘルペスによって起こされますから新生児、乳幼児、年長児に起こることがあります。ヘルペス脳炎の発症年齢が新生児、年長児、成人によってその病態はかなり異なりますが脳炎が起こるメカニズムは同じです。長い間、知覚神経の神経節である脊椎の左右の真横にある31対の後根神経節に潜伏感染していたherpesウイルスは面英が落ちた機会を狙って脊髄に入り込んで更に脳まで感染したり血中に侵入して全身に広がろうとします。このようにして成人で起こるヘルペス脳炎の原因も新生児で初感染したherpesウイルスが免疫が正常である間は後根神経節に潜伏感染していたherpesウイルスが免疫が落ちたときに再活性化して増殖を繰り返している間に脳の様々な神経細胞に感染してしまい免疫のミクログリアに発見されて炎症が起こってしまって脳や脊髄で戦いが起こると「herpes性の脊髄炎やいろいろなヘルペス脳炎」となるのです。成人になって起こる筋委縮性側索硬化症(ALS)も同じメカニズムでおこるのです。因みにALSの患者数は7,000名くらい、発症年齢は平均59歳、男性は女性の1.5倍くらいです。
筋萎縮性側索硬化症(ALS)は、身体を動かすための神経である運動ニューロンがヘルペス感染によって変性する病気です。変性というのは、神経細胞に感染したヘルペスがビリオンを増やすために神経細胞体を利用し過ぎて変性崩壊壊死してしまい同時に神経細胞の軸索も徐々に壊れていってしまう状態をいい、そうすると大脳からの運動神経の命令が伝わらなくなって筋肉がだんだん廃用萎縮になり縮んでしまい筋肉も壊死してしまいます。しかも増えたherpesの子供たちである数多くのビリオンが隣のニューロンにも感染を広げて尾やherpesと同じように増えようとするのでヘルペスの増殖を抑えない限りALSは進行性の病気となります。
大脳や脊髄の中枢神経は一度損傷されると絶対再生されません。しかし末梢神経は切れてしまっても細胞体が損傷されていなければ、シュワン細胞が神経再生を促してくれます。 シュワン細胞が標的細胞に向かう道を作り、その道に沿って軸索が伸長していき、その後で再びシュワン細胞に軸索が包まれ髄鞘を形成して元通りの末梢神経が再生されるのです。筋萎縮性側索硬化症(ALS)は原因はherpes感染ですからherpesを増やさない抗ヘルペス剤と免疫を上げる漢方せんじ薬を服用すれば必ずよくなります。有効な治療法がほとんどない予後不良の疾患と言われていますが嘘です。筋萎縮性側索硬化症(ALS)を良くした臨床経験を持っていますので自信を持って言えます。
左の下図は運動の命令が脳の一次運動野の上位ニューロンから錐体路を通って前核細胞に伝えられ下位ニューロンの前核細胞でシナプスされ運動終板まで伝わる図です。
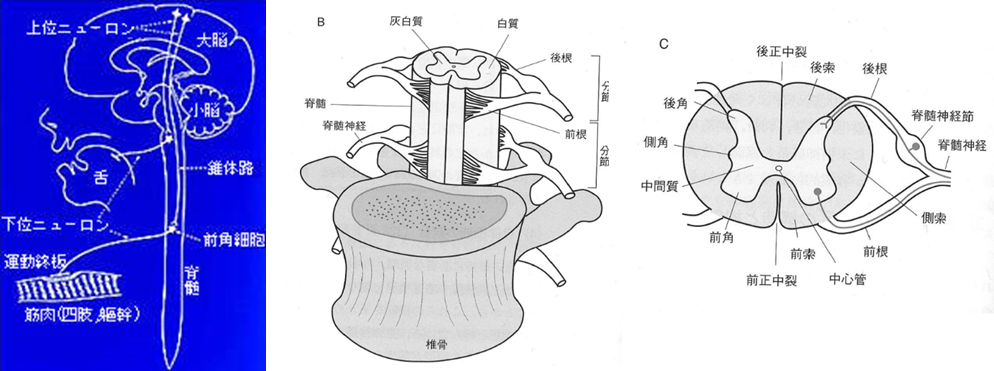
運動終盤とは運動終板とは何ですか?運動終板とは神経筋接合部とも呼ばれます。骨格筋を支配する下位運動ニューロンの体性運動神経の軸索は、上の左図で分かるように目標の筋肉の中に入ると枝分かれして、その終末部が筋肉の筋線維の中央付近に付着して終わる。 この付着部は、神経筋接合部あるいは運動終板 (motor end plate) とよばれ、化学的シナプスの一種で、神経筋接合部は、神経の末端が骨格筋組織と交わる部分です。 筋肉を収縮させる信号は、神経伝達物質であるアセチルコリンなどの化学物質によって発せられ、このアセチルコリンが神経の末端(運動神経終板)から筋肉に送られますと神経の興奮が筋肉に伝えられて筋の収縮を引き起こすと運動が可能になるのです。上の中央のBの図は椎骨と脊髄との関係と、脊髄が灰白質と白質からできていることを示しています。上の右の図は脊髄の灰白質と白質の各部位の名称を示しています。
筋萎縮性側索硬化症の側索は白質の神経線維(軸索)が通る経路が硬くなってしまう病気です。脳で「口や手を動かしたい」と考えると、頭の中の運動神経細胞(上位ニューロン)からその命令が神経線維を伝わって下りてきて(この線維の束を錐体路といいます)、脳幹(中脳、橋、延髄)あるいは脊髄で次の神経細胞(下位ニューロン)に運動する命令を伝えます。そしてこの命令は実際に口や手につながっている下位ニューロンの神経線維を伝わって行き、筋肉に到達します。ALSで障害される場所は、命令の乗り換えの場所(前角細胞)から始まる下位ニューロンと、脳から下りてくる上位ニューロンの両方です。両方が障害されると、筋肉を動かす命令が伝わらなくなり運動が出来なくなります。
ALSの意味ですが、AはAmyotrophicの略で筋肉が縮むこと(筋萎縮)を云い、アミトロと呼ばれるのはここから来ています。LはLateralの略で側索を意味し、脳から下りてくる上位ニューロンの束(錐体路)が脊髄の左右の白質の側索を通ることから来ています。つまり側索は、脳から脊髄に運動をするようにという命令が下りてくる通り道のことなのです。Sはスクレローシス(Sclerosis)の略で壊れたあとが硬くなって働かなくなってしまうという意味です。したがって、ALSは筋肉自身の病気ではないし、手足に行っている細かい神経の病気でもありません。主に脊髄と脳の運動神経がヘルペスによって変性し、脱落するために起こるものです。その結果、手が握れなくなる、舌がしわしわになって呂律が回りにくい、飲み込みにくい、立ち上がりにくい、歩きにくいなどという症状から始まり、徐々に手足が痩せていくことになります。
一般的には、はじめに手足が動きにくくなるタイプと、しゃべったり飲み込んだりという、口の中が先に動かなくなるタイプとがあります。手足から先に動きにくくなる場合が4分の3くらい、4分の1くらいの方は口から始まります。最終的には手足と口の両方に障害が進みます。
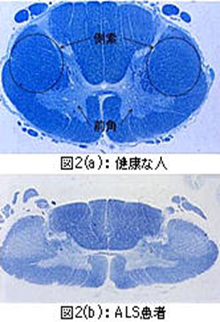
次に左に脊髄の断面写真を2枚示します。図2(a)は正常な40歳の男性の脊髄(頸髄)です。組織は染色してあるので、神経線維があるところが青く見えます。脊髄というのは首から腰のところまで脊椎という骨に囲まれていて、太さは親指くらいです。命令は脊髄の側索を伝わって来て、前角で一度神経を乗り換えて手足に行っています。脊髄の真ん中から左右の下側あたりに広がっている部分を前角といいます。図2(b)の脊髄は50代のALS患者さんの頸髄です。側索がかなり白く見えるのは、運動ニューロンが壊れて硬くなっているからです。正常な人では脊髄の前角は蝶の羽を広げたように大きく左右に広がって見えますが、患者さんでは白くなって縮んできているのが分ります。脊髄全体の太さも、正常な親指くらい太さが細くなって小指くらいになってきています。
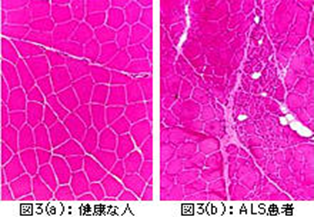
図3は筋肉の横断面を染色して比較したものです。図3(a)の正常な方の筋肉は、同じ太さの細い筋肉の束(筋線維)が集まっているのが分かります。図3(b)はALSの方の筋肉です。ひとまとまりの筋線維がグループになってしまい細くなっています。正常なところも残っていますが、集団で細くなったところはさらに細くなって壊れていってしまうので、収縮できないので筋力が出なくなります。筋肉に命令を伝えている神経はグループの筋線維を支配しているので、もし運動神経が壊れるとその先にある筋線維のグループが細くなり、筋肉は縮んでいくことになります。
筋萎縮性側索硬化症(ALS)の症状の典型的なパターンとしては、どちらかの足の力がだんだん弱くなってきて、反対側の足に広がり、次に手の力がなくなってくるというものと、手から始まって徐々に足に広がるものがあります。しかも手足では、からだから遠い部位の筋肉の力がまず弱くなってきて痩せて来ます。そして、そのうちに食物を飲み込みにくくなってくる、しゃべりにくくなってくる、という症状が出てきて、からだ全体の筋肉の力が2~4年くらいで弱くなるために息苦しさを感じるようになります。さらに進行すると、呼吸が困難になり、人工呼吸器をつけるというのが一般的な経過です。また、手足の力がなくなるのと同時くらいに言語障害、飲み込みが悪くなるという場合もあります。
ALSは全身が動きにくくなる病気ですが、出にくい症状というものが6つほどあります。そのうち4つを4大陰性徴候といいます。四大陰性症状とは. 「①眼球運動障害②膀胱直腸障害③感覚障害④床ずれ(褥瘡)」の4つの症状はみられません。筋肉の問題では、手足やからだや顔が全く動かなくなっても目を動かす筋肉が最終的にある程度は残ることが挙げられます。また、尿道や肛門をキュッと締める括約筋も筋肉ですが障害は受けにくいのです。何故かと言うと尿道や肛門をキュッと締める括約筋は自律神経であるから運動神経に支配されにくいからです。
排尿筋と膀胱括約筋は、自律神経によって支配される不随意筋で、膀胱内圧が上昇すると反射的に排 尿を促します。 ところが、随意筋である外尿道括約筋は陰部神経の支配を受けているため、尿意が起きても自分の意志で 括約筋を収縮して排尿を中断することができます。
一方、内肛門括約筋は腸の筋肉の一部で、平滑筋という自律神経がコントロールする筋肉です。 内臓の筋肉の一部である内肛門括約筋は、おしりを締めようと意識しなくても、自律神経のはたらきでおしりを締めてくれます。 一方の外肛門括約筋は、体性神経支配の横紋筋です。 手や足の骨格筋と一緒で、自分で締めることができます。すなわち尿や便が勝手にもれて、垂れ流しにはなりにくいということです。
運動以外では、ALSでは知覚障害や感覚障害が起こりにくいことが挙げられます。すなわち見たり聴いたりする知覚神経や、あるいは冷たさや痛さなどを感じる温痛覚などの感覚神経は最後まで障害されません。何故でしょうか?ALSで障害されるのは運動神経だけであるからです。
このように自分では動けないけれども感覚・知覚神経は侵されないので全て周囲の状況が分かってしまうということで精神的なストレスは大きくなります。ただ、徐々に寝たきりになって行きますが、いわゆる“床ずれ”が出来にくいという特徴もあります。何故“床ずれ”が出来にくいのでしょうか?褥瘡(床ずれ)は、同じ姿勢で長い時間寝たままや座ったままの状態が続くと、マットレスやふとん、車いすに触れている体重のかかる部分の皮膚が圧迫されて血の巡りが悪くなります。そうすると皮膚やその下にある皮膚を支える組織(皮下組織)が死んでしまいます。このようにしてできた傷のことを床ずれ(褥瘡)といいます。「床ずれ」は骨の突き出した部分や脂肪の薄い部分、常時湿気ている部分などに、長時間の圧迫、摩擦などの外力が皮膚に加わってできます。「ずれ」とは、皮膚の表面と皮下組織が互い違いにずれることで、この皮膚の表面と皮下組織の「ずれ」により皮膚や皮下組織の細胞間にずれが生じ、さらに皮下組織にある毛細血管組織が障害されます。その結果、皮膚や皮膚内部の組織、筋肉などに酸素や栄養が行き届かなくなり床ずれを引き起こします。特に皮膚の同じ部分(特に骨が突出している部分)への圧迫が持続することで起こります。 ベッドのマットや布団、車いすなどにより外から圧迫を受けると、体の中では皮膚や皮下脂肪、筋肉などを押しつぶそうとする力と、左右に引っ張ろうとする力などがかかるからです。ALSで障害されるのは運動神経だけで、自律神経は障害されていません。血管は100%交感神経支配ですから継続してゆっくり寝続けていると交感神経支配が弱まりますから周囲の血管にも血流がそれなりに増え続けるからALSでは「床ずれ」が起きにくいのです。
ALSの患者の人数は、7,000名くらいで男性の方が1.5倍くらい女性よりも多い。発症年齢は平均59歳です。
ALSの診断はどのようにして下されるのでしょうか?ALSは、手足の先の方の筋力が徐々に低下し動かし難くなり、それが他の部位にゆっくり拡大進行する場合に疑われます。これらは下位運動ニューロンの症状です。筋線維束攣縮と言われる筋肉の表面が小さく痙攣するのも症状のひとつです。さらに、球症状といわれるしゃべりにくい、飲み込みにくいなどや、舌や口の中の筋肉の動かしにくさが見られてくるとALSがかなり疑わしくなります。球麻痺は延髄から出る運動性脳神経(舌咽神経・迷走神経・副神経・舌下神経)の核下性の障害で、つまり脳神経核・末梢神経、それに支配される神経筋接合部、筋肉の障害で生じる運動麻痺です。運動麻痺とは,体が思うとおりに動かないことを言います。運動麻痺の中で用いられる核性,核上性,核下性とは何ですか?運動核からみて,運動核そのもの(核性),運動覚の上位の中枢(核上性),末梢運動神経(核下性)
と言います。それでは運動核とは何でしょうか?運動核とは脳幹の運動神経細胞の細胞体の集まりです。脳幹には、脳神経の運動核が7種類存在しています。①動眼神経核、②滑車神経核、③三叉神経運動核、④外転神経核、⑤顔面神経運動核、⑥副神経核、⑦舌下神経ですべて運動を指令する脳神経です。
A. 運動核からみて,運動核そのものを核性,運動覚の上位の中枢を核上性,末梢運動神経を核下性といいます。この三つの障害の違いによる麻痺を核性麻痺、核上性麻痺、核下性麻痺の三つに分類します。脳幹では、末梢神経である脳神経の七つの運動核が存在しており、この七つの運動覚の障害による麻痺を核性麻痺と呼びます。
核上麻痺は,大脳皮質→内包→脳幹→脊髄→脊髄前角細胞(末梢神経の出入り口)までのどこかに障害がある場合です。上位運動ニューロン障害のよって核上麻痺が起こります。
核下性麻痺は,脊髄前角細胞(末梢神経の出入り口)→筋肉までに至る神経経路のどこかでの末梢神経障害です。下位運動ニューロン障害で核下性麻痺になります。この場合、舌の表面がさざ波のように勝手に動いているのが見られます。これらの下位運動ニューロンの症状に加えて、上位運動ニューロンの障害があると現れる手足の反射が正常よりも非常に出やすい状態になっている場合は、ほぼALSです。つまり、臨床的に、下位と上位の運動ニューロンが障害されている可能性が高い場合にALSなのです。ただ、早い段階では部分的な症状だけですから、例えば片手の筋力低下のみというような場合は、診察だけでは診断は困難です。
ALSを特異的に診断するための検査法はありません。下位運動ニューロンの障害は、筋肉に細い針を刺して筋肉の電気的な活動を調べる筋電図(針筋電図)で証明できます。また、この検査では、明らかに筋力が低下してきていない筋肉においても、異常があるかどうかを調べることが可能です。ALSの場合は、症状が出ていない手足や舌の筋肉でも異常を認めますから、比較的早期で症状が強くない場合でも異常を検出することが可能です。
ALSの場合、筋電図以外に血液検査、脊髄・脳のMRI、髄液、場合によっては筋肉の一部をとって組織を染色して調べる筋生検を行いますが、これらはいずれもALSと似た病気を除外するために行われます。変形性頸椎症、脊髄空洞症、筋肉自体の病気であるミオパチーなど多くの病気を除外する必要があります。ALSでは、血液中のCKという物質が多少増える方もいますが、一般的な血液検査や画像所見では明らかな異常が認められないことが特徴です。
したがって、症状、診察所見、検査を組み合わせて診断していくことになります。
なぜ筋委縮性側索硬化症(ALS)は筋委縮硬化症とはならずに側索硬化症になったのでしょうか?脊髄というのは首から腰のところまで脊椎という骨に囲まれていて、太さは親指くらいです。命令は脊髄の側索を伝わって来て、前角で一度神経を乗り換えて手足に行っています。脊髄の真ん中から左右の下側あたりに広がっている部分を前角といいます。図2(b)の脊髄は50代のALS患者さんの頸髄です。側索がかなり白く見えるのは、運動ニューロンが壊れて硬くなっているからです。正常な人では脊髄の前角は蝶の羽を広げたように大きく左右に広がって見えますが、患者さんでは白くなって縮んできているのが分ります。脊髄全体の太さも、細くなって小指くらいになってきています。側索は、脳から脊髄に運動をするようにという命令が下りてくる通り道のことなのです。ALSの SはSclerosisの略で「硬化」と言う意味で側索が壊れたあとが硬くなって働かなくなってしまうという意味です。 したがって、ALSは筋肉自身の病気ではないし、手足に行っている細かい神経の病気でもありません。原発性側索硬化症とは原発性 側索硬化症(primary lateral sclerosis: PLS)とは、原発性側索硬化症(Primary lateral sclerosis: PLS)は上位(一次)運動ニューロンが選択的に障害される疾患であり、大脳から脊髄にいたる 運動神経 が障害されるために、通常は45歳を過ぎた頃より下肢のツッパリ感、歩行障害を自覚症状として発病します。当初の障害は筋力低下ではなく痙性が問題で、病初期の筋力自体は保たれる傾向があります。ALSでは痙性よりも筋力低下が最初の症状となることと対照的です。運動神経の障害により、主に足と腕の筋肉がおかされる病気で、通常は50代に発症します。筋萎縮性側索硬化症(ALS)によく似ていますが、ALSのような筋萎縮はみられず、ALSよりもゆっくり進行します。その後、徐々に上肢の症状、しゃべりにくい、飲み込みづらいという症状が加わってきます。
病気の進行は、筋萎縮性側索硬化症に較べて 緩徐 とされていますが、正確な診断が困難であるため、病状・経過については今後も検討する必要があります。
原発性側索硬化症とは何でしょうか?運動ニューロン疾患のうちで一次(上位)運動ニューロンのみが選択的、進行性に障害され、二次(下位)運動ニューロンは保たれる原因不明の疾患であると言われていますが原因不明の疾患であるのはすべてherpesが原因です。若年から中年以降にわたって幅広い年齢層に発症する。原発性側索硬化症(PLS:primary lateral sclerosis)は、一次運動ニューロン障害が前面に出た筋萎縮性側索硬化症(ALS:amyotrophic lateral sclerosis)との鑑別が困難な場合があるのは同じherpesが原因である同じ病気なのですが感染しているヘルペスの量や患者さんのストレスの強さや病気の広がりの違いやかつ病気の進行の違いがあるだけです。原発性側索硬化症(PLS)は前頭側頭葉変性症であるという人も出てくるのは脳の変性疾患はherpesによってもたらされた病気であることを認めないから原因が同じでも病名が違うだけなのです。
一方、臨床的には遺伝性痙性対麻痺との鑑別は困難であるのも原因はherpesであるので臨床的な病名がことなるだけであるからです。原発性側索硬化症(PLS)は常 50 才以降に下肢の痙性対麻痺で発症する例が多く進行性だが、一般的に筋萎縮性側索硬化症に比べて進行は緩徐とされている。
筋萎縮や線維束性収縮は通常認められず、筋電図でも二次運動ニューロン障害を示す所見はなくても、罹病期間が長くなると軽度の二次運動ニューロン障害を示すこともある。
頭部画像でも、萎縮が確認できない症例から運動野である中心前回に限局性した萎縮、前頭葉に広範な萎縮を認めた症例もあります。
ヘルペス脳炎とは何でしょうか?
ヘルペス脳炎は単純ヘルペスウイルス1型(herpes simplex virus type 1:HSV-1)あるいは2型(herpes simplex virus type 2 :HSV-2)の初感染時または再活性化時に発症し、発症年齢(新生児、年長児、成人)によってその病態はかなり異なる。年長児から成人のヘルペス脳炎の ほとんどの症例はHSV-1によるものであり、新生児のヘルペス脳炎においては、HSV-1がHSV-2 より約2:1の比率で多い。HSV が中枢神経系に移行する経路は、上気道感染から嗅神経を介してのルート、血行性ルート、感染した神経節からのルートの3通りといわれている。新生児の場合は全脳炎のパターンをとることが多いが、年長児、成人においては、上記のルートを介して好発部位である大脳辺縁系にウイルスが到達し、病変を起こすとされている。全脳炎のパターンとは脳のあらゆる部位にヘルペスが感染して炎症を起こすという意味です。
抗ウイルス剤が開発されるまでの予後はきわめて不良で、小児のヘルペス脳炎の致命率は70~80%、成人のヘルペス脳炎においても30%の致命率であった。抗ウイルス剤が開発されてからは致命率は10%程度に低下したものの、いまだ3分の1の症例においては重度の後遺症を残す重篤な疾患で あることに変わりはない。
HSV は感染力が強烈で世界的に広く浸透したウイルスで、感染様式はHSV による皮疹や口唇ヘルペスを発症した患者の唾液との密接な接触、性器ヘルペスからの母子感染あるいは性的感染によるものが極めて多いのです。
HSV‐1感染の好発年齢は2歳にピークがあり、6歳ぐらいまでに感染を受ける確率が高い。一方、HSV-2感染はsexually transmitted diseases(STD)としての性質を有し、15歳以下の小児における抗体保有率は1%以下である。感染を受ける年齢は20 ~30 歳代が多く、男女比ではやや男性の方が多く発症している。
森島らの全国調査の結果から、我が国での小児における急性脳炎・脳症の発症数は約1,000~2,000 例/年でそのうちHSV によるものは約80 ~160 例と推測されている。成人も含めると、年間100万人当たり1人、計300~400 例です。
HSV はヒトヘルペス科ウイルスα亜科に属する約152kbp の2本鎖DNA ウイルスで、直径約150~200 nmである。増殖サイクルが速く、その後に神経節で潜伏感染する性質を有する。皮膚、粘膜に感染したHSVは知覚神経の軸索輸送により31対ある後根神経節へと運ばれ、 潜伏感染状態に入る。ウイルス粒子内では線状DNAとして存在し、細胞に取り込まれたあとは、環状構造をとる。さらに細胞の核にある遺伝子に組み込まれプロウイルス化して隠れ遺伝子を突然変異させることがある。免疫が落ちると再活性化して前初期遺伝子 (immediate early gene)、初期遺伝子(early gene)、後期遺伝子(late gene)の順に転写が進行し、核内でrolling‐circle 型のDNA複製を行い、envelope をかぶったウイルス粒子として細胞外へ放出される。
HSV にはHSV-1とHSV-2が存在し、この2つのHSV-1とHSV-2のherpesウイルス間のDNA の相同性は約50%である。制限酵素パターンやその他の分子生物学的手法、ならびに免疫学的手法を用いて区別が可能である。HSV‐1は主に顔面に、 HSV-2は主に外陰部に病巣を形成する。そのため、HSV‐1 は三叉神経節領域、HSV-2 は腰髄・仙髄神経節領域に潜伏感染することが多い。三叉神経節は脊髄神経の知覚神経の後根神経節に非常に似た神経節で頭頚部の後根神経節と言うべき神経節なのでherpesが宣布記感染したがる神経節で半月神経節やガッセル神経節とも言われます。
日本は欧米に比してHSV-1 による性器ヘルペスの頻度が高く、新生児ヘルペスの原因ウイルスがHSV-1とHSV-2 で約2:1 であることがそれを物語っている。HSVの細胞への進入にはenvelope に存在する糖蛋白glycoprotein D(gD)および糖蛋白glycoprotein B (gB) が関与している。
HSVの潜伏期は2 ~12 日(平均6日)である。潜伏期間、あるいは潜伏期とは、病原体に感染してから、体に症状が出るまでの期間、あるいは感染性を持つようになるまでの期間のことであり病原体の種類によって異なると言われますが間違っています。何故ならば宿主の体に症状が出るのは宿主の免疫との戦いの始まりですから宿主の免疫の強さで決められるので決して病原体が決めることではないからです。
新生児ヘルペス脳炎と小児期・成人のヘルペス脳炎ではその病態が異なる。その理由として、新生児ヘルペスの場合は産道で初感染した HSV が血行性に全身に広がり、血液脳関門を通過して中枢神経系に到達するが、年長児や成人の場合は血液からウイルスが検出されないことから、初感染後の神経節に潜伏している間に免疫が落ちたときの再発により神経行性にウイル スが脳に進入し、好発部位である側頭葉、大脳辺縁系に病変を呈するためなのです。つまり小児期と年長児・成人の違いは、小児の場合はHSV の初感染に伴ってすぐに免疫に見つかって発症することが多いのに比して、成人や年長児の場合はそのほとんどが再活性化後に免疫との戦いによることで症状が出るのです。
新生児ヘルペスは全身型、中枢神経型、表在型の大きく3つのカテゴリーに分類されるのも宿主の免疫の強弱によって決まるのです。脳炎の症状を呈するのは全身型と中枢神経型である。頻度的には全身型が36%、中枢神経型が36%、表在型が28%であり、発症時期は、全身型が生後平均4.6 日、中枢神経型が平均11.0日、表在型が平均6.0日です。母親の性器ヘルペスから産道感染することが最も多いが、ヘルペス病変を認めない場合も多く、家族、医療従事者を含めて、口唇ヘルペスやherpes性ひょう疽も感染源となり得るため、新生児との接触には十分に注意が必要である。因みにひょう疽の原因は細菌性と言われますが間違いでヘルペスによるひょう疽なのです。というのは細菌性のものであれば痛覚神経に感染することもなく従って強い痛みが続くこともないのです。しかもひょう疽が細菌が原因であれば必ず最後は病巣が崩壊して膿が排泄されてはずですが見たことはありません。治療は抗生物質ではなく、抗ウイルス薬の内服です。
抗生物質が効いたとすれば単なる皮膚感染症です。
新生児ヘルペスの臨床症状は皮疹以外は非特異的で、発熱、哺乳力低下、活気がないなどの症状から始まり、大脳基底核への感染による痙攣、肝臓へのherpes性感染による肝機能異常、呼吸障害、herpesの血管内皮細胞感染による出血傾向が認められるようになる。皮疹がない場合も多く、上記にあげる非特異的な症状をみた場合、いかに早く新生児ヘルペスを疑って治療を開始するかが予後を大きく左右するのです。非特異的な症状とは、ある状態や疾患に特徴的にみられるとは限らない症状であり、逆に特異的な症状とは、特徴的にみられ、 ほかの状態や病気では見られない症状です。
年長児・成人のヘルペス脳炎はHSV-1の免疫低下による再活性化によるものが多く、HSV‐2 は主に脊髄炎や髄膜炎の形をとることが多い。急性期の症状としては、発熱、頭痛、嘔吐以外に、急性herpes性脳炎症状である髄膜刺激症状、意識障害、痙攣、記憶障害、言語障害、人格変化、幻視、異常行動、不随意運動、片麻痺、失調、脳神経症状など多彩で、脳障害のすべての症状がありますが、すべてが揃うことは少なく、発熱と不随意運動のみの症例もあります。中枢神経症状を 認める患者を診た場合には、まずヘルペス脳炎を念頭に置いて、迅速診断・早期治療を心がける必要がある。この時ステロイド治療を大量に行うと症状は一時的によくなりますがヘルペスがさらに大脳基底核にも感染してしまい免疫があがったときに癲癇が起こることになります。死ぬか生きるかの時にしかステロイドは絶対に使うべきではないのです。幼児期や年長児に癲癇が起こるのは上記の急性herpes性脳炎が起こったときにステロイド点滴をされた為に一生苦しむ医原病を作られてしまったためです。癲癇についてはここを読んでください。
抗ウイルス剤の開発により致命率は減少したものの、脳細胞がヘルペスによって破壊されてしまうと再生が二度と不可能なので後遺症を残す症例も多く、いまだ重篤な疾患の一つであることと、抗ウイルス剤投与中止後の再燃には十分な注意が必要である。抗ヘルペス剤は抗生物質と異なりherpesウイルスを殺すことはできないからです。ヘルペス性脳炎に見られる検査所見として、まず髄液においては髄液圧は高く、髄液中の免疫にかかわる細胞数が軽度増加を認め、リンパ球・単球優位である。それはherpesウイルスが脳室の髄液にも感染してしまったからです。Bリンパ球が最初に作るIgM抗体蛋白が増えCRPも高くなります。ヘルペス脳炎の初期にCRPが高くなるのはCRPは補体の役割も持っており炎症に初期に増えるIgM抗体5量体と結合してヘルペスとも結合して好中球に貪食させるためです。髄液タンパク量も発症1週目をピークに、100mg/dl 程度の増加を認める場合が多いのも自然免疫の補体のみならずherpesに対する初期抗体であるIgM抗体蛋白も大量に産生されるからです。髄液糖は通常正常範囲内で、病初期には高値であることが少なからず存在する。髄液中のグルコースが髄液糖でありすべて血糖に由来し、その濃度は血糖値に大きく依存し、血糖が基準範囲の70~120mg/dLの場合には、その60~70%程度の値を示します。髄液糖の異常、特に減少は髄膜炎の診断、治療経過、予後決定に重要な因子となります。髄液中の糖は血糖の2/3程度の濃度であり、2時間ぐらいの遅れで、平行して動く。 結核性や化膿性髄膜炎では著減し、脳腫瘍、脳出血、糖尿病、herpes性では増加する。
髄液は何処で作られるのでしょうか?脳室内の脈絡叢で産生され,側脳室の髄液は第 3 脳 室,中脳水道,第 4 脳室へと流れて,第 4 脳室のMagendie 孔(マジャンディ孔)や Lushcka 孔(ルシュカ孔)から、くも膜下腔に出て,脳底部脳槽からしだいに上行し, 最終的には上矢状洞のクモ膜顆粒から吸収され静脈血に排出される。脳底部脳槽は脳底槽とも脳槽とも言われます。くも膜の下には脳を栄養する脳脊髄液が貯留しており脳底槽と呼ばれる広大なくも膜下腔を形成しています
血液検査では、新生児ヘルペスの場合herpes性の肝機能異常、LDH増加を高頻度に認め、補体の役割をするCRPなどの炎症反応は軽度~中等度陽性に見られます。播種性血管内凝固症候群(Disseminated Intravascular Coagulation 略DIC)を合併することも多く、呼吸管理や血漿交換など新生児集中治療管理室(neonatal intensive care unit略NICU)の 管理が必要となる。
DICと何でしょうか?血管内に無数の血栓がばらまかれた、凝固の反応が非常に高ぶった状態の病気を指しています。DICは「汎発性血管内凝固症候群」と呼ばれることもあります。 DICは元々、がん、白血病、細菌感染症(この3種類の疾患がDICの約3/4を占める)などの病気(基礎疾患)にかかっている患者さんに生じる一方、成人のヘルペス脳炎ではherpes性肝機能異常の頻度は低く、炎症所見を軽度認める程度で、やはり中枢神経系の症状が主でありDICは滅多に見られない。
画像検査では、発症の極早期においては瀰漫性の脳浮腫が認められる。その後、側頭葉を中心としてCT上低吸収域あるいはmass effect を認め、出血巣が混在するようになる。mass effectとは血腫が形成されると、血腫により脳組織が圧迫を受けている状態を反映して、脳全体が押しつぶされているように見えることです。頭部CTでは、脳白質とほぼ等しい濃淡を示す領域を等吸収域(iso-density area:IDA)、脳白質よりも白い領域を高吸収域(high density area:HDA)、脳白質よりも黒い領域を低吸収域(low density area:LDA)といいます。CT画像は通常の単純X線画像と同様に、X線の吸収度合いに応じてグレースケールで表示される。グレースケールとは、コンピュータ上及び写真での色の表現方法の一種であり、グレースケールでは、画像を光が最も強い白から最も弱い黒までさらにその間の灰色の明暗も含めて表現する。X線が透過すれば低吸収となり、画像では黒く映る。グレースケールとは、白と黒の中間色であるグレーの濃淡(グラデーション )を、254階調で表したものになります。真っ白と真っ黒の2階調を合わせて合計256階調で表現されるのです。白くなればなるほど低吸収域(low density area:LDA)となりその高吸収域(high density area:HDA)の部位の病状が重篤であることを示しています。
予後不良の症例においては、その後低吸収域がさらに増加する。MRI はCT に比して、側頭葉底部や海馬領域など大脳辺縁系の所見がとらえやすい。片側性の側頭葉下部、島、海馬などの異常所見は、ヘルペス脳炎に特徴的です。脳波所見では、非ヘルペス脳炎に比してヘルペス脳炎で周期性片側性癲癇様放電(paroxysmal lateral epileptiform discharges略してPLEDs )の頻度が高くなります。癲癇も大脳基底核にヘルペスが感染して起こるので癲癇様放電がヘルペス性脳炎でも起こりやすくなるのです。それはヘルペス脳炎でもherpesと脳の免疫細胞であるミクログリアが戦いはじめ炎症が生じてその炎症がもたらす異常電気活動が部分発作を起こしてしまうからです。癲癇についてはここを読んでください。
ヘルペス性脳炎を診断するときに、髄液中のHSV のDNA をPCR 法で検出するのが最も迅速かつ有用である。ただし、抗ウイルス剤投与後はウイルス量が減少し、検出感度以下になるため、投与前あるいは投与初期の髄液で診断することが重要である。ウイルス分離は新生児ヘルペスの場合は陽性であることが多いが、年長児、成人のヘルペス脳炎でウイルスが分離されることはきわめて稀であり、PCR 法による迅速診断が必須である。髄液中のHSV 抗体価は、発症後10日から1カ月の間に1週間間隔で繰り返しELISA 法で実施する。ELISA法(Enzyme-Linked Immuno Sorbent Assay;イライザ、エライザ、あるいはエライサと呼びます)は、試料溶液中に含まれる目的のherpes抗原あるいはherpesに対するgM抗体を、特異抗体あるいは特異抗原で捕捉するとともに、酵素反応を利用して検出・定量する方法です。特異抗体とは何でしょうか?ある特定の抗原しか認識できない1つの抗体を特異抗体といいます。その特定の抗原を特異抗原と呼びます。このように、抗体は細菌やウィルスなどを特異的に認識・区別することで、人体に有害な病原体を排除しているのです。又、ペア血清で血清中のHSV IgG の有意な上昇、あるいは急性期のHSV IgM 陽性も診断の一助となります。
ヘルペス脳炎の治療は、ヘルペス脳炎を疑う場合、一刻も早く抗ウイルス剤の投与を開始すべきである。第1選択はアシクロビルで、10mg/kg を一日3回緩徐に点滴静注する。投与量を15mg/kg~20mg/kg/回に増量して21日間行うと再燃の割合が少ない。また、治療終了時には、必ずPCR 法によるHSV DNA の陰性化を確かめることが重要である。
アシクロビルの作用機序は、HSV の持つチミジンキナーゼによりリン酸化されたアシクロビルがウイルスのDNA 鎖に取り込まれ、DNA 鎖の伸長反応を止めることにより、ウイルス増殖を抑制することにある。
第2選択剤はビダラビン (Ara-A)である。ビダラビンまたは9-β-D-アラビノフラノシルアデニン(ara-A)とは、アシクロビルの効果が不十分な場合に投与を考慮する。その場合、アシクロビルとの併用が奏効する場合もある。作用機序は、(1)宿主細胞のチミジンキナーゼにより3 リン酸となり、ウイルスDNA ポリメラーゼを阻害、(2)ウイルス特異的リボヌクレオチドリダクターゼを阻害、(3)非リン酸化体によるアデノシルホモシステイン水解酵素抑制、のいず れか、あるいはそれらの組み合わせによる。ヘルペス脳炎の場合の投与量として、基本的には 1日15mg/kg を2時間以上かけて緩徐に点滴静注する。投与期間は10日間を1クールとする。副作用として白血球、血小板減少、肝機能異常に注意を要する。
その他、γグロブリン製剤、抗痙攣剤、脳浮腫に対して副腎皮質ステロイド剤、浸透圧利尿剤、濃グリセリンなどが併用して用いられる。
ビダラビンのherpesウイルスの感染細胞内での働きを知るために3つの抗ウイルス作用を詳しく説明しましょう。単純ウイルスは感染細胞で子供のビリオンを作る(増殖する)ためには①核の中でDNA複製②核の中でウイルスDNAの材料である4種類のヌクレオチド生成③細胞質のリボゾームで自らの体の構成成分であるタンパク質を合成しなければなりません。ビダラビンは、上に上げた3つの働きを阻止する抗ウイルス作用により、口唇ヘルペスの原因ウイルスである単純ヘルペスウイルスの増殖を抑制します。下図に「単純ヘルペスの増殖」の流れを示します。
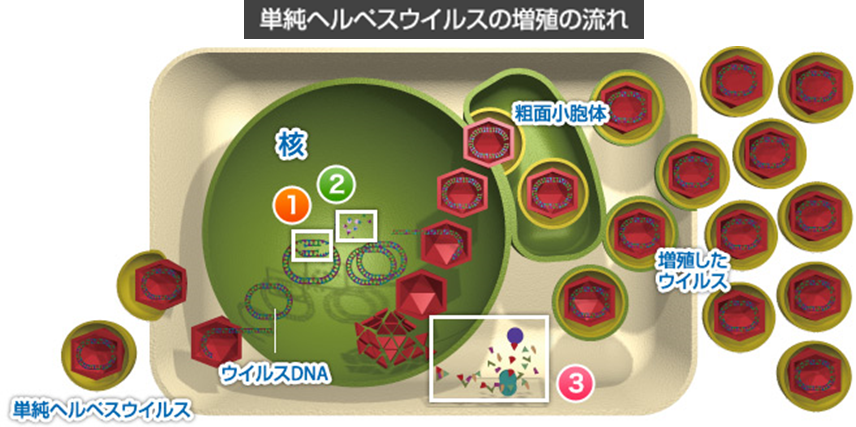
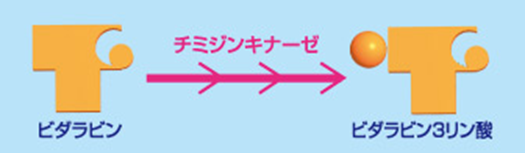
1.ウイルスのDNA伸張を停止し、DNA複製を阻害する。
下図でビダラビンは、宿主細胞の酵素であるチミジンキナーゼによってリン酸化され、ビダラビン3リン酸という活性型になります。上の図でビダラビン3リン酸の左についた丸印がリン酸なのです。
下図でビダラビン3リン酸以外の丸印のリン酸が付いた4種類のヌクレオチドは正常な4種類の3ヌクレオチドです。白い→はDNA複製の方向を示しています。
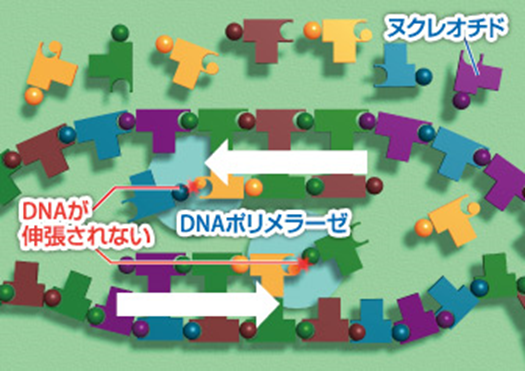
ビダラビン3リン酸はデオキシアデノシン3リン酸と構造が似ているため競合的に拮抗し、DNAポリメラーゼの働きを抑制します。その結果、ウイルスのDNA伸張が阻害されます。ビダラビン3リン酸はウイルス由来の酵素と親和性が高いため、正常ヒト細胞にはほとんど影響しません。
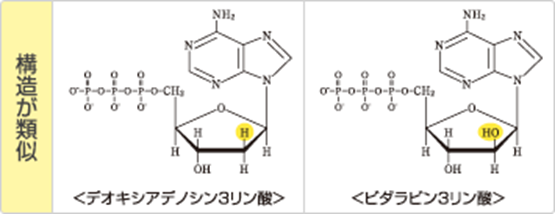
下図はデオキシアデノシン3リン酸とビダラビン3リン酸の構造図です。黄色で塗られたHとOHの違いだけで他の構造は全く同じです。
2.ウイルスDNAの材料であるヌクレオチド生成を抑制する。下図の4種類のヌクレオシドと薄紫の円板のリボヌクレオチドレダクターゼに乗せられた(結合した)ビダラビン3リン酸が描かれています。ビダラビン3リン酸がリボヌクレオチドレダクターゼと結合してしまうと4種類のヌクレオシドがリン酸化されないのでヌクレオチド生成が出来なくなります。ヌクレオチドとは、ヌクレオシドにリン酸基が結合した物質である。

ビダラビン3リン酸は、リボヌクレオチドレダクターゼという酵素のはたらきが阻害されてしまい、その結果、DNAの材料である4種類のアデニン、チミン、グアニン、シトシンのヌクレオチドが生成されず、ウイルスのDNA鎖の合成が阻害されます。ビダラビン3リン酸はウイルス由来の酵素と親和性が高いため、正常ヒト細胞にはほとんど影響しません。
3.ウイルスを形成するタンパク質の合成を阻害する。下図はビダラビンが(SAH)水解酵素を阻害する説明図です。
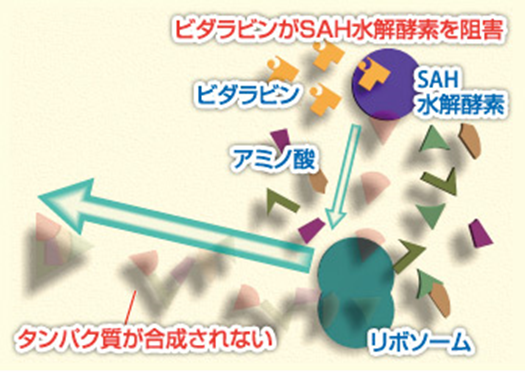
ウイルスの増殖に必要なタンパク質を合成するために必要なのが、Sアデノシル-L-ホモシステイン(SAH)水解酵素です。ビダラビンはこのSAH水解酵素の働きを阻害します。この作用により、ウイルスは自らの体の構成成分であるタンパク質を作り出せないので、結果として増殖できなくなります。水解酵素とは加水分解酵素のことでありヒドロラーゼとも言われます。加水分解の際に触媒として働く酵素の総称で生体内で澱粉やたんぱく質の加水分解を促進する。エステラーゼ・アミラーゼ・プロテアーゼなどがある。因みに上に上げた2、3の作用はビダラビンのもつ特有の抗ウイルス作用です。
