前回の続きとなります!!初めての方はここから読み始めてください!!!詳細に詳細に書き連ねているのでついてくるのが大変ですが頑張ってついてきてください!!!以下から前回の続きです。
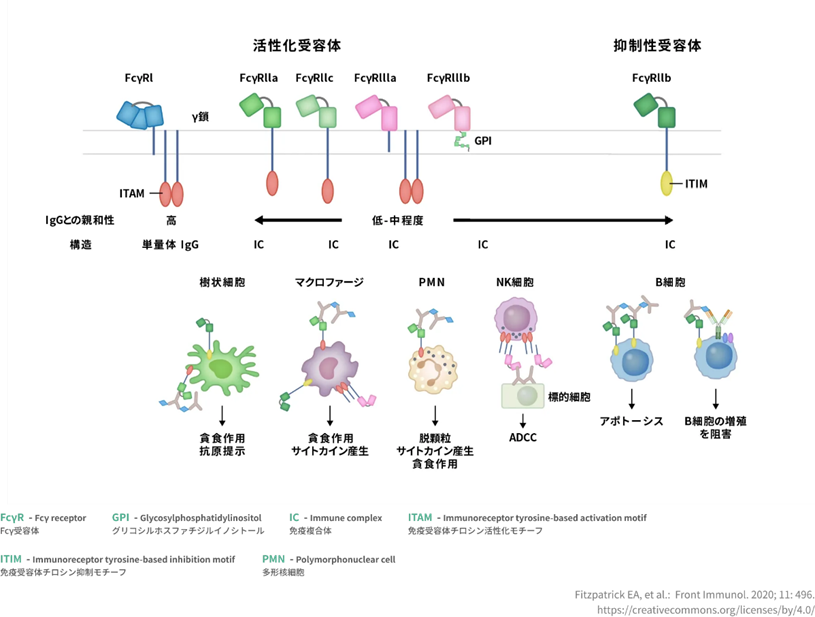
Fc受容体からのシグナル伝達はどのように細胞に伝えられるのでしょうか?Fc受容体を持っている免疫細胞の細胞表面で抗体および多価抗原によって凝集するとシグナルを免疫細胞の核に伝達します。免疫受容体チロシンベースの活性化モチーフ (ITAM) を備えた Fc 受容体の凝集により、src ファミリー チロシン キナーゼと syk ファミリー チロシン キナーゼが順番に活性化されます。Srcとは増殖因子やインテグリンからの細胞外シグナルを様々な下流の細胞内シグナル経路に伝達する中継点であり、正常細胞において、増殖・生存・細胞骨格構築、細胞外マトリックスとの相互作用、遊走など幅広い生理機能に関与しています。Sykとは造血細胞で広範に発現する非受容体型タンパク質チロシンキナーゼで、増殖、分化、および貪食性をはじめとした多様な 細胞応答を介する下流のシグナル伝達に対し、共役型の活性化免疫受容体に関与します。これらのキナーゼは、変換されたシグナルを共通の活性化経路と結び付けます。ITAM は、7 つのアミノ酸の可変残基に隣接する 2 回繰り返されるアミノ酸の YxxL 配列で構成されます。ITAM を持つ Fc 受容体は、細胞の活性化、エンドサイトーシス、および食作用を引き起こします。
Fc受容体の機能と寄与は、Fc受容体は、マクロファージや単球などの食細胞、好中球や好酸球などの顆粒球、自然免疫系(ナチュラルキラー細胞)または適応免疫系(B細胞など)のリンパ球などの免疫系の多くの細胞上に見られます。念のために書き添えますと血液にある単球は組織に出るとマクロファージになりますので食細胞に分類されます。それらは、これらの細胞が微生物または微生物に感染した細胞の表面に付着した抗体に結合できるようにFc受容体が存在しており、これらの細胞が微生物病原体を特定して排除するのを助けます。食細胞の活性化は、Fc 受容体に起因すると考えられる最も一般的な機能です。
Fcα受容体の機能はFc α 受容体は、2 つの細胞外 Ig 様ドメイン、α 鎖と γ 鎖で構成されています。Fc α 受容体 I γ 鎖には、いわゆる ITAM (免疫受容体チロシンベースの活性化モチーフ) シグナル伝達モチーフが含まれています。ITAMを伴うFcα受容体Iは、srcファミリーチロシンキナーゼおよびsykファミリーチロシンキナーゼを連続的に活性化し、エンドサイトーシス、ADCCを媒介します。シグナル伝達は、FcαRI と別の FcαRI γ 鎖サブユニットとの会合に依存しています。
Fcガンマ受容体の機能についてはFc ガンマ受容体 (FcγR) は、IgG に結合する Fc 受容体の一種です。Fcγ受容体は受容体の親和性に応じて、高親和性受容体FcγRI、低親和性受容体FcγRII、FcγRIIIに分類されます。FcγRII は、免疫複合体の食作用とエンドサイトーシス、および B 細胞の活性化を可能にします。FcγRIII は、NK 細胞および活性化単球で発現される膜貫通分子であり、抗体依存性細胞傷害 (ADCC) を媒介します。
Fcイプシロン受容体の機能についてはFc イプシロン受容体は、好酸球などの顆粒球で発現され、IgE に結合する Fc 受容体です。Fc γ 受容体と同様に、Fc ε 受容体は高親和性受容体 FcεRI と低親和性受容体 FcεRII に分類できます。そのうち、FcεRI はアレルギー反応と寄生虫感染に対する防御に関与しています。アレルギー抗原または寄生虫が存在する場合、好酸球の顆粒球はマクロファージコロニー刺激因子(GM-CSF),インターロイキン3(IL-3),およびインターロイキン5(IL-5)を分泌します。肥満細胞などの顆粒球においては肥満細胞の表面で少なくとも 2 つの IgE 分子とその Fc 受容体の架橋が引き起こされ、顆粒球細胞である肥満細胞はその顆粒からあらかじめ形成されたメディエーターであるヒスタミン,ロイコトリエン(血管収縮および気管支収縮を引き起こすことがある),リゾリン脂質,およびヘパリンといったメディエーターを迅速に放出します。好塩基球の顆粒の中には、ヒスタミン、セロトニンなどの 血管作動性アミン、ヘパリンの血液凝固阻害、ヒアルロン酸の細胞接着分子である糖タンパク質が含まれている。 アレルギー反応の際には、このヒスタミンが放出され、アナフィラキシーショック・蕁麻疹・気管支喘息などを引き起こします。ほとんどの低親和性受容体の FcεRII は B リンパ球に存在します。FcεRIIは、Bリンパ球によるIgE-抗原複合体のエンドサイトーシスおよびIgEでコーティングされた粒子の食作用を媒介します。食細胞の活性化は、Fcレセプターに起因する最も一般的な機能である。
Fc受容体の種類はFc受容体は単離されており、認識する抗体のタイプに基づいて異なるタイプに分類される。①Fcアルファ受容体(FCAR / FcαR)。Fcアルファ受容体(FcαR)は、低親和性でIgAに結合し、IgAに対して特異的な受容体である。FcαRI(CD89 / FCAR /FcαR)と呼ばれるFcアルファ受容体サブグループに属するタイプは1つだけである。Fcアルファ受容体Iは、好中球、好酸球、単球/マクロファージ、樹状細胞およびクッパー細胞で発現される。②Fcガンマ受容体(FCGR /FcγR)。Fcガンマ受容体(FcγR)は、IgGのFc部分の受容体である。Fcガンマ受容体には例えば、 CD64(FCGRI /FcγRI)、 CD32(FCGRII /FcγRII)、CD16(FCGRIII /FcγRIII)という3つの主要なクラスがある。全てのFcガンマ受容体(FcγR)は免疫グロブリンスーパーファミリーに属する。Fcガンマ受容体は、オプソニン化された食作用、炎症性メディエーターの放出および抗体依存性細胞傷害作用のような多くの免疫系エフェクター機能では不可欠である。③Fcイプシロン受容体(FCER /FcεR)。Fcイプシロン受容体(FcεR)は、IgEに結合するFc受容体である。免疫系の細胞には2種類のFcεRがある。高親和性受容体のFcイプシロン受容体I (FcεRI/ FCERIは、単量体IgEに結合することができる。低親和性受容体のFcイプシロン受容体II(FcεRII/ CD23 / FCERII)は複合体IgEと優先的に相互作用する。④新生児Fc受容体(FCGRT)。新生児Fc受容体は、MHC クラスI受容体の一種である。新生児Fc受容体(FCGRT )は、げっ歯類に最初に発見された。さらなる研究により、ヒトにも同様の受容体があることが明らかになった。げっ歯類では、新生児の腸上皮および胎児の卵黄嚢における新生児Fc受容体は母IgGを新生児へ輸送し、また、母から胎児へ胎盤を越えるIgGの輸送を媒介する。⑤Fc受容体様タンパク質(FCRL / FCRH)。FCRLは、Fc受容体様タンパク質であり、5つのIgスーパーファミリーメンバーのサブファミリーである。 FCRL はFc受容体ホモログ(FCRH)とも呼ばれる。FCRL遺伝子は、ヒト第1染色体およびマウス第3染色体上に位置する。FCRL遺伝子は、免疫グロブリンスーパーファミリー受容体転座関連(IRTA)遺伝子、SH-2ドメインを持つホスファターゼアンカータンパク質(SPAP)遺伝子としても同定されている。FCRLは、IgG、FCGRI、FCGRIIおよびFCGRIIIの古典的Fc受容体と配列ホモログを有する。FcRH1-5サブファミリーのメンバーは、免疫受容体チロシンベースの活性化モチーフ(ITAM)、阻害モチーフ(ITIM)またはその両方を有するレセプターのネットワークに属する。FCRLの機能に関しては、B細胞における活性化コレセプターであり、B細胞の活性化および分化を促進することである。
Fcα/μR (FCAMR)
Fcα/μレセプター(Fcα/μR )は、IgM媒介性免疫防御に関与する可能性があるIgMおよびIgA(FCAMR)の新規Fcレセプターである。Fcα/μRは、遺伝子が第1染色体上のFc受容体遺伝子クラスター中の高分子免疫グロブリン受容体(poly-IgR)に密接に位置するFc受容体の新規メンバーである。Fcα/μRは、脾臓にある大部分のB-リンパ球およびマクロファージ、二次リンパ球の中心に構成的に発現される。Fcα/μRは、黄色ブドウ球菌/抗Sのエンドサイトーシス免疫複合体を媒介する。Bリンパ球による黄色ブドウ球菌IgM抗体。これらの結果によって、微生物に対する免疫防御の第1段階における新たなメカニズムが明らかになった。
下の図は「IgGによるFcγRを介したエフェクター機能」の図であり説明します。
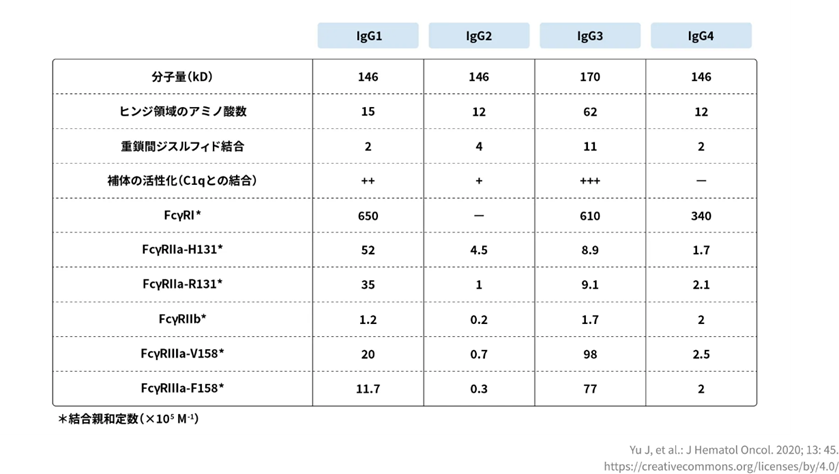
IgGのサブクラスのうち、IgG1はCDC活性を誘導するだけでなく、すべてのFcγRに対して高い親和性を示します。CDC活性とはComplement-Dependent Cytotoxicityの略でADCC活性と同じく抗体薬がターゲットの役割を行う作用です。 がん細胞に抗体薬が結合するところまではADCC活性と同じですが、CDC活性は抗体薬に補体というたんぱく質が結合します。 IgG1は、NK細胞上のFcγRⅢaを介したADCC活性や、 マクロファージや単球、樹状細胞上のFcγRⅠやFcγRⅡaなどを介してADCP活性を誘導します。ADCP活性とは、抗体依存性細胞貪食活性と訳し異物として認識された標的細胞の表面にある抗原に抗体が結合することで、貪食活性(異物を取り込んで消化する働き)を持つ細胞が呼び寄せられ、標的細胞を除去する働きのこと。 がん細胞の抗原特異的な抗体が結合することで、マクロファージや好中球等の貪食活性が活性化され、がん細胞を攻撃すると考えられています。
一方、IgG4はFcγRⅠのみ、IgG2はFcγRⅡaのH131型のみに高い親和性を示し、エフェクター機能の誘導能は低いと考えられます(図4)。IgG3はエフェクター機能やFcγRに対する親和性は高いですが、他のIgGよりもヒンジが長く遺伝子多型も認められることから、 安定性が低く免疫原性のリスクがあると考えられ、治療薬には不向きであるとされています。
IgGの四つのサブクラスIgG1、 IgG2、 IgG3、1 IgG4、と六つのFcγRのサブタイプの親和性の関係
造血器腫瘍では、がん細胞上の抗原を標的としてADCCやADCP活性の誘導を期待した抗体製剤が多いため、多くの抗体製剤でIgG1が選択されます。ADCC活性の誘導を増強させるために、 Fc領域の糖鎖のうちフコースを除去したIgG1も実用化されています 。
糖鎖修飾によるIgG抗体のエフェクター機能制御とは何でしょうか?抗体がもたらすエフェクター機能とは抗体のFc領域が担う機能で,抗体クラスに大きく依存している. 補体を活性化する機能はIgMとIgGクラスの抗体に限られ,抗体の可変領域が結合した細胞を溶解させる機能を特にCDC(補体依存性細胞障害)と呼ぶ。ADCC活性の誘導を増強させるために、 Fc領域の糖鎖のうちフコースを除去したIgG1も実用化されています。
抗体の糖鎖とは糖鎖は抗体(IgG)の重鎖の Fc 部分の Asn 残基(297残基目) に N―結合型糖鎖を有しており、この糖鎖は抗体分子としての活性や動態、安全性等に寄与しています。Asnはアミノ酸の一つでありスパラギンであり略号は N あるいは Asn。病原体や感染細胞に結合し、抗体の働きにとっては必須成分でもあります。 抗体は病原体や感染細胞に結合し、それらを中和したり、白血球が病原体を除去するための目印の役割も果たします。 抗体に付加している糖鎖構造の違いにより、抗体の標的、結合能力、活性が変化するのです。
糖鎖とは一体何でしょうか?グルコース、ガラクトース、マンノース、N-アセチルグルコサミン、N-アセチルガラクトサミン、フコース、キシロース、シアル酸などの糖が複雑に連なって糖鎖を形成する。 細胞表面の糖鎖は、他の細胞(白血球、癌細胞など)、細菌、ウイルス、毒素などが、細胞に接着する際の結合する部位(リガンド)となる。細菌は、宿主の糖鎖と結合するためのレクチンを持つ 。 糖鎖は、蛋白や脂質と結合して、糖蛋白質や糖脂質となり、蛋白や脂質を安定化させ、水分含ませ組織を保護したり、細胞表面に発現して細胞間の情報伝達に重要な役割を果たす。そのほとんどの機能は解明されておらず、糖鎖は無限の可能性を秘めている。 蛋白質や脂質に糖鎖が結合したものは、複合糖質と呼ばれる。複合糖質には、糖蛋白質、糖脂質、プロテオグリカンに分類される。
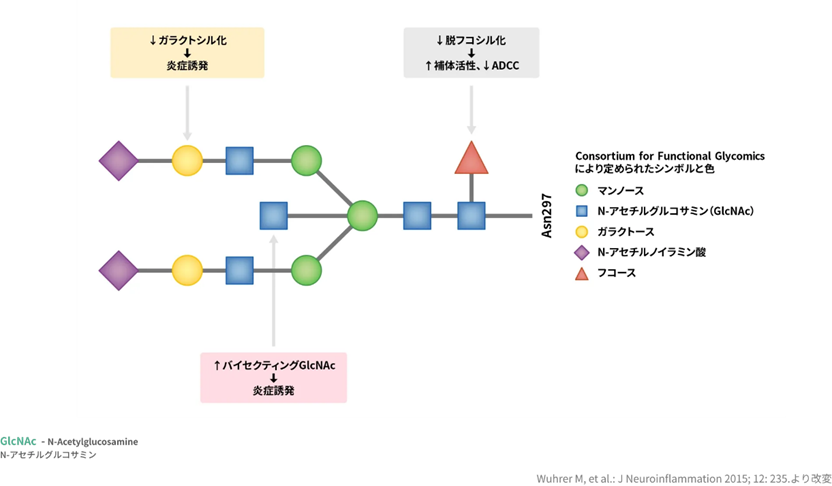
左の図はIgG抗体のFc部分の糖鎖を示しています。①マンノース②N-アセチルグルコサミン(GlcNAc)③ガラクトース④N-アセチルノイラミン⑤フコースはすべて糖です。この5つの糖が連なって糖の鎖である糖鎖を形成しているのです。
また、さまざまながんに対して使用されている免疫チェックポイント阻害薬では、細胞傷害性T細胞(CTL)上の免疫チェックポイント分子 (PD-1など)を標的とする場合には、ADCC/ADCP活性などが誘導されないようにIgG4が主に選択されますが、がん細胞上の免疫チェックポイントリガンド (PD-L1など)を標的とする場合には主にIgG1が選択されます。
このように、抗体製剤では、標的に応じてエフェクター機能を誘導すべきか否かを考慮し、IgGのサブタイプが選択されています。
補体のC1q 結合性が無いのはIgG4抗体のFc領域だけです。第二経路だけはターゲットが特定されない自然発生的であり第一経路の古典経路と第三経路のマンノース結合レクチン(MBL)はターゲットが初めから特定されています。補体についてはここを読んでください。免疫学を完全に理解するためには毎日の勉強が欠かせません。もちろん免疫学が臨床に応用されるときには間違いだらけですが。アッハッハ!!!
免疫グロブリン(抗体)Fc受容体を介した免疫抑制機構の開始は細胞膜表面受容体を介して伝達される抑制性シグナルによって行われ、正常値状態が定められ,これが安定値状態として推移するのです。仮にストレスで異常値状態になったとしても,原因のストレスさえ取り除かれれば再び正常値状態に戻るのです。これは,明らかに恒常性の概念を表現したもののようにみえるが,元来は免疫現象を表現した文章を少し変えたものである.すなわち,免疫現象にも恒常性の一面があると言ってよい.恒常性の支柱となるのは,負のフィードバック制御システムである。 Fc受容体の一つFcγRIIbの機能は免疫抑制機能に特徴があり,抗体産生系に対して負のフィードバック制御を行なう過剰感知受容体として機能し,免疫系の恒常性の一面を支えている。
Fc受容体とは抗体の構造は大きく定常領域抗原の性質によって変化する可変領域に分けられる.定常領域には抗原結合性をもたない抗体のFc部分があり,また抗体の可変領域には抗原と結合するFab部分が存在する.このうち,定常領域のFc部分を結合する細胞表面受容体分子群,それがFc受容体である.抗体は可変領域で抗原を認識する一方で,その定常領域でFc受容体により免疫・炎症細胞などの細胞表面に捕捉される.すなわち,免疫応答系において,異物(抗原)が存在するという情報は,抗体を介してFc受容体発現細胞へと伝達され,細胞に免疫実効機能を発揮させる方向に導く。こうしたFc受容体を経由する異物認識の流れは,補体系,T細胞系と並んで獲得性免疫システム(acquired-immunity)の根幹を成しています。
Fc受容体の主な機能抗原の存在は,抗体とFc受容体を介して細胞系に伝達される.ヒトではIgE,IgG,IgA抗体クラスに対応する13種以上のFc受容体遺伝子が同定されており,それらは主として免疫・炎症細胞に発現している。構造的には,免疫グロブリン様構造をとるもの,レクチン分子に属するもの,またサブユニット会合の有無など,多様化した分子群である. レクチンとは何ですか?レクチンは、ウイルス、細菌、植物からヒトにまで広く存在する「糖鎖結合性タンパク質」の総称です。 これまでに世界中で発見されてきた1万種以上のレクチンは、約100パターンのアミノ酸配列と、30種類のタンパク質の細胞骨格に分類されます。細胞骨格もその一つ。 主にアクチンフィラメント、中間径フィラメント、微小管という、タンパク質でできた3種類の繊維からなる。 テントが1つの細胞だとすると、天幕が細胞膜、それを支えて潰れないようにする骨組みが細胞骨格とするとわかりやすい。
糖鎖は、ヒトの血液型物質やウイルスの感染標的などに働く分子の鎖です。また機能的にも,抗体クラスに対応した認識特異性の分化や結合親和性の強弱の他,Fc受容体からのシグナルで惹起される細胞応答様式の点で,細胞活性化,細胞の抑制,エンドサイトーシスなどの多様化がみられている.こうしたFc受容体機能の多様化は,サブユニットを含めたFc受容体を持っている細胞内領域の属性による。たとえば,免疫活性化物質の分泌などを惹起する細胞のFc受容体は,ITAM(immunoreceptor-tyrosine-based-activation-motif)と称される活性化アミノ酸配列を細胞内領域にもつ。ITAMは,CD3分子群や抗原と結合したB細胞抗原抗体受容体複合体など,免疫系細胞に発現する活性型受容体分子に広く認められるアミノ酸モチーフで,src型チロシンキナーゼやsykなどのチロシンキナーゼと結合して細胞内シグナルを起動する。CD3分子群とはT細胞表面上でTCRと複合体を形成し, T細胞の核に刺激シグナルを伝達します。
srcとはSrcはsarcoma の略で増殖因子やインテグリンからの細胞外シグナルを様々な下流の細胞内シグナル経路に伝達する中継点であり、正常細胞において、増殖・生存・細胞骨格構築、細胞外マトリックスとの相互作用、遊走など幅広い生理機能に関与しています。Sykとはspleen tyrosine kinaseの略で、非受容体型チロシンキナーゼの1つ.自然免疫の活性化においては,Dectin-1のような細胞質ドメインに免疫受容体チロシン活性化モチーフ(ITAM)をもつ受容体などによって活性化され,下流にシグナルを伝える役割をもつ。このITAMがFc受容体にもある。Dectin-1とは細胞膜上に存在するタンパク質で、細胞外に糖鎖を認識する領域を持ち、細胞内にはITAMと呼ばれる活性化シグナルを伝えるモチーフを持つ。Dectin-1分子とはマクロファージや樹状細胞、好中球などの自然免疫を担う細胞に発現している。この分子がβグルカンの受容体であることから、βグルカンを持っている真菌感染防御における役割がある。β-グルカンは真菌全般の細胞質の骨格を構成する成分です。
一方,ITIM(immune-receptor-tyrosine-based-inhibitory-motif)と称される抑制性アミノ酸配列をもつFc受容体もある.これは近年,ITAMからの活性化シグナルのブレーキ役を果たしていることが明らかにされました.したがって,Fc受容体群は活性化と抑制という相反する作用を免疫・炎症系に及ぼしながら,この免疫系の合理性(異物の排除と恒常性)に寄与することになる.活性と抑制のバランス機構に,Fc受容体の生理学と免疫学の焦点の一つになっているのです。 Fc受容体Fab受容体は別物ですよ。
Fc受容体群の中では,唯一抑制機能を果たすFcγRIIbに関して,その抑制性シグナルの実体をさらに詳しく見ましょう。ITAM(immunoreceptor tyrosine-based activating motif)とITIM(immunoreceptor tyrosine-based inhibitory motif)との違いは何でしょうか?ITAM と ITIM は免疫細胞(B 細胞・T 細胞・樹状細胞・マスト細胞など)のFab受容体に存在するアミノ酸配列モチーフである.Fc受容体にもITIMは存在しています。ITAM はチロシン残基を二つ含むアミノ酸配列モチーフ(YxxL/Ix(6-8)YxxL/I)であり,活性化型レセプターまたはそれと会合するアダプター分子の細胞内領域に存在する.活性化型レセプターの刺激により ITAM のチロシン残基がリン酸化されると,Syk ファミリーキナーゼなどがリン酸化された ITAM に結合して活性化シグナルを伝達する.一方,唯一抑制機能を果たすFcγRIIbに関しては,その抑制性シグナルを発することが出来るのはITIMだけです。
Fcγ受容体(FcγR)とIgGの相互作用についてはヒトIgG-Fcに結合するFcγRは活性化型FcγRの 5種類(FcγRI, FcγRIIa, FcγRIIc, FcγRIIIa, FcγRIIIb)および抑制性FcγR の1種類(FcγRIIb)に分類され、免疫細胞はおのおの特徴的なFcγRを発現している。FcγRはIgG-Fcに対する親和性により高親和性FcγR(FcγRI)と低親和性FcγR(FcγRII、FcγRIII)に分類される。
抗体や抗体の抗原レセプターやFabやFcに関する医学術語の略語表もついでに付記しておきます。
CD; cluster of differentiation。
Ig; Immunoglobulin。
CDR; complementary determining region。
V; variable。
D; diversity。
J; joining。
RAG; recombination-activating gene。
RSS; recombination signal sequences。
TdT; terminal deoxynucleotidyl-transferase。
AID; activation induced cytidine deaminase。
BCR; B cell receptor。
TCR; T cell receptor。
Fab; fragment, antigen binding。
Fc; Fragment Crystallizable。
VH; variable heavy。
CH; constant heavy。
VL; variable light。
CL; constant light。
CDC; complement-dependent cytotoxicity。
ADCC; antibody-dependent cellular cytotoxicity。
ADCP; antibody-dependent cellular phagocytosis。
NK; natural killer。
FcγR; Fc gamma receptor。
ITAM; immunoreceptor tyrosine-based activation motif。
ITIM; immunoreceptor tyrosine-based inhibitory motif。
FcRn; neonatal Fc receptor。
PD-1; programmed cell death 1。
PD-L1; programmed cell death –lignd1。
VLA4; very late antigen-4。
DNP; dinitrophenol。
ELISA; Enzyme-linked immunosorbent assay。
KD; dissociation constant。
SEC; size-exclusion chromatography。
DSF; differential scanning fluorimetry。
DSC; differential scanning calorimetry。
Tm; melting transition。
RU; resonance unit。
免疫グロブリンの種類および機能について復習しましょう。抗体である免疫グロブリン(Immunoglobulin略してIg)はヒトを含む哺乳細胞に存在する B 細胞から産生される糖タンパク質であり、抗体は外来抗原を認識して結合する機能を有する。Ig(抗体)は主に血液中および組織体液中やリンパ液に存在し、細菌やウイルスなどの外来抗原に結合することにより、好中球又はマクロファージによる食作用、ならびにT細胞やキラー細胞や樹状細胞などの免疫細胞の結合による免疫作用により生体防御に貢献している。ヒトの免疫グロブリンは、IgG, IgA, IgM, IgD および IgE の 5 つのクラスが存在し、重鎖(H鎖)と軽鎖(L鎖)から構成される。重鎖の定常領域の配列によりさらにクラスが分類され、IgG は、重鎖の定常領域(Fc領域)の配列からIgG1, IgG2, IgG3 および IgG4 の 4 つのサブクラスに分類される。また、IgA は、IgA1 および IgA2 の 2 つのサブクラスに分類される。IgG は、血液中に最も多く存在し、抗体の 70-75%を占めており、細菌やウイルスなどの様々な抗原に結合し、食作用、中和作用などに関わる。IgA は、抗原や細菌に暴露されやすい消化管および呼吸器で分泌され、粘膜の免疫防御に関与している。IgM は、ジスルフィド結合により多量体(5量体)を形成しており、その殆どは 5 量体で単量体は極めて少ないのです。5量体のIgMは、細菌などの初期感染により発現し、古典経路の補体活性能が高く、初期の生体防御に関与している。IgD は、IgM 発現の直後に発現し、抗原の自己または非自己の選択に関与している。また、分泌型の IgD は、粘膜免疫に関与していることが報告されている。IgE は、アレルギー反応に関与しており、マスト細胞や好塩基球の脱顆粒反応を起こすのです。
5量体免疫グロブリン IgM クラスについて詳しく説明しましょう。
血清 IgM は、哺乳類において五量体として存在し、正常ヒト血清 Ig 含量の約 10% を占めます。IgG は、血液中に最も多く存在し、抗体の 70-75%を占めているので血清IgM は約7%が血液中に存在しています。ほとんどの抗原に対して補体の古典経路により優れた一次免疫応答を示し、最も効率的な補体活性能を持つ免疫グロブリンです。また、IgM は単量体として B リンパ球の細胞膜上にも発現します。この膜抗体の形態では、B細胞抗原受容体がH鎖とともに細胞膜上に発現しており、それぞれには膜を貫通して固定するための付加的な疎水性ドメインが含まれます。生体膜に挿入される膜貫通ドメインは約20個の疎水性アミノ酸配列からなり,さまざまなタンパク質ドメインの中でも最も高疎水性なのです。
血清 IgM の各単量体は、ジスルフィド結合および結合J 鎖によって互いに結合しています。
五量体構造内の 5 つの各単量体は、2 つの軽鎖 (κ または λ) および 2 つの重鎖から構成されます。IgG抗体などの一般構造 とは異なり、IgM 単量体の重鎖は、1 つの可変領域と 4 つの定常領域からなり、ヒンジ領域は付加的な定常ドメインにより置換されます。IgM は侵入した微生物上のエピトープを認識し、細胞凝集を生じさせます。その後、この抗体-抗原免疫複合体は、補体固定またはマクロファージによる受容体媒介エンドサイトーシスによって破壊されます。IgM は、最初に新生児で合成される免疫グロブリンクラスであり、自己免疫疾患の病態形成において役割を果たします。
IgM クラスは他の抗体とは大きな違いがあるので免疫グロブリン IgM 抗体について詳しく説明しましょう。
血清 IgM は、人を含む哺乳類において五量体として存在し、正常ヒト血清 Ig 含量の約 10% を占めますから。ほとんどの抗原に対して優れた一次免疫応答を示し、最も効率的な補体固定能を持つ免疫グロブリンです。また、IgM は単量体として B リンパ球の細胞膜上にも発現します。この形態では、B細胞抗原受容体がH鎖とともに細胞膜上に発現しており、それぞれには膜に固定するための付加的な疎水性ドメインが含まれます。血清 IgM の各単量体は、ジスルフィド結合および結合 (J) 鎖によって互いに結合します。
五量体構造内の 5 つの各単量体は、2 つの軽鎖 (κ または λ) および 2 つの重鎖から構成されます。IgG (および上記の一般構造) とは異なり、IgM 単量体の重鎖は、1 つの可変領域と 4 つの定常領域からなり、ヒンジ領域は付加的な定常ドメインにより置換されます。IgM は侵入した微生物上のエピトープを認識し、細胞凝集を生じさせます。その後、この抗体-抗原免疫複合体は、補体固定またはマクロファージによる受容体媒介エンドサイトーシスによって破壊されます。IgM は、最初に新生児で合成される免疫グロブリンクラスであり、自己免疫疾患の病態形成において役割を果たしますと言われますが、自己免疫疾患は存在しないのでIgM はヘルペス感染の時に細胞内に潜伏する前に五量体で補体の古典経路の活性化によってherpesを殺すためには極めて大切です。
IgM の特性のいろいろ。
分子量: 900,000
H 鎖のタイプ (MW): μ 鎖 (65,000)。MWはMolecular Weightの略語です。分子量と訳し、原子量と同じように、質量数12の炭素を基準として求めた分子の相対質量を『分子量』といいます。 分子量は、分子式を構成する元素の原子量を、すべて足したものです。
血清濃度: 0.5~2 mg/mL
総免疫グロブリンの割合: 10%~7%
グリコシル化 (重量 %): 12%。グリコシル化とは何でしょうか?グリコシル化 は、タンパク質もしくは脂質へ糖類が付加する反応である。糖鎖付加とも言う。この反応は、細胞膜の合成やタンパク質分泌における遺伝子の翻訳後の修飾の重要な過程の1つであり、こういった合成の大部分は粗面小胞体で行われる。グリコシル化は、非酵素的糖化反応であるメイラード反応とは対照的に酵素によって管理されている。グリコシル化は酵素を用いる品質管理機構で利用され、適切に折り畳まれたタンパク質のみをゴルジ体へ輸送するための制御に関わっています。 可溶性タンパク質上の糖鎖部分にトランスゴルジ網内の特定受容体が結合することによって、適正な送達先へ運搬が行われます。抗体も糖鎖を付加されて糖タンパクになるためにグリコシル化が必要なのです。グリコシル化にはN-結合型グリコシル化とO-結合型グリコシル化の2つのタイプが存在する。アスパラギン側鎖のアミドのN原子への付加はN-結合型グリコシル化、セリンとトレオニン側鎖のヒドロキシ基のO原子への付加はO-結合型グリコシル化である。グリコシル化にはN-結合型グリコシル化とO-結合型グリコシル化の2つのタイプが存在する。アスパラギン側鎖のアミドのN原子への付加はN-結合型グリコシル化、セリンとトレオニン側鎖のヒドロキシ基のO原子への付加はO-結合型グリコシル化であるのです。
人体における分布: 主に血管内に存在している免疫グロブリン M(IgM抗体)は、IgG,IgAについで血液中には3番目に一般的な血清 IgMです。免疫グロブリン M は次の 2 つのうち 1 つの形態を取ります。一つ目は全ての重鎖が同一であり、全ての軽鎖が同一である五量体と言う形態であり、二つ目は単量体と言われる、例えば、B 細胞受容体として B リンパ球上に膜抗体として見られる形態の二つです。
大きな五量体構造では、連結可能な距離にある、より小さい IgG 抗体の抗原分子上のエピトープ間(抗原決定基間)で架橋が構築されています。架橋というのはIgM抗体とIgG 抗体とが一つの抗原分子上のエピトープ間(抗原決定基間)に結合することです。エピトープとは何でしょうか?エピトープは、抗原決定基とも呼ばれ、免疫系、特に抗体、B細胞、T細胞によって認識される抗原の一部である。抗体は、病原微生物や高分子化学物質などの抗原と結合する際、その全体を認識するわけではなく、抗原の比較的小さな特定の部分のみを認識して結合する。この抗体結合部位を抗原のエピトープと呼ぶ。
IgM は、免疫応答の間に形成される最初の五量体抗体です。理論上、その五量体構造には 10ヵ所の遊離抗原結合部位であるFab 部分があり、高い結合活性を持つことから、IgM は抗原の凝集や病原体の細胞溶解に関わっています。10 個の Fab 部分の間には立体配座の制約があるため、IgM の抗体価は10価ではなく 5 価しかありません。また、IgM は IgG ほど汎用性がありません。しかしながら、IgM は補体活性化および凝集に極めて重要です。
IgM は主にリンパ液と血液中に見られ、疾患の初期段階における非常に効果的な中和剤です。中和剤というのは病原体が細胞に感染させなくさせる働きです。IgM レベルの上昇は、最近の感染または抗原への曝露の兆候である可能性を示唆しているのです。免疫応答における IgM の役割は感染の初期の一次応答です。
IgM は、免疫応答のために形成される最初の抗体です。理論上、うえの図に書いたようにその五量体構造には 10ヵ所の遊離抗原結合部位があり、高い結合活性を持つことから、IgM は凝集や細胞溶解反応に関係しています。10 個の Fab 部分の間には立体配座の制約があるため、IgM の抗体価は10価あるはずですが実際は5 価しかありません。また、IgM は IgG ほど汎用性がありません。しかしながら、5量体のIgM は補体活性化および補体の凝集に極めて重要です。特に補体の古典経路の活性化には極めて重要です。
IgM は主にリンパ液と血液中に見られ、疾患の初期段階における非常に効果的な中和作用剤です。IgM レベルの上昇は、最近の感染または抗原への曝露の兆候である可能性があります。IgM は主にリンパ液と血液中に見られ、疾患の初期段階における非常に効果的な中和剤です。IgM レベルの上昇は、最近の感染または抗原への曝露の兆候である可能性を示唆しているのです。因みに補体は安っぽいIgM抗体と言ってもよいのです。
再び抗体医薬とは何でしょうか?抗体医薬は生体防御システムのひとつである液性免疫反応を司る抗体を、遺伝子組換え技術と細胞培養技術を用いて製造し、製剤化した医薬の総称である。抗体医薬とは治療用モノクローナル抗体のことです。<1970~ 80年代に齧歯類(げっしるい)からハイブリドーマ法を用いてモノクローナル抗体を作製する技術が確立され、抗体を人工的に作製することが可能となり、抗体医薬はその特異性の高さから夢のミサイル療法として注目を浴びた。齧歯類(げっしるい)は「のみ 」の形をした一対の門歯は絶えず伸びつづけるので、常に物をかじってすり減らす。 犬歯はない。 哺乳類では最も種類が多く、リス・ネズミ・ヤマアラシの3亜目に大別され、約1600種が知られる。
ハイブリドーマ法は何でありモノクローナル抗体ってどうやって作るのでしょうか?一般的にモノクローナル抗体は、抗体を作り出すB細胞と、無限に増え続ける能力を持った特殊な細胞である癌細胞である骨髄腫細胞(ミエローマ細胞)の二つの細胞を融合して作った融合細胞をハイブリドーマ細胞と言います。このハイブリドーマ細胞からモノクローナル抗体は作られます。モノクローナル抗体とは、単一の抗体産生細胞をクローニングして作られた抗体である。このようにして得られた後続の抗体は、すべて単一の同一の抗体です。 通常の抗体は抗原で免疫した動物の血清から調製するため、いろいろな抗体分子種の混合物となるが、モノクローナル抗体はすべて同一なのです。
がん細胞である骨髄腫細胞(ミエローマ細胞)を例にあげると、もし、「がん細胞である骨髄腫細胞(ミエローマ細胞)が持つ特定の目印に結合するモノクローナル抗体だけを大量に作ることができれば、がん細胞だけをやっつけることができる抗体医薬品を作ることができる」と考えられました。しかし、B細胞には寿命があるため、1種類のモノクローナル抗体を大量に作り出すのは困難でした。そこで、「無限に増え続ける能力を持つ細胞の性質を、B細胞に持たせることはできないか」と考え、B細胞と無限に増え続ける能力を持つ細胞を融合させた細胞を作ることに成功し、モノクローナル抗体を大量に作ることができるようになりました。しかし当初は、マウスなど異種生物由来の抗体であったため、ヒトに投与すると異物として認識されて、投与抗体に対するヒト抗体が体内に誘導され、投与抗体が十分な治療効果を発揮する前に体内から速やかに排除されてしまうという結果に終わりました。その後、抗体工学の進歩によって、げっ歯類由来抗体の可変領域とヒト由来抗体の定常領域を組み合わせたヒト型キメラ抗体、抗原特異性を決定する相補性決定領域のみをげっ歯類由来抗体からヒト抗体に移植したヒト化抗体など、ヒトに対する抗原性が低く、医薬品として臨床応用可能な抗体が作製可能となった。さらに、ヒト染色体を有しヒト抗体を産生するマウスの開発、あるいはファージディスプレイ技術の開発により、完全ヒト抗体の作製が可能となった。ファージ・ディスプレイは、ファージ(細菌に感染するウイルス)の表面に、他の分子と相互作用できるような形で、ペプチドや蛋白質を提示する技術のこと。 特定の標的分子(抗原)と相互作用する蛋白質や抗体のスクリーニングに利用される。これら抗原性の克服に加え、遺伝子工学と細胞培養技術を用いた遺伝子組換え抗体の工業的大量生産技術の確立が進み、今日では、医療の現場にヒトモノクローナル抗体を安定的に供給し続けることができるようになった。現在、世界で認可された抗体医薬品は既に30種類に達し、抗体医薬は1つの大きな医薬品群として認知されている。しかし、抗体医薬が多くの患者に恩恵をもたらしてきたことは事実であるが、その一方、新たな課題も見出されてきている。それは、治療効果の発揮には大量投与が必要なこと、抗体に対する耐性が出現すること、また、治療効果においてもなお改善する余地があることなどが挙げられる。このような背景から、より治療効果の高い次世代抗体医薬の開発が求められ生まれたのがポテリジェント技術です。ポテリジェント技術は、抗体の糖鎖を制御することにより、抗体医薬の治療効果を著しく向上させることが可能になった技術のことです。このタンパク質の糖鎖中のフコース含量を低下させる糖鎖工学技術はポテリジェント技術(POTELLIGENT® Technology)と命名された。抗体医薬品(治療用モノクローナル抗体)は、様々ながんや慢性疾患の治療に使用されています。その効果や安全性の高さから、世界における医薬品販売額の上位を多くの抗体医薬品が占めるほど市場規模の大きな医薬品カテゴリーとなっています。また、現時点で450種類以上の抗体医薬品が第1相試験、300種類以上が第2相試験中であるなど、新しい抗体医薬品の研究開発も加速しています。これらの抗体医薬品のほとんどはガンマイムノグロブリン(IgG)タンパク質で、重鎖のFc領域のアスパラギン残基(297残基目)に2つのN型糖鎖が結合しています。
N型糖鎖とは何でしょうか?すでに説明したように糖鎖とは、ブドウ糖などの単糖が鎖のように数個から数十個連なったものです。糖鎖修飾は、タンパク質の修飾構造のひとつであり、タンパク質の機能や安定性に大きな影響を与えます。この糖鎖のうち、タンパク質中のアスパラギン残基(Asn、またはNと表記)に付加されるタイプの糖鎖をN型糖鎖と呼びます。タンパク質は機能を発揮するためにリン酸化などさまざまな修飾を受けますが、糖鎖もそのうちのひとつです。たとえば、抗体依存性細胞傷害活性(ADCC活性)を持つ抗体医薬品においては、ある特定の糖鎖構造を持つと効果が大幅に増強されることが知られており、この性質を利用した製品がすでに上市されています。抗体の糖鎖とは抗体のFc部分にある糖鎖のことであり抗体の必須成分でもあります。抗体は病原体や感染細胞に結合し、それらを中和したり、白血球が病原体を除去するための目印の役割も果たします。 抗体に付加している糖鎖構造の違いにより、抗体の標的、結合能力、活性が変化するのです。
ポテリジェント技術とはなんでしょうか?抗体の基本構造と作用機序はまず抗体は軽鎖2本と重鎖2本からから構成される四量体蛋白質であり、抗原との結合を担う可変領域(Fab領域)と、抗体のエフェクター機能を担う定常領域(Fc領域)に分けることができる。可変領域の配列は抗体ごとに異なるが、定常領域の配列は抗体のアイソタイプあるいはサブクラスで共通である。ヒト抗体は定常領域配列の違いから IgM、IgG、IgE、IgA、IgD の5種類のアイソタイプに分類される。疾患患治療の目的においては、血中半減期が比較的長く、エフェクター機能を有する IgG の抗体が主として利用されている。IgG クラスの抗体はさらに IgG1、IgG2、IgG3、IgG4の4種類のサブクラスに分類される。エフェクター機能を薬効発現に必要とする場合は、エフェクター機能抗体医薬の生物活性増強の高い IgG1が主に利用され、逆にエフェクター機能を不要とする場合はIgG2やIgG4が利用される。
抗体のエフェクター機能とは何でしょうか?抗体のFc領域が担う機能で,抗体クラスに大きく依存している.補体を活性化する機能はIgMとIgGクラスの抗体に限られ,抗体の可変領域が結合した病原体感染細胞を補体のよって溶解させる機能を特にCDC(補体依存性細胞障害)と呼ぶ.また,IgG,IgE,IgAクラスの抗体のFc領域はそれぞれに免疫細胞が持っている特異的なそれぞれのFc受容体に結合し,Fc受容体をもつ免疫細胞を活性化したり,抗体の細胞間トランスポートに働く.特に,IgGクラス抗体が免疫細胞のT細胞,NK細胞,好中球,マクロファージ上のFc受容体を介して,これらのエフェクター細胞になる前のナイーブな免疫細胞を活性化し,抗体の可変領域が結合した敵である標的細胞を殺すことをADCC(抗体依存性細胞障害)とよぶ.抗原刺激により、ナイーブB細胞、ナイーブキラーT細胞、ナイーブヘルパーT細胞が抗原特異的に活性化されると、分裂を繰り返して増殖する。 増殖した細胞はそれぞれの役割を果たすべく一生懸命に働く。 この時期の免疫細胞を各細胞の「エフェクター細胞」とよぶ。時に,NK細胞を活性化する機能をADCC,マクロファージを活性化する機能をADMCと区別して使用する場合がある.ヒトIgGの定常領域は軽鎖の constant light chain(CL)、重鎖のconstant heavy chain(CH 1、CH 2、CH 3)およびヒンジ領域から構成される。軽鎖の可変領域(variable light chain ; VL)と重鎖の可変領域(variable heavy chain ; VH)、およびCLとCH 1からなる部分はfragment-antigen binding(Fab)領域とよばれ、ヒンジ領域および CH 2、CH 3からなる部分は fragment crystallizable(Fc)領域とよばれる。
一般に、抗体医薬が薬効を発揮するメカニズムは、①敵の標的分子に結合することにより標的分子の有する生物活性を制御・中和する作用、②血中に存在する免疫メカニズムを利用し標的分子を発現する細胞を排除するエフェクター作用の2つに大別される。①の中和作用は抗体のFab 領域を介して行われ、②のエフェクター作用は抗体のFab領域とFc領域の両方を介して行われる。 中和作用を主な作用機序とする代表的な抗体医薬としては、腫瘍壊死因子(TNF-α)に対する中和活性を有し、慢性関節リウマチの治療に用いられているレミケード®(インフリキシマブ)、ヒュミラ®(アダリムマブ)といった抗 TNF-α抗体が挙げられる。これらの抗体医薬はすべて免疫を抑える薬ですから毒薬そのものです。また、世界に先駆けて日本で最初に認可された抗インターロイキン-6(IL-6)受容体抗体アクテムラ®(トシリズマブ)は、IL-6と IL-6受容体の結合を阻害する作用によって病気を治せない薬効を発揮しているので使うべきではないのです。また、癌領域においてもアバスチン®(ベバシズマブ)は腫瘍組織において腫瘍血管新生を促す血管内皮細胞増殖因子(VEGF)の作用を中和することで抗癌作用を発揮している。癌の原因はherpesによる突然変異で遺伝子を癌化させることで生じるものですからアバスチン®(ベバシズマブ)も対症療法に過ぎません。
これまでの低分子を中心とした創薬技術では、高分子である蛋白質間の相互作用を制御する低分子を見出すことは難しく、このような標的分子の中和作用を主たる薬効メカニズムとする薬剤には抗体分子が適していたといえる。 一方、抗体医薬には血中の免疫メカニズムを利用した抗体依存性細胞傷害活性(antibody-dependent cellular cytotoxicity ; ADCC)や補体依存性細胞傷害活性(complement-dependent cytotoxicity ; CDC)といった抗体特有のエフェクター機能が備わっている。ADCC は、Fab領域を介して標的細胞に結合した抗体のFc領域が、ナチュラルキラー(NK)細胞や活性化マクロファージなどのエフェクター細胞に発現する Fcγ受容体に結合することで発揮される。 近年、多くの抗体医薬の臨床成績が明らかになるにつれ、特に癌に対する抗体医薬の主要な薬効メカニズムの1つが ADCC であることが明らかにされた。具体的には、非ホジキンリンパ腫や乳癌患者の Fcγ受容体の多型解析から、抗 CD20抗体リツキサン®(リツキシマブ)や抗 Her2抗体ハーセプチン®(トラスツズマブ)のいずれにおいても、抗体の Fc 領域と親和性の高い Fcγ受容体Ⅲa アロタイプを持つ患者は、親和性が低い Fcγ受容体Ⅲa アロタイプを持つ患者より明らかに予後が良いという臨床結果が得られているしかし根本治療でないので癌は治りません。これは、Fc 領域と親和性の高い受容体アロタイプの患者は、低い受容体アロタイプの患者よりも高い ADCC を惹起できるためと考えられ、これら癌治療抗体の薬効として ADCC の寄与が大きいことを強く示唆している。アロタイプとはアロは「その他または標準とは異なる」を意味します。アロタイプは抗体クラス間で見られる免疫グロブリン(抗体)のバリエーションであり、単一の脊椎動物種に存在する免疫グロブリンの不均一性を示します。
また、抗体のCDC は、抗原と結合した抗体に補体因子 C1q が会合することにより古典的経路と呼ばれる補体経路が活性化されることによって発揮される。実際、いくつかの癌治療用抗体は CDC を有しており、リツキサン® よりも強いCDCを有する抗CD20抗体アルゼラ®(オファツムマブ)は、難治性慢性リンパ性白血病に対してリツキサン® よりも高い奏功率を示すといった結果が得られている。 近年では、中和作用と抗体のエフェクター作用の他にも、抗体に低分子の抗癌剤や核酸医薬、放射性核種を結合させ、敵である標的細胞にこれらの薬剤を送達するといった試みも盛んに行われている。ポテリジェント技術の開発経緯については、上述したとおり、抗体の主要なエフェクター機能であるADCCは治療用抗体の薬効発現に重要な役割を果たしているのですが、昔からその薬効発現にはin―vitroとin ―vivoにおいて乖離があることが知られていた。実際、in vitroでは10ng/mL 以下で十分な細胞傷害活性を示すことができる抗体が、in vivo では10μg/mL と1000倍もの濃度が必要となる場合がある。最近になって、この原因の1つが血液中に存在するイムノグロブリン(以下 IgG)の存在だということが示された。In―vitro で、抗体の ADCC を測定する際にヒト血清を添加すると、その活性が大幅に抑制される。これは、血清中に存在するIgGが抗体と競合し、エフェクター細胞上のFcγ受容体への抗体の結合を阻害するためだと考えられる。ヒト血液中には10mg/mLもの莫大な量のIgGが存在しているため、抗体が血中 IgG に打ち勝つために、数~数十 mg/kg もの高用量の投与が必要となっていたことが推測できる。すなわち、エフェクター活性ADCCを主薬効とする抗体医薬においては、ヒト血中IgGに負けない Fcγ受容体への親和性の増強が鍵となっているといえるだろう。 このような中、抗体の Fcγ受容体への親和性を向上させる試みが盛んに研究され、既にいくつかの確立された技術が報告されている。その1つであるポテリジェント技術は、抗体 Fc 領域に存在するフコース修飾を除去することによって、Fcγ受容体Ⅲa への親和性を顕著に増強させる技術である。フコース修飾とはフコースは糖鎖を構成する単糖の一つであります。フコシル化糖鎖には様々な生理活性がありますが、がん・炎症と最も関係が深い糖鎖修飾の1つです。シアリルルイス型糖鎖を介したがんの血行性転移に関与したり、肝がんに対しても様々な腫瘍マーカーとして臨床応用されています。
抗体の糖鎖構造は、mannosyl-chitobiose core 構造を基本構造とする N-グリコシド結合複合型糖鎖であり、ガラクトース、バイセクティング N-アセチルグルコサミン、シアル酸の有無、根元のフコースの有無のバリエーションが報告されている。mannosyl-chitobiose core 構造抗体の糖鎖はエフェクター機能の発現に必須であり、糖鎖を持たない抗体は ADCC を消失してしまう。長い間、抗体の糖鎖と ADCC の関係は不明であったが、2000年代になり、N-グリコシド結合複合型糖鎖の根元のフコースこそが抗体のADCC に最も影響を与えることが明らかとなった。
同じ抗体遺伝子の発現ベクターを導入しても、取得された抗体の ADCC は、その抗体を生産した宿主細胞によって大きく異なる現象が見られた。抗体のアミノ酸配列には相違が観察されないことから、糖鎖構造の違いにその原因があると考え抗体糖鎖のフコース含量と ADCC に負の相関関係が認められた。そこで、抗体糖鎖のフコースを除去した抗体は、抗原結合活性や CDC に影響することなく、ADCCのみが従来の抗体の100倍以上と顕著に増強されていることが見出された。このタンパク質の糖鎖中のフコース含量を低下させる糖鎖工学技術はポテリジェント技術(POTELLIGENT® Technology)と命名された。ポテリジェント技術を応用し、抗体Fc 領域の糖鎖からフコースを除去した抗体をポテリジェント抗体と称されることになりました。
ポテリジェント抗体のメカニズムについては ポテリジェント抗体の詳細な解析により、抗体糖鎖の低フコース化により NK 細胞上の Fcγ受容体Ⅲa への親が上昇していることが明らかとなった。このため、抗体を介して NK 細胞が効率よく活性化され、標的細胞に対して高い ADCC が惹起される。興味深いことに、ヒト血中内在性のIgGよりもFcγ受容体Ⅲaへの高い親和性を持つポテリジェント抗体は、血中IgGが存在してもその ADCC はほとんど阻害を受けないことが明らかとなった。これは、ポテリジェント抗体が臨床においても低濃度で高い効果を示すことの裏づけとなっている。 また、最近の構造生物学的な解析により、ポテリジェント抗体が Fcγ受容体Ⅲa に高い親和性を有する理由が明らかとなった。ポテリジェント抗体と、細胞外領域のみからなる可溶型Fcγ受容体Ⅲaの複合体のX線結晶構造解析の結果、両分子間の結合は、蛋白質同士の相互作用のみならず、糖鎖と蛋白質の相互作用、さらに糖鎖同士の相互作用により媒介されていた。しかし、抗体糖鎖にフコースが付加されると立体障害が生じ、複合体が不安定化してしまう。さらに、Fc 領域のチロシン残基(Tyr296)が複合体形成の安定化に寄与しているが、抗体糖鎖のフコースは Tyr296と抗体分子内で相互作用することによりその動きを制限し、抗体分子と受容体の複合体安定化を阻害していた。抗体糖鎖におけるフコース修飾の有無という微細な構造の差異が、抗体分子とFcγ受容体Ⅲa との相互作用にこれほど大きな影響を与えることは非常に興味深い。
ポテリジェント抗体の臨床開発については ポテリジェント抗体は、天然型糖鎖構造を有する抗体分子の中で最強の ADCC を発揮することが判明している。4すなわち、低い用量で高い ADCC を発揮することができるため、従来の抗体医薬を用いた治療では効果が不十分であった癌細胞の効率的な除去や、発現量の低さから抗体医薬の標的とはなりえなかった分子への適応拡大といったことが期待できる。また、ポテリジェント抗体は、既存の抗体医薬に対して低い親和性しか示さないFcγ受容体Ⅲa アロタイプの患者のエフェクター細胞においても高い ADCC を惹起することができる。よって、従来の抗体医薬を用いても治療効果が得られにくかった患者への適応が期待される。また、フコース修飾のないN-グリコシド結合複合型糖鎖が付加された IgG はヒト血液中にも存在する天然構造であるため、抗原性を心配する必要はない。このように、高薬効かつ安全な技術として期待されるポテリジェント技術は、現在、複数の臨床開発段階の抗体医薬に用いられている。さらに、2012年3月、日本においてポテリジェント技術を用いた世界初の抗体医薬として、ヒト化抗 C-C ケモカイン受容体4(CCR4)抗体ポテリジオ®(モガムリズマブ)が承認された。CCR4とは何でしょうか?CCケモカイン受容体4です。 白血球、主にT細胞の表面に発現しているタンパク質で、免疫細胞の浸潤に関わる。 成人T細胞白血病/リンパ腫(ATLL)などの造血器腫瘍の一部に高発現しているため、分子標的治療の標的となっている。ポテリジオ® は厚生労働省より CCR4陽性の成人T 細胞白血病リンパ腫(ATL)の希少疾病用医薬品として指定されており、臨床試験において、ポテリジオ®1回量1.0mg/kg を1週間間隔で8回投与により、ATL細胞の長期にわたる消失が確認された。また、CCR4は ATL の他にも末梢性 T 細胞リンパ腫(PTCL)や皮膚 T 細胞リンパ腫(CTCL)等でも発現が認められることから、これらの疾患においてもポテリジオ® の効果が期待されており、実際に日本をはじめ米国および欧州において臨床試験が進められている。また、現在、癌領域のみならず、免疫/アレルギー領域においても、テリジェント技術を応用した複数の抗体医薬品が臨床開発段階にある。おわりに 日本で開発に成功したポテリジェント技術は、内外の製薬企業に導出され、次世代抗体医薬として医療の現場に新たな価値を提供し始めようとしている。また、本稿で紹介したポテリジェント技術の他にも、Fc 領域のアミノ酸改変技術をはじめとするさまざまな改良型抗体が開発され、臨床応用のための研究が進められている。これらの技術は、標的分子や対象疾患に応じて最適な技術を組み合わせることで、抗体医薬の分子標的薬としての効果を最大限に高めることが期待される。その一方、抗体医薬は標的分子が明確であるため、標的分子と疾患のバイオロジーの解明が不可欠であり、これからの抗体医薬の研究開発においては、より高度なサイエンスが求められる時代になってきているといえるだろう。 ポテリジェント技術がより良い医療の実現に貢献できることを願いつつ、さらなる抗体医薬の発展に尽力していきたいと考えている。しかしポテリジェント技術も癌の原因はヘルペスであることを全く認めていないので対症療法的な癌医療で終わるのは言うまでもないことです。癌についてはここを読んでください。
濾胞樹状細胞(follicular dendritic cell略して FDC )はどんな細胞で樹状細胞と何が違いどんな役割がありどこに住んでいるかを見ていきましょう。濾胞樹状細胞(follicular dendritic cell略して FDC )が突然出てきたのは濾胞性樹状細胞(follicular dendritic cell略してFDC)はF DC 受容体である CR1、CR2、以外に抗体のFc部分に対する受容体である FcγRIIb の3つの受容体を補体も持っていることが分かったからです。勿論、補体も抗体もオプソニン化された抗原を捕捉してしまいます。それでは抗体のFc部分に対して濾胞性樹状細胞が持っている抗体のFc部分に対する受容体の FcγRIIb FcγRIIb受容体はどんな役割があるや更に補体についても詳しく復習のつもりで勉強しましょう。例のごとく一言で説明しきれませんのでややこしいですが繰り返し見方を変えて説明しますからついてきてください。
濾胞樹状細胞 (follicular dendritic cell略してFDC) とはリンパ濾胞(別名はリンパ小節)の胚中心に存在する間質細胞と言えます。抗原を捕捉するが、細胞内には取り込まず細胞表面に保持する。T細胞に抗原を提示する樹状細胞と異なり、保持した抗原によりB細胞と相互作用してB細胞を活性化します。一般の樹状細胞とは違って骨髄の造血幹細胞には由来しておらず、MHC II も発現していない。リンパ濾胞はリンパ小節(lymph nodule)とも呼び、Bリンパ球と濾胞樹状細胞( follicular dendritic cell、樹状細胞とは無関係)から成る。胚中心を持たないリンパ小節を一次小節、胚中心を持つリンパ小節を二次小節と呼ぶ。胚中心については後で説明します。リンパ小節(リンパ濾胞)を持つ散在性リンパ組織は消化器(腸管関連リンパ組織)、呼吸器、尿生殖器などの壁内に高い頻度で出現する。リンパ小節(リンパ濾胞)が単独で存在しているものを孤立リンパ小節、複数のリンパ小節が集合しているものを集合リンパ小節と呼びます。
濾胞樹状細胞(follicular dendritic cell略して FDC )は、丸い核、中心に位置する核小体、当たり障りのない分散したクロマチン、および隣接する核膜の平坦化を備えているのは一般の組織にいるT細胞に抗原提示する普通の樹状細胞( dendritic cell略して DC )と同じことですが、一方、濾胞樹状細胞はリンパ濾胞にいるB細胞に抗原提示してB細胞を活性化する点が大きな違いです。
濾胞樹状細胞(follicular dendritic cell略して FDC ) は、すべての二次リンパ器官に存在しているリンパ濾胞のB 細胞領域に生まれつき住み着いている免疫系の細胞です。リンパ濾胞にはBリンパ球が集まっているB 細胞領域とT細胞が集まっているT 細胞領域の二つの領域があります。それぞれ役割が異なります。二次リンパ器官には大きく分類すると①リンパ節②脾臓③粘膜関連リンパ組織の三種類があります。
すべての二次リンパ器官が必ず共通に持っている解剖学的な特色はリンパ濾胞を持っていることです。骨髄で生まれた普通の樹状細胞(dendritic cell略してDC) はT細胞に抗原提示を行う樹状細胞なのです。ところが、濾胞樹状細胞(follicular dendritic cell略して FDC ) はB細胞に抗原を提示する樹状細胞で全く違った細胞がFDCなのです。濾胞樹状細胞(follicular dendritic cell略して FDC ) は普通の骨髄造血幹細胞に由来せず、間葉起源で胎児であるときにすでに生まれつつあるのがFDCです。リンパ濾胞の濾胞とは何でしょうか?濾胞とは、球状の構造のことリンパ節や甲状腺などになどにある球状の形になっていくつか散らばった構造をとっています。リンパ節の濾胞はリンパ濾胞といいます。 herpesウイルスや細菌などの病原体が侵入していない通常の正常なリンパ節の、球状のリンパ濾胞のイメージとしては球状構造の全体にB細胞が散在して広がっておりその球状の中心部に濾胞樹状細胞がいくつか集まっています。ウイルスや細菌などの異物が補体や抗体に補足されて侵入してきて初めては大きく変化していきます。リンパ濾胞まで補体や抗体で運ばれてきた病原体を濾胞樹状細胞(follicular dendritic cell略して FDC )は補体や抗体から奪い取りこれらの抗原をナイーブ B細胞に提示するとB細胞の抗原レセプターは自分が認識できる抗原と順番に結びつくとB細胞が活性化されて増殖し始めてはどんどん数を増やしていきます。するとB細胞の中心部が大きくなっていきます。このB細胞が増えて大きくなった中心部を胚中心(germinal centar)とか二次リンパ濾胞と呼びます。元の中心部をprimary lymphoid follicle(一次リンパ濾胞)と呼びます。例えば、風邪などで病原体の感染があるとリンパ節が腫れることがあるのは以上述べたメカニズムのためなのです。
FDC の機能には、ナイーブB 細胞を活性化するために補体や抗体が組織から補足してきた抗原をFDCが奪い取りナイーブなB 細胞に提示して活性化すること、胚中心からの破片の除去の促進などもあります。
濾胞性 DC は、三つの二次リンパ器官である①リンパ節、②脾臓、③粘膜関連リンパ組織(MALT)のリンパ濾胞の中心部にある B 細胞領域の一次および二次濾胞に見られる二次リンパ器官の住民となってしまっている非遊走性集団で二次リンパ器官から外へ出ることはない住民となっているのです。③粘膜関連リンパ組織(MALT)の代表がパイエルパッチなのです。濾胞性 DCとB 細胞は、FDC 内での胞活性化とB 細胞の増殖のプロセスの間の二つの細胞間の密接な相互作用の安定したネットワークを形成します。濾胞性 DC ネットワークは通常、濾胞の中心を形成し、別の濾胞領域には及びませんがB 細胞が成熟したかをテストされるすぐ 隣にあるT 細胞ゾーンには行き来があります。
濾胞性DCは、補体受容体CR1およびCR2(それぞれCD35およびCD21)およびFc受容体FcγRIIb(CD32)の発現が高い。さらに、FDCに特異的な分子マーカーは、FDC-M1、FDC-M2およびC4である。他の DC やマクロファージとは異なり、FDC は MHC クラス II 抗原分子を欠き、パターン認識受容体をほとんど発現しないため、オプソニン化されていない抗原を捕捉する能力がほとんどありません。
濾胞性DC(follicular dendritic cell)は、間葉前駆体から発生します。TNF-αおよびリンホトキシン(LT)によって媒介される FDC 前駆体とリンパ系細胞との相互作用は、正常な FDC の発生と維持にとって重要です。TNF-α はTNFRI 受容体に結合しますが、リン補トキシン(LT) はFDC 前駆体上に発現するLTβ 受容体と相互作用します。
濾胞性樹状細胞(follicular dendritic cell略してFDC)はF DC 受容体である CR1、CR2、および FcγRIIb の3つの受容体を持っており、補体または抗体によってオプソニン化された抗原を捕捉(結合)します。FcγRIIb受容体はどんな役割があるのでしょうか?つまりヘルペスウイルスのような病原体と免疫複合体を作った抗体はどんな仕事をするのでしょうか?濾胞性樹状細胞(FDC)受容体であるCR1、CR2とは何でしょうか?補体系は30種類以上の蛋白質からなり、自然免疫及び獲得免疫の活性化などに重要な役割を持つ。補体活性化経路 補体は多くのステップを経て活性化されるが、その経路には、古典経路、第二経路、レクチン経路の3つがある。また、これらの経路における最終ステップであるC5から膜侵襲複合体(MAC)に至る最終ステップは後期経路と呼ばれる。古典経路は抗体による抗原認識、レクチン経路はレクチンによる糖鎖認識、第二経路は病原体表面の活性化物質によってそれぞれ活性化される。また、異物排除に特に重要とされるのはC3bの結合以降のステップである。
補体の主な機能と特性は、補体の主な機能としては、①病原体をオプソニン化してマクロファージによる貪食を促進すること、②MACを形成して溶菌作用を促進すること、③補体フラグメント(C3a、C5a)による炎症反応の誘発などがある。このような補体の機能は、補体がそれぞれ特異的免疫細胞や白血球などが持っているレセプターに結合することにより発揮される。例えば補体のフラグメントである補体のC3bとC4bは免疫細胞が持っているレセプターであるCR1(CD35)と結合し、C3dとC3dgはCR2(CD21)と結合し、iC3bはCR3と結合し、C1qはC1qRと結合し、C3aはC3aRと結合し、C5aはC5aRなどと結合するとその機能は様々であります。例えば、C3aとC5aは好中球、マクロファージ、血管内皮細胞などに発現するC3aRとC5aRにそれぞれ結合して、炎症反応である他の細胞の走化性、活性化をもたらし、血管透過性亢進などを誘発するのです。
補体機能の特性としては、①古典経路による補体C1活性化には抗原に結合し構造変化を起こした二個以上の抗体のFc部分が2個以上必要であること、②MAC(膜侵襲複合体)形成の程度により細胞破壊まで至るMACとそこまで至らないMAC(sublytic MAC)が存在し、このsublytic MACは炎症性サイトカイン様作用を持つこと、sublytic MACの訳は亜分解性膜攻撃複合体③別の経路(alternative-pathway)による抗体産生の促進がみられることなどがある。
補体の欠損は、様々な疾患の原因となる。補体活性化経路の初期の活性化による前期成分が欠損した場合には、感染症、herpesが原因である自己免疫性疾患(全身性エリテマトーデス、関節リウマチ、糸球体炎、橋本病など)の病名がつけられることになる。一方、後期成分であるC5 ~ 9が欠損した場合には、髄膜炎菌感染症のリスクが高まる。
補体は多くの機能や疾患に関与しているため、補体は様々な疾患治療における治療の重要なターゲットとされ、すでに抗補体療法が臨床応用されている。例えば、人工モノクローナル抗体であるエクリズマブは補体活性化経路においてヒト補体C5がC5aと C5bにの開裂するのを阻害することにより、終末補体複合体C5b~9の生成を阻害するヒト化C5モノクローナル抗体である。エクリズマブは最初、発作性夜間ヘモグロビン尿症(PNH)を適応として承認され、その後、非典型溶血性尿毒症症候群(aHUS)への適応を広げ、2017年12月には重症筋無力症(MG)にも適応を広げている。
いくつかの免疫性神経疾患の発症や進行にはこの世にない嘘の自己抗体実はherpesウイルスや補体が深く関与しており、代表的な疾患として重症筋無力症(MG)、視神経脊髄炎(NMO)、ギラン・バレー症候群(GBS)があるが自己抗体という抗体は存在しないので重症筋無力症(MG)も、視神経脊髄炎(NMO)も、ギラン・バレー症候群(GBS)もヘルペスによって起こる疾患であるのです。
重症筋無力症(MG)は、日内変動を伴う筋の易疲労性・脱力を主徴とする神経疾患であるのも原因はherpesウイルスなのですが、MGは、神経筋接合部の後シナプス膜に存在するニコチン性アセチルコリン受容体に対する自己抗体である抗アセチルコリン受容体抗体(抗AChR抗体)が神経伝達をブロックすることで発症するといわれるのですが自己抗体が原因ではないのです。それ以外にも、MGの病態には、抗AChR抗体による抗原性の修飾や、補体介在性の後シナプス膜傷害などが深く関与していると言われますがヘルペスと免疫との炎症によって起こったのです。自己免疫疾患も自己抗体もこの世には絶対に存在しません。存在しない理由は多すぎるほどあるのですがあらゆる抗体が作られるには自然免疫が
まず最初に自己の成分を抗原提示細胞が持っているTLRで「危険である敵」であることを認識してその自己の成分を危険であるというシグナルを免疫システムに伝えなければ獲得免疫が抗体を作ることは絶対に不可能であるからです。自己の成分ほど安全な蛋白がどこにありますか???????近いうちに自己免疫論者の何10か所も存在するもある間違いの論理を徹底的に暴くつもりです。極めて長い論文になりますが乞うご期待を!!!!!
1 全身型重症筋無力症における抗補体薬ソリリスの可能性 ES1-1 補体系からみた自己免疫性神経疾患の病態 東北大学医学部神経内科 黒田 宙 先生 本講演では視神経脊髄炎(NMO)、ギラン・バレー症候群 (GBS)を取り上げているが、エクリズマブの両疾患に対する適応 はない。 補体系は30種類以上の蛋白質からなり、自然免疫及び獲得免 疫の活性化などに重要な役割を持つ。 補体活性化経路 補体は多くのステップを経て活性化されるが、その経路には、古典経路、第二経路、レクチン経路の3つがある。また、これ らの経路における最終ステップであるC5から膜侵襲複合体(MAC)に至る最終ステップは後期経路と呼ばれる。古典経路は 抗体による抗原認識、レクチン経路はレクチンによる糖鎖認識、第二経路は病原体表面の活性化物質によってそれぞれ活性化される。また、異物排除に特に重要とされるのはC3bの結合以降のステップである。補体の主な機能と特性については補体の主な機能としては、①病原体をオプソニン化してマクロ ファージによる貪食を促進すること、②MAC(膜侵襲複合体)を形成して溶菌作用を 促進すること、③また補体フラグメント(C3a、C5a)による炎症反応の 誘発などがある。下の図2と表1を見ながら読んでください。このような補体の機能は、補体がそれぞれ特異的レセプター C3bとC4bの補体はCR1(CD35)と言うレセプターと結合します。C3dとC3dgの補体はCR2(CD21)と言うレセプターと結合します。iC3b はCR3、C1qはC1qR、C3aはC3aR、C5aはC5aRなどに結合することにより補体の機能が発揮されるのです。その機能は様々であり、例えば、C3aと C5aは好中球、マクロファージ、血管内皮細胞などに発現する C3aRとC5aRにそれぞれ結合して、炎症反応(走化性、活性化、 血管透過性亢進など)を誘発するのです。
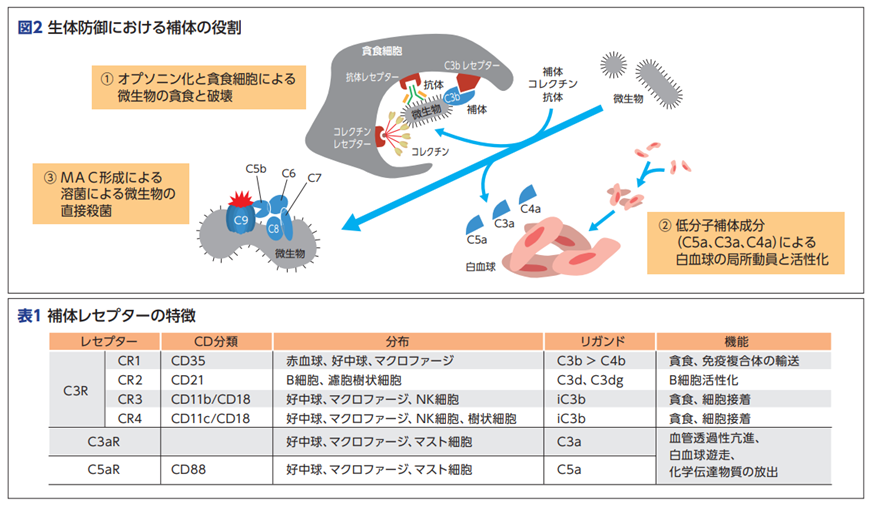
表1の「補体レセプターの特徴」を見て理解できますか?レセプター(受容体)を持っているのは分布の項目にある赤血球以外の免疫細胞であるB細胞、好中球、マクロファージなどが持っているレセプター(受容体)なのです。リガンドの項目を見てください。リガンドは免疫細胞が持っているレセプター(受容体)に結合する補体が持っているリガンドなのです。補体は30種類以上あります。例えば補体のリガンドにはC3b, C4b ,C3a, C5a, C3d,C3dgなど30種類以上あります。リガンドは受容体と結合するものです。
リガンドとは機能蛋白質であるレセプターに特異的に結合する物質と定義されます。細胞表面にあるレセプター(受容体)とリガンドはいわば鍵穴と鍵の関係にあります。鍵穴の受容体に鍵であるリガンドが結合すると、受容体はそれを何らかの信号に変換して、細胞内へその信号を送り機能が発揮されるのです。
補体機能の特性としては、①古典経路によるC1活性化にはIgM抗体やIgG抗体が抗原に結合し構造変化を起こした抗体のFc部分が2個以上必要であるこ と、②MAC形成の程度により細胞破壊まで至るMACとそこまで 至らないMAC(sub-lytic MAC)が存在し、sub-lytic MACのsub-lyticは「分解・破壊に至らない」と言う意味です。③別の経路(alternative pathway)による抗体産生の促進がみられることなどがある。補体の欠損は、様々な疾患の原因となる。補体活性化経路の前期成分が欠損した場合には、感染症は起こりやすくなりますが、自己免疫性疾患(全身 性エリテマトーデス、関節リウマチ、糸球体炎、橋本病など)の原因となると言われるのは嘘です。自己免疫性疾患はすべてヘルペスと免疫が戦って生じた病気ですから。一方、後期成分であるC5 ~ 9が欠損した場合には、髄膜炎菌感染症のリスクが高まるのは免疫が下がるので当然です。
補体は多くの機能や疾患に関与しているため、補体は様々な疾 患治療における重要なターゲットとされ、すでに抗補体療法が臨床 応用されているのは間違った療法です。例えば、エクリズマブは補体活性化経路におい てヒト補体C5の開裂を阻害することにより、終末補体複合体C5b ~9の生成を阻害するヒト化C5モノクローナル抗体であるのは間違った病気つくりの薬です。モノクローナル抗体であるエクリズマブは最初、発作性夜間ヘモグロビン尿症(PNH)を適応として 承認され、その後、非典型溶血性尿毒症症候群(aHUS)への適 応を広げ、2017年12月には重症筋無力症(MG)にも適応を広げているのはこれらの病気はherpes感染であることを証明しているのです。重症筋無力症(myasthenia gravis, 略してMG)とは何でしょうか?重症筋無力症 (myasthenia gravis, MG)は神経・筋接合部のアセチルコリン受容体 (AChR)あるいは筋特異的チロシンキナーゼ (muscle-specific receptor tyrosine kinase略してMuSK)に対する自己抗体が原因となる自己免疫疾患ですと言われますが間違いです。自己免疫疾患は絶対に存在しないから自己抗体のできるわけは無いのです。昔はこの自己抗体もIgMでしたが現在はIgGとなっています。何故なのかわかりません。いずれ解明します。というのはIgMは生まれたばかりのすべてのB細胞は抗原との出会いの有無にかかわらずこの世のすべての何億種類の有機物に対して自己の成分を含めて病気が有っても無くてもあらゆる種類のIgM抗体を作れるのです。しかしIgG抗体はリンパ節で様々な免疫細胞の力を借りて体細胞超突然変異や抗体のクラススイッチを時間をかけて実行しなければB細胞はIgG抗体は作れないのです。存在しない自己免疫疾患に対してIgG抗体が作れるのか謎だらけです。必ず解明します。さらに同じ自己免疫疾患でもその自己免疫疾患に特有な自己抗体を持っていない人がいくらでもいるのは何故かの謎をもいずれ解き明かして見せます。全ての謎にはherpes感染によって遺伝子の組換えが行なわれたからであることは分かっています。このあとも間違った標準医療の理論を批判しながら述べていきます。
神経から筋肉への指令を伝える“アセチルコリン”のはたらきを邪魔する抗体が作り出されてしまいのも間違いです。神経と筋肉との接合部の細胞にherpesが感染したから神経から筋肉に信号が伝わらなくなることが原因です。つまり重症筋無力症 (myasthenia gravis, MG)はherpes性神経変性疾患なのです。いくつかの免疫性神経変性疾患の発症や進行には自己抗体や補体が深く関与しており、代表的な疾患としてMG、視神経脊髄炎 (NMO)、ギラン・バレー症候群(GBS)があるのはherpesによるものです。 重症筋無力症(MG)は、日内変動を伴う筋の易疲労性・脱力を主徴とする神経疾患である。MGは、神経筋接合部の後シナプス膜に存在するニ コチン性アセチルコリン受容体に対する自己抗体である抗アセチルコリン受容体抗体(抗AChR抗体)が神経伝達をブロックすることで発症するのは間違いです。
視神経脊髄炎(Neuro-myelitis Optica略して NMO)は、重度の視神経炎と横断性脊髄炎を中核症状とする炎 症性中枢神経変性疾患である。NMOの原因となる自己抗体はアストロサイト足突起に多く存在する水チャネルタンパクaquaporin-4 (AQP4)を認識する抗AQP抗体であるのは嘘です。NMOの病態には、抗 AQP抗体及び補体介在性のアストロサイト傷害が深く関与している。例えば、急性期NMO病変においては、AQP4の 脱落、血管周囲への免疫グロブリンと活性化補体の沈着、炎症性 浸潤などがみられるのはherpesによる炎症のためです。また、AQP4-IgGが 細胞傷害性を発揮するには補体を必要とすることもヘルペスと免疫が戦う時には補体も大活躍するからです。NMO患者の髄液中にはC5aの上昇がみられ、 再発重症度と髄液中C5a濃度は相関することを確認できるのは正にherpesと補体がたたかっているからです。
ギラン・バレー症候群(Guillain-Barre Syndrome,略して GBS)は、急性~亜急性経過の自己免疫性末梢神経障害で脱髄型と軸索型に分けられるのは髄鞘や軸索の細胞にherpes感染があるからです。急性期には糖脂質に対する自己抗体(抗ガングリオシド抗体)が高率に検出され、病原体由来抗原 (Campylobacter jejuniなど)に対するmolecular mimicryが 存在するのもすべて嘘です。カンピロバクター・ジェジュニとは何でしょうか?Campylobacter jejuni は病原性細菌の一種で、ヨーロッパやアメリカで最も一般的な食中毒の原因の 1 つです。大多数の症例は、孤立したイベントとして発生します。Campylobacter ;カンピロバクターとは「彎曲した菌」、jejuni ;ジェジュニとは「空腸」を意味します。加熱不十分な肉、食肉製品、生乳や牛乳などから感染します。カンピロバクター細菌を含んだ水、氷なども感染源となります。カンピロバクター感染症は、人獣共通感染症です。
molecular mimicry(分子相同性)とは, 本来無関係である感染微生物抗原と宿主抗原の間に一次構造, あるいは高次構造の類似性が存在することをいうのですが実はギラン・バレー症候群(Guillain-Barre Syndrome, 略してGBS)の場合は. 本来、関係があるどころかGBSの原因である感染微生物であるヘルペスが免疫と闘って作られた抗体そのものをmolecular mimicry(分子相同性)と間違って想像しているだけです。抗原 GBSにおける髄鞘や軸索の傷害には補体が深く関与 しているのは髄鞘や軸索の細胞にherpesが感染しているからです。さらに免疫の補体もヘルペスを攻撃しているからです。
これらの免疫性神経疾患のなかで、全身型重症筋無力症に対 してはすでに抗補体療法としてヒト化C5モノクローナル抗体であるエクリズマブが使用可能です。ヒト化モノクローナル抗体製剤とは何でしょうか?ヒト補体成分の C5にのみ結合するモノクローナル抗体であるのでヒト化C5が付きました。補体C5に高い親和性をもって特異的に結合し、C5のC5a及びC5bへの開裂を阻害しますと免疫が下がり全身型重症筋無力症の病気原因であるherpesが増えることになります。薬の語尾に「~マブ」がつけられる遺伝子工学で作られた薬はきわめて高価なモノクローナル抗体で病気を治すために必要な免疫を抑制するだけであります。このような免疫だけしか病気を治せないのにその一番肝心な免疫を抑制する薬は絶対に病気は治せないどころか補体はすべての病原体と闘って殺せる自然免疫の代表である役割をエクリズマブで奪い取るのは言語道断です。自分の免疫の遺伝子が作る蛋白が最高の薬です。
モノクローナル抗体も症状を一時的に消す対処療法に過ぎないので原因治療ではないのでモノクローナル抗体を用いた治療で難病と言われる病気を治すことは絶対に不可能です。何故ならば現代のすべての病気の原因は先天性や後天性の遺伝子病やあらゆる原因不明の難病や自己免疫疾患や癌もすべてヘルペスが原因なのですが世界中の無責任な医者はherpesについては誰も言いません。それどころか免疫を抑える薬ばかりを作ってherpesを増やすばかりの病気つくりに専念して患者からお金をもらっている責任を果たしていないのです。哀しいですね。病気が無くなれば医者が不必要になりますからね。
今後、視神経脊髄炎(Neuro-myelitis Optica略して NMO)とGBSなどの免疫性神経疾患に関しても発症のメカニズムの解明がさらに進むとヘルペスが神経細胞に感染したためと分かるはずですが医者たちは口が裂けても言わないでしょう。より有効な治療薬の開発が期待されると研究者は口をそろえて言いますがこれも「嘘の期待ですから」どうにもなりませんね。絶望だけが肥大するばかりです。Neuro-myelitis Opticaの「Neuro」は「神経の」、「myelitis」は「脊髄炎」、「Optica」は「視力の、目の」という意味です。
免疫性神経疾患のすべてはherpesが感染した神経細胞で増殖するときの傷や酷い時には壊死や崩壊のために神経の正常な機能が失われてしまうからです。しかもすべての抗体医薬品は癌を治すことも勿論無理です。癌が発見されたときには癌の原因であるヘルペスは何百億個も人体にたむろしており転移性の癌であれば何千億個のherpesが増えてしまっているのでこのようにherpesが増えすぎた転移性の癌は何をやっても治すことは不可能です。癌についてはここを読んでください。
最後に補体系について、最終的に詳しくまとめてみましょう。
一体、補体とは、どのようなものでしょうか。補体系には多くの分子が関与しており、その作用機序や活性化機序はとても複雑です。近年、補体が関連するさまざまな疾患の病態が解明されるにつれ、補体と補体系に関する理解は急速に進展していますがこの理解を金儲けのために利用する医薬業界の人たちが免疫の働きを抑えるいろんなことを企んでいますが小手先で病気を治すことはできません。病気を治すのは36億年かけて完成した免疫でしか治せません。かつ病気の原因が何であるかを突き止めない限りは医薬業界は病気を治す免疫を助けることはできません。そこで今回も補体の免疫の役割りを完全に理解するため正常状態での補体の本来の役割、すなわち、生体防御において補体が果たす役割や、補体の活性化機序、さらには補体系を抑制する制御因子の機能と役割について勉強しましょう。
補体は、抗体の殺菌作用を補完する血清中の成分として発見され、従って「抗体を補助できる」補体(complement)と名づけられました。補体には大きく9つの成分があり、C1~C9と表されます。これらの補体成分を含む補体系は、40種以上の血清、または細胞膜タンパク質から構成される複雑なシステムなのです。この補体系の細胞膜蛋白は人体を構成している細網膜の蛋白は強力な補体から身を守るために出来上がった蛋白なのです。原始的な自然免疫のレベルでも自己免疫疾患が起こらないように人体の細胞を守るシステムを備えているのに高等免疫の抗体レベルで自己免疫疾患がこの世にあると思いますか?自然免疫の補体でも知っていることをはるかに進化したリンパ球が知らないほど馬鹿だと思いますか?補体は安っぽいIgM抗体と言われることもあるのですよ!!!

補体は自然免疫系の重要な要素の1つであり、活性化のカスケード反応を起こすことにより、生体防御において多くの役割を果たしているのです。しかし補体は自然免疫の手榴弾に似たところがるのでこの小型の爆弾の補体から人体の細胞守るために血清中や細胞膜上
補体系を抑制する様々な制御因子が存在しています。
それでは、補体の生体防御における役割について確認のためにもう一度見ていきましょう。
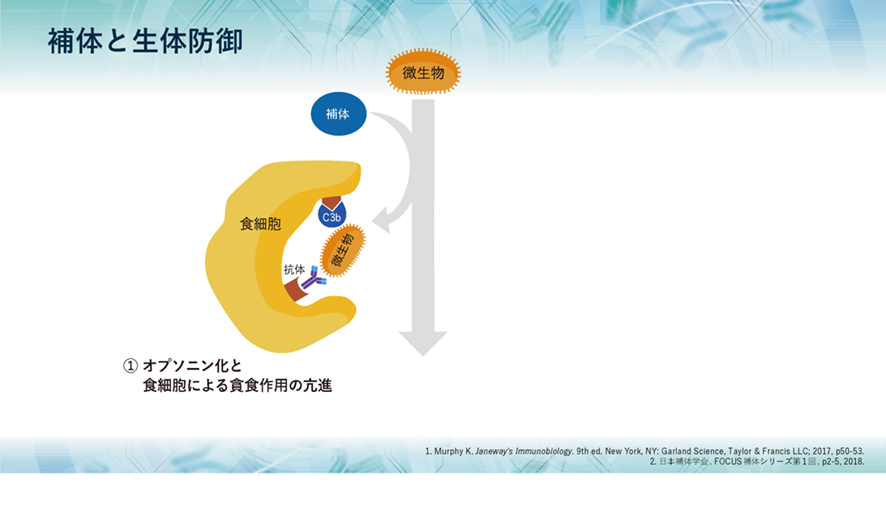
補体には大きく3つの役割があり、1つ目として、侵入してきた生きたherpesのような微生物や無生物である化学物質のような異物などに抗体がやっているように補体も真似をして結合して免疫複合体(抗原抗体複合体)となって敵を捕まえたよと言わんばかりに標識することで、すなわちオプソニン化することにより、食細胞に知らせて食細胞の貪食作用を高めます。また、異物排除とともに免疫複合体の除去も行うのです。
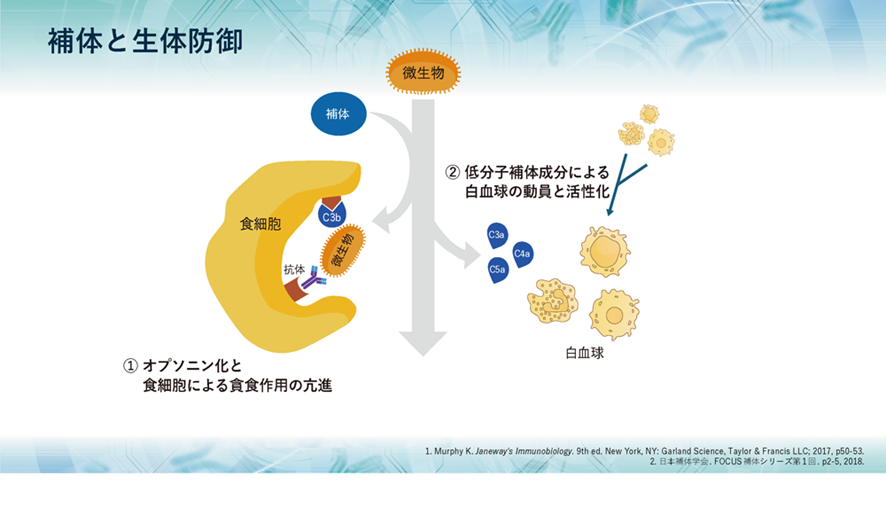
2つ目として、補体が活性化する過程で生成されるC5a、C3a、C4aなどが、血管から異物がある局所への白血球の動員を促進し、同時に白血球を活性化させます。
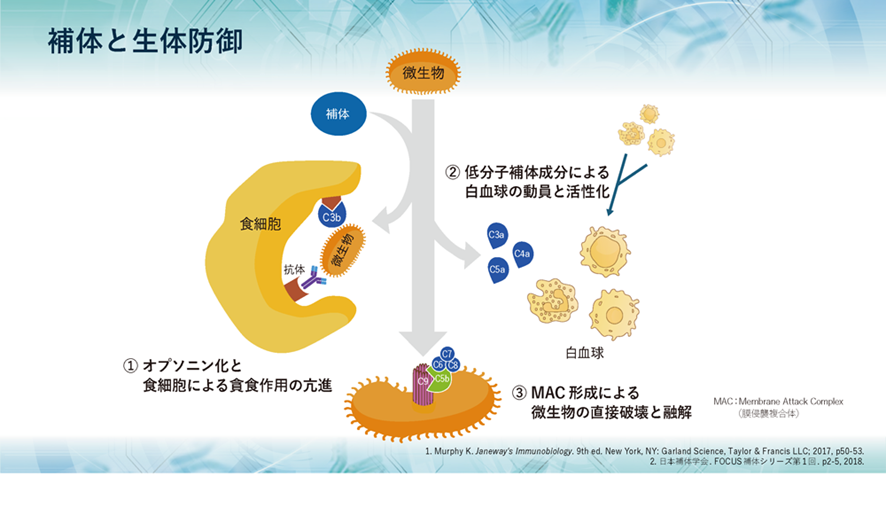
3つ目として、補体の活性化により最終的に生成されるC5bがC6~C9とともに膜表面に膜侵襲複合体(membrane attack complex略してMAC)を形成し、微生物などを直接破壊し融解します。
補体は活性化されないと上の三つの仕事ができないので、どのような機序で活性化されるのでしょうか?
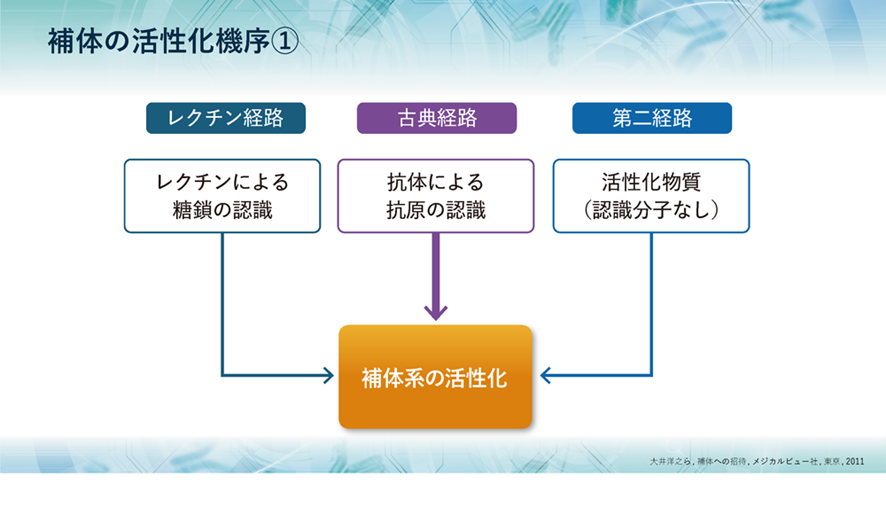
補体は、古典経路、レクチン経路、第二経路(副経路)の3つの経路により活性化されます。 古典経路は、抗体が抗原を認識し、抗原抗体反応することによって古典経路の何段階の活性化が開始されます。レクチン経路は、病原体の糖鎖と結合できるタンパク質のレクチンが、病原体の表面の糖鎖を認識することによって始動します。そして、第二経路は、C3が自然に活性化することによって始動します。
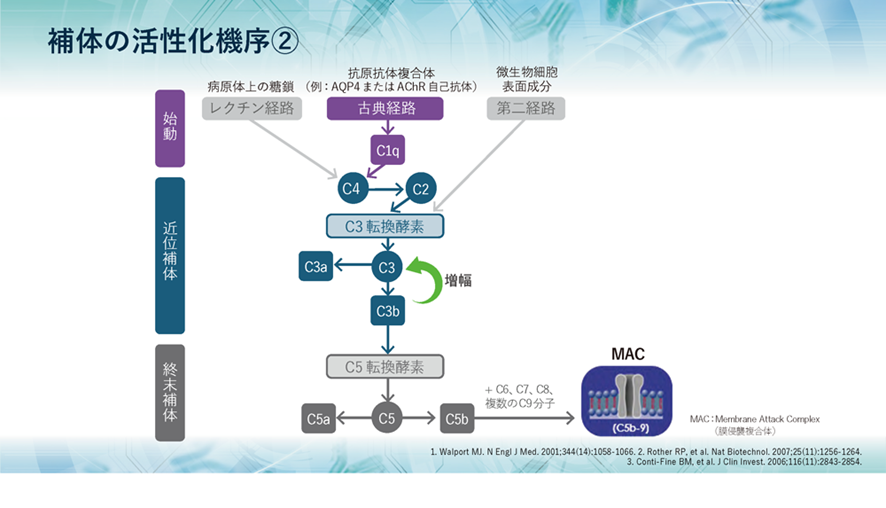
古典経路では、まず、補体のC1qが抗原抗体複合体に結合することによってC2、C4が活性化されます。その後は、レクチン経路、第二経路とも共通です。その共通の経路は、まずC3転換酵素によってC3aとC3bが生成され、さらにはC5転換酵素によってC5が開裂し、C5aとC5bが生成されます。そして、C5bはC6~C9とともに膜侵襲複合体、MACを形成するのは三つの経路は同じなのです。
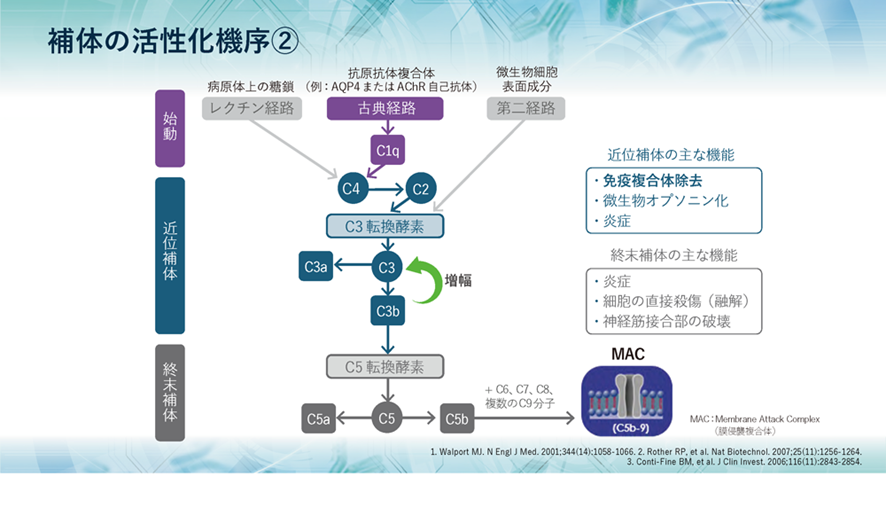
補体の活性化の過程で生成された補体成分の機能と役割についてみてみると、初期の活性化で生まれる近位補体のC3aは弱いアナフィラトキシンとして炎症を促進し、C3bはオプソニン化および免疫複合体除去に関与します。 また、終末補体のC5aは強力なアナフィラトキシンとして作用し、C5bはC6~C9とともに膜侵襲複合体、MACを形成し、病原体の細胞膜を破壊し、直接的な細胞融解作用を引き起こします。アナフィラトキシンとは肥満細胞や好塩基球に作用してヒスタミンを放出させ、血管透過性亢進や平滑筋の収縮を引き起こす IgEを介さないアナフィラキシーの機序の一つであります。
補体系の抑制系制御因子
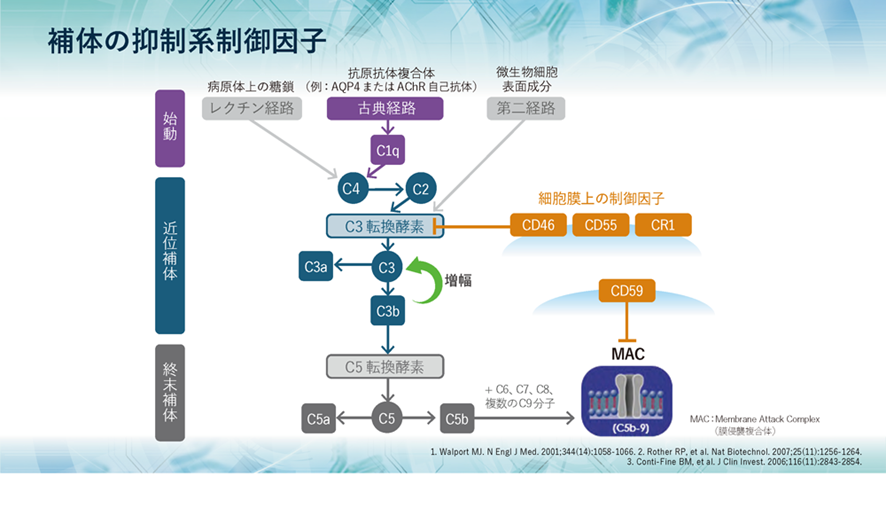
一方、血清中、または細胞膜上には、補体系を抑制する種々の制御因子が存在します。細胞膜上で機能するCD46やCD55はC3転換酵素を解離・失活させ、CD59はC5b~C8と結合し、C9の重合を阻害することによりMACの形成を阻害します。これらの膜タンパク質は、体内のほとんどすべての細胞に存在し、補体による侵襲が自己細胞に向かないようにコントロールしています。
補体系は,感染に対する防御に役立つ酵素カスケードである。多くの補体タンパク質が不活性の酵素前駆体(酵素原)として血清中に存在する;この不活性の酵素前駆体(酵素原)がカスケードのように順番に活性化していくのです。細胞表面に存在する補体タンパク質もある。補体(complement)とは、生体に侵入した病原微生物などの抗原を排除するための免疫反応を媒介するタンパク質の総称である。 「抗体の働きを補完する」という意味で、「補体」と名付けられた。 補体系ともいう。
補体系は以下によって 自然免疫と獲得免疫の療法の橋渡しをする:
①抗体応答および免疫記憶の増強
②異種細胞の溶解
④補体成分には多くの生物学的機能がある(例,走化性の亢進,アレルギー抗体である免疫グロブリンE(IgE)に依存しない肥満細胞の脱顆粒の誘発)。⑤オプソニン作用があります。
③免疫複合体およびアポトーシス細胞の除去も補体はできます。
オプソニン作用とは何でしょうか?補体や抗体が抗原に結合することによって、抗原が貪食細胞によって捕らえやすくなる現象を「オプソニン化(オプソニン効果)」と言います。
補体の活性化のために三つの補体活性化経路があります。
①古典経路では、抗原が抗体と結合することによって補体が活性化されます。この、抗原が抗体と結合したものを免疫複合体といいます。二個以上の免疫複合体に接触することで活性化した補体C1は補体C4を活性化し、その後補体C2から補体C8までが次々と連鎖的に活性化します。すると、抗原の細胞膜にC9の複合体が埋め込まれ、穴をあけて水や電解質を侵入させることで抗原を死滅させます。
②副経路では補体は免疫複合体を介さなくても活性化することができます。この経路を別経路または副経路といいます。この別経路では、C3が自発的に抗原に反応することで、C5を活性化させます。この後の連鎖は古典経路と同じく、C5、C6、C7、C8、C9と補体が順番に活性化され、最終的に病原体を死滅させます。
③レクチン経路では、血液中に存在するレクチン(タンパク質の複合体)の一つであるマンノース結合レクチン(MBL)が病原体と結合することによってC4が活性化されます。この後の連鎖は古典的経路と同様で、最終的には病原体を死滅させます。
補体活性化経路の三つの①古典経路,②副経路(別経路)③レクチン経路,C3転換酵素(C3 convertase)がC3をC3aとC3bに切断し始めると,最終の共通経路に収束する。略語の説明。Ab は 抗体。Ag は 抗原。C1-INH は C1インヒビター。MAC は 膜侵襲複合体。MASP は MBL関連セリンプロテアーゼ。MBLは マンノース結合レクチン。C1インヒビター(C1-INH)とは補体のC1の働きを抑えます。C1インヒビターは、主に肝臓で作られているたんぱく質です。C1インヒビターは多くの機能を持つたんぱく質なので、補体系に働くだけではなく、凝固・線溶系、キニン系などにも働くことで、それらの活性化に対してブレーキ(抑制)をかける重要な役目を担っています。例えば遺伝性血管性浮腫(C1インヒビター欠損症)があります。
遺伝性血管性浮腫(C1インヒビター欠損症)とはどんな病気なのでしょう。局所性で突発性の血管性浮腫であり、遺伝性におこる。C1 inhibitorの欠損あるいは機能異常によっておこり、その結果、補体系、凝固線溶系、キニン系が活性化し、生成されたブラジキニンが、血管透過性亢進、血管拡張などをおこすことで突発性に血管浮腫を呈する。
①古典経路②副経路③レクチン経路の三つの補体活性化経路の説明を詳しくしましょう。
①古典経路の成分は,C(補体)に加え,発見され同定された順番に基づく数字で表示されている(例,C1,C3)。②副経路の成分は,アルファベット(例,B因子,D因子)または名称(例,プロパージン)で表されることが多い。プロパージンとはP 因子(プロパージン)とも呼ばれ、補体の第二経路のC3 および C5の転換酵素が崩壊解離しないよう安定化させます。
古典経路の活性化には,以下の2種類がある:
- 抗体依存性はC1が,抗原-IgM複合体または凝集した抗原-IgG複合体と相互作用した場合に生じる。
- 抗体非依存性でポリアニオン(例としては,ヘパリン,プロタミン,アポトーシス細胞由来のDNAおよびRNA)や,グラム陰性細菌,または結合C反応性タンパク(CRP)がC1と直接反応した場合に生じます。プロタミンはヘパリン拮抗剤です。C反応性タンパク (C-reactive protein: CRP)とは、急性反応性タンパクの一つで、炎症のマーカーとして日常臨床で広く利用されている。 肺炎球菌のC多糖体と沈降反応するタンパクとして発見された。 分子量は105 kDa、5個のサブユニットが輪状に結合するペンタマー構造をとる。IgM5量体と似ていますね。結合C反応性タンパク(CRP)とは何でしょうか?
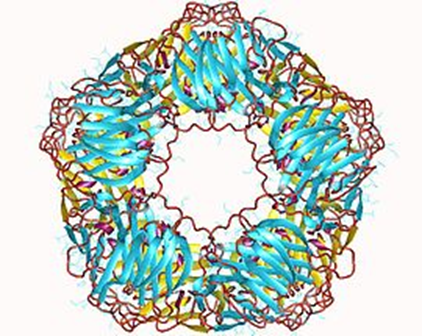
左図の絵でお分かりのようにC反応性蛋白(C-reactive protein、略してCRP)5つ結合しているCRPが結合C反応性タンパク(CRP)なのです。環状の5量体タンパク質であり、体内で炎症反応や組織の破壊が起きているときに血中に現れる。代表的な急性期反応タンパクの一つです。肺炎球菌のC多糖体と結合するためこの名がある。CRPはマクロファージとT細胞からのIL-6の分泌により、肝臓と脂肪細胞から分泌される。CRPは、死細胞や細菌表面のリゾフォスファチジルコリンに結合し、C1qを介して補体の古典的経路を活性化し、細菌の溶菌・凝集に関与する。リゾフォスファチジルコリンとは(LPC)は,酸化 LDL中 に含 まれる主要な脂質成分であり,動脈.硬化巣や炎症組織 において増加 する。
CRPの産生量は生きたherpesウイルスなどの病原体と免疫の戦いで見られる炎症反応の強さに相関するため、血清中のCRPを定量して炎症反応の指標になる。すなわち炎症が強いほど血清CRP値は高くなる。日本においては血液検査においてごく一般的に計測される。細菌感染では上昇しやすく、ウイルス感染ではアデノウイルスやherpesウイルスやherpesウイルスでは上昇は軽微から高値まである。通常の感冒では上昇しないことが多い。アデノウイルスとはアデノウイルスで最も典型的な症状は、扁桃腺炎です。扁桃腺に白苔(白い膿のようなもの)がついて、高い熱がでます。のどの奥の壁にはイクラのようなリンパ節の腫れがみられます。アデノウイルスは、かぜ(上気道炎)、胃腸炎、結膜炎、膀胱炎、股関節炎など、様々な症状をおこすウイルスです。アデノウイルスは,3つの主要なカプシド抗原(ヘキソン,ペントン,およびファイバー)によって分類されるDNAウイルスである。ヒトアデノウイルスには,7つの種(A~G)と57の血清型があるため、免疫がつきにくく、何回もかかることがあります。血清型によって異なる病態がみられる。結膜炎を合併した咽頭結膜熱(プール熱)になることもあります。
CRPの上昇の程度には同様の疾患で同程度の重症度の場合でも、大きな個人差があります。一人の患者の経過を観察するために有用な指標といえる。ヘルペスウイルスは潜伏感染するのでヘルペスウイルスのCRPの経過を正しく判断するのは実は極めて困難です。
また、細菌性感染の炎症開始から6時間程度は上昇せず、反応が遅いので、炎症早期の指標としては白血球の左方移動、白血球数増加の方が有用である。日本以外では炎症の指標として一般的に用いられることはなく、英語論文における炎症や感染症の指標はもっぱら白血球に依存しているが、最近では心疾患で測定されることがあるのはherpesが心筋細胞や心臓を支配する自律神経にも感染することが分かったからです。
補体の古典経路は,C1インヒビター(C1-INH)によって制御されています。 C1インヒビターとはIgM5量体がC1のC1qに結合するとC1-INH(C1インヒビター)の抑制が取れて古典経路の活性化が開始されるのです。
遺伝性血管性浮腫(HAE)とは何でしょうか?遺伝性血管性浮腫はC1-INH(C1インヒビター)の遺伝的欠損が原因です。血液中に存在しているC1インヒビター(C1-INH)は古典経路の活性化以外にさまざまな機能を担っています。そのうちのひとつが、「ブラジキニン」の量が増えすぎないようにすることです。「ブラジキニン」は血圧の調節や炎症にかかわっていて、ブラジキニン受容体にくっつくと、むくみや強い痛みを引き起こします。健康なヒトでは「ブラジキニン」が増えすぎないよう、C1インヒビターがブレーキをかけています。しかし、遺伝性血管性浮腫(HAE)の患者さんではC1インヒビターが少なかったり、うまく働かなかったりするので「ブラジキニン」が増えやすい状態になっています。具体的には、「抜歯」「手術」「ストレス」「疲れがたまる」などの刺激により「ブラジキニン」が増え、ブラジキニン受容体にどんどんブラジキニンがくっつき、激しい腫れやむくみ、腹痛が起こるのです。
- レクチン経路の活性化は抗体非依存性です。血清タンパク質のマンノース結合レクチン(MBL)がマンノース,フコース,または細菌の細胞壁,酵母細胞壁,もしくはウイルスのN-アセチルグルコサミン基に結合した場合に生じる。このレクチン経路は,他の点では構造的および機能的に補体活性化経路の古典経路と似ている。
- 副経路の活性化は,微生物細胞表面の成分(例,酵母細胞壁,内毒素である細菌細胞壁リポ多糖体)または免疫グロブリンなどが少量のC3を切断した場合に生じる。この経路は,プロパージン,H因子,および崩壊促進因子(CD55)によって制御されています。プロパージンとは補体P 因子(プロパージン)とも呼ばれ、補体第二経路のC3 および C5転換酵素が崩壊解離しないよう安定化させます。例えばプロパージンは副経路C3転換酵素の半減期を6〜10倍延長できるのです。
H因子とは何でしょうか?補体制御因子の一つです。補体は自然免疫ですから自己非自己の見境なく攻撃しようとするので、補体制御因子は、補体活性化から自己組織を守ってくれている因子です。H因子,I因子,CD46などがあります。補体制御因子のI因子は,CD46(membrane cofactor protein略してMCP訳して膜補因子タンパク質)を含む補因子とともに,C3bおよびC4bを不活化して補体の,C3bおよびC4bの働きを抑制するのです。membrane cofactor protein(膜補因子タンパク質)とはCD 46とも呼び、膜補因子タンパク質 (MCP) は補体系の膜調節糖タンパク質であり、自己細胞膜に結合した C3b および C4b を不活化する第 I 因子の補因子として作用します。MCPは、赤血球、線維芽細胞、上皮細胞および内皮細胞を除くヒトの末梢血細胞に存在し、最近では消化管を含む他の臓器にも存在しています。
この3つの活性化経路は,C3転換酵素がC3をC3aとC3bに切断すると,最終の共通経路に収束する。C3の切断により,補体系の細胞傷害性成分である膜侵襲複合体(MAC)の形成に至ることがある。MACは,異種細胞の溶解を引き起こす。
I因子は,CD46(membrane cofactor protein)を含む補因子とともに,C3bおよびC4bを不活化する。
補体の欠損または異常
特定の補体成分の欠損または異常は,固有の疾患と関連している;以下はその例である:
C1,C2,C3,MBL,MBL関連セリンプロテアーゼ2(MASP-2),H因子,I因子,または補体受容体2(CR2)の欠損:細菌感染症に繰り返し罹患しやすい
C5,C9,B因子,D因子,またはプロパージンの欠損: ナイセリア感染症に罹患しやすい
C1,C4,およびC5の異常: 全身性エリテマトーデスはherpesと免疫とが全身に細胞で戦っている病気であって決して自己免疫疾患ではないのです。
CR2の異常: 分類不能型免疫不全症
CR3の異常: 白血球接着不全症1型
B因子,H因子,I因子,CD46(membrane cofactor protein),またはC3の遺伝子変異は非典型 の溶血性尿毒症症候群を発生させる。membrane cofactor proteinは膜補因子タンパク質と訳し膜補因子タンパク質(MCP)は、自己細胞を補体攻撃から保護する制御膜タンパク質であると同時に、麻疹ウイルスのレセプターでもある。
補体の生物活性については補体成分には,様々な他の細胞上にある補体受容体(CR)によって媒介される他の免疫機能がある。
CR1(CD35)は,食作用を促進して免疫複合体の除去を助ける。
CR2(CD21)は,B細胞による抗体産生を調節するとともに,エプスタイン-バーウイルス受容体でもある。
CR3(CD11b/CD18),CR4(CD11c/CD18),およびC1q受容体は,食作用に関与する。
C3a,C5a,C4a(弱い)は,アナフィラトキシン活性を有する;肥満細胞の脱顆粒を引き起こして,血管透過性の亢進および平滑筋の収縮をもたらす。
C3bは,病原性微生物を覆うことによってオプソニンとして働き,それによって食作用を増強する。
C3dは,B細胞による抗体産生を増強する。
C5aは好中球遊走因子である;好中球および単球の活性を調節し,細胞接着の増強,脱顆粒および顆粒球からの細胞内酵素の放出,毒性酸素代謝物の産生,ならびに他の細胞代謝性事象の開始を引き起こすことがある。
濾胞樹状細胞は、丸い核、中心に位置する核小体、当たり障りのない分散したクロマチン、および隣接する核膜の平坦化を備えています。
濾胞樹状細胞( FDC ) は、リンパ組織のB 細胞領域の一次および二次リンパ濾胞(リンパ節)に見られる免疫系の細胞です。樹状細胞(DC) とは異なり、FDC は骨髄造血幹細胞に由来せず、間葉起源です。FDC の考えられる機能には、リンパ組織の細胞と微細構造の組織化、B 細胞をサポートする抗原の捕捉、胚中心からの破片の除去の促進、および自己免疫からの保護が含まれます。FDC が関与する可能性のある疾患プロセスには、原発性 FDC 腫瘍、慢性炎症状態、HIV-1感染症の発症、および神経侵襲性スクレイピーが含まれます。
神経侵襲性スクレイピーとはスクレイピーは羊と山羊に起こるプリオン病です。 18世紀にはヨーロッパで大流行を起こし、畜産に大きな被害を及ぼしました。 世界中でスクレイピーの存在しない国はオーストラリアとニュージーランドだけです。 日本もフリーでしたが1974年にカナダから北海道に輸入した羊により持ち込まれ、東北、関東、九州にも拡がりました。
増殖しているB細胞にT細胞の補助刺激が必要です。T細胞からの補助刺激がないB細胞はアトポーシスしてしまいます。
抗原特異的ではないB 細胞は、FDC への抗原の輸送において重要な役割を果たします。それらは、補体のCR1あるいはCR2依存性の方法でリンパまたはマクロファージから直接抗原と結合した免疫複合体を捕捉し、リンパ組織に移動し、そこで補体によってオプソニン化された抗原をFDC(濾胞樹状細胞)に奪い取られるとcognate antigenと結合したナイーブBリンパ球を活性化すると二次リンパ濾胞で増殖していくのですがこの時ふえたBリンパ球は極めてもろいので隣にあるT細胞領域にいるT細胞から補助刺激をされないとアポトーシスしてしまうのです。アポトーシスしなかったBリンパ球は6時間で2倍も増殖するのです。
次に、FDC は化学誘引物質 CXCL13 で B 細胞を誘引します。濾胞構造を生成するには、B 細胞によって産生されるメディエーターであるリンホトキシン (LT) によって FDC が刺激される必要があります。FDC もB 細胞上の CXCR5 の刺激により LT 産生が上方制御され、これにより FDC の活性化が引き起こされ、さらに CXCL13 分泌が刺激され、正のフィードフォワード ループが生成されます。つまりFDC もB 細胞の助けがいるのです。これにより胚中心(germinal center略してGC)が形成され、そこで抗原活性化B細胞が持ってきた抗原も捕捉されB 細胞もどんどん増えていくのですがこの時に形質細胞になって胚中心(germinal center略してGC)を離れて、抗原特異的な抗体を産生するのですがこの抗体はIgMだけなのです。なぜならばこのときのB 細胞はcognate antigenに対する体細胞突然変異による高親和性形質細胞にはなっていないからです。胚中心(germinal center略してGC)に残った他のB細胞はそこでもっと増えている間に、cognate antigenに対する親和性を高めるための体細胞突然変異が胚中心(germinal center略してGC)のダークゾーンと言われる増えたリンパ球が集積している領域で起こるのです。胚中心(germinal center略してGC)のダークゾーンで増えた体細胞突然変異をも終わったB 細胞は増えたB細胞の親和性をFDCに捉えられたcognate antigenとの結合の強さをテストしてもらうためにcognate antigen を捕まえているFDCが多いライトゾーンに移動します。増えた数多くのB細胞がFDCに提示されているcognate antigenと結びつく数が多くかつ強ければかつライトゾーンにいる活性化T細胞から補助刺激をさせてもらったB細胞アポトーシスから逃れることが出来るのです。
以上を要約するとリンパ濾胞は未熟なBリンパ球をcognate antigenにたいして完璧な抗体を産生させるために700個以上も存在する特別な二次リンパ器官なのです。そのためにリンパ節に最高の道具を集める場所がリンパ濾胞なのです。まず組織に侵入してきた病原体をリンパ濾胞まで捕まえて運んでくる補体と抗原提示細胞である樹状細胞の二種類の運び屋、二つ目はリンパ濾胞の住民になったFDC(濾胞樹状細胞)です。FDC(濾胞樹状細胞)の仕事は補体と樹状細胞が運んできたherpesなどの病原体をすべて奪い取ることです。三つめはリンパ濾胞は未熟な数多いBリンパ球から成り立った海に数少ない濾胞樹状細胞と言う島が浮かんでいるのです。つまり未熟なBリンパ球と濾胞樹状細胞のカップルが三つ目の登場人物です。四つ目は増えていったひ弱で未成熟なBリンパ球が絶望してアトポーシスしないようにヘルパーTリンパ球の補助刺激が必要です。これらの登場人物が相互協力していくと完璧なB細胞になるための体細胞超突然変異細胞とb細胞が作る抗体のクラススイッチが最後の起こるのです。その経過については上に説明しました。
最後には次々と抗体のスイッチング、および高親和性形質細胞およびメモリーB細胞への分化の三つが起こります。因みにFDC(濾胞樹状細胞)と B 細胞間の接着は、ICAM-1 (CD54)と LFA-1 (CD11a) および VCAMと VLA-4分子によって媒介されます。LFA-1とは何でしょうか?Lymphocyte function-associated antigen 1で略してLFA-1です。リンパ球が細胞に速やかに接着するためには、LFA-1という接着因子がその接着性を変化させる能力が必要です。接着因子とは接着因子は細胞表面に発現するたんぱく質で、細胞同士、あるいは、細胞と細胞外マトリクスとの接着を司る。VLA-4分子とはVLA-4(インテグリンα4β1)で細胞表面リガンドである血管細胞接着分子-1(VCAM-1)に結合し細胞間接着に関与します。
FDC(濾胞樹状細胞)が起こす病気についてはまれな原発性 FDC 腫瘍が報告されています。原発性と言う病気はすべて病気の原因は不明なので不明な腫瘍の原因は言うまでもなくherpesです。これらの原発性 FDC 腫瘍は上皮性の癌ではないので肉腫ですがリンパ組織が関与することが多いです。多くの場合、原発性 FDC腫瘍は肝臓、胆管、膵臓、甲状腺、鼻咽頭、口蓋、胃または十二指腸の粘膜下組織で発見されています。多くの慢性炎症状態において、CXCL13 ケモカインを産生し、VCAM-1 や CD21 などの FDC (濾胞樹状細胞)マーカーを保有する細胞が、関節リウマチ(RA) 患者の滑膜組織、シェーグレン症候群患者の唾液腺など、まったく予想外の部位で観察されています。慢性炎症状態を起こすのは絶対に殺しきれないherpesが起こすのです。つまりヘルペスは免疫があがると潜伏感染して細胞のゲノムに隠れ免疫が下がると細胞で増えて次の細胞に感染するときに免疫細胞に捕まると炎症が起こるという繰り返しのイタチごっこをして慢性炎症状態を繰り返すのがヘルペス感染の特徴なのです。 濾胞樹状細胞は、RNAウイルスであるHIV-1 は濾胞樹状細胞に感染してゲノムに隠れてしまうので避難場所を提供することになるのはherpesウイルスと似ています
以上、FDC(濾胞樹状細胞)についてまとめておきましょう。
濾胞樹状細胞(FDC).リンパ濾胞内にあり樹枝状の形態を示し,抗原を細胞表面に提示して胚中心B細胞を活性化する.しかし,T細胞への抗原提示能を示さないことから通常の樹状細胞とは異なった細胞系列に属する.
FDC(濾胞樹状細胞)とはどういう細胞ですか?濾胞樹状細胞 (follicular dendritic cell、FDC) とはリンパ小節の胚中心に存在する間質細胞とも言えます。 抗原を捕捉するが、細胞内には取り込まず細胞表面に保持する。 T細胞に抗原を提示するいわゆる樹状細胞と異なり、保持した抗原によりB細胞と相互作用する。造血幹細胞には由来しておらず、MHC II も発現していない。
