①グルコースにL型とD型があるのは何故でしょうか?
6単糖の5番目の炭素の右にOHがあるのをD型といいます。英語のdexterous(器用な、右利きの)のDですね。カルボニル基から最も遠い不斉炭素(C5)に結合したヒドロキシ基が右側であれば,その糖をD-糖とよびます。英語のdexterous(器用な、右利きの、右側の)のDですが、ちなみに左側のという意味の英語は、sinisterです。不斉炭素については何回も説明するつもりですが、まず一般的でかつ専門的な説明をしておきましょう。
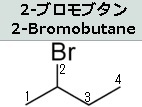
説明に必要なので上図に有機臭素化合物である2-ブロモブタンの構造式を示しておきます。
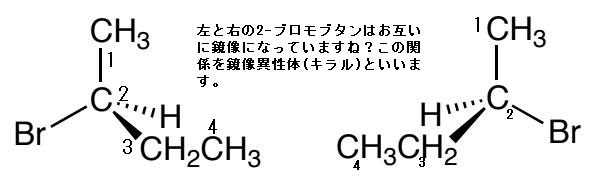
まず四面体型構造を持つ sp3 混成の炭素原子(2番目の炭素)に4つの異なる置換基が結合している時、その炭素原子を不斉炭素(asymmetric carbon)と呼びます。不斉炭素の特徴は、2-ブロモブタンの化学式(C₄H₉Br)が同じであっても置換基の空間配置に二種類の異なる構造異性体があることです。なぜ構造異性体ができるのでしょうか?たとえば、左図の2-ブロモブタンには、2番目の炭素に「水素原子、臭素原子、メチル基、エチル基」という4つの異なる置換基が結合しています。このとき、上の右2つの分子は同一ではないことがわかるでしょう。Brは臭素原子であり、英語でbromineといいます。
2-ブロモブタンとは、化学式C₄H₉Brで表される有機臭素化合物であり、ハロゲン化アルキルの1種でもあります。この臭素が結合した炭素は不斉中心であるため、2-ブロモブタンは1対の鏡像異性体を持ち、それは1-ブロモブタン、2-ブロモ-2-メチルプロパンです。この構造異性体の命名法は難しいので省きます。鏡像異性体は英語でEnantiomerといいます。
化学式とは、化学物質を元素の構成で表現する表記法です。分子からなる物質を表す化学式を分子式、イオン物質を表す化学式をイオン式と呼ぶことがありますが、化学式と呼ぶべきなのに、分子式と言われる場合が多いのです。化学式については後で詳しく説明します。
これらの構造異性体の関係は、「右手」と「左手」の間の関係と似ています。右手と左手は同じ形ではないのです。その証拠に、右手用の手袋を左手にはめることはできないからです。一方、右手を鏡に映すと、左手と同じ形になります。逆に、左手を鏡に映すと、右手と同じ形になります。先ほどの2-ブロモブタン分子は、互いに異なる形であるが、左側のものを鏡に映すと右側のものと同じ形になります。従って、この2つの2-ブロモブタン分子はキラルであります。2-ブロモブタンがキラルである原因は、不斉炭素を1個持っているからです。有機化合物 の中には、炭素以外の原子が分子をキラルにさせている原因になっている場合があり、そのような炭素原子以外の原子を不斉中心(asymmetric center)と言います。もちろん不斉炭素も不斉中心の一種です。
②グルコースにα型、β型があるのは何故でしょうか?
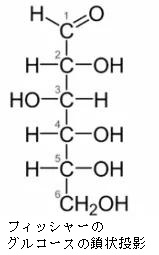
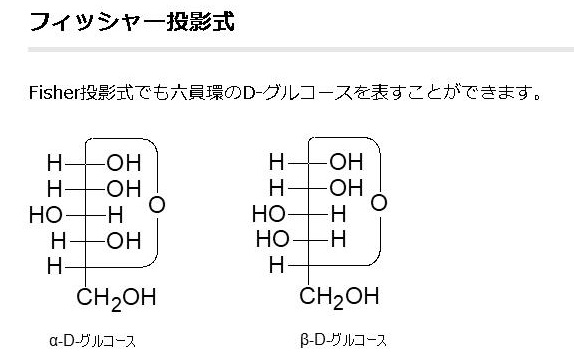
すべての単糖はヒドロキシ-メチル基(CH2OH)をもっています。単糖はアルドースとケトースの2種類に分けられます。アルデヒド基を持っている単糖をアルドースといい、ケトン基(C=O)を持っている単糖をケトースと言います。ケトースは、両端にヒドロキシ-メチル基を持っていますが、アルドースは一端だけにヒドロキシ-メチル基を持っています。グルコースはアルドースですから、CH2OH は1つしか持っていません。鎖状から環状の立体構造をとった時に、フィッシャーの投影式で立体構造を表したときに、このCH2OHと同じ側(上側)にOH基があるのをβ型といい、CH2OHと反対側にあるグルコースをα型といいます。ちなみに1890年代にグルコースの構造を初めて見つけ出したのは、このフィッシャーです。
③アセタールとは何でしょうか?
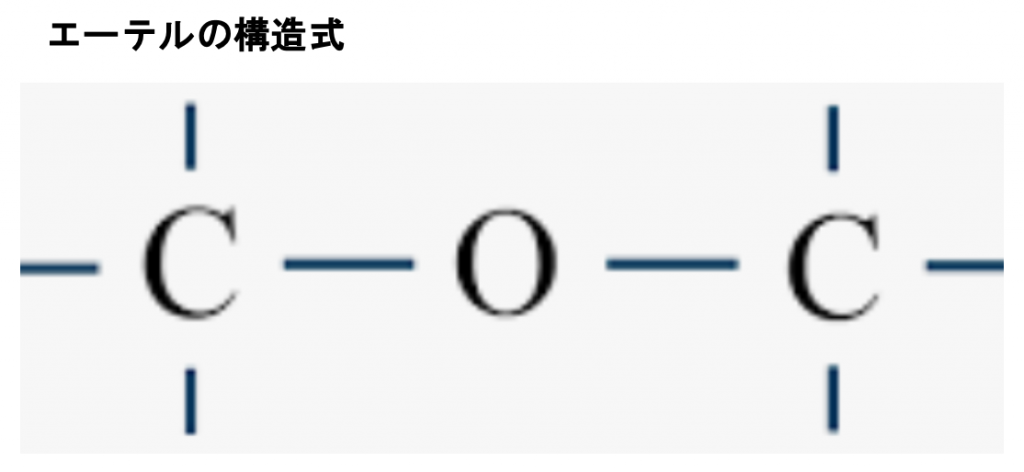
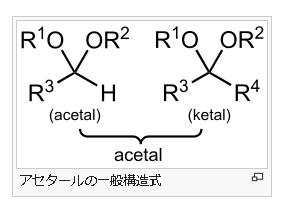
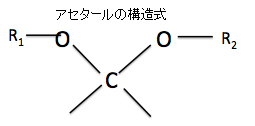
アセタールは有機化合物のうち、R³−C−R⁴ で表されるエーテルの呼び名です。アセタールはアルデヒドもしくはケトンに酸触媒下でアルコールを縮合させると得られます。かつてはアルデヒドから得られるものをアセタール、ケトンから得られるものをケタールと呼んで区別していましたが、現在はいずれもアセタールと呼びます。
④ヘミアセタールとは何でしょうか?
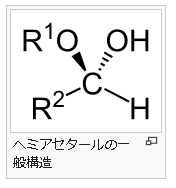
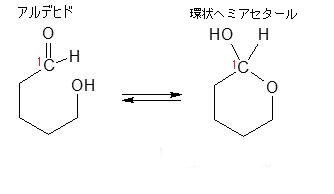
ヘ ミアセタール(Hemiacetal)は、有機化合物で、アルデヒド基とアルコール性OH基とが結合してできる構造で、生体物質では糖の環状構造が代表です。RCHO + R’-OH → R-CH(OH)-OR’と反応します。RCHOのCHOがアルデヒド基です。このアルデヒド基とR-CH(OH)-OR’の中のOHのアルコール性OH基から形成するのがヘミアセタールであり、ケトン(CO)とアルコールから形成するのがヘミケタール(hemiketal)です。ちなみに上に取り上げたRCHO + R’-OH → R-CH(OH)-OR’というRとR’が一体なんであるか気なる人がいるでしょう。このRとR’はアルキル基なのです。アルキル基とは炭素(C)と炭素(C)だけで成り立っている基とか、炭素(C)と水素(H)だけからなる炭化水素基を意味します。炭化水素というのは炭素と水素から成り立っている化合物のことです。
⑤アセタールとヘミアセタールとは何が違うのか?
まずアセタールとヘミアセタールの構造の違いを見てみましょう。上の図のアセタールの構造式でR1、R2は炭化水素なので、C(炭素)を含んでいるので-C-O-C-O-C-という構造になります。-C-O-C-はエーテル結合そのものなのでエーテル結合が2つ並んでいる状態です。つまり-C-O-C-O-C-の前3つの-C-O-C-と後ろ3つの-C-O-C-の2つのダブルエーテル構造となっているのをアセタール構造といいます。
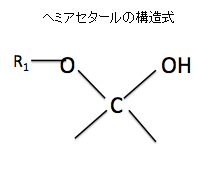
2つの上の図のヘミアセタールの構造式を見て下さい。ヘミアセタールのヘミというのは、半分を表しますので、エーテル結合が上のアセタールの半分しかないのでヘミアセタールというのです。左の図の片方のOHがアルキル基でなく水酸基(OH)になっていますね。このような「半分エーテル」を英語でヘミアセタールと言います。
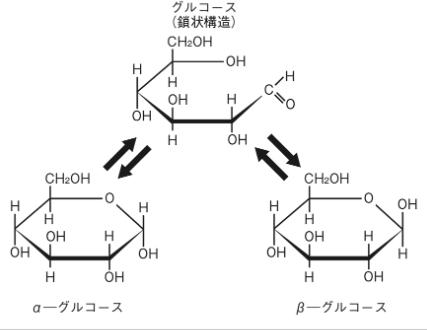
左 の図を見ながらαグルコース(α型グルコース)とβグルコース(β型グルコース)の鎖状構造が平衡状態になっている関係について説明しましょう。
糖というのは、α型の環状とβ型の環状が平衡状態にあります。化学では,「正反応と逆反応の反応速度が等しくなり、見かけ上反応が止まったように見える状態」をいいます。従って平衡状態は、一方向にのみ進む反応ではなく、逆反応が起こる可逆反応も生じている状態です。
グルコースの99%は、環状の状態ですが、水中では水溶液ではα-グルコースとβ-グルコースは36:64の比で平衡状態が見られます。
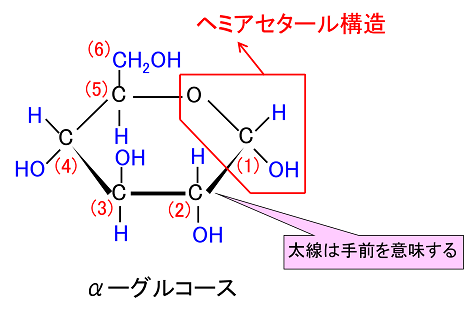
そして、この環状が鎖状になるときに環が開く(環が切れる)場所が『ヘミアセタールのヒドロキシ基(OH)』です。ヘミアセタールはもっと具体的にどのようにして環状が鎖状になるかをグルコース(血糖、ブドウ糖)を例に考えていきましょう。グルコースは結晶ではほとんどがα型です。
単糖は鎖状から環状構造をとるのですが、どのようにヘミアセタール結合をして鎖状が環状になるか説明しましょう。
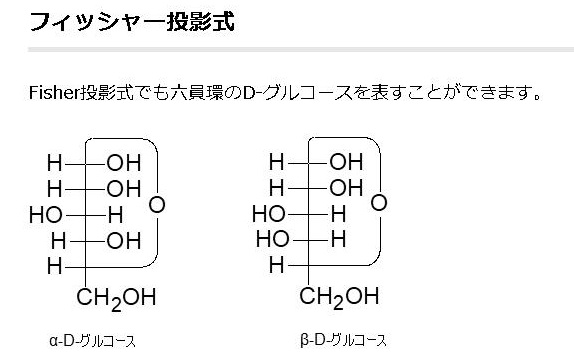
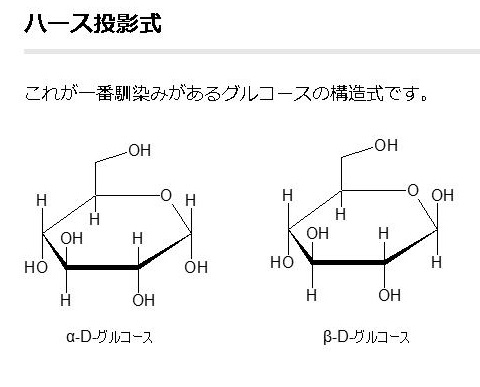
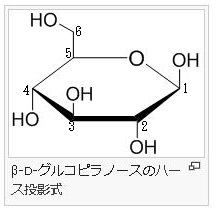
単糖であるグルコースは鎖状構造から環状構造をとります。グルコースの鎖状構造はフィッシャーの投影式で表せます。一方、グルコースの環状構造はハースの式で表せます。まず、下にフィッシャーの投影式とハースの投影式を書きます。
示性式は有機化合物の化学式の1つです。
化学式は大きく分けて物質の元素組成を示す組成式と、分子構造を表示する構造式とに分類されます。組成式も構造式も物質を構成する元素の種別は元素記号を使って表現します。また同一原子の個数を示すために元素記号の右下付き添え字をつけて表現します。主な化学式の種類は5種類あり、1)組成式、2)分子式、3)示性式、4)構造式、5)電子式化学式の5つです。私たちが用いるのは、2)分子式と、3)示性式と、4)構造式です。示性式は分子式と構造式の中間的性格をもっています。
例えばエチルアルコール(エタノール)の分子式はC2H6Oですが、さらにその特定の官能基を明示するために示性式があり、C2H5OHと書きます。OHが最後につくと、C2H6Oの分子式で明示されなかったアルコールということが示されます。さらに分子の性質をさらによく示すには見慣れている構造式の登場となります。
ここでグルコースのような単糖には異性体(Isomer)が多いので、Isomerについて語るのは難しいのですが、簡単に説明しておきましょう。
異性体(Isomer)とは分子式は同じですが、互いに異なる物質であります。異性体には2種類あり、構造異性体と立体異性体の2つです。
構造異性体は、分子式が同じですが構造式だけが違います。単糖のアルドースとケトースは構造異性体ですが、鏡像異性体(Enantiomer)ではありません。単糖のアルドースとケトースを鏡に写しても重なることがないからです。構造異性体は判別が簡単です。ところが立体異性体を理解するのははるかに難しいのです。
立体異性体は分子式も構造も同じですが、原子配置が違います。原子配置というのは、原子の中の電子の配置と考えてください。電子配置とは、英語でElectron configurationと書き、多くの電子で構成されている原子の電子状態や、さらに分子の電子状態が近似的に得られる原子の電子軌道あるいは分子の電子軌道に複数の電子が詰まった状態と考えたときに、電子がどのような軌道に配置しているのかを示したもので、各元素固有の性質が決定され、かつ分子固有の性質が決定されるのです。このような3次元で成り立っている分子の立体異性体の違いがどのように生まれ、どのように違うかを判別するのは極めて難しいのです。立体異性体の違いについて少し具体的にふれておきましょう。
例えば、グルコースのC-5の-OH基が右にあるのがD型で、左にあるのはL型ですが、DグルコースとLグルコースの立体異性体の違いはエナンチオマーだけの違いが生まれるのです。エナンチオマーは英語でEnantiomarと書き、日本語で鏡像異性体と訳します。鏡像異性体とは鏡に映すとぴったり重なり合う違いであります。この違いを光学活性だけが違うといいます。それでは、光学活性というのは何でしょうか?難しく言うと、光学活性とは光を当てた時の偏光(光の偏り)が違いから生まれると説明されます。
次に鏡に映してもぴったり重ならないジアステレオマー、英語でDiastereomerという立体異性体があります。ジアステレオマーは鏡に映してもぴったり重ならない上に物理化学的な性質も違うのです。
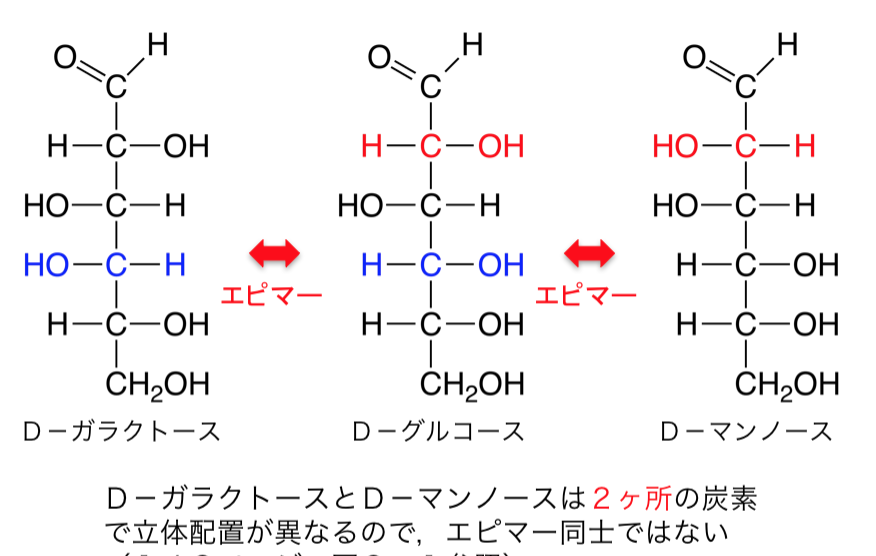
もう一つ立体異性体の種類があり、エピマーといい、英語でEpimerと書き、-OH基の向きが一ヶ所だけ違う時にエピマーという構造異性体が生じます。たとえば、グルコースとガラクトースは互いにジアステレオマーであり、かつエピマーなのであります。つまりグルコースとガラクトースは構造異性体ではありますが、実は鏡に映してもグルコースとガラクトースはぴったり重ならないジアステレオマーであると同時に、グルコースとガラクトースは同じアルドースであると同時に、かつ六炭糖(ヘキソース)であるにもかかわらず、Cの4番目(C4)についている-OH基 の向きだけの一ヶ所だけが異なるエピマーであるのです。つまり、グルコースとガラクトースは互いにジアステレオマーであると同時に、エピマーなのであります。
立体異性体は3種類は覚えておいてください。1つ目は鏡像異性体であるエナンチオマー(Enantiomar)、2つ目は鏡に写しても重ならないジアステレオマー、3つ目は1か所の官能基だけが向きが違うエピマーの3つです。立体異性体は理解するのは難しいでしょ?さらになぜこのような立体異性体が起こるのかをもっと詳しく勉強すればするほど難しくなるのです。
さて、これからの文章は、アノマー(anomer)とアイソマー(isomer)とα型グルコースとβ型グルコースの関係のみならず、ヘミアセタールと糖類の環状構造の関係、さらにヘミアセタール炭素に関するエピマーとアノマー(anomer)の関係や、グルコースの環状構造の水酸基がアキシアル方向のα-アノマーと、水酸基がエカトリアル方向のβ-アノマーの意味など、これら全てを説明していくのですが、自分自身のための勉強であり、復習です。難しすぎる人は飛ばしてください。
アキシアル原子とエクアトリアル原子について
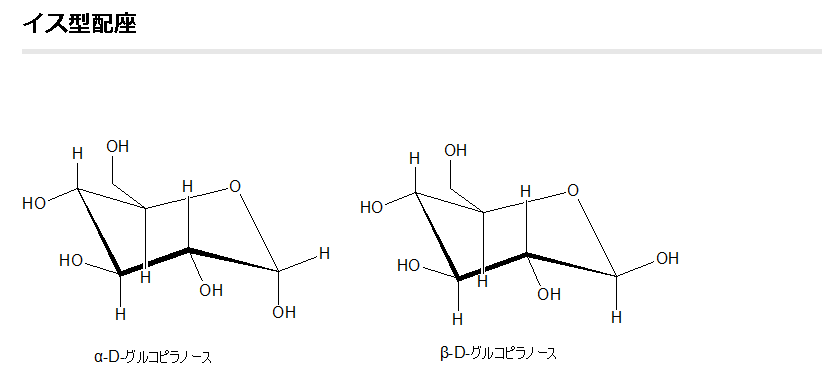
既にフィッシャー投影図とハースの式によるグルコースの鎖状構造の図を上に掲載しましたが、実を言えばもう一つグルコースの構造図の書き方があるのです。それが左に示した、イス形配座と言われるものです。このイス型配座の環を構成する各炭素原子から伸びる電子軌道には大きく分けて2つの方向である垂直方向と横方向とがあることがわかっています。これが既に述べたように、立体異性体に関わる原子配置とか電子配置の意味の一つです。垂直方向に伸びた電子軌道の先にある原子をアキシアル原子またはアキシアル位にある原子と呼び、横方向に伸びた電子軌道の先にある原子をエクアトリアル原子、またはエクアトリアル位にある原子と呼びます。アキシアルは、英語でaxialと書き、エクアトリアルは英語でequatorialと書きます。アキシアルは英語のaxis(軸)の形容詞であり、エクアトリアルは英語のequator(赤道)の形容詞です。軸は垂直に立って伸びていますし、一方、赤道は真横に向かって伸びていますね。従って地球になぞらえると、アキシアルは“地軸方向の”という意味から“垂直の”とか“上下に”という意味が生まれ、垂直方向の電子軌道がイメージされますね。一方、エクアトリアルは“赤道面方向の”という意味から、“真横の”とか“水平の”という電子軌道をイメージできますね。また、環を構成する炭素原子とアキシアル原子である真上の原子との間の原子間結合をアキシアル結合と呼び、一方、炭素原子とエクアトリアル原子である真横の原子との間の原子間結合をエクアトリアル結合と呼びます。
ここでグルコースと同じくヘキソース(六炭糖)であるシクロヘキサンの構造式を用いて、より分かりやすくアキシアル結合と原子やエクアトリアル結合と原子について説明しましょう。ついでにどうして糖に異性体があったり、構造式が5〜6つもあるかについて詳しく説明しましょう。下図にシクロヘキサンのイス型配座と舟形配座の構造式と、その構造が変換しながら平衡を保っている反応式を掲載しておきます。
左図のシクロヘキサンとベンゼンの構造図をまず見て下さい。シクロヘキサン (cyclohexane) は、分子式 C6H12で、シクロアルカンの有機化合物の一種です。アルカンはCとHだけの単結合で成り立っている炭化水素です。最も単純な芳香族炭化水素である六員環のベンゼン(C6H6)の水素付加によって作られます。シクロヘキサンは、6つの各構成炭素原子にエクアトリアル水素(水平向き水素)とアキシアル水素(上下向き水素)がそれぞれ1つずつついています。垂直方向と横方向だけでなく、環を固定して考えたときに、上側か下側かについても同様の向きとなるように電子軌道を持つ炭素原子は1個おきにあり、これらの電子軌道は互いに反発しあっているのです。
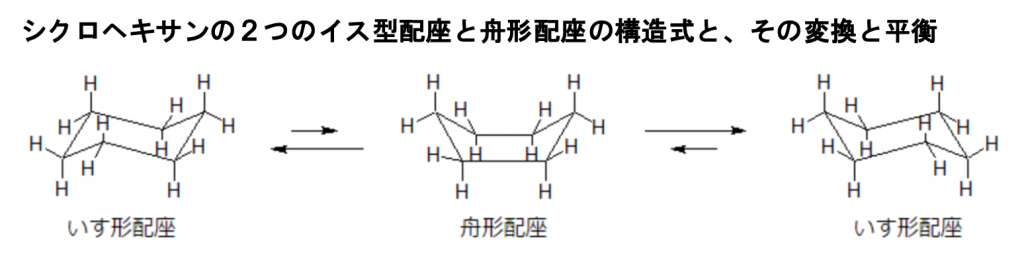
シクロヘキサンは6つの炭素が平面上に並んでいるわけではなく、折れ曲がった形を取ることで安定な構造を保っていますが、ときにはもうひとつの真ん中の舟形配座を取ることもあり、これらの平衡が成りたっています。ただし、舟形配座よりもイス型配座の方が安定しているので、平衡はより安定なイス形に偏ります。 このイス形配座と舟形配座の関係を、配座異性体といいます。 上図を見てもわかるように、いす形配座では各々の炭素同士と水素同士がどれも離れているために安定性が高いのです。 一方、舟形については、炭素同士と水素同士がやや近づく箇所がどうしてもできてしまうため、相対的には不安定な構造ということができます。しかし、どちらも結合角ひずみはないため、そういう意味では安定な構造といえます。 結 合角は英語で bond angleといいます。結合角は分子構造の構造要素の一つで、それぞれの原子から伸びている手が作る2つの化学結合のなす角度を示します。
結合角のひずみとは何でしょうか?
元素の基本単位は原子で、中心は原子核で、その原子核の周りを電子が惑星のように動いているのです。原子を野球場の大きさとすれば、原子核は中央に置かれた豆粒ほどの大きさであります。原子核の周りを動き回っている電子は決められた電子軌道の上を電子が動き回っているのです。電子軌道は内側から1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p…というように原子番号が大きくなればなるほど、電子軌道も増えていきます。なぜならば、原子番号と電子の数が同じだからです。しかもsがつく軌道には2個しか電子が入りません。pがつく軌道には電子が6個しか入れないのです。dの付く軌道は10個しか電子が入れません。1つの元素の原子の電子軌道の数と電子の数も決まっているのですが、原子が分子を作ると電子が動き回る電子軌道は新たにsp3と名づけられる混成軌道という軌道を作ってしまいます。例えば、炭素は水素と化学結合してメタン(CH4)という分子を作る時にお互いに1つずつの電子を出し合って、1対の電子を共有結合し合うのですが、この時、新たにsp3という混成軌道を作ってしてしまいます。一方、炭素は水素の電子と共有しない孤立電子対と呼ばれる1対の非共有電子対を残しています。sp3混成軌道が新たに作られると、このsp3混成軌道とCのもつ2sにある孤立電子対(非共有電子対)の軌道との反発などにより結合角はわずかに変化します。これを結合角のずれといいます。
孤立電子対とは、原子の最外殻の電子対のうち、共有結合に関与していない電子対のことであり、それゆえ、非共有電子対とも呼ばれます。ついでに自分のためにsp3 混成軌道について説明しましょう。
sp3混成軌道とは何でしょうか?
混成軌道は英語で Hybrid orbitalといい、原子が化学結合を形成する際に、新たに作られる原子軌道です。典型例は、すでに述べた炭素原子です。炭素は、sp3、sp2、spと呼ばれる3種類の混成軌道を形成することができますが、これが、有機化合物の多様性に大きく関与しているのです。混成軌道の概念は、第2周期以降の原子を含む分子の幾何構造と、原子の結合の性質の説明に非常に役に立つのです。(皆さん、覚えていらっしゃるでしょう。メンデレエフ元素の周期表には7周期あることもご存じでしょう。) 原子は、混成軌道を形成することにより、化学結合を形成するのに適した状態に変化するのです。この状態を原子価結合法において原子価状態と呼ばれる状態となれるのです。原子価結合法とは、量子化学において化学結合を各原子の原子価軌道に属する電子の相互作用によって説明する手法です。新たに作られる混成軌道は、基本となる軌道とは異なるエネルギーや形状等を持ちますが、当初、この現象の成因として、異なる種類の軌道が混ぜ合わさったものだと考えられたために、混成(hybridization)と呼ばれるようになりました。分子の構造は各原子と化学結合から成り立っているので、化学結合の構造が原子核と電子を用いた量子力学でどのように解釈されるかは分子の挙動を理論的に解釈できる基礎になるのです。
化学結合を量子力学で扱う方法には、分子軌道法と原子価結合法の2つがあります。分子軌道法は分子の原子核と電子との全体を一括して取り扱う方法であるのに対して、原子価軌道法では分子を、まず化学結合のところで切り分けた原子価状態と呼ばれる個々の原子と価電子の状態をまず想定します。価電子とは、電子の軌道の最も外にある軌道である最外殻と呼ばれる電子軌道にある電子の数であります。次の段階として、分子の全体像を原子価状態を組み立てることで明らかにしてゆくのです。
原子価とは、ある原子が何個の他の原子と結合するかを表す数であり、高等学校の化学教育ではすでに私が使っているように他の原子と結びつく手の数として表されます。1つの手は別の1つの分子と結合すると1つの手同士が結びついて結合していくのです。元素によっては複数の原子価(複数の手)を持つものもありますが、特に遷移金属は多くの原子価を取ることができるため、多様な酸化状態や反応性を示すことができるのです。
遷移元素とは、周期表で第3族元素から第11族元素の間に存在する元素の総称であります。遷移金属とも呼ばれるのは、典型的な金属ではなくて典型的な金属になりきっていないがなりつつある(遷移しつつある)金属という意味でつけられました。第12族元素は化学的性質が典型元素の金属に似ており、またイオン化してもd軌道が10電子で満たされ閉殻していることから典型元素に分類されることもありますが、遷移元素に分類される例も多く見られます。具体的には個々の原子の軌道や混成軌道をσ(シグマ)結合やπ(パイ)結合の概念を使って組み上げることで、共有結合で構成された分子像を説明しやすくなるのです。したがって、原子軌道から原子価状態(他の原子と結びつく手の数)を説明する時に利用できる混成軌道の概念は原子価軌道法の根本に位置するのです。
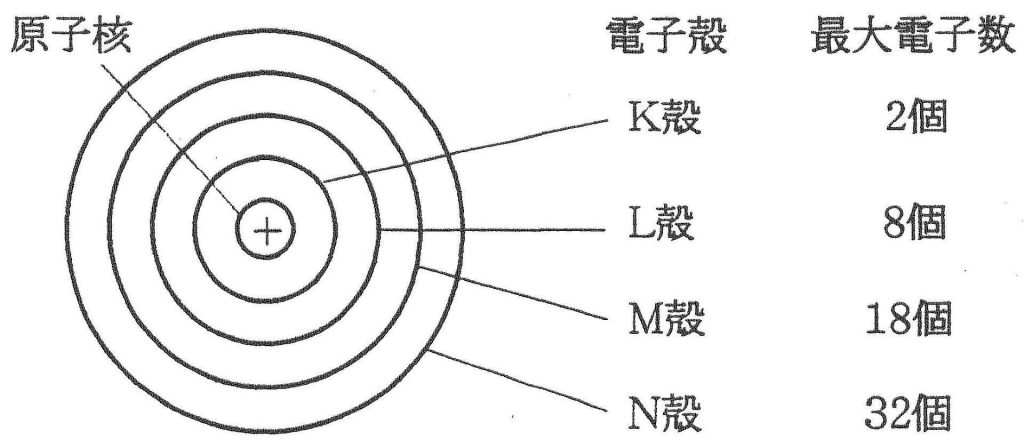
電子殻とは何でしょうか?
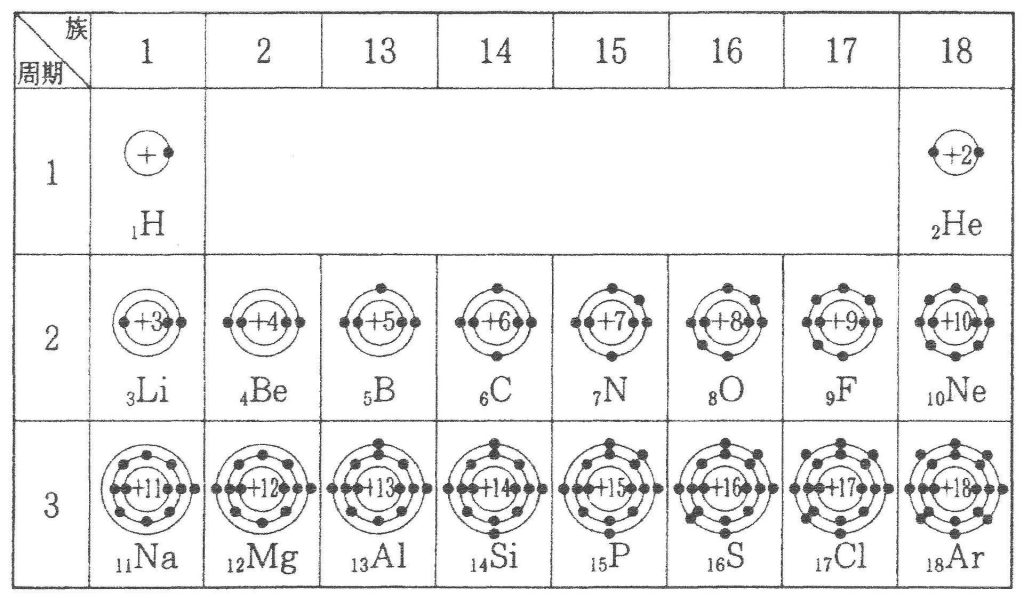
元素に電子が多数ある場合,電子は原子の周りにいくつかの層に分かれて存在しています。この層を電子殻といいます。左の下図に示したようにそれぞれの電子殻に決まった数の電子が配置されています。内側からK殻,L殻,M殻,N殻……と名づけ,各電子殻に入り得る電子の最大数はそれぞれ2コ,8コ,18コ,32コ……と決まっています。その決め方は各々の殻の最大数の計算方法があり2n2と表せれるのです。nの数は原子核に一番近い殻(K殻)を1とし、2番目に近い殻(L殻)を2とし、3番目に近い殻(M殻)を3とし、4番目に近い殻(N殻)を4……と順番につけていく番号です。K殻の電子の最大数は2n2=2×12=2×1=2となり、L殻の電子の最大数は2n2=2×22=2×4=8となり、M殻の電子の最大数は2n2=2×32=2×9=18となり、N殻の電子の最大数は2n2=2×42=2×16=32となるのです。下図に周期表と各元素の原子番号(陽子数)と・で電子の数も示しておきます。例えば、6Cは炭素の原子番号が6という意味ですね。さらに、メタンの化学式と原子価表現と分子構造と原子価結合法と原子価状態と原子軌道と混成軌道を掲載しておきます。難しいですが着いて来て下さい。
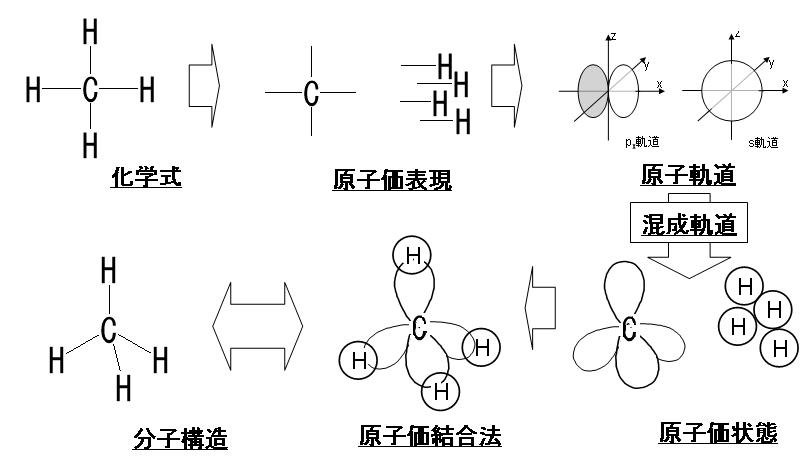
この原子価結合法と分子構造を初めて提唱したのは、かの有名なノーベル化学賞受賞者であり、メガビタミン療法の提唱者であるライナス・ポーリングであります。ちなみにポーリングは1950年にアミノ酸がαヘリックスという2次構造を取っているという概念も初めて提唱した大天才です。ところが残念なことにポーリングはビタミンC大量投与で癌も治せるというアホなことを言ったのでその時点で彼が築いた名声はすべて瓦解してしまいました。ビタミンCで癌が治るはずがないのですが、やはり彼は医者ではなかったので根拠もなしに言い過ぎたのです。ともあれ彼は世界で初めて、上で説明したメタン (CH4) といった分子の構造を説明するために混成理論を開発提唱した化学者なのです。この概念はメタン(CH4)のような単純な化学分子のために開発されましたが、正しい混成理論であったので今でも幅広く応用され、今日では有機化合物の構造を合理的に説明する有効な経験則となっているのです。もちろん混成理論は、分子軌道法ほど、定量的計算には実用的ではないのでいつくかの問題を含んでいます。ポーリングの混成理論の問題点は、配位化学や有機金属化学において化学結合にd 軌道が関与する場合に特に顕著になります。d軌道を持っている遷移元素は全て金属元素でありますが、d軌道またはf軌道などの最外殻電子軌道以外の内殻(内側)に空位(電子が詰まっていない)の軌道を持つために、つまり不対電子の軌道を持つために典型元素の金属とは異なる化学的性質を持ってしまうのです。何故かというと、そもそも不対電子は不安定であるために対電子を持とうとするのですが、d軌道だけは安定な不対電子を持つことが可能な特性を持っているからです。そのため、これら金属元素は「遷移金属」とも呼ばれます。遷移元素は周期表中央の凹型領域に位置する原子の集団です。遷移という意味は、定まった状態から別の定まった状態へ変化することです。したがって、d軌道の最外殻電子軌道以外の内殻(内側)に安定な不対電子を持つことが可能なため、遷移金属の多くは常磁性であったり、複数の酸化数をとることが容易です。あるいはd軌道はさまざまな配位子と結合して、同じ元素でも多様な錯体を形成します。錯体とは、金属と非金属の原子が結合した構造を持つ化合物です。この非金属原子は配位子であります。配位子とは、金属に配位結合する化合物をいいます。配位結合は、英語で coordinate bondといいます。配位結合とは二つの原子が化学結合するときに、2つの原子の一方からのみ結合電子が分子軌道に提供される化学結合であります。
一方、最外殻電子軌道以外の内殻軌道(内側の軌道)が閉殻の金属である3つの亜鉛族元素のグループである亜鉛(Zn)やカドミウム(Cd)や水銀(Hg)は、電子配置も化学的性質も典型元素の金属に近いので遷移元素とはされません。閉殻とは、原子の電子軌道の最外殻に最大数の電子が入っている状態のことです。これとは反対に最外殻に最大数の電子が入っていない状態のことを開殻と呼びます。言い換えると電子が詰まっていない空位(からの)の軌道のことです。多くの原子において、閉殻の状態になると安定します。なお貴ガス(稀ガス、希ガス)の場合、閉殻の状態なので安定なのですが、これは貴ガスの最外殻電子が完全に詰まっている8個の電子を持っているからです。ちなみに貴ガスと稀ガスは高貴なガスという意味ですが、周期表の最右列のグループにあるHe(ヘリウム)、Ne(ネオン)、Ar(アルゴン)、Kr(クリプトン)、Xe(キセノン)、Rn(ラドン)、Og(オガネソン)の7つの原子だけが他の原子とは絶対に混じり合わない単体で存在しているから高貴ガスと言われるのです。ちなみに現在知られている元素は全部で118種類あります。
遷移元素を研究する化学において混成理論を用いることは可能ですが、上で述べたように一般的に正確ではないのです。軌道は分子中の電子の挙動のモデル表現であって、単純な混成の場合は、この近似は原子軌道に基づいているのです。炭素(6C)や窒素(7N)、酸素(8O)のようなより重い原子では、2sおよび2p軌道が原子軌道として用いられています。6Cや7Nや8Oの下付きの数は元素番号を示していると同時にそれぞれの原子の陽子数を示しています。混成軌道はこれらの原子軌道が混合したものと仮定され、様々な割合で互いを重ね合わせるのです。ライナス・ポーリングが生み出した混成理論はこれらの仮定の下において最も適切であり、ルイス構造と等価な単純な軌道の描写を可能にします。
ルイス構造とは、元素記号の周りに最外殻電子軌道以外にある内殻電子を無視して最外殻電子のみを点で表した化学構造式の一種で、分子中に存在する原子間の結合と孤立電子対(他の分子と共有結合していない電子)を示す言わば最外殻にある電子の数を表した図です。ルイス構造は、どの原子同士が互いに結合を形成しているか、どの原子が孤立電子対を持っているか、どの原子が形式電荷を持っているかが分かるため有用であります。形式電荷とは、形式的に原子が保持する電荷であります。もっと具体的に説明すると化学では、相対的な電気陰性度に関係なく、すべての化学結合の電子が原子間で等しく共有されると仮定すると、形式的な電荷は分子内の原子に割り当てられる電荷です。例えば電気陰性度の強さはH<C<N<Oとなり、Oが一番強いのですが、そのような電気陰性度の強さを無視して分子に最適なルイス構造を決定するとき、各原子の形式電荷ができるだけゼロに近くなるようにルイス構造が作れます。
単糖のアノマーとは何でしょうか?
アノマー(anomer)とはピラノースあるいはフラノースが環状構造を取ることで発生する立体異性体の関係を示す化学用語であります。
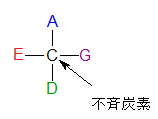
不斉炭素(ふせいたんそ)とは何でしょうか?まず左の不斉炭素の図を見ながら説明しましょう。左のCの4本の手にはそれぞれ違うA、E、D、Gが結合しているのでこの炭素を不斉炭素といいます。炭素に水素(H)が2個結合していたり、ヒドロキシ基(OH)が2個結合していると、それは不斉炭素にはなりません。ついでに示性式について述べておきましょう。まず下にピラノースとフラノ-スの絵図を示しておきます。ピラノースもフラノースも環の中のCは書かれていませんがCの番号だけ記しておきます。今更言う必要もないのですが、炭化水素である化合物はCとHが省かれることは既にご存知ですね。
ピラノース(Pyranose)は、5つの炭素と1つの酸素を頂点として六員環を構成している炭水化物の総称です。左図の左側のグルコースの鎖状の状態から、C-5のヒドロキシ基とC-1のアルデヒド基が分子内ヘミアセタール反応を起こすことによって左図の中央の六角形が形成されることはすでに説明しました。六員環のエーテル化合物である左図の右側のピランに形が似ていることから名前がつけられました。グルコースのC-1位のアノマーOH基がOR基に変換されているピラノースはピラノシドと呼ばれます。水溶液中では五員環のフラノースと平衡状態になるのですが、5炭糖(ヘキソース)のアラビノースやリボフラノースなどのヘキソースを除いて、糖には主にピラノース構造を取るものが多いのです。
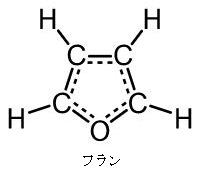
今述べたように左図の左側のフラノース(Furanose)は、左図の右側のフラン様の五員環を持った糖の総称であります。フラノース環は、アルドテトロース、アルドペントースの環状ヘミアセタールまたはケトヘキソースの環状ヘミケタールです。フラノース環は4つの炭素原子と1つの酸素原子を頂点に持ち、酸素の右側の1つの炭素はアノマーとなっています。最も番号の大きいキラル炭素の向きによって、D体かL体かが決まります。キラル炭素とは別名、不斉炭素とか不斉中心とかキラル中心ともいわれます。上で説明したように最も多く見られるキラル中心(不斉中心)というのは、異なる 4 つの原子または置換基に共有結合している炭素です。L体のフラノースでは、最も番号の大きいキラル炭素(不斉炭素)の置換基は下向きであるのに対して、D体のフラノースではこれが上向きです。またフラノース環には、アノマー炭素の水酸基の向きによって、α型とβ型があるのは、グルコースと同じです。一方、D体のフラノースでは、α型の水酸基は下向きであるのに対して、β型の水酸基は上を向いています。通常、アノマー炭素は水溶液の中では、α型とβ型は常に移り変わりながら平衡状態を取っているのです。ピラノースやフラノースは他の糖とグルコシド結合していない状態ではヘミアセタール(ヘミケタール)結合を生成したり、加水分解したりすることで、鎖状構造と環状構造との間で平衡が存在します。アノマーは環状構造を取ったときに、ヘミアセタール(ヘミケタール)を形成するC-1炭素が不斉炭素になることで発生する立体異性体なので、糖が単独で存在する場合はアノマー同士には平衡状態が存在できるのです。アノマーの違いを表記する為にα-またはβ-の接頭辞が使用され、D-Glucoseをハース投影式で記述した場合、C-1炭素のヒドロキシ基が下向き(下側)なアノマーがα-D-Glucoseであり、上向き(上側)のアノマーがβ-D-Glucoseになるのはすでに説明しました。
加水分解(hydrolysis)とは何でしょうか?どのようにして水に加わって水に反応するのでしょうか?
加水分解とは化合物が水と反応することによって起こる分解反応のことを言い、水解とも呼ばれます。極性を持つ化合物(AB)が水(H2O)と反応すると、水分子は、水素イオン(H+)と水酸化イオン(OH–)とに分割され、OH–は陽性であるAと、H+は陰性であるBと結合します。
極性とは何か?電気陰性度とは何か?双極子とは何か?
極性(polarity)とは分子を作っているそれぞれの原子自身が持っている電気陰性度と言われる電気的な偏りです。例として、反応式がAB+H2O→AOH+BHとなる加水分解反応を取り上げて説明します。化合物ABのBはAよりも電気陰性度が強くて、Bは陰性度が強いので陽性であるH+と結びつく一方、Aは陰性度が弱いので陰性であるOH–と結びつきやすくなるのです。ちなみに電気陰性度が一番強い原子は酸素(O)であり、次に窒素(N)であり、炭素(C)であり、電気陰性度が一番弱い原子は水素(H)であります。言い換えると電気陰性度の高い方が負(2δ–)になり、電気陰性度の低い方が正(δ+)になるということです。例えば、水分子そのものは正にも負にも帯電していない中性でありますが、電子内に電荷の偏りがあり、酸素(O)が負(2δ–)となり、水素(H)が正(δ+)になります。このような水分子を双極子(dipole)といいます。水に限らず、有機分子には双極子分子が多いのです。2個の原子がくっ付いて双極子になる場合の極性(負になるか正になるか)は電気陰性度(Electro-negativity)で決まり、電気陰性度の高い方が負になります。電気陰性度が最も高い酸素(O)は常に負になり、電気陰性度の最も引く水素(H)は常に正になります。
別の例として、酢酸ナトリウム(CH3COONa)の分子が水に溶解すると、酢酸イオン(CH3COO–)とナトリウムイオン(Na+)に分解します。酢酸イオンはそのままでは安定度が低いため、水分子(H2O)から水素イオン(H+)を奪い、これと結合して安定度の高い酢酸分子(CH3COOH)に変わります。 一方、ナトリウムイオン(Na+)と水酸化イオン(OH–)は、互いに結合することにより水酸化ナトリウムを生成します。水酸化ナトリウムは強アルカリで電離度が高く、溶液中ではイオンに分離した状態(Na+とOH–)で存在します。
キラリティー (chirality) とは何か?
3次元の図形や物体や現象が、その鏡像と重ね合わすことができない性質であり、両手の掌と似ているのでキラリティーの日本語の訳は掌性ともいいます。キラリティがあることをキラル (chiral) といいます。英語風の発音でカイラリティ、カイラルとも発音します。これらの語はギリシャ語で「手」を意味する言葉が語源です。まさに、手はキラルなものの一例で、実際の右手とその鏡像である実物の左手は互いに重ね合わせられないのですが、鏡に映った鏡像では重ね合わせることができるので鏡像異性体というのです。鏡像異性体という言葉を使われるのは、光がある物質を通過する時に光によって写された鏡の像の形が違うので鏡像異性体とか光学異性体とか言われるようになったのですが、本当は鏡像になると同じ形になるので鏡像同性体と言えば混乱が生じなかったのですが、誰が言い始めたのでしょうか?そして光学異性体の原因は、光がある物質の影響を受けた結果、光の持つ旋光性の原因が分子のキラリティーによることが判明すると、鏡像異性体とか、対掌体とか、またエナンチオマーの同義語として使われるようになりました。
旋光性とは何でしょうか?
元来、直線偏光をもつ光がある種の物質中を通るとき,その偏光面が回転することがあります。このような物質は旋光性をもつ,あるいは光学的に活性であるというのは当然なのです。偏光面は、光は電磁波の一種であるため、光自身の進行方向と光が持つ電場、または磁場の振動方向があり、振動方向の面を偏光面といいます。電磁波全般については偏波面ともいいます。偏光面の回転方向が光の進行方向からみて右回りか左回りかによって右旋性,左旋性といいます。偏光とは英語でpolarizationといい、電場および磁場の振動方向が規則的な光のことであり、これに対して、無規則に振動している光は、非偏光あるいは自然光と呼びます。一部の結晶や光学フィルターを通すことによって、自然光から偏光を得ることができます。つまり、本来、自然光であった光は結晶や光学フィルターを通ることによって偏光に変わるのです。
自然光とは、電場や磁場の振動方向がそろっていない光,すなわち偏光でない光を自然光といいます。光は電磁波であって,電場,磁場が光の進行方向に対して垂直な方向に振動しながら伝搬してゆくものです。特殊な条件のもとでは電場または磁場の振動方向がそろっている偏光をつくることができ,このようなとき光はかたよっている、つまり偏光しているといいます。電灯やガス体から出る光は一般に自然光です。偏光面の定義を取り違えると訳がわからなくなります。
さて最後に単糖は鎖状から環状構造をとるのですが、どのようにヘミアセタール結合をして鎖状が環状になるかを、今までの説明を十分に活用しながら明確にしましょう。
Fischer投影式の例として、もう一度上で載せた図を持って来ます。この魚の骨のような書き方がFischer投影式です。左のアルドースの図だけ見ると平面的ですが、実際は、主鎖である縦方向は紙面より奥に折れ曲がっていて、左右にある水素(H)やヒドロキシ基(OH)は紙面より手前(こちら側)に飛び出しているのをしっかりイメージしてください。

左のDグル コースのフィッシャー投影式の主鎖を右に倒して、一番下の-CH2OH(ハイドロメチル基)をつまんで、一番上の-CHO(アルデヒド基)に近づけてC-5の-OH(水酸基)と-CHO(アルデヒド基)を結合させます。左右にある水素(H)やヒドロキシ基(OH)は紙面より手前(こちら側)に飛び出しているので、主鎖を右に倒すとC-5の-H(水素)が下に来ることがわかりますね。するとアルデヒド(-CHO)とアルコール(-OH)は反応して右端の環状ヘミアセタールという構造を作ります。ヘミアセタールについてはすぐ上で説明しましたね。単糖であるグルコースは同一分子にアルデヒド(CHO基)とアルコール(OH基)の両方があるので、分子内でヘミアセタールを作るのです。これが糖の環状化です。ついでに述べれば環状になると、C-1が不斉炭素となってアノマーと呼ばれる異性体が新たに生まれることも既に述べました。というのはC-1の炭素に4つの違った基、つまりOH、H、C、Oの違った基がついていますね。したがってC-1が不斉炭素となるのです。Dグルコースの場合、C-1の-OH が下に来るとα型、上に来るとβ型の異性体ができるのです。でんぷんとセルロースの違いはどこにあると思いますか?構造異性体の違いだけなのです。同じグルコースが連結したものでありますが型が違うのです。でんぷんはα型が連結したものであり、セルロースはβ型が連結したものであり、でんぷんもセルロースも全く成分が同じなのに物質としては性質がまったく異なった構造異性体が生まれるのです。既 に述べたことですが、C5位のヒドロキシル基(-OH)が1位のアルデヒド(-CHO)を攻撃して閉環し,六員環のヘミアセタールを形成するのです。
酸素を含む六員環のことをピランというので、このような六員環の糖のことを,酸素を含む六員環の名称(ピラン)にちなんでピラノース(pyranose)と呼ぶことはすでに述べました。たとえば,D-グルコースが六員環のヘミアセタールを形成したものは,D-グルコピラノースとよばれますが、D-グルコピラノースを簡単にいうとD-グルコースとなるのです。D-グルコピラノースとD-グルコースは同じものなのです。また,この閉環によって新しく不斉炭素が1位に生じますが、この1位をアノマー位とよびます。D-グルコースの場合,1位のヒドロキシ基(-OH)が環状グルコースの図で下にあるものをα-アノマー(α-anomer),簡単にα型といい、上にあるものをβ-アノマー(β-anomer)簡単にβ型と区別してよぶのです。すでに述べたことを復習しています。
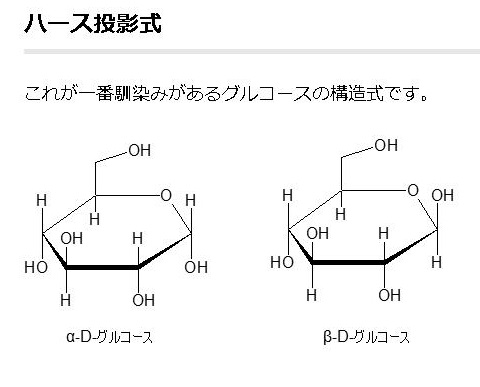
グルコースの構造式の書き方は上の図に掲載しているように3種類あります。イス型配座、ハース投影式とフィッシャー投影式の3つです。平面でない立体的なグルコースを、しかも環状になったり、鎖状になったり自由に行うグルコースを平面で表すことがいかに難しいかわかるでしょう。同じグルコースでも平面で書くと全く違ったものに見えるでしょうが、同じグルコースであることを十分理解してください。
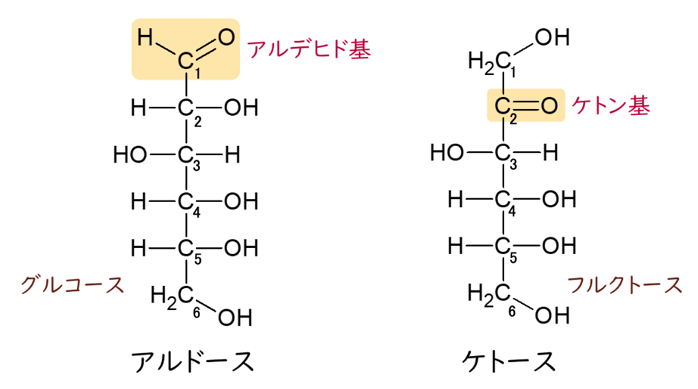
六炭糖の単糖にも2種類の構造があるので、それを上図を見ながら説明していきましょう。単糖はアルデヒド基を持っているアルドースとケト基を持っているケトースに分けられます。アルドースやケトースのカルボニル基(C=O)を一番上の方に書くフィッシャー投影式の描き方です。2、3、4、5の炭素は全て不斉炭素(アノマー)です。
なぜ2、3、4、5の炭素(C)が不斉炭素(アノマー)になるのか?お分かりになりますか?
C-2の炭素にしろ、C-3の炭素にしろ、4つの手に全く違った基がついていますね。例えば、C-3の炭素の左右には-HOと-Hの2つの異なった基が付いている上に、上の方はケトン基から始まる大きな基と、下の方はC-4からつながる異なった大きな基とつながっているからです。つまりC-3は4つの手のすべてに違った4つの基が付いているからアノマー(不斉炭素)となるのです。カルボニル基(C=O)から一番遠い5番目の不斉炭素(アノマー)に結合しているヒドロキシ基(OH)が右にあればD-、左にあればL-がつくことは既に述べました。さらに、これはグルコース(ブドウ糖)の場合ですが、5位のヒドロキシ基(OH)が1位のアルデヒド基と結合して閉環すること、つまり鎖状のグルコースが環状のグルコースになることも既に詳しく述べました。環状になると、アルデヒド基にある1番目の炭素(C)も新たなる不斉炭素になりますが、この1位の炭素もアノマー位の炭素とよびます。この時、ヒドロキシ基(OH)が下向きで(下に)あれば、α–となり、上向きで(上に)あればβ–となり、グルコースの分子内でヘミアセタール結合をすることも既に詳しく説明しました。このヘミアセタールの-OHが無い場合、環を開く事が出来ませんが、グルコースはこのヘミアセタールの-OHがあるので、環が開いて再び鎖状になることができるので、環状グルコースと鎖状グルコースとは簡単に入れ替わってしまうのです。
ところが異なった糖同士や、あるいは糖と他の糖の誘導体の有機化合物の糖同士が結合するのは、グリコシド結合によってであります。以前に書いたことがありますが、グリコシド結合とは、英語でglycosidic bondといい、炭水化物(糖)分子と別の有機化合物とが脱水縮合して形成する共有結合です。グリコシド結合については下で詳しく説明します。
上 のR、R’、R2、R3はアルキル基を指しています。
⑥アセチル基とアセト基の違いは何でしょうか?
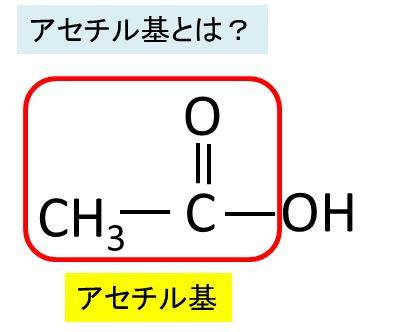
アセチル基はアシル基の一つです。アシル基はカルボン酸(COOHを持っている酸)からOHを抜いた形、すなわちR–CO–という形の基です。例えば酢酸(CH₃COOH)から水酸基を除いた CH3CO-をアセチル基といい、しばしば アセチル基はAc と略記され、生体内ではエステルやアミドとして使われます。アセチル基は英語でacetyl groupというのでAcはacetylのAcを取ってアセチル基の略語となるのです。気を付けなければならないのは、酢酸(CH3COOH)は水溶液中でCH3COOH⇄CH3COO– + H+ と電離するときにCH3COO– を酢酸基とよびます。酢酸基は英語でacetic acid groupとかacetic acid radicalと書きます。上にエステルやアミドの構造式を掲載しました。炭素原子と直接結合している場合や接頭語として部分構造を示す場合はアセトと呼ばれることが多いのです。つまりアセチル基とアセトは同じものなのです。酢酸エチル,アセトアミド,アセト酢酸,ジアセチルなどの構造に含まれています。アセトアミドはアセチルアミドと言ってもいいですが、かつアセト酢酸はアセチル酢酸と言っていいのですが実際には使われていません。酢酸(醋酸、英語で acetic acid)は、簡単なカルボン酸の一種です。酢酸がほとんど電離しないのは弱酸だからです。酢酸はエタン酸 (ethanoic acid) ともいいます。純粋なものは冬に凍結することから氷酢酸(ひょうさくさん)と呼ばれます。2分子の酢酸が脱水縮合すると別の化合物の無水酢酸となります。酢酸は、酢(食酢)の主成分として知られる有機化合物です。化学式はC2H4O2(示性式はCH3COOH)で表わされます。無色透明の液体であり、強い酸味と刺激臭を持ち、食酢には酢酸が3~5パーセント程度含まれています。高純度の酢酸は低温で結晶するため「氷酢酸」と呼ばれます。間違わないようにしてもらいたいのはアセチル基はCH3CO-であり、酢酸基はCH3COO– です。
酢酸は古代文明から食酢として知られていました。化学物質としての酢酸は8世紀に発見され、英語ではacetic acidですがaceticには「酢の」「すっぱい」という意味の形容詞であり、acidは「酸」を意味する名詞です。日本には江戸時代に蘭学として伝わり、蘭学者の宇田川榕菴により「酢酸」と訳されました。ちなみに宇田川は「金属」「酸素」「水素」「物質」をはじめ多くの科学用語を初めて用いました。
酢酸の主な用途としては、調味料(食酢)としてのみならず酢酸ビニル等の化学物質を作製する原料となります。酢酸ビニルは合成樹脂の原料として、酢酸エステルは塗料の原料などとして用いられます。
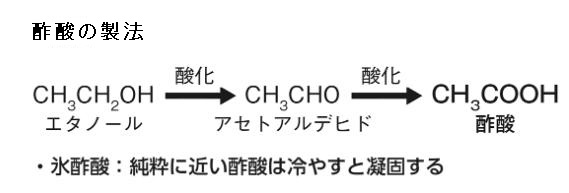
酢酸の製法は左の式でお分かりのようにエタノールから作られます。エタノールとは、アルコールの一種で、示性式はCH₃CH₂OH で揮発性の無色液体で特有の芳香を持ち、別名はエチルアルコールです。酒を酒たらしめる化学成分であり、酒精とも呼ばれます。エタノールが酸化されてアセトアルデヒド(CH3CHO)になり、さらにアセトアルデヒドが酸化されて酢酸(CH3COOH)が生成されます。
⑦グリカンとは何でしょうか?
ポリサッカライドのことです。日本語で多糖です。多糖については後で詳しく説明します。
⑧ヒアルロン酸とは何でしょうか?
ヒアルロナンともいいます。目の水晶体の成分として見つけられました。代表的なグリコサミノグリカン(ムコ多糖)であり、代表的なムコ多糖体です。皮膚、腱、軟骨などに含まれています。大切なことは他のグリコサミノグリカンと異なって硫酸基を持っていません。下にコンドロイチン、コンドロイチン硫酸、コンドロイチン4硫酸、コンドロイチン6硫酸と硫酸と硫酸基の構造図を書いておきます。
コンドロイチンはグルクロン酸とN-アセチルガラクトサミンのヘテロ多糖であります。ヘテロ多糖とは、異なった二種以上の単糖類から成る多糖で、寒天のアガロース,コンブのアルギン酸,グルコサミノグリカン(グリコサミノグリカン)などです。これらのヘテロ多糖のいくつかはアミノ糖を含んでいます。アミノ酸を含む多糖の動物性粘性物質をムコ多糖というのは既に述べました。
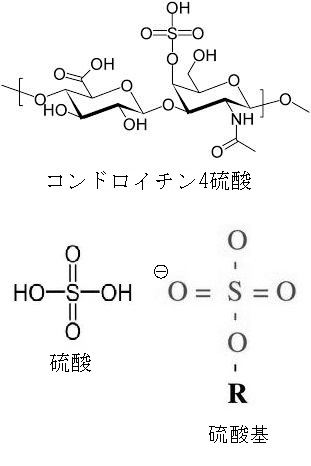
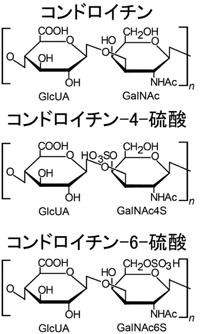
C-4が硫酸化されたものがコンドロイチン4硫酸です。N-アセチルガラクトサミンのC-6が硫酸化されるとコンドロイチン6硫 酸になります。
コンドロイチンの絵図のGlcUAという略語は、glucuronic acid で日本語でグルクロン酸と訳します。GalNAcはN-acethyl-galactosamineの略語で日本語でN-アセチルガラクトサミンと訳します。GalNAc4SはN-アセチルガラクトサミン-4硫酸です。 GalNAc6SはN-アセチルガラクトサミン-6硫酸です。
⑨コンドロイチン硫酸とは何でしょう?
上図のコンドロイチン硫酸の構造式を見て下さい。グルクロン酸とN-アセチル-グルコサミンに硫酸(H2SO4)が付加したヘテロ多糖体です。ヘテロ多糖体のヘテロとは、異なったという意味で、ヘテロ多糖体というのは2種類の異なった単糖が交互に並んだ糖のことはすでに述べました。多糖というのは、単糖がグリコシド結合で多数つながった物質です。少なくとも数千個、多いもので数百万個の糖が直線状か、もしくは枝分かれしてつながっているのです。ヘテロ多糖についても後でもっと詳しく説明します。
⑩糖の誘導体と多糖とは何が違うのでしょうか?まず、糖の誘導体とは何か?
単糖の分子には-OH(水酸基)や-CHO(アルデヒド基)のように反応性の高い部位が多く、この部位でいくつかの反応が組み合わさって様々な単糖の誘導体ができるのです。この単糖の誘導体は6種類あります。1)アミノ糖(Amino sugar)、2)アルドン酸(Aldonic acid)、3)ウロン酸(Uronic acid)、4)デオキシド糖(Deoxy sugar)、5)糖アルコール(Sugar alcohol)、6)配糖体(Glycoside)の6つがあります。まず、アミノ糖の代表であるN-アセチルグルコサミンから話を始めましょう。糖の誘導体の糖は単糖ですから、1個の単糖の誘導体と書くべきなのです。例外的にはオリゴ糖(オリゴは少ないという意味です。)の誘導体の場合もありますが。オリゴ糖は単糖がグリコシド結合で10個ぐらいまでつながったものです。天然のオリゴ糖は単糖が3つグリコシド結合でつながった三糖までしかありません。
⑪多糖の中に多糖の1つとして糖たんぱく質があり、たんぱく質が糖鎖によって結びつけられています。この糖鎖とは何でしょうか?
糖鎖(glycan)とは、各種の糖がグリコシド結合によってつながりあった一群の化合物を指し、結合した糖の数は2つから数万まで様々であり、10個程度までのものをオリゴ糖とも呼びます。多数のα-グルコース分子が直線上に結合したアミロースやセルロースは最も単純な糖鎖であります。糖鎖(グリカン、Glycan) は,炭水化物(carbohydrate)や糖(sugar)という言葉が意味するところと異なり,「くさり」を強く意識した言葉です。グリカン(glycan)とは、糖が多数連なることによって新しい機能性、構造性の発現を強く意識した多糖を意味する言葉であります。プロテオグリカン(proteoglycan)はグリカンの仲間であり、決して糖タンパク(glycoprotein)のようなタンパク質の仲間ではないのです。糖タンパク質とは、タンパク質を構成するアミノ酸の一部に糖鎖が結合したものであり、ヒトにおいては、細胞表面や細胞外に分泌されているタンパク質のほとんどが糖タンパク質であるのです。
つまり、プロテオグリカンは少量のタンパク質を含むグリカンであります。
⑫複合糖質とは何でしょうか?
食べ物に含まれる一部の糖を除けば、生体内の糖はタンパク質や脂質と結合して存在しています。したがって、複合糖質は、糖たんぱく質や脂質たんぱく質などに含まれる糖鎖というべきなのです。
⑬糖の誘導体とは何でしょうか?
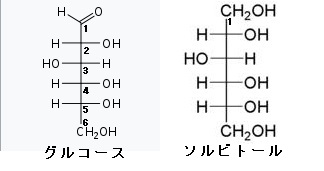
糖の誘導体という言い方は、実は単糖の化学修飾誘導体というべきなのです。もっと分かりやすく言えば、単糖の変形体というべきなのです。ぜ糖の誘導体つまり糖の変形体は多種多様なのでしょうか?それは単糖の分子には-OHや-CHOやC=Oのように反応性の高い部位が多いので、この部位に6種類の単糖の変形体、言い換えると単糖の分子の中にある反応性の高い-OH(水酸基)や-CHO(アルデヒド基)やC=O(カルボニル基)やOやCに様々な化学物質が付いたり、変えられたり、修飾されたりすることで糖の誘導体が出来てしまうからです。1)アミノ糖というのはアミノ酸のアミノ基のHが糖のアセチル基(CH2CO-)と入れ替わってできます。さらにグルコース(糖)のC-2の-OH基がアミノ基(-NH2)に入れ替えられたものが1)のアミノ糖でありますが、さらにこのアミノ基の水素がアセチル基(CH2CO-)で置き換えられたものがN-アセチルであるアミノ糖なのです。2)ウロン酸という糖の誘導体は、グルコース(単糖)のC-6が酸化されてカルボキシル基になったものです。つまりCH2CO-が-COOHになってウロン酸という誘導体が生まれるのです。このウロン酸は配糖体やムコ多糖や細菌の多糖などを構成する単糖となっています。6炭糖のウロンさんが多くあり、グルクロン酸やガラクツロン酸やマンムロン酸やイズロン酸がウロン酸の6炭糖です。3)糖アルコールは単糖のカルボニル基(C=O)が還元されて-OHに変化したものです。語尾が~イトールになります。糖アルコールはアルジトールともいいます。人工甘味料のキシリトールは単糖のキシロースが糖アルコールになったものです。この人工甘味料のキシロースは小腸で吸収されても代謝されずに排泄されるのでダイエットで用いられることがあります。単糖の糖アルコールには、有名な天然のイノシトールがあり、このイノシトールは5個の異性体があり、イノシトールの前に、myo–,D–,L–,muco–,scyllo–をつけて5種の異性体を示します。左にmyo-イノシトールの構造図を掲載しておきます。糖アルコールで有名なのは左の図のソルビトールです。ソルビットとも呼ばれ、さらにグルコースから作られる糖アルコールですから、グルシトールとも呼ばれます。ソルビトールはトウモロコシのデンプン由来の糖アルコールですから、デンプンはグルコースの多糖ですからグルコース由来の糖アルコールがソルビトールです。
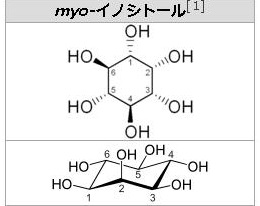
イ ノシトール (inositol) は、シクロヘキサンの各炭素上の水素原子が1つずつヒドロキシ基(-OH)に置き換わった構造(1,2,3,4,5,6-シクロヘキサンヘキサオール)を持ちます。広義にはビタミンB群の1種であり、糖尿病などが原因で体内でイノシトールが不足すると、神経症状が起こります。
4)デオキシ糖というのは、単糖が持っている-OHが-Hで置き換わったものなのです。それがN-アセチル-ノイラミン酸なのです。糖鎖に含まれるL-フコースという6-デオキシ-Lガラクトースもデオキシ糖であります。N-アセチル-ノイラミン酸はC-3が還元されているのでシアル酸ともいわれるのですがアミノ糖であると同時にデオキシ糖であるのです。特に5炭糖のデオキシ糖はDNAの成分として重要です。単糖が還元されると、つまり単糖の酸素(O)がなくなると酸素が除かれるのですが、英語でデオキシ(除酸素)になり、その結果、デオキシ糖が生まれるのです。一番有名なのはDNAのデオキシ-リボース(5炭糖)のC-2が還元されて、-OHが-Hに変わってしまうのです。-OHのOが除かれて還元されて-Hになるのです。
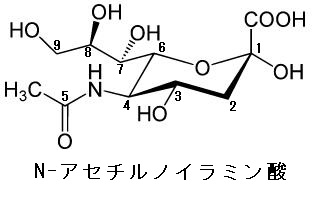
N-アセチル-ノイラミン酸は英語でN-Acetyl-neuraminic-acidと書き、縮めてNeu5AcとかNeuAcとかNANAと書きます。皆さんNeu5Acの5という数字が気になりませんか?この5は左図のN-アセチル-ノイラミン酸の5番目のCにAc(アセチル基)が付いていることを示しています。いずれにしろ、僕の論文は素人には難しいとはわかっていますが、僕自身が全てを理解するために書き綴っています。脳のガングリオシドの分解で得られるアミノ糖であるN-アセチルノイラミン酸はスフィンゴ脂質の一種であるセラミドと結合することによってガングリオシドを生じます。セラミドは正式名はN-アシルスフィンゴシンでありすべてのスフィンゴ脂質の土台となっています。ちなみにガングリオシドと関連があるガングリオン(ganglion)という意味は神経節、結節腫、中枢という意味があり、脳にガングリオシドが多いことを示唆しています。さらにスフィンゴ脂質は髄鞘の原料となっています。セラミドはスフィンゴ脂質の一種であり、スフィンゴシンと脂肪酸がアミド結合した化合物群の総称であります。
ガングリオシド(Ganglioside)とは、糖鎖上に1つ以上のシアル酸(N-アセチルノイラミン酸)を結合しているスフィンゴ糖脂質の一種です。現在40種類以上のガングリオシドが発見されており、それぞれN-アセチルノイラミン酸の数と位置が異なっているだけの違いです。ガングリオシドは細胞膜表面の脂質ラフトに集中して存在し、細胞のシグナル伝達も調節しています。脂質ラフト(lipid raft)とは、細胞膜に存在するスフィンゴ脂質とコレステロールに富む細胞膜上の領域です。このガングリオシドはシアル酸が最も多い型となっています。2番目はN-グリコリルノイラミン酸です。インフルエンザA型ウイルスが結合する糖鎖分子です。細胞表面上の糖鎖末端のNeu5Acは、インフルエンザA型ウイルスが感染を開始する受容体として利用しています。
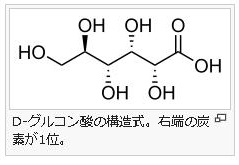
5 )アルドン酸 アルドン酸(aldonic acid)とは、単糖のアルドース(代表はグルコースです)を酸化して得られる誘導体のうち、アルドースの1位のアルデヒド基(別名ホルミル基)がカルボキシル基に変わったカルボン酸の総称です。アルドン酸の名称は語尾が~オン酸となります。例えば、アルドン酸の代表例であるグルコン酸は、グルコースを酸化して合成されます。左にグルコン酸の構造図を掲載しておきます。6)配糖体 グリコシドともいいます。糖がグリコシド結合で他の分子とつながった物質です。狭義にはO-グリコシド結合した物質であり、糖以外の部分をアグリコンといいます。配糖体の元となる糖をグリコンと呼び、残りの原子団に水素を結合させたものをアグリコンと呼びます。広義には、グリコシド結合における酸素原子(O)が窒素や硫黄など他の原子によって置換された構造の化合物も含みます。硫黄原子と結合したものはS-グリコシド結合、窒素原子と結合したものはN-グリコシド結合と呼びます。
糖鎖とは何でしょうか?
糖鎖(glycan)とは、文字通り単糖がつながった鎖です。各種の単糖がグリコシド結合によってつながりあった一群の化合物を指します。結合した単糖の数は2つから数万まで様々であり、10個程度までのものをオリゴ糖とも呼びます。多数のα-グルコース分子が直線上に結合したアミロースやセルロースは最も単純な糖鎖とも言えます。アミロースやセルロースはホモ多糖の代表ですから、糖鎖(グリカン)と多糖(polysaccharide)は同じものだと考えてもいいのです。
化学式は何でしょうか?化学式と分子式と構造式の違いは何でしょうか?
化学式(英語で chemical formula)とは、元素記号を使って物質の組成や構造を表した式のことをいいます。化学式には、1)組成式、2)分子式、3)示性式、4)構造式の順に詳しい表記になります。
1)の組成式とは、物質の元素組成を表した化学式のことです。実験で定められる式であるため、実験式ともいいます。化合物を構成している原子の種類と割合を最も簡単な整数比で表しています。
2)の分子式とは、分子を構成する原子の種類と数を表した化学式のことです。分子式がわかると物質を構成している原子の総和がわかるので分子量を求めることができます。
3)の示性式とは、分子式中の官能基を区別して書いた化学式のことです。
4)構造式とは、分子中の化学結合を記述し分子構造を表した化学式のことです。構造式においては分子中の化学結合を示すために、価標(かひょう)と呼ばれる直線で表示されます。単結合は1本線(-)、二重結合は2本線(=)、三重結合は3本線(≡)で表されます。例えば、水素(H2)はH-H、酸素(O2)はO=O、二酸化炭素(CO2)はO=C=O、アセチレン(C2H2)はH-C≡C-Hと表されます。
リウマチは自己免疫性疾患ではなくて、関節の細胞にヘルペスが感染し、ヘルペスが増殖するために様々な関節の細胞を傷つけかつ変性死させて、関節の細胞が崩壊していくために生ずるということを理解してもらうための関節全体の基礎知識について詳しく書いてきました。これからは関節の成り立ちそのものについて取り組んでいきましょう。
関節の支持組織(結合組織)であるムコ多糖体(グリコサミノグリカン)やコンドロイチン硫酸などをはじめとする組成は、全て糖の誘導体か多糖体であるので、関節の病気、つまり関節の支持組織(結合組織)の病気を説明するためには、糖の基本を知っておかねばならないので、長々と糖を作る単糖について詳しく述べました。しかし関節の組織は単糖で出来上がっているのではなくて、糖の誘導体とか単糖の集まりである多糖の話も今後詳しくせざるをえなくなります。
さらに関節の病気の代表はリウマチでありますが、リウマチのみならず他の関節の病気の根元は、実はヘルペスウイルスと免疫の戦いが人体の全ての関節で行われうるので、糖の複合体で作られている関節の支持組織が崩壊し、症状によって病名がつけられるだけであることを実証していきましょう。世界中の医者が論じているように、リウマチは最後は何も自己免疫疾患によって骨組織が破壊されるわけではないということをさらに詳しく説明していきましょう。
1.関節軟骨の構造
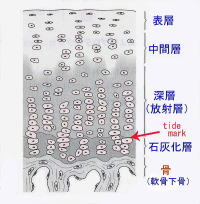
関節軟骨は硝子軟骨からなり、白色で光沢があり、粘弾性に富んでいます。左の図のように関節軟骨は1)表層、2)中間層、3)深層(放射層)、4)石灰化層の4層の層状構造をとります。放射層と言われる深層と石灰化層との間にtide mark(石灰化前線)と言われる境界線があります。石灰化層は軟骨下骨と言われる骨と強固に連結します。Tide markはhematoxylin(ヘマトキシリン)染色で濃染する線状に見える部分です。
そもそも軟骨とはなんでしょうか?
軟骨細胞とそれを取り囲む基質からなる結合組織です。ところがこの結合組織中には、左の関節軟骨の絵図でわかるように血管、神経、リンパ管はありません。軟骨は、軟骨基質の成分によって3つに分けられ、1)硝子軟骨、2)線維軟骨、3)弾性軟骨の3つです。この3つは、軟骨基質の成分によって弾力性の特性が異なるのは、軟骨細胞の違いではなくて、軟骨細胞が作り出し、細胞外へ放り出す基質(matrix)が決めるのです。この基質を細胞外基質といいます。
軟骨における細胞外基質を、軟骨基質(軟骨細胞が作り出した基質)といい、軟骨基質の主成分は、コンドロイチン硫酸などのプロテオグリカンです。プロテオグリカンについては後で書きます。コンドロイチン硫酸は硫酸化多糖類の一つです。コンドロイチン硫酸は大量の陰電荷を持っているので、+イオンであるナトリウムイオンを引きつけるので、ナトリウムに引き寄せられた水和水が一緒に寄ってくるので、軟骨は豊富な水分を含んでいます。特にコンドロイチン硫酸は硫酸基を多くふくんでいることで、この点が他の多くの多糖類との大きな違いで、硫酸基の特徴は、なんといっても水分を貯蔵する力です。
軟骨細胞は、軟骨基質の中の軟骨小腔と呼ばれる穴の中に入っています。既に述べたように、軟骨細胞は、線維芽細胞から分化した軟骨芽細胞から分化します。線維芽細胞は、結合組織のあらゆる細胞の幹細胞(stem cell)といってもいいほどの万能細胞です。iPSを作った山中先生もそもそも線維芽細胞は万能細胞になりやすい特性に目をつけて、この線維芽細胞(ファイブロスト)に山中4因子を入れてiPSに変えたのです。線維芽細胞とちがってiPSは癌の心配がいつもとりつくので、癌を作る力はiPSには負けますけれどもね。アッハッハ!線維芽細胞は絶対に癌にはならないからです。アッハッハ!軟骨細胞は分裂するときには密集していますが、周囲に軟骨基質を分泌するにつれて隙間(すきま)が開いていきます。そのため、完成した軟骨では、一つの軟骨小腔には2〜3個の軟骨細胞しか入っていません。軟骨全体は、軟骨膜によって包まれるのが普通でありますが、可動性が必要である関節軟骨は軟骨膜によって包まれていません。既に述べたように、血管は軟骨の中には侵入せず、軟骨細胞は、組織液を介した拡散によって酸素や養分を受け取り、かつ代謝老廃物を組織液に排出します。軟骨細胞は、目の水晶体やガラス体の細胞に似ていますね。
上に述べたように、軟骨は軟骨細胞が作る軟骨基質の成分によって3種類に分けられ、それぞれの組織にふさわしい力学的特性を持っています。それぞれ軟骨について詳しく説明しましょう。
1つ目の硝子軟骨(「ガラス軟骨」とか「しょうし軟骨」と読みます。)は、最も一般的に見られる軟骨で、関節面を覆う関節軟骨、気管を潰れないように囲っている気管軟骨や甲状軟骨、胸郭の可動部分となる肋軟骨などがあります。皆さん硝子軟骨というと硬くて割れやすい軟骨というイメージが湧くでしょう。液体を溶融状態から冷却したとき、結晶せずに固形化し、原子の配列が液体に似た不規則な状態になっている三次元無規則網目(あみめ)構造物質ですから、水に溶けやすいのです。さらに眼球の中心にガラス体があるのをご存知でしょう。あのガラス体はガラスのように硬くて壊れやすいのではなくて、眼の前眼部(角膜や水晶体)の後方に位置して網膜に包まれ、眼球の球内を満たしている透明な寒天様物質であって、決して硬いガラスではないのです。(寒天は、テングサ(天草)の紅藻類の粘液質を凍結して乾燥したものです。)なぜならば、このガラス体の主成分はコラーゲンというタンパク質からできているからです。このコラーゲンは水分を吸収する力が強く窓ガラスのガラスとは全く異なっているのです。この硝子という言葉は目の硝子体(しょうしたいとか、ガラス体)で用いられていますが、この硝子体は眼球の器官の一つで、水晶体の後方にあり、内腔をうめる透明なゼリー状の組織であります。硝子軟骨は硬い軟骨ではないのです。硝子軟骨を軟体軟骨と変えた方が的確で覚えやすいでしょうに。残念です。
生涯見られる硝子軟骨(軟体軟骨と言った方がいいのですが)であるため、永久軟骨といいます。軟骨には、骨形成を行う成長軟骨と骨化しない永久軟骨(静止軟骨、関節軟骨、気管軟骨、耳介軟骨など)の2種類があります。軟骨から構成される長管骨の原基は石灰化し軟骨内骨形成(軟骨内骨化)を行いますが、一方、一生涯軟骨として存在する気管軟骨などの永久軟骨も加齢に伴って石灰化することもあり得ます。
ヒトの胎児期においては、全身の骨格が硝子軟骨(軟体軟骨?)として現れ、これが骨に置換され、出生後も成長期においては、全身の長骨に骨端軟骨(成長軟骨)とよばれる一時的な軟骨の層があり、これが成長に合わせて骨に置換され続けるのを軟骨性骨化とか軟骨内骨化とか内軟骨性骨化といわれるのが成長軟骨です。決して軟骨が骨になるのではなくて、軟骨のある部分が骨と入れ替わるだけです。胎生期は軟骨で偽の骨格が作られているのですが、本当の骨ではないのです。
軟骨細胞は肥大化後、やがて細胞死(アポトーシス)します。細胞死中の軟骨細胞は破骨細胞に取り込まれて処理され、軟骨細胞がなくなった部分には、骨芽細胞が骨基質を分泌して本当の骨を形成します。成長期では、軟骨細胞が破骨細胞に吸収される速さと、骨芽細胞によって石灰化していく速さが等しく、その結果、骨芽細胞による石灰化が増えていくと骨がどんどん作られ、身長が伸びていきます。
2つ目の線維の多い線維軟骨は、椎間円板(椎間板)、恥骨結合、関節半月などに見られます。また、通常の硝子軟骨でできている関節の関節包と関節軟骨の移行部には線維軟骨があります。これも永久軟骨です。軟骨基質にタンパクでできている固いコラーゲンを多く含むので、線維の多い軟骨としては固く、強い圧力に耐えることができます。
3つ目の弾性軟骨は、耳の耳介にある耳介軟骨や、嚥下時に食物が気管に入らないように蓋をする喉頭蓋の軟骨などです。耳介軟骨も一部はガラス軟骨でできているのは、既に述べました。物が器官に入らないように柔軟性のある弾性軟骨も永久軟骨です。軟骨基質は、弾性線維を多く含むため、硝子軟骨や線維軟骨と比べ、柔軟でかつ弾力性があります。胎児の時の骨は全て軟骨ですが、ほとんどの軟骨は骨になってしまいますが、残りの一部の軟骨が分化して硝子軟骨、繊維軟骨、弾性軟骨になってしまうと、全て永久に軟骨を続けるので、永久軟骨といいます。永久軟骨といわれるのは、ひとたび軟骨が分化して硝子軟骨、繊維軟骨、弾性軟骨の3つになってしまうと、生涯にわたって永久に同じ役割を果たし続けるという意味で、永久に変わらない軟骨というのです。
さて、硝子軟骨に属する関節軟骨の厚さは1mm位から、最大の膝蓋軟骨で5mmにもなります。関節軟骨は、深部の骨と強固に連結するために、関節軟骨の中でも深層は石灰化していきます。関節の線維芽細胞や軟骨細胞にヘルペスが感染して軟骨細胞が崩壊すると、軟骨細胞は細胞外基質が作れなくなり、関節軟骨が深部の骨と強固に連結することができなくなるために、関節の骨が破壊されて、関節の形状を維持できなくなるのを、ありもしない自己免疫疾患のリウマチという病気のために生じると、自己免疫疾患論者は主張するのです。間違いですね。何も自己の免疫が自己の成分である自己の骨までしゃぶり尽くしているわけではないのです。上の図で描いたように、関節軟骨には表層の未石灰化層と深層の石灰化層が存在し、それらの間にタイドマークと言われる石灰化前線という境界が形成され、それが軟骨の石灰化の前線としての目印になっているのです。つまり石灰化の前線であるタイドマークは、軟骨が骨に置換され続けているマーカーとなり、これを軟骨性骨化とか内軟骨性骨化とか軟骨内骨化とかというのは、軟骨が骨を作っているわけではないことを示しているのです。
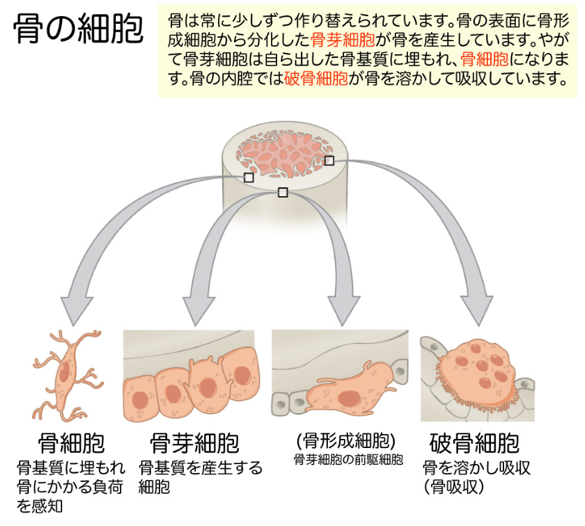
左の絵図にどのようにして骨 が作られるか、ついでに示しておきましょう。骨形成細胞から分化した骨芽細胞が、骨の表面に存在しています。骨芽細胞も自分が作った骨基質(骨マトリックス)に埋もれ、骨細胞に分化します。骨の内側の内腔の表面には破骨細胞が存在し、古くなった骨を溶かして吸収しています。従って、軟骨細胞にヘルペスは感染するのみならず、さらに軟骨組織のさらに奥にある骨組織の骨芽細胞や破骨細胞にも感染し、ヘルペスウイルスが増殖するたびごとに、これらの細胞の機構やアミノ酸やエネルギーを使い尽くして殺していくのも、リウマチ論者は、リウマチという自己免疫疾患で自分の免疫が軟骨組織のみならず、骨組織も破壊していくという間違いを言い続けているのです。悲しいですね。
さて、軟骨を骨に変えていく境界線である石灰化前線(tide mark)という境界の重要性は、近年の人口の高齢化に伴って変形性膝関節症(Osteo-arthritis of the knee、略してOA)患者が増加しており、これが身体的な活動制限や寝たきり状態を引き起こします。
Osteo-arthritisの本来の訳は“骨関節炎”であるにもかかわらず、日本では変形性関節症と訳されることが多いのです。“炎”は炎症の事で、急性疾患であり、かつ慢性疾患となる「病気」の一つです。“症”は痛みなどの「症状」を表す言葉であり、病気ではありません。このように炎と症は意味が全く違うにもかかわらず、アメリカで使われているOsteo-arthritisの日本語訳は本来、骨関節炎と訳すべきなのです。なぜならばOsteoが骨であり、arthritisは関節炎という意味であるからです。なぜ日本の整形医学者は変形性関節症と、まるで違った訳にしてしまったのでしょうか?答えは簡単です。炎症であれば、必ず免疫が戦うべき敵、つまり病原体を探し出す必要があるのですが、彼らは探し出すことができなかったのです。この病原体はヘルペスであるのです。しかし日本でもアメリカでもOsteo-arthritisの原因がヘルペスであると主張する人は私以外に誰もいません。かつ日本語訳は“骨”を“変形性”とすり替えています。変形性という言葉に変えたのは、年寄りに多い病気ですから、加齢が原因だと思い込んだからです。全くとんでもない訳が日本で生まれたのです。さらにこのような誤訳を起こしたのは、日本中の医学界は病気を症状と同一視しているという間違った概念が支配しているからです。それは症状をとれば病気が治ったと愚かな一般大衆に思い込ませるためであるのです。
これから私が世界で初めて正しいOAの原因と治療法を証明しようとしているのですが、結論から言うと、OAの原因はヘルペスであり、治療法は抗ヘルペス剤を投与することです。巷にいわれているように、他の一切の原因は間違いであり、治療法も間違いであることを証明したいのです。その為に、現代の整形外科学会の考え方をまな板の鯉としながら、批判をして行きたいと思います。念のために言えば、Osteo-arthritisの正しい日本語訳は骨関節炎であります。Osteo-arthritis of the kneeの正しい日本語訳は膝-骨関節炎であります。
まず、なぜ歳を取れば取るほど、変形性膝関節症をはじめとする全ての関節症を引き起こすのでしょうか?それは、歳を取れば取るほど、ストレスの多い人生を送ってきた老人にヘルペスが大量にあちこちの組織に増殖してしまっているからです。ちょうど老人のアルツハイマー病による認知症の発症の理由と同じです。過去の人生で耐えることが多かった老人の脳の海馬に増殖したヘルペスが多すぎたためです。これらの関節症はヘルペスが感染した線維芽細胞や関節軟骨細胞や骨芽細胞や破骨細胞に感染したヘルペスによる細胞変性障害や細胞変性死の結果生じたものであることを既に説明しました。決して自己の細胞が自己の軟骨や骨を攻撃して生まれた自己免疫疾患ではないのです。関節軟骨の構造と機能の維持には、石灰化層やその深部の骨の形成状態が関わり、タイドマーク(石灰化前線)付近の構造が重要です。リウマチは関節を構成する様々な細胞に、とりわけ線維芽細胞、軟骨芽細胞、軟骨細胞、骨芽細胞、破骨細胞などの細胞にヘルペスが感染したためです。ちなみにヘルペスウイルスの特技は人を殺す腕は全くないのですが、人体の全ての細胞に感染して増殖し続けるたびに、こっそり感染した細胞を殺しまくるという才能です。その結果、それぞれの細胞の機能不全が生ずるために、様々な不都合な症状が出現するのです。ところが、世界中の医者たちは誰もこの真実を口にしません。ひょっとすればこの真実を知らないのかもしれませんね、アッハッハ!
OA(Osteo-arthritis of the knee)の病理学的な組織所見では、タイドマーク(石灰化前線)の不整や重複化に加え、関節表面方向への移動や軟骨下の骨の肥厚が見られるのも、軟骨細胞に感染したヘルペス細胞が増殖するときに軟骨細胞死を起こしたために石灰化前線の境界が不鮮明になってしまうのみならず、関節組織の正常な構築が崩壊するためです。
関節軟骨は80%の水分と、20%のマトリックス(軟骨基質)とわずかな軟骨細胞により構成されます。このマトリックスは、純粋タンパク質であるコラーゲン(乾燥重量の60%)とタンパク質と多糖類の複合体であるプロテオグリカン(乾燥重量の10%)から構成されます。プロテオグリカンについては、後で詳しく書きますが、プロテオはタンパクという意味であり、グリカンは多糖類を意味していることを知っておいてください。
特にプロテオグリカンの内、グリコサミノグリカン(glycosaminoglycan、略してGAG、日本語でムコ多糖)と呼ばれる長鎖の枝分かれがみられない多糖類が95%で、ヒアルロン酸、コンドロイチン硫酸、ヘパラン硫酸、ケタラン硫酸から成り立っており、残りの5%はタンパク質です。これから、ヘパラン硫酸、ケタラン硫酸、ヒアルロン酸、コンドロイチン硫酸、について詳しく説明していきましょう。
ヘパラン硫酸(Heparan sulfate、略してHS)は、ヘパラン硫酸プロテオグリカン(Heparan sulfate proteoglycan、略してHSPG)とも言います。ヘパラン硫酸は、糖質のグリコサミノグリカンファミリーのメンバーであり、構造がヘパリンと非常に密接に関連しているので、ヘパラン硫酸と名づけられました。ヘパリンは、抗凝固剤として知られており、主に肥満細胞の分泌顆粒に見られる高度に硫酸化されたヘパリン硫酸(HS)と言っても良いのです。どちらも、さまざまに硫酸化された繰り返し二糖ユニットで構成されている線状多糖類です。2つまたは3つのHS鎖が細胞表面または細胞外マトリックスタンパクと結合しているプロテオグリカン(HSPG)の一部になっているので、HSのことをHSPGと言うのです。HSは、様々なタンパク質と結びつき、血管形成、血液凝固、腫瘍の転移に関わっています。さらにHSは、多くのウイルスの細胞受容体として機能しており、特に新型コロナウイルスがACE2に付着した場合に、HSがSARS-CoV-2感染に関割っているのです。ACE2というのは、英語でAngiotensin-converting enzyme 2(アンジオテンシン変換酵素2)で、今をときめく英語です。このACE2について詳しく勉強しましょう。
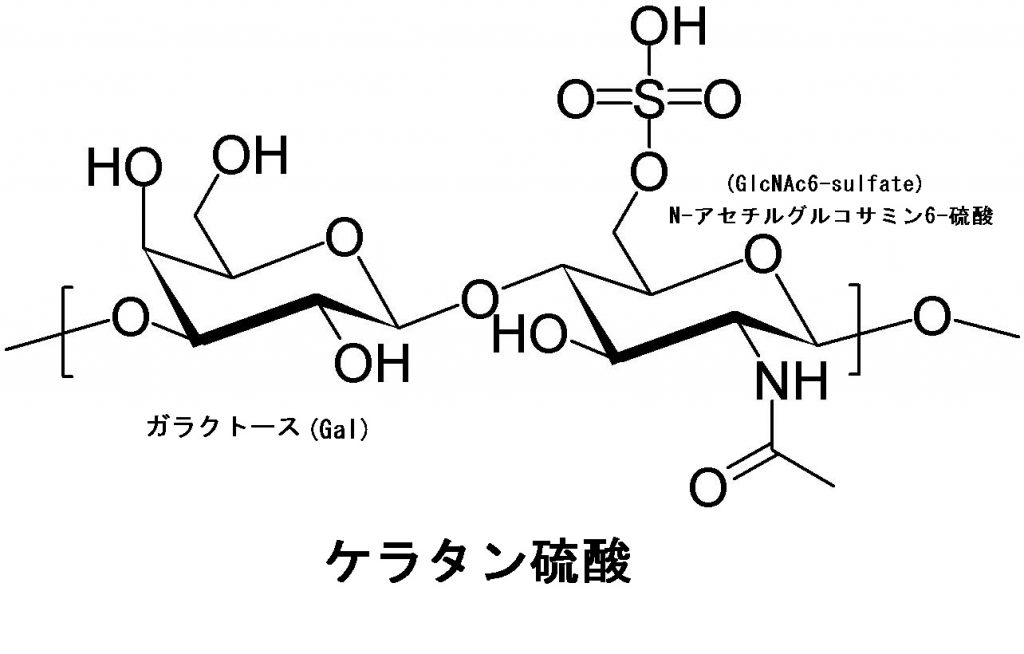
ケラタン硫酸は、英語でKeratan sulfate、略してKSとか、ケラト硫酸(Kerato-sulfate)と言われます。人間の角膜、軟骨、骨に見られる硫酸グリコサミノグリカンです。ガラクトースとN-アセチルグルコサミン6-硫酸の2種類のヘテロ多糖です。他のグリコサミノグリカン(ムコ多糖)と違い、ウロン酸を含んでおらず代わりにD-ガラクトースが含まれているヘテロ多糖です。ケラタン硫酸は通常、-Gal-GlcNAc-の二糖の繰り返しで構成されています。一般に、髄核、軟骨に見られるケラタン硫酸(KS)は、角膜のケラタン硫酸に比べて硫酸基の含量が多いのです。左の図では、GalとGlcNAcとの結合様式は、O-グリコシド結合となっています。
コラーゲンとプロテオグリカンについて重複するところがありますが詳しく説明しましょう。
コラーゲン(collagen)は、主に脊椎動物の真皮、靱帯、腱、骨、軟骨などの組織の支持組織(結合組織)を構成する構造タンパク質のひとつです。他の構造タンパクとしては、αケラチンがあります。コラーゲンは、線維芽細胞や軟骨芽細胞や軟骨細胞が作る細胞外基質(細胞外マトリクス)の主成分です。体内に存在しているコラーゲンの総量は、ヒトでは、全タンパク質の約25%を占めます。また、コラーゲンは支持組織の細胞外マトリクスを作っているので、動物の真皮で作られた皮革は、まさにコラーゲンが主成分であります。革靴を履いている時は、コラーゲンを履いていると思ってください。アッハッハ!コラーゲンに熱を加え変性させて抽出したものがゼラチン(gelatin)であり、食品、化粧品、工業製品などあらゆる分野で大量に用いられています。
ゼラチンは、動物の皮膚や骨、腱などの結合組織の主成分であるコラーゲンに熱を加え抽出したものであり、化学的にはアミノ酸の直鎖状ポリマー(タンパク質)が主成分であります。乾燥粉末のゼラチンに含まれる栄養素のほとんどはタンパク質です。タンパク質を構成する必須アミノ酸ではリジンが多く含まれる一方でトリプトファンはまったく含まれていないので、ゼラチンのアミノ酸スコアはゼロとなります。ゼラチンの第一制限アミノ酸はトリプトファンです。またメチオニンの量が相対的に少ない組成となっています。非必須アミノ酸に関しては、グリシンとプロリンが大変多く含まれており、この2つで重量比の3割強を占め、グルタミン酸も合わせると半分近い重量を占めています。
コラーゲンタンパク質の構造は、ペプチド鎖を構成するアミノ酸残基は、グリシンの後に2つのアミノ酸が続き、再びグリシン残基が現れ、その後にまた2つのアミノ酸が続くという繰り返しを3残基ごとに見られる一次構造になっています。このグリシンの後に2つのアミノ酸が続く繰り返し配列は、コラーゲン様配列と呼ばれ、コラーゲンタンパク質の特徴です。例えば、I型コラーゲンでは、この(グリシン)―(アミノ酸X)―(アミノ酸Y)という繰り返し配列が1014アミノ酸残基の繰返えし配列となっています。コラーゲンタンパク質分子を構成する1本のペプチド鎖はα鎖と呼ばれ、分子量はI型コラーゲンの場合は、10万程度です。I型コラーゲンの分子の長さはおよそ300 nm(300ナノメートルと読み、ナノは10億分の1です)、太さは1.5 nmほどです。 線維性コラーゲン分子が、少しずつずれてたくさん集まり、線維を作ったものをコラーゲン原繊維(線維) (collagen fibril) と呼びます。例えば、骨や軟骨の中のコラーゲンは、このコラーゲン線維をつくっており、骨基質、軟骨基質にびっしりと詰まっています。
脊椎動物は30種近くのコラーゲンタンパク質を有しており、それぞれのコラーゲンはI型、Ⅱ型のローマ数字を使って2007年の時点で28の型に分類されています。主成分は軟骨以外の組織ではI型コラーゲン、軟骨ではⅡ型コラーゲン分子です。V型やⅪ型コラーゲン分子や、Ⅸ型、Ⅻ型、XⅣ型コラーゲンも含まれます。コラーゲン線維には、ほぼ65 nm周期の縞模様が見られます。コラーゲン線維の太さは通常、数十〜百数十 nm程度です。この太さは、そのコラーゲン線維を作っているコラーゲンの各型の割合やプロテオグリカン(糖タンパク)などによって決まります。プロテオグリカンは後で説明します。コラーゲン線維は、さらに多くが寄り集まって、結合組織内(関節支持組織内)で強大な繊維を形成する場合もあります。解剖学の分野では、このプロテオグリカンは、コラーゲン繊維(線維)とか膠原繊維(collagen fiber)とかコラーゲン線維束と呼ばれます。コラーゲン線維束の太さは数μm〜数十 μm(マイクロは100万分の1)程度で、適切な染色をおこなうと、光学顕微鏡でも観察できます。
コラーゲンのアミノ酸組成はどうなっているのでしょうか?
I型コラーゲンのコラーゲン領域のアミノ酸組成は、既に述べた3つのアミノ酸(グリシン)―(アミノ酸X)―(アミノ酸Y)の繰り返しからなるポリペプチドが同じ向きに3本寄り集まって形成された三重らせん構造になっています。いちばん単純なアミノ酸であるグリシン(グリシン残基)が一番多くて1/3を占めルこともお分かりでしょう。次に唯一の環状のアミノ酸であるプロリンとプロリンに-OH(水酸基)がついたヒドロキシプロリン残基の2つを合わせて21%、グリシンに次いで2番目に最も単純なアラニン残基が11%とかなり偏った構成となっています。またコラーゲンに特有のアミノ酸残基として3-および4-ヒドロキシプロリン、5-ヒドロキシリジン残基などがあります。これらは通常のプロリンとリジン残基(リシン残基)に水酸基が小胞体内での酵素によってタンパク翻訳後に修飾されたもので、他のタンパク中にはほとんど含まれていないのです。言い換えると、コラーゲンがいかに特殊なタンパクであるかを示しています。3-ヒドロキシプロリン残基は、Gly-Xaa-Yaa-の繰り返し配列でできています。Gly-Xaa-Yaa-はグリシン-Xアミノ酸-Yアミノ酸を示しています。XaaやYaaの小文字のaaは、amino acidの略で、アミノ酸です。Xaaの位置のアミノ酸は、4-ヒドロキシプロリン残基であり、ヒドロキシリジン残基はYaaの位置にあります。4-ヒドロキシプロリン残基量の測定から、動物組織のおよそのコラーゲン量を推測することができます。ヒドロキシプロリン残基は、コラーゲンの3重らせん構造を安定化させる働きがあります。ヒドロキシリジン残基の生理的な機能は、3本のらせんのアミノ酸分子間を結びつける架橋の仕事をし、細胞外マトリックスを安定化させています。ヒドロキシリジン残基やヒドロキシリジン糖に修飾されるYaaのリジン残基の位置はランダムではなく、それぞれプロリンとリジン残基の形でタンパク質が合成された後、小胞体内で酸化酵素により付加される翻訳後修飾によって決まるのです。またこの反応の際にはビタミンCを補酵素として、鉄を補因子として必要とするため、L-グロノ-ラクトン-オキシダーゼ遺伝子の活性がないヒトではビタミンC欠乏によって正常なコラーゲン合成ができなくなり、壊血病を引き起こしてしまうのです。つまりビタミンC欠乏が起こるとL-グロノ-ラクトン-オキシダーゼ遺伝子の活性がなくなり、正常なコラーゲンが作られなくなり、壊血病が起こるのでビタミンCがいかに大切かお分かりになるでしょう。
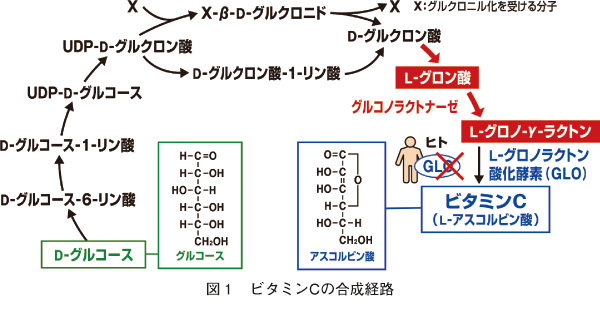
左にビタミンCの合成経路を掲載しておきましょう。ビタミンCの正式科学名はアスコルビン酸といいます。UDP-D-グルコースは、ウリジン二リン酸グルコースと読み、英語でUridine diphosphate glucoseで、ヌクレオチド糖の一種です。UDP-グルコースとも言い、代謝過程でグリコシルトランスフェラーゼの基質となります。UDP-グルコースはグルコースの活性化した形で、グリコーゲンの前駆体になったり、またUDP-ガラクトースやUDP-グルクロン酸に変換されてガラクトースやグルクロン酸を含む多糖の原料になります。さらに、リポ多糖(lipo-poly-saccharide)や スフィンゴ糖脂質の原料にもなります。
コラーゲンの機能は、あらゆる結合組織(支持組織)に、力学的な強度を与えています。若干の弾力性もあり、特に、腱の主成分は3重らせんになったコラーゲン繊維がきちんとすきまなく配列したもので非常に強い力に耐えます。腱には、筋肉が発生した引っ張り力を骨などに伝え、運動を起こす際に非常に強い力がかかるからです。また、骨や軟骨の内部では、びっしりと詰め込まれたコラーゲン細繊維が、骨や軟骨の弾力性を増すのに役立っており、衝撃で骨折などから守っています。同時に、骨のみならず皮膚の弾力性や強度にも役立っています。一方、細胞外マトリクスの成分となり、細胞間同士の接着に利用されているコラーゲンが、接している細胞に対して、増殖、分化シグナルを与える情報伝達の働きも担っています。
どうして単細胞が多細胞に進化できたのか?まずコラーゲンが、地球で初めて誕生したのは、原生代後期の全地球凍結後の6億〜8億年前であります。コラーゲンの産生には大量の酸素の供給が必要であるのです。なぜならば、コラーゲンはさまざまなアミノ酸で出来ています。アミノ酸は生成や新陳代謝を繰り返すときに大量の酸素を消費します。そのためコラーゲン生成のためには十分な酸素補給が必要となるのです。ところが6億〜8億年前の全地球凍結以前は地球においてはコラーゲンを作り出せるだけの高濃度の酸素が蓄積されていませんでした。従って、それまでの生物の進化は単細胞生物までに留まらざるをえなかったのです。ところが、全地球凍結の状態が終わり、急激な気候変動の影響で大量に酸素が作られ地球に蓄積しました。この影響により単細胞生物がコラーゲンを作り出す事に成功し、初めて細胞同士が接着できるようになり、単細胞生物の多細胞化が促進されたのです。今日に見られる多細胞生物(動物・植物・原生生物・真菌類)は全てこのコラーゲンの生産に成功した種の子孫であるのです。まさにチャールズ・ダーウィンが発見した外部環境と内部環境に適応した種が多細胞生物であったのです。ところがその子孫である植物は細胞間接着にコラーゲンを用いず、セルロースを用いています。コラーゲンを細胞間接着として利用している生物は動物と一部の原生生物に限られているのです。
コラーゲンタンパク質の種類と分布について説明しましょう。
脊椎動物は30種近くのコラーゲンタンパク質を有することが報告されており、それぞれのコラーゲンはI型、II型のようにローマ数字を使って2007年時点で28の型に分類されています。真皮、靱帯、腱、骨などではI型コラーゲンが、関節軟骨ではII型コラーゲンが主成分です。また、すべての上皮組織の裏打ち構造である基底膜にはIV型コラーゲンが主に含まれています。体内で最も豊富に存在しているのはI型コラーゲンです。これらのコラーゲンタンパク質は、すべてがコラーゲン細線維を形成するタイプではなく、コラーゲン細線維の主成分となるタイプのコラーゲンタンパク質は 線維性コラーゲンといい、線維を形成しないものを 非線維性コラーゲンと呼びます。非線維性コラーゲンでは、コラーゲン線維の表面に結合するFACIT(Fibril Associated Collagens with Interrupted Triple helices)や基底膜構造の主成分となる非常に細い網目構造を作るものや、細胞膜に結合して存在するコラーゲンもあります。
多糖とは何でしょうか?グリコシド結合とはなんでしょうか?
多糖とは一言で言いうと単糖がグリコシド結合で多数つながった物質です。多糖は英語で、poly-saccharideといい、グルコースどうしがグリコシド結合で連続的に多数重合した炭水化物の総称です。グルコースというのは、別名ブドウ糖とか、血糖とかいわれる6つの炭素からできている単糖の代表です。6つの炭素からできている単糖がグルコースですから、グルコースを6炭糖といいます。グルコースの単糖分子の全てが持っている酸素のOによって2つの単糖のグルコースなどが結びついて二糖になることをグリコシド結合といいます。グリコシド結合で連続的に多数重合した多糖の代表はデンプンであり、構成単位となる単糖であるグルコースなどとは異なる性質を示すのです。単糖数が10個を超えるときに多糖といい、単糖の数が10個まで多糖をオリゴ糖といいます。例えば、デンプンとセルロースはいずれもグルコースの多糖であります。餅米のデンプンはアミロペクチンともいいますが、100万個近くの単糖であるグルコースから成り立っている極めて大きな多糖なのです。それでは単糖とはなんでしょうか?それ以上加水分解できない糖です。その代表がグルコースなのです。それではなぜグルコースが単糖の代表なのでしょうか?それはグルコース(ブドウ糖)が地球上で最も大量に存在する単糖であり、食物中の単糖はグルコースまで消化され、さらにそれ以外の単糖であるガラクトースやマンノースやフルクトースなどの単糖も一旦グルコースに変換されてからエネルギー代謝が始まり、最終的にはエネルギー通貨であるATPが作られるからです。糖は糖質とも言いますが単糖の違いはなんでしょうか?糖(糖質)の別名は炭水化物です。この糖(糖質)を作る基本単位が単糖であるのです。糖(糖質)は、英語でsugerまたはsaccharideであり、糖(糖質)の別名は炭水化物でありますが、炭水化物は英語でcarbo-hydrateと書きます。一方、単糖は先ほど述べたように、それ以上、加水分解できない最小単位の糖であり、多糖の基本単位でありましたね。英語では単糖はmono-saccharideといいます。ここではっきりしておきたいのは、糖(糖質)と単糖は別物であるということです。それでは糖(糖質)は関節や結合組織でどんな仕事をしているのでしょうか?糖(糖質)は、人体のあらゆる結合組織において、柔らかいクッションとして働きます。さらに細胞と細胞の間などを満たしている細胞間物質がマトリックスですね。このマトリックスはネバネバした物質であり、その大半がムコ多糖なのです。ムコ多糖(Muco-poly-saccharide)のムコ(Muco)は粘液のという意味の接頭字です。しかもMuco という英語の発音は「ミューコウ」であり、「ムコ」ではありません。結局、ムコ(ミューコウ)多糖の日本語は粘液性の「ネバネバした多糖」という意味です。ムコ(ミューコウ)という言葉が付けばネバネバしている粘液が多いと連想できますね。
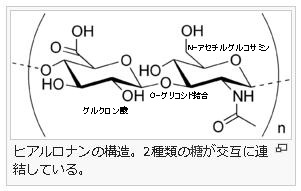
ムコ多糖とは何でしょうか?
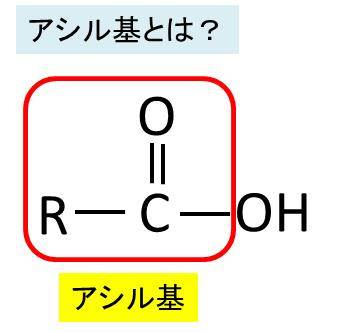
ムコ多糖は専門語としては別名グリコサミノグリカンともいいます。ムコ多糖は糖(糖質)の誘導体(糖質から誘導されて作られる物質)で、二糖単位でつながった誘導体で、代表的なムコ多糖は左図のヒアルロン酸(ヒアルロナン)なのです。このヒアルロン酸はグルクロン酸とN-アセチルグルコサミンが一個おきに順番に繋がっているのです。グルクロン酸というのは、グルコースの誘導体であります。グルコースの末端基であるヒドロキシメチル基(-CH2OH)が酸化されて、カルボキシル基(-COOH)になるとグルクロン酸という誘導体になります。グルクロン酸とは、ウロン酸(uronic acid)のひとつであり、ウロン酸とは、単糖(グルコース)を酸化して得られる誘導体のうち、主鎖の末端のヒドロキシメチル基 (-CH2OH) がカルボキシル基 (-COOH) に変わったカルボン酸の総称です。カルボン酸とはC=Oの片方に-OHが付くものです。ちなみにカルボン酸から-OHを除いたものはアシル基です。
グルクロン酸は、ネバネバした細胞間物質(マトリックス)となるムコ多糖の主成分であります。細胞間物質は細胞外物質ともいいます。ついでに言えば、ビタミンCであるアスコルビン酸もグルクロン酸に由来する補酵素と呼ばれる物質です。つまりビタミンCであるアスコルビン酸も、グルコースから作られるのです。ビタミンCはタンパクを作る酵素を活性化するために必要な補酵素です。さらにヒアルロン酸は、糖の誘導体(誘導糖)であるグルクロン酸とN-アセチルグルコサミンが一個おきに繋がっていると述べましたが、このN-アセチルグルコサミンというのも、グルコースの誘導体(誘導糖)のひとつであるのを知ってください。グルコとつけばすべて糖が成分になっている糖の誘導体と考えてください。皆さんは糖というと、エネルギー源になったり、美味しくて甘くて食べすぎるので太るから食べ過ぎに注意しなければならないと思うだけの人が多いと思いますが、糖や糖の誘導体は色々な働きがあることを改めて知っておいてください。
N-アセチルグルコサミンとは何でしょうか?
地球上でセルロースの次に多いのは昆虫や甲殻類の殻(から)に含まれているキチンです。キチンの成分は上にしばしば述べたN-アセチルグルコサミンという糖です。まずN-アセチルグルコサミンはグルコースのC-2の-OH基がアミノ基(-NH2)で置き換えられたものがN-アセチルです。次にアミノ基(-NH2)の水素がアセチル基(CH2CO-)で置き換えられたものがN-アセチルであります。つまり、2段階の反応でN-アセチルグルコサミンが作られるのです。アミノ糖には主なものは4つあります。1つ目が今、説明したN-アセチルグルコサミン、2つ目がN-アセチルガラクトサン、3つ目がN-アセチルグルコサミン6-硫酸、4つ目がN-アセチルグルコサミン4-硫酸の4つがあります。これら4つは全てムコ多糖の成分です。実は5番目のN-アセチルノイラミン酸があり、シアル酸とも呼ばれます。このシアル酸は6単糖のマンノースのC-5がN-アセチル化したもので、このN-アセチルマンノサンミンにピルビン酸が付加した糖であるのです。
シアル酸(N-アセチルノイラミン酸)とは何か?
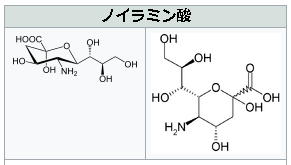
N-アセチルノイラミン酸のノイラミン酸とは何でしょうか?ノイラミン酸(neuraminic acid,略してNeu)は、特殊な9炭素の単糖です。形式的には、ピルビン酸とD-マンノサミン(2-アミノ-2-デオキシマンノース)がアルドール縮合した構造を持つ。アルドール反応とは、カルボニル基のα位の炭素に水素を持つカルボニル化合物が、アルデヒドまたはケトンと反応してβ-ヒ ドロキシカルボニル化合物が生成する反応です。アルデヒド同士がこの反応を起こすとアルドールを生成するので、アルドール反応と呼ばれるのです。縮合反応は、付加脱離反応とも呼ばれ、付加反応と脱離反応とが連続して進行する化学反応であり、カルボン酸あるいはカルボン酸誘導体からエステル、アミドなどが生成する反応が代表的な付加脱離反応でであります。特に縮合反応の内、水分子が脱離する場合を、脱水縮合と呼ぶのです。
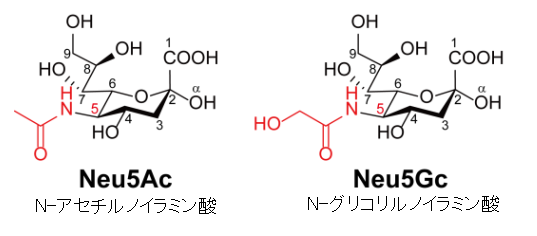
左図のシアル酸 (sialic acid) とは、ノイラミン酸 (neuraminic acid) のアミノ基やヒドロキシ基が置換された物質を総称するファミリー名である。通常糖鎖の非還元末端に存在し、細胞の認識など重要な機能を担っています。ノイラミン酸は分子内にカルボキシル基とアミノ基を持つ特殊な9炭糖でガングリオシドなどの糖鎖の一部として存在しています。カルボキシル基の炭素を1位として骨格に番号をつけています。天然には5位がアセチル化されたN-アセチルノイラミン酸 (Neu5Ac) が多く存在しています。グリコール酸で修飾されたN-グライコリルノイラミン酸 (Neu5Gc) が 次に多く存在する。 シアル酸を多く含む糖タンパク質であるセレクチンはヒトとその他の生物の結合を制御している。また、転移するガン細胞は多くのシアル酸リッチな糖タンパク質を発現しており、これらのガン細胞が血流に入るのを助けている。 細胞表面に存在するシアル酸リッチな複合糖質は細胞表面の水分を保っている。細胞表面のシアル酸リッチな部位は、生理的な条件下でカルボキシ基の一部が解離して負に帯電することもあり、細胞表面を負に帯電させる作用がある。水は極性分子なので正に帯電した部分が細胞の表面に引き付けられる。また例えば、赤血球の表面もシアル酸リッチであり、赤血球の表面が負に帯電していることで、赤血球同士が電気的に反発して凝集しにくいようになっていることなどにも関係している。
それでは、糖の誘導体が極めて多いのはなぜでしょうか?
糖(糖質)は、地球上に最も多量に存在する有機化合物であるのですが、人体に含まれる糖(糖質)などの炭水化物はたった1%であるにもかかわらず、糖(糖質)の分子には、-OH(アルコール)や、-CHO(アルデヒド)や、ヒドロキシメチル基である -CH2OH(第一級アルコール)など反応性の高い分子が多いので、この部位で何通りもの反応が組み合わさって、非常に多くの変化のある誘導体ができるからです。
プロテオグリカンとは何でしょうか?
プロテオグリカン(Proteo-glycan)は、ヒアルロン酸と結合したアミノ糖とムコ多糖(ミューコウ多糖)であるグリコサミノグリカンの高分子量ポリマーの繰り返しからできています。アミノ糖とは、C-N結合を持つアミンを含む糖のことです。アミノ糖の誘導体には N-アセチルグルコサミン、シアル酸(N-アセチルノイラミン酸)などがあります。ヒアルロン酸は直線的ポリマー(重合体)で、糖(糖質)の誘導体であるグルクロン酸と、同じくタンパク質に糖鎖付加した(グリコシル化した)N糖(糖質)の誘導体であるアセチルグルコサミン(グルコサミンのアセチル化)の二糖類の繰り返しから成り立っています。N糖というのは、N-結合型糖鎖のことです。N糖に対してO糖があり、O糖はO-結合型糖鎖のことです。糖鎖がタンパク質に結合する様式はこの2通りだけです。
糖鎖とはなんでしょうか?糖鎖は英語でglycanといい、各種の糖がグリコシド結合によってつながりあった一群の化合物です。結合した糖の数は2つから数万まで様々であり、10個程度までのものをオリゴ糖といい、多数のα-グルコース分子が直線上に結合したアミロースやセルロースは最も単純な糖鎖ですが、何万個がつながっています。糖鎖は糖同士だけでなく、タンパク質や脂質その他の低分子とも結合して多様な分子を作り出せます。糖鎖は単糖だけがつながっているのではなくてタンパク質や脂質も糖鎖に結びついているのです。これら糖タンパク質、糖脂質は生体内で重要な生理作用を担っています。
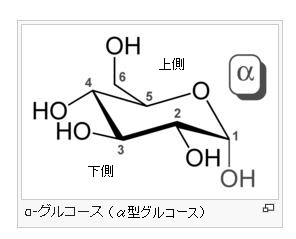
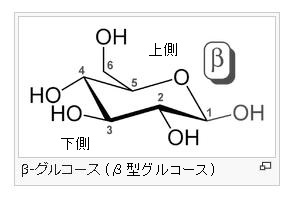
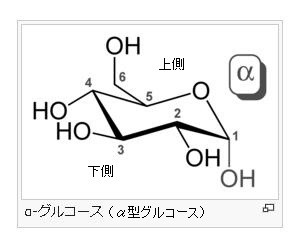
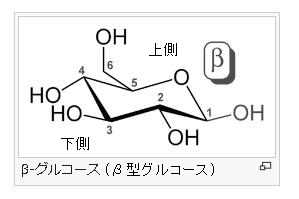
α-グルコース分子とは何でしょう?
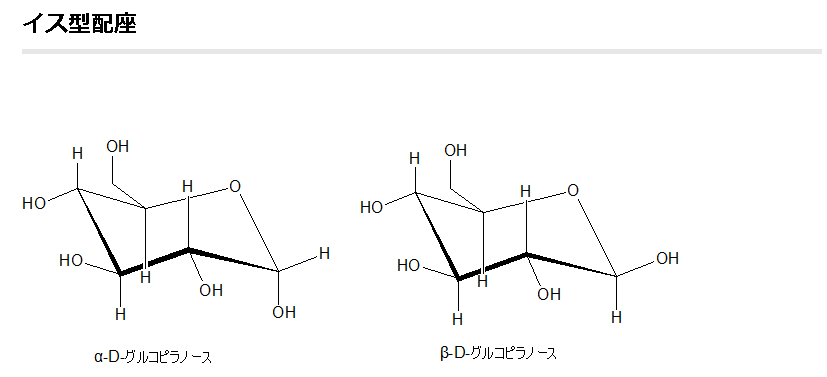
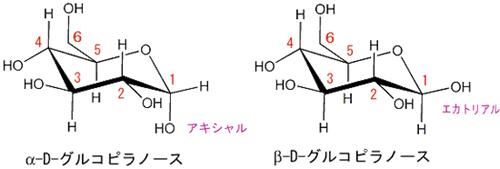
グルコース(ブドウ糖)は水溶液中では,環状構造のα型,環状構造のβ型,鎖状構造の3種類の異性体が平衡状態にあり,混合物として存在します。α型のグルコース(α-グルコ-ス)は-CH2OH基(ハイドロオキシメチル基)を上にして六員環を描いたとき,1の位置の-OH基が六員環の下側にあるものをα型グルコース(α-グルコ-ス)といい、上側にあるのをβ型グルコ-ス(β-グルコ-ス)というのは既に述べました。1の位置にある炭素原子(C)を不斉炭素原子といいます。上の2つの図の番号は不斉炭素を1とし、時計周りに炭素に1~6まで順番に番号がつけられていますね。知っておいてください。皆さん、上の図のαとβの環状グルコースの六員環のどこに-CH2OH基(ハイドロオキシメチル基)があるか図示されているかを不思議に思いません?構造図を描くときに略される元素名が2種類あることを知っておいて下さい。炭素原子のCと炭素原子に結びついた水素原子のHの2つは表示されないのです。当たり前のことであるからですが、分子の構造式をみるのに慣れていない皆さんは何がなんだがさっぱりわからない時があると思います。さらに炭素元素は4つの結合する手があり、水素元素は1つだけの血結合する手があることを思い出してください。もう一度、αとβのグルコースの環状構造図を再掲載しますから、6番目の数字の部分をよーく観察してください。実は素人向きには6番目の炭素(C)の 周辺の原子は右下のように全ての原子を書くべきなのです。
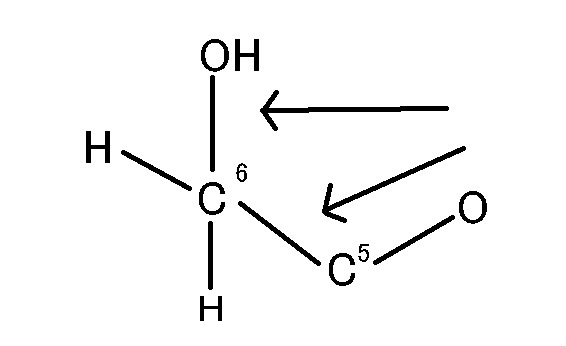
一番上の水平な矢印の先端の縦棒はC6とOが1つずつ電子の手を出し合って共有結合していることを示している棒です。
下斜め矢印の先端が示している棒は5の位置にある炭素と6の位置にある炭素が共有結合していることを示している棒です。しかも、左図のイス型の環状のαとβのグルコースには番号がついているにも関わらず、Cが略されていますが、同時にCに結合しているHも省略されていることを知って下さい。化学の初歩の知識でありますが、簡略図ではCは省かれ、かつCに結合しているHも省かれるのです。
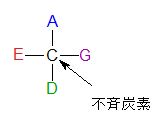
不斉炭素原子とは何でしょうか?
左に不斉炭素の絵図を再掲しておきますが、異なる 4 つの原子または置換基に共有結合している炭素を不斉炭素原子といい、英語でAsymmetric carbonとかAsymmetric carbon atomとか, chiral carbonとか, chiral centerともいいます。上のαグルコースの図で1の炭素が結びついている4つの原子はOとOHとCとHの異なった4つの原子ですので、1の炭素は不斉炭素となります。わかりますね?
タンパク質を構成するアミノ酸のうち、アスパラギンは側鎖にアミドと呼ばれる構造があります。N-結合型糖鎖とはそのアミド結合部分にN-アセチルグルコサミン (GlcNAc) がβ結合したものになります。アミド結合というのはカルボニル基(C=O)のCがOを介して別のCと結合しています。カルボン酸とアミンの反応で生じます。アミンというのは、C-N結合を有機化合物のことです。
アノマー炭素とは何か?
アノマーの訳は不斉炭素ではありません。不斉炭素の英語訳はAsymmetric carbonであり、 アノマー(anomer)とはピラノースあるいはフラノースが環状構造を取ることで発生する立体異性体の関係を示す化学用語です。ピラノースやフラノースは他の糖とグルコシド結合していない状態ではヘミアセタール(ヘミケタール)結合を生成したり、加水分解したりすることで、鎖状構造と環状構造との間で平衡が存在します。アノマーは環状構造を取ったときに、ヘミアセタール(ヘミケタール)を形成するC-1炭素が不斉炭素になることで発生する立体異性体なので、糖が単独で存在する場合はアノマー同士には平衡状態が存在します。アノマーの違いを表記する為にα-またはβ-の接頭辞が使用されています。D-Glucoseをハース投影式で記述した場合、C-1炭素のヒドロキシ基が下向きなアノマーがα-D-Glucoseであり、上向きのアノマーがβ-D-Glucoseです。
糖が5員環(フラノース)あるいは6員環(ピラノース)の環状構造を形成する際に生じる2種類の立体異性体ことを互いにアノマーであるといいます.つまり,環構造により1位炭素原子(アノマー炭素)は新たに不斉(キラル)原子となるため,この炭素に結合した水酸基の向きによりα体とβ体の2種類の立体異性体が生じます.
グリコシド結合とグリコシド化について詳しく説明しましょう。グリコシル化とはなんでしょうか?
グリコシル化は英語でGlycosylationといい、日本語で糖鎖形成とか糖鎖付加と訳します。このグリコシル化反応は、細胞膜の合成やタンパク質分泌における翻訳後修飾の重要な過程の1つであり、粗面小胞体で行われます。アスパラギン側鎖のアミドのN原子への付加はN-結合型グリコシル化、セリンとトレオニン側鎖のヒドロキシ基のO原子への付加はO-結合型グリコシル化と呼びます。
グリコシド結合は英語でglycosidic bondです。炭水化物(糖)分子と別の有機化合物とが脱水縮合して形成する共有結合です。脱水縮合とは何でしょうか?脱水縮合は分子と分子から水(H2O)が離脱することにより分子と分子が結合する反応のことです。一番身近な脱水縮合の例としては、でんぷん糊(のり)があります。でんぷん糊(のり)はでんぷんに水を加え加熱してかきまわすと出来上がります。障子紙の貼り付けに最適です。障子の枠は木材で作られます。木材はセルローズでできておりブドウ糖が結合したのもです。障子紙もセルローズでできておりブドウ糖が結合したのもです。でんぷん糊もブドウ糖が結合したのもですが、でんぷん糊のブドウ糖の水酸基(OH基)は水と良く混ざった状態でゲル状になっています。木材で出来た障子枠にでんぷん糊をつけ、障子紙を貼って乾燥させるとブドウ糖の水酸基(OH基)から水(H2O)が離脱し結合します。障子枠も障子紙もでんぷん糊も主成分はブドウ糖ですので強固に結合します。逆に障子紙を剥がしたい場合は、大量の水につけると加水分解して結合が解除されます。この特性から、でんぷん糊は障子紙の貼り付けに最も適した材料です。私たちの先人たちは理屈を知らずして経験的にでんぷん粉糊を障子張りやふすま張りに使ってきたのです。
具体的にグリコシド結合とは、単糖(または単糖誘導体)のヘミアセタールとアルコールなどの有機化合物のヒドロキシ基(OH)との間の結合です。例えば、ヌクレオシドの五炭糖の糖と塩基結合をグリコシド結合と考えてもいいのです。糖と糖以外の有機化合物とがグリコシド結合した物質は配糖体とかグリコシドと呼ばれます。配糖体の元となる糖をグリコン(glycone)とかグライコンと呼び、糖の残りの原子団に水素を結合させたものをアグリコとかアグライコン (aglycone)と呼びます。広義には、O-グリコシド結合における酸素原子が窒素(窒素配糖体)や硫黄(チオグリコシド)など他の原子によって置換された構造の化合物をも含みます。アグリコンは、配糖体のグリコシル基が水素原子に置換された後に残る非糖部分であります。例えば、強心配糖体のアグリコンは、ステロイド分子です。フィトケミカルの一部は、配糖体とアグリコンの形で見られます。
下図にグルコースとエタノールによるエチルグリコシドへの脱水縮合の絵を掲げます。
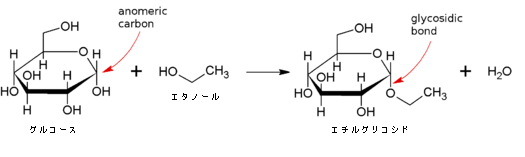
炭水化物(アノメリック炭素を含む)のヘミアセタールは反応性であり、酸の存在で容易にグリコシド結合を形成します。これは1分子の水を放出する縮合反応です。グリコシド結合は比較的安定な結合で、水溶液中の単糖は少ない鎖状構造または多い環状構造の状態で存在しており、それらは容易に相互変換します。2種の構造の中でアノメリック炭素を持ち、グリコシド結合を作ることができるのは環状構造の方であります。グリコシド結合すると糖は鎖状構造をとることができなくなります。
グルコピラノースとは、左の分子モデルはD-グルコピラノースを表わしています。 灰色の玉は炭素(C)原子、赤い玉は酸素(O)原子、水色の玉は水素(H)原子を表わしています。 玉と玉をつないでいる棒は原子と原子の間の結合を表わしています。 D-グルコースには鎖状構造のものと環状構造のものの2種 類が存在します。
再びグルコースについて
グルコース(英語で glucose)は、分子式 C6H12O6を持つ単純な糖です。グルコースは血糖として人間の血液中を循環しています。糖は植物などに含まれる葉緑体において、太陽光からのエネルギーを使って水と二酸化炭素から光合成によって作られます。グルコースは細胞呼吸のための最も重要なエネルギー源です。細胞呼吸は、体中の細胞中に存在するミトコンドリアで行われます。生物がエネルギーを取り出すのは、細胞内で有機物(栄養分)を酸素で分解してエネルギー(ATP)を取り出すことは誰もが知っています。植物では糖はデンプン、動物ではグリコーゲンのようなポリマーとして貯蔵されます。グルコースは6個の炭素原子を含む単糖です。英語でHexoseといいます。単糖のヘキソースに分類されます。D-グルコースにも16種類の異性体があり、D-グルコースはアルドヘキソース立体異性体の一つです。ちなみにD型異性体であるD-グルコースは、血糖とかブドウ糖とかいわれるのですが、デキストロース(dextrose)とも呼ばれます。
再びプロテオグリカンとコラーゲンについて。というのは、関節の細胞外マトリックスの主成分を構成し、かつリウマチのときにヘルペスによって崩壊させられるからです。
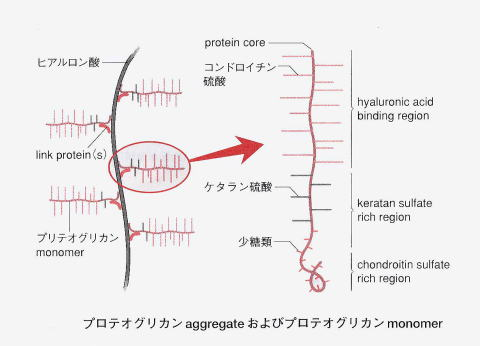
プロテオグリカン(Proteoglycan)は、繰り返しますが、ヒアルロン酸と結合したアミノ糖とムコ多糖であるグリコサミノグリカンの高分子量ポリマーの繰り返しからできています。プロテオグリカンは大量の水を保持する性質があり、ゲル状物質になります。プロテオグリカンは、特殊な構造をもつ糖とタンパク質の複合体です。「プロテオ」はプロテインつまりタンパク質、「グリカン」は多糖類を意味します。プロテオグリカンは、動物特有の成分であるグリコサミノグリカン(ムコ多糖)とコアタンパク質(糖鎖が結合する芯となるタンパク質)が一定の様式で結合したものを指し、グリコサミノグリカン(ムコ多糖)としてはウロン酸であるヒアルロン酸やコンドロイチン硫酸が代表です。コンドロイチン硫酸のコンドロイチンという意味は、軟骨細胞という意味のギリシャ語「コンドロサイト」が由来で、軟骨細胞から作られるムコ多糖(グリコサミノグリカン)であるからです。臓器、脳、皮膚を始めとした体全体の組織中の細胞外マトリックスや細胞表面に存在するほか、軟骨の主成分としても存在しています。
コラーゲンは構造性たんぱくで、軟骨の形を維持しています。コラーゲンという言葉の語源は、ギリシャ語に由来し、「Kolla(コラー)」は「膠(にかわ)」、「gen(ゲン)」は「~のもと」という意味があり、コラーゲンはまさに軟骨の形を維持する膠の仕事をしているからです。
粘性と弾性を持ち合わせている軟骨は、衝撃吸収機能、さらには潤滑機能を担います。水分の保持が多いことはすなわち衝撃につよいことです。水面を思いっきりたたいて下さい。その抵抗はすごい力になります。例えば水中で銃を撃った時の銃弾は少し先までしか進まないのは衝撃吸収機能があり、衝撃に対する恐ろしいほどの抵抗力を持っているからです。しかし、衝撃的ではなくて、ゆっくり手をいれればその抵抗はほとんどありません。軟骨は80% の水分で出来ているのでこの水分が軟骨の驚くべき衝撃吸収能となるのです。また関節軟骨の作用により、関節の磨耗係数は驚くほど小さく保たれています。大切なことは関節軟骨には神経、血管、リンパ管がないことです。軟骨の栄養は関節液で与えられています。軟骨を作る軟骨細胞がヘルペスによって破壊されると腫れたりするのは、軟骨組織に関節液が多いからです。自己免疫がリウマチを起こして軟骨組織を崩壊させたために炎症が起こって腫れるのではないのです。もし軟骨に神経、血管、リンパ管があると、水以外の成分が含まれてしまうので、衝撃吸収能がなくなってしまうので、関節に急激にかかる力が及ぼす衝撃で関節の組織が破壊されるからです。
関節軟骨に主にみられるプロテオグリカン集合体は、上の図を見ればわかるように長いフィラメントのヒアルロン酸ポリマーの芯に、枝となる多数のプロテオグリカンmonomer(コア蛋白とGAGが結合したもの)が付着したものであるのは既に述べました。念のためにGAGは、グリコサミノグリカン(glycos-amino-glycan)の頭字語の略でしたね。このプロテオグリカンmonomer の細かい枝の間に水分子を引き寄せ、保持する作用があります。これによって実に軟骨の80%は水分を含み、関節軟骨に弾性と硬さを与えます。リウマチなどで関節が腫れるのは、軟骨に含まれる80%の水分が、ヘルペスが感染した軟骨細胞を破壊するために、正常な80%の水分保持がヘルペスとの戦いのために炎症が起こりできなくなるからです。
関節軟骨の維持には、コラーゲンも、プロテオグリカンも重要です。これらはいずれも軟骨細胞が作り、細胞外マトリックスと呼ばれます。この軟骨細胞にヘルペスが感染するとヘルペス性変形性関節症のみならず、種々のあらゆる関節の変形を起こす関節症が生じるのです。
例えば手指の第1関節に生じるへバーデン結節とか、手指の第2関節に生じるブシャール結節や、手首に生じるドケルバン症候群などが、ヘルペスとの戦いの結果、痛みや圧痛や腫脹や変形が生じてしまうのです。ヘルペスはいたる所の細胞に侵入し、ストレスがかかればかかるほど増殖するために軟骨細胞も細胞変性死させ、ひどくなるとあらゆる人体の関節軟骨が多かれ少なかれ変形していくのです。
ヘ バーデン結節
指の第1関節(distal-inter-phalangeal joint略して DIP関節で、日本語で遠位指節間関節)が変形し曲がってしまう原因不明の疾患です。第1関節の背側の中央の伸筋腱付着部を挟んで2つのコブ(結節)ができるのが特徴です。この疾患の報告者へバーデンの名にちなんでヘバーデン結節と呼ばれています。いろいろな程度の変形があります。それはヘルペスが感染した軟骨細胞の度合いによって個人差が出てくるのです。全ての人が強い変形になるとは限りません。
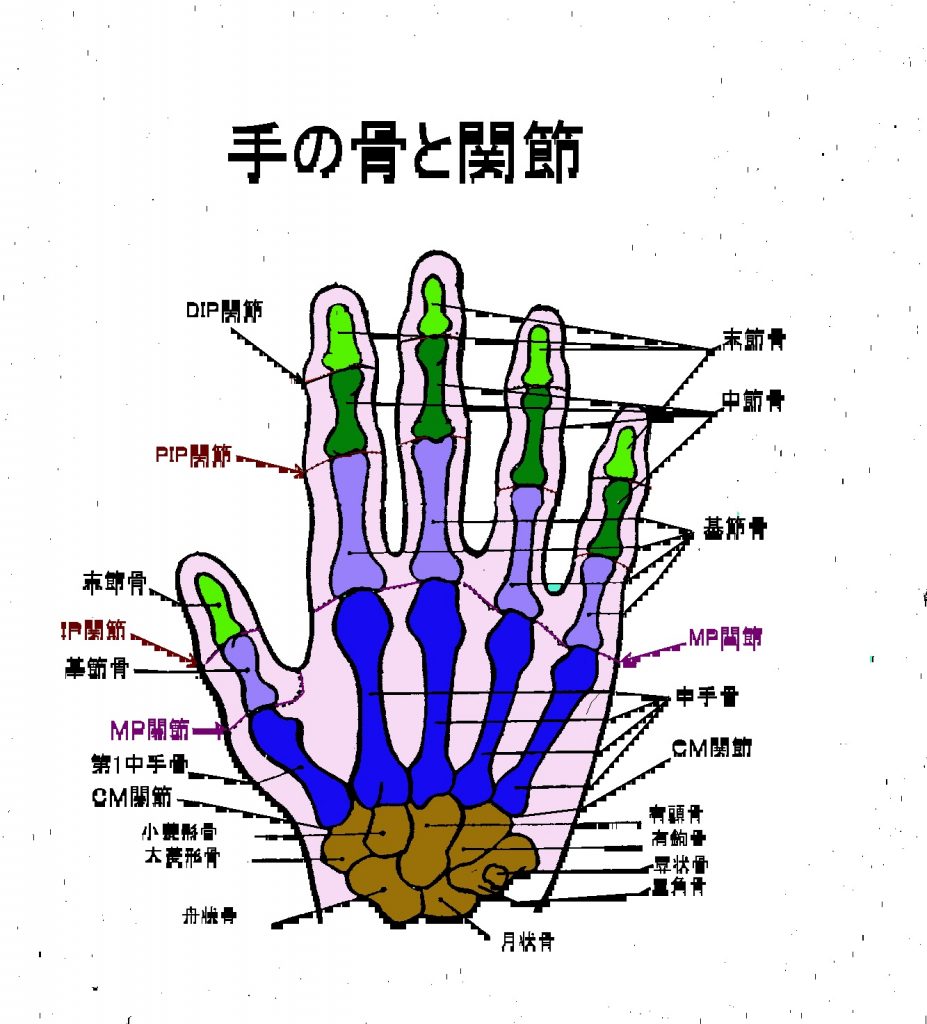
左の手の骨と関節の絵図を見ながら、手の関節の呼び名を確認してください。
- DIP関節(遠位指節間関節)を一般的に第1関節と呼んでいます。DIPの正式の英語のdistal-inter-phalangeal jointの略であり、distalは“遠い”とか“遠位の”と訳し、interは“間の”と訳し、phalangealは“指節骨の”と訳し、jointは“継ぎ目とか関節”と訳します。
- PIP関節(近位指節間関節)を一般的に第2関節と呼んでいます。DIPの正式の英語のproximal-inter-phalangeal jointの略であり、proximalは“近い”とか“近位の”と訳し、interは“間の”と訳し、phalangealは“指節骨の”と訳し、jointは“継ぎ目とか関節”と訳します。
- MP関節(中手指節間関節)は、別の略語はMCP jointです。MPの正式の英語は、metacarpal phalangeal joint の略です。
- CM関節(手根中手関節)は、英語でcarpo metacarpal jointとなります。
- IP関節(指節間関節)は、英語でinter-phalangeal jointとなります。
手足の母指(親指)には関節が1つしかないため、近位指節間関節は存在せず、親指の1つだけの関節は指節間関節と呼びます。
へバーデン結節は、示指から小指にかけて第1関節が赤く腫れたり、曲がったりします。痛みを伴うこともあります。母指(親指)にもみられることもあります。第1関節の動きも悪くなります。また、痛みのために強く握ることが困難になります。第1関節の近くに水ぶくれのような透き通ったでっぱりができることがあります。これをミューカスシスト(粘液嚢腫)と呼びます。
全ての関節の腫れや痛みや変形を引き起こす炎症の原因は、上に詳しく述べたように、ヘルペスが原因です。この世に原因のわからない病気は何一つとしてありません。後で詳しく説明しますが、手指の関節の周辺の筋肉を固定するために腱が必要です。さらに筋肉が腱から外れないように、腱の鞘である腱鞘が必要です。腱を作るために腱細胞が存在し、かつ腱鞘を作るために線維芽細胞から分化した腱鞘細胞があります。腱鞘炎は、腱細胞や腱鞘細胞に感染したヘルペスが腱細胞や腱鞘細胞を破壊し、腱や腱鞘が作れなくなるためです。
さらに滑液を作る滑膜細胞、軟骨細胞、もちろん線維芽細胞も、全ての関節の周りの結合組織を作るために存在しています。手指の関節にストレスを長い間かけると、このような細胞にヘルペスウイルスが感染していきます。さらにストレスがかかると、ストレスホルモンが大量に作られ続けて、以上にあげた細胞にヘルペスが増殖し、その細胞変性死を起こし、ヘルペスと戦うべく炎症細胞である自然免疫のマクロファージや樹状細胞やキラーT細胞や好中球のみならず、高等免疫であるヘルパーT細胞やキラーT細胞が集まってきます。これらの炎症細胞は様々なケモカインを産生し、さらに炎症がひどくなり、ヘバーデン結節のみならず、プシャール結節や、ドケルバン症候群以外の全ての関節炎を引き起こすのです。
一般に40歳代以降の女性に多く発生するのは、女性は毎月1ヶ月に2週間は黄体ホルモンを作り続けて、妊娠の準備をすることになります。妊娠がなければ、黄体ホルモンは生理と共に消えていくのでありますが、黄体ホルモンを作っている間に、この黄体ホルモンを代謝する必要があり、その代謝産物がなんと副腎皮質ホルモンの一つであるコルチコステロンになってしまいます。生理直前の2週間は、まさに自分の免疫をコルチコステロンで抑制し続けるのを何十年も女性は知らないうちにし続けるのです。さらにステロイドホルモンを出さざるを得ないストレスの多い生活をし続ける女性は、さらに知らないうちにヘルペスウイルスをあちこちの関節に増殖させてしまうのです。増殖したヘルペスは、利用し尽くした関節の様々な細胞、とりわけ線維芽細胞、軟骨細胞、滑膜細胞、骨膜細胞、腱細胞、腱鞘細胞などが崩壊してしまい、その結果、関節の正常な構造が維持できなくなり、手指の関節細胞の機能不全となり、と同時に、関節の正常な機能のみならず、正常な構造を維持できなくなって、変形も生じ、痛みも腫れも出現してしまうのであります。いうまでもなく、増え続けたヘルペスとの戦いによって様々な炎症反応が生じてしまうのです。従って、変形性関節症のヘバーデン結節にしろ、プシャール結節にしろ、ドケルバン症候群にしろ、治療は抗ヘルペス剤の投与が一番の原因治療となるのです。
もちろんこのような関節症を引き起こした原因の一つは、ストレスの多い生活をし過ぎたためでありますから、生き方を変え、かつストレスのかからない心のあり方を身につける必要があるのです。
手を良く使う人にはなりやすい傾向があります。それは関節を使いすぎるとストレスがかかり、免疫が落ちてヘルペスがその部位に大量に感染し、その関節組織の成分を作る線維芽細胞、軟骨細胞、滑膜細胞、骨膜細胞、腱細胞、腱鞘細胞などが崩壊してしまうためです。遺伝性ではありません。病態第1関節の所見はX線(レントゲン)所見や手術所見から見ても変形性関節症です。第2関節(PIP関節)に生じる類似疾患にブシャール結節があります。関節リウマチとは異なります。診断第1関節の変形、突出、疼痛があり、X線写真で関節の隙間が狭くなったり、関節が壊れたり、骨棘(こつきょく)があれば、へバーデン結節と診断できます。
治療と予防治療保存的療法としては、局所の安静(固定も含む)や投薬、局所のテーピングなどがあります。急性期では少量の関節内ステロイド注射(特にトリアムシノロンは有効)なども有効です。なぜステロイド注射が効果があるかというと、炎症の痛みや腫れが取れるのみならず、一時的には免疫とヘルペスとの戦いが激減するために、治ったように見えるだけです。とにかくステロイドで効く病気の原因は全てヘルペスであるのです。保存的療法で痛みが改善しないときや変形がひどくなり日常生活に支障をきたす場合は、手術を考慮します。手術法にはコブ結節を切除するものや関節を固定してしまう方法が行われます。予防第1関節が痛むときは安静にしましょう。痛くても使わなくてはならないときは、テーピングがお勧めです。普段でも指先に過度な負担をかけて、ストレスが関節にかからないようにしましょう。
触診での圧痛および他動運動での痛みは比較的後期の徴候です。筋攣縮および拘縮が見られるのは、関節の筋肉を支配する神経にヘルペスが感染しているからです。さらに痛みに加わるのは、関節周辺の痛覚神経にもヘルペスが感染しているからです。関節内の遊離体または異常な位置にある半月板による機械的な引っかかりが起こることがあり、ロッキングまたはキャッチングの原因となります。ロッキングというのは、激しい痛みとともに膝の曲げ伸ばしができなくなり、歩行が困難になる状態です。キャッチングというのは、関節に何か挟まる感じや、引っかかる感じが起こることです。ヘルペスの感染が深刻になればなるほど、変形および亜脱臼も発生することがあります。全身性OA(Osteoarthritis)で最も侵されることが多い関節には、1)遠位指節間(DIP)関節、2)近位指節間(PIP)関節(ヘバーデン結節およびブシャール結節を起こす)、3)母指手根中手関節、4)頸椎、5)腰椎の椎間板の関節、6)腰椎の椎間関節、7)第1中足趾節関節、8)股関節、9)膝関節、の9つがあります。これらの原因は全てヘルペスであるのですが、整形外科医に手術されて余計にひどくなる人も多く見ています。
ブシャール結節
ブシャール結節とは、指の第二関節(proximal-inter-phalangeal joint略してPIP関節)の軟骨が摩耗することで、関節の変形、腫れ、屈曲などが起こる病気です。痛みは必ず生じるものではなく、中には全く感じない方もいらっしゃいます。似た症状を持つものに「へバーデン結節」がありますが、こちらは第二関節ではなく、第一関節で症状が起こります。ブシャール結節、へバーデン結節ともに、指の変形性関節症に分類されます。へバーデン結節は、指の第一関節(DIP関節)の軟骨が摩耗することで、関節の変形、腫れ、屈曲などを起こす病気です。ブシャール結節と同様、指の変形性関節症に分類されます。
ブシャール結節は、特に40代以上の女性に多く見られます。
男性よりも女性の方が多いという病気は全てヘルペスによる病気です。なぜなら女性は初潮が始まってから妊娠出産のために黄体ホルモンを分泌しますが、この黄体ホルモンはコルチコステロンに代謝されます。女性を長く続ければ続けるほど、男性よりもコルチコステロンという副腎皮質ホルモンを作らざるを得ないので、必ず1ヶ月の間に排卵のあと生理が始まる2週間は免疫を抑え続けることになります。例えば10歳から初潮が始まり50歳で閉経になれば、1ヶ月の半分は男が作る必要がない黄体ホルモンを処理するためにコルチコステロンを作り続け、40年間のうち半分の20年間もこのコルチコステロンで免疫を抑え続けることになるので、その間ヘルペスがどんどん増え続け、あらゆる細胞に感染するヘルペスは知らぬ間に増殖する時に感染細胞を殺して別の新しい細胞に感染し続けるので、あらゆる細胞がどんどん傷つけられ破壊されて細胞機能不全となり、あらゆる不明な病気の原因となり、かつ自己免疫疾患というフェイクな病気の原因となるのです。さらにヘルペスが怖いのは、人間を殺すことはないのですが、免疫が戻った時に今度は免疫のキラーT細胞やNK細胞がヘルペスが感染した細胞を殺すという二重の細胞破壊が起こってしまい、免疫が上がることによって、免疫を抑えてヘルペスを増やした細胞を殺すことによって、再び細胞の機能不全が起こるのです。高等免疫のキラーT細胞よりも自然免疫のNK細胞の方が手強いのです。なぜならば、キラーT細胞はヘルペスが感染した細胞を見つけると、例のPD-1リガンドを作り出し、ヘルペスが感染した細胞を殺そうとした時に、全ての細胞が持っているPDL-1と結びつくことによって、その細胞を殺すことを躊躇してしまうからです。一方、NK細胞はPD-1を作ることがないので、細胞を殺しまくるのです。とにかく人体に感染したウイルスが細胞に感染してしまえば、高等免疫は手も足も出ないということです。細胞に感染したウイルスを殺すのは、自然免疫の特技であります。それはIFN-αとIFN-βとNK細胞の独壇場です。PD-1とPDL-1、 IFN-αとIFN-β、NK細胞についてはそれぞれこちらを読んでください。
女性的であればあるほど、女性ホルモンである卵胞ホルモンと黄体ホルモンが多いのですから、魅力的な女性ほど原因不明な病気や自己免疫疾患にかかりやすいと言えますね、アッハッハ!ヘルペスを増やさないためには、男性で生まれた方が得ですね、アッハッハ!
さて、ブシャール結節の症状指の第二関節の腫れ、痛み、こわばりなどの症状を伴い、変形が進行すると、関節を動かすことが難しくなります。稀に、関節に水が溜まってしまうケースもあります。また、雑巾が強く絞れなかったり、ペンや箸をうまく使えないなど、日常生活に支障をきたすような症状が現れることもあります。ブシャール結節の原因ブシャール結節の原因は、まさにヘルペスです。ただし、遺伝、加齢、更年期・妊娠・出産時のホルモンバランスの乱れ、腎臓機能の低下、手先の使いすぎなどが原因ではないかといわれていますが、全て間違いであります。抗ヘルペス剤のアシクロビルが、このような原因不明の病気に対して保険で使えないのは、まさに医薬業界が病気を作ることによってしか繁栄できないためです。ましてやアシクロビル の2000倍も抑制療法ができるソリブジンを作る製薬メーカーが世界中どこにもないことが残念でたまりません。それどころか、SARS-CoV-2に対して出来もしないワクチンを作ろうとしている製薬メーカーが200社近いというのは、いったい世の中はどうなっているのでしょうか?やはり金が一番大事な資本主義という亡霊がいつまでも世界を支配しているからでしょう。SARS-CoV-2に対するワクチンは、ヘルペスに対してワクチンができないのと同じですから、資本主義が潰れるまで続くでしょう。中国をはじめとする中華文明圏が完全にSARS-CoV-2を抑え込んでいるのは、感染の疑いがある人には清肺排毒湯を大量に飲ませているからです。アメリカは中国から学ぶべきですが、トランプは西洋薬が最高だと思い込んでいる白人至上主義者ですから、アメリカのSARS-CoV-2感染は永遠に続くでしょう。みなさんご存知ですか?WHOは既に人類の1割以上、つまり7億人以上が罹患していると報告しましたね。私もそう思います。
治療は、テーピングなどで患部を固定し、安静を保つことで、痛みは多少抑えられます。その上で、湿布、軟膏、温熱療法、炎症鎮痛剤、その他薬物療法などの治療を行います。日常生活に支障をきたすような強い症状が現れている場合には、手術を検討する必要があるといわれていますが、原因療法ではないので、意味がありません。実際にブシャール結節の手術では、指を曲げる機能を担う腱を部分的に切除し、関節にかかる負荷を軽減し、指の動きを円滑にし、痛みを和らげるためにされているようですが、手術なんかしなくても、病気の診断がつけばすぐに抗ヘルペス剤を飲ませれば治すことができるのに、このような治療は全て間違っています。残念です。
変形性頸椎症と変形性腰椎症は、脊髄症や神経根障害につながることがあるといわれていますが、このような神経症状が起こるのも、ヘルペスによる神経変性疾患であります。しかし脊髄症の臨床徴候は通常は軽度であります。有名な腰部脊柱管狭窄症は,歩行または背筋を伸ばすことにより悪化する背部痛または下肢痛があり、そのために神経性跛行が生じます。跛行(claudication)とは、何らかの障害により、正常な歩行ができない状態、つまり、かばうように歩いたり、足をひきずったりとした異常歩行のことといわれていますが、何らかの障害というのは、ほとんどヘルペスが原因であります。
さらに詳しく説明すると、腰部脊柱管狭窄症とは、加齢など様々な原因で骨、関節、椎間板、靭帯などが肥厚し、神経が通る管である脊柱管が狭くなることで神経の血行を阻害し、症状が出る病気です。腰椎椎間板ヘルニアと同様に坐骨神経痛を起こす病気の一つでもあります。が、この神経根障害も、ヘルペスが神経根の細胞や、線維芽細胞、軟骨細胞、滑膜細胞、腱細胞、腱鞘細胞、さらに骨を作る骨芽細胞、骨を作り替える破骨細胞、骨を取り巻く骨膜細胞、さらに静脈や動脈などの血管の内細胞や、さらに周辺の末梢神経細胞や脊髄神経細胞、脊髄神経根細胞などや、筋肉細胞、椎間板の細胞、滑液包細胞、関節包細胞のあらゆる細胞に感染しているからであります。ヘルペスの最も特徴ある才能は、全ての細胞に感染する能力であります。神経根および神経節は十分に保護されているためあまり一般的ではないようなのは、ヘルペスが上記の細胞に感染している度合いに個人差があるためです。様々な細胞に感染したヘルペスは、これらの細胞の機能を奪い取ってしまう度合いが、症状の強さの度合いとして現れるのです。例えば、椎骨動脈の機能不全、脊髄の梗塞、および頸椎の骨棘が食道に突き当たることによる嚥下困難もときに生じさせるのです。Osteo-arthritisによって引き起こされる症状および徴候は、一般に、軟骨の下にある骨、靱帯構造、関節滑膜、関節周囲の滑液包、関節包、筋肉、腱、椎間板、および骨膜からも生じることがあるのです。これらの細胞がヘルペスによって崩壊してしまうと、全て痛みを感じますが、軟骨下骨の骨髄内の静脈血管内細胞に感染したヘルペスは、静脈の圧が上昇させて痛みを引き起こすことがあるのです。このような痛みをbone anginaと呼ぶことがあります。
ドケルバン症候群
de Quervain症候群 (ドケルバン症候群)は狭窄性腱鞘炎とか洗濯女により見られるので洗濯女の捻挫、英語でWasherwoman’s Sprainともいいます。
de Quervain症候群は,第1伸筋腱区画内における短母指伸筋腱および長母指外転筋腱のヘルペスが原因による狭窄性の腱鞘滑膜炎であります。もっとわかりやすく言えば、親指の手首の手関節が痛くなることです。 de Quervain症候群は通常手関節を繰り返し使用(特に絞る動作)し続けるとそこにストレスがかかり、免疫が落ちてヘルペスが増殖するために起こりますが、ときに関節リウマチにも見られます。ご存じのように関節リウマチは自己免疫疾患ではなく、関節の軟骨細胞や軟骨細胞を作る線維芽細胞に感染したヘルペスによるものですから、当然関節リウマチでもドケルバン症候群が見られるのです。ドケルバン症候群は新生児の親によくみられるのは、妊娠中に胎盤を維持するために黄体ホルモンを大量に作る必要があるので、その間黄体ホルモン(Progesterone、プロゲステロン)は代謝されるとすべてステロイドホルモンの1つであるコルチコステロン(Corticosterone)に代謝され、免疫を抑え続ける間ヘルペスがどんどん関節に増殖し続けます。出産後、胎盤もなくなってしまうと免疫が戻って増えたヘルペスと関節で戦い、ドケルバン症候群が出るのは当たり前ですし、と同時に出産後に関節リウマチが見られるのも当然なのです。
橈骨(親指側の)茎状突起のすぐ近位側で,罹患した腱鞘部位上に圧痛が誘発されることもあります。de Quervain症候群の診断はフィンケルシュタイン-テストと言われる、患者に罹患した母指を手掌へと内転させ,他の指で母指を覆い、手関節を他動的に尺側(小指側)へと屈曲させることにより罹患した腱鞘部位に強い痛みが引き起こされれば,このフィンケルシュタイン-テストは陽性であり、ドケルバン症候群の診断となります。
現代行われている治療法は、コルチコステロイド注射がよく効くのは、ヘルペスと免疫の戦いを一時的に止めるからであります。ステロイドで効果があるすべての病気はまずヘルペスが原因であると考えると100%正しいと言えます。
2.変形性関節症の代表の変形性膝関節症もヘルペスによって生じます。
関節の損傷や劣化は軟骨細胞に侵入したヘルペスが原因で軟骨細胞の変性死が生じ、軟骨細胞の機能がどんどん減っていくからです。ヘルペスが感染した関節は初期は無症候性の軟骨の剥離、欠損が見られます。実はコラーゲンもプロテオグリカンも作っているのが軟骨細胞なのです。軟骨細胞は線維芽細胞の機能が特化し、軟骨細胞になったものであり、それが軟骨を維持し、さらには軟骨のヘルペスによる損傷時には機能を分化させて修復に当たるのが線維芽細胞です。軟骨の一部に損傷が起こるのは、軟骨に毎日かける外力によるストレスの強度が大きければ免疫が下がり、ヘルペスが増殖するので、軟骨細胞の機能がなくなっていきます。グルコサミン(ムコ多糖)やコンドロイチンなどの関節の成分を合成する軟骨細胞や、その元の線維芽細胞にストレスによるステロイドホルモンを増やさないように、かつ医療機関でステロイドホルモンを投与されないことで、免疫を抑えることがないような生活をする必要があります。というのは、免疫を抑える最も大きな役割をするのがステロイドホルモンであり、ステロイドを出せば出すほどステロイドを医者からもらえばもらうほど、ヘルペスウイルスが軟骨細胞やその元の線維芽細胞に感染し、関節の構造が崩壊し続けるからです。
ここで関節の成分として極めて大切なグルコサミンとヒアルロン酸とコンドロイチンとグリコサミノグリカンについてもう一度復習しておきましょう。
グルコサミンとグリコシル化について。グルコサミンは、アミノ基がアセチル化されたN-アセチルグルコサミン(GlcNAc、またはNAG)の形で、糖タンパク質、ヒアルロン酸などグリコサミノグリカン(ムコ多糖)の成分となっています。グルコサミンから作られるN-アセチルグルコサミンに、さらにグリコシル化 (Glycosylation)によって、糖鎖にタンパク質が付加することでN(窒素)-結合型糖タンパク質ができます。N(窒素)-結合型糖タンパク質とは何でしょうか?まず糖タンパク質とはなんでしょうか?まさに糖とタンパク質から成り立っている多糖です。例えば、アスパラギンというアミノ酸の側鎖はアミド基を持っています。このアミドというのは、カルボニル基のC=OのCがNと結合してアミドができます。このアミド基のN原子への単糖の主にマンノースから出来ているオリゴ糖鎖がアスパラギンに付加結合するとN(窒素)-結合型グリコシル化が起こり、N結合型糖タンパク質が出来上がります。さらに多くの単糖のマンノース同士がグリコシル化することで、マンノースが多い長い糖の鎖を作ると関節組織に多いムコ多糖といわれるグリコサミノグリカンができるのです。すでに述べたようにマンノースはグルコースと同じ仲間ですが、構造異性体同士です。
グリコシル化には今説明したアスパラギンの側鎖のアミド基が持っているN(窒素)と結合するN-結合型グリコシル化と、もうひとつのO-結合型グリコシル化の2つのタイプが存在します。O-結合型グリコシル化は、アミノ酸のセリンとトレオニン側鎖のヒドロキシ基(OH)の酸素(O)が、単糖への付加結合を行うとO-結合型グリコシル化ができます。糖鎖がタンパク質に結合する様式は、N-結合型グリコシル化とO-結合型グリコシル化による糖鎖との結合の2通りだけです。ちなみにNグリコシド結合を構成する糖は8種類ほどですが、その糖の配列が複雑で枝分かれがあるために糖鎖のパターンには驚くほど多様性があるのです。グリカンというのは多糖類という意味です。
糖タンパク質と糖脂質
食べ物に含まれる一部の糖を除けば、生体内の糖はタンパク質や脂質と結合して糖タンパク質や糖脂質などとして存在しています。糖タンパク質とは、タンパク質を構成するアミノ酸の一部に糖鎖が結合したものであり、人間(動物)においては、細胞表面や細胞外に分泌されているタンパク質のほとんどが糖タンパク質であります。さらにタンパク質のアミノ酸の修飾では、糖がアスパラギンに結合したもの(N-結合型)とセリンやスレオニンに結合したもの(O-結合型)の2種類があります。糖タンパク質に結合している糖鎖を成す糖の種類はそれほど多くなく、糖タンパク質に結合している糖はよく見られるものは1)グルコース、2)ガラクトース、3)マンノース、4)フコース、5)N-アセチルグルコサミン、6)N-アセチルガラクトサミン、7)N-アセチルノイラミン酸、8)キシロースなど7~8種程度に過ぎません。糖タンパクの構造様式もある程度限られており、その中のわずかな構造の違いが識別され、精密に認識されて様々な生命現象が制御されています。ちなみに N-アセチルノイラミン酸は、アミノ糖であり、N-アセチルマンノサミンにピリビン酸が付加されたものです。さらにN-アセチルマンノサミンはマンノースのC-5の-OH基がアミノ基(-NH2)に置き換えれてマンノサミンになり、さらにアミノ基の水素がアセチル基(CH3CO–)で置き換えられてNアセチル化したものがN-アセチルマンノサミンです。復習しておくと、N-アセチルグルコサミンは、グルコースのC-2の-OH基がアミノ基(-NH2)に置き換えられてグルコサミンになり、さらにアミノ基の水素がアセチル基(CH3CO–)で置き換えられたものです。しっかり覚えてもらいたいのはN-アセチルグルコサミンとN-アセチルマンノサミンの合成は同じ機序なのです。違うのは出発点がグルコースかマンノースかの違いと、グルコースのC-2かマンノースのC-5のそれぞれの-OH基がアミノ基(-NH2)に置き換えられた違いだけなのです。
糖タンパク質の例として、1)黄体形成ホルモン、2)卵胞刺激ホルモン、3)甲状腺刺激ホルモン、4)ヒト絨毛性ゴナドトロピン、5)アビジン、6)カドヘリン、7)プロテオグリカン、8)ムチンだけです。ちなみにアビジンは、鳥類、爬虫類、両生類の卵管で産生される四量体型ビオチン(ビタミンB7)結合性タンパク質であります。ビオチンは、カルボキシラーゼの補酵素であり、腸内細菌によって合成されます。ところが生の卵白を多量に摂取すると卵白中のアジピンと結合しすぎて欠乏症を起こします。これらの動物の卵の白身に蓄積されます。一部のバクテリアでは二量体型のアビジンファミリーも存在します。鶏卵の白身(卵白)では、アビジンは全タンパク質の約0.05%を占めます。
一方、糖脂質(Glycolipid)は、糖を結合した脂質です。エネルギーを供給したり、細胞認識の標識として働きます。糖脂質は細胞膜の表面でリン脂質と結合した状態で存在し、全ての真核生物の細胞膜表面で見られます。脂質二重膜内部から膜表面へ突き出すように存在し、特定の化合物を認識する部位として働いています。この働きによって細胞膜が安定し、別の細胞と結合して組織を形成するのに役立っています。なお、糖脂質は、細胞膜の二重層のうち外側にしか存在しません。これは、細胞膜の形成時に糖を付加する酵素がゴルジ体の内部にしか存在しないこと、糖脂質を外層から内層に輸送するフリッパーゼが存在しないことによります。
糖脂質の種類は、1)グリセロ糖脂質は、長鎖脂肪酸と糖がグリセロールで結合されたものです。2)ガラクト脂質(Galactolipid)は、糖がガラクトースです。3)スルホ脂質(Sulfolipid) は硫酸を含む糖脂質です。4)スフィンゴ糖脂質(Glyco-sphingolipid)は、長鎖脂肪酸と糖がスフィンゴシンで結合されたものです。5)セレブロシド(Cerebroside)は、糖が単糖であるものです。6)ガラクトセレブロシド(Galacto-cerebroside)は、糖がガラクトースであるセレブロシドです。7)スルファチド(Sulfatide)は、糖に硫酸基が結合したガラクトセレブロシドです。8)グルコセレブロシド(Gluco-cerebroside)、9)ガングリオシド(Ganglioside)は、糖がオリゴ糖であり、動物細胞中で最も複雑な糖脂質であり、負電荷を帯びたオリゴ糖と1つ以上のシアル酸残基を持っています。40種類以上が発見され、神経細胞に最も多く含まれています。10)グロボシド、11)スルファチド、12) 糖スフィンゴリン脂質 (Glycophosphosphingolipid)は、菌類、酵母、植物が持つ糖リン脂質の複合体であります。動物細胞中のガングリオシドと同じくらい複雑な物質です。13)ソホロ脂質は、ヒドロキシ脂肪酸がソホロースに結合したものです。ソホロース (sophorose) は、グルコース2分子がβ1-2結合で結合した、二糖の一種です。
複合糖質とは、英語でグリコ-コンジュゲートともいいます.糖質とほかの生体分子であるタンパクや脂質などとの複合体の総称です.一般には,タンパク質との複合体である1)糖タンパク質と脂質との複合体である2)糖脂質,および3)プロテオグリカンの3種類の生体高分子が含まれます.プロテオグリカンは,糖とタンパク質からなる点では,糖タンパク質と同じであるが,糖成分がグリコサミノグリカンとよばれる酸性多糖であるという点で,糖タンパク質と区別されています.これらのほか,リポ多糖,ペプチドグリカンを広い意味での複合糖質に入れることがあります.複合糖質は多細胞生物に特徴的な細胞機能である細胞認識において,重要な役割りをしています.このような,複合糖質の生物学的な機能を研究する学問領域は,糖鎖生物学とよばれる.
グリコサミノグリカン(GAG)はウロン酸(例外としてケラタン硫酸はガラクトース)とアミノ糖の二糖単位の繰り返し構造を有する直鎖状の多糖です。ヒアルロナン(ヒアルロン酸とも呼ばれる)やデルマタン硫酸、コンドロイチン硫酸、ケラタン硫酸、へパラン硫酸などが知られており、ヒアルロナン(ヒアルロン酸)以外は硫酸化されています。グリコサミノグリカンの言葉を分析すると、グリコは糖(ウロン酸)と、サミノはアミノという意味でアミノ酸とグリカンは多糖という意味ですから、糖のウロン酸とアミノ酸と多糖で出来た化合物ですと覚えおいてください。元来、グリカン(glycan)は大きな炭水化物分子という意味です。互いに化学的に結合した小さな糖分子を多数含んで大きな炭水化物分子となっているのです。グリカンは別名poly-saccharide(多糖類)とも呼ばれています。
皆さん、私の免疫の論文の中でLPSという言葉を見たことありませんか?LPSは、英語ではリポポリサッカライド(Lipo-poly-saccharide)の略がLPSです。糖は英語でsugarまたはsaccharide といい、別名はcarbohydrateといいます。リポは脂質の、ポリは多くの、サッカライドは糖という意味で、まとめて日本語ではLPSは「リポ-多-糖」と訳されます。グラム陰性細菌の成分で、グラム陰性細菌の細胞壁の外側にぎっしりと埋め込まれた形で存在しています。糖と脂質が結合した構造をしているので、糖部分は水溶性、脂質部分は油溶性ですから、LPSは両方に溶ける両親媒性の物質ですが、油より水によく溶けます。この細菌の壁の外側にあるLPSは抗原性が強いので、マクロファージを最高度に活性化します。マクロファージは自然免疫の中心的細胞で、体中に存在しており、細菌やヘルペスウイルスやSARS-CoV-2ウイルスから身体を守ったり、傷の修復を助けたり、新陳代謝の調節に欠かせない働きをしています。従って、マクロファージを活性化するLPSは、感染防御、創傷治癒、代謝調節の機能を高めています。
LPSが免疫細胞の中枢であるマクロファージを活性化するしくみは、マクロファージの細胞表面には、病原体を認識するためのレセプター(受容体)が多数存在します。その中のTLR4(Toll-like receptor 4)というレセプターがグラム陰性菌の外膜の成分であるリポ多糖(LPS)やグラム陽性菌のペプチドグリカン層にあるリポ-テイコ酸を認識する受容体となるのです。TLR4にLPSが結合すると、細胞内の核にシグナルが伝達されて、マクロファージの核の中の遺伝子が発現し、マクロファージが活性化します。ちなみに、ヨーグルトに含まれている乳酸菌やキノコに含まれているアガリクスや、酵母の成分は、TLR2という別のレセプターに結合してマクロファージを活性化します。酵母の中のミネラルは、カルシウム、リン、鉄、カリウム、マグネシウムなどが含まれ、特にカリウムが豊富です。 カリウムは体内のナトリウム量を保ち、血圧を調整する大切な働きがあります。また、β-グルカン、グルタチオンなどの成分も豊富に含み、免疫力の向上に働きます。しかしながら、上に述べたβ-グルカンやペプチドグリカンなどはマクロファージを活性化しますが、LPSと同程度にマクロファージを活性化するために、LPSの1000~10000倍の量を必要とします。というのは、細菌の細胞壁にあるペプチドと糖からなる高分子化合物であるペプチドグリカンやβ-グルカン(β-glucan)などは病原性(抗原性)が弱いからです。β-グルカンというのは、グルコースがグリコシド結合で連なった多糖であるグルカン(多糖)の内、β-グリコシド結合で繋がった多糖体の1つなのです。いかにLPSがマクロファージを活性化する能力がいかに強いかがおわかりになるでしょう。β-グルカンはアガリクス(キノコ類)やメシマコブ(キノコ類)、霊芝(キノコ類)などに多く含まれており、免疫賦活作用、制癌作用を持つとされています。ペプチドグリカンは言うまでもなくペプチドとグリカン(多糖類)からできたものです。
グラム陰性菌(gram-negative bacteria)とはグラム染色においてクリスタルバイオレットによる染色が脱色される細菌の総称です。グラム陰性の桿菌は病原性が強く、主に1)呼吸器系の障害を引き起こす桿菌としてインフルエンザ菌、肺炎桿菌 (Klebsiella pneumoniae)、レジオネラ・ニューモフィラ (Legionella pneumophila)、緑膿菌(Pseudomonas aeruginosa)などがあり、2)泌尿器系に障害を引き起こす桿菌として大腸菌、ミラビリス変形菌 (Proteus mirabilis)、Enterobacter cloacae、セラチア菌 (Serratia marcescens)などがあり、3)消化器系に障害を引き起こす有名なヘリコバクター・ピロリ、ゲルトネル菌 (Salmonella enteritidis)、チフス菌 (Salmonella typhi)などがある。 グラム陰性菌は病院の集中治療室において菌血症を引き起こし、二次的に髄膜炎や人工呼吸器が関与した肺炎を引き起こすAcinetobacter baumaniiに関わっています。
なぜグラム陰性菌桿菌が怖いか?
病原性が強いからです。 グラム陰性菌の病原性には、細胞壁の外側に存在するLPSが内毒素(エンドトキシン)として働くからです。グラム陰性菌の膜の壁の外葉(外側)は脂質部位が内毒素として機能する複雑なリポ多糖類 (LPS) により構成されています。循環系に内毒素が侵入した場合、発熱、呼吸促拍、低血圧を引き起こし、重篤になるとエンドトキシンショックを引き起こすと死亡することがあります。ヒトではLPSはサイトカイン産生、免疫系の活性化による強い自然免疫反応 (innate immune response) による炎症を引き起こします。炎症とはサイトカイン産生による正常な免疫反応であり、宿主を守るために炎症が起こるのですが時には害となり得ます。
エンドトキシンショックとは何か?
グラム陰性桿菌の細胞壁の構成成分であるリポ多糖類(LPS)がエンドトキシン(内毒素)であり,さまざまな生物活性を有しています。グラム陰性桿菌の死滅や破壊にともない,エンドトキシンが体内の組織や血管に侵入すると,単球・マクロファージの細胞膜レセプターであるCD14およびTLR (Toll-like receptor) -4によって認識されます。その結果,シグナル伝達経路を経てマクロファージなどの核に伝えられNFkBが活性化され,TNF-α,IL-1,IL-6,やIL-8などのサイトカインのほか,アナンダマイド,2-AG,プロスタグランジンなどの炎症性メディエータが産生されます。アナンダマイドとは、牛肉や豚肉の脂肪に含まれている必須脂肪酸の1つであり、アラキドン酸が含まれています。アラキドン酸の一部は脳内で「アナンダマイド(アナンダミド)」という物質に変化しますが、この物質は別名「至福物質」とも呼ばれ、幸福感や高揚感をもたらすことが知られています。これらのメディエータの相互作用により血管内皮障害や血管透過性亢進,好中球や凝固系の活性化を惹起し,ショック(エンドトキシンショック)や多臓器不全を生じることがあります。2-AGは,正式には2-アラキドノイルグリセロール(2-Arachidonoylglycerol)とは、内因性カンナビノイドのひとつで、グリセロールの2位にアラキドン酸がエステル結合した構造をしています。アラキドン酸を側鎖に含むトリグリセリドやホスファチジルイノシトール、一部のリン脂質から誘導・生合成されます。カンナビノイド(Cannabinoid)は、アサ(大麻草)に含まれる化学物質の総称です。窒素を含まず、酸素と水素、炭素からなるので、炭水化物でありアルカロイドには分類されません。60種類を超える成分が麻薬である大麻草特有のものとして分離されており、三大主成分としてテトラヒドロカンナビノール (THC)、カンナビノール (CBN)、カンナビジオール (CBD)が含まれています。陶酔作用がある成分はこの3成分の中でもテトラヒドロカンナビノール (THC)のみです。
ヒアルロン酸(hyaluronic acid)は、直鎖状のグリコサミノグリカン(ムコ多糖)の一種で、グルクロン酸とN-アセチルグルコサミンの2種類の単糖からできたヘテロ多糖です。保水性が高く水分保持により粘性を持つ。生体内に広く分布し、皮膚、軟骨、眼球では重要な役割を持つ。ヒアルロン酸の分子量は多いと200万に達することもありますが、最小では411です。保湿成分として変形性関節症や成人の美容にも用いられています。ヒアルロン酸は、軟骨に大量に存在するプロテオグリカン複合体で、巨大なグリコサミノグリカンの一つです。
コンドロイチン硫酸(chondroitin sulfate)は、グルクロン酸とN-アセチルガラクトサミンの2炭糖から出来ているヘテロ多糖です。動物体内にみられるグリコサミノグリカン(ムコ多糖)の一種です。通常、コアタンパク質と呼ばれる核となるタンパク質に共有結合したプロテオグリカンとして存在しています。特に軟骨の細胞外マトリックスにアグリカンと呼ばれるプロテオグリカンとして多く存在しますが、皮膚などの結合組織、脳などあらゆる組織に広くみられます。コアタンパク質(core protein) とは、プロテオグリカンにおいて糖鎖が結合する中心(芯)となるタンパク質です。プロテオグリカンは、人間や動物特有の成分であるグリコサミノグリカン(多糖類)とコアタンパク質が一定の様式で結合したものを指し、グリコサミノグリカンとしては上で説明した2つのヒアルロン酸やコンドロイチン硫酸が有名です。
グリコサミノグリカン(glycos-amino-glycan)は、長鎖の通常枝分れがみられない多糖です。動物の結合組織を中心にあらゆる組織に普遍的に存在します。狭義のムコ多糖でglycos-amino-glycan の頭字語を取ってGAGと略されます。硫酸基が付加した異なった2糖の繰り返し構造からなります。うち1つはアミノ糖(ガラクトサミンか、グルコサミン)であります。アミンとつけば、アミノ酸が入っているという意味です。もう1つはウロン酸(グルクロン酸か、イズロン酸)またはガラクトースです。イズロン酸は、イドースというグルコースのC-2、C-3、C-4の-OH基の向きが逆になったグルコースの構造異性体です。このイドースのウロン酸がイズロン酸です。イドースは、六炭糖およびアルドースに分類される単糖の一種です。グルコースの5位のエピマーです。エピマーというのは、-OH基の向きが一ヶ所だけ違う異性体です。イドース自体は自然界にほとんど存在しませんが、イドースのウロン酸であるイズロン酸は皮膚や血液に含まれ、人間にとって重要なグリコサミノグリカンであるヘパラン硫酸やデルマタン硫酸を構成しています。ちなみに六単糖(ヘキソース)のアルドースには構造異性体が3つあり、グルクトースとガラクトースとマンノースの3つです。多数の硫酸基(OSO3–)とカルボキシル基(COO–)を持つために、強く負に帯電しており、この負電荷同士が反発し合い、水分子を多数抱え込んで膨らんだゲルを形成します。グリコサミノグリカンであるムコ多糖体は、溶液の中では体積は乾燥時の1千倍ほどになります。このようなムコ多糖(グリコサミノグリカン)とタンパク質が組み合わさったのがプロテオグリカンなのです。多くのグリコサミノグリカンは、プロテオグリカンとしてコアタンパク質と呼ばれる核となるタンパク質に付加した形で存在しています。唯一の例外は、ヒアルロン酸であり、プロテオグリカンとしては存在していません。プロテオグリカンは、分泌型(細胞外マトリックス成分)あるいは細胞膜結合型として存在します。組織の基底膜や軟骨や細胞外マトリックスの主成分となっているのがプロテオグリカンです。
プロテオグリカン(Proteoglycan)は、特殊な構造をもつグリカンと言われる多糖とタンパク質の複合体で、複合糖質の一種です。グリカン(glycan)は大きな炭水化物分子(糖)が。互いに化学的に結合した小さな糖分子を多数含んでいます。グリカンは多糖類とも呼ばれ英語でpolysaccharideといいます。「プロテオ」はプロテインつまりタンパク質の意味です。人間のプロテオグリカンは、人間(動物)特有の成分であるグリコサミノグリカン(多糖類)とコアタンパク質(糖鎖が結合する“芯”となるタンパク質)が一定の様式で結合したものです。グリコサミノは、実はグルコースとアミノが1つになって発音するとグルコサミノとなり、意味はグリコが糖であり、アミノがアミノ酸であるのでグリコサミンはアミノ基のついた糖なのでアミノ糖となります。アミノ糖については上で既に説明しました。グリコサミノグリカンのグリカンは「アミノ糖の多糖」という意味になります。グリコサミノグリカンとしてはヒアルロン酸やコンドロイチン硫酸が有名です。臓器、脳、皮膚を始めとした体全体の組織中の細胞外マトリックスや細胞表面に存在するほか、軟骨の主成分としても存在しています。
N-アセチルグルコサミンとグルコサミノグリカンとグルコサミンの違いを説明しましょう。
グルコサミンとグルコサミノグリカンとN-アセチルグルコサミンの違いが理解できますか?それぞれについてはすでに説明したのですが、なかなかこの違いを明確に区別出来る人は少ないのです。簡単に言えば、グルコサミンをまず完全に理解することです。すぐ上で述べたように、グルコサミンは糖にアミノ基が付加したものです。次にN-アセチルグルコサミンはアミノ糖のグルコサミンのアミノ基(-NH2)の水素(-H)がアセチル基(CH3CO–)で置き換えられて、-NH2が-NHになりますがN(窒素)が残っているのでN-アセチルグルコサミンとなるのです。最後にグルコサミノグリカンというのは、グルコサミンにグリカンという多糖が引っ付いているだけです。まず、グルコサミノという言葉の意味を完全に理解してください。
関節リウマチって、どんな病気?自己免疫疾患ではなくて、ヘルペス性疾患と化学物質をIgGで免疫が戦うだけです。自分の免疫が自分の成分と戦っている自己免疫疾患ではないのです。自己免疫疾患論者は、抗核抗体で40倍以上であれば鬼の首を取ったように症状がなくても患者を全部、自己免疫疾患の患者に仕立て上げるのです。この抗体は患者の免疫が作った抗体ですが、抗原は検査メーカーが作った人工の化学物質とタンパクなのです。本当の自分の組織の抗原は生検して取り出して自分の免疫で作った抗体と反応して初めて自己免疫疾患と診断できるのですが、未だかつて行われたことはないのです。残念です。
関節リウマチ(Rheumatoid Arthritis、RA)は,主に関節を侵す慢性の全身性自己免疫疾患であると言われていますが大間違いです。RAは,ヘルペスと化学物質と戦う免疫が産生するサイトカイン,ケモカイン,およびメタロプロテアーゼなどの様々な炎症性サイトカインが生じるのは、化学物質を殺しのTh1によって生じたIgGとの戦いと、かつヘルペスが感染している軟骨細胞や線維芽細胞を免疫のキラーT細胞やNK細胞が殺そうとする戦いの時に出現します。さらに戦いが始まる前から免疫が落ちている時に、すでにヘルペスが感染した軟骨細胞や線維芽細胞が増殖するために利用し尽くしたこれらの細胞を死に至らせる細胞変性死のために、崩壊した細胞成分が完全に処理されず化学物質と結びついてこれらが抗原となり、免疫反応が起こる場合もありえます。一旦、細胞にヘルペスが感染してしまうと免疫を落とすまいが、ヘルペスが原因で人体の細胞が傷つけられたり、細胞死で細胞の機能がなくなっていくのです。いずれにしろ、ヘルペスによって細胞が障害を受けたり正常な細胞が細胞死のために崩壊してしまうと本来の組織や細胞機能が消失して関節が動かなくなったりするのです。殺されきっていない細胞は傷ついているだけで、様々な症状が出現しているだけであり、何も自己の免疫が自己の細胞や組織をはじめとする自己の成分を攻撃することによって生じた自己免疫疾患による病気ではないのです。
現代の自己免疫疾患とされているすべての病気の治療は免疫を抑えて一時的にヘルペスの戦いや化学物質との戦いがなくなり、一時的にだけ症状を除去するためだけのステロイドや生物製剤でありますが、免疫を抑えている間に、爆発的にヘルペスがあらゆる細胞に増殖し続けているので永遠にリウマチという病気が治らないようにしていることを世界の医学者の誰一人も認めようとしません。コロナに感染したアメリカの大統領は重症であったので入院して酸素吸入のみならず、ベータメサゾン(ベタメタゾン)という強力なステロイドを投与されて症状が良くなったのですが、その間にコロナウイルスはどんどん増えていますから、いずれは彼はさらに重症になっていくでしょう。最悪の場合は、選挙運動中にトランプ大統領は命を失くすかもしれません。ベタメタゾン は、糖質コルチコイドであり、ステロイド抗炎症薬・免疫抑制薬として用いられますが、他のステロイドと比べて、ベタメタゾンは鉱質コルチコイド作用が少なく、副作用としてはナトリウムおよび水貯留を引き起こしにくいのです。気管支喘息、副腎不全、ネフローゼ症候群等多岐にわたる一時的な炎症の抑制のために治療に用いられています。
自分自身が作り出すステロイドホルモンはネガティブフィードバックがかかっているので副腎皮質が過剰に作り過ぎれば視床下部や脳下垂体の細胞が察知して、作れという命令を出さなくなるので、免疫が抑えられている間に次々と隣接する細胞に感染して増殖するヘルペスの数は限られているのです。ところが医者が投与するステロイドホルモンは人体のネガティブフィードバックによるコントロールとは関わりがないのです。医者はステロイドホルモンを出したいだけ出せるからです。したがって自由にいつまでも大量のステロイドホルモンや免疫抑制人工生物製剤などを無限に投与することができるので、それ応じて無限にヘルペスも増殖し続けるのです。したがってステロイドをやめることができないのです。なぜならば、ステロイド投与をやめると抑え続けた免疫が働き出すと増え続け過ぎたヘルペスとの戦いが始まり、時には最初の症状の何倍もひどくなるリバウンド現象が生じるのでやめることができないのです。その結果、自己免疫疾患は医者が投与したステロイドによって生涯治らない病気であるのみならず、自分たちが作った病気を患者の過剰な自己免疫が原因であると言い張り、責任をとらない上に医療過誤をし続けることになるのです。悲しいですね。まさに原因と結果をすり替える典型的なエセ医学であります。本来、最高の医者は免疫の遺伝子であり、最高の薬は免疫の遺伝子が作ったタンパク質であることを繰り返し強調しておきましょう。38億年かかって修練しつくした自己の最高の免疫の遺伝子という本当の医者の働きを完璧に無視しかつその遺伝子が作り上げる最高のタンパクである薬を完璧に抑制しきる免疫を抑える薬を投与して自己免疫疾患は永遠に治らない病気だと言い続ける現代臨床医学や治療医学は全て間違いなのであります。
西洋医学が医学に貢献した1つだけの例外があります。それがワクチンです。ワクチンは西洋医学が作った免疫を上げて病気を治せる唯一の真実の薬でありますが、実はワクチンを作ることができない病原体がいることを知るべきなのです。その最新の病原体ウイルスがSARS-CoV-2であり、何十万年もの間、人間を悩ませ続けてきたヘルペスウイルスもワクチンを製造することができないことを知っておいてください。にも関わらずステロイドを投与せざるを得ないと言い続けるのは、ヘルペスの存在を完全に無視したとんでもない医者に最も都合の良い病気なのです。しかもステロイドを投与すればするほどヘルペスやSARS-CoV-2のウイルスが増え続けることを知っておいてください。
手関節や中手指節関節などの末梢関節の様々な細胞に増殖したヘルペスによって炎症が生じ,関節構造が進行性に破壊されたり、全身の関節の症状を伴うのは患者自身のストレスホルモンか医者が出したステロイドホルモンが免疫を抑えてヘルペスを増やしたためであります。診断は特異的な臨床所見,臨床検査結果,および画像所見に基づくとされていますが、言ってみれば無駄な検査です。なぜならば、根本原因はヘルペスであると認めないからです。治療としては,薬物療法,理学療法,および様々の抗リウマチ薬は症状のコントロールおよび疾患の進行を遅らせるのに有用であるとされているのは、ちょうど癌は遺伝子の病気ですから絶対に治らないにもかかわらず、延命治療のために抗がん剤を投与しているのと似ています。しかも抗がん剤を使わなければ癌患者の延命はもっと伸びている場合もあるにも関わらずです。ガンについては近藤誠先生が抗がん剤治療をするなと言っているのも抗がん剤治療はガンの根本治療ではないからです。
RAは正確な原因は不明であると言われていますが、未知または未確定の環境因子であるウイルス感染であることも知られているのですが、実はほとんどがヘルペスウイルスと化学物質をIgGの戦いで生じているのです。
顕著な免疫学的異常として,関節の毛細血管を形成している内皮細胞に感染したヘルペスが増殖を行って隣接する内皮細胞に感染するときに、さらに内皮細胞が崩壊したときに、ヘルペスに対する抗体とヘルペスの残骸のペプチドとペプチド抗原と結びついた免疫複合体がみられます。滑膜表層細胞は滑膜の周辺に存在する線維芽細胞そのものであり、さらに滑膜を作る滑膜細胞は線維芽細胞が滑膜細胞に分化したものであります。Bリンパ球が分化してヘルペスに対する抗体を作る形質細胞がそのような複合体の一因となる抗体であるリウマトイド因子(RF)や抗環状シトルリン化ペプチド抗体(抗CCP)を産生します。もちろん、このような抗体はリウマチを起こす抗体ではなくて、誰もが多かれ少なかれ作っている抗体なのです。しかもこの検査で使われる抗原は自分の成分ではなく検査屋が人工的に作った抗原であるのです。
抗環状シトルリン化ペプチド抗体(抗CCP抗体)とは何か?人工的に作れられた抗原であり、決してリウマチ患者の自己成分ではないのです。 抗CCP抗体というのは、英語でAnti-cyclic citrullinated peptide antibodyといい、頭字語を取って略してanti-CCP, ACPAとか、ACCPAといいます。日本語で抗環状シトルリン化ペプチド抗体と訳します。この抗体をリウマチの患者は特異的に自分の成分に対して作っているというとんでもない嘘をついているのです。なぜかというと、抗原である環状シトルリン化ペプチドは人工的に作れられた偽のリウマチ患者の成分なのです。どのようにして環状シトルリン化ペプチドが作られるのか知ればリウマチ患者の自己抗原でないことがわかるからです。環状シトルリン化ペプチドを作るためにはまず、シトルリン化フィラグリンユニットにシスチン残基を導入して、ヨウ素酸化で人工的に環状化した分子が環状シトルリン化ペプチドであるからです。このようにして作った人工抗原に対して医者たちは自己抗原であり、かつリウマチ患者の血液の中にある抗体を自己抗体といって100%嘘で塗り固めらえらた自己免疫性疾患が付けられるのです。残念ですね。しかもリウマチ以外の人もこの偽りの自己抗体が多かれ少なかれ持っているのです。抗CCP抗体の基準値は4.5U/mLとされていますが、陽性値は5U/mLとしています。さらに抗CCP抗体陰性のRA患者も15~30%存在していますが,このような抗CCP抗体陰性の患者は関節破壊の進行は緩徐であることが多いとされています。この意味はわかりますか?それは抗CCP抗体というのはリウマチの診断には役に立たないということです。しかも陽性は5U/mLより高い人ですが、それでは低い人はリウマチではないかという問題が出てきます。この問題はすべての自己免疫性疾患の検査について当てはまる矛盾ですが、世界中の自己免疫性疾患の専門家は答えてくれません。なぜでしょうか?元来、自己免疫性疾患というのは存在しないからです。自己免疫性疾患の診断の検査はすべて検査遊びをしてるだけで全く無駄です。しかも、インチキな検査である抗CCP抗体検査は関節リウマチ(RA)に特異性の高い抗体として評価されているのです。残念ですね。
どのように抗CCP抗体検査が開発されたか?フィラグリンとは何か?
関節リウマチ(RA)に特異性の高い、しかもリウマチでない人が作っている抗体として種々の細胞質の成分に対する無駄な抗体が報告されていましたが、中でもリウマチに関係のない皮膚表皮の構成成分の一つであるフィラグリンに対するリウマチに対する自己抗体の陽性率が高いことが知られてきました。フィラグリンとは、皮膚のバリア機能に欠かすことのできない角質層を形成する時に、ケラチンとともに重要な役割を担っています。前駆体のプロフィラグリンとして生合成され、角質層が形成される段階で、リン酸プロフィラグリンが脱リン酸化と加水分解を受けて分解し、フィラグリンが作られます。その後、強い抗原性を発揮する上でフィラグリンがシトルリン化されることが重要であることがわかり、環状シトルリン化ペプチドを作るためにはまず、シトルリン化フィラグリンユニットにシスチン残基を導入して、ヨウ素酸化で人工的に環状化した分子が環状シトルリン化ペプチドになり、このように人工的に作製した環状化シトルリン化ペプチド(cyclic citrullinated peptide;CCP)を抗原とする抗CCP抗体の測定系が作られたのです。シトルリンとは、アミノ酸の1種の2-アミノ-5-ペンタン酸です。
抗CCP抗体は、リウマトイド因子(RF)などの既存のRA検査項目に比べて感度、特異性ともに優れて、RA早期診断にも有用であると言われていますが全て意味がありません。感度とは、ある検査について「陽性と判定されるべきものを正しく陽性と判定する確率」として定義される値です。特異度とは、「陰性のものを正しく陰性と判定する確率」として定義される値です。
関節リウマチ(rheumatoid arthritis、略してRA)は関節滑膜の増殖により骨軟骨を破壊する慢性多発性関節炎を特徴とする炎症性疾患であるのではなくて、滑膜細胞に感染したヘルペスが滑膜を破壊する時に滑膜細胞が繰り返し増殖する際に、正常な滑膜が作れないどころか軟骨細胞にも感染したヘルペスが軟骨をも破壊するために生じるのが慢性多発性関節炎となるのです。RA患者の関節滑膜には多くのシトルリン化蛋白が発現しており、血清中にはシトルリン化抗原に対する抗体が産生されるのは、多かれ少なかれ全ての人が人工的に作られた環状化シトルリン化ペプチドに対して自然に作っている抗体が交差反応をしただけです。他の関節リウマチの確定診断に用いられるリウマチ因子 (RF), IgM-RF, IgG-RF, 抗ガラクトース欠損IgGなどと同じように抗原は全て人工的な診断薬ですから、全く意味がないのです。ましてや確定診断などというのは言葉の遊びです。
いずれにしろ、リウマチの検査薬に対する抗体が作られても作られなくても、ヘルペスによる関節の様々なヘルペスが感染した細胞を破壊することによって見られる破壊性関節炎も存在するのは当たり前なのです。マクロファージもまた,初期に患部の関節滑膜にまで遊走して単球由来の表層細胞となる樹状細胞の増加が血管の炎症とともに顕著にみられます。滑膜組織に浸潤するリンパ球は主にCD4陽性T細胞であるヘルパーT細胞(Th1)です。マクロファージおよびリンパ球(Th1)は,関節滑膜で炎症性のサイトカインおよびケモカインであるTNF-α,顆粒球マクロファージコロニー刺激因子(GM-CSF),さらに多種のIL-2やIL-12などのTh1サイトカインと呼ばれるインターロイキンやインターフェロンγ(IF-γ)を産生します。このような細胞性免疫細胞が放出する炎症メディエータや様々な酵素が様々な軟骨や骨の表層タンパクを溶かすことによって,RAの全身症状ならびに関節症状である軟骨破壊,骨破壊などの一因となるのです。実験的血清反応陽性のRAでは,炎症の何らかの徴候が現れるよりもかなり前から抗CCP抗体が現れているのです。加えて,抗カルバミル化タンパク(抗CarP)抗体がみられる場合,抗CCP陰性のRA患者において関節軟骨や関節の骨の破壊画像所見の進行がみられることがあります。リウマチでの関節の細胞に巣くっているヘルペスの量は免疫を抑えて来た個人差が大きく症状も様々です。CRPがヘルペスとの戦いの度合いを示してくれます。自己免疫性疾患に最も有用なのはCRPなのです。
なぜ自己免疫性疾患のリウマチに最も有用なのはCRPなのか?なぜヘルペス感染の時にCRPが上がるのか?
C反応性蛋白(C-reactive protein、略してCRP)は、環状の5量体タンパク質であり、体内で炎症反応やヘルペスによる組織の破壊が起きているときに血中に出現し、人体の免疫が病原体と戦っている証拠となります。ヘルペスは初感染の時には急性期の反応タンパクとしてCRPが上昇しますが、一旦人体に入り込んだヘルペスは殺しきることができないので死ぬまで細胞に隠れるのみらず、免疫が下がると必ず細胞を破壊しながら増殖するので見かけ症状がなくてもCRPが上がることがいくらでもあります。元来、CRPは肺炎球菌のC多糖体と結合するためにC多糖体と反応するタンパクの名称ですから、本当はC glycan(多糖体) reactive protein となりCGRPが略称になるべきです。CRPはヘルペスを貪食したマクロファージとヘルパーT細胞から分泌されるIL-6により、肝臓と脂肪細胞にCRPが作れと命令が入り、この2つの細胞から分泌されます。脂肪細胞は免疫細胞であることはすでにご存知ですよね。リゾフォスファチジルコリン(LPC)はどのようにして作られるのでしょうか?生体膜や血漿リポ蛋白質の主要脂質成分であるフォスファチジルコリンがフォスフォ-リパーゼA2などで加水分解されることによりLPCが生成されます。リゾフォスファチジルコリン(LPC)は,酸化LDL中に含まれる主要な脂質成分であり,動脈硬化巣やヘルペスによる炎症組織において増加しています。これまでリゾフォスファチジルコリン(LPC)の生理作用として,1)血管内皮細胞による血管弛緩反応の抑制、2)protein kinase C(PKC)活性化を介したTリンパ球の活性化、3)単球やTリンパ球の血管内皮細胞下への遊走促進、4)動脈硬化症の発生、5)ヘルペスに対する炎症反応に重要な役割を果たしています。
CRPは、ヘルペスによる死細胞や細菌表面のリゾフォスファチジルコリンに結合し、補体の一成分であるC1qを介して補体の古典的経路を活性化し、細菌の溶菌や細菌の凝集を行います。
CRPの産生量は炎症反応の強さに相関するため、血清中の定量されたCRPは炎症反応の強さの指標となります。ヘルペスとの戦いによる炎症が強いほど血清CRP値は高くなります。細菌感染では上昇しやすく、ウイルス感染ではアデノウイルスやヘルペスウイルスなどの慢性化しやすいウイルスとの戦いではCRPの上昇は顕著です。インフルエンザウイルスでは上昇は軽微です。通常の感冒では上昇しないことが多いのです。しかもヘルペスによるCRPの上昇の程度には大きな個人差があります。そのために一人の患者の経過を観察するために有用な指標となります。また、細菌性感染の場合は炎症開始から6時間程度は上昇せず、反応が遅いのです。炎症早期の指標としては白血球の左方移動、白血球数増加が有用となる。
CRPの正常範囲は 0.3 mg/dl以下であり、ヘルペスとの戦いが激しくなるとCRPが20を超えることがあります。現代の病気の原因は、アレルギーや自己免疫性疾患を起こす化学物質とヘルペスしかありません。現代の病気でCRPが上がるのは、化学物質をIgGの世界で戦う時とすべての人が感染しているヘルペスしかありません。もちろん、圧倒的に多いのはヘルペスですから、常にCRPが高い時にはヘルペスが原因であることをまず考えるべきなのです。したがってCRPが15.0〜20.0 の高値を示す疾患にはワクチンが作られた現代ではほとんどなくなったのですが、細菌性感染症やワクチンが作れない今説明したヘルペスウイルスとの戦いによって見られます。自己免疫疾患である関節リウマチや,リウマチ性多発筋痛症や,成人発症Still病などで高くなるのは自己免疫性疾患の原因はヘルペスであるからです。もちろん化学物質をIgGで戦うときにも関節リウマチをはじめとする自己免疫性疾患を起こしている可能性があるので、自己免疫性疾患の患者を診察する時には常に化学物質とヘルペスと同時に免疫が戦っていることを考えねばなりません。一方、現代世界の最後の病気である悪性腫瘍ではCRPはそれほど上昇することはないのです。他にCRPが少し上がるのは外傷や心筋梗塞や狭心症などであります。その他、胃炎や腸炎などでもCRPは上がります。知られていないのですが胃炎や腸炎の原因がヘルペスである場合が多いからです。現代の病気の炎症はほとんどがヘルペスとの戦いで見られるものです。
さらにまたCRP(C glycan(多糖体) reactive protein 、略してCGRP)が結合したがる標的の一つがホスホコリンであるのです。細胞が損傷された時にCRP(CGRP)はホスホコリンに結合することによってヘルペスの認識および食作用を行い、免疫反応を開始させます。ホスホコリン(phosphocholine)は、組織内におけるグリセロリン脂質の代表であるホスファチジルコリン合成の途上で作られる中間体です。ホスホコリンはコリンキナーゼによって触媒されるATPとコリンの反応の結果、ATPがADPとなり、コリンがホスホコリンに変換されて作られます。ホスホコリンはレシチン(フォスファチジルコリン)の中に見出される分子です。レシチンは、ホスファチジルコリンとも呼ばれ、リン脂質と呼ばれる脂質の一種です。人間にとって最も大切な脳や神経組織などに一番多く含まれているのがレシチンです。レシチンは体内のあらゆる細胞の膜に含まれている主要な構成成分です。生理機能を担い、極めて大切な神経伝達物質のアセチルコリンをつくる際にも必要です。
何故、ヘルペスと戦いの時に赤血球沈降速度(ESR)が上昇するのか?
CRPと同じように赤血球沈降速度(ESR)なども高くなるのは現代の病気ではヘルペスが原因です。赤血球沈降速度(ESR)が上がる原因は、化学物質をIgGの世界で戦う時とヘルペスと戦うときです。
ESRとはなんでしょうか?
赤血球沈降速度(赤沈、血沈、erythrocyte sedimentation rate、略して ESR)は、赤血球が試薬内を沈んでいく速度です。結核をはじめ、種々の疾患の診断に用いられる。 正常値は、一時間値が、男性で10mm以下、女性で15mm以下です。女性が高くなるのは生理のために貧血が毎月生じると貧血が原因でESRが上昇するからです。二時間値が、男性は25mm以下、女性で40mm以下。 赤血球沈降速度(ESR)が正常値を超える原因には、赤血球の減少(貧血)やアルブミンの減少、ガンマグロブリンやフィブリノゲンの増加やヘルペスとの激しい戦いなどで見られます。 血管内凝固症候群 (DIC)の際にはフィブリノーゲンが減少するため、ESRが減少します。
以下にESRが亢進する疾患とESRが減少する疾患を羅列しておきましょう。
ESRが亢進する病気
1)貧血、2)結核などの慢性疾患、3)心筋梗塞、4)リウマチや膠原病などの慢性炎症疾患、5)白血病、6)悪性腫瘍、7)潰瘍性大腸炎、8)肝硬変などの肝疾患、9)ネフローゼ症候群、10)慢性腎炎腎疾患、11)多発性骨髄腫などのヘルペス性疾患、12)高グロブリン血症、13)高フィブリン血症、14)外傷、15)手術、16)妊娠、17)ヘルペスを増やし過ぎた老年者
ESRが減少する疾患
1) 播種性血管内凝固症候群 (DIC) 、2)赤血球増加症、3)無フィブリン血症(遺伝病)
血清蛋白分画とは何か?なぜ、蛋白分画がヘルペス感染を診断するのに大切であるのか?
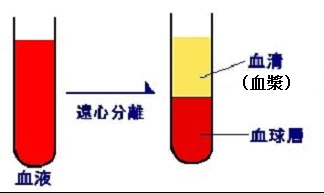
血漿と血清の違いについて述べましょう。血漿は血清とフィブリノゲン(凝固因子の第Ⅰ因子)に分けられます。全血から細胞成分(血球)を除いた液体成分中に、凝固因子が含まれるのを血漿といい、含まれないのを血清といいます。血漿に凝固促進剤を加え、フィブリノゲンを除去すると血清になります。左の図は遠心分離する前に凝固促進剤を加えたので血清になります。ところが、凝固促進剤を入れない場合には、遠心分離器にかけても血漿になります。
血清100mLに血清蛋白質は100 種類以上の蛋白が7g含まれており、生命維持に必要な様々な機能をもち、血液中の数万種類といわれるタンパクの集合体です。電気泳動という技術を用いると、タンパクの持つ負の電荷の強さを利用して電気的に血清に含まれる蛋白(血清タンパク)を大きく5つに分けることができ、左下図に示したようにその曲線を蛋白分画像と呼びます。血清中の蛋白は、大きくアルブミンとグロブリンの2つに分けられます。さらにグロブリンは4つに分けられます。血清蛋白に電気泳動の装置に電気を通すと、アルブミンは陰性度が高いのでグロブリンより陽極(+)側に移動し、グロブリンは陽極側から陰性度の強さによってα1、α2、β、γの4つに分けられ、アルブミンを入れて合わせて5つのグループに分画されます。
生命に関わる血清中のタンパク質全部が含まれる情報を余さず一度に表現できるのは血清蛋白分画像しかないのです。この血清蛋白分画像のグロブリンは免疫成分が多いのでグロブリンが作り出す曲線は特に免疫の戦い振りを示しているのです。とりわけ、最後に残されたヘルペスウイルスとの戦い振りが血清蛋白分画像を読むだけで理解できるのは世界で私だけです。アハハ!もちろん世界で最後に残る病気の原因はヘルペスであるということを知っているのは私だけですからね。アハハ!最もアメリカが作った新型コロナウイルスは永遠に人類を苦しめることになるでしょうが。下に健康な人の正常な血清蛋白分画像を示しながら蛋白分画の成分と役割を説明していきましょう。
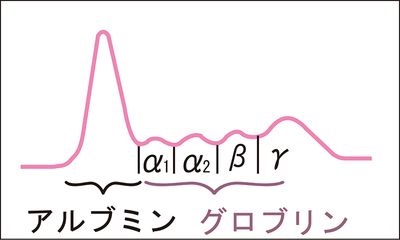
血清タンパクの種類には、1)アルブミン(ALB)、2)α1グロブリン、3)α2グロブリン、4)βグロブリン、5)γグロブリンの5種類が蛋白分画像で示されます。病気になるとこの正常な血清蛋白分画像が現代の唯一の病原体であるヘルペスとの戦いによって免疫のタンパクの変化が読み取れるのです。現在の病気の原因は、化学物質とヘルペス8種類しか存在しませんので、(COVID-19は例外ですが)もちろん他の医者はヘルペスについては一切口に出さずヘルペスによる病気を原因不明な病気とか、自己免疫性疾患であると言い続けています。しかし、すべてヘルペスと免疫の戦いで免疫が作るタンパクに変化をもたらし、それが蛋白分画像に反映されるのです。それでは血清蛋白分画像に示される5種類のタンパク質とヘルペスとの関わりの意味付けをしながら説明しましょう。
血清の代わりに血漿で蛋白分画を行うこともできますが、血漿にはフィブリノゲンが残っていますのでフィブリノゲンがβ-グロブリン分画に泳動され、M蛋白と誤認されることがあります。
M蛋白とは何でしょうか?
M蛋白は英語でmonoclonal proteinといい、略してM蛋白と呼び、日本語に訳して単クローン性蛋白です。クローンというのは、最初は同一の起源を持ち、尚かつ均一な遺伝情報を持つ核酸、細胞、個体の集団を指しましたが、いつの間にかクローンという言葉が拡大されるようになったので漠然と単純にクローンは「同一の」という意味を持つようになりました。この単クローン性蛋白も「同一の」グロブリン分画に属しているという意味で使われるようになりました。M蛋白の正式名は単クローン性免疫グロブリンとなります。単クローン性という意味はIgD、IgM、IgG、IgA、IgEの5つの抗体が含まれているグロブリンです。次に単クローンという意味はこの5つの抗体のうち、たった1種類の抗原だけを認識する特異的なたった1種類の抗原に対応するたった1種類の抗体(クローン)に対して用いられるのが単クローン性です。このような抗体をモノクローナル抗体、英語でmonoclonal protein(M蛋白)と呼ぶのです。専門的にはモノクローナル抗体とは、単一の抗体産生細胞(Bリンパ球)に由来するクローンから得られた抗体分子です。通常の抗体は抗原で免疫した動物の血清から得られるので、いろいろな抗体分子種の混合物となりますが、モノクローナル抗体は抗体分子種が均一なのです。このようなモノクローナル抗体が血液に見られるときに、M 蛋白血症といいます。繰り返しになりますがM 蛋白血症は異常に増殖した 1 つのクローンの形質細胞(B 細胞)から均一な免疫グロブリンまたは その構成成分が産生分泌され,血液中に増加した状態 であり,一部は尿中にも排泄されます。これをM蛋白尿症といいます。
繰り返しになりますが、蛋白分画でMピークといわれる鋭く尖った山を認めたら、M蛋白が疑われます。感染症などで増加する抗体は、抗原と特異的に反応する免疫グロブリンの総称で、リンパ球のうちB細胞や形質細胞から産生されます。人の体には無数の抗原に対応して多数の抗体が作られていますが、1つの細胞からは1種類の抗体しか産生されないため、正常および通常の状態では多クローン性免疫グロブリンです。ところが、形質細胞が癌化すると、それに対応した単一性の抗体が多量に産生され、その一部は尿中へ漏れ出てくることがあり、ベンス・ジョーンズ蛋白と呼ばれます。したがって、M蛋白は多発性骨髄腫を代表とする血液の悪性疾患で認められ、診断の決め手となります。M蛋白は多発性骨髄腫を代表とする血液の悪性疾患で認められ、診断の決め手となります。 ただし、M蛋白は膠原病、慢性感染症、肝疾患などの慢性疾患や健常者でも高率に認められます。このように健常者でも健康な人でも認められるのはヘルペスとこっそり免疫との戦いの結果、症状がなくてもヘルペスに対する単クローン性の抗体が作られるからです。
ちなみにヘルペスというのは急性感染症というよりも慢性感染症というべきです。なぜならば、ヘルペスは一旦、感染すると永遠に殺し切ることができなくなる上に、免疫が落ちた人は再感染のみならず、ヘルペスが再活性して増殖し続けるからです。
1)アルブミン
アルブミン分子は、約600個のアミノ酸からできた分子量約66,000の比較的小さなタンパク質です。そして、アルブミンは血漿タンパクのうち約60%を占めており、100種類以上あるといわれる血漿タンパクの中で最も量が多いタンパク質です。そのため、アルブミンは血漿タンパクの中で、血管内に水を保持する働きが最大です。このことにより、私たちの血管中の血液量や体内での水分の量を調整する重要な働き (血液の浸透圧の維持)をしています。血液中のアルブミンが低下すると、血管内の血液の量が少なくなったり、血管外(お腹や肺など)に水が溜まったりします。また、アルブミンは脂肪酸やホルモン、薬物など様々な物質と結合して、必要な部位にこれらを運搬する働きもしています。
浸透圧とは何か?
アルブミンの濃度の異なる2つのアルブミン水溶液が血管の壁ような半透膜をはさんで接した時に生じます。半透膜には、水などの小さな分子を通す小さな穴が開いています。血管の場合、アクアポリンと呼ばれるタンパク質でできた水を通す穴が開いています。しかし、この半透膜はアルブミンなどの大きな分子(分子量は66,000)は通しません。半透膜を通して水(分子量は18)は拡散することができます。半透膜を通しての拡散は「浸透」と呼ばれます。ところがアルブミンは大き過ぎて半透膜を通れず、浸透できません。この結果、水はアルブミン濃度の低い水溶液から濃度の濃い水溶液側に移動し、浸透圧を生じることになります。
浸透圧は半透膜の両側の溶液の間で生ずる圧力です。血漿成分は90%が水、8%が血漿タンパクで、残り2%がイオン、ブドウ糖、ホルモンなどです。血漿タンパクの中でアルブミンは約60%を占めており、最も量の多いタンパク質です。アルブミンは、アミノ酸を原料として肝臓で一日に6g~12g作られ、血液中に入ります。またアルブミンは、体重1kgあたり4~5gが体内に貯蔵されています。体重60kgの成人では、240~300gのアルブミンが存在することになります。その約40%が血管内に、残り60%が血管外(細胞や組織間液中)に分布しています。血漿中のアルブミン濃度は通常4.4~5%に保たれています。体内で働いた後、半減期が14~18日間で、アルブミンの多くは筋肉や皮膚において分解されます。
なぜアルブミンは血中の様々な物質を運搬できるのか?
アルブミンは、いろいろな物質と結合する力が強い血漿タンパク質です。この結合力を持っている理由は、1つ目はアルブミンが分子内の多くの場所でプラス、マイナスに帯電しているためです。2つ目はアルブミンは周囲の変化に対応して柔軟に分子の構造を変える構造適応性を持っているからです。3つ目はアルブミン分子表面には「つぎはぎの疎水性領域」があるためです。この結合力でアルブミンは、カルシウムや亜鉛などの微量元素、栄養物質、代謝物質、水に溶けない脂肪酸、酵素、ホルモン、薬などと結合できます。アルブミンが少ないと栄養物質を運搬できないので、低栄養に陥っていないかの指標にもなるのです。さらにアルブミンの特色は、物質を結合することでアルブミン自身の安定度が高まります。たとえば、アルブミン1分子は水に溶けない脂肪酸の2分子と強く結合して、アルブミンを更に安定化しています。安定な状態でアルブミンは、結合した物質を人体が必要とする目的部位へ運搬します。また、毒素などと結合して中和する作用も持っています。アルブミンは、物質の保管庫の働きがあります。毒素がアルブミンと結合することで、その毒素の血中濃度が低下します。このため毒物への中和作用が生まれます。
血清アルブミンは物質の輸送以外に極めて大切な血液の浸透圧を維持しています。血液の浸透圧というのはその名の通り「水が浸透しようとする圧力」言い換えると「水を引っ張る力」であるのはすでに述べました。つまりアルブミン濃度の濃い液体はアルブミン濃度の薄い液体から水を引っ張る仕事をしてくれるのです。この力を利用して私たち人間は水分や栄養分を細胞に行きわたらせることができます。 血清アルブミンは単に血液アルブミンと言われることがあります。というのは、血清アルブミンは肝臓で産生され、血管の血液に流れ出て血液と体組織の間で体液を適切に分配するために必要な膠質浸透圧を維持しているからです。
膠質浸透圧とは何でしょうか?
膠質浸透圧は英語でOncotic pressureといい、浸透圧の一種で、人間や動物の循環系において主としてアルブミンの濃度によって生じる血漿や間質液(組織液)の浸透圧です。膠質とはコロイドと呼び、アルブミンのような粒子が水のような溶媒の中に分散している状態を膠質(コロイド)と呼ぶのです。毛細血管壁にはかなり大きな穴があいているのですが、そこから血球やアルブミンのような高分子は通れず、小分子やイオンを含んだ血漿が間質(血管外)に押し出されるという濾過作用が行われています。また、いくつかの疎水性ステロイドホルモンに非特異的に結合することにより血漿担体として、脂肪酸の輸送タンパク質としても機能することは既に述べました。尿中のアルブミンは通常、腎臓病の存在を示します。
ヘルペスとアルブミンの減少
後で書きますが、ヘルペスと免疫の激しい戦いでは、γG(ガンマグロブリン)が免疫抗体の大部分がIgGであり、このIgGもアルブミンもアミノ酸からできていますから、どちらも合成される時にアミノ酸の取り合いが起こり、必ずアルブミンが減ります。というのは、アルブミンは免疫の成分ではないからです。もちろん、と同時に、免疫抗体のIgGが大部分を占めているγG(ガンマグロブリン)が増えているのです。したがって、タンパク分画のアルブミンとγG(ガンマグロブリン)を見るだけで、ヘルペスとの戦いが行われているということがすぐにわかるのです。さらにタンパク分画の最後にA/G比が必ず書かれています。このA/G比のAはアルブミンであり、Gはグロブリンですが、実はIgG抗体なのです。しかもこのIgG抗体は、ヘルペスに対する特異的IgG抗体なのです。このA/G値の正常値は、施設によって大いに違っています。検査会社によってA/G値の基準値を1.10〜1.80とか1.10〜2.0とか1.1〜2.3とか1.3〜2.0とか1.1〜2.1とか1.5〜2.5など様々です。このデータは、A/G値の基準値といわれていますが、実は正常値と言うべきなのです。当院に来られる人は、他の病医院に行っても原因がわからないという患者が来られます。原因のわからない病気などはこの世に何一つとしてないのです。世界中の医者が知らない病気の原因はヘルペスしかないのです。さらに自己免疫疾患と診断されて受診される患者の病気の原因はやはりヘルペスか化学物質をIgEではなくてIgGで戦っている以外に原因はないのです。従って、私がタンパク分画のアルブミンとγG(ガンマグロブリン)を見、かつA/G比を見るだけで、実は正常値でなければ全てヘルペスであると診断できるのです。
ついでに言えば、CRPの基準値も、大体は0.3mg/dl以下となっていますが、全ての検査で異常がないという患者さんでもCRPは0.3mg/dlであっても愁訴のある人は例えば頭痛がするとか、しんどいとか、肩が凝るとか、の神経細胞に感染したヘルペスが原因であるのです。もちろんこのような患者さんでも、CRPが0.3mg/dlを超えている人は必ずヘルペスがどこかの細胞で免疫と戦っていたり、ヘルペスのために細胞が崩壊したために基準値を超えてしまっている人なのです。このような人に抗ヘルペス剤を投与すれば必ず症状は無くなってしまうのです。
2)α1グロブリン(α1G)について
α1分画では急性相反応物質であるα1アンチトリプシンが主体で、炎症性疾患で上昇する。α1アンチトリプシンとはなんでしょうか?
α1アンチトリプシンは、病原体による急性期の炎症性反応タンパクとして上昇します。病原体であるヘルペスによる感染や、ヘルペスによる細胞壊死や組織壊死により活性化されたマクロファージや、さらにヘルペスが感染したマクロファージによって産生される腫瘍壊死因子(TNF)、インターロイキン1、インターロイキン6 などの炎症性サイトカインの作用で、主に肝臓で産生されます。α1G の産生はCRPの産生と似ていると思いませんか?既に書いたように、CRPはヘルペスを貪食したマクロファージとヘルパーT細胞から分泌されるIL-6により、肝臓と脂肪細胞にCRPが作れと命令が入り、この2つの細胞から分泌されます。
α1Gが上昇するのは、感染症、悪性腫瘍、自己免疫疾患、細胞壊死、組織壊死、心筋梗塞などといった炎症性疾患で増加し、その活動性の指標となります。鋭敏度ではCRPに劣るため単独で測定されることは少ないです。このような炎症性疾患でα1Gが上昇するのは、やはりCRPと似ていますね。
CRPが上昇する病気について少し復習してみましょう。細胞が壊れるとCRPが増えるのは既に述べたのですが、α1Gも細胞崩壊で上昇するのと似ていますね。細胞の壊れ方が激しい病気ほど血中のCRP値が高くなります。慢性関節リウマチ、膠原病、種々の細菌感染症や敗血症、がん、急性心筋梗塞、壊疽や怪我による組織の壊死や挫滅などです。ヘルペスウイルスによる内分泌疾患では細胞の壊れ方が少ない場合が多いので、CRPはあまり増えないことが多いのですが、CRPが20mg/dlの患者さんを治したこともあります。また、静脈や動脈の内面を被っている血管内皮細胞にヘルペスが感染して細胞が崩壊したり、血管内皮細胞が動脈硬化のせいで壊れたりする時も、血液中にCRPが流れ出ることがあります。
3)α2グロブリン(α2G)について
α2分画ではハプトグロビンタンパクが主体で、炎症で増加します。ハプトグロビンは英語はhaptoglobinと書き、略してHpです。血漿中でハプトグロビン(Hp)は赤血球から放出された遊離ヘモグロビンに高い親和性で結合し、ハプトグロビン-ヘモグロビン複合体を作って、ヘモグロビンの有害な酸化活性を阻害する抗酸化作用を示すのみならず、腎臓からの鉄の喪失を防ぎ、かつヘモグロビンによる損傷から腎臓を保護します。α2分画にはセルロプラスミンといわれる銅輸送タンパクであり、酵素であるタンパクも含まれます。
さらにα2-マクログロブリンがα2分画に含まれています。α2-マクログロブリンは、分子量約72万の巨大分子タンパクで、凝固や線溶に関わるタンパク分解酵素に結合し、その活性を阻害する働きがあります。72万の分子量を持った巨大分子である性質から、蛋白尿を示すネフローゼなどの疾患でも腎から排泄されにくいので、血中濃度が上昇します。α2-マクログロブリンは、主に肝臓で産生されますが、マクロファージ、線維芽細胞、副腎皮質細胞でも局所的な合成が行われます。α2-マクログロブリンは抗プロテアーゼ機能を持ち、きわめて多様なプロテアーゼを不活性化することができます。既に述べたように、アルブミンの分子量はたった66000に過ぎないのです。α2-マクログロブリンの1/10の分子量がアルブミンなのです。だからこそ、α2-マクログロブリンという、大きいという意味のマクロがつくのです。異常高値を示す主な疾患は、1)ネフローゼ症候群、2)高エストロゲン血症(分子量27万)、3)慢性炎症性疾患であります。一方、異常低値を示す疾患には、1) 播種性血管内凝固症候群、英語でdisseminated intravascular coagulation、略してDIC、2)急性膵炎、3)骨転移のある前立腺癌、4)肝機能障害などです。注意してもらいたいのは、α2-マクログロブリンとβ2-ミクログロブリンを間違えないようにしてください。
さて、なぜ自然免疫の王者であるマクロファージは、抗プロテアーゼを作るのでしょうか?答えは極めて簡単です。全てのヘルペスウイルスはプロテアーゼ(タンパク分解酵素)を有しますが、このプロテアーゼ(タンパク分解酵素)はヘルペスウイルスのみならずAIDSのウイルスをはじめとするあらゆるウイルスが増殖するために持っているのです。ヘルペスウイルスが持っているプロテアーゼは25kDaの大きさで別のタンパク質と結びついて発現します。この時、プロテアーゼは不活性な単量体でありますが、ヘルペスウイルスが球形になり、その球形の中にプロテアーゼが包み込まれると、二量体を形成し、活性体となります。その結果、ヘルペスウイルスは活性型のプロテアーゼの作用によって成熟体へと変形し、新たなる細胞へと感染し続けていくのです。まさにヘルペスウイルスにとって増殖のために絶対に必要なプロテアーゼの働きを抑えるためにマクロファージはこの働きを抑える抗プロテアーゼ(プロテアーゼ阻害剤)を作り出すのです。まさに、α2タンパク分画もヘルペスが増殖するときに絶対に必要なプロテアーゼの働きを抑える抗プロテアーゼという免疫の成分が含まれているのです。
4)βグロブリン(βG)について
β分画には主要なものはリポ蛋白とトランスフェリンが含まれています。リポ蛋白は高脂血症で増加、トランスフェリンは腎糸球体障害で減少します。βグロブリンには、知られている成分は次の8つが含まれています。1)リポ蛋白、2)トランスフェリン、3)β2マイクログロブリン、4)プラスミノーゲン、5)アンギオスタチン、6)プロペルジン、7)性ホルモン結合グロブリン、8)補体C3が含まれています。1)から8)までのβグロブリン(βG)に含まれているそれぞれの成分について解説しましょう。
βグロブリン(βG)の成分の1)のリポ蛋白は 遊離脂肪酸(脂質)を血漿には溶けないので血液中に安定に存在させるには、タンパク質とも結びついて輸送する必要があります。このタンパク質をアポタンパク質と呼びます。リポタンパク質によって運ばれる脂質には、1つ目はトリアシルグリセロール、別名トリグリセリドとか、中性脂肪と呼ばれる脂質と2つ目は細胞の生命維持に不可欠なコレステロールを多く含んでいます。リポ蛋白は球状粒子です。
βグロブリン(βG)の成分の2)のトランスフェリン(英語でtrans-ferrin、略してTf)はタンパク質の一種で、鉄イオンを結合しその輸送を担っています。各細胞の表面にはトランスフェリン受容体があり、特に骨髄にある幼若赤血球ではヘモグロビン合成のために多量の鉄を要するので重要です。鉄を結合したトランスフェリンがこの受容体に結合すると、エンドサイトーシスにより被覆小胞に包まれて細胞内に輸送されます。一方、鉄イオンは病原性細菌の生存や増殖にも必須であります。そのために病原菌は、ヘモグロビンから鉄を含んだ化合物であるヘムを奪い、病原菌の細胞膜を貫通しているタンパク質であるヘムトランスポーター(ヘム輸送体)を利用して細胞内へ取り込み、最後は細菌の細胞内での鉄の取り出します。このプロセスはヘルペスウイルスとは関係のない細菌だけの話です。
βグロブリン(βG)の成分の3)のβ2-マイクログロブリンはどんな仕事をするのでしょうか?
β2-マイクログロブリンbeta2-microglobulinは略してβ2-mは、分子量が11,800の小さい分子量の単鎖のポリペプチドで,HLA抗原クラスⅠ(MHC-Ⅰ)のL鎖(軽鎖)としてH鎖(重鎖)と非共有結合し,赤血球を除く全身の有核細胞表面に広く分布し,特にリンパ球,単球などには豊富に存在し、細胞に入った異物と結びついて抗原提示細胞(APC)の免疫提示の役割を持っており、いわゆる免疫応答に重要な役割を果たします。多発性骨髄腫などのリンパ腫瘍や自己免疫疾患などで高値を示すのです。リンパ腫瘍の多くはヘルペスによるものであり、また免疫疾患はヘルペスが原因です。また,β2-mはアルブミン(分子量66,000)よりもはるかに低分子量(11,800)のため腎糸球体基底膜を容易に通過し,尿細管で大部分が吸収されます。血清β2-m値は糸球体濾過値の低下に伴い上昇するので,濾過作用を行う腎糸球体が障害されるので濾過されず血液に残るので糸球体の障害の度合いをβ2-mで見ることができます。一方,糸球体から尿細管に濾過された濾過液は尿細管障害の際には,尿細管が行う再吸収や異化が障害されるため,かつ腎不全では糸球体からの濾過排泄が障害されるために尿中への排泄が増加するので、尿中β2-mの測定は尿細管,とりわけ再吸収を行う近位尿細管障害の度合いを見るのに重要です。もちろん、腎臓が障害されなくてもβ2-mは免疫とヘルペスとの戦いで免疫細胞のみならず様々な細胞からの産生が多くなるので、血中のβ2-mの多いか少ないかはヘルペスとの戦いの指標となります。
糸球体で濾過された尿(原尿とよびます)は、健康な方では1日におよそ150リットルにもなります。実際の尿は1.5リットル程度ですから、99%は再吸収されることになります。この再吸収する働きをするのが、尿細管です。糸球体でろ過された原尿には、老廃物以外に、アミノ酸やブドウ糖などの栄養素や、塩分(ナトリウム)やカリウム、リン、マグネシウムなど、さまざまなイオン(電解質)も含まれています。このような体にとって必要な成分を再吸収することにより、体内の水分量を一定に保ったり、イオンのバランスを調整したり、体を弱アルカリ性(pH 7.4)の状態に保ったりしているのです。
βグロブリン(βG)の成分の4)のプラスミノーゲン(Plasminogen、略してPLG)は肝臓で産生されプラスミノーゲンアクチベータ(PA)により活性化されるとプラスミンになります。プラスミンは,フイブリン,凝固第Ⅴと第Ⅷ因子等を分解します。血栓ができたときにその血栓を溶解するために線溶系の中心的役割はプラスミンが担っており,このプラスミンはフィブリン溶解作用があることから,その前駆体であるプラスミノーゲンの測定により,生体内での凝固や線溶状態,特に線溶活性を知ることができます。上昇する疾患として、急性炎症性疾患です。というのは、血管内皮細胞にヘルペスが感染すると血管内皮細胞が崩壊し出血がおこり、さらに凝血させて止血しますがこの時、多かれ少なかれ血栓ができるのでそれを溶解するのがプラスミンです。固まった血栓は線維素溶解系が凝集したものですから、これを溶かして分解するのが線維素溶解系といい、略して線溶といいます。
βグロブリン(βG)の成分の5)のアンギオスタチン(Angiostatin)は、内因性の血管新生阻害剤であり、癌が出来たときに癌の増殖を抑えるために新しい血管を作らせない仕事をしています。アンギオスタチンは、より大きなタンパク質であるプラスミンの断片です。プラスミンは専用の仕事をしますが、その後で新たなる余計な血管を作らせないのがアンギオスタチンです。
βグロブリン(βG)の成分の6)のプロペルジンとはなんでしょうか?
プロペルジンは、英語でproperdinと書き、発音がプロパージンと読まれることがあり、補体P因子ともいわれます。プロペルジン(プロパージン)は、血漿に存在する補体制御因子で、別名、補体B因子のひとつです。細菌や酵母の細胞壁を構成する多糖類やヘルペスウイルスと反応する血清タンパク質のβグロブリンに含まれています。C3bBbやC3bBb3bの安定化を行い、かつ、補体の反応を増進させます。最後は、細菌やヘルペスウイルスを破壊します。補体についてはこちらを読んでください。
βグロブリン(βG)の成分の7)の性ホルモン結合グロブリン(Sex Hormone-Binding Globulin、略してSHBG)はエストラジオール、テストステロンなどの性ホルモンと結合する糖蛋白です。主に性ステロイド(女性ホルモンと男性ホルモン)を血流に載せて血管外の目的組織に運んだり、性ステロイド濃度を抑制して、アンドロゲン(男性ホルモン)とエストロゲン(男性ホルモン)の間におけるバランスを保つなどの重要な役割を果たしています。ヘルペスとは関係ありません。
βグロブリン(βG)の成分の8)の補体C3は補体第3成分と言い、分子量19万で2本のポリペプチド鎖からなる糖蛋白です。血中補体成分の中では最も重要なので高濃度に存在します。主に肝臓で産生されるほか、単球やマクロファージでも産生されます。また慢性関節リウマチ患者の関節滑膜組織がC3を産生、分泌しますが、それは滑膜組織にヘルペスが感染しているからです。胎児期にすでにC3の産生が生じています。C3(Complement 3)は、補体の成分が20種類以上ある中で最も中心的な補体です。この補体は言うまでもなく、自然免疫のいわば安物の抗体であると言えるのですが、このC3が胎児期に既に作られているというのは、いかにC3が重要であるかがお分かりでしょう。補体が出来上がったのは人類が生まれるはるか大昔の、今から7億年以上前なのです。
C3のα鎖内のチオール-エステル基(S-C=O)が加水分解を受けたC3(H2O)と、B因子からなるC3(H2O)B複合体にD因子が作用してC3(H2O)Bbが産生されます。チオールは硫酸(S)のことです。このC3(H2O)Bbは初期C3転換酵素と呼ばれます。C3bBにD因子が作用するとC3bBbが産生します。このC3bBbは第二経路由来のC3転換酵素と呼ばれます。このC3転換酵素と呼ばれるC3bBbによってC3は水解(加水分解)され、水解(加水分解)されたC3はC3aとC3bに分解されます。C3転換酵素(C3を変化させる酵素)であるC3bBbの活性は、過剰に活性化しないようにI因子(complement factor I、略してCFI)(C3bインアクチベーター)とH因子(complement factor H、略してCFH)が働き、C3転換酵素であるC3bBbの活性が不活化され、自己の細胞を殺さないように制御されています。C3転換酵素であるC3bBbにC3bが反応してできる(C3b)2Bbは、C5転換酵素活性をもち、C5を水解(加水分解)します。以降の反応はすぐ下に書く古典経路と共通です。
古典経路とは体内に侵入してきた細菌や細胞の膜抗原に抗体であるIgMやIgGが結合して免疫複合体を形成すると、補体第1成分(C1)がこの抗体と結合して、C1が活性化されます。古典経路で最初に活性化したC1は補体成分C4を活性化し、その後、補体成分のC2~C8を次々に活性化します。
C3転換酵素であるC3bBによりC3が上で述べたようにC3aとC3bに水解(加水分解)されてしまいます。C3bは免疫複合体や膜表面に結合しますが、C3aは血液や組織液に遊離されます。C3bはI因子およびH因子によりiC3b(inactivated C3b)となり溶血活性を失います。さらにC3bは蛋白分解酵素によってC3cとC3dとC3dgの3つに分解されます。これらの分解産物は、生体内で細胞膜上の種々のレセプターと反応し、多彩な生物学的活性を示します。組織液中に遊離されたC3aは、ショックを起こすアナフィラトキシン活性を有しています。抗原抗体複合物は、抗体のFc領域に結合したC3bを介して、免疫細胞上のC3bに対するレセプター(CR1)にも結合できます。C3bと結合するCR1(complement receptor 1、別名CD35)はヒトでは、Bリンパ球、一部のTリンパ球、顆粒球、単球、マクロファージなどの免疫細胞以外に赤血球膜にも認められます。C3bとCR1との結合反応は、CR1を持っている抗原と抗体と補体が結合する抗原-抗体-補体の3者の結合体にヒト赤血球やウサギ血小板が付着し、凝集する現象を免疫粘着現象と呼びます。微生物上のC3bと貪食細胞のCR1の免疫粘着現象は、微生物の貪食を高め、C3bがオプソニン物質として作用するのです。C3bのオプソニン作用は、IgGとならんで異物排除機構に重要です。赤血球のCR1は、C3bを結合した抗原抗体免疫複合体と反応すると、それらを網内系(脾臓と肝臓)へ運搬して、除去してくれるのです。なぜならば抗原は常に人体にとっては侵入者となるので網内系(脾臓と肝臓)に数多く存在する貪食細胞である大食細胞や単球が貪食処理してくれるのです。従って、脾臓も肝臓も免疫のシステムの一つと言えるのです。
網内系とは何でしょうか?細網細胞とは何でしょう?
元来、120日の寿命しかない赤血球は老化すると脾臓や肝臓や骨髄の血管内に張り巡らされている血管内皮壁を覆う細網細胞と、付随している細網線維が作り出す網目構造状の組織に捕まえられ、そこには老化赤血球を捕捉しマクロファージが存在し、マクロファージに貪食処理されます。
細網細胞とは、脾臓や肝臓や骨髄などのリンパ組織やリンパ節内でリンパ節の支柱を成していますが,今だ明確に突き止められていません。現在は細網細胞(reticulum cell)とは細網構造(reticulum)を形成する細胞群の総称となっています。かつては細網内皮系統(網内系)の主要構成細胞とみなされ、細網細胞はリンパ節やその他のリンパ組織,脾臓,骨髄など造血器の支柱をなすと考えられていましたが,電子顕微鏡や免疫学的手法の発達によって細網細胞は単一な細胞腫ではないことが明らかにされました。すなわち,細網細胞は紡錘形を呈し,粗面小胞体の発達が良好で,細網線維とくっついているものもあり,この細網線維は構造タンパク質であるⅢ型コラーゲン,巨大な糖タンパク質で細胞接着分子であるフィブロネクチンやその他のO-結合型糖蛋白やN-結合型糖蛋白から構成され,電顕的に細い膠原線維,無定形物質,およびマイクロフィブリルから成りたっています. このような細網線維との関連の密な細網細胞は線維芽細胞に近縁の細胞と考えられ,線維芽細胞性細網細胞(fibroblastic reticulum cell)と呼ばれています。ところが線維芽細胞性細網細胞に対して,細網線維線維との関係が明らかでなく,原形質突起で相互に連なり,細網構造を形成する細胞があり,骨髄の細網細胞,リンパ組織におけるリンパ濾胞の胚中心内に存在する樹枝状細網細胞(dendritic reticulum cell)が胸腺依存性領域に存在する“噛み合い”細胞(interdigitating cell)がこれに属します。その他,胸腺には特殊な細網細胞が存在し,かつては上皮性細網細胞とも呼ばれた. 細網細胞(英:Reticular cell)は、細網線維と細胞質とともにその繊維周辺の組織を生成します。細網細胞は、脾臓、リンパ節、リンパ小節を含む多くの組織で見られます。網状繊維は線維芽細胞によって産生されます。Ⅲ型コラーゲンは、細網細胞により合成される。細網細胞は、リンパ組織内で特定の部位にBリンパ球とTリンパ球を引き込みます。リンパ節ではリンパ球が主体を成す一方,細網細胞が細網線維とともに「網」をつくり,この骨組みの中にリンパ球が容れられています。いずれにしろ、細網系というのは今も昔もイメージができにくい組織です。
なぜ老朽化した赤血球は貪食細胞に認識されるのか?
老化赤血球は網内系に存在するマクロファージによって貪食されますがどのようにして老化赤血球はマクロファージに認識されるのでしょうか?そのシステムは2つあります。1つは赤血球の細胞膜にはバンド3というタンパク質が存在しています。バンド3 というタンパク質から赤血球表面に露出している糖鎖があり、その糖鎖に対して自然抗体の抗バンド3IgG抗体が血中に存在しています。自然抗体についてはこの文のすぐ下に書きます。存在する膜縦貫タンパク質であるバンド3 は若い赤血球では間隔を空けて存在しているので、全ての人が持っているこの抗バンド3IgG抗体という自然抗体はバンド3 の糖鎖が十分な間隔を置いている若い赤血球では結びつくことができないのです。しかし、赤血球が老化してくるとヘモグロビンが酸化した後に出来上がる酸化物が増えていき、ヘモグロビン酸化物はバンド3の細胞質側に結合していきます。さらにバンド3に結合したヘモグロビンの酸化物はお互いに架橋し、バンド3 を凝集させてしまいます。バンド3 が凝集すると細胞表面の糖鎖も凝集し、凝集した糖鎖は抗バンド3IgG抗体との親和性が高いので抗バンド3IgG抗体が結合することができるようになります。元々、バンド3の本来の仕事は、赤血球外から必要なものを赤血球内に取り込んで赤血球の細胞膜に輸送するタンパクであります。脾臓には抗バンド3IgG抗体に対するレセプターを持つマクロファージが多く存在しています。凝集糖鎖に抗バンド3IgG抗体が結合した老化赤血球はマクロファージに容易に認識かつ貪食捕捉されるようになり、老化した赤血球は除去されます。
2つ目の老化赤血球除去のメカニズムは、若い赤血球では脂質2重層を構成するリン脂質であるホスファチジルセリン(Phospha-tidyl-serine、略してPS) は2重層では赤血球膜の内面や赤血球の細胞質側に多く存在していますが、赤血球が老化してくると元々ミトコンドリアがないので好気性解糖ができないので、嫌気性解糖系のエネルギー産出も衰えてくると、ホスファチジルセリン(PS)を赤血球膜内面側に移動させていた酵素であるフリッパーゼ(flippase) の働きも衰えホスファチジルセリン(PS)は膜表面に多く現れてきます。この赤血球膜表面に多く現れたホスファチジルセリンもマクロファージに認識され貪食されやすくなるからです。
<自然抗体について>
まず自然抗体とはなんでしょうか?人間は知らぬ間に抗原が人体に侵入しなくても、毎日毎日Bリンパ球の遺伝子の組み替えを行って、様々なIgDやIgMを作っています。これを自然抗体といいます。病原体や異物が人体に侵入した時に抗体が作られると言われますが、異物が入らなくても自然に作られている抗体が自然抗体なのです。抗原の刺激やヘルパーT細胞の手助けがなくても自然に作られる抗体であるので、自然抗体というのです。
言い換えると、骨髄で毎日絶え間なく自然に作られているBリンパ球は、アトランダムに抗体の遺伝子の組み替えを行って、無限と言ってもいいぐらいの多種類の抗体を作り、Bリンパ球の膜にIgDとIgMとして付着し、Bリンパ球の抗原を認識するレセプターとして自然に生まれてくるのです。まるで敵が人体にいようがいまいが肝臓で自然に補体を作っているのと同じなのです。IgDは膜から剥がれることはないのですが、IgMの方はBリンパ球から自然に剥がれて血中や組織に運ばれていくのです。
これらのBリンパ球はB1リンパ球といわれることがあります。異物が膜にとどまっているIgMにひっつくときに、初めてBリンパ球が活性化され、形質細胞となり、IgMがIgGやIgAやIgEに作り変えられる抗体のクラススイッチの現象もご存知ですね。このようにIgDやIgM以外に、IgGやIgAやIgEを作るBリンパ球をB2リンパ球というのです。言い換えると、Bリンパ球の中で、レセプターに抗原が一度もつかないものをB1リンパ球といい、Bリンパ球の中で、レセプターに抗原がひっつくと、B2リンパ球になるといってもいいのです。このB2リンパ球だけが抗体のクラススイッチを繰り返しながら5種類の抗体を作ることができるのです。
この説明でB1リンパ球が作るIgMが自然抗体であることがご理解できましたね。B1リンパ球はリンパ球であるので、獲得免疫の一部であると同時に敵と出会わなくても自然にできるので自然免疫の一部であると言えるのです。従って、補体の古典経路というのは、全て自然免疫の働きといっても良いと思いませんか?
今日はここまで2020/10/24
