私はさらに癌について詳しく詳しく勉強し続けているので莫大な量になっていますが一旦、ここまでをこの論文のラストに区切らせています!!皆さん、極めて難しい内容ですが頑張って着いて来て下さい!!!初めての方はここから読み始めて下さい。
抗体はherpesウイルスがひとたび細胞に侵入してしまうと抗体は細胞に入れないのでherpesウイルスに対しては100%無力です。herpesウイルスは無事に何千というコピー(ビリオン)を作れます。これに対処するためにキラーT細胞が生まれたのです。T細胞は成人では3000億個も血中に存在しているのです。T細胞には外観の良く似たキラーT細胞(CTL)とヘルパーT細胞(Th-cell)と抑制T細胞(Treg)の三つに大きく分けられます。この三つを合わせて3000億個ですよ!!!これらの細胞性免疫のT細胞(Tリンパ球)と抗体をつくるBリンパ球(B細胞)とよく似ているので顕微鏡では判別がつきません。さらにBリンパ球(B細胞)は骨髄で生まれ骨髄で分化して骨髄で成熟しますが、T細胞(Tリンパ球)は骨髄で生まれかつ骨髄で分化しますが完全な分化と成熟は胸腺で行います。
胸腺(きょうせん、thymus)とは何でしょうか?胸腺は胸腔に存在し胸骨の後ろ、心臓の前に位置し、心臓に乗るように存在する組織で、胸小葉とよばれる二葉からなっており、胸骨の後ろ、骨髄で作られた未熟なリンパ球(Tリンパ球)が完全に分化・成熟して正常に働くようにする役割を担っています。T細胞の分化、成熟など免疫系に関与する一次リンパ器官です。胸腺(thymus)は英語でthymus というのでそこで成熟したリンパ球をT細胞と名付けたのです。胸腺では正の選択と負の選択によって適切なリンパ球のみを末梢に送り出している。
正の選択と負の選択とは何でしょうか?骨髄で作られた未熟なリンパ球(Tリンパ球)が正常に働くようにする役割に正の選択と負の選択があります。正の選択では胸腺の皮質の上皮に発現する主要組織適合遺伝子複合体(MHC)とこれに結合した自己ペプチド抗原に対して、適度な親和性があるTCR(T細胞抗原レセプター)を有する胸腺細胞が選択的に増加する。負の選択では自己MHCと自己抗原に強い親和性をもつ自己反応性の細胞が髄質内で消去される。こうした一連の選択は一般に自己の成分に対して免疫寛容を起こすための「教育」とよばれますが論理が全く成り立たないのです。これはすべて間違っています。
何故ならばこの正の選択と負の選択は自己の成分を自分の免疫が敵と見なさいためとされているのですがそもそも自己免疫疾患がないので私はすべての自己免疫疾患を治すことができたからです。しかも、T細胞は主として感染細胞を破壊する細胞性免疫にかかわる胸腺(きょうせん、thymus)の機能は幼児期まで活発に働き、思春期で最も大きくなり、その後は年齢とともに萎縮していき、脂肪組織と置き換わることで周囲の脂肪組織と見分けがつきにくくなります。しかも年をとればとるほど胸腺は退化して脂肪組織になってしまえば自己の成分に対して自己免疫疾患が起きないように免疫寛容を起こすための「教育」は一切できないのに老人になればすべての人は自己免疫疾患になるのは当たり前なのに逆に自己免疫疾患は老人には完全に見られない病気になってしまうのは何故でしょうか?老人になると骨髄では細胞が産生できないわけでもないし胸腺中のリンパ球が最も多いのは思春期(10代前後)でピーク時の胸腺は30 – 40gに達する。その後は急速に萎縮し脂肪組織に置き換わる。この胸腺の退縮は70歳までにほぼ完了する。そのため胸腺は最も老化の早い器官となります。逆にいえば胸腺は発達が早く、たとえば、出生直後のマウスで胸腺摘出を行うと、マウスは免疫不全に陥るが、成熟マウスで摘出をしても免疫系に影響は少ない。これは、成熟した個体では十分なメモリーT細胞のプールができ、末梢でもエフェクターリンパ球が生理的増殖を行うようになるからです。
主要組織適合遺伝子複合体(MHC)は役割が異なるMHC‐1とMHC‐2の二つのMHCがあり確かにMHC‐1は内在的な自己のペプチド結びつくと自己免疫疾患の問題は出てきますがMHC‐2は外部から取りこんだ異物に対しては自己免疫疾患を問題視する必要がないのにも関わらず一緒くたにしているのは間違いです。確かにMHC‐2に対しては免疫寛容を起こさないための「教育」は必要ないからです。
主要組織適合遺伝子複合体(MHC)とは一体何でしょうか?
主要組織適合遺伝子複合体(major histocompatibility complex略して MHC)は、免疫反応に必要な多くのタンパクの遺伝子情報を含む細胞膜表面にある糖タンパク質である。研究の当初、MHCは遺伝子として同定されてきたが、のちにMHCは糖タンパク質として意味が置き換わった。MHCは遺伝子と糖タンパクの二つの意味で使われることが多いので、糖タンパクか遺伝子かの区別のために糖タンパク質であることを明記・強調したい場合には、日本では「MHC抗原」、「MHC分子」、「MHCタンパク質」などと表現されます。
一方、遺伝子領域においてMHCをコードする遺伝子のこととして明記したい場合には、「MHC領域」、「MHC遺伝子」などと表現する。MHC分子は、ほとんどの脊椎動物が細胞の中に持ち、ヒトのMHCはヒト白血球型抗原 (HLA)と呼ばれる。
ヒトのMHCはヒト白血球型抗原 (HLA)と呼ばれるのは何故でしょうか?
HLAとは英語でHuman Leukocyte Antigenで略してHLAで訳してヒト白血球抗原となります。HLA は1954年、白血球の血液型として発見され、頭文字をとってHLAと呼ばれてきました。半世紀以上を経て、HLAは白血球だけにあるのではなく、ほぼすべての細胞と体液に分布していて、ヒトの免疫に関わる重要な分子として働いている組織適合性抗原であることが判明しました。ヒトではすべての細胞の第6染色体の遺伝子にあります。
HLA検査を行うと、遺伝子型ごとに2つの型が判明します。それは、父親と母親の型を1つずつ遺伝子として受け継いでいるからです。両親から受け継いだ遺伝子の染色体は一対の対立遺伝子(アリル)から成り立っています。対立遺伝子(alleleアリル)とは親から子へ遺伝子が伝えられる時にお互いにどちらか一方が選ばれるような関係にある一連の遺伝子です。例えば血液型をきめる遺伝子が存在するは9番染色体長腕であり細胞1個あたり2本なので、遺伝子を2つしかもつことができないのです。ヒトのABO式血液型ではA遺伝子、B遺伝子およびO遺伝子の3種類の対立遺伝子があります。ABO式血液型の遺伝形式については遺伝子AとBは遺伝子Oに対し優性であり、遺伝子AとBの間には優劣差がありません。従ってABO式血液型に関する遺伝子はA,B、Oの3種類で決まります。
このようにHLAも同様に両親から受け継いだ2つの型が対立遺伝子として一対となって1つのセットを形成しています。それを「HLA ハプロタイプ」と言います。ハプロタイプとは、何でしょうか?複数の対立遺伝子それぞれについてどちらの親から受け継いだ遺伝子かで分けたときに、片方の親由来の遺伝子の並びをハプロタイプ(haplotype)と言います。ハプロタイプとは、”haploid genotype”(半数体の遺伝子型)の略で単倍型とも訳されます。ハプロタイプは、生物がもっている単一の染色体上の遺伝的な構成(DNA配列)のことである。二倍体生物である人の場合、ハプロタイプは各遺伝子座位にある対立遺伝子のいずれか一方の組合せをいいます。
またゲノム全体に対してや、複数の染色体にまたがっていうこともあるが、この場合には特にいずれかの片親に由来する遺伝子の組合せを指す。通常、母系のミトコンドリアと、父系のY染色体が対象となります。
さらに現在は限定的な意味として、同一染色体上で統計学的に見て関連のある、つまり遺伝的に連鎖している多型(一塩基多型[SNP]など)の組合せをいうことが多い。このような組合せがわかれば、ある範囲内について、少数の対立遺伝子を同定することで他の多型座位も決めることができる。連鎖とは何ですか?遺伝的連鎖(genetic linkage)または遺伝的連関と言いますが、特定の対立遺伝子の組合せ(ハプロタイプ)が、メンデルの独立の法則に従わずに親から子へ一緒に遺伝する遺伝学的現象をいうのです。
ここで補足しておきますが遺伝子型とハプロタイプは別の概念であり、個体の遺伝子型からその個体のハプロタイプ(haploid genotype 訳して半数体の遺伝子)つまり一つの対立遺伝子を一意的に決めることはできないのです。ハプロは「半分」や「半数」という意味です。遺伝子型 (genotype)とはある生物が持っている2つの対立遺伝子の組み合わせのタイプで、例えばヒトのABO式血液型ではAA、AB、AO、BB、BO、OOの6種類の遺伝子型があります。つまり6種類の蛋白を作る設計図が遺伝子に隠されえているのです。その設計図に従って蛋白を作って表に実際に表現したのが表現型 (phenotype)であり遺伝子型に対応する言葉でABO式血液型ではA型、B型、AB型およびO型の4種類があります。実際に観察できる形と質を持った実物になったある形質のタイプを表現型 (phenotype)と言います。血液型のように質的形質と違い量的形質では量はいくらでも変化するので表現型は無数にあり、それぞれの個体の個々の観察値を表現型値というのです。
例として2つの遺伝子座位を考え、それぞれに2種の対立遺伝子(第1がAまたはa、第2がBまたはb)があるとしよう。遺伝子座位とは染色体上の遺伝子の固定位置のこと。ある個体の遺伝子型がAaBbであることがわかったら、同じ染色体にどの対立遺伝子であるペアがあるかによってハプロタイプのセットには2つの可能性があります。遺伝子型(genotype)とはある生物が持っている2つの対立遺伝子の組み合わせのタイプで個体に現れる形質を指す表現型(phenotype)の対語であるとも言えます。
| 染色体1の ハプロタイプ | 染色体2の ハプロタイプ | |
| ハプロタイプセット1 | AB | ab |
| ハプロタイプセット2 | Ab | aB |
この場合、どの特定のハプロタイプのセットが個体に現れているか、つまりどの対立遺伝子が同じ染色体上にあるかを決定するにはさらなる情報が必要となります。自分のHLA検査を行えば、各遺伝子型の2個の型が判明するだけですが、両親のHLA検査も行うと、どちらの遺伝子がどちらの親から遺伝したのかがわかります。
HLAのハプロタイプは、A遺伝子、B遺伝子およびO遺伝子の3種類の対立遺伝子だけですが両親から受け継いだ複数の対立遺伝子のそれぞれについてどちらの親から受け継いだ遺伝子かを調べるとHLAのハプロタイプの組み合わせは数万通りになるのも驚くべきではないのです。血液型はA遺伝子、B遺伝子およびO遺伝子のたったの3種類の対立遺伝子だけですがHLAのハプロタイプの組み合わせは数万通りなのです!!!今日あるHLA検査は、HLAが遺伝子の第6染色体の短腕にあることが解明された結果なのです。
HLAはA,B,C,DR,DQ,DPなど多くの抗原の組み合わせで構成され、さらにそれぞれが数十種類の異なるタイプ(アリル)をもち、ハプロタイプの組み合わせは、数万通りともいわれます。HLAはヒトの体の中で重要な免疫機構として働いており、その主な役割は自他認識をすることにあります。何故HLAはA,B,C,DR,DQ,DPなど自分の細胞で作ったのに自分の糖タンパクであるのに「抗原」であると言い方をするのでしょうか?HLAが「抗原」になるのは他人の血液を輸血したり他人の臓器を移植するときに他人のHLAは臓器をもらった人にとっては最も強い外来移植抗原となるからです。HLA抗原の本来の機能は自己と非自己の識別を通じて免疫応答を支配しているのです。すなわち,HLA抗原は外来、病原体などの抗原が侵入した際にマクロファージやリンパ球などの免疫担当細胞間の相互作用に遺伝的拘束因子として機能し, 病原体などの抗原を非自己である敵として認識し駆遂するためにT,B細胞を誘導・分化させ免疫応答を制御しているのです。自分自身のHLAと100%憎き敵であるペプチドを捕まえている意味は何でしょうか?数多くの免疫担当細胞間の相互作用に遺伝的に共通に認識できる自分自身そのものであるHLAと殺すべきペプチドとの複合体を免疫細胞に提示することによって、自分自身そのものの一部であるHLAと敵のペプチドをしっかり捕まえて離さないのは自分自身を象徴するHLAを敵の象徴であるペプチドとまぎれもなく戦っていることを免疫細胞に自分たちは身内だから「敵を見つけたのでお願い殺してくれ」と身をもって懇願している姿なのです。herpesウイルスに苦しんでいる私だけが持っているHLA(MHC)は免疫細胞のあなたも持っているHLA(MHC)と全く同じですよと証拠を示しているのです。
臓器移植の拒絶反応を避けるためのHLAを適合させなければならないのですが多型性が極めて多いHLAは両親からその半分ずつを受け継ぐため、親子や兄弟の間でも一致する確率は低く、まして非血縁間では数百〜数万分の1の確率でしか一致しないのです。HLAが一致する確率は一万に一人といわれます。造血幹細胞移植や臓器移植では、自分のHLAのタイプに合わないものはすべて異物と認識して攻撃を始めてしまうため、HLAの適合性が極めて重要なのです。そのために主に血縁者間でHLA検査を行い、ドナーとレシピエントの適合性を読みとることが必要となります。
がんワクチンとはがんだけに特異的に効くペプチドを接種して抗-がん効果を高める治療法です。日本人の半数はがんに罹り、二分の一はがんで亡くなります。がんの三大治療法は「外科手術」「化学療法」「放射線療法」です。それらの効果を高めるために「がんワクチン療法」が注目されるようになってきました。ペプチド・ワクチンはある特定のHLAに効くように開発されており、HLAタイピングががんの治療に必須となる時代になってきています。HLAタイピングとは何でしょうか?ABO 血液型は赤血球の型ですが、HLA は白血球型とも言われ、免疫細胞による自己と非自己の区別に役立っています。そのため、移植医療においては提供者と患者さん(レシピエ ント)の HLA 型を調べる事が重要で、その HLA 型検査を HLA タイピング検査と呼びます。
癌ペプチド・ワクチンとは何でしょうか?残念ながらすべて失敗に終わりましたがその考え方を紹介します。なぜ失敗に終わったのかも説明します。
癌ペプチドワクチンは、抗原ペプチドを接種することにより、患者自身の細胞傷害性T細胞(CTL)を活性化することを目的とした免疫療法の一つです。がんは目印となる抗原ペプチドをHLA分子によって細胞表面に提示しています。ペプチドワクチンによって、このがんの目印を認識するように教育され増殖したCTLは、がん細胞を見つけて殺傷します。CTLのがん細胞に対する傷害はCTLは、がん抗原ペプチドを認識すると、細胞傷害顆粒の放出や、Fasリガンドの結合によるシグナル伝達によって、がん細胞のDNAを分解し細胞死を引き起こします。がんペプチドワクチンはすべてが失敗したのは何故でしょうか?
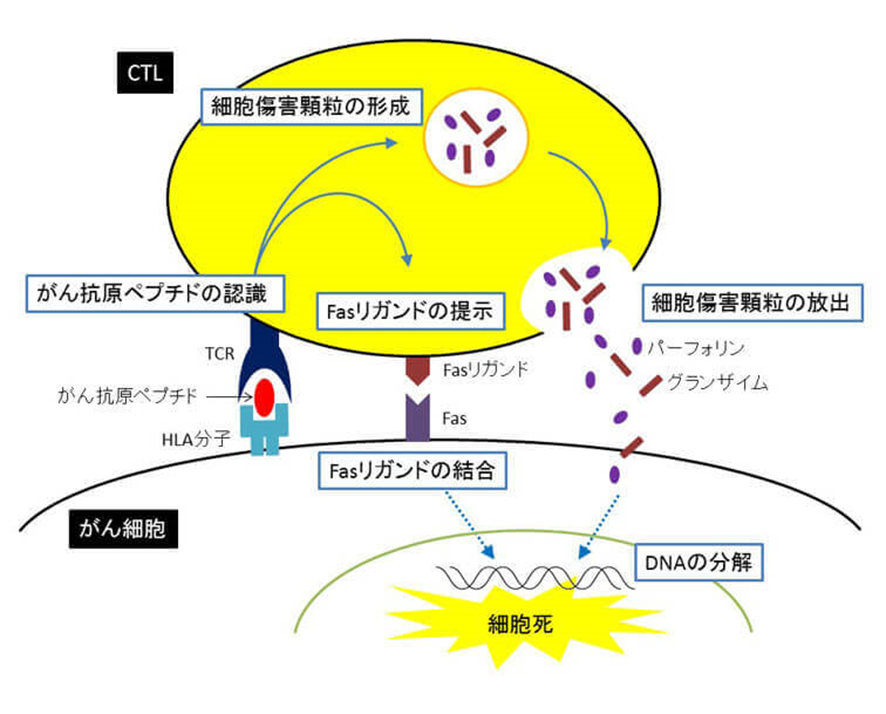
上の絵図で示したのは「がん治療ペプチドワクチン」の正しい理論ですが失敗に終わりました。理論通り癌細胞死が起こらなかったのは何故でしょうか?それは「癌抗原ペプチド」は実は自分の蛋白のペプチドであったからです。自分の蛋白のペプチドはTCRをもっているヘルパーT細胞も細胞傷害性T細胞(CTL)も認識できないからです。しかし癌細胞は「癌ウイルス」であるherpesウイルスが突然変異をして遺伝子を変えただけですから癌細胞自身は自分の細胞ですからヘルパーT細胞も細胞傷害性T細胞(CTL)も「異物」と認識できないのです。しかも癌細胞が二つに分裂した娘細胞を二個作るときに歩調を合わせてherpesは多い時には数百個、数千個にも増殖するとそのまま核の二個になった娘細胞のゲノムに自分のゲノムを大量に組み込んで新しい二つのゲノムの遺伝子を数多くのがん関連遺伝子のみならず一生常に遺伝子を発現するハウスキーピング遺伝子を発現させて新しい生まれたばかりの娘細胞の癌遺伝子を変えてしまい新たな癌細胞が増えてしまうのです。さらに癌遺伝子以外の様々な遺伝子にもヘルペスのゲノムは組み込まれてしまうので遺伝子が毎日発現せざるを得ないハウスキーピング遺伝子が発現されるたびにherpesのゲノムの一部も発現されてしまい腫瘍マーカーも高くなっていくのです。もちろん遺伝子を持っている蛋白の「設計図」であるエキソンのみならず遺伝子を持っていないイントロンのDNAの塩基の配列をherpesウイルスが変えても蛋白の「設計図」が変わらないどころか、もともとイントロンは遺伝子ではないので設計図ではないので何の変化も起こらないのです。
Herpesは細胞分裂のたびに遺伝子の突然変異を起こしているのですが何故このイントロンでherpesが起こした突然変異は病気を起こさないのでしょうか?つまり突然変異はすべての形質に影響を与えるのでしょうか?癌が起こるのは遺伝子の突然変異によるのですが「突然変異」とは「DNAの突然の変化」です。「遺伝子とはDN A」です。「DNAは蛋白とRNAの設計図」です。設計図が変われば設計図通りに作られた製品である「蛋白質」が変わりその蛋白質の形質(形と性質)も変わります。ところが突然変異が形質を変えて癌や他の病気を作ることは極めてまれなのです。何故極めてまれなのでしょうか?herpesウイルスの遺伝子情報のすべてである塩基で成り立っているゲノムの総数は15万でありますが人のゲノムの塩基の総数は30億です。人のゲノムの大部分を占める「遺伝子以外の領域とエキソン以外のイントロンの領域」の二つの領域はherpesによって塩基の並びを突然変異を起こして変えられても蛋白質には直接影響しない領域だからなのです。
癌は癌遺伝子への突然変異であることは世界中のがん専門家の一致する真実でありますが癌遺伝子の突然変異を起こすのはロイアル・レイモンド・ライフ博士の言う「癌ウイルス」しかないのです。タバコ、活性酸素、アルコール、放射線、紫外線、生活習慣、脂肪、発癌物質などいろいろ挙げられていますがどのようにこれらの物質が直接核の中に忍び込んで遺伝子を癌化するのかについては一切証拠がありませんので誰一人語りません。癌の原因は遺伝子を癌化させるロイアル・レイモンド・ライフ博士の言う「癌ウイルス」であり今となっては圧倒的に多いherpesウイルスこそが「癌ウイルス」なのです。しかもherpesウイルスは遺伝子を癌化させるだけでなく遺伝物質であるDNAをアット・ランダムに変えて見かけはDNA損傷を起こすこともしばしばあるのですが表にその変化は出てこないだけです。
DNA損傷とは何でしょうか?DNA損傷の原因には内因性と外因性の二つがあります。外因によるものには放射線、食物の中の発がん物質、たばこ、環境中の化学物質等があり、一日1細胞当たり、1万から100万箇所の頻度でDNAは損傷を受けているのです。細胞には、DNA損傷を修復する機能があり、DNAが損傷を受けると、修復酵素が駆けつけて、こうした傷を修復します。修復には、完全に修復される場合と一部が不完全に修復される場合があります。DNA修復速度の細胞の加齢に伴う低下や、環境要因のよるDNA分子の損傷増大によりDNA修復がDNA損傷の発生に追いつかなくなると、①老化(細胞老化)と呼ばれる、不可逆な休眠状態に陥る②癌化③アポトーシス(プログラム細胞死)と呼ばれる細胞の自殺が起こる。このアポトーシスは体内の細胞がDNAの損傷により癌化し、体全体が生命の危険にさらされるのを防ぐための「切り札」として機能している。細胞のDNA修復能力は細胞の正常な機能の維持と、体全体の健康の維持にとって重要であり、また、寿命に影響を及ぼすと見られる遺伝子の多くがDNA損傷の修復と保護に関連している。
細胞内の内因によるDNA損傷は細胞の中に日常的にでき酸素による活性酸素がありますが癌を作ることはありません。酸素は生成する活性酸素によってDNA損傷も数が多く塩基の脱アミノ化や脱プリン化などが多いのです。細胞外の外因性のDNA損傷はすべてherpesによるもので遺伝子を癌化させてしまうこともあるのです。ところがこのようなDNA損傷に対しては細胞に備わった修復系はあらゆる種類のDNAを修復したりDNA鎖切断に対しては相同組み換えと言われるDNA組み換えによって正常に戻して事実上100%治癒させてしまうのです。DNA損傷にはDNAの塩基損傷とDNA鎖切断の二つがあり、このDNA損傷にはDNAの修復機構が働き正常な遺伝子情報を毎日毎日修復して死ぬまで働いているのです。
相同組換えとは何でしょうか?相同組換えは遺伝的組換えの一種であり、2つの類似したまたは同一の核酸分子の間でヌクレオチド配列が交換される過程です。相同組換えは、DNA二本鎖の双方の鎖に起こった有害な切断を正確に修復するために細胞で最も広く利用されている手法である。一般的組み換えとか正統的組み換えともいわれる。
それではherpesウイルスが人の細胞のゲノムに自分のゲノムを組み込むときにはどんな組み換えをやっているのでしょうか?相同組換えではなくて別の部位特異的組み換えというやり方です。保存的部位特異的組換えとしても知られる部位特異的組換えは、少なくともある程度の配列相同性を有するセグメント間でDNA鎖交換が行われる遺伝子組換えの一種です。セグメントとは、集団やまとまった部分。保存型部位特異的組換え(conservative site-specific recombination)とはゲノムの全領域にわたって同じ機構で起こる一般的組換え以外に、ゲノム上の特定の配列を認識し、その部位でのみ起こる部位特異的組換えがある。この反応には、特定の配列を認識するラムダインテグラーゼなどの配列を認識する酵素が行うが、組換え後に元のDNA配列が再生される場合を保存型部位特異的組換え(conservative site-specific reombination)といわれるのです。
ウイルスは,基本的には①ゲノムの性質および構造,②遺伝子の複製方法に従って分類されており,各ウイルスが引き起こす疾患に従って分類されているわけではなく,③DNAウイルスとRNAウイルスに分けられ,それぞれの④遺伝物質は一本鎖の場合と二本鎖の場合によって分類されます。
Herpesウイルスの八つの分類の分け方がある。ヘルペスウイルス科に属するウイルスは線状の2本鎖DNAをゲノムとして持つDNAウイルスであり、そのビリオンは正20面体のカプシドがエンベロープに包まれた直径120~200nmの球状粒子である。ウイルスの増殖は宿主細胞の核内で行われる。
ヘルペスウイルスはヘルペスウイルス科に属するDNA型ウイルスの総称で、エンベロープを有します。その種類は約100種に及び、α、β、γの3つの亜科に分類されます。ヒトを宿主とするヘルペスウイルス(Human herpes viruses: HHV)としては8種類が知られており、それらをそれぞれHHV1~8と呼びます。
ウイルス学上は以下の次の3種類の亜科に分類されます。生物学的な分類学では、 亜科は、補助的な階級であり、科の直下に位置しますが、属よりは広い分類である。亜科は、別の科というほど離れてはいないが科と比べて形態が異なる科のことです。因みにウイルスでは科の名の語尾 は-viridae, 亜科の名の語尾 は-virinae, 属名 の名の語尾 は-virus(ウイルス)と, なります。更に付け加えると生物の分類学においては、類縁の深いもの同士を集めた七つの大きな分類群に対して、それぞれの ランク(分類階級)を表す階級名を与えています。 伝統的な分類体系では、下位階級から順に、 種、属、科、目、綱、門、界という 7 つの階級名が与えられています。ヒトの分類は、下位階級から並べると①動物界の、②脊索動物門(セキツイ動物亜門)、③哺乳綱、④サル目、⑤ヒト科、⑥ ヒト属、⑦ヒトとなります。なぜヒト科と言わないのかはヒトはヒト科でただ一つしか存在しないから「ヒト」で済ましているのです。
herpesウイルスとは何かについての最新の情報をまとめて見ましょう。
herpesウイルスが細胞に感染したとき宿主細胞は5つの運命をたどります。①溶解感染②持続感染③潜伏感染④変化なし⑤形質転換(トランスフォーメーイション)して癌細胞になります。
①溶解感染(lytic infection)、またの名をウイルス産生感染(productive infection)とも言われ、感染力のあるウイルス粒子(ビリオン)の産生が行われ、宿主細胞は死にます。約 80 個のherpesウイルス遺伝子が秩序立って発現し,短時間の内にウイルスゲノム複製と,続く粒子形成が協調的になされます。潜伏感染から溶解感染へと変化するのです。一個のherpes粒子は100個から1000個に増幅複製されるのです。このherpesウイルスを合成するときにherpesのDNA合成を宿主細胞はDNA損傷即ち異常DNAとみなしATM依存的DNA損傷チェックポイント経路を活性化することもあるのです。例えば癌ウイルスそのものであるEpstein-Barr virus(EBV)による細胞の不完全溶解(abortive lytic)感染という状態が、効率のよい感染の成立やがん化に重要であることを示唆する知見も出てきています。
②持続感染。初めて感染したherpesが自然免疫や液性免疫で排除できずに細胞に感染してしまうとherpesはいったん細胞に感染してしまうと免疫で細胞から排除されないので、細胞内感染状態が続いており宿主細胞の核の染色体の遺伝子にプロウイルスとして潜伏してしまい細胞の分裂のたびにherpesも分裂して一個のherpes粒子は100個から1000個に増幅複製してしまい感染力のあるウイルス粒子(ビリオン)を持続的に細胞分裂毎に増やしてビリオンを細胞外に排泄してしまうのです。免疫機能が未熟な乳幼児などがherpesに感染すると、免疫機能が弱いのでherpesウイルスが細胞に感染する前に異物の敵と認識できないためherpesとの戦いに見られる炎症を生じないことがしばしばあり、ウイルスが排除されないので、ウイルスは細胞に隠れてしまい持続感染になります。このように、ウイルスを細胞内に保有している人を「キャリア」と呼びます。
③潜伏感染。herpes感染宿主細胞内のゲノムの染色体の遺伝子にherpesの遺伝子を組み込んで潜伏しますが宿主の免疫が高い時には細胞の分裂時にherpesは分裂しないのでもビリオンを細胞外に排泄できません。しかしステロイド治療などで宿主の免疫が低くなると細胞の分裂に合わせてビリオンを大量に増やしてしまいます。がん細胞にはherpesが満載されていますから癌が転移する勢いがなっている時には何十億の癌細胞に何百億個のherpesが細胞のゲノムに莫大なherpesのゲノムを組み込んでいきますから遺伝子を癌化させる勢いも強くなりそれだけ癌細胞も加速度的に増えて行きそれこそ癌死という最悪の事態を迎えることになるのです。
因みに癌はherpes感染症による後天的遺伝子病ですからいかにherpesを増やさないかが根本治療の目標になるのです。この後天的遺伝子病の病名は「herpes感染性細胞無限増殖症」というべきなのです。従って癌を除去する治療が一時的に効果があるのは癌細胞を除去しているのではなく「突然変異細胞を作ったherpes感染細胞」を摘除譲許しているだけですから癌は治らないのです。この論理はオプジーボにも言えるのです。オプジーボが殺しているのは癌細胞ではなくてherpes感染細胞を殺しているだけですから癌は治らないのです。
潜伏感染(せんぷくかんせん)とは臨床的に認められる症状を示さず、体内に病原体が存続している状態であり、持続感染の一種。ヘルペスウイルスでは体表面に感染したウイルスが増殖したのちに神経節に上行して潜伏し、潜伏感染となる。この状態では新しいウイルスは作られず、また抗ウイルス薬なども無効である。宿主の免疫低下に伴って再活性化し、初感染した部位の近傍に病巣を発症する。
体の外表面での初感染ののち,その部分を支配する知覚神経に沿って上行し,対応する知覚神経節で潜伏感染に入る.その後おそらくはニューロンで再活性化され,上行してきた神経に沿って体の外表面に到達し,その神経の支配する領域に病巣を形成する.」というものである.その後約40年間は,見るべき成果が得られなかったが,1970年代に入り,続々とHSVの潜伏感染を直接証明する成績が報告されるようになった.これより先,1965年Roizmanは,「ヒト再発性ヘルペス感染症の機構に関する設問」という総説を発表し,この中で次の4点の問題を提起している.1)再発性の発疹が形成される場合,中和抗体の存在する免疫状態の宿主体内で,ウイルスはどのようにして波及し,病巣を形成するのであろうか?2)再発性病巣は,しばらくすると治癒するが,この場合,ウイルスの増殖と感染の波及がいかにして停止するのか?3)肉体的あるいは感情的刺激が,どのようにして再発性病変を誘導するか?4)再発と再発の間,ウイルスが宿主体内に持続的に存在している機構は何か?HSVの潜伏感染が最初に実証されてから10年余を経た現時点で,上記の問題を含めHSVの潜伏感染と再発に関する基本的問題について,総合的に検討することは意義深いことと思われる.
ヘルペスウイルスは直径150~200nmで直鎖状の二本鎖DNAウイルスである。ウイルスの中で最も進化したウイルスであるので人間の成就した免疫の進化よりもはるかに優れた能力を持った最も恐ろしいウイルスなのです。遺伝子数も70~300個と多い。その最大の特徴はウイルスの複製という増殖以外に,宿主のゲノムに感染して潜伏感染することにある。潜伏感染時では環状のウイルスDNAが核内に保持され,ウイルスの蛋白はほとんど産生されず,複製もおこらない。ところが人為的に病気治療のために強力な免疫抑制剤である面絵局製剤であるsteroidホルモンなどの免疫が落とされるとヒトを宿主とするヘルペスウイルスは9種類あり,感染細胞などの生物学的特徴からα,β,γの3つの亜科に分類される。
α亜科ヘルペスウイルスは主に神経細胞に感染,潜伏し,単純ヘルペスウイルス1型(herpes simplex virustype1:HSV―1),2型(HSV―2),水痘・帯状疱疹ウイルス(varicella―zoster virus:VZV)が属する。
β亜科にはヒトサイトメガロウイルス(cyto‐megalo‐virus:CMV),ヒトヘルペスウイルス6A型(human herpes virus 6A:HHV―6A),HHV―6B型,HHV―7型が属し,単球,マクロファージに感染する。β亜科のヒトサイトメガロウイルスは自然免疫の王者であるマクロファージに感染するとは勇気あるherpesウイルスなのです。
γ亜科にはEBウイルス(Epstein―Barr‐virus:EBV),HHV―8型が属し,B細胞に感染する。EBウイルスはB細胞に感染してB細胞のゲノムにEBウイルスのゲノムを組み込ませて悪性腫瘍であるバーキットリンパ種を起こすのでEBウイルスも癌ウイルスなのです。
ところで以前はHHV―6Aは6Bの亜型とみなされβ亜科に分類されていましたが現在は分離され,現在は別の種のHHV―6Aと判明し9種に再編されている。今まではherpesウイルスは8種類であったのですが現在は9種類になりました。
herpesゲノムはどのようにして感染細胞のゲノムに自分の遺伝子を組み込むのでしょうか?バクテリオファージ λ (Int) によってコードされる部位特異的リコンビナーゼと同じくherpesウイルスが持っている酵素の一つである部位特異的リコンビナーゼを利用して、ウイルス染色体をその感染細胞のゲノムの染色体に組み込みのみならず、また染色体から切除する役割を果たすことができるのです。
①アルファ-ヘルペスウイルス亜科②ベータ-ヘルペスウイルス亜科③ガンマ-ヘルペスウイルス亜科の三つです。
①アルファヘルペスウイルス亜科は他のヘルペスウイルス科の亜科よりも早く認識された亜科である。
②ベータヘルペスウイルス亜科以下の属がある。サイトメガロウイルス。ムロメガロウイルス。ロゼオロウイルス。プロバシスウイルス。
③ガンマヘルペスウイルス亜科には以下の属がある。リンホクリプトウイルス。ラジノウイルス。マカウイルス。ペルカウイルス。
ところが突然変異が形質を変えて癌や他の病気を作ることは極めてまれなのですが実はherpesウイルスが起こす突然変異には癌そのもの以外に癌に関連する様々の現象はすべて遺伝子の異常に基づいているのです。何故ならばherpesウイルスがゲノムを組み込んだ細胞の癌遺伝子以外のゲノムには癌遺伝子以外の癌無関係遺伝子の塩基の配列を突然変異を起こしてしまうことがしばしばあるのです。このタイプには多すぎるほどの突然変異を起こすタイプがありますが癌を起こす確証がないものばかりです。
腫瘍マーカーとは何でしょうか?
心配もいらないのです。癌ですが遺伝子には全く関わりがないので表現形質には起こっているのですが内ランダムに変えてしまい誰もが持っている蛋白などのも増やしていくのです。従って腫瘍マーカーの値も癌の進行に応じて高くなるので間違ったがんの転移の度合いや悪性度の度合いや癌の予後を決める指標にされてしまうのです。
がん治療ワクチンとは、「体外から抗原を投与して樹状細胞をがん特異的に活性化し、CTL(細胞傷害性T細胞)を誘導することで、抗腫瘍効果を得ようとする治療法」と定義できますががん治療ワクチンを使った5回のすべてのピボタル試験で連戦連敗してしまったので今はどの製薬メーカーも中止してしまいました。ピボタル試験とは、何でしょうか?ピボタル試験(pivotal trial)は、主試験、中枢的試験などとも呼ばれ、臨床試験の中で、後の治療を変えるような重要な中枢となるスタディと定義できます。医薬品の有効性および安全性を証明するための重要な試験で、 検証的試験ともいい、薬事承認申請に必要なデータを取得するために実施される。
胃がんの原因であるピロリ―菌とherpesの関係。後述します
MHCは免疫に関わるが、MHC分子そのものの存在箇所は免疫細胞だけではなく、ほぼすべての有核細胞にもMHC分子は存在する。また、MHC分子は糖タンパク質である。MHC分子には主に2種類あり、クラスIとクラスIIという2種類が主要で、このうちMHCクラスIが、核のあるすべての細胞に存在・発現している。実はMHC遺伝子には、補体系をコードする遺伝子領域としてMHCクラスIIIがある。 MHCクラスIIは、三つのB細胞・樹状細胞・マクロファージなどの抗原提示細胞(APC)に存在・発現しています。
このMHC分子は抗原提示を行うことで細菌やウイルスなどの感染病原体の排除や、がん細胞の拒絶、臓器移植の際の拒絶反応などに関与し、免疫にとって非常に重要な働きをしているががん細胞の拒絶が一番困難なのです。その他、ペプチドの輸送に関与するTAP (transporter associated with antigen processing) やプロテアソームに関与するLMP (low-molecular-weight protein) といった、免疫に関するさまざまなタンパク群もこのMHCにコードされているのです。なお、T細胞側の、敵のペプチドと結合したMHCと結合する受容体のことを「T細胞受容体」(Tcell recepterTCR)という。つまり、MHCにとってはリガンド(ある受容体にとっての結合相手側の別の受容体のこと)となるT細胞側のことを「T細胞受容体」という。
MHC分子とは何でしょうか?MHC分子は細胞表面に存在する細胞膜貫通型の糖タンパク分子であり、細胞内のさまざまなタンパク質の断片(ペプチド)を細胞表面に提示する働きをもつ。このMHC分子は一個の細胞表面には10万個あります。
「抗原ペプチド」とは、細胞に感染したウイルスや癌抗原、あるいは樹状細胞などの抗原提示細胞に貪食処理された結果、生成するペプチドのことで「ペプチド抗原」ともいいます。
抗原ペプチドがMHC分子に結合して細胞表面に提示されると、それがリンパ球のうちT細胞に抗原として認識され、引き続き免疫反応が惹起されてウイルスや癌などを攻撃排除し始めます。
いっぽう、抗原の無い状態でのMHC自身の生成時にも10万個もあるMHCに自己由来のペプチドである「自己ペプチド」が結合して細胞膜を安定化しているのですが、抗原の侵入・発生時には抗原由来のペプチドに置き換わるのです。MHC分子にペプチドがついた状態のMHC分子のことを「MHC分子-ペプチド複合体」または「ペプチド-MHC複合体」などと呼びます。
生物個体のそれぞれは、似たような構造のMHC分子の遺伝子情報を何種類も持ち、こうして数種類のMHCを同時に発現させている。さらに数種類のMHC全てを、父親由来のMHC1組と母親由来MHC1組の計2組ずつもっている。またMHCは個体によって非常に多様性に富み(多型性 polymorphic )、このため2組のMHCはほとんどの場合異なった種類の組み合わせとなる(ヘテロ接合体)。このようにしてそれぞれの個体は、何種類ものMHC分子の遺伝子情報をもっており(多遺伝子性 polygenic )、このためMHCはさまざまな抗原に対応できる。また多型性のため、MHC分子はT細胞が自己と他者の区別をする目印にもなる。つまり、T細胞は自己のMHC分子を発現する細胞から抗原提示を受けるが、自己と異なるMHC分子を異物と見なし、攻撃排除しようとする。しかし、個体によって持つMHCが異なるということは、MHCによって結合できる抗原が異なるため、MHCの違いにより病気のなりやすさが異なることがある。例えばMHCの違いによってAIDSの進行が違ってくる。逆にいうとこの多様性によって、病原体に対して種の絶滅を防ぐことができるようになっている。
MHC分子には大きく分けてクラスIとクラスIIの2つの種類がある。MHCクラスI分子は細胞内の内因性抗原を結合し、MHCクラスII分子はエンドサイトーシスで細胞内に取り込まれて処理された外来性抗原を結合して提示する。つまり、ウイルスのように感染した細胞内で増殖する病原体に対して、あるいはがん細胞内で産生されるがん抗原に対しては、MHCクラスIを介した抗原提示により免疫反応をおこし、いっぽう、細菌など細胞外で増殖する病原体や毒素に対して、あるいは結核菌のようにマクロファージ等の抗原提示細胞に感染する病原体に対しては、抗原提示細胞のMHCクラスIIを介した抗原提示により免疫反応をおこす。ただしこの2つ経路は絶対的なものではなく、外来抗原もMHCクラスIによる抗原提示経路にも入りうる(クロスプライミング cross-priming またはクロスプレゼンテーション cross-presentation )。
MHCクラスIに結合するペプチドの長さと、MHCクラスIIに結合するペプチドの長さは違っていることが分かっており、MHCクラスIIに結合するペプチドのほうが長い。MHCクラスIに結合するペプチドのアミノ酸の長さは、およそ8〜10塩基である。いっぽう、MHCクラスIIに結合するペプチドのアミノ酸の長さはおよそ10〜30塩基である。
MHCクラスI分子
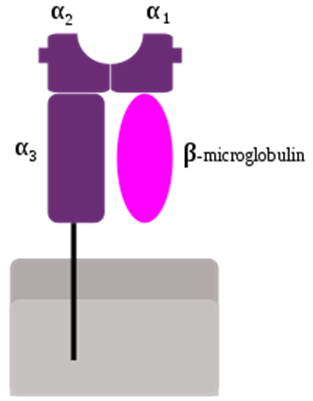
MHCクラスI分子。α1〜α3の3つの細胞外領域と細胞膜貫通領域、細胞内領域からなる重鎖と、β2-ミクログロブリンからなる。
MHCクラスI分子はほとんどすべての有核細胞と血小板の細胞表面に存在する糖タンパクであり、内因性抗原を抗原提示する働きをもつ。MHCクラスI分子はさらに古典的クラスI分子(クラスIa)と非古典的クラスI分子(クラスIb)に分けられる。古典的クラスI分子には、ヒトではHLA-A、HLA-B、HLA-Cの3種類が、マウスではH-2K、H-2D、H-2Lの3種類がある。非古典的クラスI分子にはヒトではHLA-E、HLA-F、HLA-Gが、マウスではH-2Qa、H-2Tlaがある。
構造
MHCクラスI分子は、糖鎖が付加した分子量45 kDaの重鎖(α鎖)と、分子量12 kDaのβ2-ミクログロブリン軽鎖の2つが非共有結合した二量体であり、これにペプチド抗原が結合して三量体として細胞表面に発現する。非古典的クラスI分子の中には、発現にβ2-ミクログロブリンを必要としないものもある。クラスI重鎖はα1〜α3の3つの細胞外領域と、細胞膜貫通領域、細胞内領域からなる。α1領域とα2領域の間に大きな溝状の構造(「ペプチド収容溝」)があり、MHCはこのペプチド収容溝に抗原を結合しT細胞に提示する。
局在
MHCクラスI分子はほとんど全ての有核細胞および血小板の細胞表面に発現するが、発現の程度には差異がある。甲状腺、副甲状腺、下垂体の内分泌細胞や膵臓ランゲルハンス島、胃粘膜、心筋、骨格筋、肝細胞では発現が弱く、中枢神経,末梢神経には発現がない。また、精子細胞は精巣にある間はMHCクラスI分子を発現しているが、精巣上体(副睾丸)に移動すると発現がなくなる。
悪性腫瘍においても、さまざまな悪性腫瘍で16〜50%程度にMHCクラスI分子の発現の低下・欠失がみられる。さらに、原発巣よりも転移巣において発現低下・欠失の頻度が高く、MHCクラスI発現は腫瘍の予後,免疫治療の効果等と関連することから,MHCクラスI分子の発現低下・欠失により腫瘍細胞は免疫監視機構から逃避していると考えられている。
発現経路
ウイルスのように感染した細胞内で増殖する病原体や、あるいはがん細胞内で産生されるタンパクなど、細胞質内のタンパクはユビキチン化された後、プロテアソームによって5〜15アミノ酸程度のペプチドにまで分解される。分解されたペプチドは、小胞体 (ER) 膜上にあるTAP (transporter associated with antigen processing) というATP駆動型トランスポーターによって小胞体 (ER) 内部に輸送される。なおTAPの構造は、膜貫通型であり、TAP1とTAP2からなるヘテロ二量体である。なお一般にABC輸送体と呼ばれるATP駆動型トランスポーターは膜貫通型である。TAPを、ABC輸送体の一種として分類することもある。
MHCクラスIα鎖とβ2ミクログロブリンは小胞体(ER)内で合成され、小胞体(ER)内でMHCクラスIα鎖、β2ミクログロブリン、そしてペプチドの3つが結合してMHC-ペプチド複合体を作る[25]。その後、MHC-ペプチド複合体は、より小さな小胞体の内部に置かれて、小胞輸送によって細胞膜を目指して運ばれる途中でゴルジ体を通り、糖鎖修飾を受けた後、細胞膜上に到達して発現する。
機能
T細胞には、主にキラーT細胞やヘルパーT細胞という2種類があるが、MHCクラスI分子の抗原と反応するのはキラーT細胞のほうである。
詳細にいうと、CD8陽性T細胞(キラーT細胞)は、細胞膜上に発現したMHCクラスI分子と抗原を認識し、活性化する。そしてその抗原を発現している細胞、例えばウイルス感染細胞やがん細胞を傷害するようになる(細胞傷害性T細胞)。ただしCD8陽性T細胞は、自己と同じMHCクラスI分子に結合した抗原のみ認識し、自己と異なるMHC分子は異物と見なし攻撃する。
MHCクラスI分子は、NK細胞の細胞傷害活性を抑制する働きももつ。NK細胞は細胞表面にKIR(キラー細胞免疫グロブリン様受容体 killer cell immunoglobulin-like receptor )とよばれる受容体を持っており、このKIRが古典的MHCクラスI分子、あるいはヒト非古典的MHCクラスI分子のうちHLA-Gを認識すると、NK細胞はその細胞を傷害しなくなる。またヒト非古典的MHCクラスI分子であるHLA-Eは、NK細胞がもつ受容体のひとつであるNKG2A (natural killer group 2A) を介してNK細胞の傷害活性を抑制する。逆にNK細胞はMHCクラスI分子を持たない細胞を攻撃する(Missing Self説)。例えばヒトでは胎児由来の胎盤細胞はHLAクラスI分子の発現がないが、HLA-Gを発現して母親由来のNK細胞から胎児を守っている。
つまり、MHCクラスI分子は自己と他者を区別する標識であり、自己のCD8陽性T細胞に抗原を提示して病原体や癌などを排除しつつ、NK細胞の攻撃から身を守る働きをしている。
MHCクラスII分子

MHCクラスII分子。α鎖とβ鎖からなり、それぞれ2つの細胞外領域および膜貫通領域、細胞内領域からなる。
T細胞には、主にキラーT細胞やヘルパーT細胞という2種類があるが、MHCクラスII分子の抗原と反応するのはヘルパーT細胞のほうである。
MHCクラスII分子は、マクロファージや樹状細胞、活性化T細胞、B細胞などの抗原提示細胞を含め、限られた細胞にのみ発現している。クラスII分子はα鎖とβ鎖の2つの重合体であり、それぞれ2つの細胞外領域および膜貫通領域、細胞内領域からなる。MHCクラスII分子はヒトではHLA-DR、HLA-DQ、HLA-DPの3種類があるが、DRのβ鎖は2種類あることが多く、これがDRα鎖と結合するためDR分子は2種類あることになる。つまり、ヒトでは4種類のMHCクラスII分子をもつことが多い。マウスMHCクラスII分子にはH-2A、H-2Eの2種類がある。
エンドサイトーシスにより抗原提示細胞に取り込まれた外来抗原は、抗原提示細胞内のエンドソームでタンパク分解酵素により消化され、ペプチド断片に分解される。MHCクラスII分子に結合するペプチドはクラスI分子に結合するペプチドよりも長く、15〜24アミノ酸程度である。ペプチド断片はその後CPL (compartment for peptide loading) と呼ばれる小胞に移動する。小胞体 (ER) で合成されたMHCクラスIIα鎖とβ鎖はゴルジ体を通ってCPL内に移動し、このCPL内でペプチドとMHCクラスII複合体が生成される。そして細胞表面に発現し、CD4陽性T細胞(ヘルパーT細胞)に抗原を提示して活性化させる。活性化したCD4陽性細胞は細胞傷害性T細胞やB細胞、その他の免疫細胞を活性化して異物を攻撃する。
遺伝子
ヒトMHC (HLA) 遺伝子は6番染色体短腕上に、マウスMHC (H-2) は17番染色体上に存在し、ヒトでは224もの遺伝子(128の機能的遺伝子と96の偽遺伝子)を含む360万塩基対にも及ぶ巨大な複合的遺伝子領域である。1999年にヒトMHC遺伝子の全塩基配列と遺伝子地図が解読された。
ヒトMHC遺伝子の分類は、3つの領域に分けられ、クラスI領域、クラスII領域、クラスIII領域に分けられている。染色体のテロメア側(末端側)からセントロメア側(中心側)に向かって、クラスI領域、クラスIII領域、クラスII領域が存在する。クラスIII領域のうち、腫瘍壊死因子 (TNF) スーパーファミリーなど炎症に関わる遺伝子群の領域はクラスIV領域と分類されることもある[29]。マウスMHCは転座がおこっているためクラスI領域が2つに分断されており、テロメア側からクラスI領域、クラスIII領域、クラスII領域、小さなクラスI領域となっている。
MHCクラスI領域(遺伝子領域)には3種類のクラスI分子α鎖、つまりヒトではHLA-A、B、C、マウスではH-2K、D、Lの3種類のクラスI分子α鎖がコードされている。β2-ミクログロブリン遺伝子はMHCにはなく、ヒトでは15番染色体 (15q21-q22.2) に[30]、マウスでは2番染色体 (2 F1-F3; 2 69.0 cM) に存在する。MHCクラスII領域にはクラスII分子α鎖とβ鎖、つまりヒトではHLA-DQ、DR、DPのα鎖とβ鎖が、マウスではH-2AとEのα鎖とβ鎖がコードされている。その他2つのTAP (TAP1、TAP2) 遺伝子、LMP (low-molecular-weight protein) 遺伝子、タパシン (tapasin) 遺伝子もクラスII領域にある。ヒトMHCクラスIII領域にはC4、C2、B因子などの補体や、TNFなどのサイトカインの遺伝子が存在する。
MHC遺伝子には、免疫と関係のない遺伝子も存在する。たとえば、クラスIB領域にあるHFe 遺伝子は腸管の細胞の鉄代謝に関与しており、クラスII領域の21–水酸化酵素はステロイド合成に関与している。
MHC遺伝子の進化と多様性
MHC遺伝子はほとんどの脊椎動物にみられる遺伝子領域であるが、遺伝子の構成や配置は種によってさまざまである。例えばニワトリは最も小さいMHC遺伝子をもつ種のひとつであり、ヒトMHC遺伝子の約20分の1、全長92,000塩基で19の遺伝子しか持たないが、一方ほとんどのほ乳類はヒトとよく似た構成のMHCをもつ。ニワトリMHC遺伝子の19全ての遺伝子に相当する遺伝子がヒトにも存在し、これは必要最低限のMHCであるといえるかもしれない。 MHC遺伝子の多様性は遺伝子重複によるところが大きい。ヒトMHCには多くの偽遺伝子がちりばめられている。
アクセサリー分子
MHCおよびそれと結合するTCRは、抗原提示反応において中心的な特別的な役割をしていると考えられている。しかし、MHC・TCR以外にも抗原提示に関わる分子(ここでいう「分子」とは何らかの細胞表面にある特別なタンパク質の意味)は発見されており、CD40(抗原提示細胞 側)とそれに接着するCD154(T細胞 側)、CD58(抗原提示細胞 側)とそれに接着するCD2(T細胞 側)、などの接着分子も発見されている。
これら、MHCとTCR以外の接着分子のことを「アクセサリー分子」または「アクセサリーたんぱく質」などという。
しかも遺伝子の突然変異が起こるたびに正常な細t胞に新たなる異常な別の多種類のタンパク質が作られて生まれたのが癌細胞ですから、もとは自分の蛋白が一部変化しただけであくまでも自分の遺伝子から生まれた新しくできた自分の蛋白抗原であり、全く別の病原体であるherpesウイルスの抗原蛋白ではありませんので抗原提示細胞(APC)である樹枝状細胞やキラーT細胞やヘルパーT細胞に認識されないので癌細胞に対しては異物だと認識されにくいのです。何故ならば自分である表札である自分の組織適合抗原であるMHC‐1と自分の成分である蛋白ペプチドとの複合体が細胞の膜に提示しても抗原提示細胞(APC)には敵と認識されないからです。これを敵と認識してしまえば自己免疫疾患が起こるわけですが自己免疫疾患は存在しないので起こるわけはないのです。ワッハッハ!!!
だからこそ獲得免疫の力は役に立たないのです。しかし遺伝子を変えて癌細胞にした癌ウイルスであるherpesウイルスを殺せば癌細胞が生まれないどころか生まれた癌細胞をロイアル・レイモンド・ライフ博士の「光がん療法」は原因療法で簡単に癌を撲滅できるのです。近頃、価値のない「光免疫がん療法」というつまらない金のかかる無駄な療法が出てきましたがロイアル・レイモンド・ライフ博士の「光がん療法」と間違わないようにして下さい。「光免疫がん療法」はここを読んで下さい。しかしこの人類を癌から救う「光がん療法」を100年前に潰したのはアメリカの医師会会長であったユダヤ人のフイッシュベインであったのです。現代の医療でも何故か、ロイアル・レイモンド・ライフ博士の「光がん療法」はアメリカでは法律で禁じられています。何故かは、「光がん療法」で癌ウイルスを殺して癌が簡単に安価で苦痛なく治れば、治らない癌治療からの稼ぎのドル箱から一銭も入りませんからね。ワッハッハー!!!ロイアル・レイモンド・ライフ博士の「光がん療法」はここを読んでください。だからこそ癌細胞は好んで人体に600個もある防衛大学に集合して敵であるherpes性癌細胞の殺し方さえ知らないかつ殺せない学生を教育する軍事大学である「リンパ節」に集まり癌細胞は増えるばかりとなるのです。
免疫の二次リンパ器官の一つである脾臓がヘルペス感染性癌細胞にいかに無力であることを説明しましょう。また人体の粘膜に200個もあるパイエルパッチという特に腸管の粘膜に多い免疫の二次リンパ器官にもがん転移が極めて少ない理由も説明しましょう。
脾臓は動脈と静脈の間にある血液の異物を処理するための濾過器です。丁度リンパ節はリンパ液に含まれている異物を排除するための濾過装置になっています。にもかかわらず癌のリンパ節転移は常に問題になりますがパイエルパッチ転移や脾臓転移は問題にはなりません。何故でしょうか?
心臓が脈打つたびに5%の血液が脾臓を通ります。200個もあるパイエルパッチと同じくリンパを運び入れる輸入リンパ管がないようにと脾臓には同じ様に輸入リンパ管はありませんし更にパイエルパッチには見られる輸出リンパ管も脾臓にはありません。つまり脾臓には輸入リンパ管も輸出リンパ管も脾臓には無いのです。
しかも脾臓を除いてすべての二次リンパ器官には「high endothelial venule略してHEV」と言われ、日本語で「高内皮細静脈」と訳される特殊な細静脈が存在しているのです。この「高内皮細静脈」の構造と役割は何でしょうか?「高内皮細静脈」の構造は背の高い内皮細胞を持っておりその役割はリンパ球だけと接着できる特異な接着分子を発現してリンパ球だけを血管から選択的に脾臓以外の二次リンパ器官に取りこめることができるのです。一秒間に一万個のリンパ球が「高内皮細静脈」を通って二次リンパ器官に遊出していくのです。脾臓を除いて一分間毎に60万個ずつ二次リンパ管に休まずに送り込んでいるわけですから、免疫の中枢的な仕事をしているリンパ球が脾臓にいかに少ないかがお判りでしょう。つまりたった一個の脾臓は600個もあるリンパ節と違って転移癌細胞がリンパ管を介して転移する度合いは極めて少ないことがお分かりでしょう。しかも一本の血管だけですから癌細胞が脾臓に集中するわけもないのです。もちろん極めて少ないのですが脾臓転移もあることはあるのです。
脾臓の仕事は免疫の仕事以外に寿命の尽きた莫大な赤血球を処理する大事な仕事があるので異物を殺す仕事も後回しになるのです。因みに赤血球は寿命(約120日)がくると脾臓等のマクロファージに貪食され、赤血球中のヘモグロビンは分解されてグロビンとヘムになります。このうち蛋白であるグロビンはアミノ酸に分解され、タンパク質合成に再利用されます。またヘムはさらに鉄とプロトポリフィリンに分離します。鉄もグロビン同様にヘモグロビン等の合成に再利用されます。残りのプロトポリフェリンは環状構造が切断され、緑色のビリベルジンとなります。ビリベルジンはさらに還元されて黄色のビリルビンに変化します。ビリルビンは血液中のタンパク質であるアルブミンと結合して肝臓に輸送されます。肝臓でビリルビンはグルクロン酸と抱合した後、胆汁の成分として捨てられます。肝臓の機能が障害された際に皮膚の色が黄色くなる黄疸という症状がありますが、これは肝臓でのビリルビンの処理が遅れて、血液中に黄色いビリルビンが多量に存在するために皮膚の色が黄色くなることです。ヘモグロビンは赤色から緑色のビリベルジン、そして黄色のビリルビンと色を変えながら代謝されてしまうのです。
次に腸管にある粘膜関連リンパ組織であるパイエルパッチにリンパ管からの癌の転移があるかを見ましょう。また同時になぜ小腸に癌がないのは何故かの答えも出しましょう。
パイエル板(Peyer’s patch)は、小腸に存在し、多くの免疫細胞が集まるドーム状の免疫器官です。腸内でも多くの免疫機能を担っているのが、小腸の下のほうにある「パイエル板」と呼ばれる器官です。
主に小腸に200個もあるパイエル板(Peyer’s patch)は、すでに説明したようにリンパを運び入れる輸入リンパ管がないので組織に散らばった癌細胞からリンパ管に取り込まれたがん細胞は輸入リンパ管のあるリンパ節のようにパイエル板(Peyer’s patch)のリンパ管から入りこむことができないのでリンパ管から癌細胞はパイエル板(Peyer’s patch)に転移することはできません。ところがパイエル板(Peyer’s patch)の静脈には「高内皮細静脈」がありますから「高内皮細静脈」から血液に含まれたわずかな癌細胞を取りこむことはできますがほとんどの癌細胞はリンパ節に取り込まれてきっているのでパイエル板(Peyer’s patch)の二次リンパ器官で癌細胞が転移することはないのです。
それではなぜ小腸は癌が少ないのでしょうか?
小腸の内側を広げるとテニスコート1面の4分の1ほどの面積に達するのは毎日毎日エネルギーを作るための消化吸収に広さが必要であるからです。そもそも、昔からあらゆる種類の食物や水分が通過してするうえ、あらゆる病原体が含まれさらに色々な腸内細菌と共存しているとはいえ、様々な人にとっては異物である物質を放出しています。しかも消化するだけではなく体の細胞に取り込まれて体の一部になる栄養分だけを吸収するためには吸収する前に、病原体のherpesウイルスを始めとする人間に有害となる毒性の異物に対処できる強い免疫機能を持たせるために200個もあるパイエル板(Peyer’s patch)という特別な二次リンパ器官を小腸に作ったのです。また食物が大腸に比べてはるかに短い時間で早く通過させることや、小腸の粘膜の細胞が3日程度で脱落更新するのも、herpesが小腸の細胞に潜伏感染して長く居ついて細胞の遺伝子を突然変異させて小腸の細胞を癌細胞にさせないためなのです。癌の原因はherpesですから小腸は大腸に比べて遥かに遥かにherpes感染はないと言えるのです。だから小腸には癌が極めてないのです。言うまでもなく細菌大腸がんが増えまくっています。
IELs( intra‐epithelial lymphocytes略してIELs訳して腸管上皮細胞間リンパ球)とは何でしょうか?腸管上皮細胞間リンパ球(IELs)は腸管粘膜に存在するリンパ球であり大多数が成熟T細胞であることから,腸管内の異物に対する免疫防御にかかわります。T細胞の抗原受容体(TCR)はα鎖とβ鎖,またはγ鎖とδ鎖の各2本のペプチドがジスルフィド結合したヘテロ二量体である.脾臓や末梢組織に存在するT細胞の大多数はαβ型のTCR(TCRαβ)を発現しているのに対し,IELsではTCRγδを発現する細胞の割合が高い.TCRγδ細胞は,上皮細胞が病原体感染などのストレスを受けることで発現した非古典的MHC分子を認識する.非古典的MHC分子とは,ペプチド抗原を提示せずに,MHC分子そのものがTCRγδ細胞のリガンドとして機能するものである.TCRγδ細胞はMHCの有無によりストレスを受けた病態性上皮細胞を識別し,パーフォリンやグランザイムなどの殺細胞因子によって排除する.またIELsはケラチノサイト増殖因子などを産生することで,上皮細胞の修復も同時に行っている.またCD8+T細胞について,末梢組織ではCD8α/β細胞が多いのに対して,IELsではCD8α/α細胞が多く存在する.CD8α/β細胞はウイルス感染細胞を特異的に認識して細胞傷害活性を示すのに対して,CD8α/α細胞は腸管粘膜における炎症を抑制する。
腸管上皮細胞間リンパ球の生理的機能
腸管上皮細胞間リンパ球は,上皮細胞からでた非古典的MHC 分子を,TCRγδによって認識し,ケラチノサイト増殖因子を産生することで,正常上皮細胞に修復する.またパーフォリンやグランザイムなど殺細胞因子を放出し感染細胞を排除する.
粘膜関連リンパ組織(mucosa-associated lymphoid tissue、MALT)とは何でしょうか?MALT(まると)とは ”mucosa-associated lymphoid tissue” の略称であり、「粘膜関連リンパ組織」とも呼ばれ、孤立リンパ組織からなる粘膜に分布した免疫機構である。胃腸管、甲状腺、肺、性腺、目、肌などの体の様々な領域に分布する。T細胞、B細胞、形質細胞、マクロファージなどが有名であり、それぞれ粘膜上皮を通過した抗原に攻撃する。腸のMALTにはM細胞が加わり、腸管内から抗原を採取してリンパ組織に運ぶ役割を担う。
MALTリンパ腫とは、悪性リンパ腫の種類の1つで、粘膜に関連したリンパ組織からリンパ球の中のB細胞が腫瘍化する非ホジキンリンパ腫。病気の進行が比較的遅い「低悪性度」に分類され、年単位でゆっくりとした経過をたどる。MALTがある臓器は約半数が消化管で、そのうちの大部分が胃に集中しているため、胃MALTリンパ腫は、胃の悪性リンパ腫の約40%を占めている。
なぜ小腸は免疫機能が強いのでしょうか?大腸にはないパイエル板という特殊な二次免役器官があるからです。パイエル板の表面にはM細胞と呼ばれる細胞が待機し、抗原をパイエル板内部に取り込みます。パイエル板内部に控えて待っている樹状細胞は取り込まれた抗原を分解してT細胞に抗原の情報を提示します。抗原情報を受け取ったT細胞によって活性化されたB細胞は主に粘膜免疫に重要な抗体である免疫グロブリンA(IgA)を作る細胞へと分化します。 M細胞やパイエル板を欠損させたマウスでは、腸管や糞便中のIgAの量が減少するため、herpesウイルスなどの病原体を排除する能力が低下し、感染症に罹患しやすくなるのです。
病原体ウイルスであるヘルペスが獲得免疫(適応免疫)は敵を認識する教育が必要なのです。二次リンパ節の最も重要な機能はリンパ球の教育機関であるのです。まずあらゆる種類のリンパ球とすべての種類の抗原提示細胞を集める場所です次に、そこで集めた未熟なリンパ球を教育して敵を認識させて活性化することです。しかし乳幼児期、小児期、成人期に癌になる前にヘルペス感染しているのにも変わらずしかもヘルペスに対する抗体も出来上がり、かつherpesに対するメモリ-T細胞もメモリーB細胞もメモリーキラーT細胞もすでに十分あるにもかかわらずherpesを人体から除去できないのは感染細胞の遺伝子に自分の遺伝子をランダムに組み込んで感染細胞のゲノム(遺伝子)に雲隠れしてしまうのです。その挙句の果てに感染細胞の遺伝子に感染している間になんと感染細胞の二つの癌関連遺伝子を人も気が付かぬ間にいとも簡単に変異させ癌細胞にしてしまうのを賢い世界中の医者が気が付いていないわけはないのです。すべての難病や原因不明な病気も自己免疫疾患も一代限りの遺伝子病もほとんどの精神疾患も原因はすべてヘルペスが原因であるのです。精神疾患の精神は心であり心とは脳であります。ストレスが強すぎて免疫が低下してヘルペスが分裂増殖して末梢神経から中枢神経の脳にまでherpesが感染して正常な脳の働きが侵されて精神病は生まれるのです。脳神経変性疾患はここを読んで下さい。鬱はここを読んでください。
なぜherpesウイルスは人の細胞に感染したがるのでしょうか?この地上に遺伝子を持った生命の誕生は36億年前のRNAウイルスでした。一方DNAウイルスであるherpesウイルスは4億年前に地球に誕生しました。遺伝子を持っているすべての生命は永久に続く時間になりたいのですが無理なので生命の根源であるできる限り多くの自分自身の遺伝子を親から子に伝えることで妥協したのです。病原体ウイルスの中でこれに最も成功したのはherpesウイルスなのです。Herpesこそできる限り最大限の数のビリオン(herpesの子供)を増やす進化をとげたのです。ビリオンはすべてのウイルスの子供のことです。人間の敵は人間である競争社会はストレスホルモンを出し続けて競争を死ぬまでやり続けるので免疫が落ちている間に無限に増殖できることをherpesは知っているのです。つまり人は免疫を低下させたがる動物であることを知ってしまっているのです。しかも長い進化の中でherpesは自分自身を増やすためには人間だけが持っている高度な細胞が持っている機構や酵素を利用して自分の遺伝子であるDNAやカプシドやテグメントやエンベロープやスパイクなどを複製して完全なウイルス粒子を数えきれないほど生み出しやすいことも知っているのです。しかも細胞が二個に分裂すると出来上がった二個共に自分のビリオンの多くを感染させて免疫が高い時には遺伝子に侵入して隠れ、隠れている間に遺伝子を突然変異させて癌細胞を作る準備をやり、免疫低下の時には細胞の分裂に乗じてherpesウイルスも自分の遺伝子をのみならず自分に必要な成分を大量に複製してしまい多数のビリオンを分裂した二つのあたらしい娘細胞に分割して感染細胞を増やすのです。免疫が落ちようが高まろうがる感染した細胞の分裂に歩調を合わせて増えたherpesビリオンも分裂しますから指数関数的にherpesは細胞の中に住み着くことになります。あちこちの感染細胞で細胞の分裂のたび毎に同じ増殖を繰り返すのでがん細胞よりもはるかに、はるかに多いherpesウイルスがあちこちの細胞に感染してしまいいつの間にか癌を作ってしまうことになるのです。
「癌ウイルス」とは何でしょうか?「癌ウイルス」にはウイルスのRNAかDNAかの核酸の違いによって二種類に分けられます。しかし両者とも最後は感染した細胞の遺伝子を変異させてがん細胞にすることは同じです。一つはレトロウイルスというRNAウイルスのうち、動物に投与すると1~2週間という短期間で悪性腫瘍を形成する「癌ウイルス」(急性形質転換ウイルス)であり人の細胞に感染する前からレトロウイルス自身の遺伝子に二つのがん関連遺伝子の一つである「原がん遺伝子」が「癌遺伝子」になってしまった変異を持っているウイルスですから人体の細胞に感染して、感染した細胞の遺伝子をプロウイルス状態にさせるべく自分のゲノムをまずはじめに組み込んでしまうとたまたま細胞のハウスキーピング遺伝子に組み込まれてしまうとすぐに1~2週間という短期間で悪性腫瘍を形成するのもあり得るのです。感染後すぐにがん遺伝子が発現されるので癌になることもあるのは不思議なことではないのです。
ハウスキーピング遺伝子とはなんでしょうか?細胞のホメオスタシスを維持するために必要な遺伝子なので、常に転写・翻訳されて細胞の維持・増殖に関与している多くの組織や細胞中に共通して常に一定量発現する遺伝子であり、細胞の維持、増殖に不可欠な遺伝子である。ハウスキーピング遺伝子は特殊な機能は果たさないのですが細胞の生存に必須のタンパク質つまり人が毎日元気に生き続けるために必要な蛋白質がコードされており、毎日毎日すべての細胞で作られている蛋白なので人が生き続けるのに絶対に必要な蛋白なのです。従ってハウスキーピング遺伝子と言う名前ではなくライフキーピング遺伝子と言うべきなのです。β-actin,18s rRNA,GAPDHなどのハウスキーピング遺伝子の総数は人のゲノムの23,500個のうち2000個余り存在するのです。やはり生き続けるためだけに20001個の遺伝子を毎日発現しなければならないのです。残りの2万個余りは生きるために絶対必要なタンパク質ではなく特殊な蛋白の発現のために用いる遺伝子なのです。
毎日発現している遺伝子が使われているハウスキーピング遺伝子にherpesが感染してその遺伝子が癌化してしまうと癌が極めてできやすくなります。何故ならば細胞の遺伝子が癌遺伝子になってもその癌遺伝子が発現して異常なタンパクを作られない限り癌は生まれることはないのです。しかしハウスキーピング遺伝子が癌遺伝子になってしまいますと常に癌細胞ができやすくなってしまう可能性が増えてしまうのです。人は23500個の遺伝子を持っていますが其のうち2080個がハウスキーピング遺伝子であることが証明されます。
例えば、ハウスキーピング遺伝子には RNA合成酵素、エネルギー生成系酵素、リボソームのタンパク質、細胞骨格タンパク質、GAPDH(glyceraldehyde-3-phosphate dehydrogenase),β-アクチン,β2-マイクログロブリン,HPRT 1(hypoxanthine phosphoribosyltransferase 1)などの遺伝子があります。
細胞骨格蛋白質とは、なんでしょうか?フィラメントと呼ばれる3つの異なるタンパク質構造からなります。 それらは、微小管、マイクロフィラメント(アクチンフィラメント)、中間径フィラメントの3種類です。 これらのタンパク質は、相互に依存して異なる機能を果たす独自のネットワークを細胞内に形成します。糸球体濾過または尿細管再吸収機能の低下により、血中や尿中で増加する低分子タンパク質であります。
β2マイクログロブリン(β2M)は、β2-ミクログロブリンは多様性が無く、クラスⅠの主要組織適合抗原複合体‐Ⅰ(major histocompatibility comlex‐Ⅰで略してMHC-Ⅰ)に結合している軽鎖であり、全ての有核細胞表面に発現しています。その構造はジスルフィド結合によって安定化しており、Ig様ドメインと似通っています。小胞体(ER)内でMHCクラスⅠ分子が他の蛋白と会合し、小胞体(ER)から細胞表面へ搬送されるloading complexを形成するのにβ2-ミクログロブリンが必要です。ペプチド提示後、β2-ミクログロブリンは積極的に循環血液中に放出されます。99個のアミノ酸よりなる分子量11,800の低分子タンパク質で糖鎖は持っていない。臓器移植の拒絶反応に関わる自己であることの証明にもなるHLA抗原系A,B,CのL鎖を構成するタンパク質で、核がない赤血球を除くほとんどの体細胞表面に発現している。β2Mは、体細胞から1日に150~250 mg程度血中に放出されている。低分子タンパク質のため、糸球体でいったん濾過されるが、近位尿細管で99 %が再吸収され、その後アミノ酸やオリゴペプタイドに異化される。
全ての有核細胞の細胞膜表面に広く分布しており、腎糸球体を通過し、近位尿細管で再吸収され分解されます。健常人ではごくわずかしか尿中に排泄されません。
・尿細管に障害があると、尿中への排出が多くなり尿中濃度が高値となります。
・腎機能の低下で糸球体での濾過が低下すると血清濃度が上昇します。
・悪性腫瘍や、炎症性疾患ではこれらの細胞から過剰産生され、血清濃度が上昇し、腎の許容量を超えた場合は尿中濃度も上昇します。
・尿中β2-マイクログロブリンの評価は、血中濃度の増加の有無と、尿細管吸収能を総合的に評価する必要があります。長い間透析をしている患者さんに頻発する血液透析固有の合併症に透析アミロイドーシスがあります。β2-ミクログロブリンが排泄されなくなって血中に溜まり、やがて骨や関節に沈着することによって痛みとともに機能障害を起こす治療が難しい合併症です。
糸球体濾過値(GFR)が低下すると、尿中へ排泄されなくなるため血中のβ2M値は上昇する。また、近位尿細管再吸収機能が低下すると尿から血中への再吸収が滞るため尿中β2M値が上昇する。このようにβ2M測定の臨床的意義は、糸球体と尿細管機能の評価にある。
主要組織適合性複合体 I(Major Histocompatibility Complex I、MHC I)は、免疫システムは何の目的のために存在させたのでしょうか?
免疫システムは常に異物を敵であるか、敵であるかを見分けなければならない。そのため、免疫系が感染した細胞や腫瘍を発見したときは、本当に敵の成分なのか自己の成分なのかを確実に確認できる判断の根拠が主要組織適合性複合体 I(Major Histocompatibility Complex I、MHC I)なのです。主要組織適合性複合体 I(Major Histocompatibility Complex I、MHC I)は細胞のほとんどは、正常な細胞内にあるタンパク質をいくつか切り刻み、MHC Iに載せてその小さなペプチド片と結合させたMHC Iペプチドローディング複合体。ペプチドローディング複合体(MHC I‐ peptide loading complex、略してMHC I ‐PLC)を細胞表面に提示する。そうすることで、細胞が最も関心を持っている異物のペプチドだけをMHC Iに認識を前もってさせるのに役立つのです。その結果、免疫系は細胞内の異物を見分けることが出来るようになったのです。長い進化的自然学習的淘汰の中で、毎日毎日、10万個以上の自分のペプチドと滅多に極めてまれにしか出会わない病原体である異物のペプチドの違いを見分ける能力を免疫細胞は身に着けることが出来たのです。
GAPDHとはグリセルアルデヒド3-リン酸脱水素酵素(GAPDH;G3PDHと略されることもあります。)は、解糖に重要な役割を果たす約37 kDaの酵素ですから毎日人は解糖して毎日エネルギーを使っているからハウスキーピング遺伝子にGAPDHという酵素を作らせているのです。
HPRT 1(hypoxanthine phospho‐ribosylt‐ransferase 1)の遺伝子とは何でしょうか?HPRT 1はhypoxanthine phospho‐ribosyl‐transferase 1の略でヒポキサンチン・グアニン‐ホスホ‐リボシル‐トランスフェラーゼです。HPRTヒポキサンチンとホスホリボース二リン酸(PRPP)からイノシン酸を合成するプリン代謝経路で再利用にはたらく酵素です。イノシン酸は核酸の一種で、ヌクレオチドとも呼ばれるリン酸を含んだ有機化合物です。鰹節のうま味成分でもあります。
レッシュ・ナイハン症候群は、ほとんどが男性のみに発症する遺伝性疾患です。何故でしょうか?レッシュ・ナイハン症候群は、X連鎖劣性(潜性)遺伝と呼ばれる形式で遺伝します。ヒトは、性染色体と呼ばれる染色体を2本持っています。性染色体にはX染色体とY染色体の2種類があり、XYの組み合わせは男性、XXの組み合わせは女性になります。HPRT1遺伝子は、X染色体に存在する遺伝子です。HPRT1遺伝子に異常がある男性は発症しますが、女性では、2本もつX染色体のうち片方の染色体に存在するHPRT1(hypoxanthine phosphoribosyltransferase 1)遺伝子に異常があっても、もう1本が機能を補完するため、発症しません。このように、遺伝子異常をもっていて発病しない状態を「保因者」と言います。この病気の2本のうち異常な一本を持つ保因者の母親から生まれた男児は2分の1の確率で病気になり、女児は2分の1の確率で保因者になるのは簡単に理解できますね。女性が2本のX染色体の両方でHPRT1遺伝子に変異を持つ可能性はまれなため、レッシュ・ナイハン症候群はほとんどが男性で発症します。遺伝子変異により、プリン体の再利用に関わる酵素が欠損し、高尿酸血症、精神発達遅滞、自傷行為、不随意運動、筋硬直、腎結石などの症状が起こります。
プリン体とはなんでしょうか?プリン体は遺伝情報に関わる核酸(DNA、RNA)を構成する物質で、代謝されると尿酸が作られます。核酸が分解されて生じたプリン体をプリンサルベージ経路を介して再利用するための反応に関わる酵素としてヒポキサンチン・グアニンホスホリボシル・トランスフェラーゼ(HPRT)があります。HPRTによってプリン体が再利用されることで、細胞には核酸を作るための材料が供給されることになります。レッシュ・ナイハン症候群ではHPRT1遺伝子の変異によって、酵素であるHPRTが欠損し、プリン体の再利用が行われないので、残ったプリン体およびその代謝産物である尿酸が過剰に蓄積します。
レッシュ・ナイハン症候群の症状には、精神発達遅滞、舞踏病アテトーゼ、高尿酸血症、自傷行為、不随意運動、筋硬直、腎結石などの症状が起こります。
舞踏病アテトーゼとは、体のさまざまな部位に本人の意思と関係なく体が動く不随意運動が起きる状態です。症状は生後すぐから発現し、生後2~3か月で腎結石や尿路感染症、乳児期には哺乳異常・発育不良や運動発達遅滞がみられ、1歳以降では不随意運動、2歳以降では自傷行為等が認められます。生後すぐから発現した先天性の遺伝子病は胎児であった10か月の間に妊婦が妊娠中に初めてのherpes感染によりHPRTの遺伝子の塩基が異常になったからです。しかし何とか生き延びて誕生できたのですがHPRT1遺伝子の変異が残り、酵素であるHPRTが欠損し、プリン体の再利用が行われず、また、プリン体およびその代謝産物である尿酸が過剰に蓄積しまった悲しい病気です。妊娠前にherpes感染がなかった妊婦に抗体ができていなかったからです。妊娠前に抗体の有無をPCRで調べておけば防げるレッシュ・ナイハン症候群なのです。
一代限りの遺伝子病のほとんどすべての先天性の遺伝子病はherpesの抗体を持っていない妊婦が感染したために生じた胎児性遺伝子病ですからこのような悲劇を防ぐためにはどうしたらいいのでしょうか?極めて簡単です。妊娠する前のすべての女性にヘルペスのherpesのPCR検査をやり抗体のない女性には全例herpesのワクチンを接種すればほとんどすべての胎児性遺伝子病は防げるのです。悲しいですね。
レッシュ・ナイハン症候群の病気に特徴的なかみつきや頭を激しく振るヘッドバンギング(頭をたたきつけること)などの自傷行為が見られ又通常、歩行が困難なため介助や車いすが必要となります。また、HPRTの活性が完全に見られないHPRT遺伝子の完全欠損の場合には、症状は特に重篤になります。完全欠損に対し、酵素の活性が少量見られる場合は部分欠損と言います。部分欠損は「ケリー・シーグミラー症候群」と呼ばれます。レッシュ・ナイハン症候群の発症頻度は出生男児10万人に1人程度です。
レッシュ・ナイハン症候群は、X連鎖劣性(潜性)遺伝と呼ばれる形式で遺伝します。劣性潜性遺伝は潜性遺伝ともいわれます。ヒトは、性染色体と呼ばれる染色体を2本持っています。性染色体にはX染色体とY染色体の2種類があり、XYの組み合わせは男性、XXの組み合わせは女性になります。HPRT1遺伝子は、X染色体に存在する遺伝子です。HPRT1遺伝子に異常がある男性は発症しますが、女性では、2本もつX染色体のうち片方の染色体に存在するHPRT1遺伝子に異常があっても、もう1本が機能を補完するため、発症しません。
ハウスキーピング遺伝子以外の他の遺伝子は、生きている間には、ほとんどの場合使われません。因みにハウスキーピングの本来の意味は「家事、家政、家計」です。例えば、2000個もあるハウスキーピング遺伝子以外の遺伝子の中には受精卵(胚細胞)から発育する初期段階だけで使われ、その後二度と使われない遺伝子も多くあります。さらに多くの遺伝子が、特定の細胞内でのみ使われ、その細胞の特徴を作り出してしまうと、ほとんどどの場合使われません。人には23500個の遺伝子がありますが通常、細胞はそのうちの遺伝子の内、必要なときだけしかも必要な遺伝子だけを働かせ、そうでないときは意図的にその働きを止めているからです。
ハウスキーピング遺伝子とは多くの組織や細胞中に共通して一定量常に発現する遺伝子のことであり人体のホメオスタシス「恒常性」を維持するために発現され、細胞の維持、増殖に不可欠な遺伝子なのです。だからこの遺伝子は休む暇がないのです。
人の23500個の遺伝子の中にハウスキーピング遺伝子(hous keeping gene略してHKG)は何個ありますか?古いデータですが2,087個の遺伝子が、大部分の状況でしかも大多数の組織で毎日発現するハウスキーピング遺伝子(hous keeping gene略してHKG)としてはじめて見出されたという古い記事がありました。つまり人の23500個の遺伝子のうち生きるために毎日2,087個の遺伝子が発現しているのです。全遺伝子のうち一割近くの遺伝子によって毎日生きるために必要なタンパク質とRNAが産生されているのです。因みに遺伝子とは正確に定義すると「タンパク質又はRNAの元になる情報を持っているDNAの部分です。」
二つ目の「癌ウイルス」はロイアル・レイモンド・ライフ博士が見つけた「癌ウイルス」で「herpesウイルス」のことです。この癌ウイルスに属するのはB型・C型肝炎ウイルス、ヒトパピローマウイルス(HPV)、ヒトTリンパ好性ウイルス1型などですがすべての人に感染してすべての細胞に感染してあらゆる種類のがんを作り出すherpesウイルスと比べると微々たる数の癌しかないので無視してもいいのです。従って「すべての癌はherpesだ。」と言い切れるのです。herpesウイルスは人体を構成する250種類のすべての細胞に感染するのでのあらゆる臓器を癌にすることができるのです。最近、人体を構成する細胞は300種類という学者もいます。
二種類の「癌ウイルス」とも人体の細胞にまず感染し細胞の遺伝子にどちらの「癌ウイルス」も自分のゲノムを細胞のゲノムにまず組み込まなければならないのです。herpesウイルスに感染した細胞を癌化するためには二つの条件が必要です。レトロウイルスというRNAウイルスとherpesウイルスはあらゆる細胞にランダムに感染できますが、他のがんウイルスは特定の臓器の細胞にしか感染できません。細胞に感染して細胞質に隠れている並みのウイルスはすべての細胞が持つ免疫に見つかるとインターフェロンαを感染した細胞に出されてしまうと自爆テロで細胞ともどもウイルスは死んでしまいます。従って絶対に見つからない唯一のためには細胞の遺伝子にゲノムを組み込んで細胞のゲノムに潜伏するしかないので、細胞の遺伝子にプロウイルスになるべく自分のゲノムを組み込んで細胞に見つからないようにしまいます。次に細胞を「癌細胞」にならせるためにはプロウイルスになって感染細胞の遺伝子を癌遺伝子に変えなければなりません。癌細胞が生まれるためには細胞の遺伝子の23500個のうち二つのがん関連遺伝子を癌遺伝子にしなければならないのです。最近ではがん関連遺伝子は4つあることがわかりました。一つだけだと良性腫瘍になるだけで悪性腫瘍である癌にはなれないのです。最新のデータでは2種類の癌関連遺伝子は合わせて480個もあることが分かったのです。癌が発見されたときにはherpesが癌細胞は10憶個になっていますから一個の癌細胞には10匹~100匹のherpesが感染していますから癌細胞の2種類の480個の癌関連遺伝子がヘルペスによりものすごい勢いで突然変異する可能性が加速的に増えていきますから現代の免疫を落とす癌標準医療ではherpes性遺伝子突然変異で死ぬ以外には道は無いのです。
良性腫瘍にしろ悪性腫瘍(癌)にしろ腫瘍に若くしてなりやすい人はストレスがかかりやすい人でもあるので免疫が落ちてherpesウイルスにも感染しやすくかつherpesウイルスが増殖しやすい人で、たまたまハウスキーピング遺伝子にherpesウイルスのゲノムを自分の細胞のゲノムに組み込まれた人なのです。
繰り返しますが、毎日使われるハウスキーピング遺伝子以外の、遺伝子は、特別に必要な時にしか使われません。細胞の遺伝子が使われなければ使われることがない細胞の遺伝子にウイルスの癌を作る悪い遺伝子を組みこんでも元の組み込んだ部位の遺伝子が二度と利用されなければその悪い遺伝子が発現しないので塩基の配列が変異して癌化した遺伝子が異常な癌蛋白をそもそも産生できないので癌にはなりません。だからこそすべての細胞で毎日使われるハウスキーピング遺伝子にウイルスの癌遺伝子が侵入してしまえば塩基の並びが変異した腫瘍になりやすい可能性が増えるのは当然のことなのです。
しかし稀な時にしか発現されない遺伝子にいわば癌ウイルスであるherpesの遺伝子が感染してしまうと腫瘍ができてしまうこともあるのです。だからこそ癌はウイルスによる感染症であると明確に言えるのです。がんとは「癌ウイルスの遺伝子が細胞の遺伝子に感染したために生まれる感染症」と言ったら一番理解しやすいのです。昔も今も万病のもとは病源体による感染症なのです。言い換えると正常な細胞の遺伝子に異常な遺伝子がかぶさっただけですから熱もなく痛みもなく炎症所見も癌では見られない遺伝子性感染症と言えるのですが、感染症であっても細胞外に出ないで遺伝子に隠れ住むために自分のゲノムを細胞の遺伝子のゲノムに組み込むことによって細胞の遺伝子を突然変異を起こしてしまうのです。組み込む遺伝子座位がランダムであるので必ずしも細胞の遺伝子を突然変異させて癌化させるわけではないのですが組み込むherpesが多くなればなるほどその可能性は高まっていくのです。herpesが細胞内にとどまる限りは免疫に発見されて戦うことはないのでCRPなどの炎症所見は見られないのです。癌細胞自身と免疫と闘ってCRPが上がることはないのです。何故ならばがん細胞自身は細胞の奥深くの核のゲノムの一部の遺伝子が変異しただけの自分の細胞にすぎないからです。元来、自己免疫疾患は存在しないのでつまり自分の細胞は対しては絶対に免疫は攻撃しないので炎症は起きないので癌に際してCRPが上がるのはherpesのビリオンが増殖してがん細胞外の組織や血液に出て大食細胞などの自然免疫細胞に貪食されるときだけです。更に癌細胞なって癌細胞が作る異常な蛋白と闘うこともないのです。何故ならば異常な自分の蛋白は病原体ではないからで、炎症の指標であるCRPも上がりません。癌で時にCRPが上昇するのは癌細胞の原因はherpesであるので外部に放出されたherpesが大食細胞に貪食されたときだけです。癌が進めば進むほど免疫が下がり細胞で増えたherpesが新しい細胞に感染するときに細胞外に出ていくときに免疫につかまり大食細胞に貪食された時だけなのです。
免疫はherpesが細胞に侵入してしまえば100%無力なのです。しかしすべてのherpesウイルスが感染細胞自身が作るインターフェロンαによって自爆してしまうとherpesも死んでしまうのでそれを避けるために核の中や細胞の遺伝子に逃げ込むのです。核や遺伝子に隠れてしまうとインターフェロンαを細胞は作れないのです。
血管から血液を介して流れていく癌細胞は血管のリンパ節というべき二次リンパ器官である脾臓で癌の脾臓転移が起こらないのでしょうか?血管新生(angiogenesis)とは、「既存の血管から新しい動脈血管を形成すること」である。この新しい動脈血管はがん細胞の浸潤や転移の経路としての役割も果たしているのです。動脈血管新生には血管新生増殖因子であるVEGF(血管内皮増殖因子)やFGF(線維芽細胞増殖因子)が必要ですが、がん細胞はこれらを生み出して血管内皮細胞の増殖を刺激します。FGF(fibroblast growth factor略して FGF は訳して線維芽細胞増殖因子)とは何でしょうか?20以上あるFGF のうち、再生初期に上皮に発現するFGF 20aが間充織細胞を再生芽へと誘導し、次に、再生芽が形成されると、FGF 3などの再生芽FGF が細胞増殖を活性化するのです。FGF は成長因子(増殖因子)の一種です。FGF は細胞表面の成長因子受容体に結合し、細胞内のシグナル伝達を通じて、広範囲な細胞や組織の増殖や分化過程、血管新生、創傷治癒、胚発生などに関係する成長因子なのです。
間充織細胞とは何でしょうか?発生過程または成体で組織間の間隙を埋める細胞で、細胞の種類や細胞の分化状態は明瞭でない細胞を総称していいます。
マトリックスメタロプテアーゼと呼ばれるタンパク質分解酵素によって動脈の血管内皮細胞の基底膜を破壊します。血管新生因子(血管内皮増殖因子)によって刺激をうけ、かつ基底膜が壊された血管内皮細胞は新しい動脈血管をがん細胞まで伸ばしていきます。このように作り出された動脈の新生血管はがん細胞に到達し、その癌細胞に栄養や酸素を供給するパイプになってしまうのです。
従来からの化学療法で使われている抗がん剤やVEGF(血管内皮増殖因子)の経路を標的としない分子標的治療薬は、がん細胞に作用してそのシグナルを抑制することにより殺細胞効果や抗腫瘍効果を発揮しますが、VEGF(血管内皮増殖因子)を標的とした分子標的治療薬は、がん細胞で特有と考えられている微小環境を利用して、がん細胞への栄養供給を絶つという考えから新しい薬として開発されています。これらを血管新生阻害剤と呼んだりします。もう一度説明しますと、血管新生阻害剤とはがん細胞直接ではなく、その周囲の環境である栄養や酸素をがん細胞に届ける役目をする血管内皮細胞に作用して、増殖を抑制する働きをします。これによりがん細胞の活性化も抑制して抗腫瘍効果を示すのです。と考えられていますが意味のない無駄な治療法です。
ヘルペス性がん細胞に特有と考えられている腫瘍微小環境とは何でしょうか?腫瘍微小環境(TME)とは英語でTumor micro‐environmentで略して, TMEです。腫瘍微小環境(Tumor microenvironment, TME)とは,①ヘルペス性癌細胞と②herpesウイルスと③免疫系細胞と,④血管系細胞と,⑤線維芽細胞などの様々な細胞が作り出す複雑に絡まっている独特な微小環境のことを指します。免疫亢進と免疫抑制性と低酸素ニッチなどを特徴とし,腫瘍の発生から発達・進行に相互に多くの影響を与えあいます。ニッチとは、「隙間」を意味する言葉で、語源は英語の「niche」です。これまでのがん治療ではがん細胞を標的としてきましたが,近年ではTMEが新たな標的として注目されていますがherpesに全く焦点が当てられていないどころかherpesが細胞の遺伝子を癌化させる真実に誰も気が付いていないのも残念なことです。
癌細胞の特殊性は癌を生み出したherpesウイルスが生み出す特異性なのです。herpesウイルスが他のウイルスと異なる特異性を思いつくままに羅列しましょう。herpesウイルスは①免疫で殺しきれない②効果のあるワクチンは作れない。③人体のすべての細胞に感染するのであらゆる原因不明だとされる病気を起こす細胞のゲノム(染色体)にherpesのゲノムを簡単に組み込む⑤すべての免疫から回避できる⑥免疫が見つけることができない核の遺伝子に隠れる⑦細胞が二つに分裂するたびに多数のビリオンを生み出し細胞外に出るのは免疫が下がるときです⑧免疫が落ちると増やした子供である数多くのビリオンを次の細胞に感染させる⑨細胞が2分裂する際に隠れているビリオンがすべて倍加して分裂した二つの細胞に数多くのビリオンが感染する。⑩MHC-1に自分のペプチドを結合させない⑪自分のゲノムを細胞のゲノムに組み込んで遺伝子を変異させてしまう。その結果癌を作ってしまうことも有る。⑫遺伝子を突然変異させたり遺伝子を傷つけたりしてて後天的な遺伝子病を引き起こすことが多い⑬細胞の免疫が落ちるまでは分裂して増殖しない⑭免疫で殺しきれないので感染したら死ぬまで付きまとわれる⑮自己免疫疾患の原因はherpesである⑯原因不明の病気や難病の原因はヘルペスである⑰神経細胞は普通の細胞とは異なって特殊な形態の軸索や樹状突起や神経細胞体やシナプスなどに分かれているので感染しても免疫に見つけられないので感染したがるので神経疾患を起こしやすい⑱特には自律神経が集合しているのでさらに隠れやすいので自律神経節の自律神経に感染して溶解感染を起こしやすいので様々な自律性疾患という難病を起こしやすい。ルペス感染しやすく⑲神経細胞は一つの細胞であると思われているが実はシナプスで繋がっているのでシナプスを通じて末梢神経も中枢神経にもつながっているので全身の神経はヘルペスにとっては事実上一本の神経であると言えるのです。従って原因不明な中枢性の神経疾患もん末梢神経に感染したヘルペスがストレスの多い人生を耐え続け歩んできた真面目ないい人がなりやすいのです。脳変性疾患であるアルツハイマーも元を言えば知らぬ間に感染したヘルペスが長い時間をかけて一本の神経を伝わって脳の記憶を司る海馬体の細胞に感染したヘルペスによる炎症が起こした病気なのですがアミロイドβが原因やと言い続けている愚かな医薬業界はいつ気が付くのでしょうか???抗ヘルペス剤を出せば進行は100%抑制されしかも海馬体の細胞には幹細胞があるので良くなっていくのに残念です。
herpes感染による二つのがん関連遺伝子の癌化以外にがん細胞は一回の分裂で二個しか四個、八個ずつしか増えないので指数関数的ですが一方感染細胞の中で大量に増えたヘルペスは細胞の分裂のたびごとに更に何十、何百と分裂して増えていき、しかも二分裂によって二倍に増えた新たなる多くの細胞にも何十、何百、何千個と感染してしまうので細胞のゲノム(染色体)の遺伝子にウイルスのゲノムが数えきれなく組み込まれ一つの癌細胞のゲノムにherpesのゲノムがが何十個、何百個も組み込まれることもあるのです。しかも細胞の染色体には父親のものと、母親のものの染色体二種類ありますので細胞の分裂の時に自分の染色体を細胞のむき出しになった父親と母親のどちらの染色体にも何匹ものウイルスの染色体を組み込みやすくなるので、細胞分裂に合わせてherpesもウイルス分裂のタイミングを合わせるのです。
一つの細胞には480個もある増殖のための癌関連遺伝子をさらに突然変異を起こさせてしまうので癌細胞自身の増殖のスピードが爆発的に増えてしまい原発巣からの癌の転移の勢いも加速するのみならず転移巣からも新たなる別の転移が発生してすべての組織に転移せんばかりの勢いとなってしまうのです。再び癌細胞は一回の分裂・増殖では2倍しか増えないのですが数百も感染しているウイルスは細胞の分裂のたびごとに、数百個も増えるので主に核の中でものすごい勢いで指数関数の何倍かの量のherpesが増えるのみならず細胞の遺伝子から細胞質から出て正常な別の組織の正常な細胞にも感染してしまうのです。
又増えたherpesは既に癌になった細胞の遺伝子に入りこんで480個もある二つのがん関連遺伝子を何十個もの多くをさらに癌化させてしまうので癌細胞の分裂の勢いに大加速をつけてしまうので癌は見る見る大きくなって転移もあちこちの組織に見られるのは当然のことなのです。
大きな誤解を正しておきましょう。癌が増殖するのは二つの癌関連遺伝子の自動車の一個のアクセルと一個のブレーキが故障してしまいアクセルがかかったままになり速度(増殖)が速くなり過ぎて更に二つ目のブレーキ(癌の増殖のブレーキ)も故障して加速したスピードも止めることができなくなって癌という病気で死ぬという譬えが実は大きな間違いなのです。一つ目の間違いはアクセルが故障してしまうとスピードが落ちてしまい車はスピードが出なくなるので癌も増えないのです。二つ目の間違いはブレーキである「がん抑制遺伝子」も働かくなっているので癌の増殖も速まるというわけですが元々アクセルも踏んでいないのにブレーキを踏んで癌の増殖を抑えることができますか?本当に大衆を馬鹿にした癌のインチキな説明の一つです。医薬業界が製造しているほとんどの薬は病気を治す薬ではなく免疫を抑制するか症状を一時的に良くして患者をだますかの類の薬ですから医薬業界が病気を作って繁栄しているだけですから合法的犯罪社会ですが大衆は全く気が付いていないのです。金と権力を持っている優れた人間が支配している資本主義社会ですからどうにもなりません。残念ですね。だから優れた子供たちは医者になりたがるのです。偏差値が低い頭の悪い人は医者にはなれないので病気を作り続けても責任を問われない法律で守られた医者にはなれないのです。アッハッハ!!!
二つの癌関連遺伝子である癌現遺伝子でと大きくなったヘルペス性癌細胞に感染しているherpesを狙い撃ちにする免疫系細胞,増えた癌に栄養と酸素を供給する新規の血管系細胞,がん組織をさらに拡大する線維芽細胞などの様々な細胞が作り出す複雑で異常な癌周辺の炎症性でかつ腫瘍性の微小環境も拡大するばかりになっていくのですが癌細胞は、一向に減る様子もないのです。癌細胞内で莫大な数に増えたherpesが癌細胞の中の癌関連遺伝子の多くを癌化させ、かつ癌細胞から出て、別の正常な細胞に感染してその細胞も癌化させることになるのです。さらに崩壊していない元気な癌細胞自身にもヘルペスは感染するのです。herpesに生きている細胞である限り増殖可能な細胞であるのでいかなる種類のいかなる状態の細胞にも感染したがる特性を持っているのです。それは生きた細胞である限り細胞の奥深くにはゲノム遺伝子という最高の隠れ家に住み着けば人間に永遠に免疫に殺されることができないことを知っているからです。しかも正常な細胞であろうと癌になった細胞であろうと遺伝子にゲノムをぶち込んで癌化させればさせるほど癌細胞は分裂・増殖する勢いがつくのでそのたび毎にherpesの子供であるビリオンを何百倍も増やしてしまい癌細胞のゲノムに組み込ませて480種類の癌関連遺伝子のいくつかを突然変異をさせてしまうことになり癌細胞の増殖の勢いを増やすので細胞の分裂・増殖が激しくなり続け癌細胞が増えるという悪循環をもたらすのです。
TMEは英語でTumor micro‐environmentで訳は,腫瘍微小環境と訳し,略して(TME)となります。腫瘍微小環境(TME)とは、腫瘍組織やその周囲に混在する正常組織や免疫細胞等、様々な細胞・非細胞成分から構成され、腫瘍の進行に大きな役割を果たしています。腫瘍微小環境(TME)を構成する主な細胞と役割について見ましょう。
①がん関連線維芽細胞(Cancer-Associated Fibroblast, CAF)はがん細胞を支える組織であるがん間質を構成するコラーゲン等の線維を産生する線維芽細胞であります。がん細胞の悪性化を起こす増殖、浸潤、転移を促進するさまざまな増殖因子やサイトカイン・ケモカインを大量に産生するであり腫瘍間質の主要な構成要素であり,がんの増殖,浸潤,転移,以外に血管新生において重要な役割を果たします。
②制御性T細胞(Regulatory T cell, Treg)でCD4+T細胞を抑制するため,自己免疫や防御免疫応答を防止するリンパ球のサブセットです。しかし自己免疫疾患もありませんし、防御免疫応答を防止するリンパ球などもないのでしかもCD4+T細胞はヘルパーT細胞のことですからCD4+T細胞にはⅠ型とⅡ型があり制御性T細胞(Regulatory T cell, Treg)はⅠ型を抑制してするだけですからアレルギーを免疫寛容を起こすための制御性T細胞なのです。転写因子であるFOXP3を発現しているのはⅠ型ヘルパーT細胞をⅡ型ヘルパーT細胞に分化させるためなのです。又FOXタンパク質( FOX protein)は、細胞の成長、増殖、分化、長寿などに関わる遺伝子の発現調節に重要な役割を果たす、転写因子のファミリーひとつであり、FOXタンパク質の多くは胚発生と胚の分化に重要です。胚発生(embryo‐genesis)とは、多細胞生物が受精卵から成体になるまでの過程を指します。
③腫瘍随伴マクロファージ(Tumor-Associated Macrophage, TAM)はM2型のマクロファージです。抗炎症性サイトカインや血管新生因子を多く分泌します。癌は原因は癌細胞にはびこっているherpesウイルスですからherpesと闘っても殺しきれないのでM1マクロファージと違って抗炎症性サイトカインを出して仲良く共存しようとするのがM2型のマクロファージなのです。M2型のマクロファージとは何でしょうか?マクロファージはその役割によってM1型とM2型に大別されます。 M1マクロファージは炎症性単球がTNF-αやIFN-γなどを受けて分化し,病原体や寄生虫感染防御に働く一方,M2マクロファージは組織常在性単球がIL-4やIL-13などTh2型サイトカインを受けて分化し,病原体との戦いの炎症の後の組織修復などにかかわります。癌は癌細胞に大量に感染したてherpesが遺伝子を突然変異させて作ったものですからヘルペスウイルスと闘っても意味がないので抗炎症性サイトカインを多く分泌するのがM2型のマクロファージなのです。しかもガンは本来異物ではなく自分の分身ですから炎症は起こらないのですが癌細胞は原因であるヘルペスが満載されていますから祖手を認識した免疫はM1マクロファージのように炎症を起こそうとしますがM2マクロファージはそれを阻止しようとして抗炎症性サイトカインを多く分泌して組織修復に励むのです。否が応でもherpesと闘っても勝てないことを免疫は進化の中で学んだのですが愚かな医者たちは無知100%なのです。
④骨髄由来免疫抑制細胞(Myeloid Derived Suppressor Cell, MDSC)は顆粒球,マクロファージ,樹状細胞などに分化する前の未熟な骨髄細胞です。これらTreg, TAM, MDSCはT細胞による敵を殺すという本来の免疫応答を阻害するのは癌細胞は実はヘルペス感染細胞であることをわかって分化した細胞であるからです。何故T細胞による免疫応答を阻害するのかはherpesと戦っても勝てるわけはないことを免疫がわかっているからです。オプジーボも免疫阻止ポイントを阻害するから副作用が1600種類生まれるだけのみならずオプジーボが殺しているのはherpes感染細胞でありかつ、ついでに癌になったがん細胞をも殺しているだけです。キラー細胞が敵として認識できるのはherpesが感染した細胞だけであり癌化した異物ではない自分の細胞を殺すことはできないのです。キラー細胞は自分と同じ仲間が癌化しても敵ではないので危険な殺すべき敵と認識できないのです。オプジーボの副作用は癌になっていないherpes感染細胞を殺したために生まれたのです。従って同じ理由で自己免疫疾患などは絶対にありえないので私はすべての自己免疫疾患を治せたのです。それでは自己免疫疾患の原因は何ですか?言わずと知れたherpesです。癌の原因も遺伝子を癌化させたのはherpesなのです。
何故癌の幹細胞はないのでしょうか?がん細胞にも幹細胞があるあると言われるのですがあるわけは無いのです。幹細胞を持つ細胞の幹細胞がherpesウイルスが感染してがん化した幹細胞を間違って癌幹細胞と言っているだけです。答えと詳細は後述します。簡単な答えは正常な幹細胞にherpesが感染して幹細胞の二つの癌関連遺伝子が突然変異を起こしただけなのです。癌細胞を作るいわゆる本当の幹細胞は存在しません。何故ならば、幹細胞と組織の細胞は絶えず入れ替わり続けなければ組織を維持できません。失われた細胞を再び生み出して補充する能力を持った幹細胞を持っています。 また、組織が傷つけられたりダメージを受けたりしたときも失われた組織を補充する能力を持った細胞が必要となります。 こうした能力を持つ細胞を「幹細胞」と呼びます。
リンパ管にリンパ球が流れ込めるルートは二つあります。答えは後述します。
何故二次リンパ器官である脾臓にがんの脾臓転移はほとんどないのでしようか?脾臓は癌細胞に対する仕事はしていないのでしょうか?答えと詳細は後述します。
何故herpesに対する特異抗体は癌の原因はherpesであるのに脚光を浴びないのか?答えは後述します。
がんには、もともと血管は備わっていません。血管がないと酸素や栄養が足りないので、がんは一定のサイズ(2~3m㎥)以上に大きくなることはできません。そこでがんは、新しい血管(腫瘍新規血管)を作って、周囲の血管から新たなる毛細血管を作って血液を引いてくるのです。一度新規血管ができると、がんはどんどん大きくなり(進行がん)、そして体中に転移を起こします。つまり、血管新生を阻止して、がんを兵糧攻めにすることが治療に役立つと考えられているのですが無駄です。すべての病気は癌を含めてヘルペルスが原因であることを理解しない限り他の医療は金儲けの免疫を抑える対症療法ですから逆にherpesを増やしているだけですから資本主義医療は病気が増えるつまり患者の苦しみが増えるだけです。しかもこれに患者が気が付いていないのが悲劇です。
毎年9000人近くの病気つくりの医者が増えていますがそれは大学に医学部で病気の作り方を教えているだけだからです。毎年患者が医者に払うお金は去年は46兆円で毎年増えています。病気を治すのは医者ではなく薬でもなく患者の免疫だけであることを一切教えないからです。最高の名医は免疫の遺伝子だけなのです。現代の医学は基本からすべて間違っています。
新規血管はどのようにして作られるか? 血管は大動脈として心臓を出発し、どんどん枝分かれして細くなり、毛細血管となって全身にくまなく分布して組織に酸素と栄養を与え、再び静脈となってリンパ管も合流してherpesの多いリンパも二酸化炭素も心臓に戻ります。このような血管は、母体の中で胎児が発達するとき、一番初めに形成が開始します。血管ができないと胎児は発育することはできず、肝臓や膵臓といった臓器すら形成されないのです。血管を作るため、体には特別なしくみが備わっています。その代表が血管内皮成長因子(Vascular endothelial growth factor略して VEGF)と呼ばれる蛋白質(VEGF)です。血管内皮成長因子は血管内皮増殖因子とも訳します。血管内皮増殖因子にはたくさんの種類があって、すべてのいろんな種類の細胞に作用しますが、VEGFは血管を作っている血管内皮細胞に選択的に作用する増殖因子です。VEGFは、酸素が足りないとき生成され、血管の基となる細胞(幹細胞)から血管内皮細胞へ分化させるとともに、血管内皮細胞に働きかけて新しい血管を作らせるのです。
VEGFは、子宮内膜や創傷治癒といった正常な大人の必要な血管新生でも中心的な役割を担っていますが、癌もこのしくみを使って血管を作っているのです。がん細胞は、酸素が足りないことを感知してVEGFをたくさん生成しますが、さらにVEGFの遺伝子のがん化による遺伝子の変異のために、低酸素とは関係なくVEGF遺伝子の発現が高まってしまうのです。つまり正常なVEGF遺伝子を癌現遺伝子と言い遺伝子ががん化したVEGFを癌遺伝子と名付けるのです。この癌化した血管内皮成長因子は癌促増殖因子となりもう一つのがん抑制遺伝子も癌化してしまうと癌細胞が増えまくりのです。
がんが増殖して大きくなるためには、動脈血液からの栄養が必要です。 そのためにがんは、近くにもともとあった正常な動脈血管から枝分かれするような「がん栄養血管」という新しい血管を自ら作り、がんの中に血液を取り込むのです。
癌細胞が増えて行くつまり進行していき遠隔転移が見つかった場合、herpesやherpes感染細胞やherpes感染癌細胞がリンパや血流にのって移動したことになりますがこの時、全身治療である抗がん剤の治療を行うのは間違いで投与すべきは抗herpes剤と漢方煎じ薬とインターフェロンαの点滴です。herpes感染細胞が癌細胞になってしまえば高額なインターフェロンαの点滴で癌細胞とherpesもろとも自殺(アポトーシス)させるのが最高の治療ですが保険ではできないようになっているのです。もちろん最高の癌治療はロイアルレイモンドライフ博士の『癌光療法です』。ロイアルレイモンドライフ博士の『癌光療法』はここを読んでください。
抗がん剤の作用メカニズムは何でしょうか?抗がん剤は、細胞のDNAと結合する性質を持っていたり、細胞内の物質と似た形をしていたり、そもそも正常な細胞には毒である物質です。細胞は増殖するときにDNAを複製しますが、その際にDNAに結合しやすい薬である抗がん剤が入り込んでしまうと、すべての細胞は増殖できなくなり、やがて癌細胞も正常な細胞も死滅します。しかも癌の原因であるherpesを殺すことは全くできません。何故ならばherpesウイルスも細胞の分裂に際して凄い憩いで増殖しますが細胞ではないので抗ガン剤の作用は全く関係がないのです。
白血病には血管新生は必要ないのは何でしょうか?白血病は、骨髄という骨の中の空間に血液成分の一つである白血球が異常に増えて骨髄を占領してしまう血液がんの一種で、異常な白血球が骨髄から血液中にあふれ出たり、骨髄が正常な血液を作れなくなっている状態だからです。①白血病と②悪性リンパ腫と③多発性骨髄腫を合わせて三大血液がんと言われます。三大血液癌の原因の殆どがヘルペスウイルスです。悪性リンパ腫は、白血球のうちリンパ球ががん化する病気です。悪性リンパ腫は、がん細胞の形態や性質によって、大きく①B細胞リンパ腫、②T細胞リンパ腫、③NK細胞リンパ腫、④ホジキンリンパ腫、⑤非ホジキンリンパ腫に分かれます。細かくは、100種類近くのタイプが悪性リンパ腫にはあります。多発性骨髄腫は、白血球の中のリンパ球のうち、B細胞から分化(未熟な細胞が成熟した細胞になること)した 形質細胞が癌化して骨髄腫細胞になり、骨髄腫細胞が主に骨髄で増える病気です。分化とは未熟な細胞が成熟した細胞になることです。
白血病の発症原因は何でしょうか?白血病は、特定の化学物質の曝露や放射線被ばく、ウイルス感染、遺伝子の異常などの原因が明らかな場合を除き、原因がわからないケースがほとんどですと言われていますが骨髄に感染したherpesウイルスが未分化な白血球の遺伝子を突然変異させたためです。それではリンパ種の発症原因は何でしょうか?悪性リンパ腫が発症する原因としては、ウイルス(EBウイルスなど)、細菌(ピロリ菌)、自己免疫疾患(関節リウマチなど)、免疫不全を引き起こす薬剤治療(メトトレキサートなど)、化学物質への暴露が挙げられますが、他の原因が明らかではない場合はherpesウイルスによる未分化なリンパ球の遺伝子を突然変異させたためです。さらに多発性⾻髄腫の原因は何でしょうか?形質細胞ががん化したことによって発症する病気です。 ⾻髄で異常な細胞が無秩序に増殖するので、⾻、造⾎機能、腎臓などにさまざまな症状(合併症)が出現します。成熟した形質細胞をがん化させるのも形質細胞の遺伝子に感染したherpesウイルスが遺伝子を突然変異させたからです。
血液癌のすべては固形癌と違って癌になるのになぜ時間がかからないのでしょうか?詳しくは後述します。極めて簡単な答えはherpesは骨髄の血液細胞を簡単に突然変異をさせしかも二つの癌関連遺伝子を同時に極めてたやすく癌化させてしまうからです。
すい臓がんは何故癌になると進行がんになるスピードが超特急なのでしょうか?詳しくは後述します。簡単な答えはすい臓の細胞はすべてハウスキーピング遺伝子を持っているのですい臓がんが発見されるまでに数多くの細胞のハウスキーピング遺伝子が癌化すると480種類もある癌関連遺伝子が毎日発現しなければならない上に毎日三回食べるために発現されるハウスキーピング遺伝子を持ったすい臓の細胞の細胞代謝の分裂の回転が速いので癌細胞を作った数多くのヘルペスウイルスの分裂・増殖も膵臓の細胞の分裂・増殖に歩調を合わせるので膵臓以外の癌細胞と比べて早くなります。増えた多くのherpesは癌細胞のゲノムに自分のゲノムを大量に組み込むと新たな480種類もある癌関連遺伝子に自分遺伝子を重ねて組み入れてしまうと正常な膵細胞の遺伝子の並びを変えてしまう確率が高くなり癌化する遺伝子が増えてしまうのでそれだけ癌細胞が増殖する勢いも増えてしまうのです。もう一つは癌細胞で増えすぎたherpesは隣接する膵臓の他の正常な細胞に感染すると同じ事が起こり続けることになってしまうのです。
何故白血球と言われる血球はどれ一つも白色をしていないのに紛らわしい白血球という名前が付けられたのでしょうか?一秒間に200万個も作られる赤色のヘモグロビンを持った赤血球と区別するためです。赤色の赤血球以外の骨髄の血液幹細胞から作られたマクロファージ、好中球、リンパ球などの赤くはない赤血球以外の他のすべての血球をまとめて白血球と言っただけなのです。しかし白血球にも役割の全く違った血球が採血による臨床血液検査では5種類に分けられます。①好中球②好酸球③好塩基球④単球⑤リンパ球の五つですが、④の単球と⑤のリンパ球の二つは血管の外に出ると④の単球はマクロファージや樹枝状細胞になどに分化してしまい⑤のリンパ球はTリンパ球やBリンパ球やNK細胞に分化してしまい機能が全く異なるのです。しかも臨床的には5種類の血球から分化した細胞になって免疫の仕事をするので臨床的には分化した細胞の方がはるかに臨床上重要なのです。
播種(はしゅ)もherpes感染癌細胞とherpesが飛び散っただけです。肺の入っている「胸腔」や腹部の臓器が入っている「腹腔」にがん細胞とherpesが漏れ出て、胸膜や腹膜に飛び散るようにして広がる状態が播種です。まるで小麦粉をばらまいたように飛び散った小さいヘルペス性癌細胞のherpesが増殖してがん細胞を破ってがんが免疫と戦って炎症を起こすことで膜に穴が開き、水(胸水・腹水)がたまることもあります。最初は少量ですが、がんが進行し漏れ出た体液である水分の量が多くなると、身体的に辛い症状がでることがあります。また完治を目指す治療が難しいことが多く、抗がん剤や排水など処置的治療にとどまるため水がたまり始めると治療としては非常に困難な状態ですと言われますが間違いです。苦痛の原因となっている胸水・腹水を除去してアルブミンを点滴し足り少なくなった電解質を補充して脱水症状があればて水分を補給すれば苦痛は簡単に減らせます。こんな手数がかかるだけで面倒なことはお金にならないのでやらないだけです。アメリカの金がすべてだの資本主義医療が日本の医療をも席巻するようになってしまったので日本人の特性であった細やかな患者に対する思いやりがなくなってしまったのは残念なことです。
播種性転移とは何でしょうか?播種性転移とは、種を蒔くようにがん細胞が散らばっていくことからつけられた名前です。 内臓と腹膜、胸膜の間に腹腔や胸膜という隙間があります。 この隙間に、近くに出来た臓器にあるがんが増殖して、その内面に種を蒔くように広がっていくのが播種性転移です。
播種しやすいがんの種類と治療法
胃がん・大腸がん・膵臓がん・卵巣がん・子宮体がんなどの消化器系のがんや腹部に位置する臓器のがんが比較的播種を起こしやすいと言われています。横隔膜より上で発生したがんは胸膜播種をして胸水がたまりやすいのです。横隔膜より下で発生したがんは腹膜播種しやすくて腹水がたまりやすいのです。もともと健康な人でも少量の水がありますが、がんが進行することで水分バランスが崩れコントロールできない状態となり胸水や腹水の量が増えていきますと言われていますが、水分バランスの問題ではなく実は癌細胞に猛烈に増えたherpesが感染した多数の感染癌細胞を破って外に出るときに細胞から水分が大量に出てしまうからです。胸水や腹水がたまるとさまざまな症状が出ます。例えば、胸水が多くなると肺がふくらむスペースが減り息苦しくなりますし、腹水がたまるとお腹が張る感じが強くなり胃や腸を圧迫するため食欲がおちてきます。
胸水や腹水が溜まっている際の現代行われている代表的な治療(処置)は以下の4種類になります。手術は腹膜を広範囲に切除する。腹膜の切除は技術的に高度で実施できる医師(病院)が限られているのみならず100%間違っています。しかも手術の後遺症で苦しむことになります。
抗がん剤を点滴で投入する。また、注射で直接投与することもあるようですが、100%間違いです。
胸水や腹水の排水は局所麻酔を行い、針をさしてバッグやボトルに排水する。水の中には栄養が含まれているので、水を抜いたあと栄養分だけ取り出して栄養を体に戻すこともある。
何回も繰り返しますが癌細胞とは特別な細胞でもないし人殺しの細胞でもないのです。癌細胞の原因は30億個の塩基から成り立っているゲノムの2%の6000万個から生まれた23500個の遺伝子の中のまず一つずつをherpesウイルスが突然変異を起こしてしまうと40兆個の細胞の一個の癌細胞が生まれます。しかし他の遺伝子に突然変異が起きても絶対にがん細胞が生まれることはないのです。二つのがん関連遺伝子の一つを癌原遺伝子と言い突然変異した癌原遺伝子を癌遺伝子と言います。つまり癌遺伝子とは本来の機能とは違った機能を持つことで発癌につながる遺伝子になってしまうのです。
一方、二つ目の関連遺伝子をがん抑制遺伝子と呼びます。この癌抑制遺伝子がherpesが突然変異させられると癌を増えないように抑制する遺伝子の機能が失われてしまい二つとも突然変異を起こしてしまうと一個のがん細胞が生まれてしまうだけの話なのです。
この二つのがん関連遺伝子はどちらも突然変異の無い状態では正常に機能して生命活動の一端を担っているのです。従ってがん細胞とは何かを簡単に定義すると「ふたつのがん関連遺伝子がたまたまherpesウイルスによって偶然突然変異を起こされた結果生まれた細胞」と言えます。このように偶然に一個の細胞が癌細胞になって他の細胞よりも分裂スピードが速くなっても増え続けても癌細胞に感染しているherpesの増殖が癌細胞の増殖に拍車をかけていることを考慮する必要がなければ対して問題にならないのです。何故ならば現代の医学は正常な一個の細胞が突然変異を起こすのはherpesであることを、一顧だにもしないでいろいろの突然変異を起こす原因を論っているのですがこれらの例えば煙草にしろ活性酸素にしろ具体的にかつ直接的にどのように二つのがん関連遺伝子が変異させるのかについては一切触れてはいないだけでなくがん細胞の増殖についても想像の域を出ていないのです。つまりいかなる癌細胞でも100%正常な細胞の遺伝子が癌化する必要があるのですが一個の癌細胞にしろ新しい多数のがん細胞にしろ二つのがん関連遺伝子が癌になるべく変異する必要があるのですがその根本の遺伝子の変異は単純にがん細胞が増えたからで終わっているのは極めて非論理的であることを証明するためにherpesを一切考慮しない現代医療の「がん細胞の増殖」の考え方を批判的に勉強していきましょう。ついでに間違った二つの発癌説も説明しておきましょう。多段階発癌説と二階発癌説の二つです。二つとも想像の域を出ていない間違った仮説です。
多段階発癌説とは何でしょうか?この説は間違いです。
細胞内で複数の遺伝子異常が蓄積するにしたがい,癌化ならびに悪性度が増していくとする説です。癌が生じるのは二つの癌関連遺伝子が突然変異を起こすと癌細胞になるだけの話です。勿論、二種類の癌関連遺伝子は合わせて480個もあるので二種類の癌関連遺伝子が癌化すればするほど癌の悪性度や癌の進行度は飛躍的に増加するのは言うまでもないことです。膵癌では480個もあるので二種類の癌関連遺伝子の中でKRAS,CDKN2A,TP53,SMAD4の順に遺伝子異常が起こるとされ,それにともない前癌病変である膵管内腫瘍の異型度が 増し,最終的に浸潤癌に至ると考えられているようですが。
異型度(atypia)とは何でしょうか?細胞診によって決められます。異型度(atypia)とは,ある一つの細胞の形が正常な細胞とどのくらい異なっているかを示す度合いのことです。正常であれば同じような形の細胞が整然と並んでいますが、がん細胞やその前の段階の細胞は形がゆがんでいたり、細胞内の核が大きくなっていたりします。このような細胞の「顔つき」の違いを異型度と呼び、がん細胞の悪性度の目安とされています。一般に腫瘍の悪性度である増えやすさ、広がりやすさも決められています。しかし異型度にしろ悪性度にしろ癌の本質ではなく癌を見た眼で評価しているだけです。
分化度(differentiation)とは何でしょうか?組織診によって決められます。細胞に異型が見られる癌細胞が、細胞の塊である組織にも異形が現れます。生検を行って組織を取り出し染色して組織の異型の度合いである「分化度」を調べるのが組織診です。本来の正常な細胞の形態をどれくらい維持しているかを「分化度」といい、「未分化」「低分化」「高分化」などと表現します。何故同じ癌細胞であるはずなのに「未分化」「低分化」「高分化」という本来の正常な細胞の形態からずれる度合いが異なるのは何故なのでしょうか?答えは細胞周期(細胞分裂期)は4段階ありますからその段階のどの時期に遺伝子が突然変異を起こしてがんになったかの違いが「未分化」「低分化」「高分化」の違いを生み出すのです。同時に異型度(atypia)とは,ある細胞の形が正常な細胞とどのくらい異なっているかを示す度合いのことですから異型度(atypia)と分化度の違いは一つの細胞と一つの組織の塊との異型をそれぞれ決める違いなのです。
正常な細胞分化(differentiation)と癌細胞の分化(differentiation)とは何が違うのでしょうか?癌の分化度(differation)の違いはなぜ起こるのでしょうか?
正常な細胞分化(differentiation)とは細胞が成熟するために変化して特殊な形や機能を持つようになることです。筋肉や神経は分化した細胞の代表です。分化が始まるときには文化を誘導する遺伝子が発現します。この筋肉や神経が分化するときにherpes遺伝子を変えてしまうと軟部肉腫は軟部組織(筋肉、脂肪、神経など)と言われるところから軟部肉腫といわれる悪性腫瘍が発生するのです。分化が軟部肉腫を作ってしまうと正常な細胞の分化は停止してしまい悪性腫瘍に分化し終わってしまうとがん細胞の増殖の遺伝子が発現し正常な細胞に戻ることはできないのです。つまり「分化」と「増殖」とは完全に排他的な関係にあるのです。従って「分化」の途上のどのレベルで癌の遺伝子が発現されるかで「未分化」「低分化」「高分化」の癌の違いが生み出されるのです。
細胞診とは何でしょうか?細胞採取の検査は尿や喀痰や粘膜などの細胞を採取して腫瘍の細胞が悪性かどうかを判定します。簡単で安価でありますが尿や腹水を採取してもその中に必ず癌細胞があるとは限らないのです。がんの疑いがあるかのふるい分けのスクリーニングとして有用です。がんの確定診断をするには細胞診は不十分です。
組織診とは何でしょうか?癌の確定診断をするにはがんの疑いのある組織を採取してその組織の状態から癌を診断する組織診が必要なのです。組織の採取法は癌の患部と思われる部分から生体組織を「生検」で採取して行われるので「癌であるかどうか」という正確な診断のみならずがん細胞の組織型や分化度などの情報も得られます。組織型とは「腺癌」や「扁平上皮癌」などのがんのタイプであり化学療法や放射線などに反応しやすさも判定可能となります。
悪性か良性かは病理検査で可能でしょうか?
生検や手術によって採取されたで糸くずから親指大の大きさの組織を病理検査で顕微鏡で観察して悪性か良性かを診断します。病理検査において、いちばん大切なことは腫瘍が良性か悪性かの判断で、もし悪性であればその組織型の種類や悪性度も併せて判定します。したがって、病理検査は患者さんの病気の最終診断である確定診断となり、主治医はこの病理診断をもとに、さらに治療を行うのか、経過を観察するのかを決定します。良性と悪性の判断が間違うと患者さんは大きな不利益を被ることとなりますので、病理検査においてもっとも重要な検査の目的は悪性か良性かを確定することです。実は悪性か良性かを決定できる100%確実な検査があります。それは四つの癌関連遺伝子が突然変異をしているかどうかの遺伝子検査です。いずれ近いうちに可能になるでしょう。その時はや組織検査、細胞検査や他の画像検査や内視鏡検査などは必要がなくなるでしょう。
腫瘍の悪性度とは何でしょうか?悪性度とは、がんが増殖したり広がったりする速さ(侵攻性と呼ばれます)の尺度です。悪性度とは、がんが増殖したり広がったりする速さの尺度ですが癌の増殖の速さは何が決めるのでしょうか?がんの悪性度は、医師が予後(経過の見通し)を判定するのに役立ちます。悪性度は、生検で採取した組織サンプルを調べることで判定されます。悪性度は、顕微鏡検査でがん細胞の見た目が異常に見える度合いに基づきます。細胞の見た目が異常なほど侵攻性が高くなります。多くのがんについて、悪性度の評価尺度がつくられています。
腫瘍の悪性度とは何故生まれるのでしょうか?癌を作ったherpesが二つのがん関連遺伝子を突然変異させると必ず一個のがん細胞が生まれます。この時が癌の悪性度が一番低いのです。悪性度は、がんが増殖したり広がったりする速さで決まるので、増殖したり広がったりする癌細胞の多少で決まります。herpesが二つのがん関連遺伝子を突然変異させる数が多ければ多いほど増殖性と癌細胞が広まり癌が周囲に広がる侵攻性や浸潤性が高まります。しかもがん関連遺伝子は最近の研究では460遺伝子も存在しているのです。更にびっくり仰天したのは遺伝子が癌化するのは二つの癌遺伝子とがん抑制遺伝子だけではなく三つ目に癌遺伝子とがん抑制遺伝子を併せ持った両方の性質を持っている遺伝子も見つかり4つ目には上に挙げた三つのいずれにも分類できない細胞を癌化させる遺伝子が見つかっているのです。これも何も不思議なことではなく30億対の塩基の並びを細胞に組み入れられたherpesゲノムが変えてしまえば細胞の遺伝子が突然変異させられて癌遺伝子に変えることはできるので何も不思議ではないどころか当然なことなのです。
従って460遺伝子もあるがん関連遺伝子がherpesによって癌遺伝子に変えられる数が多ければ多いほど増殖の勢いが高まり癌の悪性度が増えるのも説明する必要はないでしょう。癌細胞の最大にして唯一の特色は「増殖」だけです。「増殖」の遺伝子エンジンをふかしているのは「herpes」なのに世界中に医学者の誰も気が付いていないのです。
「資本主義の悪の増殖のエンジン」はすべての欲望を満たす「お金」ですから「herpes」と「金」とは全く共通の性質を持っているのです。「人間の命」よりも「お金」が一番大事な資本主義によって人類の命はherpesと間違った金儲け医療の二つの敵によって徐々に徐々に最後は癌で殺されていくのです。しかし金で満たせない例外的な欲が一つだけあります。病気を治すことです。いくら大金を積んでも病気は絶対に治せません。それどころか病気を作る医者の治療は高価な治療をすればするほど棺桶が近くになるだけです。
本来の正常な細胞は高分化して初めて成熟した細胞になるわけですから高分化した癌細胞ほど正常な細胞に近いわけです。逆に「未分化」な癌細胞ほど正常な細胞になっていない癌細胞ですからこれからどんな細胞になるかわからない癌細胞なのです。分化度の低いがん細胞は、悪性度が高く活発に増殖します。病理検査でがん細胞の分化度を調べることで、悪性度の評価や治療効果の予測などを行います。この「分化度」の説明は何故分化度の低いがん細胞は、悪性度が高く活発に増殖する傾向がある根拠は説明がありません。癌の分化度を決定するのは正常な細胞の分化が終わるまでのどの段階で460個の癌関連遺伝子が発現されて癌の増殖が始まるかによって決まるのです。
がんの「顔つき」とは、専門家がしばしば使う言葉であり、細胞の分化度のことです。
顕微鏡でがんを見る病理の専門家はよく、「このがんは顔つきがいい」とか「顔つきが悪い」などといいます。「分化」とは細胞が決められた役割を果たせるように成長していく過程のことです。がん細胞は正常な役割を果たすために「分化」する前の細胞から発生しますが、元の役割を果たす細胞に近い形まで成長したがんを高分化がん、元の役割を果たす細胞の形がほとんど見られない未熟ながんを低分化がん、元の役割を果たす細胞がどんな細胞か判別できないものを未分化がん、といいます。未熟ながん、分化度が低いがんほど増殖の余力を残しているので悪性である度合いは高くなります。それに対し、正常な役割を果たす細胞に近いところまで成長した高分化がんは、比較的、顔つきのおとなしいがんということになるわけです。
脾臓には転移癌がリンパ節転移と比較して圧倒的に少ないのは何故でしょうか?
何故二次リンパ器官であるリンパ節には癌のリンパ節転移は全ての癌で見られるのになぜ脾臓には癌の転移は少ないのは何故でしょうか?脾臓の腫瘍はまれですが、悪性腫瘍として悪性リンパ腫、血管肉腫などが、良性腫瘍として血管腫、リンパ管腫、過誤腫などがみられます。 ほかの臓器のがんから脾臓への転移は起こりにくいといわれていますが、卵巣がん、結腸がん、肺がんからの転移がみられることがあります。治療としては、原疾患の治療をおこなったうえで、脾臓の摘出を考慮されます。
脾臓は悪性リンパ腫や白血病などの血液悪性疾患を除けば,悪性腫瘍の転移が少ない臓器とされている.その理由として1)脾臓はリンパ経路の発達が乏しく輸入リンパ管が少ないこと,2)脾臓は律動的に収縮しており,このため腫瘍細胞が締め出されること,3)網内系組織であるため,腫瘍細胞が生着しにくい環境であることが挙げられる.また癌の末期像として全身性転移の一部として見られることはあるが,孤立性の脾転移はまれであり,Lam らの報告では 12,399 例の剖検例中,脾転移は 92例(0.7%)で,その中で孤立性脾転移はわずか 4 例(0.03%)とされている.脾転移を来す悪性腫瘍としては乳癌,肺癌,大腸癌,卵巣癌,胃癌の順に多い.脾臓への転移経路としては1)脾動脈2)脾静脈(逆行性)3)リンパ管の3つが考えられている.脾転移は主に血行性に生ずると言われています。
悪性腫瘍の脾臓転移は癌の末期像として全身性転移の一部として見られることが多く,孤立性の脾転移はまれである。特に固形癌の脾臓転移は比較的少数であり,中でも肺癌はまれである.脾臓転移が比較的少数であり稀であることの原因として①脾臓類洞内では血流が一定の速度で流れているため血行性転移に必要とされる脾臓への癌細胞の付着が困難となっている可能性と②脾臓内の体液性免疫により多臓器と比較して癌細胞が破壊されやすく転移が困難となっている可能性を指摘されていますが本当でしょうか?さらになぜ固形癌の中でも肺癌が少数であるのかは不明であるとされているのですが何故かをいずれ解明しましょう。 後述します。
がん免疫チェックポイント阻害薬であるオプジーボは、PD-1を標的とした抗体医薬ですが、進行がんの治療において、がん免疫療法、特に免疫チェックポイント阻害薬による治療は、肺がん、悪性黒色腫、腎臓がんをはじめ、様々ながんにおいて重要な役割を果たすようになり、肺がんなどの一部の進行がんの治療においては、第1選択薬となってきています。このPD-1分子のように、免疫系を抑制する分子や、類似の機能を有する分子等を総称して免疫チェックポイント分子と呼び、免疫チェックポイント阻害機構を阻害する抗体医薬が、多数開発されています。これまでに臨床での使用が承認された免疫チェックポイント阻害薬である、現在臨床応用されている癌免疫チェックポイント阻害薬は、オプジーボを代表とするPD-1と並びにキイトルーダを代表とするPD-L1を標的とした抗体医薬です。免疫チェックポイント阻害薬には二種類あり抗PD-1抗体薬と抗PD-L1抗体薬です。オプジーボについてはここを読んでください。
免疫チェックポイント阻害薬とは、がん細胞を攻撃するT細胞の働きにブレーキをかけている蛋白質であるPD-1とPD-L1の結合を阻止することで、PD-L1により抑えられていたT細胞の働きを活性化することで抗腫瘍効果を発揮させる薬である。免疫チェックポイン阻害薬は、他に抗CTLA-4抗体等が存在しています。抗CTLA-4抗体については後述します。
がん細胞に対するキラーT細胞の攻撃が抑制されるその作用機序はがん細胞の表面に発現するPD-L1がT細胞の表面に発現するPD-1受容体に結合するからであり、免疫チェックポイント阻害薬はこの結合を阻止することでキラーT細胞の攻撃力を復活させるのです。
PD-L1がPD-1に結合することを阻止する免疫チェックポイント阻害薬は2種類ある。1つはPD-1を標的とし、PD-L1の代わりにPD-1と結合する抗PD-1抗体薬。もう1つはPD-L1を標的とし、PD-1の代わりにPD-L1と結合する抗PD-L1抗体薬である。オプジーボはPD-1に結合することを阻止する免疫チェックポイント阻害薬です。
チェックポイントとは何でしょうか?免疫チェックポイントとは何でしょうか?チェックポイントが良く使われるのは細胞周期においてです。細胞周期とは細胞が分裂増速するときに一個の細胞が二個の細胞になるまでのG1期→S期→G2期→M期の四つの順序だった一連の出来事が細胞周期一回分になります。ところが例えばその途中で遺伝子のDNAが傷ついているのにかまわずに遺伝子の複製や細胞の分裂が始まると出来上がった細胞は異常な細胞になるのでこのような異変に対して細胞周期のG1期→S期→G2期→M期の四つの進行を一時的に止める仕組みがチェックポイントであり「進行阻止」と訳すのです。
つまりチェックポイントとは細胞に働きの進行を止める検問所なのです。がん細胞は免疫系からの攻撃を回避するために、制御性T細胞(Regulatory T cell:Treg)や骨髄由来抑制細胞(Myeloid-derived suppressor cell:MDSC)のほかに、免疫チェックポイント分子による免疫抑制機能も積極的に活用し、免疫逃避しています。ここでは免疫チェックポイント分子について詳しくみていきます。
免疫チェックポイント分子とは何でしょうか?
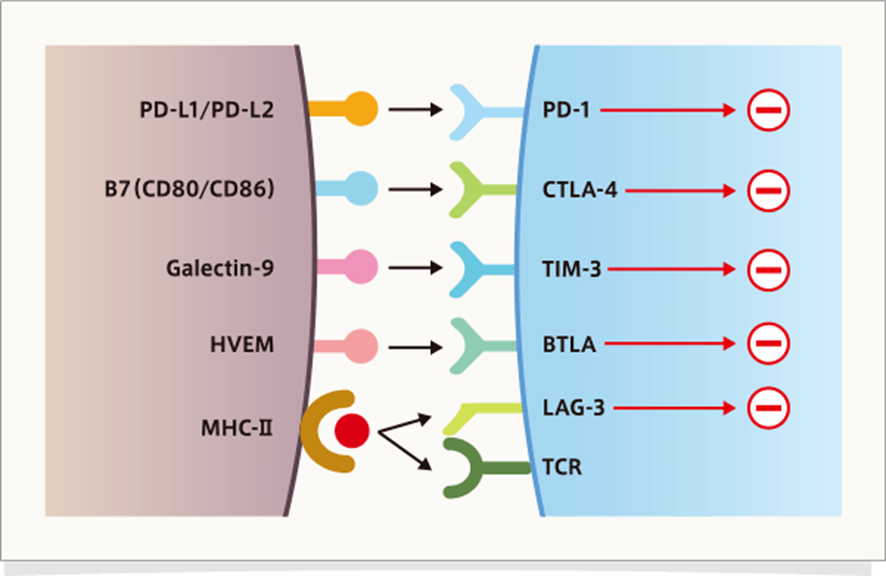
免疫チェックポイント分子は、免疫恒常性を保つために自己に対する免疫応答を抑制するとともに、過剰な免疫反応を抑制する分子群です。本来、T細胞の過剰な活性化を抑制するとともに、自己を攻撃しないために存在していますが、発がん過程では、がん細胞が免疫系からの攻撃を回避し増殖するために利用されます。現在、さまざまな免疫チェックポイント分子とそのリガンドが同定されていますが(下図)、ここでは特にCTLA-4とPD-1について解説します。
CTLA-4(Cytotoxic T-lymphocyte associated antigen-4)
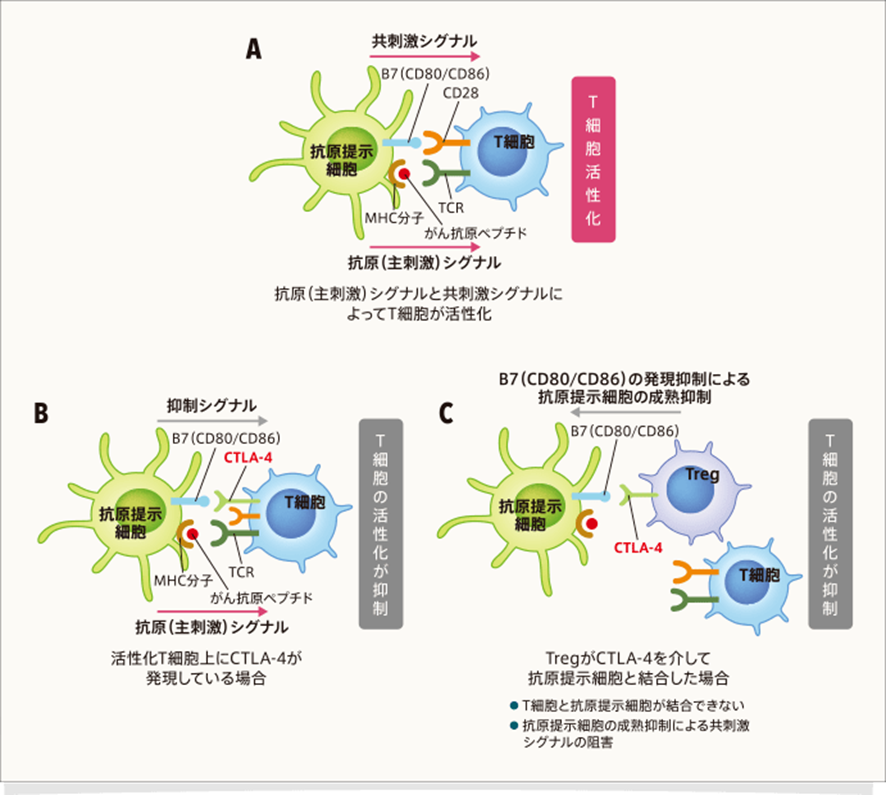
CTLA-4はT細胞を抑制する免疫チェックポイント分子として機能しています。定常状態のT細胞には発現しておらず、T細胞の活性化に伴い発現が誘導されます。また、免疫抑制機能を有するTreg上には恒常的に発現しています。
T細胞は、T細胞受容体(T-cell receptor:TCR)を介したがん抗原認識による抗原(主刺激)シグナルと、共刺激分子であるCD28と抗原提示細胞上のB7(CD80/CD86)の結合による共刺激シグナルによって活性化します(下図A)。しかしCTLA-4は、CD28のリガンドであるB7(CD80/CD86)に対してCD28よりも高い親和性を有するために、T細胞にCTLA-4が多く発現している状態ではB7(CD80/CD86)が占有され、CD28はB7(CD80/CD86)と結合できず、T細胞活性化が抑制されます(下図B)。また、TregはCTLA-4を介してB7(CD80/CD86)の発現を抑制し、抗原提示細胞の成熟を抑制するため、共刺激シグナルが阻害され、T細胞の活性化が抑制されます(下図C)。
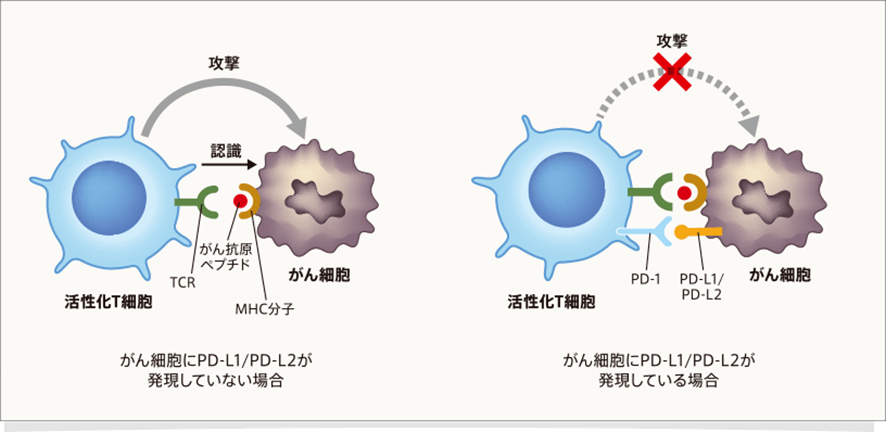
PD-1(Programmed-cell death-1/CD279)とは何でしょうか?PD-1は活性化T細胞に発現する免疫チェックポイント分子であり、代表的なリガンドはPD-L1、PD-L2です。T細胞上のPD-1がPD-L1やPD-L2と結合すると、T細胞は活性化が抑制され機能不全に陥り、抗腫瘍免疫応答が抑制されます。
PD-L1は、抗原提示細胞やがん細胞(肺がん、大腸がん、悪性黒色腫など)で発現がみられます。がん細胞自身の遺伝子異常に由来して発現が誘導、上昇している場合と、活性化T細胞が放出する炎症性サイトカインのIFN-γによってがん細胞上に発現が誘導される場合があります。PD-L2は活性化した抗原提示細胞やマクロファージのほか、がん細胞においても発現が認められています。
がん細胞は、自身に発現したPD-L1/PD-L2を、がん組織に集まってきたT細胞のPD-1と結合させることで免疫逃避していると考えられます。
CTLA-4はがん免疫応答のしくみ(Cancer-Immunity Cycle)のなかで、T細胞の活性化(プライミング相、下図STEP③)の部分でがん免疫応答にブレーキをかけています。PD-1やPD-L1/PD-L2は、がん細胞への攻撃(エフェクター相、下図STEP⑦)の部分でがん免疫応答にブレーキをかけているほか、T細胞の活性化(プライミング相、下図STEP③)の部分でも免疫応答を阻害していると考えられます。
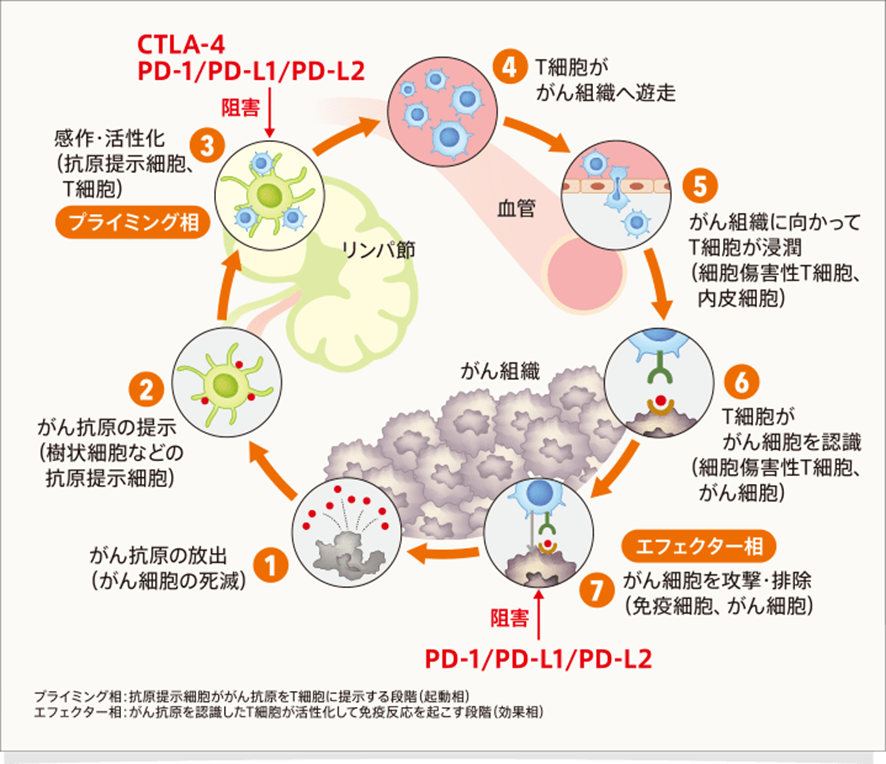
これら抗PD-1抗体薬、抗PD-L1抗体薬をまとめて免疫チェックポイント阻害薬と呼ぶ。世界で初めて発売された免疫チェックポイント阻害薬は、日本の製薬会社である小野薬品工業が2014年発売したニボルマブ(商品名オプジーボ)であるが、以降他の免疫チェックポイント阻害薬が次々と開発され、現在までに5つの免疫チェックポイント阻害薬が世の中に存在している。
ところが抗PD-1抗体や抗PD-L1抗体は、数割程度の患者さんにおいて、長期にわたり腫瘍増殖を抑制する効果が認められても、やがて耐性を獲得し腫瘍が再増悪して副作用として死者が出るという臨床例が報告され問題となっています。以前からオプジーボの副作用について詳しく書いています。何故とんでもないオプジーボの副作用が以前から出ていたのは何故でしょうか?癌の原因は細胞に感染したherpesが二つのがん遺伝子を突然変異させたことは皆さんよくご存じですよね。
これまでに、抗PD-1抗体(オプジーボ)に対する耐性機構としては、細胞障害性T細胞が腫瘍細胞を異物として認識するために必須の抗原提示がされなくなるといったメカニズムなどが相次いで報告されていますが、抗PD-L1抗体に対する耐性機構はほとんど明らかになっていませんでした。PD-L1は様々な腫瘍において高発現しているだけでなく、マクロファージや樹状細胞などの抗原提示細胞や、心臓内の内皮細胞など、多種類の細胞に発現しています。一方その結合相手であるPD-1は主に細胞障害性T細胞などの免疫細胞に発現しています。PD-L1は,樹状細胞,リンパ球,マクロファージ,肥満細胞等,抗原提示細胞を中心とした多くの免疫系細胞にも発現が認められ,サイトカイン等の刺激により発現量が増加する.
このようにPD-L1は,樹状細胞,リンパ球,マクロファージ,肥満細胞等,抗原提示細胞を中心とした多くの免疫系細胞にも発現が見られるのは何故でしょうか?herpesはあらゆる細胞に感染するのみならずherpesを殺すべき免疫系の細胞にも感染できます。ところがherpesという病原体のウイルスを見つけ出して活性化されるとherpesに騙されてherpes感染細胞を殺そうとするのですが殺しても殺し切ることができないので樹状細胞,リンパ球,マクロファージ,肥満細胞等,抗原提示細胞にPD-L1が発現してしまうと、詳細は後述します。
PD-L2の発現は樹状細胞,マクロファージ,肥満細胞等に認められ,やはりサイトカイン等の刺激により発現量が増加する.PD-L1の発現は,免疫系細胞に加え,心臓,肺,肝臓,胎盤,角膜等の末梢実質臓器にも認められ,やはりサイトカイン等の刺激により発現量が増加する.胎盤や角膜は,免疫応答が制限されておりimmune-privilege(免疫特権)を有すると考えられているが,免疫系からの隔絶にPD-L1が関与している可能性が示唆されている.一方,末梢実質臓器におけるPD-L2の発現は限定的である.また,一部のがん細胞株やヒトがん組織,ウイルス感染細胞において,PD-L1およびPD-L2の発現が認められる.B7の発現が主に抗原提示細胞に限局していることから,PD-1とCTLA-4は空間的に使い分けられているのです。
腫瘍細胞等のPD-L1が細胞障害性T細胞上のPD-1に結合すると、T細胞の活性が抑制されます。このようなメカニズムにより、腫瘍は細胞障害性T細胞により異物として認識されても、T細胞を抑制することで免疫監視機構から逃れて増殖しています。このPD-1分子のように、免疫系を抑制する分子や、類似の機能を有する分子等を総称して免疫チェックポイント分子と呼び、免疫チェックポイント阻害機構を阻害する抗体医薬が、多数開発されています。これまでに臨床での使用が承認された免疫チェックポイント阻害薬である、抗PD-1抗体や抗PD-L1抗体は、数割程度の患者さんにおいて、長期にわたり腫瘍増殖を抑制する効果が認められても、やがて耐性を獲得し腫瘍が再増悪してしまう臨床例が報告され問題となっています。これまでに、抗PD-1抗体に対する耐性機構としては、細胞障害性T細胞が腫瘍細胞を異物として認識するために必須の抗原提示がされなくなるといったメカニズムなどが相次いで報告されていますが、抗PD-L1抗体に対する耐性機構はほとんど明らかになっていませんでした。
何故キラーT細胞はherpesが感染した細胞を癌化した癌細胞を殺せないのか?詳細は後述します。
二階発癌説とは何でしょうか?この説も間違いです。
発がん過程では、イニシエーターとよばれるDNA損傷作用を有する物質と、プロモーターとよばれるイニシエーターの作用を促進させる物質が作用します。それぞれ単独では、腫瘍が形成されませんが、イニシエーターの後にプロモーターが加わることで腫瘍が形成され、このことを発がんの二段階説と言われています。
がん細胞の増殖はどのようにして行われるか?
たった1個のがん細胞は10年から20年あるいはそれ以上の長い年月をかけて何段階にも変化して1個のがん細胞は30回の分裂で10億個のがん細胞が含まれ、約1cm、1gの塊(がん巣)になります。さらに40回の分裂で約10cmの塊で1㎏の大きさに成長します。
この何段階もの変化がどのようにして生じるかの説明がありません。つまり時間とともに比例直線的に変化しないのは何故なのかの説明がまずありません。herpesを絡ませるとherpesが増殖できるのは核の中でありしかも癌細胞が分裂するときにしか細胞の遺伝子やDNAやRNAや細胞の酵素などを利用できないからです。しかも細胞が分裂して生まれた二つの新しい癌細胞に同時に分裂して大量に生まれてherpesが分配されてしまい分配されたherpesのゲノムが複数個も癌細胞の遺伝子のゲノムに組み込まれてさらに多くの二つのがん関連遺伝子を変異させる可能性が増えて行くのです。そして150種もある癌原遺伝子が癌遺伝子になってしまうと癌の増殖スピードがますます増えて行くのです。同じようにがん抑制遺伝子も癌細胞のゲノムに増えたherpesのゲノムが組み込まれてがん抑制遺伝子も変異してしまって癌を抑制する機能がなくなりさらに癌細胞の悪性の度合いが弥増しに増えて行く可能性を増やしてしまうのです。因みに悪性のがんとは転移、遠隔転移をおこすがんです。
しかしいくら小さな固形がんでも発見されたときには転移するかどうかは今でもわかっていません。
手術後摘発した組織を病理検査しても転移するかしないかはわりません。
1個のがん細胞から分裂がはじまって30回目あたりでまでの増殖過程は最新の画像診断機器を使っても人間の目はまだ異常としてとらえることはできません。
1個のがん細胞の大きさは約10ミクロン(1ミリの百分の1)大きさが1mmのガン細胞の塊は約1,000万個です。早期発見といわれている1cm位の大きさでは、10cmの塊に増殖すると仮定して4分の3を経過した状態でしか早期発見は出来ないのが現状です。
40回分裂して1㎏の大きさですから、分裂が30回目以降でないと発見できないのです。このことは、早期であっても細胞レベルでは30回目以降の分裂ですからはたしてその時点で本当に早期と言えるのか疑問に思えますが。
がん細胞の分裂のスビートは必ずしも一様ではなく、がん細胞の分裂は最初のうちは早く途中からスビードダウン(常に倍々に増えるわけでは決してないのですが)することも知られています。
どの臓器でも、大きさが部位にもよりますが3cm以上なりますと、一概に言えませんが年齢、性別に関係なく自覚症状も出てきますし、生命に危険を脅かします。当然ですがそれ以前の段階でもがんは全身のあらゆる臓器、組織に発生するので、それぞれの機能や局所の変化として個々に症状をあらわします。
すでに遠隔転移、多発転移している場合もあります。しかしそこまでがん細胞が大きくなるには、がん細胞が分裂をかさねていくあいだには、死滅するがん細胞もありますが1個のがん細胞が単純に2分裂を40回分裂くりかえすだけで10センチ程度になります。
今の医学は早期と呼ばれるがんが進行してその延長線上に進行がんがあると普通考えますが、しかし早期がん(5mm以下の超早期がんなど)はいつまでたっても早期がんで、手術で切除、摘出しなくても、そのままの状態かまたは、そのうち自然に無くなっていくという考えも根強く残っています。このことは、身体の抑制遺伝子によってがん細胞の増殖を抑えていると考えることも出来ます。しかも早期がんの決定的な定義は何もないのが現状です。
再発とは何でしょうか?転移と播種、再発との関係は何でしょうか? 「再発」とは、治療がうまくいったように見えても、手術で取りきれていなかった目に見えない小さながんが残っていて再び現れたり、薬物療法(抗がん剤治療)や放射線治療でいったん縮小したがんが再び大きくなったり、別の場所に同じがんが出現することをいいます。治療した場所の近くで再発を指摘されるだけでなく、別の場所で「転移」としてがんが見つかることも含めて再発といいます。血液やリンパのがん、前立腺がんなどの場合には、「再燃」という言葉が使われます。
初回の治療でがんが完全に取り除かれていれば、もちろん再発することはありません。けれども実際には、がんが発見されたときすでに、その癌の多くに目に見える転移、あるいは目に見えない転移(微小転移)があるといわれています。そのため初回の治療では、再発や転移を防ぐ目的で抗がん剤が使われることが多くあります。再発というのは、決してまれなことではないのです。
「転移」とは、がん細胞が最初に発生した場所から、血管やリンパ管に入り込み、血液やリンパ液の流れに乗って別の臓器や器官へ移動し、そこで増えることをいいます。多いのは、リンパ液の流れが集まるリンパ節への転移(リンパ行性転移)、肺や肝臓、脳、骨など血液の流れが豊富な場所への転移(血行性転移)です。「播種」とは、がんのできた臓器からがん細胞がはがれ落ち、近接する体内の空間である胸腔や腹腔に散らばるように広がることをいいます。転移は、肺、肝臓、脳、骨などさまざまな部位に起こり得ます。原発から転移したがん病変を、転移した部位によって、肺転移、肝転移、脳転移、骨転移、腹膜転移(腹膜播種)などと呼びます。これらは、癌細胞がその部分に広がっていることを示しています。
最初にできたがんの部位は「原発巣」と呼ばれます。例えば、大腸に初めにがんができ、肺に転移した状態は肺がんとは呼ばれず、「大腸がんの肺転移(原発は大腸がんで、肺転移を起こした状態)」です。この場合、肺にできたがんは、大腸がんの細胞と同じ性質を持っています。つまり、「転移」した部分のがんは、もともとのがんと同じ性質を持つことになります。そのため、例えば大腸が「原発」のがんであれば、肺に転移した腫瘍も、大腸がんに効果がある抗がん剤でないと反応しません。初めてがんと診断された場合でも、病気が進んだ状態で発見されると、診断がついた時点でこれらの状態のいくつかを併せ持っていることもあります。「原発」がどこか、その腫瘍が「転移」か「原発」か、再発した部位はどこかなどが、がん治療の方針を決める重要な情報になります。
がんが再発した場合、その成り立ちと部位によって①「局所再発」②「領域再発」③「遠隔(全身)再発」の三つに分かれます。またこれによって治療法も異なります。①局所再発:最初のがんと同じ場所あるいはごく近くに現れます。②領域再発:腫瘍が最初のがん発生場所の近くのリンパ節または組織で成長したときに現れます。③遠隔(全身)再発:最初のがんの発生場所から離れている器官または組織に転移しています。
具体的な癌の症例を見ながら癌とは何かを勉強しましょう。
病院の先生に手術は無理だと言われた患者が「がんの診断を受けましたが、先生が手術をしてくれないんです。親戚の時は手術して治ったのに。」この患者は手術して退院して家に戻れたら癌は治ったと思い込んでいる無知な人です。この方は肺がんの診断を受け、同時に肝臓転移が見つかったということでした。肝臓は血管が豊富ですから肺で発生したがんが外へ飛び出し、血管やリンパ管に入り肝臓にたどり着くところまで進行しています。いずれにしても癌は手術で治るものではありません。手術には、肉眼あるいは画像検査で”ここにがんがある”と特定できる状態であるという条件がありますが、実は血管やリンパ管の中に入ったがんはどこに運ばれていったか特定できない転移がんの患者の体内は全身のあらゆる場所に見えないがんが潜んでいる状態です。ヘルペス性転移癌はあらゆる細胞にherpesが感染しまくるからです。herpes自身は単独であらゆる細胞に感染できるのですが癌細胞になってしまうと原発巣で正常な一個の細胞の二つのがん関連遺伝子をherpesが突然変異を起こして癌細胞にしてしまうと癌細胞が積み重なるように増えて行きますから原発巣からはがれやすくなり、はがれた癌細胞は播種やリンパや血流を介して好き放題に転移してしまうので全身病になってしまいます。このように全身病であることを考えれば肺と肝臓のがんを切除しただけでは不十分だということが理解されない患者が多すぎます。つまり手術しても見えない転移巣は取り切れないのです。しかも切除した癌の部分はherpesが一番増殖した部分のherpes感染巣ですから確かに手術はherpesを除去したので原因療法になるかもしれませんね。アッハッハッハ!!!!たとえherpes感染巣の癌の一部が消えても癌を生み出す癌になっていないherpes感染細胞はいくらでも存在しているうえに見えない取り切れなかったherpes感染癌細胞のherpesが増殖して既に癌に変えてしまった癌細胞の正常ながん関連遺伝子がさらにもっと癌化しないようにかつ新たなる正常細胞を癌に変異させないように免疫を抑えない、ストレスにかかりにくい心の在り方を実践してかつ抗herpes剤を飲んでかつ免疫を上げる漢方洗剤を飲めばherpesは潜伏感染したままで終わることになるでしょう。
現代のがん専門の外科医も癌の原因はヘルペスであることを理解していないので現代の手術、放射線、抗がん剤の三大医療は癌の原因治療ではないので副作用が多すぎる「癌の無駄な対処治療」にすぎないのでがんで死ぬ患者が増えるだけです。
仮に見えているがんを手術でとったとしても血管とリンパ管から転移した見えない転移がんに対しては無治療ですよね。それらが今後、まるでもぐら叩きのようにボコボコと大きくなっていくのです。このような状態だと、主治医からは手術、放射線、抗がん剤の免疫抑制の三大医療を強く勧められても、それらは治癒を目指した根本的な癌を治す治療ではなく、辛い症状の改善や延命を目的とした処置です。
ところが延命治療ほど非科学的な治療はないのです。何故ならば延命という言葉は「命を延ばす」という意味の偽善性は「逆に治療しなければ命は伸びないという証拠なのか」を現代の医療は明示していません。さらに伸びるという限りは比較すべき他の治療と比べて「延ばせる」ことを実証する必要がありますが彼らは一切していません。大きな疑問です。
がんが進行した場合の治療法として選択されている抗がん剤治療ですが、一口に抗がん剤といっても昨今は様々な種類の治療薬剤が誕生していますが絶対に治すことはできません。分子標的薬や免疫チェックポイント阻害剤のオプジーボといった言葉を聞いたことがある方も多いでしょう。オプジーボなどはがん細胞を殺しているのではなくヘルペス感染細胞のherpesを殺すついでに癌細胞も死んだだけなのですよ。だから癌になっていないherpes感染細胞を癌ではないのに不必要に殺してしまったので重篤な副作用が1500以上も出たのです。オポジーボはここを読んでください。
現代の癌治療は癌を退治絶滅させているのではなく「がん治療」と称して免役を抑えてherpesを増やし過ぎて全身の人体内の痛みを感じるポリモーダル自由神経終末にherpesが感染して最後の断末魔はherpes性疼痛で苦しみモルヒネを打たれて現在のお金儲けの医療で殺されていくだけなのです。
現代の癌治療で人が殺されていくメカニズムを説明しましょう。同じことを何度も繰り返し説明しているように金がないので思い道理にならない資本主義の不平等な能力の過当競争を強いられて心で密かに耐えるストレスをかけて免疫を落として長い時間かけてherpesが増えたためにあらゆる病気はherpesによって生まれてしまうのです。しかもあらゆる治療はストレス免疫を抑える根本原因には一切目をつむり治療はすべて免疫を抑えてherpesを増やすだけですからすべて廃止すべきです。癌の病巣を摘除するのもヘルペスが感染して癌になった癌部位をとるだけですからherpesをすべて人体から除去できるわけはないので患者にとっては無駄な苦痛に過ぎない手慰みの病気つくりの行為にすぎないのです。他の放射線治療も抗がん剤治療のすべても癌を治す治療ではないのです。世界中の医薬業界だけが快楽を手にするために行われている病気を作って最期は増やしすぎた癌の原因であるherpesを増やしすぎて苦しみながらこの世からおさらばをさせるお金を儲ける商売に過ぎないのです。
みなさん「近藤誠」いう慶応大学の放射線科の癌専門医で現代の間違った大学病院における癌治療を100%こき下ろすだけでなく全否定されて2022年に虚血性心不全で亡くなられたのをご存知ですか?彼は日本の大学病院をはじめとする医療界の癌治療を「人殺し医療」と口汚く批判する本を何十冊も書いていますが彼の本には私自身は全く興味を持つことができませんでした。その理由は極めて簡単です。私は「癌を治せる治療に関連する」本しか読む気にはならないからです。
ところが癌の原因は癌ウイルス(ヘルペスウイルス)であるので癌細胞に隠れている癌ウイルスをロイアル・レイモンド・ライフ博士の光療法で殺せば転移があちこちにある末期がんも治せることが100年前に出来たという真実を語る本との奇跡的な出会いがあったのです。ロイアル・レイモンド・ライフ博士の光療法はここを読んでください。彼の癌完治の天才的な仕事ぶりが英語で書かれた本は2冊読みました。皆さんのためにいずれ一冊は日本語に翻訳する予定です。「近藤誠」さんの本は現代医療界が金儲けのためにあらゆる分野でいかに腐敗しきっているかを告発しているのですが癌の原因も一言も言及せずに同じ仲間内の悪事の内部告発に過ぎないので目次だけさらっと目を通すだけで全て知っていることばかりなので買って読む価値がある本ではなかったのです。しかし医療界の身内の仲間の悪事をここまで暴ききった男の度胸には脱帽しました。などという意味はなかったのです。彼も突然死する直前の三日前に書き上げた本の裏表紙に「体に一番大事なのは免疫だ」と書きましたが死ぬ直前に気が付いたのもびっくり仰天でした。
私の病気は私自身が見つけたのですが若年性海馬炎を主とするherpes性脳神経炎であったのですが今は抗ヘルペス剤を服用しているので進行はしないのですが右目は完全に失明しました。今も尚その病気を持ってはいるのですが病気で苦しんでいた若い時にはいや今でもどの医者も原因不明の病気、従って診断も下せないかつ病名もつかない病気を治すために三つ目の京都府立医科大に入り直したのですがやはり大学でもいかなる科のどの教授も「見たことがない病気だ」と口をそろえるだけでした。開業し始めて何十万人と言う難病患者を診ることで診断が下せない病気がヘルペスであることに気が付き始めたのです。まずは自己免疫疾患は存在するわけは無いので自己免疫疾患と言われる病気の原因はherpesだと気が付き最後には遺伝子を形質転換させて癌細胞に変えるのもherpesだということも自分が15歳から悩んだ右目が見えなくなったりしつこい片頭痛も起床時の脱力感も鬱が強くて常に自殺願望からのがれられなく集中力減退も感情を抑制できずに爆発させたり、強い強迫観念症も一日12時間以上寝なければ起床も不可能などのすべての脳の異常も心の病気の原因もherpesであることが徐々に難病の患者に教えられながら分かっていったのです。最後は100年前に光療法で癌をなおしたロイアル・レイモンド・ライフ博士という天才の業績との出会いがあり癌も癌ウイルスであるherpesウイルスであることを証明してもらったので現在私が治せない病気は何一つとして無くなってしまったのです。ロイアル・レイモンド・ライフ博士が見つけた癌ウイルスはまさにherpesウイルスであることを見つけたのです。
精神の病の最初の原因はあちこちで書いているように、生まれ持った才能を無視して飯を食うためにかつ快楽を得るための武器となるお金儲けに不自由し、思い通りにならないストレスに耐えすぎてもあきらめきれない人が最後に出てくるこころの病なのです。何故ならば脳の視床下部はCRH(コルチコトロピン放出ホルモン)を出してストレスに耐えさせるために二種類のストレスホルモンを出させるのです。一つは副腎皮質からコルチゾールを出させ心(脳)を耐えさせるためのエネルギーを最大限に、もう一つが副腎髄質から最大限にアドレナリンを出して交感神経の働きを刺激してストレスに心がつぶれないように頑張ってくれます。ところが人間には個人差がありますが耐える限界があります。だからこそどの国でも自殺者が出ない国は歴史上どこにもないのです。このように過剰なストレスは人間を自殺に追い込むことにもなるので心の苦しみは感情を支配する脳神経で耐えているのですが脳神経もエネルギーを大量に獲得しかつ自律神経の交感神経を最大限刺激しても神経だけでは耐えられなくなる限界があり、かつCRH(コルチコトロピン放出ホルモン)が視床下部から作られている限りホルモンに反応するのでCRHを出し過ぎても刺激されても下垂体に作用して副腎皮質刺激ホルモンの分泌を過剰に促進しても作らせ過ぎた副腎皮質ホルモンのコルチゾールによってCRH(コルチコトロピン放出ホルモン)の分泌が抑制されてしまうのです。つまりストレスが過剰になったらだめですよと言う信号が脳から入るようになっているのです。つまり生理的に生産して放出できる限界量のCRH(コルチコトロビン放出ホルモン)の量は決まっているのです。
それでは生理学的にストレスホルモンでストレスに対抗できなくなるとさて何が起こるのでしょうか?そうです。此処から精神病の症状が出現することになるのです。しかも副腎皮質ホルモンのコルチゾールが出ている間から出せなくなるまでに免役が長時間抑制されていますからCRH(コルチコトロピン放出ホルモン)や副腎皮質ホルモンのコルチゾールは免疫抑制ホルモンそのものであります。しかもあらゆるウイルスの中で唯一すべての人類に感染しているのはherpesウイルスだけであるだけでなく人体を構成する核のある230種類以上の細胞のすべてに感染してそのすべての細胞に癌を作るのはherpesウイルスしかいないのです。免疫抑制ホルモンであるCRHとコルチゾールは我慢し過ぎて出し過ぎると神経の病である精神病のみならず肉体の病気である癌まで作ってしまうのです。
herpesウイルスは自分の遺伝子を持っているのになぜ人の細胞に自己増殖のために寄生しなければならないのでしょうか?herpesウイルスは、150nm(ナノメーター)のとても小さな粒子の中に、自己増殖のための遺伝情報を確かに持っています。ウイルスは独自の遺伝情報を持っていますが、その遺伝情報を伝えるDNAやRNAを覆っている粒子を構成する部品であるタンパク質の合成を宿主細胞に依存している寄生体です。ウイルスは小さすぎるので自分のDNAやRNAを覆う蛋白までの情報を自分のDNAにコードできないのです。Herpesウイルスの仲間は80から200の遺伝子を持っていますが,ウイルスの増殖に必要な遺伝子はその半分以下の約40個の遺伝子で,それ以外の遺伝子は,自分自身の生存を有利にするために,潜伏感染,発癌,宿主の免疫能の抑制など,宿主との相互作用および宿主細胞機能の抑制や修飾に必要であるのです。又herpesウイルスのDNA合成は宿主のDNAウイルスのDNA合成に関わる酵素を利用しherpesウイルスもゲノムを複製するので、ポックスウイルスのような自分自身のDNA合成酵素を持つもの以外は、核の中で増殖するのです。又、herpesウイルスの遺伝子発現調節も宿主細胞の転写開始の制御により行われます。このようにHerpesのDNA合成は宿主のDNA合成機構を利用しているので宿主が増殖するための複製分裂するときにherpesも一緒に遺伝子の複製や細胞分裂するのです。
ポックスウイルスとは何でしょうか?ポックスウイルスはレンガ型あるいは卵形をしたエンベロープを有するウイルスであるが、全長が220-450nmもある大きなDNAウイルスである。インフルエンザウイルスやヒト免疫不全ウイルスではだいたい100nmほどです。また、herpesウイルスなどの通常のDNAウイルスは感染細胞の酵素を借りて核内で増殖するが、ポックスウイルスはDNA複製に必要な酵素のほとんどを自前で持っているため、宿主細胞の細胞質内で増殖を行う。ポックスウイルス科のウイルスによる病気の特徴は皮膚の発疹様斑紋であり斑紋とはまだらの模様です。今は根絶された天然痘が有名です。ポックスウイルスのような自分自身のDNA合成酵素を持つもの以外は、核の中でしか増殖することができないのです。
CRHとコルチゾールとストレスの関係をさらに詳しく見てみましょう。
ストレスから自らを防御するためには糖質コルチコイド(GC)が不可欠であるが,中枢性に糖質コルチコイド合成・分泌を制御するのが視床下部のコルチコトロピン放出ホルモン(CRH)ニューロンである.ヒトでも齧歯類(げっしるい)でも CRH は視床下部の室傍核(para‐ventricular nucleus略して PVN)の小型神経細胞で産生される.齧歯目は、哺乳綱の下の目に分類される。別名ネズミ目。現在のところ地球上で最も繁栄している哺乳類で、南極大陸を除く全ての大陸、およびほぼ全ての島に生息する。齧歯類(げっしるい)のネズミでもコルチコトロピン放出ホルモン(CRH)ニューロンがあり副腎皮質刺激ホルモン(ACTH)を分泌しているのですよ!!ネズミにもストレスがあるんですよ!!!
CRH ニューロンには同じく視床下部で合成されるバゾプレッシン(AVP)があり,両者が下垂体からの副腎皮質刺激ホルモン(ACTH)分泌を調節する.バゾプレッシン(AVP)とは何でしょうか?AVPは、視床下部で合成され下垂体後葉に蓄えられる下垂体後葉ホルモンであり腎尿細管における水の再吸収を促進する作用があるので血流量が増えるので血圧が上がります。AVPはArginine vasopressinの略語で日本語ではバソプレッシンと訳されています。AVP(Arginine vasopressin)は下垂体後葉から分泌されるペプチドです。バゾプレシンは、抗利尿ホルモン、血圧上昇ホルモンとも呼ばれる。バソプレシンはなぜ血圧を上げるのでしょうか?バソプレシンは、血圧低下に反応して下垂体後葉から分泌されるホルモンで、腎臓で水を再吸収し、血液量を増加させて血圧を高める。バソプレシンは、本来の役割は血圧低下に反応して下垂体後葉から分泌されるホルモンでバソプレシンのバソは「血管の」でありプレシンは「押す」であるので血管を押すと血圧が上がるので血圧上昇ホルモンとなります。
CRH ニューロンの活動性は GC(糖質コルチコイド) などの液性因子および他の脳神経から入力される神経終末から放出される神経伝達物質によって調節されています。たとえばストレスがかかると脳内 NE(ノルエピネフリン、別名ノルアドレナリン)神経が刺激されてNE(ノルエピネフリン、別名ノルアドレナリン)が視床下部のCRH ニューロンを刺激します。ノルエピネフリンは別名ノルアドレナリンです。この様にストレスがかかりすぎると脳内 NE(ノルエピネフリン)神経からノルエピネフリン量が過剰になり、不安や恐怖、焦燥、や取り乱す状態が出現し、さらに代謝物であるアドレナリンも増えることで、頻脈や冷や汗などが出現し、その不安や焦燥はさらに助長されてしまいます。脳におけるノルエピネフリンアドレナリン作動性の神経細胞群は、主に延髄(medulla)、橋(pons)に存在し、A1-A7に分けられている。とりわけ橋にある青斑核(A6)にノルアドレナリン作動性神経細胞が多く存在し、そこからほぼ脳全域に投射しています。橋にある青斑核(A6)の中枢神経系ノルアドレナリンは覚醒-睡眠や注意、記憶や学習以外にストレスがかかると青斑核(A6)からノルアドレナリンが大量に出され視床下部にストレスが生じたことを知らせるのです。CRH と AVP は共に小型神経細胞に存在するにもかかわらずストレス時これらの遺伝子発現は必ずしも平行しない.この現象を説明する細胞内メカニズムとして両遺伝子転写機構の違いがあげられるが,CRH とAVP による二重支配はストレス防御という視点からは生体応答の多様性の一つなのです。
CRH(Corticotropin-releasing hormone)は,コルチコトロピン放出ホルモンと訳しストレス下で下垂体からのACTH(adreno‐cortico‐tropic‐ hormoneの略で副腎皮質刺激ホルモン)の分泌を促進する下垂体刺激作用のみならず,視床下部―下垂体―副腎系のストレス応答の調節に中心的な役割を果たしているほかに,種々のストレスに反応して生じる自律神経系,免疫機能,行動,情動等の変化の発現に重要な役割を担っている。すべての人(ネズミも)がストレスを受けると延髄(medulla)、橋(pons)に存在している青斑核(A6)にノルアドレナリン作動性神経細胞にまず伝えられその情報はノルアドレナリンによって視床下部の室傍核の背内側に存在するCRH産生ニューロンを活性化させるのです。
副腎皮質刺激ホルモン放出ホルモンとは、ヒトのストレス反応に関するペプチドホルモンの一つで主な機能は、副腎皮質刺激ホルモン (ACTH) の分泌を促進させることである。ストレスに反応して視床下部(PVN)から分泌され、視床下部の底部にある正中隆起の血管網に放出され、下垂体門脈を通って下垂体前葉に到達する。
CRHの産生にはストレスによって免疫が落下してherpesが脳の神経細胞まで感染してアルツハイマー病や重度なうつ病が生じるのです。脳神経変性疾患の原因のすべてはherpesが脳神経細胞に感染して神経細胞内でherpes増殖の結果、海馬体の脳細胞の機能が破壊され脳細胞が溶解して死滅するからです。例えばアルツハイマー病の原因はアミロイドβと言われ原因除去と全く関係のない「レカネマブ」が認可されましたがアミロイドβはherpesによる海馬体の記憶を司る細胞の崩壊産物にすぎないのです。抗herpes剤で良くなっていきます。うつ病も強いストレスに耐えすぎてステロイドホルモンを出し過ぎて免疫を抑えてherpesが脳神経の感情を司る偏桃体にherpesが感染したからです。うつ病についてはここを読んでください。
CRHのホルモン作用としては、短期的には食欲を抑制し戦いの態勢を取らせ、不安の主観的感情やストレスに対して怒りの感情を増大させ、負けないように注意力を高めるなどの機能を強めるのです。CRHの免疫抑制作用は、ストレスと対抗するためにコルチゾール作用を介した一時的な免疫抑制によってエネルギーをストレスにむけてherpesとの戦いは一時休戦しているだけですから、しかし自己免疫疾患と言われる多発性硬化症の研究において、実際に炎症を増強しうると言われているのはCRH産生とコルチコステロンが作られる時間差があるためです。多発性硬化症もherpesが原因です。多発性硬化症(multiple sclerosis:MS)は、中枢神経系の脳神経の髄鞘に感染して生ずる慢性炎症性脱髄疾患であり、時間的・空間的に病変が多発するのが特徴であるのはherpesはあらゆる部位の中枢神経系の脳神経の髄鞘に感染できるのと免疫が上がって初めてミクログリア細胞と戦うと症状が出るのです。免疫が落ちているときはミクログリア細胞は戦いが出来なくてherpesが増えるのを手をこまぬいてじっとherpesが感染増殖するのを見るしかないのです。多発性硬化症はここを読んでください。
精神薬理学的にはストレスがかかりすぎてたた自殺した人の脳脊髄液には、異常に高いレベルのCRHが見られます。人がストレスを受けると延髄(medulla)、橋(pons)に存在している青斑核(A6)にノルアドレナリン作動性神経細胞にまず伝えられその情報はノルアドレナリンによって視床下部の室傍核の背内側に存在するCRH産生ニューロンを活性化させ、CRHニューロンは視床下部の正中隆起部に線維をおくっており、その神経線維の終末よりCRHが下垂体門脈中に放出される。放出されたCRHは下垂体前葉に到達し、ACTH産生細胞よりACTHの分泌を促進し、ACTHは副腎皮質束状層からのステロイドホルモンであるグルココルチコイドの分泌を刺激するのです。
ストレスを受けると脳幹である延髄(medulla)と、橋(pons)に存在している青斑核(A6)にノルアドレナリン作動性神経細胞にまず伝えられその情報はノルアドレナリンによってCRH1型受容体とCRH2型受容体に伝えられます。ともに視床下部の室傍核、延髄の背側にある孤束核、迷走神経背側運動核に存在している。CRH1型受容体は、副腎皮質ホルモンの放出を引き起こすストレス応答に関わるとともに下部消化管運動(結腸)の亢進にも関わる過敏性腸症候群を起こりやすくします。過敏性腸症候群はストレス性のherpes性の腸過敏症なのです。クローン病も潰瘍性大腸炎もストレス応答が続いて免疫が落ちてherpesが増えたために起こるのです。ストレスの増大とherpesの増殖は常にセットで起こっているのです。現代は人間の歴史上最もストレスの多い資本第一の競争社会となってしまったのでヘルペスがあらゆる種類の病気を最も作りやすい時代になってしまったのです。誰もかれもが人間よりもお金が価値があると思い知るようになってしまったのです。しかしこの真実をどの医者も気が付いていないのです。
CRH2型受容体はストレスから引き起こされる不安解消、食欲不振、血圧低下等に関わります。胃や十二指腸といった上部消化管運動を抑制する機能性ディスペプシアの原因ともなります。機能性ディスペプシアとは何でしょうか?機能性ディスペプシアは、胃もたれ、早期満腹感、みぞおちの痛みをはじめとする症状が自覚されている一方で、内視鏡で観察しても粘膜に異常が認められない病気です。 内視鏡検査が広まる以前は、神経性胃炎やストレス性胃炎、慢性胃炎などと診断されることもありました。以前はストレス性胃炎と診断されていることが多かったのですが機能性ディスペプシアの原因も自律神経に感染したヘルペスが原因です。このようにして、ストレスがいわゆるステロイドと言われるグルココルチコイドの分泌を高めることにより、脳のエネルギーは糖しか使えないので糖新生による脳の機能低下を防いだり、エネルギーを大量に必要な免疫系に一時的に糖分を使わせないようにするために免疫抑制反応を起こすのです。
また、グルココルチコイド(ステロイド)はCRHの転写を正にも負にも調節していて、熱ショックタンパク質である HSP90(heat shock protein 90)の量が多い組織では、ステロイドはグルココチルチコイドレセプター(GR)と結合してステロイド-GR複合体のホモ2量体を形成し、CRH遺伝子の5’上流域に存在するGREに結合し、CRH遺伝子の転写を促進します。GREは glucocorticoid response elementの略で. グルココルチコイド反応転写領域と訳します。ホモ二量体(homodimer)とは同じ種類の2つのタンパク質が結合して形成する二量体でホモダイマーともいう。しかし視床下部の 室傍核のようにHSP90の少ない組織では、ステロイド-GR複合体はAP-1を構成するJunやFosタンパク質などとヘテロ2量体を形成し、CRH遺伝子の転写を起さないばかりか、 AP-1によるCRH遺伝子の転写促進すらも抑制する。転写因子であるAP-1は、c-Fos、c-Jun、ATF、JDPファミリーに属するタンパク質で構成されているヘテロ二量体タンパク質の転写因子である。AP-1はサイトカインや成長因子、ストレス、バクテリアやウイルスの感染など様々な刺激に応答して遺伝子発現を制御している。AP-1の阻害作用は、まさに薬物としてのステロイドと同じメカニズムであり、薬物ステロイドと同様AP-1阻害にて抗炎症、免疫抑制作用を示しますが、 AP-1阻害作用は負のフィードバックとして、室傍核ではCRHの合成・分泌を、下垂体ではACTHの合成・分泌を抑制する。つまりAP-1阻害作用もまた、免疫抑制に対して正の作用と、行き過ぎたときのフィードバック機構として負の作用を担っているのです。
一方、CRHによるACTH分泌のメカニズムは、ストレスがかかると脳内 NE(ノルエピネフリン、別名ノルアドレナリン)神経が刺激されてNE(ノルエピネフリン、別名ノルアドレナリン)が視床下部の室傍核のCRHニューロンに伝達され、CRH ニューロンを刺激します。ストレスの情報が室傍核のCRHニューロン細胞内のcAMPレベルを上昇させ、CREBがただちにリン酸化され活性型に変換することにより、 CRH遺伝子の転写が起こり、産生されたCRHはGタンパク質と共役する特異的受容体に結合しプロテインキナーゼA(PKA)という酵素を介してACTHを放出するのです。Gタンパク質と共役する特異的受容体とはなんでしょうか?Gタンパク質共役受容体(GPCR)は細胞膜上で神経伝達物質やホルモンを認識する生体センサーです。 また、嗅覚、味覚、視覚などを感じるのもGPCRの役割です。7回膜貫通部位を持つという特徴をもち、タンパク質の中で最大のスーパーファミリーを形成しています。
CREB とはなんでしょうか?CREB(cAMP response element binding protein)は転写因子であり、cAMP応答配列(cAMP response element、CRE)と呼ばれる特定のDNA配列に結合し、遺伝子の転写を増加させたり低下させたりする。また転写因子であるCREBのcAMP応答配列(cAMP response element、略してCRE)の下流に位置するAP-1結合領域に転写因子であるAP-1が結合することでもCRHの転写が促進される。Gタンパク質(Gタンパクしつ)は、グアニンヌクレオチド結合タンパク質(グアニンヌクレオチドけつごうタンパクしつ)の略称であり、GTPまたはGDPを結合して活性のON/OFFを行うことにより、細胞内情報伝達に関与する。このうち、Rasに代表される低分子量GTPアーゼ(分子量は20から30kDaほど 単量体で機能し、細胞内のプロテインキナーゼカスケードに関与する)一群と、グアニンヌクレオチドを結合するαサブユニットのほかにβ、γのサブユニットからなる「三量体Gタンパク質」と呼ばれる一群に大別される。三量体Gタンパク質はGタンパク質共役受容体(GPCR)と共役してセカンドメッセンジャーカスケードに関連する。「三量体Gタンパク質」を「Gタンパク質」という場合もある。グアノシン二リン酸 (GDP)を結合した不活性型分子は刺激によってGDPよりもグアノシン三リン酸(GTP)に対する親和性が増し、GDP結合型からGTP結合型の活性型へ変わって情報を伝達する。結合したGTPをGDPへ加水分解するGTPアーゼ活性を持ち不活性なGDP型に戻ることができる。
ストレスから自らを防御するためには糖質コルチコイド(GC)が不可欠であるが,中枢性に糖質コルチコイド合成・分泌を制御するのが視床下部のコルチコトロピン放出ホルモン(CRH)ニューロンである.
ストレス応答を制御する CRH ニューロンは数多くの神経性,液性の因子による調節を受けており,ストレスの種類,強さ,持続時間などにより多様な応答を示します。臨床的には,強いストレスが長期に続くと免疫が下がりすぎてherpesが脳の情感を支配する偏桃体にヘルペスが感染してしまうことと、ステロイドホルモンが出過ぎるとストレス応答を制御する CRH ニューロンから出されるコルチコトロピン放出ホルモン(CRH)が出なくなるのでストレスに対抗できなくなりどうすることもできなくなりうつ病になってしまうのです。うつの苦しさに耐えられなくなった鬱患者が自殺することも有るのです。
原因不明のほとんど全ての病気は耐えられないストレスと長いストレスの間に増えたherpesが自律神経や脳の海馬体や偏桃体に感染したために生じた病気なのです。このようにストレスは現代医学・医療上の最重要課題の一つであるのですが資本主義体制に起こる能力の違いを無視した過当競争と人間よりも金力で支配される社会が感染症のキングであるヘルペスが精神病のみならず癌も自己免疫疾患も生み出したのですが誰も口にしない嘘偽りで塗り固められた社会に堕落してしまったのでどうにもなりません。生成AIもあらゆる嘘を覚えきって金儲けのために利用されてしまうだけです。これだけ発展した科学技術も経済戦争や殺し合いの戦争で利用されるだけですべての人間が幸せになるのではなく特定の国や個人だけが栄えるのは間違っていますが金力、政治力、軍事力を持っている国家や人間だけが栄えるのは間違っていますが絶望以外に残るものはありません。いずれ人類は早晩滅びる運命に瀕することになるでしょう。
癌細胞はなぜ死なないのでしょうか?
がん細胞ではたいてい、テロメラーゼ(telomerase)と呼ばれるテロメア合成酵素が活性化しており、この酵素の働きによってテロメアが安定に維持されます。 がん細胞が無限に分裂出来るのはこのテロメラーゼ(telomerase)と言う酵素の働きがあるためです。
テロメアは染色体の末端にみられる構造で,6塩基の特徴的な繰り返し配列(telo‐meric ‐repeats:TMRs)を持つDNAと,さまざまな蛋白質で構成される.Teloの意味は「末端, 終り」と言う意味でテロメア は真核生物の染色体の末端部にある構造。テロメアは染色体末端を保護する役目をもつ。テロメアは複製による染色体の短縮や他の染色体との融合を防ぐ役割をしている.Marek’s disease virus(MDV)はヘルペスウイルス属の2本鎖DNAウイルスであり,鶏に感染してMarek病を引き起こす.MDVはそのゲノムの末端に,TMRsと同一の繰り返し配列を有する.TMRs変異MDVを作製し鶏に感染させたところ,感染鶏のマレック病発症率は有意に低下した.野生型MDVのゲノムが宿主のテロメアへ組込まれたのに対して,変異MDVは染色体内に組込まれた.さらに変異MDVでは,ウイルスの再活性化が有意に阻害されていた.以上の結果より,MDVがTMRsを利用して宿主テロメアへ組込まれることで,効率的な再活性化を可能にしているのです。
HHV-6など他のヘルペスウイルスにもTMRsが存在することから,TMRsによるherpesウイルスゲノムの組込みが,保存されたメカニズムであることが推察されます。HHV-6は,薬剤過敏症症候群において再活性化することが知られていますがそれは薬剤過敏症症候群のアレルギーによるものではなくアレルギーを起こしたその薬剤が免疫を下げたためなのです。
薬剤過敏症症候群とは何でしょうか?薬剤性過敏症症候群は、重症の薬疹であり、高熱(38℃以上) をともなって、全身に赤い斑点がみられ、さらに全身のリンパ 節(首、わきの下、股の付け根など)がはれたり、肝機能障害 など、血液検査値の異常がみられたりします。薬剤性過敏症症候群の過敏症はアレルギーですから薬疹とほとんど同じことなのです。薬疹とは、薬を内服したり注射したりすることにより生ずる発疹のことです。発疹(ほっしん)とは皮膚に現れるかゆみや水疱、吹き出物のことをいいますがこの発疹の原因はアレルギーを起こす化学物質が原因である場合と、ヘルペスの皮膚感染と血管内皮細胞の感染によるものや細菌感染症によるものがあります。膠原病の一つ、全身性エリテマトーデスは鼻から両頬にかけて蝶のような形の赤い発疹が現れるのは、頬の血流が豊かな毛細血管の内皮細胞に感染した単純ヘルペスや水痘帯状ウイルスによって発症する帯状疱疹は、赤い発疹が現れます。
その中でも問題となるのは、薬を投与されたごく一部の人に生ずるアレルギー性薬疹です。 ふつう薬疹といった場合には、このアレルギー性薬疹を指し、薬に対して反応するような細胞や抗体がある人(これを薬に感作された状態と呼びます)にのみ生じます。がこれは薬疹といっても、薬の他にウイルス感染が関係してくる病気です。他の薬疹と比べとてもユニークな特徴があります。原因となる化学物質である薬は抗痙攣剤が圧倒的に多く、その他尿酸を下げる薬などがあります。薬を飲み始めてから発症するまでに時間がかかるのが特徴で、多くは3週間以上で平均4週間と言われていますが、なかには1年以上たって発症することもあります。病原体であるヘルペスウイルスの炎症による発熱と、痒みのある紅い斑で発症することが多く、ウイルス感染症なのでリンパ腺が腫れ、白血球が増えてきます。発疹は圧迫部では融合する傾向が強く、紅斑は出血が混じるため鮮紅色~紫紅色調となります。発症時には淡い紅斑だったのが、原因薬を中止して対症治療も終えた数日後にはリバウンドのために著明な悪化を認めます。殆どの場合、原因となった薬を中止しても、良くなるどころか、どんどん悪くなってきます。herpesが感染した肝臓や腎臓などの症状の他、神経症状など様々な臓器の症状を呈してくるのはherpesと免疫との戦いが見られるからです。原因となった薬以外で発症後に使用した薬の特に免疫抑制剤のである一つである解熱鎮痛剤に対しても反応を示す場合が多いため、本症では治療として使う薬の選択が非常に難しくなると言われますが原因はherpesですから抗ヘルペス剤と唯一の免疫を上げてくれる漢方煎じ薬を投与すればステロイドを使っていなければ簡単に治ります。本症が最近注目されるようになったのは、本症の殆どの例においてヒト6型ヘルペスウイルス(HHV-6)の再活性化、つまり分裂・増殖が認められることが明らかになったからです。ヒト6型ヘルペスウイルス(HHV-6)とは何でしょうか?HHV-6型のヘルペスウイルスとは、ヘルペスウイルスの一種で、 赤ちゃんの頃に突発性発疹という40℃近い高熱と発疹を伴う感染症になりますが、この突発性発疹の原因がヘルペスウイルス科の6型といわれるHHV-6型ヘルペスウイルスです。このウイルスは赤ちゃんがかかる突発性発疹の原因ウイルスで、殆どが乳幼児期に感染してそのまま潜伏します。それが免疫を抑制される解熱鎮痛剤を用いてしまったりすると潜伏していたHHV-6型ヘルペスウイルス分裂・増殖してしまいます。つまり免疫抑制剤を投与しているうちに、そのようなウイルスの再活性化状態つまり増殖しだします。そのうちに免疫抑制剤の影響が終わりかけると増えたHHV-6型ヘルペスウイルスと免疫の戦いが始まり症状がいろいろの臓器にも出てくるのです。しかも6型ヘルペスだけでなく、サイトメガロウイルスやEBウイルスなど様々なヘルペス科のウイルスも免疫が落ちている間に、次々と再活性化(分裂・増殖)し、免疫が戻りだすといろいろなヘルペスが増えた臓器で免疫との戦いによる炎症が起こるのは当然のことなのです。そのため本症は原因薬を止めた後も、極めて多彩な症状、経過をとるのは医者の間違った免疫を抑える対症療法のためなのです。つまり医者の作った病気なのです。哀しいですね!!!
ヘルペスが再活性化するのは医者が免疫を抑える薬を使うときにはherpesのビリオンが増えても感染細胞がインターフェロンαを作って自爆テロをやることがないのでherpesの子供であるビリオンが死ぬことは無いことを知っているからです。世界中の医者たちはherpesを増やすのは自分たちが使うステロイドをはじめとするあらゆる種類の解熱鎮痛剤であることを教えられていないからです。残念です。
何故世界中の80億人のすべての人に8種類のherpesのどれか一つに感染しているのに気が付かない医療人が多いのでしょうか?herpesは他の感染症を起こすウイルスと何がどこが違うのでしょうか?すでに詳しくは書いたのですが更に書き残した詳細は後述します。
「ヘルペスの再活性化状態」の意味は何なんでしょうか?皆さんは単純にherpesの症状が出ているとお考えでしょうがそれも間違っているのです。「ヘルペスの再活性化状態」の最も正しい表現は一言でいうと「増殖・分裂して自分の子孫の数をこっそり免疫があがるまで増やしつつある状態」と言えるのです。具体的に説明すると「核や核の遺伝子に潜んでいたヘルペスが免疫が落ちた時に自分自身が分裂増殖して子供のビリオンを大量に生み出してビリオンが細胞外の組織や血管やリンパ管に侵入したり、またherpesが組織やリンパ管や血管などにも入り込んだときに自然免疫細胞や獲得免疫細胞に見つかり戦いが始まり炎症が生じてherpesとの戦いが行なわれている」という状態までを再活性化状態といってもいいのです。「ヘルペスの再活性化状態」を患者が認識できるためには免疫とヘルペスとの戦いの証拠がない限りは「ヘルペスの再活性化状態」つまりherpesに感染していることがわからないのです。ビリオンはherpesウイルスの子供たちだけではなくすべてのウイルスの子供たちを指します。
しかも6型ヘルペスだけでなく、サイトメガロウイルスやEBウイルスなど様々なヘルペス科のウイルスが、次々と再活性化し、増えてキラーT細胞にherpes感染細胞もろとも殺されたりします。また細胞内で増えたビリオン(ヘルペスウイルスの子供)は細胞外に出ると初めて自然免疫の細胞であるマクロファージや好中球や補体やナチュラルキラー細胞に見つかって戦いの炎症を起こしたり、あるいは別の臓器や器官や組織のすべての種類の細胞に感染して細胞を溶解感染して殺したり、あるいは細胞質にいる多くのヘルペスはヘルパーT細胞とキラーT細胞に見つかって細胞もろとも殺されたりすると初めていろいろの炎症所見や炎症反応が現れるのです。炎症とか炎症所見とか炎症反応とは何でしょうか?炎症とは、病原体と免疫の戦いが起こった時にだけ五つの症状が出ます。発熱、疼痛、発赤、腫脹、炎症臓器や組織の機能障害が起こすのは実はマクロファージ(大食細胞)なのです。
マクロファージ(大食細胞)はどのようにして病原体と戦って除去するために炎症と言われる発熱、疼痛、発赤、腫脹、炎症臓器や組織の機能障害の五つの症状を起こすのでしょうか?
マクロファージ(大食細胞)は骨髄の血液幹細胞から生まれて血液に出たときにモノサイト(単球)と呼ばれます。このモノサイト(単球)が血液に出ていくと総計20億個のモノサイトが血液にいつでも流れています。骨髄から血液に出て三日間は血液に血管にとどまっていますが毛細血管の内皮細胞まで来ると内皮細胞の隙間に足を絡めて組織に出ます。組織に出て初めて成熟した大食細胞になります。出てすぐにherpesウイルスに出会うことはないのでぶらぶらしながら組織のごみ集めの仕事をし始めますが血中に大量のherpesを見つけると貪食して俄然興奮し出してその周辺の毛細血管の血流を増やす化学物質を血中に放出します。まず血流が増えると発赤が見られます。つぎにこの化学物質は血管内皮細胞を収縮させますと毛細血管の隙間から組織に体液を漏らさせるので周辺の組織が腫れていきます。その炎症の周辺を腫脹させます。またその化学物質は周りの組織にある痛覚神経を刺激して脳に痛みを感じさせることになります。さらに大量にherpesウイルスを食べた大食細胞は内因性の発熱物質であるインターロイキン1(interleukin-1略してIL-1)を産生します。IL-1は視床下部の体温調節中枢に作用してプロスタグランデイン(prostaglandin略してPG)を特にPGEというプロスタグランデインの産生を活性化すると免疫に見つからない特技を持っているherpesでも大食細胞に大量に貪食されて発熱が見られることがあるのです。特に子供の時からアトピーでsteroidを塗り過ぎた人に見られます。因みにインターロイキン1(interleukin-1略してIL-1)は世界で初めて発見されたインターロイキンなので1が付けられたのです。インターロイキン (IL)とは何でしょうか?免疫細胞で初めて確認されたサイトカインの一群です。 T細胞、マクロファージをはじめとする免疫細胞や血管内皮細胞からも分泌されます。 50種以上のインターロイキンの遺伝子がヒトゲノムに組み込まれており、構造や機能も多岐にわたっています。ヘルペスとの戦いは慢性かつ急性感染症です。サイトカインとは何でしょうか?細胞から分泌される低分子のタンパク質で生理活性物質の総称。生理活性蛋白質とも呼ばれ、細胞間相互作用に関与し周囲の細胞に影響を与える。放出する細胞によって作用は変わるが、詳細な働きは解明途中です。
何故ヘルペス感染症は慢性疾患でありかつ急性疾患なのでしょうか?herpesは一度でも感染すると免疫が高いときは細胞の中にとりわけ自律神経の神経節の細胞に慢性的に潜伏感染しているか免疫が落下した時に分裂増殖すると初めて免疫に見つかり戦いが始まると急性感染症となり炎症反応が出るのです。
癌はherpesにより突然変異が起こって癌細胞になるのですが長い時間をかけて癌細胞が増えるのは同時にherpesが免疫が落下した時に分裂増殖しているので初めて免疫に見つかり免疫との戦いで炎症反応も出るので戦いが始まると急性感染症となり炎症反応の代表であるCRPもかならず高くなるのです。herpesが癌細胞の原因でなければ癌細胞は自然に自分勝手に遺伝子が変わったとすれば癌細胞は免疫にとっては異物でないどころか病原体になっているわけでもないので絶対に免疫の炎症反応であるCRP(C反応性蛋白)が上昇することはありえないのです。つまり癌でCRP(C反応性蛋白)が上昇するのは癌は感染症でありその感染症を起こしているのはherpesであるという証拠となるのです。だからこそ癌はherpes感染症でありかつもっと正確に言うとヘルペスによる遺伝子感染と言うのです。
癌はherpes性遺伝子感染症ですから癌が増殖したり転移癌がすでにあったりとりわけリンパ節転移があればリンパ節での免疫とヘルペスとの戦いが激しくなるので必ずCRP(C反応性蛋白)が非常に高くなっていきます。herpesと免疫との戦いがあれば転移性癌があったり必ず常にしかも説明されない限りは炎症の原因はヘルペスであるかどうかは患者は知る由もないのです。あらゆる種類のウイルスや細菌に対してワクチンが作られ、かつあらゆる種類の細菌を殺せる抗生物質も開発された現在においては病気を起こす原因不明の炎症を起こす病原体は一例を残してすべてなくなったと断言しても許されるのです。それではワクチンを作ることが出来ない唯一の例外のウイルスは何でしょうか?言わずと知れたヘルペスウイルスだけなのです。皆さん最高のワクチンは何だと思いますか?それは病源体に感染して生き残れば感染した病原体自身が最高の生きたワクチンと言えるのです。しかし実際の病原体に感染して死ぬことも有る病原体に対してワクチンが開発されたのです。皆さんヘルペスにかかって死んだ人がいますか?誰もいないのに誰もいないのに阪大の微研は「開発した水痘帯状ヘルペスワクチンを老人に接種しなさい」と金儲けのためにメディアで宣伝しまくっていますが意味がありません。だってほとんど全ての老人はすでに最高の水痘帯状ヘルペスワクチン接種は終わっていますからね。ワッハッハー!!!!
癌細胞は免疫に認識されて攻撃されるか?答えは100%NOです。何故ならば自分の細胞を異物と認識できないからです。herpesが原因であるのでherpesの成分のペプチドと細胞のMHC1複合体がリンパ球に認識させることはできるので免疫細胞はherpesによって生み出されたがん細胞を攻撃します。しかしherpesのいない癌細胞はあり得ないので免役は正常細胞を敵と認識できないので癌細胞を殺すことはできませんがオプジーボが癌細胞を殺しているように見えるのは、herpes感染細胞でありそれがたまたまherpesによってがんになった細胞を殺しているだけです。癌が自己免疫疾患の一つであれば正に攻撃の対象になるでしょうが。アッハッハ。したがってオプジーボが癌細胞を殺せるのはオプジーボはherpes感染細胞を殺しているだけで癌細胞を殺しているわけではないのです。
従って癌に際して炎症所見のCRPや血沈や好中球が増えたりするのは癌の背後にherpesがいるからです。
癌抑制遺伝子のどこがどのように癌現遺伝子と比較して何が異なるのか?
「遺伝する癌」は癌全体の1%を占めます。最初に見つかった「遺伝する癌」は小児の眼にできる網膜芽細胞腫でした。この網膜芽細胞腫は遺伝性腫瘍である「遺伝する癌」であり「がん抑制遺伝子」として最初に見つかったRB1遺伝子が突然変異によってがんを抑制する機能を失ってしまったために癌原遺伝子が異常な増殖を起こしてしまい癌ができてしまうのです。
癌を引き起こす癌関連遺伝子には二種類あります。「癌原遺伝子」と「癌抑制遺伝子」です。この二つの遺伝子が二つとも突然変異をおこしてしまうと癌が発生します。「癌原遺伝子」が突然変異を起こすと「癌遺伝子」となり「癌原遺伝子」の過剰発現や過剰機能が生じて細胞の増殖が止まらなくなります。一方「癌抑制遺伝子」が突然変異をおこすと「癌原遺伝子」の細胞を増殖させない機能が失われてしまうと始めてがんが生まれるのです。 「癌原遺伝子」の場合は両親からもらった二つの対立遺伝子(アレル)のうち一つでも突然変異が起これば「癌原遺伝子」が突然変異を起こして「癌遺伝子」となってしまいます。ところが「癌抑制遺伝子」の遺伝様式は「癌原遺伝子」の遺伝様式とは違って面白い特徴があるのです。
優性遺伝子と劣性遺伝子について説明する必要があります。父親と母親それぞれからある特定の遺伝情報を引き継ぐため、異なる二つの遺伝情報を持つことになります。ある特定の性質(形質)に関する遺伝情報が存在する染色体の部位を相同の遺伝子座と言います。この相同の遺伝子座にあって、異なる遺伝情報を有する遺伝子の二つを対立遺伝子(allele、アレル)といい、ヒトは両親から一つずつの染色体を合計二つ受け継いでいるのですべての遺伝子について二つの対立遺伝子(allele、アレル)を持って生まれるので2倍体の生物といい、それぞれの遺伝子座について2つの対立遺伝子を持つことになります。優性遺伝子の二つの対立遺伝子の内一つでもあればその優性遺伝子が決める特定の性質(形質)が現れます。一方、劣性遺伝子が決める特定の性質(形質)が現れるためには対立遺伝子の二つとも劣性遺伝子が必要なのです。
仮に対立遺伝子を優性遺伝子Aと劣性遺伝子aとした場合、すべての遺伝子の対立遺伝子の組み合わせは両親から同じ種類の遺伝子を引き継ぐホモ接合のAAとaaの二種類か、または異なる種類の遺伝子を引き継ぐヘテロ接合のAaの合計3種類がとなります。ホモは「同じ」という意味でAAあるいはaaの同じ対立遺伝子を持っているのでホモ接合と言います。一方ヘテロは「異なる」という意味でAaは異なった対立遺伝子をもっているのでヘテロ接合となります。接合は「二つをつなげあう」という意味です。このような対立遺伝子の組み合わせを遺伝型と言い、各遺伝型に対応した発現した形質(性質・外見)を表現型と言います。また、対立遺伝子は優性・劣性の区別を付けることができるので、優性遺伝子と劣性遺伝子のヘテロ接合(Aa)では、優性遺伝子支配の形質が表現型となり、優性遺伝子のホモ接合(AA)の場合と同様となることを遺伝学では優性の法則といいます。つまり優性遺伝子が一つでもあれば優性遺伝子の形質(性質・外見)が現れますが劣性遺伝子の形質が現れるためには劣性遺伝子が二つ必要なのです。
「遺伝する癌」の遺伝子の遺伝様式が面白い特徴があるという意味はこの癌遺伝子は本来機能的には「劣性」なのになんと優性遺伝をするからなのです。つまり劣性アレルであれば癌の形質を表すことはできないどころか劣性アレルが二つあれば優性に負けてしまうので絶対に癌の形質を表すことはできないのに癌になる劣性アレルで癌になってしまうのが「遺伝する癌」の遺伝子の遺伝様式が特別に面白い特徴があるというわけです。つまり「優性の法則」が成り立たないのです。
まず優性遺伝子と劣性遺伝子の違いと優性形質と劣性形質の違いは何ですか?
優性遺伝子によって決まる優性形質は、その形質の遺伝子が2本の染色体のどちらか一方にあるだけでも発現します。 常染色体上にある劣性遺伝子によって決まる劣性形質は、その劣性形質の遺伝子が対になった両親からもらった染色体の両方にある場合にのみ発現し、片方にしかなければ、通常はその形質を示さない方の遺伝子が発現します。しかも正常な形質は一般には優性形質[A]で表し、がんなどの異常な形質は劣性形質[a]で表します。
突然変異した「遺伝する癌」の遺伝子のアレルを「a」とすれば「遺伝する癌」にかかっている癌患者はヘテロ接合である「Aa」なのです。「a」が一個でもあれば「遺伝する癌」になるリスクは高まりますから遺伝様式は優性遺伝というべきなのです。ところが発がんに至るにはAa→aになるべくAを欠失するか又は突然変異を起こしてAa→aaのどちらかになる必要があるのです。これをヘテロ接合性の喪失と言い英語でloss of heterozygosityであり略してLOHになります。このLOHこそ癌抑制遺伝子のすべてに共通する性質なのです。発がんに至るにはAa→aになるかAa→aaになるかのいずれかですがどちらもヘテロ接合性の喪失であり(loss of heterozygosity略してLOH)ならなければならないのです。このように癌については遺伝子が突然変異していないときに成り立つ遺伝子発現を決定する「優性の法則」が成立しないのは「癌」はherpesにより遺伝子が突然変異して遺伝子の表現型の発現も異常になったからです。言い換えると「癌」は唯一「劣性の法則」が成り立つ世界です。この世界を支配しているのはherpesなのです。
何故多発性骨髄腫と称される形質細胞の潰瘍性増殖は、なぜ骨髄に好んで生じるのだろう?続きは後述します。
