Herpesウイルスとは何か?癌をはじめとするあらゆる難病と言われる病気の原因です。自己免疫疾患もherpesが原因ですからすべての自己免疫疾患は治せます。自律神経の病気はherpesが自律神経に感染し易いので起こるのですが何故、自律神経に感染しやすいのでしょうか?特に自律神経の神経節に感染して潜伏感染しやすいのでしょうか?
ヘルペスウイルス科のウイルス群でウイルス中最大のグループで、現在130種以上が知られ、哺乳動物、両生類、魚類など自然宿主(ウイルスの寄生対象となる生物)は広く、それぞれの生物に固有のウイルスが知られている。ヘルペスウイルス科Herpesviridaeはαヘルペス亜科Alpha‐herpesvirinae、βヘルペス亜科Beta‐herpesvirinae、γヘルペスウイルス亜科Gamma‐herpesvirinaeの3亜科と他の未分類の群とに分類されている。αヘルペス亜科には単純ヘルペス1型(HSV-1)、単純ヘルペス2型(HSV-2)、水痘帯状疱疹ウイルス(VZV)、仮性狂犬病ウイルス、ウシ伝染性鼻腔気管支炎ウイルス、ウマ流産ウイルス、ウマ鼻腔肺炎ウイルス、ネコ鼻腔気管支炎ウイルスがありherpesウイルスは哺乳動物、両生類、魚類などのあらゆる脊椎動物に感染できる進化を4億年かけて突然変異を繰り返して成し遂げた大天才ウイルスの仲間なのです。だからこそ人類に最後に残された現在の病気の原因はすべてherpesなのは何の不思議もないのです。しかもこの真実を世界中の医者が誰も認めないのも世界の大不思議の一つです。癌原遺伝子を癌遺伝子に変えてしまうのもロイアルレイモンドライフ博士の言う癌ウイルスであるヘルペスなのです。ライフ博士についてはここを読んでください。
β-ヘルペスウイルス亜科にはヒトサイトメガロウイルス(HCMV)、ヒトヘルペスウイルス6型(HHV-6)、ヒトヘルペスウイルス7型(HHV-7)、マウスサイトメガロウイルス、モルモットサイトメガロウイルスがある。γ-ヘルペスウイルス亜科にはエプスタイン・バーウイルス(EBV)、カポジ肉腫(にくしゅ)関連ヘルペスウイルス(KSHV)、チンパンジーヘルペスウイルス、クモザルヘルペスウイルスがある。未分類にはカエルを自然宿主とするルッケヘルペスウイルス、高価な鯉の美しさを奪い取るので鯉ウイルスとして有名なコイポックスウイルスがいます。
ヘルペスウイルス共通の性質としては持続感染(潜伏感染)をおこすことであり、潜伏感染の間に回帰的に発症をみる。ヘルペスウイルスが持続感染(潜伏感染)を起こすとは何でしょうか?溶原サイクルの状態にあることで潜伏感染のherpesウイルスは自分のゲノムDNAの一部を細胞のゲノムの一部を細胞のゲノムDNAに組み込ませて休眠状態(プロウイルス状態)となって免疫から隠れているのです。一方、溶菌サイクルになるとヘルペスウイルスは感染した細胞内で増殖し始め、細胞を溶菌して殺してしまったりして、子孫ウイルスのビリオンを放出し、周囲の細胞に感染することを繰り返し回帰的感染を起こし細胞の外に出たときに免疫に見つかると炎症が起こり症状が再び出るのです。つまり潜伏感染中は無症候ですが再び一時的に症候が現れる場合を回帰発症といいます。
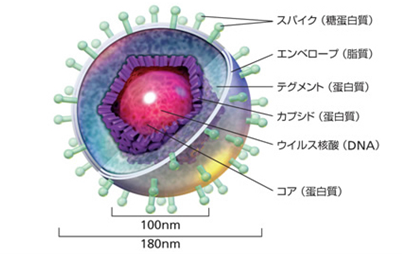
herpesウイルス粒子は、ほぼ球状で120~200ナノメートル(1ナノメートルは10億分の1メートル)、正二十面体、外側には突起をもつエンベロープ(外被)があり、100~110ナノメートルのカプシド(ウイルス核酸と結合タンパク質を取り巻くタンパク質殻)を内蔵しています。完全な形をしたウイルス粒子をビリオンvirionとよぶ。核酸とカプシド合わせた構造をヌクレオカプシドnucleo‐capsidとよぶ。カプシドを構成する形態学的な構造単位をカプソメアcapso‐mereとよぶ。カプシドの中にはDNA(デオキシリボ核酸)を含むコア(中心部)がある。元来、コアは「核心」と言う意味ですが医学では核酸を入れている中心部をコアと言います。エンベロープとカプシドとの間には(別名は内膜inner membraneとかマトリックスとよばれる)という特別な構造がある。テグメントとは,ヘルペスウイルスに特徴的なウイルス構造であり,エンベロープとカプシドとの間に介在する タンパク質層である。下図にHSV の増殖・潜伏感染機構 の絵を示します。
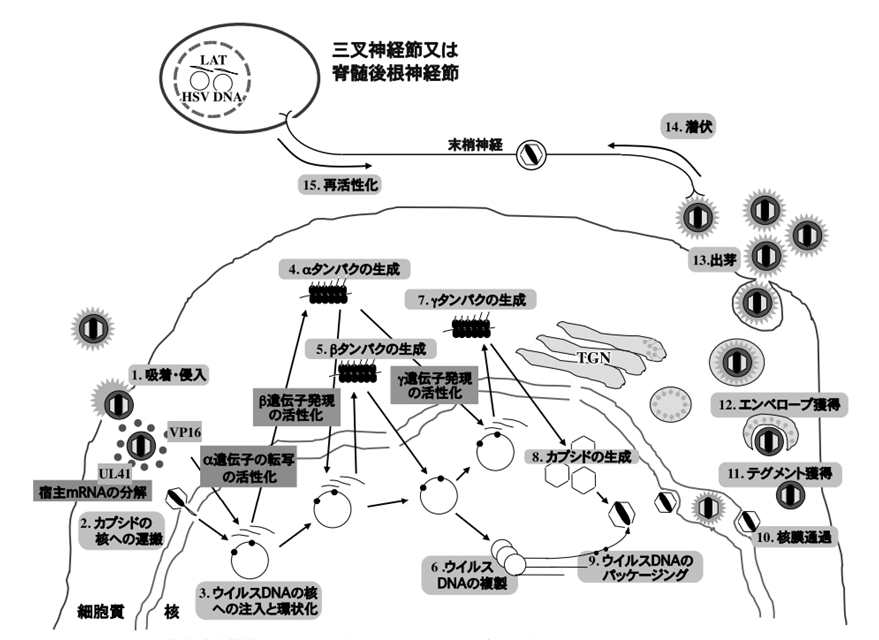
上図にHSVの増殖・潜伏感染機構の絵を示します。上の絵を見ながら説明します。単純ヘルペス(HSV)をヘルペスウイルスの代表として示します。
1.吸着・侵入。HSV(単純ヘルペスウイルス)はエンペローブ上のgCで細胞表面のプロテオグリカン(ヘパラン硫酸)に吸着し、gB、gDおよびgHによりエンペローブは細胞膜と融合します。感染により、宿主タンパクが合成されるときに用いられる合成阻害は阻止されます。それはherpesウイルスは宿主タンパクが合成されるときに用いられる宿主の合成機構の酵素などを同時に利用して自分の蛋白を作ろうとするずるいウイルスであるからです。
カプシドは細胞内へ侵入する。ウイルスの細胞への侵入後、ウイルス粒子中のテグメントタンパク質であるUL41とVP16(αTIV)が細胞質へ放出される.UL41は宿主のmRNAを分解することによって宿主タンパク質の合成を阻害し,その代わりに自分自身のmRNAを作りやすくしてそのmRNAを用いて自分に必要なウイルスタンパク質をリボゾームで翻訳させて作らせるのです。VP16は核に運ばれる.
2.カプシドの核への運搬・脱殻。ヌクレオカプシドは核膜孔近傍に移動し、脱殻が起こり、核膜孔を通じてウイルスDNAを核内に放出される.カプシドは核膜孔まで運ばれ、ウイルスDNAを核に放出する。
3.ウイルスDNAの核への注入と環状化。ウイルスDNAは、細胞のRNAポリメラーゼを利用して、転写される。ウイルス特異タンパクは、α―β―γの順に合成される(cascade regulation)。これらのタンパクは抗原性があり、それぞれimmediate-early antigen(前初期抗原)、early antigen(初期抗原)およびlate antigen(後期抗原)とよばれる。α遺伝子は5個知られており、その転写は、タンパク質合成阻害剤存在下でも起こる。
4.α蛋白の生成。テグメントタンパク質であるVP16によりウイルスのα遺伝子群の転写が活性化される.核で合成されたウイルスmRNAは細胞質へ運ばれαタンパク質に翻訳される.αタンパク質は核に運ばれ,β,γ遺伝子の発現を制御するのです.
αタンパクは2~4時間でピークに達する、HSVビリオン(感染性をもつ完全な粒子)テグメント(エンペローブとヌクレオチドカプシドの間のタンパク)中のαTIV(VP16)はα遺伝子にトランスに作用し、α遺伝子の転写を促進する。トランスに作用するとは、「異なる分子の間で機能する」の意味である。対義語はシスで「同一分子の間で機能する」の意味です。一般に、「トランス」や「シス」は標的遺伝子に対してその発現に影響を与えるような、別の遺伝子もしくはその遺伝子発現の産物であるRNAまたはタンパク質を指す用語です。
5.β蛋白の生成。αタンパク質によってβ遺伝子群の発現が活性化され,βタンパク質が生成される.αタンパクはいずれも調節機能を持ち、β遺伝子を活性化、βタンパクの合成を促進する。β遺伝子の転写は、αタンパクの合成が先行する必要があり、βタンパクは感染後5~7時間でピークに達し、主に核酸代謝およびウイルスDNAの複製に関与する。β遺伝子にコードされるタンパクは、①DNAポリメラーゼなどDNA複製に必須なもの 、②チミジンキナーゼ(TK)、リボヌクレオチド・リダクターゼなどDNA合成に関与するが感染細胞の酵素でも代替できるものがある。①を欠く変異体は増殖できないが、②を欠く変異体は増殖中の宿主細胞では増殖できる。
6.ウイルスDNAの複製。免疫が低下すると感染細胞の複製分裂と歩調を合わせた増殖し始めます。βタンパク質群はウイルスDNAの複製に関与するタンパク質を多く含む.これらの作用によりウイルスDNAはローリングサイクル機構で複製され,中間体として巨大なコンカテマーを形成する.コンカテマーとは直鎖状多量体ともいう.短いゲノムDNAがいくつか直鎖状に連結したもの.ここで複製されるウイルスの子供であるビリオンは数百個から千数百個以上と言われています。
7.γ蛋白の生成。ウイルスDNAの複製が行われると,γ遺伝子群が発現する.γ遺伝子は、ビリオンを構成するγタンパクをコードしており、その発現にはαタンパクおよびβタンパクの合成とDNA複製が必要である。しかし、γタンパクには、gB、gDおよび主要カプシドタンパクなど感染初期および後期を通して合成されるものがある。
核内でウイルスDNAはむき出しにされエピソウムと言われる環状になります。免疫が上昇している限りは環状化したウイルスはプロウイルスとなってDNAに自分の遺伝子を組み込んで潜伏してしまうのです。プロウイルスとはherpesウイルスのDNAコピーが、細胞の染色体DNAに挿入されることでありプロウイルスは細胞の染色体DNAの一部として挙動するのです。
8.カプシドの形成。カプシドを構成するタンパクは、細胞質で合成され、核に移動し、核内でカプシドを形成する。ローリングサークル様式で複製したDNAはゲノム単位に切断され、カプシドにパッケージされてヌクレオカプシドが形成される。核内のヌクレオカプシドは核膜を破り一度核膜外腔に出た後、再び細胞質に侵入、テグメントを獲得し、ウイルス糖タンパクで修飾された細胞膜を最終的にエンペローブとして被り、空腔内に出芽、細胞外へ放出される。
9.ウイルスDNAのパッケージングとなります。ウイルスDNAのパッケージングとは何でしょうか?パッケージングとは、タンパク質から構成されるカプシド(被殻)にウイルスゲノムが詰め込まれてウイルス粒子となることです。カプシドを構成するタンパクは、細胞質で合成され、核に移動し、核内でカプシドを形成する。ローリングサークル様式で複製したDNAはゲノム単位に切断され、カプシドにパッケージされてヌクレオカプシドが形成される。核内のヌクレオカプシドは核膜を被り一度核膜外腔に出た後、再び細胞質に侵入、テグメントを獲得し、ウイルス糖タンパクで修飾された細胞膜を最終的にエンベロープとして被り、空胞内に出芽、細胞外へ放出されるのです。カプシド生成後,中間体であるコンカテマーがウイルスゲノムの大きさに開裂したウイルスDNAがカプシドへパッケージングされてヌクレオカプシドになる。ヌクレオカプシドとはウイルスの遺伝子を包む殻のことです。コンカテマーとは何でしょうか?コンカテマーは、直鎖状多量体ともいわれherpesウイルスの短いゲノムDNAがいつくか直鎖状の多量体に連結したものです。つまりコンカテマーは直列にリンクされた同じDNA配列の複数のコピーを含む長く連続したDNA分子なので直鎖状多量体と言われるのです。
10.核膜通過。ヌクレオカプシドは核膜内膜でいったん一次エンベロープを獲得することによって核内外膜間に出芽し,次に,一次エンベロープと核外膜が融合することによってヌクレオカプシドが細胞質に放出される.出芽とは何でしょうか? 細胞膜や核膜の表面に芽状の突起ができることです。成熟したウイルスや細胞外小胞が細胞外に放出されるときに形成されます。
11.テグメント獲得。その後,ヌクレオカプシドは細胞質でテグメントタンパク質を獲得し,12.エンベロープ獲得。細胞質内のトランスゴルジネットワークで最終エンベロープを獲得する.
13.出芽。最終エンベロープを獲得したウイルス粒子はエクソサイトーシスで細胞外へ放出される.
14.潜伏。局所のHSVは末梢神経の軸索を逆行して上向して,上の図でみられるように三叉神経節または脊髄後根神経節にまずは潜伏します。潜伏中のウイルスDNAはエピゾーム状に存在し,エピゾーム状態でもLAT遺伝子のみがLAT蛋白を転写できるのです。何故ならばLATは潜伏感染で唯一高発現している蛋白質であり抗アポトーシス作用を持っているので感染細胞と共にアポトーシスされて死んでしまうのは嫌なので潜伏感染でいつまでも抗アポトーシス作用を持っている裸の遺伝子であるエピゾーム状態でもLAT遺伝子のみがLAT蛋白を転写できるようにしているのです。herpesは細胞の中で潜伏状態でも生き延びることができるためにLAT蛋白だけを転写できるのです。
15.再活性化。ストレス等で免疫が下がると再活性化され増殖してウイルスは末梢神経の軸索を順行して下向し,局所で免疫に見つかり回帰発症を再び引き起こすのです。しかも免疫が落ち続けると長い時間をかけてあらゆる神経細胞のみならずあらゆる細胞に感染して癌細胞をも作ってしまう最も恐ろしいウイルスがヘルペスなのです。しかし世界中の医者は誰も口にしません。
ヘルペスウイルスに極めて特徴的なウイルス構造であるテグメントは何であり、どんな役割を持っているのでしょうか?また何故、必要なのでしょうか?herpesが細胞に感染するときエンベロープが細胞膜に融合し,カプシドが細胞内に侵入する際に,一部のテグメントタンパク質が細胞質に放出されます。テグメントタンパク質群は,カプシドとの位置関係から内側のインナーテグメントと外側のアウターテグメントに分類され,放出されるテグメントの多くはアウターテグメントである.放出されるテグメントタンパク質には,ヘルペスのの遺伝子の複製に必要な転写因子,核酸分解酵素,プロテインキナーゼ等が含まれており,これらは又効率的な潜伏感染成立に必要であるからです。
プロテインキナーゼ(protein kinase)とは特定の細胞内タンパク質にセリン・スレオニン・チロシン残基にATPのリン酸基転移を触媒する酵素です。リン酸化はそれを受けたタンパク質の酵素活性,局在,タンパク質間相互作用などを変化させることで細胞内のシグナル伝達・機能調節に重要な役割を果たしている。ヒトゲノム中には約530のプロテインキナーゼが存在します。
人の核内に注入されたウイルスDNAは遺伝子を裸にして環状化し,ウイルス遺伝子の転写がウイルスに必要な蛋白を作るために開始される.ウイルスの遺伝子は,その発現時期によって3群(α,β,γ)に大別され,それぞれの発現はカスケード状に制御されています。最初に発現するα遺伝子群のプロモーター領域には,VP16response‐elementとよばれる配列が共通に存在する。テグメントタンパク質として感染細胞に持ち込まれたVP16は,宿主転写因子Oct-1およびHCFと複合体を形成後,VP16response‐elementに結合してα遺伝子の発現を活性化するのです。このようなウイルスの働きは宿主の遺伝子も裸になって遺伝子を複製できる宿主自身の細胞分裂の時に行われるのです。
感染局所で増殖したHSVはエンベロープと知覚神経アクソン(神経軸索)末端の細胞膜を融合させることによってカプシドをアクソン(神経軸索)内に侵入させる.カプシドはアクソン(神経軸索)内を逆行性輸送され,神経節内の神経細胞体に到達して宿主の免役に見つからないように潜伏感染するために脊髄後根神経節の神経細胞体に隠れ続けるのです。宿主の免疫が落ちたときに増殖するのです。逆行性輸送される際の機構は,herpesが増殖する時におけるカプシドを宿主の核への輸送に類似しており,カプシドに付着しているインナー・テグメント群が宿主細胞のモータータンパク質であるダイニンおよびそのコファクターであるダイナクチンと相互作用することによって微小管の中を輸送されるのです。コファクターは補因子と訳され、酵素の触媒活性に必要なタンパク質以外の化学物質であり補助分子とも呼ばれます。微小管とは,細胞骨格を形成するタンパク質フィラメントであり,細胞分裂時の紡錘体や細胞内の物質輸送のレールとして機能している.
カプシドは162個のカプソマー(カプソメア)によって構成される。カプソマーはカプソメア(capsomere)とも読み、ウイルスの遺伝物質を保護するタンパク質の外被であるカプシドの小さなタンパク質の構成単位です。構造を持つ(カプソマー)が多数組み合わさって構成されている。
エンベロープの表面にある突起はウイルスタンパク質からでき、宿主細胞への吸着・侵入のための役割と抗体や補体によって不活性化されることに対する抵抗性の役割をもつ。このヘルペスウイルスのゲノムは線状2本鎖DNAで、分子量は80~160×106ダルトン(1ダルトンは1.661×10-27キログラム)、GC含量は35~75%(種によって異なる)である。ダルトンとは何でしょうか?分子や原子の質量の単位で、 炭素の同位体元素12Cの1原子の質量の12分の1である。 数値的には分子量に等しいが、分子量は1モル(mol)あたりの相対質量で無名数であるのに対し、ダルトンは“分子1個の質量”を表すのに使う。タンパク質などの巨大分子で,厳密な分子量が求めにくいものの大きさ(molecular mass)をいうときの単位がダルトンであり,Daと表示する.Daは分子量の単位ではない。GC含量は35~75%(種によって異なる)である。GC含量とは何でしょうか?DNAは,通常2本鎖を形成しており,その2本鎖は塩基配列が相補的で,Watson-Crick塩基対の規則どおり,アデニン(A)対チミン(T),グアニン(G)対シトシン(C)の対を水素結合で作っています。その原理に従えば,AとT,GとCのモル比はともに1:1であるから,DNAのプリン塩基であるアデニン(A)とグアニン(G)、ピリミジン塩基であるチミン(T)とシトシン(C)はつねに等しく存在していることが明らかである.したがって,個々の生物のDNAの化学組成は,(G+C)のモル百分率(または単にGC含量ということがある)によって特徴づけられます.高等植物や動物はすべてDNA中のGC含量が大きいが,ウイルスや細菌,下等植物では必ずしもそうではない.これらのGC含量は分類学上関係が深い生物ではよく似ている.
細胞への感染は、エンベロープ表面にある糖タンパク質が、宿主細胞表面のレセプター(受容体)と結合することにより吸着、さらにエンベロープと宿主細胞膜との融合がおこり、細脂質内に侵入し、脱殻する。カプシドはさらに宿主の核に近づき、核膜孔から、ウイルスDNAが核内に放出され核内でのウイルスDNAは環状(エピソーム)と言われる裸の遺伝子となり、このチャンスに時に宿主の遺伝子に侵入してプロ遺伝子として細胞に見つからないように宿主の遺伝子に隠れてしまうのです。宿主のRNAポリメラーゼによって、ゲノム特定部位から転写が開始され、ウイルスタンパク質の合成と、ウイルスDNAの合成が行われる。カプシドの形成も核内で行われる。Herpesウイルスは自分のDNAの合成をするために宿主のRNAポリメラーゼを利用せざるを得ないので宿主に感染して初めて自分のDNAの合成やウイルスタンパク質の合成ができるのです。
宿主がステロイドを使って免役が落ちている時には通常は宿主細胞内においてエンベロープが構成されると、次の細胞に感染するために細胞外に出ていきます。なお、宿主のRNAポリメラーゼには二種類あり(1)DNA鋳型からのRNA(リボ核酸)形成を触媒する酵素であるDNA依存性RNAポリメラーゼと、(2)RNA鋳型からのRNA形成を触媒する酵素であるRNA依存性RNAポリメラーゼがある。
次に、それぞれのherpesの性質の違いを下記に示します。
『1』単純ヘルペスウイルス1型、2型(Herpes simplex virus type1、2)(別名Human herpesvirus1、2) この二つのウイルスは、遺伝子構成はほとんど同一であるが免疫学的性状が異なる。1型は主に口唇や眼、2型は陰部に感染し、病巣をつくる。このウイルスは両者とも神経向性で神経系に向かって動いて感染する特性がある。まず、口腔、眼や陰部などの粘膜や微小の傷口などの皮膚を介して感染し、ここで増殖(局所増殖)して子供のビリオンを増やして、さらに知覚神経末端へと移動し又知覚神経末端で増殖してビリオンを増やすのです。次に三叉神経節や脊椎後根神経節へと移動し、この後根神経節の神経細胞の細胞体に潜伏感染し、じっと隠れ続けるのです。ストレスなどで免疫が下がると再活性化reactivationし増殖して、末梢神経組織を経て免疫細胞に見つかると炎症が起こり病巣を形成する。これを回帰発症recurrenceとよぶ。回帰性感染を誘発する免疫を上げる刺激は感冒、普通の日光の紫外線、月経などがある。次に単純ヘルペスによる炎症の病名を下に羅列します。
(1)口唇ヘルペス 唇の周辺に小疱ができ、数日後に痂皮(かひ)(かさぶた)状態となる。数日にして治癒、病班は残ることはない。三叉神経節に潜伏し、回帰発症をくり返す。
(2)ヘルペス脳炎 国内では年間200例程度で病例は多いとはいえないが、致命率が高く、後遺障害が厳しいのできわめて注意すべき重要な疾患である。治療は抗ヘルペス薬が使用されているが、よりよい抗ヘルペス薬のソリブジンが最高ですが製薬メーカーは何故か製造しません。不思議ですね。ソリブジンについてはここを読んでください。
(3)角膜ヘルペス 失明の原因となる重大な疾患である。三叉神経節に潜伏し、回帰的に再発、再々発をくり返し、失明へと至ることが多い。
(4)性器ヘルペス 性的接触によって感染する代表的なウイルスのひとつ。発症は性器および、陰部です。回帰性で再発頻度が大変高いのですがアシクロビル軟膏を塗り同時にアシクロビルを飲めば治ってしまいます。完治はなかなか難しいといわれているのは保険で八日以上使わせないからです。過去においてはHSV-2によるものが大部分であったが、現在はHSV-1が半数となっている。この疾患の流行が性風俗や性習慣が悪化するとよく見られます。1970年ころから性道徳が崩壊し始めたので、急速な増加傾向にある。
(5)その他 HSV-1、HSV-2は癌患者でよく見られます。というのは現在の癌の治療はすべて免疫を抑えることでありかつ、臓器移植患者にも拒絶反応を起こさないためにステロイドを使うのでその間にherpesや他の弱い病原体も増え続けるのでステロイドを止めると再び免疫が高まりherpesや増えた弱い病原体との戦いが始まり、日和見感染してしまうことになるのです。日和見感染とは何でしょうか?免疫が正常である宿主に対しては病原性を発揮しない病原体が、ステロイド治療をやっている宿主はherpesに対して免役力が弱っている時にherpesが増殖します。やめた後に免疫が回復すると再び増えたherpesを見つけた免疫が戦いを始めることで症状が出ることです。この場合、皮膚や粘膜だけではなく、食道、肺臓、肝臓にherpesが増えていくので病変をおこすことがある。末梢顔面神経麻痺の多くが免疫が押さえられたが故に顔面神経に増えたHSV-1の再活性化による疾患であることが証明されているのですが世界の医学会は反対のことを書いています。残念です。再活性化の「活性化」の言葉の意味を正確に伝えていないのです。再活性化は医者が間違った免疫を抑えるという治療の結果なのです。ヘルペスを再活性化させたのは医者が免疫を抑える薬を使ったからです。癌の原因もherpesなのです。癌についてはここを読んでください。
『2』水痘・帯状疱疹ウイルス(VZV) VZVはHSVと類似点は多いが、VZVはHSVに比べて宿主細胞への結合度が強い。感染宿主は、年齢などの条件があり、範囲が広くはない。潜伏部位は知覚神経の、おもに神経細胞周囲の外套(がいとう)細胞です。外套細胞は、衛星細胞とも呼ばれますが、神経節膠細胞(ganglional gliocyte)のことであり脊髄神経節および自律神経系神経節の神経細胞体を取り囲む細胞です。神経節膠細胞は神経細胞ではなく神経細胞体への栄養供給および神経細胞体をherpesから保護する機能を有する星状膠細胞や希突起膠細胞なのです。
この VZVは免疫が下がると神経節で増殖して仲間を増やしてから神経束のシュワン細胞に感染し,神経損傷を起こしながら下行して皮膚に至るので,神経節の神経支配領域に沿った皮膚病変、つまり、皮膚分節(デルマトーム)に沿った病変を形成します。デルマトーム(dermatomes,皮膚分節)とは,感覚求心路が単一の後根神経節,後根,脊髄分節に入っていく決まった皮膚領域のことです。皮膚感覚はデルマトームに沿って分節状配置をしているために,感覚異常の分布状況を知ることは,反射異常と筋力低下の状況を知ることとともに,脊椎脊髄疾患における病巣の部位の高さを診断するのに有用です。
神経束は神経周膜や神経上膜に包まれているので,herpesウイルスが免疫にさらされるのは皮膚に至ってからです。小児の水痘ウイルスと帯状疱疹とは同じウイルスです。成人の水痘ウイルスと帯状疱疹も同じ英語でvaricella zoster virus略してVZVであり日本語で水痘帯状疱疹ウイルスという単一の水痘帯状ヘルペスウイルスなのです。
それでは何故同じ単一のherpesウイルスであるのに水痘帯状疱疹ウイルスに感染すると水痘(水ぼうそう)と帯状疱疹の二つの違った症状が同時に出なくて別々出るのかを考察しましょう。子供に皮膚から感染した水痘(水ぼうそう)ウイルスは皮膚の細胞に感染してすぐに増殖して免役のナチュラルキラー細胞(NK細胞)に見つかれば細胞もろとも殺され水分の多い皮膚の細胞の破壊により下ろされてしまい水痘(水ぼうそう)が水痘帯状疱疹ウイルス(VZV)の初感染の症状として現れます。ところが、皮膚や粘膜から初感染した後に免疫に見つからなかったVZVは、神経線維(神経軸索)順行してデルマトームに沿って31対ある脊髄後根感覚神経節に潜伏感染し、宿主は長期間、無症状に過ごします。しかし31対もある脊髄後根神経節に隠れ住んでいたVZVは、医療で免疫を抑えるステロイドを飲まされたり、仕事や人間関係でストレスが強くなるたびに、免疫低下が起こると、潜伏感染していたVZVが脊髄後根神経節で増殖して数多くの子供のビリオンヘルペスウイルスが、脊髄後根神経節から脊髄神経から新たなる感覚神経に感染する時に免疫に見つけられて戦いとなり、炎症が生じて潜伏していた脊髄後根神経節の感覚神経の支配領域に限局して疾患を起こしたものが帯状疱疹となるのです。31対ある脊髄後根神経節の支配神経の隠れ住んでいた神経だけに帯状疱疹がでるのです。
下図を見ながら説明します。脊髄神経節(後根神経節)は,脊髄神経の領域では,運動神経である前根と感覚神経である後根が合一して脊髄神経が形成されるところよりも,少々中枢側で後根の途中に存在しています。したがって,それぞれ左右にある31対の脊髄神経に対応して1個の感覚神経の神経節である脊髄神経節(後根神経節)があり,これらを脊髄神経節(spinal ganglion)または後根神経節(dorsal root ganglion)といいます。感覚神経節は求心性神経繊維を中枢神経系に送るニューロンの細胞体の集合ですから,12対の脳神経の領域でも求心性神経繊維を含む脳神経にも感覚神経節があります。脳神経の感覚神経節には①三叉神経節、②膝神経節、③前庭神経節、④らせん神経節、舌咽神経の⑤上神経節と⑥下神経節、迷走神経の⑦上神経節と⑧下神経節、脊髄後根神経節が含まれる。膝神経節(geniculate ganglion)は頭頸部にある顔面神経の神経節。
因みに①の三叉神経では後根神経節(dorsal root ganglion略してDRG)にあたるのがガッセル神経節で三叉神経が三本の枝に分かれる前の大元の部分がガッセル神経節でペインクリニックではブロック注射をします。三叉神経節で三叉神経の感覚神経の細胞体が集まっている部分で、眼神経・上顎神経・下顎神経に分岐する。
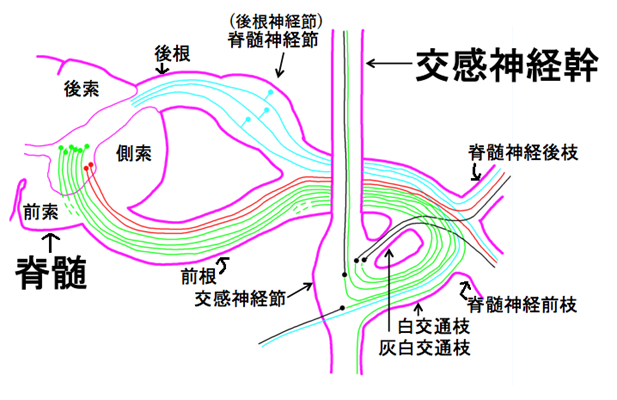
上図に、脊髄神経の構成を示します。
青:求心性感覚神経(体性、内臓性)
赤:体性遠心性運動神経
緑:交感神経節前線維
黒:交感神経節後線維
脊髄神経は脊髄から伸びる各々数本の後根と前根が合流して一本の束となって椎間孔を通り脊柱管の外に出ます。上図を見ればわかるように青色の脊髄神経節を通る後根の青色の求心性感覚神経(体性、臓性)は脊髄神経後枝から青色の求心性感覚神経(体性、臓性)と赤色の体性遠心性運動神経と黒色の交感神経節後線維と一緒に末梢に出ていきます。つまり脊髄神経後枝からも脊髄神経前肢からも三種類の青:求心性感覚神経(体性、内臓性)も赤:体性遠心性運動神経も黒:交感神経節後線維がでていきます。ただ一つ緑:交感神経節前線維は交感神経幹にある交感神経節で交感神経節後線維とシナプスしてしまうので交感神経幹から末梢に出る必要がないのです。他方、交感神経節後線維は交感神経節から末梢に出ていかないと仕事が出来ませんので脊髄神経前肢と脊髄神経後枝の二つの枝から脊髄から離れて末梢へと出ていくのです。
一方前根の赤色の体性遠心性運動神経は脊髄神経前肢から赤色の体性遠心性運動神経と黒色の交感神経節後線維と青色の求心性感覚神経(体性、内臓性)の三つが一緒に末梢に出ていくのです。
交感神経が通る道は白交通枝と灰白交通枝です。白交通枝の白は交感神経の節前線維が多いので白く見えるので白交通枝と名付けられました。つまり交感神経の節前線維は有髄性であるので髄鞘に覆われています。髄鞘は脂質が多いので白く見えるので白交通枝といわれます。従って交感神経節前線維の枝となります。一方、交感神経の節後繊維は無髄性であるので髄鞘がないので白く見えないので灰白交通枝の灰白が付くのです。つまり節後繊維の軸索の成分は神経細胞体とよく似た成分であるから灰白に見えるのです。
上の図で見逃しやすい一番大事な点は体性遠心性運動神経は脊髄神経後枝からも脊髄神経前肢からも出て行っていることです。従って31対の各々の脊髄神経は後根からは感覚神経だけが出て椎間孔を通り、前根からは運動神経だけが椎間孔を通り脊柱管の外に出ていくのですが皮膚分節(デルマトーム)に沿った神経支配は感覚神経も運動神経も交感神経も同時に行われているのです。デルマトームとは、デルマトームを日本語では皮膚分節知覚帯といいます。短く皮膚分節と訳されるように脊髄神経が支配する皮膚感覚の領域のことですが、実際に痛みや痺れや運動障害や交感神経症状が生じている部位から、どの脊髄の部位からの脊髄神経が障害されているのもわかるのです。
だからこそ皮膚感覚も運動感覚も自律神経の交感神経もデルマトームに沿って分節状配置をしているために,これらのデルマトームの神経の異常の分布状況を知ることは,感覚異常や反射異常と筋力低下の状況を知ることとともに,脊椎脊髄疾患における病巣の脊髄の部位の高さをも診断することができるのです。反射とは,意識をしないで筋肉(骨格筋・平滑筋)などに反応を引き起こすことをいいます。
デルマトーム(Dermatome)をもっと詳しく理解するためには、もう少し「脊髄神経」について復習しましょう。脊髄神経は、脊椎の椎間孔から1対ずつ出ています。頸椎の間から出ているのが頸神経(8対)、胸椎の間から出ているのが胸神経(12対)、腰椎の間から出ているのが腰神経(5対)、仙椎から出ているのが仙骨神経(5対)、第1尾椎と第2尾椎の間から出ているのが尾骨神経(1対)です。
それぞれの神経の頭文字をとって、頚神経(cervical nerve)=C、胸神経(thoracic nerve)=T、腰神経(lumbar nerve)=L、仙骨神経(sacral nerve)=S、尾骨神経(coccygeal nerve)=Coと表記されます。このアルファベットに神経の番号を付けるとデルマトームの図の中でよく見るアルファベットと番号になります。
C1〜C8(第1頚神経〜第8頚神経)
T1〜T12(第1胸神経〜第12胸神経)
L1〜L5(第1腰神経〜第5腰神経)
S1〜S5(第1仙骨神経〜第5仙骨神経)
上記のようになり、どの神経がどこの皮膚感覚の領域を支配しているのかは、覚えるしかありません。がんばりましょう!
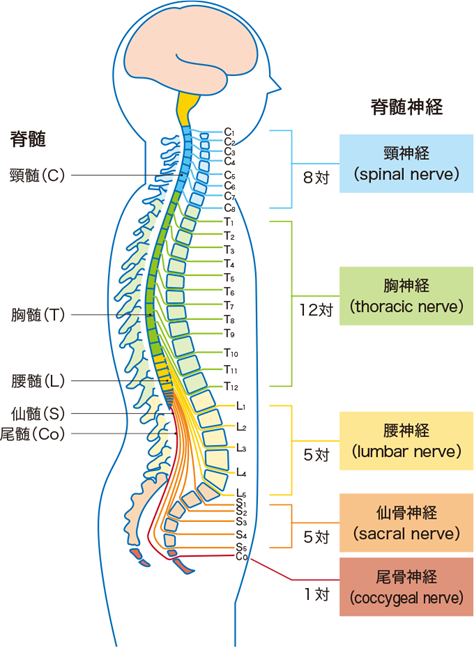
それぞれの神経の頭文字をとって、頚神経(cervical nerve)=C、胸神経(thoracic nerve)=T、腰神経(lumbar nerve)=L、仙骨神経(sacral nerve)=S、尾骨神経(coccygeal nerve)=Coと表記されます。このアルファベットに神経の番号を付けると次のように31対の脊髄神経を上から8対の頸神経、12対の胸神経、5対の腰神経、5対の仙骨神経、最後は1対の鼻骨神経の合計、31対の脊髄神経となります。
C1〜C8(第1頚神経〜第8頚神経)
T1〜T12(第1胸神経〜第12胸神経)
L1〜L5(第1腰神経〜第5腰神経)
S1〜S5(第1仙骨神経〜第5仙骨神経)
下記の、腹側と背中側の2枚のデルマトーム(皮膚分節知覚帯)の図で示すようにアルファベットの頭文字と数のC2からL5までの番号が付きます。C1の分節はどこにも表示されていませんでした。
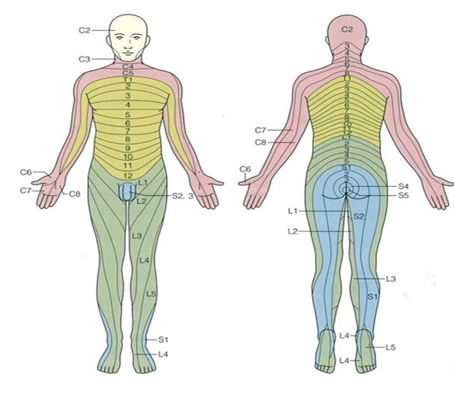
夜になるとどんな痛みでも強くなるのは何故でしょうか?
夜になるとコルチゾールの量が減少するので、炎症を抑制する力が低下するため、痛みを感じやすくなってしまうからです。 そのために、夜中になると歯痛をはじめとして、頭痛や腰痛、肩の痛み、手足の痛みや痺れなどを強く感じてしまい、なかなか眠れないということになるのです。 コルチゾールの分泌は朝にピークを迎え、その後昼になるにつれて徐々に減少していくので夜になると免疫が抑制されなくなるので再び痛みが強くなります。
痺れ感(NUMBNESS)や麻痺(PARALYSIS)を感ずる知覚受容体は無いのに何故、どのようにしびれ感を感じるのか?しかも器質的な病気がないにもかかわらずまた明確な原因がわからないのにどうして起こるのかの真実の理由を語りましょう。
しびれ感と麻痺の医学的な定義はありません。しびれとは、感覚の部分的な、または完全な消失であり、しばしば、チクチク感などの異常な感覚を伴います。 しびれには多くの原因があり、皮膚の感覚受容器から脳へと至る経路のどこかが機能しなくなると、しびれが発生します。 警戒すべき徴候 これは感覚神経系の機能不全の症状である可能性があります。このようにしびれ感は感覚神経に力点を置いた医学用語です。
麻痺とは、神経又は筋肉組織の損傷、疾病等により、筋肉の随意的な運動機能が低下又は消失した状況です。つまり、脳や脊髄(せきずい)から末梢神経までの運動神経や筋肉のどこかに障害が起こり、動かそうと思っても体の一部(もしくは全部)が思い通りに動かないことです。麻痺とは筋力の低下により、体がうまく動かせなく事をいいます。麻痺と言う言葉は運動や運動神経に力点を置いた医学用語です。
しびれとは皮膚の感覚の低下やビリビリする痛み等、異常な知覚を指します。脳は脊髄と神経を通じて筋肉に命令を出し、皮膚からの感覚を受け取ります。このため、この経路のどこかに問題があると麻痺や痺れが生じるのですがこの痺れや麻痺を感じとる受容体は人体のどこにも存在しないので不思議な現象ですね。しかし麻痺のほうが痺れよりも症状が強いようですが、しびれも麻痺も起こる原因は実はいずれもherpesなのです。
脊髄の椎間孔から出ていく31対の各々の脊髄神経は後根からは感覚神経だけが出て椎間孔を通り、前根からは運動神経だけが椎間孔を通り脊柱管の外に出ていくのですが皮膚分節(デルマトーム)に沿った人体の部位だけに出ていく神経は感覚神経も運動神経も交感神経の三つとも一緒に束になって末梢の隅々出ていきます。デルマトームとは、デルマトームを日本語では皮膚分節知覚帯といいますが実はこの言い方は適切ではないのです。正しくは皮膚分節知覚帯・運動帯・自律神経交感神経帯と言うべきなのです。
長すぎるので短く皮膚分節と言われることも有るのですが脊髄神経の感覚神経が支配する皮膚感覚が一番敏感ですぐに分かり易い感覚なので皮膚分節知覚帯と言われるようになったのです。実際に痛みや痺れや運動障害や交感神経障害症状が生じる不明な原因はすべてがヘルペス感染によるものなのです。なぜならば脊髄から出ていく三つの神経がヘルペスに感染させられるのは交感神経幹の神経節に人体の中で最大量のherpesが潜伏感染をして最高の隠れ場所として利用しているからです。そのために交感神経幹の神経節にいるときに交感神経に感染したヘルペスは感覚神経と運動神経と一緒に束になって末梢へ出ていくときにこの二つの神経にもherpesを感染させてしまいherpesのために三つの混合神経が同時に傷つき異様な症状が出てしまいそれを痺れ、麻痺として脳は認知してしまうのです。実際に痛みや痺れや運動障害や交感神経症状が生じてしまっているからなのです。どの脊髄の部位から出てきたかを知ることのよって、どの部位の交感神経幹の神経節に感染したherpesが交感神経と感覚神経と運動神経もの三つとも一緒に束になって末梢の部位において脊髄神経が障害されているのもわかるのです。
しかし麻痺のほうが痺れよりも症状が強いようです。しびれも麻痺も起こる原因は実は同じなのです。
脊椎損傷は重症になり何故治りにくいのか?
その理由は、脊髄も脳から末梢に行く中枢神経の束で、脊髄損傷により中にある脊髄神経も傷ついてしまうので傷ついた中枢神経を再生する方法がないからです。
トリガーポイントとは何でしょうか?
体内にある痛みを感じるためセンサーが、異常をきたし常に痛みを感じるようになってしまったポイントで、引き金という意味を持つ「トリガー(Trigger)」と「点」という意味を持つ「ポイント(Point)」の合成語で、日本では古くから「発痛点」と呼ばれました。身体の約200対に及ぶ筋肉の、筋組織内部の結節(しこり)に存在し、指圧刺激で鋭く身体の深部に感じる痛みを発する引き金となる限局性のポイントです。「体内にある痛みを感じるためセンサーが、異常をきたし常に痛みを感じるようになってしまったポイント」です。原因はやはりヘルペスです。皮膚表面にもありますが、身体の中、ファシアや筋膜などにも備わっています。時にそのセンサーが過敏になり、ちょっとした刺激や冷えでも痛みを感じるようになったり、ひどい場合には、刺激がなくても常に痛みを感じるようになることがあります。
ファシア(Fascia)とは何でしょうか?「膜」のことであり、臓器、骨、筋肉、脂肪、靭帯、血管、神経などの組織を覆う膜の総称です。「筋膜」もファシアの一つです。 ファシアはすべての組織同士を分割し、かつ連結させています。つまり全身の臓器を囲むファシア(Fascia)にはヘルペスが感染可能であるので痛みはどこでも起こりうるのです。
ファシアや筋膜は繰り返し動作により、ストレスがかかり同じ箇所が擦れ合いherpesが増えて靴擦れと同じような状況になってしまい、一定の動作で痛みやシビレを発し、ひどくなると安静時にも感じるようになってしまいます。ストレスがかかりやすくヘルペスが感染しやすいファシア・筋膜がトリガーポイントになるのです。前腕にストレスがかかったトリガーポイントが形成されると、肘や手首に痛みや痺れなどの症状が出るのも上で説明したように皮膚分節知覚帯・運動帯・自律神経交感神経帯のすべての運動神経や知覚神経に交感神経を通じてherpesが感染したためです。herpesが感染した知覚神経の一本一本にはすべてにポリモーダルの中自由神経終末があるのでヘルペスが感染すると多かれ少なかれ大脳の感覚野で痛みとして伝わるのです。古来から人間の病気は感染症から始まり感染症で終わるはずであったのですがそうはいきません。癌もherpes感染症ですから人類を滅亡させるまで人類はherpesで悩み続けるでしょう。癌についてはここを読んでください。
血流障害ではなくherpesが原因でトリガーポイントが生まれるのです。
もうひとつ、血流障害ではなくherpesが原因のトリガーポイントについては、霜焼けを思い出してください。霜焼けは、寒さによって免疫が落ちてherpesがもともと多い人は元々herpesが多い人だけが寒さを避けて免疫が戻ると局所的にherpesと免疫の戦いが始まるのでかゆみや腫れが起きるのです。現代の標準医学がすべて間違っているのは症状は命の守護人である免疫がヘルペスと闘っているから症状が出るので喜ぶべきなのですが反対のことをやっているので病気が治らないのです。アメリカ医学をやればお金は責任を取らずして永遠に稼げますものね!!!アッハッハ!!!
「関連痛」とは? トリガーポイントとは異なる別の部位の痛みを同時に感ずるので元の主なる痛みに関連がある痛みというのですが何故、関連痛が出るのでしょうか?
例えば筋膜トリガーポイントの周辺では、ヘルペスがたむろしていますので、先ほどすでに述べたように脊髄から出ていく皮膚分節知覚神経・運動神経・自律神経交感神経のすべてに交感神経を通じてherpesが感染しているうえに、herpesが感染した知覚神経の一本一本にはすべてにポリモーダルの自由神経終末があるので何本かの知覚神経にも距離を隔ててヘルペスが感染しているので多かれ少なかれ大脳の感覚野にすべて痛みとして伝わります。それが関連痛なのです。言い換えれば局所的なヘルペスの炎症により痛覚関連物質(痛みを感じさせる物質)が放出され、ポリモーダル自由神経終末という人体の全身の組織に存在する侵害受容器と言われる痛みのセンサーがそれらに反応することで痛みが発生するだけです。
ポリモーダル―ダル自由神経終末とは何でしょう。herpesに感染した組織が免疫と闘うときに生じる損傷により炎症メディエーターがポリモーダル受容器を刺激する。炎症性メディエーター(Inflammatory mediator)とは、体内で炎症反応を起こしたり維持したりする内因性の物質の総称である。炎症性メディエーターには、低分子化合物としては①ヒスタミン、②セロトニン、③プロスタグランジン、④ロイコトリエンなどがあり、高分子ペプチド性物質やタンパク質としては①ブラジキニン、②サブスタンスP、③カルシトニン遺伝子関連ペプチド(CGRP)、④補体制御因子、⑤サイトカインなどがある。補体制御因子にはCD55(decay-accelerating factor, DAF)とCD59(membrane inhibitor of reactive lysis: MIRL)とC1 inhibitor(C1-INHインヒビター)とCD46の四つが、血清中、または細胞膜上には、補体系を抑制する制御因子が存在します。細胞膜上で機能するCD46やCD55はC3 転換酵素を解離・失活させ、CD59はC5b~C8と結合し、C9の重合を阻害することによりMACの形成を阻害します。これらの膜タンパク質は、体内のほとんどすべての細胞に存在し、補体による侵襲が自己細胞に向かないようにコントロールしています。C1インヒビターはC1エステラーゼインヒビターとも言いその役割は,活性化補体第1成分のほか,Hageman因子(XⅡa),カリクレイン,プラスミン,トリプシンなど,各種蛋白酵素の作用を阻害し,補体系,凝固系,カリクレイン系の働きを調節する中心的役割を持っています。
炎症性メディエーターによる作用には、特に、白血球の走化性誘導、肥満細胞や好塩基球の増殖や脱顆粒など、免疫系の細胞に対する作用が含まれる。また、浮腫形成に伴う血管への影響(拡張や透過性の増加など)を示し、発熱の調節にも中心的な役割を果たしている。ポリモーダル受容器は中枢に情報を伝えるだけでなく末梢性にサブスタンス Pやカルシトニン遺伝子関連ペプチド(C G R P)などを放出する神経軸索反射が見られ、この神経軸索反射がまた炎症反応に直接に関与します。
医学的治療では、これらの炎症反応を消炎鎮痛剤などの薬物の使用によって抑える場合が多いが治療としては間違いです。非ステロイド性消炎鎮痛剤は P G(プロスタグランディン)合成に必要な酵素を阻害することで P G産生を抑える働きを持っています。
一方、鍼師が実施している温熱療法や徒手療法などは鍼療法と同様にむしろ炎症反応を円滑に進め治癒を促進させているので免疫を上げているので正しい治療なのです。この正しい鍼治療を保険収載しないのは不思議です。
因みに数多くの代替医療の中で一時的にも効果があると言われる代替医療は実行している間に心のストレスが軽減できるので免疫が押さえられないどころかむしろ免疫を上げてherpesとの戦いで生ずる炎症反応を円滑に進め治癒を促進させているので正しい治療なのです。さらに代替医療を一次的ではなく継続すればherpesを殺すことはできませんが抑え込むだけで病気は治るのです。
そのようなストレスを減らすことが出来る代替医療には鍼療法、整体、お灸などの温熱療法、徒手療法、指圧、気功、アロマセラピー、マッサージ、心理療法、座禅、ヨガ、瞑想、温泉療法、アーユルヴェーダなどは免疫を上昇させherpesとの戦いによる炎症反応を円滑に進めherpesを神経節に押し込めば戦いが終わり免疫を上げて治癒を促進させることになるので正しい治療なのです。漢方を欧米の白人は代替医療に入れたがりますが漢方こそ免疫を上げる唯一の生薬であることに気が付いていないのです。残念です。
神経軸索反射とは何でしょうか?ポリモーダル―ダル自由神経終末における侵害刺激により情報を求心性に伝達する一方で、神経軸索(神経線維)の他の分枝に逆行性に興奮が伝わり、軸索の終末部からサブスタンス Pやカルシトニン遺伝子関連ペプチド(CGRP)、血管作動性腸管ペプチド(Vasoactive intestinal peptide略してVIP)などが放出される。これらは付近の血管に作用し、血管拡張や血管透過性を高めます。痛みの「発生源」は主に「痛みの引き金になる点」である「トリガーポイント」で、また、その「トリガーポイント」が引き起こすトリガーポイントとは異なる部位に発生する痛みのことを「関連痛」といいますがherpesのみならず神経軸索反射によるものもあるのです。
神経障害性疼痛とは何ですか?
神経障害性疼痛とは、ヘルペスによる神経に起こる炎症性神経性疼痛です。 病気の名前としては、どの神経でherpesと免疫が戦っているかで、三叉神経痛や腰痛症、頸椎症、帯状疱疹後に傷が残っている神経痛(帯状疱疹後痛)、坐骨神経痛などがあります。神経圧迫で痛みは出ませんので背部痛や頸部痛、異常な感覚、筋力低下、排尿障害、排便障害などはすべて皮膚分節知覚帯・運動帯・自律神経交感神経帯にあるすべての運動神経や知覚神経や自律神経交感神経ヘルペスが感染したためです。神経にherpesが感染したがるのは人体の何百とある神経節が最高の隠れ家になるからです。これらの三つの神経にherpesが感染するまえにherpesが隠れていたのは交感神経幹の31対の神経節であります。この交感神経幹の31対の神経節に隠れている間にherpesは交感神経にこっそり感染します。脊髄から末梢神経に出ていくときには脊髄運動神経は前根から出ていき末梢の感覚神経は後根から出ていき最後の交感神経は交感神経枝から出ていきます。最後の最後は末梢に出る時には三つの異なった神経は合流して三つともすでに説明したように前肢と後肢の二つのルートから脊髄から離れて末梢の隅々までくまなく広がっていくのです。
神経が圧迫される病気は無いのです。しかも圧迫痛と言う痛みは存在しないのです。何故ならば圧覚と言う感覚受容器は存在しないからです。つまり圧痛と言う感覚は無いのですが整形外科では嘘を付きまくっています。残念ですね。痛みはすべてherpesが原因です。
「神経が圧迫されるとどうなる?」という質問は愚門です。何故ならば神経は「豆腐」のような柔らかい組織でできているので圧迫感さえ感ずることはないのです。神経・血管圧迫症候群もそもそもあり得ない病気です。神経が血管を圧迫したり、逆に流体である血液が神経を圧迫することもないからです。すべて嘘八百です。しかも神経・圧迫症候群には顔面けいれん、三叉神経痛、舌咽神経痛、痙性斜頚、動眼神経麻痺などがあると医者は嘘を付いていますがすべて正しい病名はherpes性神経炎です。動眼神経とは何ですか?動眼神経(oculomotor nerve)は、12対ある脳神経の一つで、第III脳神経とも呼ばれる。動眼神経は外側直筋と上斜筋の二つ以外の残りの内直筋、外直筋、上直筋、下斜筋の4種類を支配している眼球運動神経です。また瞳孔収縮や水晶体 (レンズ) の厚みの調節も行う。それでは動眼神経麻痺の3症状は?動眼神経は運動神経ですからherpesで動眼神経が障害されると①散瞳②眼瞼下垂③眼球運動障害の3つの症状が出現します。
腰部脊柱管狭窄症は無い。正しい病名はherpes性腰部神経根炎です。腰から脚にかけての痛み、馬尾だと両脚の広い範囲のしびれや脱力感、脚や会陰部の異常感覚、頻尿や便秘などの排尿・排便障害といった症状が出ます。herpes性腰部神経根炎 の特徴的な症状として、間欠性跛行(はこう)があります。 長時間連続で歩くと、脚に痛みが走ったり、ふくらはぎが重く脚が前に進まなくなったりします。
脊椎には「体を支える」「神経を守る」という二つの大きな働きがあり、脊柱管(背骨の管)が首から脚につながる神経を守っています。正常なら余裕がある脊柱管内の空間が何らかの原因で狭くなり、神経が圧迫されて脚のしびれや痛み、筋力低下を起こすと言われていますが骨からできている脊柱管は決して狭窄することはありません。「何らかの原因で」と言われる病気はすべてherpesが原因です。
神経がヘルペスで炎症が起こる場所により、herpes性神経根炎か胸髄症です。胸髄症とはherpesが原因で胸髄の神経に炎症が起こるからです。胸髄と腰髄から出る自律神経は交感神経節前神経と言い、中脳・延髄および仙髄から出る神経を副交感神経という。
腰部脊柱管狭窄症は加齢に伴い発症するケースが多く、腰椎の変形で脊柱管内にある神経根や馬尾という神経が圧迫されて起こります。圧迫部位が神経根だと腰から脚にかけての痛み、馬尾だと両脚の広い範囲のしびれや脱力感、脚や会陰部の異常感覚、頻尿や便秘などの排尿・排便障害といった症状が出ます。
特徴的な症状として、間欠性跛行(はこう)があります。長時間連続で歩くと、脚に痛みが走ったり、ふくらはぎが重く脚が前に進まなくなったりします。こうした症状は立ち止まってしゃがむ、前かがみになるなどの姿勢をとることで一時的に良くなります。
胸髄症は、胸椎の脊柱管が椎間板ヘルニアや靭帯(じんたい)骨化症(後縦靭帯骨化、黄色靭帯骨化)、腫瘍などで狭くなり、脊髄を圧迫することで起こるのでなくherpesが脊髄神経の前根と後根に感染して免役を下げ過ぎてherpesが前根と後根の周辺で炎症を起こしたからです。脊柱管は脊椎のことであり、あの頑丈な脊椎が狭くなるなどと言う絶対にあり得ないことを言い続けて嘘を付きまくって不必要な手術をして無責任にお金を儲けているのです。主な症状は、脚がしびれる、立ったり、歩いたりすると脚がもつれる、下り坂を歩くのが怖いなどですがすべてヘルペスのなせる業なのです。癌もherpesが細胞に核の遺伝子に感染して癌を作るのです。癌はここをしっかり読んでください。
胸髄症には、薬や運動療法などの治療は効果がないと言われていますが点滴でアシクロビルと言う抗ヘルペス剤を注入すれば治ります。脊髄の圧迫期間が長くなるにつれて歩きにくさが増したり、脚の麻痺(まひ)が出たりするのはそれだけ多くのherpesが増殖するからです。可能性があります。症状が当てはまるようなら、早めに病院で診てもらいなさいと言われていますが免疫を抑える対症療法である限り早めに病院で診てもらったところで100%無駄です。
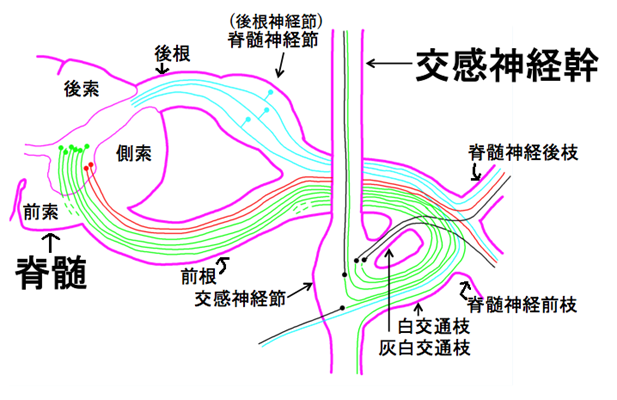
上に、脊髄神経の構成と交感神経幹との関係図を示します。
青:求心性感覚神経(体性、内臓性)
赤:体性遠心性運動神経
緑:交感神経節前線維
黒:交感神経節後線維
上図の交感神経幹の図でもう一度緑の交感神経節前線維と黒の交感神経節後線維について詳しく説明しておきましょう。緑の交感神経節前線維は脊髄から出た後、一旦、交感神経幹に入ってから交感神経節後線維となるのです。脊髄から運動神経、感覚神経、交感神経が末梢の支配臓器に向かって出ていく構造を理解するのはややこしいでしょう。一般の臨床医は自律神経の重要さを無視し続ける間違いだらけの標準医療だけをやり続ける限りここまで理解する必要がないのです。勉強する必要はないのですが病気をすべて治したい私にとっては極めて大切な複雑さなのです。
上の図で白交通枝は緑色の交感神経節前線維が通る神経線維の枝です。灰白交通枝は黒色の交感神経節後線維の枝です。胸髄~腰髄レベルの前根を通る交感神経(遠心性)の節前線維は、白交通枝を通って交感神経幹に入ります。交感神経幹は幹神経節が数珠状に連なって脊柱の両側を縦に走っています。
交感神経幹に入った節前線維は、交感神経幹の幹神経節で節後ニューロンとシナプス結合して、ここから節後線維が血管に絡まったり、あるいは末梢神経の分岐に合流しながら、支配臓器に向かうのです。例外的に腹部臓器に向かう節前線維は、幹神経節でシナプス結合せずに幹神経節を素通りして、太い動脈周囲にある腹腔神経節や上下の腸間膜動脈神経節で節後ニューロンに繋がります。支配臓器の周辺では、よく発達した神経叢(心臓神経叢、肺神経叢、腹腔神経叢、骨盤神経叢など)の形成をみる。心臓神経節は ニューロンが縦方向に並んだ神経節幹として心臓、背壁の内側もしくは外側に位置し, 多くの神経節 分枝によって心筋全体を支配する。 このように、交感神経の神経節には、交感神経幹にある幹神経節と動脈周囲の神経節の2種類があり、前者の交感神経幹にある幹神経節を椎傍神経節、後者の動脈周囲の神経節を椎前神経節に分類することもある。椎前神経節は脊柱の前側にあり、自律神経叢中にある。 腹腔神経節、上および下腸間膜動脈神経節などがある。
神経叢とは何でしょうか?脊椎動物の末梢神経がその基部付近または末梢部で分岐したり吻合(ふんごう)したりしてつくる網状構造。神経繊維は互いに独立して走っているので,その間に連絡はない。
神経節とは何でしょうか?末梢神経系における神経細胞体の集合である。脊髄神経は基部近くで,頸(けい)神経叢,腕神経叢,腰神経叢,仙骨神経叢などをつくる。自律神経は諸種の器官の外周または壁内に発達した神経叢をつくり,その中に神経細胞を含む。
神経叢は神経節と似ているが、神経節が丸くふくらんだ形なのに対し、神経叢はいくつかの神経が集まって絡み合ったような構造を指す。神経叢では、神経線維が入り組んで走っているだけなのか、その場所に神経細胞体があるのかは、ものによって違う。
脊髄神経の前根と後根をもう一度、復習しましょう。世界中の医者は前根と後根の持つ深い意味を誰も興味を持っていないからです。
前根 脊髄の前角から出る遠心性の体性運動神経線維と、側角(中間質外側核、中間質外側部)からでる遠心性の自律神経の節前線維である内臓性運動神経が通る。中間質外側核とは第一胸椎から第二腰椎までの高さにおける脊髄灰白質の脊髄側角をなすコリン作動性神経の神経核。中間外側核ともいう。
後根 脊髄後角や後索に入る求心性の体性および内臓性の感覚神経線維が通る。
後根には前根との合流直前に後根神経節(脊髄神経節)という膨らみがあって、その中に神経節細胞とよばれる一次感覚ニューロンの細胞体が集まっている。この神経細胞は細胞体から神経突起を一本だけ出し、すぐにT字型に二分する偽単極性ニューロンである。一方の突起は脊髄に向かい(中枢枝central branch)、もう片方は皮膚や粘膜などの支配領域に向かう(末梢枝 peripheral branch)。末梢枝の先端部は感覚情報を受容する受容器receptorとなる。受容器には、軸索がむき出しの自由終末から、感知する感覚の種類に応じて特殊化した終末グリアが取り囲む複雑で固有名称を有するものまである。この軸索のむき出しになった自由終末にヘルペスが感染すると痛みとして脳に伝えられるのです。これが嘘の病気である脊柱管狭窄症の痛みと言われる腰痛なのですがherpesが実は後根神経節(脊髄神経節)に感染したためなのです。末梢枝が受容した感覚情報は、求心性に神経節細胞や中枢枝へと伝えられる。中枢枝の先端部は脊髄後角や延髄まで上行し、そこで二次感覚ニューロンにシナプス連結するのです。整形外科や他の外科分野で手術で痛みの部位を除去して治るのはその痛みの原因がヘルペスであるので、痛みの原因であるヘルペス感染巣を外科的に排除するからです。この真実を世界中の医者は誰も知りません。
脊髄神経の形成
脊髄神経は前根と後根が合流したあとで、前枝と後枝に分岐する。これら前枝、後枝は運動神経と感覚神経と自律神経の交感神経の三つが混じり合い、それぞれ背部以外の体幹と四肢、背部の神経支配を担う。概して、前枝は後枝より太く支配領域も広い。
隣り合う脊髄神経の前枝は吻合と分岐を繰り返しながら、複雑な神経叢(頚神経叢:C1-C4、腕神経叢:C5-T1、腰神経叢:L1-L4、仙骨神経叢:L4-S3)を形成し、そこから固有の名称を持つ脊髄神経を送り出して特定の皮膚や筋の支配領域に向かう。それぞれの脊髄レベルから由来する脊髄神経の皮膚での分布領域は分節的となり、デルマトームとよばれる。
交感神経系
胸髄~腰髄レベルの前根を通る交感神経(遠心性)の節前線維は、白交通枝を通って交感神経幹に入る。交感神経幹は幹神経節が数珠状に連なって脊柱の両側を縦に走る。交感神経幹に入った節前線維は、幹神経節で節後ニューロンとシナプス結合して、ここから節後線維が血管に絡まったり、あるいは末梢神経の分岐に合流しながら、支配臓器に向かう。腹部臓器に向かう節前線維は、幹神経節でシナプス結合せずにここを素通りして、太い動脈周囲にある腹腔神経節や上下の腸間膜動脈神経節で節後ニューロンにリレーする。支配臓器の周辺では、よく発達した神経叢(心臓神経叢、肺神経叢、腹腔神経叢、骨盤神経叢など)の形成をみる。このように、交感神経の神経節には、交感神経幹にある幹神経節と動脈周囲の神経節の2種類があり、前者を椎傍神経節、後者を椎前神経節に分類する。
副交感神経系
中脳・延髄・脊髄下部から出た副交感神経ニューロンの神経線維が、脊髄に入り脊髄からから出て末梢に向かう副交感神経の節前線維は脊髄レベルでは第2仙髄から第4仙髄の中間質外側部の神経細胞に発する。これらの節前線維は脊髄神経に混じって結腸下部、直腸、膀胱などに進み、臓器周辺の骨盤神経節で節後ニューロンにリレーする。骨盤神経節とは何でしょうか?自律神経のうちで、大腸と膀胱に向かう副交感神経系に属する副交感神経の神経細胞体が集まる部分が骨盤神経節です。
さてherpesによる病気の病名によるタイプについて復習しましょう。
(1)水痘 宿主へのウイルスの侵入は接触または飛沫、侵入部位は傷ついた皮膚や結膜や気道粘膜である。侵入した水痘ウイルスは、侵入部位に近い所属リンパ節(領域リンパ節)で増生し、数を増やして血液に流れ出ます。この結果第一次ウイルス血症とよばれる状態となる。血液に入ったウイルスは肝臓や脾臓に達し、そこでまた数を増やし、血液に出て第二次ウイルス血症となる。このように増生したウイルスは全身に広がり、皮膚や粘膜の上で免役に見つかり、炎症を起こし発熱をともない発症する。侵入から発症まで2週間かかるので、潜伏期は2週間です。
(2)帯状疱疹 VZVは神経系の軸索を介して支配領域の皮膚に伝わっていく。このため疱疹は体の片側で正中線をこえて発症することはない。発症は年齢と関係があり、発症のピークは50~60歳代であるがステロイド治療をやると若い人でも帯状疱疹になる。免疫を抑えるストレスの多い高齢者では重篤な症状となり、1年間以上続くこともある。
『3』ヒトサイトメガロウイルス(HCMV) 巨胞ウイルスの意。このウイルスはゲノムが大きいことが特徴である。増生(増殖)速度はゆっくりであり、宿主域も狭い。HCMVが感染した宿主細胞は肥大化して球状となり、フクロウに似た独特の封入体(フクロウの目owl’s eyeとよばれる)を形成する。初期感染は通常、乳幼時におこり、日本人成人の90%以上は抗体陽性である。唾液(だえき)、尿、精液、子宮分泌液などを介して感染する。AIDS(エイズ)や移植などの外科手術などによる病原体に感染しやすい宿主が増加し、HCMVの重篤な感染症がみられるようになった。HCMVは通常の宿主については不顕性感抗体陰性の妊婦が妊娠中に初感染を受けると、胎児に垂直感染し、先天性巨細胞封入体病をおこす。新生児は出生時低体重、肝脾腫(かんひしゅ)、出血斑(はん)の症状となる。さらに中枢神経を冒し、精神発育障害や先天性脳障害などの後遺症を残す。感染しやすい宿主に、輸血や臓器移植などによって体外から新しくHCMVが感染するか、免疫を抑制すると潜伏ウイルスが再活性化することにより感染がおこり、肺炎、網膜炎、肝炎、消化管の潰瘍などを発症する。最悪の場合は、HCMV網膜炎をおこし失明し、重篤の状態となる。私の右目のherpes性網膜炎の原因はHCMVです。失明しました。
『4』エプスタイン‐バーウイルス(EBV) γ-ヘルペス亜科に属するウイルス。EBウイルスともいう。発見者であるエプスタインMichael Anthony EpsteinとバーYvonne M. Barrの名に由来する。EBVは宿主のリンパ球に感染し、宿主細胞が遺伝子の突然変異と言われる形質転換をおこし、リンパ芽球様細胞となり増生を繰り返していく白血病を起こすのです。健康者の唾液中にもEBVは排出されており感染源となる。日本では幼児期に80%の人が感染するが不顕性感染である。
(1)伝染性単核症 小児期においてEBVの洗礼を免れた若成人が口づけなどによってEBVの初感染をうけると、その約半数が発症する。発熱、咽頭痛、頸部リンパ節腫などをおこす。この場合、咽頭や扁桃に浸出物、偽膜(ぎまく)などが認められる。偽膜(ぎまく)とは何でしょうか?生体組織の炎症は滲出(しんしゅつ)物の性状や種類によって分類されるが、滲出物の中に多量の線維素(血液凝固の際に生ずる不溶性のタンパク質)を含んでいる場合を線維素性炎とよぶ。滲出した線維素は粘膜表面で上皮細胞と絡み合って膜様物を形成するのが常であり、これを偽膜という。したがって線維素性炎は偽膜性炎ともよばれる。偽膜と可否に違いは何でしょうか?偽膜に壊死を伴ったものを一般に痂皮(かひ)とよんでいる。
(2)EBVと悪性腫瘍 EBVが悪性腫瘍(癌)と関係するケースは主に2地域にみられる。アフリカのウガンダ地域と中国南部地域である。ウガンダのケースはバーキットリンパ腫は英語でBurkitt lymphomaで略してBLです。BLは腫瘤形成性の高悪性度(highly aggressive)のB 細胞リンパ腫である。中国南部のケースでは上咽頭癌(NPC)である。NPC はnaso-pharyngeal carcinomaの略で上咽頭癌と訳します。EBVによる上咽頭癌(NPC) は中国では最も多い悪性腫瘍の一つである。
BLは小児に多発する悪性リンパ腫で、腫瘍組織中にEBV DNAとEBNAが認められる。EBNA はEpstein-Barr virus-nuclear antigenの略でありエプスタインバー核抗原と訳します。 NPCは成人男性が多発する未分化扁平上皮癌で、腫瘍組織中にEBVDNAとEBNAが認められる。どちらのケースも常在性のウイルスのEBVによっておきる。
『5』ヒトヘルペスウイルス6型(HHV‐6)、7型(HHV‐7) β-ヘルペスウイルス亜科に属す。T細胞(Tリンパ球)やマクロファージに感染、感染源は保有者の唾液である。HHV‐6は1986年エイズ由来のリンパ球培養から分離されたウイルスである。HHV‐7は1990年培養Tリンパ球より分離された。両者とも構造や遺伝子構成はHCMVに類似している。
『6』ヒトヘルペスウイルス8型(カポジkaposi肉腫関連ヘルペスウイルス) カポジ肉腫は皮膚に生じる多発性の血管肉腫である。かつては、アフリカの一部地域に限定して流行していた。この肉腫が注目されたのはエイズ流行以来のことで、合併症の一つとして有名になった。日本のエイズ患者も約20%の割合でこの肉腫を合併する。性的接触が主な感染経路である。
『7』ヘルペスBウイルス アフリカミドリザルなどのサルを自然宿主とするウイルス。α-ヘルペスウイルス亜科に属する。サルによる咬傷によってヒトに感染、致命的な脳症状をおこす。1933 年にサルを取り扱う研究者がサルに咬まれ、脳脊髄炎を発症して死亡した。神経組織よりウイルスが分離され、患者の名前にちなみ、Bウイルスと命名された。正式名称はMacacine alphaherpesvirus 1ですが、Bウイルス、ヘルペスB 、Herpes simiae、Herpesvirus simiaeとも呼ばれる。Bウイルスはニホンザルなどのマカク属サルを自然宿主とし、この宿主では単純疱疹類似の疾患を引き起こし、致死的感染は例外的である。しかし、ヒトがBウイルスに感染すると、重い中枢神経感染症性疾患(Bウイルス病)を発症する。
末梢の感覚神経節のすべての数は100近くもあります。
感覚神経節には、①三叉神経節、②膝神経節、③前庭神経節、④らせん神経節、⑤舌咽神経の上神経節と下神経節、⑥迷走神経の上神経節と下神経節、⑦脊髄後根神経節が含まれるのですが⑤の舌咽神経には上神経節と下神経節の上,下二つの神経節があり⑥の迷走神経にも上神経節と下神経節の上,下二つの神経節があるので9個あります。しかし⑦の脊髄後根神経節は31対つまり左右、合計62あるので感覚神経節のすべての合計は、なんと62+9で71種類の感覚神経節が存在しているのです。
交感神経系の神経節と副交感神経系の神経節すべての合計は
交感神経系の神経節には、①交感神経幹神経節、②自律神経叢神経節が含まれる。
副交感神経系の神経節には、①毛様体神経節、②翼口蓋神経節、③顎下神経節、④耳神経節⑤内臓を支配する副交感神経節(⑤終末神経節、⑥壁内神経節)が含まれる。
副交感神経節とは何でしょうか? 中脳・延髄・脊髄下部から出た副交感神経ニューロンの神経線維が、末梢に向かうニューロンとシナプスを作って接続する所。終末の臓器の近くや内部にある。壁内神経節とは何でしょうか?胃腸管では副交感神経節前線維が壁内神経節で節後線維とシナプスを作るので壁内神経節といいます。
ここで極めて大切な事実を指摘しておきます。ヘルペスが簡単にあらゆる神経節の神経細胞に感染出来ることの理由を書きます。
あらゆる医学書に掲載されている神経伝導路が図示されていますが、単一ニューロンか一本の軸索でそれらの伝導路を代表させる方式が採用されていますがあくまでも簡略化されているだけです。実際にはすべての伝導路の一つ一つが、例外なしに多数の神経束の集合体には必ずさらに一個の神経繊維束は数百ないし数千本の軸索が寄り集まったものなのです。下図に示します。
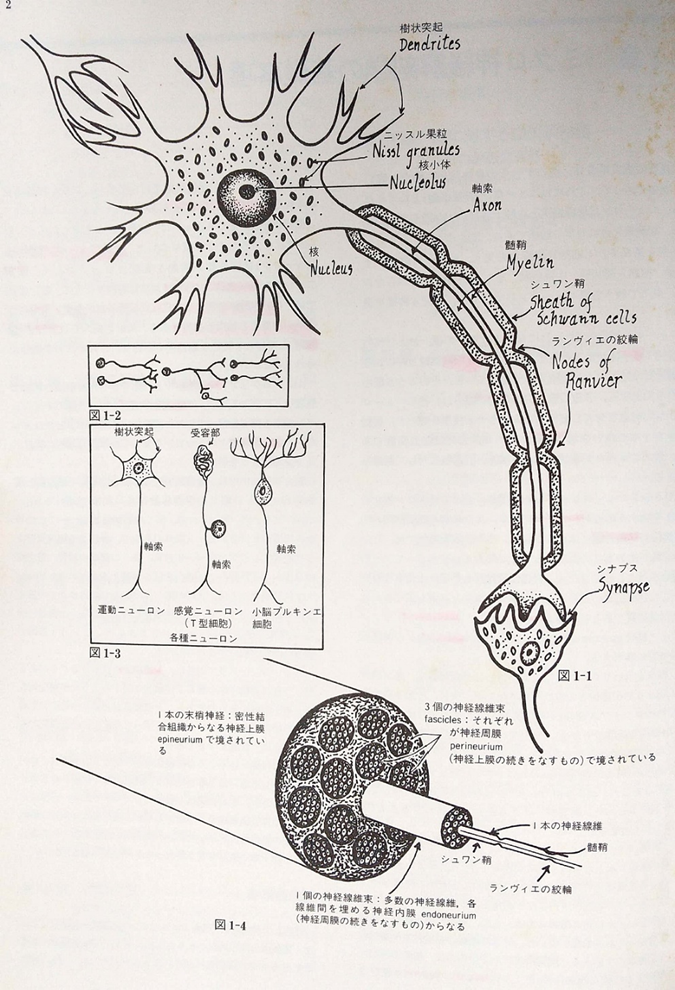
左の図1-1は一本の神経ニューロンです。
図の1-2は一本の軸索が複数のニューロンに対してシナプスを形成出来ること、および単一ニューロンの樹状突起群に対して多数のニューロン軸索がシナプスを介して接続できることを示しています。
図1―3は丹生論の種類を示しています。
図1-4 は実際の一本の末梢神経が実は三個の神経繊維束が集まっていることを示しています。しかも一個の神経は多数の神経線維から成り立っていることを十分に理解してください。
神経ニューロンは単純に一本でできていると考えれば簡単に済むことなのに何故ややこしい話を持ち出したのかと疑問に思いますか?
いつもいつもherpesはあらゆる神経細胞、とりわけ自律神経に感染しやすいと言い続けさらにいとも簡単に神経軸索を髄鞘にも感染して髄鞘が崩壊して多発性硬化症(MS)が起こるのだと断言してきました。が、どのように上の図にある難攻不落の重装備の神経ニューロンにヘルペスが感染出来るのか不思議でならなかったのです。
自己免疫疾患は絶対存在しないのですが自己免疫論者は免疫が中枢にある神経細胞の髄鞘を免疫細胞が攻撃して自己免疫疾患が生じたのだと主張しますが免疫がどのように神経の奥の奥にある髄鞘を攻撃できるのかについては一切説明がないのです。因みに多発性硬化症(multiple sclerosis:MS)は、中枢神経系の慢性炎症性脱髄疾患であります。ましてや自律神経の神経節はもっと多くの神経ニューロンが集合しているのでますます侵入して隠れるのも難儀なのにどのような戦略を持っているのかの答えを近いうちに出します。
多発性硬化症(multiple sclerosis:MS)は、髄鞘の多い中枢神経の軸索をとり囲む多くの髄鞘に感染したherpesウイルスにより生じたヘルペス性多発性硬化症(multiple sclerosis:MS)なのです。
人間の細胞に感染するヘルペスウイルスに働きが非常によく似たバクテリアテリアファージについてみましょう。
バクテリアテリアファージとは何でしょうか?ファージ( phage)とも呼ばれは、細菌に感染して複製するウイルスで、正式にはバクテリオファージ( bacteriophage)と呼ばれる。ファージの基本構造は、タンパク質の外殻と遺伝情報を担う核酸 (主に二本鎖DNA) からなる。これはヘルペスが細胞に感染して細胞核に隠れる際に裸の遺伝子だけのエピソームになって遺伝情報を担う核酸 (主に二本鎖DNA)だけになるのと似ています。ヘルペスの潜伏状態であるエピソームについてはすぐ後で詳しく説明します。
ファージが感染した細菌は細胞膜を破壊される溶菌という現象を起こし、細菌が食べ尽くされるかのように死滅するため 「細菌(bacteria)を食べるもの(ギリシア語のphagos)」を表す「バクテリオファージ(bacteriophage)」という名がつけられた。バクテリオファージは、DNAのゲノムをカプセル化したタンパク質で構成され、単純なものから精巧なものまである。それらのゲノムは、わずか4つの遺伝子から数100の遺伝子までをコードしている。ヘルペスウイルスの遺伝子数は80前後です。ファージは、細菌の細胞質にゲノムを注入した後、細菌内で複製するのもherpesに似ています。
バクテリオファージは、生物圏で単一細胞から成り立っている細菌に感染する最も多い多様な存在であるのもherpesウイルス多細胞でこの世のあらゆる生物に感染して単一の細胞に感染して増殖するのも似ています。バクテリオファージは、細菌が存在する場所ならどこにでも存在する。地球上には、バクテリオファージウイルスが1031種類以上存在すると推定されており、これは細菌を含む地球上の他のすべての生物を合わせた数よりも多くなっておりバクテリオファージウイルスは、海洋細菌の最大70%がファージに感染している可能性があると言われています。8種類のHerpesウイルスも多かれ少なかれ人類のすべてに感染しているのに似ています。しかも人体に感染したherpesウイルスが人間のあらゆる病気を作りますが人間の病気には全くかかわりがありません。
ヘルペスウイルス潜伏 (herpes virus latency viral latency) は、herpesウイルスが細胞内で休眠 (潜伏) する能力であり、herpesウイルスのライフサイクルの溶原性感染とか潜伏感染と呼ばれます。潜伏ウイルス感染症は、慢性ウイルス感染症とは区別される持続的なウイルス感染の一種である。潜伏期とは、herpesウイルスの生活環(ライフサイクル)において、最初の感染の後、免疫が低下するまで神経節の神経細胞の核にある染色体の遺伝子に隠れ、herpesウイルス粒子のビリオンの増殖は停止しています。宿主の免疫が下がらない限り、宿主内に無期限に留まり、免疫が下がれば再活性化して大量のherpesウイルス子孫 であるビリオン生成を開始する溶菌サイクルに突入します。この溶菌サイクルはウイルスの子孫ができる段階を指すのですがウイルスができすぎると細胞が解けて死滅することがあることを意味しているので、溶菌サイクルという言葉は全く不正確です。同じように溶原性感染や溶原サイクルという意味も不正確な言葉です。
ヘルペスウイルス潜伏感染を、他の病原体感染に際して病原体が休眠していない潜伏期間 ( incubation period) 中の臨床潜伏 ( clinical latency) と混同すべきではない。つまり病原体の感染があった後、自然免疫に見つかって免疫が戦い始まるまでを臨床潜伏 ( clinical latency)というのです。従ってヘルペスウイルス潜伏感染とは全く意味が違うのです。
ヘルペスウイルス潜伏はエピソーム潜伏ともいわれます。エピソーム潜伏( episomal latency)とは、潜伏期に遺伝子エピソームを使用することを指す。エピソームの潜伏型では、ウイルス遺伝子は裸となり細胞に気づかれずに安定化され、細胞質または核内に線状構造またはラリアット構造(二重鎖の輪)として浮遊している。ところが遺伝子が裸のままであるエピソーム潜伏は、プロウイルス潜伏よりもリボザイムや宿主外来遺伝子によってつくられた酵素による分解に対して脆弱なのです。しかしherpesウイルスの遺伝子だけの線状構造またはラリアット構造(二重鎖の輪)で存在している限り細胞が作るインターフェロンαによって殺されることはないのです。しかし一番安全なのはやはりプロウイルス潜伏なのです。
しかもプロウイルスになるのも極めて簡単なのです。プロウイルス(provirus)になるためには 、宿主細胞の遺伝子であるDNAにこっそり感染してヘルペスウイルスの裸の遺伝子を組み込んでしまえばよいのです。ヘルペスウイルスのゲノムは15万対の塩基対と80個の遺伝子から成り立ちっています。一方、人間のゲノムは30億対の塩基と23000個の遺伝子から成り立っている上に人間の遺伝子もherpesウイルスの遺伝子も全く同じ4種類の塩基で構成され遺伝子のなり立ちもそっくり同じですからherpesウイルスのゲノム全体をそっくり人間のゲノム遺伝子に組み込むなどはherpesウイルスにとってはいとも簡単なのです。
一例として、ヘルペスウイルス科のヘルペスウイルスは、いずれも潜伏感染を確立しプロウイルスになれます。ヘルペスウイルスには、水痘帯状ヘルペスウイルス(VZV)および単純ヘルペスウイルス (HSV-1, HSV-2) が含まれ、これらはすべて、神経細胞に感染したがります。これらの神経細胞においてエピソーム潜伏を確立し、線状遺伝物質を細胞質や核の中に浮遊させる。ガンマヘルペスウイルス亜科は、エプスタイン・バール・ウイルスは抗体を産生するB細胞に感染して、免疫系の細胞で確立されたエピソーム潜伏したプロウイルスとなりB細胞を癌化させバーキットリンパ腫という白血病を引き起こします。単純ヘルペス (HSV) の場合、ウイルスは神経節や神経細胞に侵入してプロウイルスになりDNAと融合して神経細胞の遺伝子を変えることも可能なのです。HSVは、不足すると自分が持っているクロマチンがコンパクトになってエピソームになって感染細酸素や栄養が胞の遺伝子に簡単に自分の裸の遺伝子を組み込みプロウイルスとなり潜伏状態になるのです。ところが再びストレスによって免疫が下がるとクロマチンがわずかに緩むだけでも増殖・再活性化するのです。再活性という言葉は意味不明な言葉ですが正しくは常に分裂とか増殖の意味であることを知っておいてください。
クロマチンとは、何でしょうか?クロマチンはヒストンとDNAで構成されています。147塩基対のDNAが8つのコアヒストンに巻きつくことで、クロマチンの構成単位であるヌクレオソームが形成されます。ヒト二倍体の一個の細胞に納められているDNAの総延長はおよそ2 mに達する。これを直径約10 μmの核に収納するための構造がクロマチンである。クロマチンを構築するうえで最も基本となる構造が、ヌクレオソーム(nucleosome)である。まず、4種類のコアヒストン(H2A、H2B、H3、H4)が2コピーずつ集まって八量体(オクタマー)を形成し、その周りを約146bpのコアDNAが約1.65回左巻きに巻きつく。この構造はヌクレオソームコア粒子(core particle)と呼ばれる。2つのヌクレオソーム(コア粒子)の間を繋ぐDNAがリンカーDNA(linker DNA)、そこに結合するヒストンがリンカーヒストンである。
herpesウイルスとりわけサイトメガロウイルス (CMV) は骨髄系前駆細胞の遺伝子に潜伏し、遺伝子を癌化させて白血病を起こすことがある。免疫抑制や免疫が落ちて生ずる重篤疾患 (特に敗血症) では、CMVの増殖・再活性化が起こることが多い。
ヘルペスウイルスのエピソーム潜伏の利点は、herpesウイルスが核に入って遺伝子にプロウイルスで潜伏感染しているので、したがって核ドメイン10 がその経路を介してインターフェロンを活性化することを回避できることです。やはり核や細胞質にいる限りインターフェロンαを細胞が作って細胞自殺をやられるとherpesウイルスも殺されてしまうから遺伝子に侵入してプロウイルスになって宿主細胞のDNAに組み込まれたウイルスゲノムとして潜伏する以外にないのです。プロウイルス潜伏の利点は、宿主細胞自身の分裂がヘルペスウイルスの遺伝子の複製の手助けをしてしまうのです。しかも細胞を殺さずに感染した細胞から組み込まれたプロウイルスを除去することは不可能なのです。それではherpesウイルスは長い潜伏期間をどのようにして維持しているのでしょうか?
ヘルペスがプロウイルスとして、かつエピソームとしての両方の潜伏は、主に潜伏期に発現するウイルス遺伝子によって維持される。これらの潜伏関連遺伝子の発現は、ウイルスゲノムが細胞リボザイムによって消化されたり、免疫系によって発見されたりするのを防ぐように機能することがある。リボザイムとは何でしょうか? 触媒としてはたらくリボ核酸のことです。「リボザイム」とはリボ核酸(RNA)を素材とする生体触媒である酵素(Ribo nucleic acids + Enzyme)を意味する造語である。原始生命の時代から、リボザイムは生命の中心的な役割を果たしていた。 現代の細胞システムにおいても、タンパク質の合成や翻訳や遺伝子の多様化・発現調節(mRNAスプライシング)など重要な生命反応がリボザイム(正確にはRNAを主役とする酵素)により行われている。 これらはすべて重要な生命にとって重要な化学反応であるが、その反応の基質の種類は限られており、天然のリボザイムはいずれもRNAリン酸ジエステル結合の切断・交換反応、ペプチド結合の生成反応のいずれかを触媒する。herpesウイルス遺伝子産物 であるノンコーディングRNAやタンパク質などのRNA転写物 もherpesも自分を守るためにアポトーシスを阻害するか、herpesウイルスは細胞の増殖および分裂を誘発して、感染した細胞の複製・分裂をより多く生成するときに自分自身のherpesウイルスも増やせるのみならず増えた新しい細胞に増やしたヘルペスを新たに感染できるようにするのです。ヘルペスウイルスは狡猾なウイルスでしょう。
このような遺伝子産物の例は、単純ヘルペスウイルスの潜伏関連転写物( latency associated transcripts、LAT) があり、主要組織適合遺伝子複合体 (MHC) を含む多数の宿主因子を下方制御し、MHCを作らせないようにしてキラーT細胞に敵であるherpesが感染していることを知らせないようにするのみならずherpes自身も死ぬことになるアポトーシス経路を阻害することによってアポトーシスを妨害する。アポトーシス経路とは何でしょうか?アポトーシスには内因性経路と外因性経路があります。 内因性経路は、細胞ストレス、DNA損傷などによって活性化され、外因性経路は、他の細胞からの細胞外デスシグナル(死のシグナル)検出を介して活性化されます。 アポトーシスとはそもそも何でしょうか?多細胞生物では不都合な細胞を取り除くために日常的に起こっている.細胞内からと細胞外からの二種類の刺激のどちらかによって細胞死プログラムが作動します。すると,カスパーゼ(caspase)とよばれる一群のプロテアーゼが活性化され,それに引き続いてデオキシリボヌクレアーゼ(DNase)なども活性化されてDNAの断片化や細胞の小片化が起こり,まわりの細胞に影響を与えることなく死滅する.この点が壊死(ネクローシス)と異なる点です。カスパーゼという名前は,活性中心にシステイン(Cys)を有し,アスパラギン酸(Asp)を認識して切断することに由来するのです.CysのCとAspのAsをつないでCasとなりカスパーゼの造語が生まれたのです。一つ目の細胞外からの死滅シグナルはFasリガンドから細胞表面のFasに伝えられる.二つ目の細胞内からの死滅シグナルは,ミトコンドリアからのシトクロムcの遊離が引き金になる.
カスパーゼの活性制御因子としてBcl-2のようなインヒビターがある。放射線などによってDNAが損傷を受けた場合には,まず転写調節因子でもありがん抑制因子でもあるp53が活性化され,細胞の分裂を止めたうえでアポトーシスが起こる.p53に異常があると不都合な細胞の分裂増殖が止まらず,がん化するので.p53をがん抑制因子と呼ぶのです。
特殊なタイプの潜伏ウイルスは、内在性レトロウイルスに起因するのです。内在性レトロウイルス(endogenous retrovirus; ERV)は、宿主のゲノム中に残るウイルス感染・侵略の痕跡です。 ヒトを含む哺乳類において、ERVはゲノムの大きな割合を占めているため、哺乳類の祖先は大量のレトロウイルス感染にさらされてきたと考えられていますこれらのウイルスは、遠い過去にプロウイルスとしてヒトゲノムに組み込まれ、現在は生殖によって感染していくのです。一般に、これらのタイプのウイルスは高度に進化し、多くの遺伝子産物の発現を失っている。これらのウイルスによって発現されるタンパク質の一部は、宿主細胞と共進化して、正常なプロセスで重要な役割を果たしている。
ヘルペスウイルス潜伏は活発なウイルス排出を示さず、免疫が落ちない限り病理や症状を引き起こさないのですが、herpesウイルスはストレスやステロイドホルモン治療などで免疫が落ちると再活性化し、急性感染を引き起こすのみならず現代のあらゆる病気の原因になるのです。一般に、生涯感染する単純ヘルペスウイルスの場合、免疫が落ちている間に増えてウイルスが時折、免疫に見つかって炎症が起きて口唇ヘルペスを引き起こす。その痛みは免疫システムによって速やかに解消されるが、時折、神経細胞に感染しているherpesが免疫と戦うと頭痛や肩こりや疲れやすくなったり気分が快感になることがくりかえされるのです。水痘帯状疱疹ウイルスの場合、最初の急性感染 (水痘) の後、ウイルスは帯状疱疹として再活性化されるまで神経節などに潜伏感染して休眠状態にある。ウイルス学者は再活性化して症状が出るような書き方をしますがウイルスが活性化することはウイルスが増えることですから症状は出ないのです。というのはウイルスが増えるのは免疫が落ちているので免疫との戦いは起こりえないからです。増えたヘルペスと免疫との戦いが病気でありその結果症状が出現するのです。活性化の意味を世界中の医学者は全く理解していません。残念です。
ヘルペスの潜伏感染による深刻な影響は、レトロウイルスと同じように細胞の遺伝子を形質転換し、制御されない細胞分裂を強制することによってがんを発生させることがあるのです。これは、herpesウイルスゲノムが宿主自身の遺伝子にランダムに挿入され、ウイルスの利益のために宿主細胞増殖因子が無制限に発現した結果です。
レトロウイルスベクターとは何でしょうか?
まずベクターとは何でしょうか?宿主細胞または細胞の核内に、ほかの生物などからの外来性のDNA(デオキシリボ核酸)を運び入れる役割を果たすDNA分子のことです。ウイルス、プラスミド、ファージ(バクテリオファージ)などが用いられ、こうしたベクターは宿主細胞内において複製することが可能です。
プラスミドとは何でしょうか?プラスミド(plasmid)とは、大腸菌等の細菌や酵母の核外に存在し、細胞分裂によって娘細胞へ引き継がれるDNA分子の総称です。一般的に環状の2本鎖構造をとり、染色体のDNAからは独立して複製を行います。細菌や酵母の細胞内に存在し、染色体 DNA とは別の自己増殖性の DNA の総称で、染色体とは別に環状二本鎖 DNA として存在しています。抗生物質に耐性となる酵素等の遺伝子を含んだり、他の遺伝子の DNA 断片を組み込みやすくするため、制限酵素で特異的に切断される領域を有するものがあります。制限酵素とは何でしょうか?制限酵素は、制限部位と呼ばれる特定の認識配列またはその近くでDNAを切断することから、「分子のハサミ」とも呼ばれます。これらの酵素は、DNAの2本の鎖のそれぞれに切開を1回行うもので、制限エンドヌクレアーゼとも呼ばれます。ウイルスは、DNAを細胞に注入することによって宿主細胞に感染します。このウイルスDNAは、ウイルスの子孫を複製するために宿主細胞の機構をハイジャックし、宿主細胞を死に至らしめこともあります。ウイルス感染を克服するために、多くの細菌や古細菌がいくつかのメカニズムを発展させてきました。主な保護メカニズムとしては、制限酵素を使用して、侵入したウイルスDNAを特定の制限部位で切断することによって分解することです。同時に、宿主細胞は、宿主認識配列内のアデニンまたはシトシン塩基をメチル化する、メチラーゼと呼ばれる他の酵素を使用することにより、自身のDNAが切断されるのを防ぎます。宿主細胞は、制限酵素のそれぞれに対応するメチラーゼを生成し、宿主DNAをメチル化して分解から保護します。これらの酵素は、制限修飾(R-M)系を構成します。
組換えDNA実験では、プラスミドをベクターとしてつまり目的とする遺伝子又はDNAを宿主に移入し、増殖させ、又は発現させるための運搬用 DNAとして用い、宿主内での発現を司るプロモーターやターミネーターの DNA 断片とともに目的とする遺伝子の DNA 断片を組み込み、宿主への遺伝子導入を行います。1973年にコーエンとボイヤーにより開発された組換えDNA技術は、遺伝子の人為的な組換えを簡単に行えるようにする画期的な技術でした。けれど、この技術の利用によってヒトに危険が生じる可能性を否定できないという理由で、1974年に実験の自主的な中止が呼びかけられ、生物学的・物理学的封じ込めを行って実験を行うためのガイドラインを策定されました。生物学的封じ込めというのは、宿主-ベクター系を利用する封じ込めをいいます。すなわち、自然環境中では生存できないことが確認されている宿主生物(遺伝子を導入される生物)と、遺伝子を宿主以外の生物に移さないことが知られるベクター(遺伝子を宿主に運ぶ役割をするもの)の組合せよりなる宿主-ベクター系を利用するというものです。
バクテリオファージとは何でしょうか?細菌に感染し、細菌の細胞中で増殖するウイルスのこと。単にファージともいう。20世紀初頭に細菌を殺す微小な生物として発見された。小さすぎて光学顕微鏡では観察できず、電子顕微鏡によりはじめて見ることができた。1940年代より大腸菌が多くの研究者の研究材料になるのと同時にラムダファージ、T系ファージなど大腸菌の細胞中で増殖するファージについて集中的な研究が行われた。ファージの遺伝子複製、遺伝子発現調節などの研究は分子生物学の成立に大きく寄与した。
ハーシーとチェイスの実験(Hershey-Chase experiment)はDNAがバクテリオファージの遺伝物質であることを証明した実験です。A. D. HersheyとMartha Chaseにより1952年に発表された。放射性のリン(32P)を含む培地で生長させた大腸菌にT2ファージを感染させ溶菌させるとDNAに放射能をもつ32P標識ファージが得られる。放射性のイオウ(35S)を含む培地で生長させた大腸菌からはタンパク質に放射能をもつ35S標識ファージが得られる。32P標識ファージを大腸菌に感染させたのち放射能がどこに存在するか調べることによりファージのDNAの行方を追うことができる。また、35S標識ファージを用いて同様の実験を行うとファージのタンパク質の行方を追うことができる。ファージが大腸菌に感染するときDNAが大腸菌の細胞中に入る。タンパク質は大腸菌の細胞表面に付着するのみであり撹拌すると大腸菌から離脱する。DNA が細胞中に入ればタンパク質が離脱してもファージの増殖と溶菌が起きる。また、もとのファージのDNAの放射能は新しく増殖したファージにとりこまれるが、タンパク質の放射能は新しく増殖したファージにほとんどとりこまれない。これらのことからDNAが遺伝物質であることがハーシーとチェイスの実験で示されたのです。
次にウイルスベクターとはなんでしょうか?細胞に吸着したウイルスは、自らのゲノムを細胞内に送り込み、細胞がもつ転写翻訳機構を利用してゲノムを複製し増殖する。遺伝子操作により、複製および増殖能を欠損させたウイルス(増殖力等の欠損株)や、複製・増殖能の一部を保持したウイルスに外来遺伝子を組み込み、効率的に目的の遺伝子を細胞へ導入し発現させる能力を利用したものをウイルスベクターという。
レトロウイルスは何処から生まれたのでしょうか?脊椎動物の細胞から生まれたのです。癌ウイルスの代表であるレトロウイルスがなんと私たち脊椎動物である人間の一個の細胞から生まれたのですよ。レトロウイルスはウイルスなのに動物である脊椎動物の細胞から生まれるなどと言う話は正に衝撃的な話です!!!!レトロウイルスの細胞は進化的には新しいウイルスであり脊椎動物にのみ限定されているので他の動物には見られないのです。す。そのいきさつを詳しく説明しましょう。レトロウイルス(retrovirus)はHIV(human immuno-deficiency virus)や肉腫や白血病を起こすウイルスです。人のゲノムの中には聞きなれないレトロトランスポゾン(retro-trans-poson)という転移因子があります。ゲノムとは遺伝子(gene)と染色体(chromosome)から合成された言葉で、DNAのすべての遺伝情報のことでDNAのすべてを含んでいます。レトロウイルス(retrovirus)とレトロトランスポゾン(retro-trans-poson)の両者に共通する「レトロ」の名前は逆転写酵素からきています。
レトロウイルスとは何でしょうか?レトロウイルスはRNAウイルスの一種で,ウイルスRNAから逆転写酵素によりDNA合成し,宿主ゲノムに組み込まれる.レトロウイルスベクターは,この性質を利用して動物細胞への遺伝子導入を目的としたベクターです。レトロウイルスベクターは自身のゲノムを宿主ゲノムに挿入できることから,治療遺伝子を患者の体内に運ぶ有効な手段として注目されてきた.レトロウイルスベクターが標的とする遺伝子疾患は,疾患の原因である変異遺伝子の正常型を患者細胞に直接導入することで治療が行われる.従来のガンマレトロウイルスベクターは標的細胞における治療遺伝子の発現,患者の疾患症状改善という点からこれまでの臨床治験において数々の成功例を報告してきた.しかし,遺伝子治療後の副作用としてベクターを介した遺伝子挿入を由来とする白血病が発生したのです。この白血病が起こったのは当然のことだったのです。というのはガンマ・レトロウイルスはレトロウイルス科に含まれ、マウス、猫、豚、霊長類、牛、鳥など、さまざまな哺乳類から見つかることから、人獣共通感染症ウイルスであるだけではなく、ガンマ・レトロウイルスは、動物に幅広い影響を及ぼし、人も含めて多くの種において白血病とリンパ腫などの癌、さまざまな神経疾患、免疫不全などの疾患を起こしていたからです。
形質転換(Transformation)と形質導入(Transduction)とは何でしょうか?
形質転換は裸のDNA分子が直接細菌に入ることにより起こる。形質導入は、バクテリオファージ粒子のなかにある細菌染色体の一部を含むDNA分子がファージ粒子の細菌への吸着にともない細胞中に注入されることにより起こる。
形質転換、形質導入ともに細菌の細胞に外からDNA分子が入り、菌の性質が変わることをいう。形質転換は、1920年代にグリフィスにより肺炎双球菌において観察された。1944年エイブリーらは、形質転換をひき起こす物がDNAであることをつきとめた。
形質導入は1950年代バクテリオファージの遺伝現象の研究において発見された。形質転換、形質導入ともに、発見されて以来、人工的に遺伝子組換え細菌を得る手法として用いられてきた。また、自然界においても、細菌が抗生物質への耐性を獲得したり新たな環境に適応するときなどに、形質転換や形質導入による種を超えた遺伝子の伝達が起きている場合がある。
形質転換(Transformation)とは何でしょうか?形質転換とは①細胞外からDNA断片を取り込むことによってDNAが移動します。ヘルペスウイルスが感染細胞の染色体にヘルペスのゲノムを組み込んでプロウイルスになることです。②形質のもとになる物質がDNAであることを証明したアヴェリーの実験はこの形質転換の現象に基づいています。③正常な動物細胞が無制限に分裂を行うようになる、つまり正常な細胞をがん細胞にしてしまうことです。
形質導入(Transduction)とは何でしょうか?形質導入とは①遺伝情報を担うDNAがバクテリオファージを介して,もう一方の細胞に移ること。トランスダクションともいう。②大腸菌やサルモネラなどの細菌で,細菌細胞内に存在するバクテリオファージ(細菌に感染するウイルス)が,細菌そのものの遺伝質(染色体)の断片を担ったまま他の細胞に入り込んでいくこと③その結果、いろいろな生理的な遺伝的形質,たとえば栄養の要求性や薬物に対する抵抗性などが,一つの細胞から他の細胞に移行する現象です。
バクテリオファージ(細菌ウイルスとかファージ)とは何でしょうか?
ファージとは「食べる」と言う意味でバクテリオファージはバクテリオ‐ファージ‐ウイルスの略で日本語に訳すと「細菌を食べるウイルス」となります。ファージは、細菌や古細菌に感染して複製するウイルスで、正式にはバクテリオファージと呼ばれる。ファージの基本構造は、タンパク質の外殻と遺伝情報を担う核酸 (主に二本鎖DNA) からなる。ファージが感染した細菌は細胞膜を破壊される溶菌という現象を起こし、死細胞を残さないのですがherpesウイルスといくつかの点で非常に似ています。
ウイルスとバクテリオファージの違いは何ですか?
一般的にウイルスという呼称は動植物細胞に感染するものを指していることが多く、細菌に感染するものは総称してバクテリオファージと呼んでいる。
Herpesウイルスとファージの違いと共通点は何か?ファージの基本構造は、タンパク質の外殻と遺伝情報を担う核酸 (主に二本鎖DNA) からなる。
マクロファージとバクテリオファージの違いは何ですか?
マクロファージとは白血球の一種で、体内に侵入してきた細菌や死んでしまった細胞などを動き回って食べる細胞のことです。 大食細胞とか貪食細胞などとも言われます。 バクテリオファージ(ファージ)は、細菌に感染するウイルスのことで、感染した細菌の細胞膜を破壊して溶かしてしまいます。どちらも細菌を食い殺すのでファージが付いているのです。
ベクターとは何でしょうか?
ベクター(vector)とは一言で言えば「遺伝子の運び屋」のことです。ラテン語の「運び屋 (vehere) 」に由来しています。遺伝子組み換え操作のときに頻繁に用いられ、挿入する遺伝子断片の大きさや挿入目的によって、それを挿入するために様々な特徴を付加した媒体がベクターとして使い分けられます。例えば、ライブラリーをつくるためのベクターやクローニングするためのベクター、挿入したDNA断片からタンパク質を翻訳させる発現ベクター等です。
ベクターにはウイルスベクターとプラスミドベクターが存在します。ウイルスが持つ病原性に関する遺伝子を取り除き、外来の目的遺伝子を組み込んだのがウイルスベクターです。細胞レベルから動物個体レベルでの遺伝子機能解析や、ヒトの遺伝子治療への応用が期待されています。ウイルスベクターにはアデノウイルス、アデノ随伴ウイルス(AAV)、レトロウイルス、レンチウイルス等が応用されています。
一方、遺伝子組み換え実験に使うプラスミドベクターは、バクテリアに内在性の自律増殖DNA(プラスミド)を応用したものです。人工的に変化させ、薬剤耐性遺伝子や制限酵素サイト、目的遺伝子等を追加して遺伝子クローニング実験に使いやすくしたプラスミドDNAです。
宿主とベクターとは何でしょうか?宿主(しゅくしゅ)とは、ウイルスなどの寄生体が感染し、その生体内の一部を利用して子孫を増やすために利用する生物体を示し、ベクターとは、遺伝子組換え技術において、外来DNAの導入、複製、発現に用いられるモノで、「運び屋」とも呼ばれている。遺伝子組換えでは、大腸菌など微生物(宿主)の仕組みを利用しながら、プラスミドベクターなどの数を増やすことが出来ます。
ベクターとは何でしょうか?ベクター (vector) とは、外来遺伝物質を別の細胞に人為的に運ぶために利用されるDNAまたはRNA分子である。任意の遺伝子やDNA、RNA配列を導入先の細胞内で増幅・維持・導入させる、いわゆる遺伝子組換え技術に用いられる。具体的には、プラスミドやコスミド、ラムダファージ、および人工染色体(英語版)等を指す。これらのベクターは実験操作を簡便にする目的で、複製起点、マルチクローニングサイト、および選択マーカーを持つことが多い。語源はラテン語の運び屋 (vehere) に由来する。外来DNAを含むベクターは通常、組換えDNAとみなされる。
ベクター自体は単純なDNAおよびRNA配列であり、インサート配列(導入遺伝子)を他の細胞等に導入するための輸送器(バックボーン)として機能する。一般的に細胞へ遺伝情報を移入する目的の一つは、標的細胞で導入遺伝子を単離 (isolate) したり、あるいは増幅 (cloning) させたり、発現 (express) させたりすることが多い。原理的にはあらゆるベクターはクローニングに使用することができるが、クローニングの目的に特化して設計されたベクター(クローニングベクター)も存在し、一般的にクローニング用途やライブラリー作成としてはそれらが利用されることが多い。pBR322プラスミドは、 クローニングベクターとして広く使用されるプラスミドの1つである。
一方で、導入遺伝子の転写やタンパク質発現などの目的のために設計されたベクターも存在する。標的細胞における導入遺伝子の発現を目的として設計されたベクターのことを発現ベクターと呼び、これらは一般的に導入遺伝子の発現を促進するようにプロモーター配列を組み込むことで、挿入したDNA断片からタンパク質の翻訳を促進させている。他方、転写ベクターと呼ばれるより単純なベクターは転写のみを目的としており、導入先の細胞内で複製を進めることはできるが、導入遺伝子の翻訳は行うことができない。そのため転写ベクターは、挿入遺伝子をmRNAで増幅する目的で使用される。また、挿入するDNA断片の大きさや挿入の目的によって、それを挿入するために様々な特徴を付加された媒体がベクターとして使い分けられる。
DNAの操作は通常、大腸菌での維持に必要な要素を含む、いわゆる大腸菌ベクターで行われる。他方、大腸菌に加えて酵母や植物、哺乳動物等に由来する細胞系で維持するためのベクターも存在し、 シャトルベクターと呼ばれる。このようなベクターでは、非細菌の宿主生物に移入可能な細菌・ウイルス的な要素を有する。
ベクターを標的細胞へ入れることは通常、細菌細胞の形質転換、真核細胞であればトランスフェクションと呼ばれ、ウイルスベクターの場合では形質導入と形容されることもある。
プラスミドベクター
プラスミドを改変し、ベクターとして利用したものである。プラスミドは、宿主細胞の複製機構を使用して複製できる、二本鎖の染色体外のDNA配列を指し、一般には環状である。プラスミドベクターは、宿主内でプラスミドを半独立的に複製させるための複製起点を必ず持っている。プラスミドは大腸菌を含む多くの細菌・古細菌に広く見出されるだけでなく、例えば、酵母やサッカロミセス・セレビシエ(Saccharomyces cerevisiae)といったいくつかの真核生物においても見つかっているバクテリアのプラスミドは接合性(伝染性)のものと非接合性の2種類に大別できる。接合性のものは、細胞同士の接合を介してDNAの転移が媒介されるため、個体群の細菌細胞間で急速に広がる。例えば、Fプラスミド、Rプラスミド、いくつかのcolプラスミドが知られている。一方で、非接合性のものは接合によってDNAを媒介せず、Rおよびcolプラスミドで多く知られている。
一般的なクローニング目的では、この用途に特化して機能をデザインされたプラスミドを利用する場合が多い。これらのプラスミドは、一般に非接合性であり、他の様々な機能が付加されている。例えばマルチクローニングサイトと呼ばれる、複数の制限酵素切断部位が連なる部位は、導入遺伝子配列の挿入領域として利用することができる。クローニングベクターを導入された細菌は、数時間で何百万ものベクターのコピーを細菌内で生成し、増幅されたベクターを細菌から抽出して下流の実験操作に利用することができる。一方で転写ベクターとして利用されるプラスミドは、遺伝子発現を行わないように、あえてタンパク質発現に重要な配列を欠いている場合がある。また、タンパク質発現に使用される発現ベクターのプラスミドでは、リボソーム結合部位 、開始コドン、停止コドンなど、タンパク質の翻訳のための要素が含まれている。
ウイルスベクターとかプラスミドベクターとは何でしょうか?
ウイルスベクターは一般的に感染効率が高いという特徴があり、頻繁に用いられます。ヒトへの感染も考えられるため安全キャビネットで取り扱う必要があります。
プラスミドベクターはウイルスベクターほど高い感染効率は望めない場合が多く、低毒性で生化学的なアッセイや目的の分子を常に発現する細胞株を樹立する場合に適しています。いずれのベクターも一長一短があり、研究現場では最終的な目的に合わせてベクターを選択します。
