前回の続きです!初めての方はこちらから読み始めてください。かなり専門的で極めて理解するのに時間がかかると思いますが頑張ってついてきてください!!!
アミロイドーシスの原因はすべてヘルペス感染によって溶解感染のために崩壊して壊死してしまった細胞のあらゆる蛋白質の最終的なゴミがアミロイドです。アミロイドーシスはすべての蛋白の火葬場です。完成された蛋白質はアミノ酸配列からはペプチドになり、最終的には四次構造の立体構造となるのですがこの完璧な構造は最初のアミノ酸配列でほぼ一義的に決まっており自発的に自然とおこなわれてしまうのです。したがって最初のアミノ酸配列がヘルペス感染により変えられてしまうと一義的に決まって完成された蛋白は自発的に自然と崩壊してしまい細胞内や細胞外マトリックスの蛋白は崩壊産物としてアミノロイドとならざるを得ないのです。細胞自体のみならず細胞外空間を満たして細胞の構造と機能とを維持してくれている「細胞外マトリックス」を構成している細胞内にあるタンパク質よりもより多く見られる蛋白の立体構造も崩壊して「細胞外マトリックス」の蛋白も同時に蛋白のガラクタとなってしまいそれがアミロイドになるのです。細胞外マトリックス(ECM)はほとんどが繊維状タンパク質とプロテオグリカン(PG)の二種類の高分子で構成されていますのでアミロイドの線維成分はECMの繊維状タンパク質の崩壊産物が大部分を占めているのです。更に全ての細胞に存在している細胞骨格は線維蛋白も不溶性の線維成分であるガラクタのアミロイドになるのです。細胞骨格(cytoskeleton)とは、細胞を支持して安定化させる骨格の役割を持っていますが、骨格と言っても骨ではなく線維でできた骨のように頑丈な繊維性の物質なのです。すべての細胞は、たとえバクテリア(細菌)でさえ、同じような繊維でできた細胞骨格を持ちます。細胞骨格は、細胞の形状とその機械的特性を示します。細胞運動、細胞分裂、細胞内輸送、細胞シグナル伝達等、多くの動的な細胞プロセスを細胞骨格と言われる頑丈な繊維が支えているのです。
繊維とは何か
さて、「繊維」とはいったい何でしょう?「繊維イコール衣料」というイメージを離れ、原点に帰って考えてみると、つまるところ、繊維とは「細くて長いもの」であり、それを集めてつくったのが「繊維製品」です。そこから出発して、様々な機能と製品との関係を考えることができます(図6)。
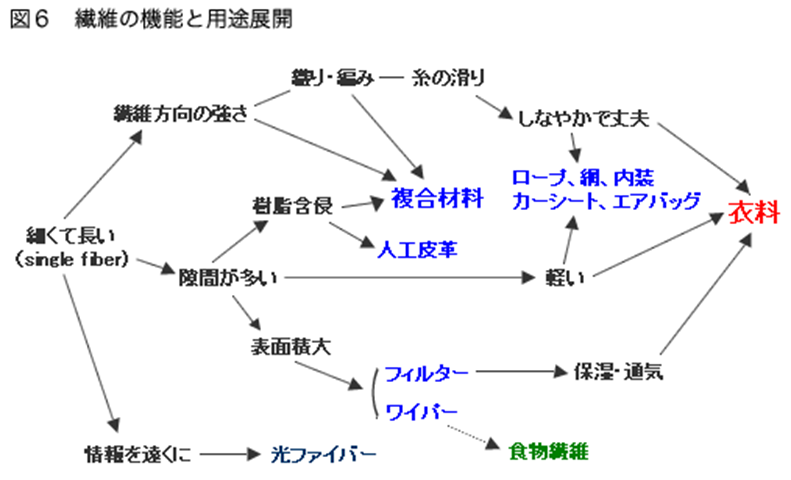
通常、我々が目にする「糸」は、「繊維」を紡績や撚糸等によって集めたものです。「繊維状のものは繊維方向に引っ張ったときに強い」という性質を持っていますが、繊維を集めて糸にして、それを織ったり編んだりすることによって、糸の滑りを利用したしなやかで丈夫な製品ができます。これを活用したものに、ロープ・カーシート・エアバッグなどがあります。
細くて長いものを集めた素材は、隙間がたくさんできます。繊維を骨組みにして強化した樹脂が複合材料です。ここでは「織りや編み」は複数方向の強さを持たせることに、「隙間が多い」ことは樹脂を浸み込ませるのに役立ちます。
また、隙間が多いということは、「表面積が大きい」ということでもあり、これがろ過を目的とするフィルター、ふき取りを目的とするワイパーの用途に結びつきます。さらにフィルターとは「何かを通して、何かを通さない」ことですから、保温通気、防水透湿などの機能に結びつきます。
さらに、隙間が多いものは軽くなります。軽い、
しなやかで丈夫、
保温通気などフィルター機能を併せ持つのが衣料と位置づけることができます。
これらをみると、古くからある「衣料」は、実は繊維の持つ様々な機能を集約したものであることがわかります。そしてそこから産業用繊維が開発される場合は、むしろ図6の矢印を逆にたどっていくといえるでしょう。いずれにしろ、繊維を「細くて長いもの」ととらえなおすことにより、その世界は大きく広がるのではないでしょうか。
アミロイドの定義は、病理学的にアルカリコンゴ赤染色で橙赤色に染まり、偏光顕微鏡下で緑色の複屈折を示すものである。herpesによる溶解感染によって細胞が崩壊してしまい 細胞内の蛋白質が立体構造(コンフォメーション)を変化させて正常な立体構造が破壊されて蛋白の「ゴミ」として細胞外にアミロイドとして凝集し蛋白機能障害として様々な疾患を引き起こします。立体構造を失った蛋白は7つの機能を失ってアミロイドーシスと言われる病気を起こします。何故ならばタンパク質の命である機能は「立体構造」によって支えられているからです。しかもヘルペスによる溶解感染で細胞や組織が崩壊して破砕された構造の残骸は何千というたんぱく質の混合物のみならず水に溶けにくい脂質やタンパク質や脂質と結合した炭水化物の構造物が跡形もなく残骸になるわけですから今なおアミロイドの実態を突き止められていないのは当然なのです。大天才であったウイルヒーヨでさえ100年前はアミロイドと呼ばれるナイロンに似た線維状の異常タンパク質をアミロイド線維は多糖であると考えていたのですから。
タンパク質の立体構造はどのようになっているのでしょうか?分子同士の共有結合とは何でしょうか?タンパク質がherpesによって機能を失うのは正常な細胞と細胞外マトリックスの線維成分のタンパク質の立体構造が崩壊することによって蛋白のガラクタが集積したのがアミロイドなのです。タンパク質の立体構造の基本はたんぱく質も一つ一つ分子が水素結合、イオン結合、ファンデルワース力、共有結合以外に疎水性相互作用によって構造を維持しているのです。疎水性とは蛋白のアミノ酸側鎖の疎水性つまり「水」を嫌う性質なのです。皆さんは「水こそ生命を保護してくれるありふれた優しい物質」と思っておられるでしょうが実はむしろ特殊で物質を破壊する攻撃的な物質なのです。
それは水の分子式はH2Oですが二本の共有結合で繋がったH-O-Hという一つの分子が二つの負極と正極の極性を持った双極子という微小な磁石になっておりHが正極でOが負極であることに由来する極性を水分子自身が持っているからです。この様な低分子は他には存在しないのです。水分子は二本の共有結合で繋がったH―O―Hで二本のーの直線で結合を示しています。このーの二本の直線は共有結合が二か所あるのです。一本の共有結合は電子が二個で繋がっていることなのです。本来ならば電子を・示しますとH―O―HはH:O:Hなのです。つまりーの直線は二個の電子を表しているのです。共有結合は電子を一個ずつ出し合って電子対を共有して原子を結合させているので電子を共有して結合と言うべきで二つの異なった分子が電子で共有結合しているのです。
ところがO原子は「非共有電子対」という共有結合に使われていない電子対があるので電子共有結合にしたくて電子が欲しくてたまらないのでいろいろの物質の分子から電子を奪い取る力があるのです。「非共有電子対」を持っているOは電子を奪い取るための攻撃をするのです。これらのOのような「非共有電子対」にはこのように欲張りなので反応し易くこの反応性で「加水分解反応」が生じるのです。この反応で電子を奪い取ろうとするのです。
実はタンパク質の立体構造の結合維持には上に上げた結合力が寄与しているのですが最も大きな力は「疎水性相互作用」なのです。疎水性相互作用とは何でしょうか?疎水性分子や疎水性物質が水中に存在するとき、水と接することを嫌うために疎水性化合物・疎水性物質同士が集まって安定化する作用です。それではタンパク質の疎水相互作用とは何でしょうか?
タンパク質分子中の非極性側鎖が水中において水分子との接触を避けて互いに集合しようとする相互作用です。 非常に弱い力ではあるが、タンパク質の立体構造の形成に最も重要な因子の一つである。 タンパク質の主鎖が折りたたまれるとき、水を嫌う疎水性基はなるべく水との接触を避けようと、タンパク質の内部に配置されタンパク質の表面には親水性の分子が集まりタンパク質そのものは水溶性になる立体構造が決まるのです。しかし疎水性の内部には親水性のアミノ酸の側鎖がすこし混ざっているのですが実はこれがまたタンパク質の安定性をさらに高めているのです。疎水性の内部環境を邪魔しないように内部の親水性側鎖同士が互いに水素結合やイオン結合が持つ極性や電化を打ち消しあうのです。酵素の触媒作用で重要な働きをするのも内部に埋もれた親水性の側鎖なのです。
タンパク質の立体構造は四つの階層の一次構造から四次構造からなりたっています。
一次構造はアミノ酸配列そのものです。
二次構造はタンパク質に共通に見られる基本パターンである複数のαヘリックスと、複数のβ構造(βストランド)を作るβシートと、αヘリックスとβ構造をつないでいるループとターンの4つがあります。平均的な蛋白はこのαヘリックスとβシートとループとターンの4つで出来上がった構造から成り立っています。
三次構造は二次構造が組み合わさった立体構造です。タンパク質が一個のポリペプチドだけで構成され場合はこの三次構造が最終形となります。
四次構造はタンパク質が複数のポリペプチドからできている時には個々のポリペプチドをサブユニットと言うのですがこのサブユニットのペプチドの構成と配置をを示す構造を四次構造の完成された蛋白となります。
二次構造と三次構造の間には更に中間的な階層があります。二次構造のすぐ上には「超二次構造」である「モチーフ」という階層があります。蛋白と言う家を建てるときに必要な「モジュール」と言う部品のようなものです。「超二次構造」とは二次構造のαヘリックスとβシートとループとターンの組み合わせでヘリックス-ループ-ヘリックスとかコイルドコイルとかβαβなどがありまβαβはβシートαヘリックスβシートが並んでいるのです。「モチーフ」の上に「ドメイン」があり構造的・機能的なまとまりをもつタンパク質の構成単位でドメインだけを切り離しても元のドメインと同じ構造を維持できるのです。ドメインは家のユニット部品と似たものと考えてください。
最後の蛋白の完成品となる「折り畳み構造」はどのようにして行われるのでしょうか?ポリペプチドの最終的な四次構造の立体構造はアミノ酸配列でほぼ一義的に決まっており自発的に自然とおこなわれてしまうのです。
完璧に蛋白の構造が出来上がって初めて10万種類の蛋白しかできない機能が発揮可能となるのです。
タンパク質の機能は幅広くすべての蛋白の役割をリストアップすればきりがないのです。ヒトの体内に存在するタンパク質は、約10万種類におよびます。しかしタンパク質の機能の種類は7つに分類できます。一つの蛋白が2つ以上に機能を持っていることも有ります。
①構造タンパク質。細胞や人体の構造や形態を形成して維持する。爪や毛を作るケラチン。結合組織を作るコラーゲン。細胞骨格や筋肉を形成するアクチン。
②酵素タンパク質。生体内の化学反応を触媒する。極めて多くの代謝酵素がある。酵素は球状蛋白が多い。大多数の蛋白は球状蛋白なのです。
③貯蔵蛋白質。小さな分子を貯蔵する。フェリチンは鉄を貯蔵する蛋白です。カゼインはイオンやアミノ酸を貯蔵。カゼインは、乳たんぱく質の約80%を占めています。牛乳に含まれるカゼインは比較的ゆっくりと吸収されることが特徴です。摂取後長い時間にわたって血中のアミノ酸濃度やイオンを維持でき、かつ体内のたんぱく質の分解を持続的に抑制する。
ミオグロビンは酸素を貯蔵できます。ミオグロビンは骨格筋と心筋に存在する低分子量のヘム蛋白質であり、酸素の貯蔵体です。ヘモグロビンと同様に酸素と可逆的に結合するが、ヘモグロビンよりも酸素親和性が高く効率よく血中の酸素を貯蔵できると同時に必要に応じて筋肉組織内に酸素を運搬する機能を担っている。
④輸送蛋白質。小さい分子や生体分子を輸送します。ヘモグロビンは酸素を、血清アルブミンは脂肪酸や他の様々な分子を、リポ蛋白は脂質を輸送できます。リポ蛋白は脂質とアポリポタンパク質が結合した球状の複合体粒子である。 水に溶けない脂質であるトリアシルグリセロール(トリグリセリド、中性脂肪)および、細胞の生命維持に不可欠なコレステロールを多く含む球状蛋白粒子であり、水に溶けない脂質を吸収部位や合成部位から使用部位へ輸送します。
⑤受容体蛋白質。細胞外からのシグナルをホルモンや神経伝達物質などの受容する蛋白。神経伝達物質のイオンチャンネルの蛋白受容体。Gタンパク質結合型受容体蛋白には水溶性ホルモンの受容体や嗅覚や味覚の受容体があり膜蛋白です。ステロイド受容体は細胞内の核または細胞質にある転写因子にもなるとなる受容体蛋白です。
⑥転写調節蛋白質。遺伝子の発現を調節する蛋白。転写調節領域に結合するDNA結合タンパク質である転写因子です。この転写因子はZnフインガーやロイシンジッパーなどのモチーフを持っています。更にクロマチン構造を変化させる因子はアセチラーゼやATPアーゼなどの酵素活性を持っています。アセチラーゼとは酢酸エステルの合成を促進する酵素。酢酸エステルとは酢酸とアルコールから生成するエステルの総称で、一般式CH3COO―で表される化合物です。エステルとはアルコールと酸(通常はカルボン酸)の脱水縮合反応 で作られる有機化合物。ATPアーゼとはATP(アデノシン三リン酸)を加水分解してADP(アデノシン二リン酸)と無機リン酸を生じる反応を触媒する酵素の総称。ATPとは生体内のエネルギー通貨であり、エネルギーを要する生物活動に関連したタンパク質であれば、この酵素の活性を持っている。 日本語ではATPアーゼを「アデノシン三リン酸分解酵素」と訳します。
⑦モータータンパク質。「モータータンパク」の日本語の意味は「運動性タンパク質」であり、アクチンフィラメントまたは微小管と作用して細胞内の運動や細胞内の輸送に関与するタンパク質です。アクチンやチューブリンのような構造タンパク質と相互作用して、運動を行うタンパク質であるミオシン、キネシン、ダイニンなどのモータータンパク質は、同時にATPアーゼなどの酵素活性をも持っています。モータータンパク質は、細胞内輸送にかかわるタンパク質です。 様々な物質と結合した状態で細胞骨格の上を移動し、細胞内で物質輸送を行う特徴があります。細胞骨格は主にアクチンフィラメント、中間径フィラメント、微小管という、タンパク質でできた3種類の繊維からなる。 モータータンパク質のうち、微小管の上を移動するものは、キネシンとダイニンです。 キネシンとダイニンはそれぞれ逆方向に移動し、一方向にのみ物質を輸送します。モータータンパク質(モーターと略すことも有る)は微小管の上をチームとして協働して移動することで、細胞内の物質輸送や細胞分裂を行うなど、生体内で重要な役割を果たしています。モータータンパク質は、細胞内輸送にかかわるタンパク質で輸送蛋白質は細胞外の主に血液中での物質輸送に関わっているという違いがあります。
この様な多種多様な構造と機能をもった生命をささえている細胞にherpesウイルスが感染して限りなく増殖するときに正常なタンパク質がどのように異常をきたすのか現代の医学者は一切触れないのです。
アミロイド(Amyloid)はヘマトキシリン・エオジン染色でみるとエオジンで淡いピンク色に染まる無構造の細胞外沈着物である。この無構造の細胞外沈着物がなぜ起きたかを研究しないで目で見える現象だけを論じているだけが研究と称されているだけです。アミロイドは細胞内にも見られますから細胞外沈着物であると定義するのは間違っています。
すでに詳しく述べたように蛋白質の立体構造は1次~4次構造の4つの階層から成り立っています。「1次構造は」アミノ酸配列そのものであり、「2次構造」はαヘリックスのようなα螺旋状とβシート(β薄板)のようなしっかりしたβ薄板構造はすべての蛋白質に共通にみられる基本的な「2次構造」のパターンです。つまり「2次構造」は「螺旋状の蛋白」と「薄い板状の蛋白」から成り立っているのです。更に二次構造には他に湾曲を示すループの部分とターンというループより短く角度が急である湾曲を描く部分があります。また二次構造のβシートを構成するタンパク質の構造がありβストランド(β strand)と言います。βストランド(β strand)には2種類あり一本鎖βストランド構造とシート形成βストランド構造です。ストランドの意味は「より糸とか一筋の糸」です。単純に一筋の糸のように伸びたβストランド構造でβストランド構造の主鎖のアミド基と他のβストランド構造のアミド基が水素結合していない構造のことを一本鎖βストランド構造と呼びます。アミド基(-CO-NH2)とは、水酸基がアミンまたはアンモニアで置き換えられたカルボン酸の誘導体。 この反応でアミノ酸間にペプチド結合が形成される。一方シート形成βストランド構造はアミド同士が水素結合している構造はシート形成βストランド構造と呼ばれ、βシート構造に属しているβストランド構造であります。
βシートは伸びきった状態のタンパク質主鎖(βストランド構造)が2本以上,水素結合網で連結することにより形成されます。
「三次構造」は二次構造が組み合わさった立体構造です。タンパク質が1個のポリペプチドだけで構成される場合は「三次構造」が最終の構造となります。
蛋白質が複数のポリペプチドからできている場合は個々のポリペプチドをサブユニットと呼びこのサブユニットの構成と配置を表す「4次構造」という最も高い階層の蛋白構造となるのです。
2次構造と3次構造の間にはさらに2つの超2次構造といわれる「モチーフ」と言う簡単な蛋白の構造がありさらに「モチーフ」という階層の上に「ドメイン」という複雑な蛋白の階層があります。「モチーフ」はいくつかの2次構造が一定のパターンで組み合わさったもので小さい部品から成り立っているスイッチ部品や電気部品のようなモジュールに似ていますが、「ドメイン」はもう少し階層の高いユニットバスになっているようなものです。つまり2次構造の上に「モチーフ」がありその上に「ドメイン」があり3次構造が続くことになるのです。
ポリペプチド(蛋白)の立体構造は実は1次構造であるアミノ酸の配列でほぼ一義的には決定されているのです。生物学的に機能するコンホメーション(立体構造)であるタンパク質鎖の三次元構造を取るには迅速かつ再現性のある方法で獲得する物理的なプロセスである。タンパク質の折り畳み(Protein folding読み方はフォールディング )は自発的に行われますが、この自発的な折り畳みの過程を補助して効率的に行わせるのは分子シャペロンです。折り畳みの初期にはhsp70ファミリーの分子シャペロンが働き、完全な折り畳みの最終段階ではhsp60ファミリーの分子シャペロンであるシャペロニンが働きます。
タンパク質の機能は折りたたみ(フォールディング)構造に依存しています。タンパク質は1個ずつ単独に折りたたまれていて、内側は水を嫌う疎水的なもの、外側は水を好む親水的なもので構成されています。この点は細胞膜に似ていますね。
アミロイド(Amyloid)はコンゴーレッド染色で赤橙色に染まり偏光顕微鏡で緑色偏光を呈し、電顕では8〜15nmの繊維構造を呈する物質として定義される。ドイツの病理学者であるウィルヒョウはこの物質の本体を「澱粉様物質」と考えアミロイド(類澱粉質)と命名したが、その後、この物質の本体は蛋白質であることが判明した。生体に存在する様々な線維蛋白を多く持っている細胞や細胞外基質の細胞にherpesが感染して変性するとアミロイドになるのです。それぞれの蛋白の特性に対応したアミロイドタンパクの名称が付けられているのです。アミロイドが由来する正常な蛋白すなわちアミロイド前駆蛋白は多種多様であり、一定のアミノ酸配列や構造を有していることはないのですが線維性タンパクなのです。蛋白の線維の違いにかかわらず共通したアミロイドの線維性の病理学的性状を呈する。
アミロイド形成過程では前駆蛋白あるいは前駆蛋白が蛋白分解を受けた断片が立体構造を変化させβシート構造に富む蛋白(断片)が重合・凝集し最終的にアミロイド線維が形成される。形成されたアミロイド線維は不溶性であり、組織、臓器に沈着する。沈着部位や沈着量により臓器の機能不全が生じる。ただしアルツハイマー型認知症の脳にみられるアミロイドβ蛋白(Aβ)の重合・凝集過程では最終的に形成されるアミロイド線維よりもオリゴマーやプロトフィブリルとよばれる中間的な凝集体のほうがより強い神経毒性をもつ。なおレビー小体や神経原線維変化は細胞内のアミロイド類似の線維性構造物であるが細胞外沈着物であるアミロイドとは定義上区別される。
細胞外マトリックス(ECM; Extracellular matrix)とは何でどんな物質からできているのでしょうか?結合組織に大量に存在しているのは細胞外マトリックスであり結合組織には数は少ないのですが様々な細胞がいますがその代表は線維芽細胞(fibroblast)です。細胞外マトリックスを産生するのはこの線維芽細胞(fibroblast)なのです。線維芽細胞(fibroblast)には他に軟骨細胞(chondrocyte)、骨芽細胞(osteocyte)、脂肪細胞(adipocyte)の合計4種類です。これら4種類の細胞は結合組織で生れた土着の細胞です。この4つの細胞のいずれも共通の幹細胞(primitive mesenchymal cell)に由来するのです。結合組織には血液細胞やリンパ系の免疫細胞も多いので組織に出たherpesをつかまえるのです。マクロファージ、好中球、形質細胞などで造血細胞(hematopoietic stem cell)由来です。これらの免疫細胞は血管壁を通って結合組織に侵入してきた「よそ者」で結合組織を動き回って免疫監視をしているのです。従って結合組織は免疫系のパトロールの場を提供しているのです。つまり免疫は人体のあらゆる組織で活躍しているのです。
結合組織は不定形の組織です。結合組織には①疎性結疎性組織で上皮、血管、リンパ管、筋肉、神経線維を支える。②密生結合組織でコラーゲン多く細胞は少ない。③細網組織でⅢ型コラーゲンからできている細網繊維と特殊な線維芽細胞である細網細胞からなり骨髄、リンパ節、脾臓などに多く単球、マクロファージが多く存在します。④脂肪組織で死亡の貯蔵に特化した組織で脂肪細胞が多い。白色脂肪組織と褐色色脂肪組の二つがある。⑤軟骨(cartilage)軟骨芽細胞と軟骨細胞が存在する。マトリックスはコラーゲン、ヒアルロン酸、プロテオグリカンを含む。ガラス軟骨、弾性軟骨、繊維軟骨の三種類がある。Herpesが原因であるリウマチで軟骨が解けるのはまず結合組織のすべての細胞の幹細胞である間充織の幹細胞と軟骨芽細胞の二つの細胞にヘルペスが感染するからです。⑥骨で骨の中には骨芽細胞、骨細胞、破骨細胞が存在しています。骨マトリックスの主成分は無機質のヒドロキシアパタイトと言われるリン酸カルシューム化合物です。しかも骨膜の内側(骨の外表面)と骨髄に面した骨内膜の両方に骨の幹細胞と骨芽細胞があるのです。
細胞外マトリックス(ECM; Extracellular matrix)はすべての組織、臓器中に存在する非細胞性の構成成分です。近年では、ECMは細胞にとって物理的な足場となるだけではなく、組織の形態形成・分化・ホメオスタシスに必要とされる重要な生化学的・生物力学的な合図を出す働きもあることが分かってきました。ECMタンパク質の遺伝的異常による症候群においては、その症状の重篤さに関わらず、ECMの重要性は証明されています。 基本的にECMは水、タンパク質および多糖類で構成されていますが、各組織には独自の組成や形態のECMが存在します。ECMの独自性は組織の発達段階で形成され、動的かつ相互的な生化学的・生物物理学的な細胞同士の、ひいてはタンパク質など微小環境との相互作用が影響します。ECMとの細胞接着は、インテグリンなどECM受容体を介して行われます。細胞接着はECMへの細胞骨格結合を媒介し、ECMを通過する細胞遊走にも関わります。さらに、成長因子との結合や細胞表面受容体との相互作用によって、シグナル伝達の誘発や遺伝子翻訳の制御など必要不可欠な形態的組織形成・生理学的機能を指揮する働きもあります。ECMは主に繊維状タンパク質とプロテオグリカン(PG)の二種類の高分子で構成されています。ECM中の主な繊維状タンパク質は、コラーゲン、エラスチン、フィブロネクチン、ラミニンです。PG(プロテオグリカン)は組織中で水和ゲルの状態となり、細胞外間質の隙間を埋める役割を担います。なお、末梢神経の神経線維は、多くの神経線維が結合組織により束ねられて、肉眼でも見える1本の神経になっています。髄鞘は何で出来ていますか?髄鞘(ミエリン)は,神経細胞に機能を与える役割を持つ鞘(さや)様の脂質に富む構造体である. ミエリンの主要成分は脂質であり,総重量の70~80%にのぼる. 残りの約20%はタンパク質から構成される。髄鞘はリン脂質に富んだタンパク質で層構造を形成しているため、非常に良い絶縁体の役割を果たす。髄鞘は細胞形質膜の多層構造体であるため、他の多くの細胞の形質膜や細胞内小胞膜と比べてタンパク質成分が少ない。脳の内外のほとんどの神経線維は、脂肪(リポタンパク質)でできた何層もの組織(ミエリンといいます)に包まれています。
コラーゲン
コラーゲンは、結合組織と基底膜の主要なタンパク質成分で、伸張強度と組織分布の異なる多数の型(タイプIからXVIIIまで)が存在します。多くの体内組織中の構造の硬さや柔軟さ、構造変化は、細胞の制限や区分化と同様に、コラーゲン組成の変化によるものです。血管内皮を取り囲んでいる基底膜は、多くの機能を持つECMタンパク質の特殊化した薄いネットワークで、最近強い関心を持たれている領域のうちの一つです。この膜はタンパク質、糖タンパク質(コラーゲン、ラミニン、エンタクチン、フィブロネクチン、ヘパリン硫酸塩、パールカン等)から構成され、上皮とその下にある組織の間の物質的なバリアとして機能しています。インテグリン、レセプター・キナーゼ、細胞表面プロテオグリカンを通して、細胞表面の足場を提供し、細胞の分化を誘導し、構築をサポートし、正常細胞の移動を制限します。基底膜のECM成分や周囲の組織を分解する腫瘍細胞の能力は、転移能に直接的に関わります。癌細胞は、タンパク質分解酵素(MMPコラゲナーゼ、プラスミノゲン活性剤、カテプシンなど)を放出することにより、膜を破り、血管壁を透過することができます。コラーゲンは、基底膜と組織足場タンパク質の主要な構造要素であることから、腫瘍細胞の移動の主要な抑制剤であることが示唆されます。
アミロイドーシスの分類
アミロイドーシスは繊維構造をもつ不溶性蛋白であるアミロイドが、臓器に沈着し機能障害をおこす疾患の総称(疾患群)として定義される。全身諸臓器にアミロイドが沈着して衰弱、貧血、心アミロイド沈着による心症状、消化器障害、腎症状(ネフローゼなど)、手足のしびれなど注目する症状を起こす。全身性にヘルペスが感染した時に見られる全身性アミロイドーシスと、ある臓器にだけherpesが感染した時に見られる限局した沈着をしめす限局性アミロイドーシスに大別され、さらにアミロイド前駆蛋白に対応する臨床病型に分類される。アミロイド前駆蛋白が特定組織に限局すると限局性アミロイドーシスとなり、血液中に存在すると全身に分布するため全身性アミロイドーシスとなる。全身性アミロイドーシスもアミロイドの組織親和性により様々な沈着パターンを呈するのはherpesが溶原感染から溶解感染になるまでの間にherpesがどれだけ細胞の機能と構造にダメージを与えたかによって決まるのです。
全身性アミロイドーシスはherpesの感染が全身に及んでいることを示しています。
ALアミロイドーシス
ALアミロイドーシスはBリンパ球に感染したヘルペスが遺伝子が変えられてしまった異常形質細胞によって産出されるモノクローナル免疫グロブリン(M蛋白)の軽鎖(L鎖)由来のアミロイドALが全身諸臓器(心臓、腎臓、消化管、肝臓、末梢神経など)に沈着する。ALにはλ鎖由来のAλとκ鎖由来のAκがありAλの方がAκよりも多い。まれに重鎖(H鎖)由来のアミロイドAHが沈着するAHアミロイドーシスがみられる。ALアミロイドーシスとAHアミロイドーシスを免疫グロブリン性アミロイドーシスとよぶ。多発性骨髄腫や原発性マクログロブリン血症などの基礎疾患を伴わない場合は原発性ALアミロイドーシスとよぶ。原発性ALアミロイドーシスはMGUS(monoclonal gammopathy of undetermined significance)に随伴したものと考えられているがMGUS随伴例と骨髄腫随伴例か鑑別困難な例もある。医学者は病気の原因には全く興味がなく病名をつけたり表層的なわずかな違いを分類することが趣味のようで病気を治すことにはまるで興味がないどころは病気つくりに励んでいるようです。アミロイドもアミロイドーシスもすべてヘルペス感染によって細胞の正常な構築と機能が不可能になり特に蛋白の立体構造が崩壊してしまいその崩壊の過程で10万もある個々の蛋白の最終産物が不溶性のアミロイドなのです。
2004年の日本の統計では免疫グロブリン性アミロイドーシスおよび老人性TTRアミロイドーシスを含めた有病率は人口100万人あたり6.1人と推定されている。いわゆるアミロイドーシスの約70%が免疫グロブリン性アミロイドーシスと考えられている。アミロイドの沈着は心臓、肝臓、腎臓、消化器、末梢神経など多臓器にわたるのはそれぞれの臓器に感染したヘルペスが様々な蛋白を崩壊させてアミロイドになってしまっただけです。初期には全身倦怠感、体重減少、浮腫、貧血などの非特異的症状があり、これもヘルペスのなせる細胞の機能障害であり経過中に鬱血性心不全、蛋白尿、吸収不良症候群、末梢神経障害、起立性低血圧、手根管症候群、肝腫大、巨舌、皮下出血などを呈するのもヘルペスはあらゆる250種類に近い細胞に感染して各臓器の症状をきたすのです。巨舌は特徴的であり約20%に認められる。血管への沈着が著明であれば出血傾向を呈し、紫斑や皮下出血、粘膜下出血を認める。眼窩周囲に紫斑が認められる場合、アライグマの眼サインと呼ばれる。末梢神経障害として知覚障害、無感覚、筋力低下を認める。感覚障害は通常左右対称性で下肢に多く、ときに痛みを伴う。手根管症候群は他の症状より1年以上先行して見られることが多い。診断は厚生省特定疾患調査研究班による免疫グロブリン性アミロイドーシス(AL型)の診断基準と第10回国際アミロイド・アミロイドーシス会議コンセンサス・オピニオンによる診断基準があるのですが原因については一切触れられていません。組織診が重視されるが腹壁の脂肪吸引生検は安全かつ診断率が高い。組織診をやったところでherpesが原因ではないかとしょっぱなからターゲットを絞らなければ絶対に正しい診断はつきません。私のような馬鹿でもわかっているのに何故賢過ぎる学者がわからないのでしょうか?それはヘルペスが現代世界に残った最後の病原体はherpesである事がばれるのみならずherpesを増やした張本人こそ医薬会社であり医者であることがわかり責任を取らなければならなくなるからです。哀れですね!!!
ALアミロイドーシスの予後は不良であり無治療例での診断からの生存期間中央値はおよそ13ヶ月である。特に心病変を有する例は予後不良である。遊離軽鎖(FLC)も予後因子である。治療の目標はアミロイド蛋白の原因となっているモノクローナルなFLC(free light chainの産生を速やかに抑制し臓器機能を温存することにあると医学者は口をそろえて言うのですが口先だけですね。抗ヘルペス剤を大量に投与すれば治るのに誰がしますか?第10回国際アミロイド・アミロイドーシス会議コンセンサス・オピニオンでは原発性アミロイドーシスの治療判定基準がある。最も有効な治療は65歳未満ならば造血幹細胞移植の自家末梢血幹細胞移植であるが治療関連毒性が多発性骨髄腫の場合と異なり高いため適応は慎重に検討する必要がある。無駄です!!!自己末梢血幹細胞移植の適応がない場合はメルファランとデキサメタゾンの併用療法が行われる。多発性骨髄腫で行うVAD療法はALアミロイドーシスでは実施する意義が乏しいと考えられている。すべて間違った医療です。恥ずかしい医療であることに誰も気が付いていません。お金を儲けるために患者に苦しみを与えるだけの医療は止めにしてください。病気を治すのに医者も薬も必要ではないのです。原因治療と患者の免疫だけです。
年齢や臓器障害の程度、全身状態などから適応ありと判断される症例では、自家末梢血幹細胞移植併用大量メルファラン療法を行い、適応が無い場合は、メルファラン-デキサメタゾン併用(MD)療法を行う。
AAアミロイドーシスもヘルペス感染による細胞の蛋白の崩壊のなれの果てです。
AAアミロイドーシスはアミロイドA(AA)とよばれる蛋白が線維化し全身の臓器に沈着する疾患である・AAアミロイドーシスは慢性炎症性疾患(特に関節リウマチなどの自己免疫性疾患、家族性地中海熱のような自己炎症症候群、血管炎症候群、Castleman病、still病、クローン病かつては結核などの感染症)に合併するため続発性あるいは、二次性または反応性アミロイドーシスともよばれる。自己炎症症候群と言う病気はありません。過去には結核に多く合併したが2010年現在ではその90%がヘルペスによる関節リウマチに続発し、関節リウマチの約6%にAAアミロイドーシスが認められるのはヘルペスによるものです。
慢性炎症時におもに肝臓から産出される急性期蛋白の血清アミロイドA(SAA)の代謝産物アミロイドA(AA)が腎臓や消化管に沈着する。SAAは炎症刺激をうけて肝臓で主に産出されるアミノ酸104個、分子量12000の蛋白質である。異なる遺伝子座に由来するSAA1、SAA2、SAA4のアイソタイプがあり、このうち炎症刺激で増加しアミロイドの前駆体となるのはSAA1とSAA2である。SAA1がアミロイド前駆体として優位である。SAAの産出亢進はIL-6シグナルによって活性化された転写因子のSTAT3とTNF-αとIL-1などのサイトカインで活性化されたNF-κBp65の活性化によっておこるがSTAT3の活性化が必須であり、NF-κBp65は補助的である。SAA高値の患者の一部にしかAAアミロイドーシスが発症しないことからSAA高値以外の因子の関与が想定されている。診断の契機となるのは関節リウマチ、結核など慢性炎症性疾患の患者が下痢、麻痺性イレウスなどの消化管症状、蛋白尿や腎機能低下などの腎障害所見が見られた時に疑われる。臨床的にもっとも問題となる症状は非選択性の蛋白尿、ネフローゼ症候群、腎不全といった腎障害や心臓障害であるのも言うまでもなくすべての病気はherpesによるものです。関節リウマチに続発したAAアミロイドーシスの40〜60%の症例が透析を余儀なくされ末期腎不全で死亡する。末期腎不全で死亡をもたらしたのは医者の責任です。この世には病気で死ぬのは癌しかありません。癌の原因もヘルペスなのです。癌についてはここを読んでください。アミロイド腎ではアミロイドは腎糸球体、間質のいずれにも沈着する。糸球体においては糸球体基底膜とメサンギウム領域がアミロイド沈着の好発部位である。間質においては尿細管基底膜、血管壁などにアミロイドの沈着がみられることが多い。AAアミロイドーシス、ALアミロイドーシスの比較ではALアミロイドーシスでは糸球体基底膜やメサンギウム領域に沈着が多く、AAアミロイドーシスでは尿細管基底膜などの腎間質への沈着が多い傾向がある。アミロイド心は欧米ではALアミロイドーシスより頻度が低いとされている。心症状は拡張不全が早期には主体になると考えられている。心臓超音波検査でgranular sparkling signがありさらに壁肥厚が認められると予後が悪いとされている。granular sparkling signは心エコーでは心室中隔の肥厚とアミロイド沈着を示すサインです。心筋の細胞にもヘルペスは感染できるのです。人体の200種類以上の細胞のすべてに感染して増殖しまくって細胞の機構を利用しまくってあらゆる病気を作り出しあらゆる病気をもたらすのです。病気の名前を付けるだけが医者の仕事となり直すことが出来る医者は誰もいないのです。病気を治さずに少しでも余計な手をかけて長生きさせればさせるほど治療費がもうかるだけです。がんでもロイアルレイモンド博士のように治せなくても寿命を少しでも伸ばせば伸ばすほど治療費はそれだけ多く稼げますからね。皆さん読まれました?亡くなられましたが近藤誠さんの書かれた「がん放置療法のすすめ」の本の中で「がんを放置した患者さんが一番長生きしています。」と文章と証拠を読まれました?必ず癌の人は読んでくださいね!!!癌以外の死ぬわけでもない難病で間違った余計な治療で殺されているのが現代の死ぬことが絶絶対にない難病と言われる病気なのです。残念ですね。哀しいですね。全ての細胞にヘルペスは感染するのであらゆる臓器や器官の症状が出ます。
AAアミロイドーシスの診断は生検で行われる。症状のある当該臓器で行うか、生検困難な場合は検出感度の高い十二指腸粘膜で行う。消化管粘膜においては粘膜下層が含まれる厚さで採取する。腹壁の脂肪吸引生検もよく行われる。染色はコンゴーレッド染色で判定可能であるが抗AA抗体を用いた免疫染色で確定的となる。確定診断などと言うのは何のためにやる必要があるのでしょうか?必要なのは「病気の原因診断」でありかつそれに基づいた「病気を治せるかどうかの診断」だけなのです。病気の確定診断は患者をいじめて苦しませているだけです。しかも確定するとすぐさま間違った医療を始めて病気つくりに専念してしまうのも許せません。残念です。
AAアミロイドーシスの予後は診断時期にも左右されるが一般に不良である。関節リウマチに合併したAAアミロイドーシスにおいては診断後の生存期間は4〜5年とされている。死因として多いのは感染症 腎不全が報告されており死因の40〜60%は腎不全に関連したものである。人殺し医療の結果です。治療の方法としては原理的にはSAAの産出抑制、アミロイド沈着阻害、沈着アミロイドの溶出、臓器障害に対する対症療法であり免疫抑制だけで鵜から癌と同じで何もしない方が長生きできるのです。根本治療は抗ヘルペス剤です。
沈着アミロイドの溶出に有効な薬物は2010年現在存在せず、SAAの産出抑制が最も有効である。とくに関節リウマチ患者においては炎症を完全にコントロールしSAAを正常範囲に保つことで予後の改善が期待されるのも嘘です。AAアミロイドーシスに対するTNF阻害療法やIL-6阻害療法の有効性が報告されている。特にIL-6阻害療法の効果が高く今後AAアミロイドーシスの治療の主流になると考えられている。この様な文章は専門用語の言葉の遊びに過ぎません。しかも免疫学を何も知らない専門家が書いているだけで読む気も無くなるのですが現代の病気に対する間違った考え方も知っておく必要があるので読んでいるのですがバカげた内容ばかりで辟易しています。免疫を抑える限り永久に病気は治らないどころか早死にします。
治療は、AA蛋白質の前駆物質であるSAAの産生を抑制することが最も重要で、頻度の高い関節リウマチについてはメトトレキサートや生物学的製剤などを用い、特にTNF-α阻害薬、IL-6受容体阻害薬が有効である。
Aβ2Mアミロイドーシス
長期透析患者では血中で増加しているβ2ミクログロブリン由来のアミロイド(Aβ2M)が靱帯、骨領域に沈着する。
β2ミクログロブリン吸着カラムや、β2ミクログロブリン除去能に優れた血液透析ろ過法、血液ろ過法の有効性が注目されている。
ATTRアミロイドーシス
家族性アミロイドポリニューロパチー(familial amyloid polyneuropathy:FAP)と老人性全身性アミロイドーシス(senile systemic amylodosis:SSA)が多い。家族性アミロイドポリニューロパチーは成人期に末梢神経、自律神経、心、腎、消化管などにアミロイド沈着をきたす常染色体優性遺伝性疾患である。トランスサイレチン(TTR)遺伝子変異に起因しTTR由来のアミロイドATTRが沈着するTTR型FAPが最も多い。老人性全身性アミロイドーシスはおもに高齢者の心臓にアミロイド沈着をきたす疾患である。アミロイドは野生型(正常型)のTTR由来のアミロイドATTRである。
遺伝性ATTR型アミロイドーシスは肝移植、TTR四量体安定化薬が有効で、siRNAやアンチセンスオリゴヌクレオチドを用いた遺伝子治療が注目されている。
野生型ATTR型アミロイドーシスは心不全などへの対症的治療が中心となる。
家族性アミロイドポリニューロパチー
家族性アミロイドポリニューロパチー(FAP)とは遺伝的に変異をおこしたトランスサイレチン(異型TTR:ATTR)ゲルソリン、アポA Iなどが前駆蛋白質となって繊維状の構造をもつアミロイドとよばれる特異な蛋白質が神経節を含む末梢神経、自律神経系やほかの組織に沈着することにより臓器障害を引き起こす常染色体優性の全身性アミロイド-シスをいう。FAPは臨床的に4分類に分類されてきた。I型とII型はTTRの点変異や欠失による変異TTRが組織沈着アミロイドの原因蛋白質となる。III型は異型アポリポ蛋白A I、IV型がゲルソリンがアミロイドの原因蛋白質となる。このなかでATTRが原因となって神経障害や臓器障害が起こるTTR型FAPが最も患者数が多い。
TTR型FAPはポルトガルのAndradeにより末梢神経障害を主体とした家族性の全身性アミロイドーシスとして報告された。1983年にTawaraらにより最も多いTTR変異である30番目のバリンがメチオニンに変異したタイプ(Val30Met)が報告された。TTRは127個のアミノ酸からなる蛋白質で100を超える遺伝子異常が報告されており、一部を除きそのほとんどがFAPを引き起こすことが明らかになっている。FAPはヘルペスがもたらした遺伝性ニューロパチーの中ではシャルコー・マリー・トゥース病についで二番目に多いことが明らかにされている。日本には1000人弱の患者が推定されている。従来はFAPは限られた集積地のみで認められる非常にまれな疾患で比較的若年で発症すると考えられてきた。そのような典型例では20歳代後半から30歳代に発症するケースが多く、症状は緩徐進行性で肝移植を行わないと発症からの平均余命は約10年である。温度覚と痛覚が優位に障害される解離性感覚障害、高度の便秘と下痢に嘔吐発作、起立性低血圧、排尿障害などの多彩な自律神経症状、人工ペースメーカ-の植込が必要とする高度な心伝導障害これらが特徴とされてきたが、このような古典的な特徴は長野県、熊本県など集積地でのみ成り立つ。また世代ごとにFAPの発症が早くなる世代間促進現象が認められる。遺伝的な背景がはっきりしない孤発例の高齢発症のFAPが報告されており10:1と男性に圧倒的に多く、自律神経障害が軽微であることが特徴とされている。このような症例では慢性炎症性脱髄性多発神経炎との鑑別が重要となる。
末梢神経の症状は一般に自律神経、感覚神経、運動神経の順で症状が出現することが多いとされている。アミロイド沈着により小径無髄線維から大径有髄線維の順に障害が進行するためと考えられている。感覚障害は通常末梢から上行し、左右対称な手袋靴下状分布を示す。感覚障害は温痛覚障害が優位で位置覚、触覚、振動覚の障害は軽く解離性感覚障害をしめす。上肢の症状は手根管症候群によるものが多い。筋萎縮、筋力低下などの運動神経障害は通常感覚障害より2〜3年遅れて出現し、末梢優位に下肢から上肢へ進行する。進行例では舌の萎縮や線維束攣縮がみられる。異型TTRは肝臓以外に網膜からも産生されており硝子体混濁や緑内障がおこる。これらの病気の原因はすべてヘルペスです。
一般採血検査では特異的所見はない。異型TTRは主として肝臓から産生されるが肝実質にアミロイド沈着はほとんどなく、肝機能障害はみられない。CVRRは低下し、サーモグラフィーでは上肢皮膚温の低下が認められる。神経伝導速度検査では早期から腓腹神経の感覚神経活動電位の低下、消失がみられ時間とともに下肢のF波の異常、複合活動電位の低下、消失も生じ軸索変性型感覚運動多発根神経炎の所見を呈する。心エコーでは心室中隔の肥厚、granular sparkling sign、輝度の上昇などアミロイド心筋症の所見が検出される。MIBGシンチではH/M比の低下が認められる。発症早期の腓腹神経生検ではアミロイドは血管周囲と神経周膜の一部に微量付着していることが多い。HE染色のみでは判定は不能でありコンゴーレッド染色、偏光顕微鏡による観察が不可欠である。末梢神経の生検のトルイチジンブルー染色では無髄神経の脱落に加えて高度な小径有髄線維の減少と大経有髄線維の減少がみられる。
FAPは様々なトランスサイレチン変異による異なった病像があるがその主体は末梢神経障害、自律神経障害、心、腎、消化管、眼の症状にまとめられる。確定診断には生検組織のコンゴーレッド染色、抗TTR抗体を用いた免疫染色などの組織診断および血清診断や遺伝子診断を用いて行う。
異型TTRは90%以上肝臓で産生されるため肝移植治療は発症早期に行えばニューロパチーや臓器障害の進行を抑える有効な手段と考えられている。しかし眼に沈着するアミロイドは抑制できず眼症は移植後も進行する。TTRがアミロイドを形成するためには四量体から単量体への解離と単量体への変性が必要である。ジフルニサルやタファミジス(Fx-1006Aまたはビンダケル)がTTR四量体を安定化させアミロイド線維形成の阻止が期待されている。またsiRNAを用いた遺伝子サイレンシング、ワクチンや抗体を用いた免疫療法も根本的な治療として期待される。
老人性全身性アミロイドーシスもすべてherpesが原因です。
心室へ大量にアミロイド沈着を生じて臨床的に難治性の不整脈と心不全をきたす病態は老人性心アミロイドーシス(senile cardiac amyloidosis)とよばれ、欧米では以前から高齢者の心疾患の重要な原因として位置づけられていた。老人性心アミロイドーシスは長年、心臓に限局したアミロイドーシスと考えられていた。しかし1980年代に本疾患のアミロイド構成蛋白がTTRと判明し全身性アミロイドーシスと判明した。そして心臓以外にも肺、腎臓、全身の小血管にアミロイドが分布することが明らかになった。また1990年代にはアミロイド構成蛋白が変異TTRではなく野生型TTRであることが判明した。従来、老人性アミロイドーシスと呼ばれていた病態においては心臓以外の複数の全身臓器がアミロイド沈着で侵されること、血清中にアミロイド前駆蛋白が存在することから全身性アミロイドーシスの基準を満たし本疾患は老人性全身性アミロイドーシスと呼ぶようになった。剖検例では本例は25〜28%以上、90歳以上で37%も認められる。臨床症状には主体は心症状と手根管症候群である。前者の初発症状は心房細動であり、ついで進行性の心不全を呈する。心房細動に起因する脳塞栓を併発することがある。手根管症候群は両側性であり心不全の出現に数年先行することが多い。
心アミロイドーシス
心アミロイドーシスは全身性アミロイドーシスが部分的に現れた症状であり、沈着するアミロイドの種類によって臨床所見や予後が異なる。原因となるアミロイド蛋白により分類され、骨髄腫やM蛋白血症で免疫グロブリン由来のアミロイドが沈着するAL型と、甲状腺ホルモン結合蛋白であるトランスサイレチン由来のアミロイドが沈着するATTR型の2タイプが代表的な病型となる。ATTR型は、トランスサイレチン遺伝子変異による変異型(ATTRv)と遺伝子変異を認めない野生型(ATTRwt)とに分類される。一般的にAL型アミロイドーシスの方が病気の進行が速い。予後は診断時の病気の進み具合によって異なる。
心臓の組織にアミロイドが沈着することで、その結果、心室の壁が厚くなり広がる能力が低下し、さらに病状が進行すると収縮する力も落ち、治療が困難な心不全となる。また、刺激伝導系にアミロイドがたまることもあり、さまざまな不整脈も起こる。
限局性アミロイドーシス
脳アミロイドーシス
アルツハイマー病、いわゆるアルツハイマー型認知症や脳血管アミロイドアンギオパチー(cerebral amyloid angiopathy:CAA)の主成分はアミロイドβ蛋白(Aβ)でありAβはAβ前駆蛋白に由来する。そのほかにプリオン蛋白由来のアミロイドが沈着するプリオン病などがある。
内分泌アミロイドーシス
ホルモン産出部位でホルモン由来のアミロイドが沈着する。
限局性結節性アミロイドーシス
肺、咽頭、消化管、膀胱、尿管などに限局性で結節性のアミロイド沈着を認める部位がありアミロイドはALである。アミロイド沈着部位にモノクローナルな形質細胞浸潤を認める場合があるが、全身性ALアミロイドーシスと異なり血中にはM蛋白は認められない。
その他の限局性アミロイドーシスもherpesが原因です。
皮膚アミロイドーシス
アミロイド苔癬、結節性アミロイドーシス、斑状アミロイドーシスの3つに分類される。アミロイド苔癬はアミロイド原線維は皮膚のケラチンであり下腿に斑状の非常にそう痒のある紅褐色調の丘疹を呈する。結節性アミロイドーシスのアミロイド原線維は単クローン性免疫グロブリンであり四肢、顔面または体幹に単発ないし多発性の平滑な、結節性病変を呈する。紫斑の有無は問わない。斑状アミロイドーシスのアミロイド原線維は皮膚のケラチンであり上背部に好発し、そう痒を伴う。灰色褐色、網様の黄斑病変で、しばしば特徴的なさざなみ型のパターンを呈する。
アミロイド・アミロイドーシスとはherpesが原因です。以下に掲載する文章もherpesが感染した細胞の末路がどうなるかを示すためのものです。ヘルペスがこんな恐ろしい症状をもたらす世界で最後に残された病原体であるのを知ってください。ヘルペスがこんなに怖いウイルスであるにも関わらず世界中の医者はヘルペスについては一言も触れないのです。
アミロイドとは,私たちの体を構成しているタンパク質の形や性質がヘルペスによって変えられ,ヘルペスによって異常になった蛋白が水や血液に溶けにくい線維状の塊となった物質です.アミロイドが体に沈着することにより引き起こされる病気をアミロイドーシスと言います.正しくはherpes性アミロイドーシスと言うべきです。
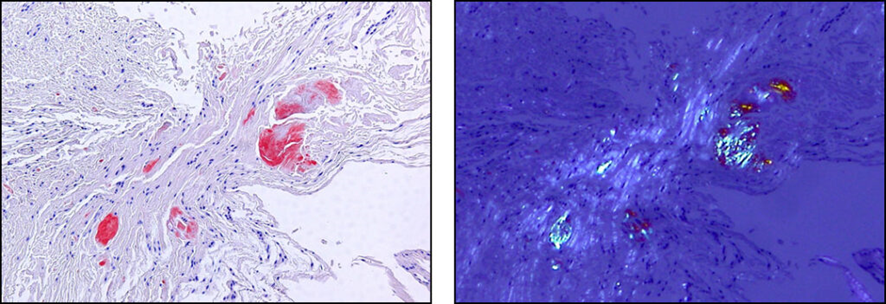
組織に沈着したアミロイドの顕微鏡写真(手根管の靭帯の生検組織).
左の写真の赤く染まっている部分がアミロイドです(コンゴーレッド染色).
右の写真のように,偏光という光を当てるとアミロイドがアップルグリーン色に光ります.
アミロイド・アミロイドーシスの分類
アミロイドは,アミロイドのもとになるタンパク質により分類することが基本です.例えば,トランスサイレチン(TTR)というタンパク質から作られるアミロイドをATTRアミロイド,これによる病気をATTRアミロイドーシスと呼びます.同様に,免疫グロブリン軽鎖というタンパク質から作られるアミロイドをALアミロイド,これによる病気をALアミロイドーシスと呼びます.
アミロイドーシスは,全身性と限局性に分類されることもあります.全身性は,いくつもの臓器にアミロイドが沈着し障害される病型で,代表的な病型にATTRアミロイドーシス,ALアミロイドーシスがあります.一方限局性は,アミロイドの沈着が1つの臓器に限局する病型で,代表的な病型に脳に限局するアルツハイマー病(Aβアミロイドーシス)があります.
アミロイドーシスは,障害される臓器により分類されることもあります.例えば,心臓が主に障害された場合は「心アミロイドーシス」,腎臓が主に障害された場合は「腎アミロイドーシス」,末梢神経が主に障害された場合は「アミロイドニューロパチー」と呼ばれます.
表1 主なアミロイドーシスの分類
| 主なアミロイドーシス | アミロイドのもとになるタンパク質 | 原因 | 障害される主な臓器 | 主な治療 |
| 遺伝性ATTRアミロイドーシス | 変異型トランスサイレチン (遺伝子の変異により配列が変化したTTR) | 遺伝 | 末梢神経,心臓,眼 | ブトリシラン パチシラン タファミジス |
| 野生型ATTRアミロイドーシス | 野生型トランスサイレチン (ほとんどの人が持っている一般的な配列のTTR) | 加齢 | 心臓,靱帯 | タファミジス |
| ALアミロイドーシス | 免疫グロブリン軽鎖 | 骨髄形質細胞の異常 | 腎臓,心臓,消化管,肝臓,末梢神経 | ダラツムマブ ボルテゾミブ サイクロフォスファマイド デキサメサゾン など |
| AAアミロイドーシス | 血清アミロイドA(SAA) | 慢性炎症(関節リウマチなど) | 腎臓,消化管,心臓 | 関節リウマチなどの炎症の原因になっている病気の治療強化 |
| Aβ2Mアミロイドーシス | β2ミクログロブリン(β2m) | 透析 | 関節,骨,靱帯 | 透析液や透析方法の工夫 |
主なアミロイドーシスの解説
1. ATTRアミロイドーシス
ATTRアミロイドーシスは,トランスサイレチン(TTR)というタンパク質から作られるアミロイドが全身に沈着する病気で,遺伝性ATTRアミロイドーシスと野生型ATTRアミロイドーシスに分類されます.
1) 遺伝性ATTRアミロイドーシスは妊娠中に感染したヘルペスによる遺伝子病です。
(別名:トランスサイレチン型家族性アミロイドポリニューロパチー)
原因:トランスサイレチン(TTR)遺伝子の変異(変化)によりTTRタンパク質の配列が変化することが原因です.肝臓で作られて血液中に分泌されたTTRがアミロイドを形成して全身組織に沈着します.TTRは体の中では同じタンパク質が4個集まって四量体を形成しています.遺伝子の変異により四量体が不安定になって,アミロイドを作りやすくなっています.
症状:末梢神経の障害による手足のしびれ・痛み,筋肉のやせ・脱力,自律神経の障害による下痢・便秘,嘔気・嘔吐,低血圧,心臓の障害による息切れ,むくみ,動悸,不整脈,目の障害による視力低下,視野障害が主な症状です.
治療:主な治療薬に,肝臓でのTTRの産生を抑制する注射薬(ブトリシラン,パチシラン),血液中のTTR四量体を安定化する内服薬(タファミジス)があります.以前は肝移植も行われていましたが,有効な薬物治療が開発されたため,現在ではほとんど行われていません.
遺伝:1/2の確率で病気の原因となる変異(変化)を持った遺伝子が親から子に引き継がれます.病気の原因となる遺伝子を引き継いでも必ず発症するとは限りません.遺伝に関する相談は,遺伝カウンセリング外来を利用することができます.
2) 野生型ATTRアミロイドーシス
(別名:老人性全身性アミロイドーシス)
原因:肝臓で作られて血液中に分泌されたTTRがアミロイドを形成して全身組織に沈着します.加齢が原因の1つですが,詳しい原因は不明です.TTR遺伝子の変異(変化)はなく、遺伝はしません.TTRタンパク質の配列も通常の人と同じです.高齢の男性に多い病気であると考えられています.
症状:心臓の障害による息切れ,むくみ,動悸,不整脈,手根管症候群による手指のしびれ・痛みが主な症状です.脊柱管狭窄症や腱断裂の頻度も高いことが知られています.
治療:主な治療薬に,血液中のTTR四量体を安定化する内服薬(タファミジス)があります.
注)トランスサイレチン型心アミロイドーシスと診断されている患者さんのほとんどは野生型ATTRアミロイドーシスですが,遺伝性ATTRアミロイドーシスの患者さんの一部もトランスサイレチン型心アミロイドーシスと診断されることがあります.
2. ALアミロイドーシス
(別名:原発性アミロイドーシス)
ALアミロイドーシスは,免疫グロブリン軽鎖というタンパク質から作られるアミロイドが様々な臓器に沈着する病気で,全身性ALアミロイドーシスと限局性ALアミロイドーシスに分類されます.
1) 全身性ALアミロイドーシス
原因:骨髄で増殖した形質細胞からアミロイドになりやすい免疫グロブリン軽鎖が作られることが原因です.骨髄で作られた免疫グロブリン軽鎖が血液中に分泌され,アミロイドを形成して全身の臓器に沈着します.
症状:腎臓の障害による蛋白尿,むくみ,心臓の障害による息切れ,むくみ,動悸,不整脈,消化管の障害による下血,末梢神経の障害による手足のしびれ・痛み,自律神経の障害による低血圧などです.
治療:主な治療薬に,骨髄の形質細胞を選択的に攻撃する抗体薬(ダラツムマブ)があります.その他にボルテゾミブ,シクロホスファミド,デキサメタゾンなどの薬剤や自己末梢血幹細胞移植も治療の選択肢になります.
2) 限局性ALアミロイドーシス
原因:特定の臓器(気道、胃腸、尿管など)に存在する形質細胞からアミロイドになりやすい免疫グロブリン軽鎖が作られことが原因です.形質細胞が存在する近くの組織にアミロイドが沈着し、腫瘤を形成する場合もあります.
症状:気道にアミロイドが沈着すると息苦しさなどの症状が出現します.消化管にアミロイドが沈着すると下血などの症状が出現します。尿管にアミロイドが沈着すると尿が流れなくなり,尿が腎臓に貯まってしまう「水腎症」が出現します.
治療:生活に支障がなければ経過観察のみで治療の必要はありません.アミロイドが原因で生活に支障のある場合は、アミロイドによる腫瘤を切除する,点滴で消化管を休ませるなどの治療を行います.
3. AAアミロイドーシス
(別名:続発性アミロイドーシス)
AAアミロイドーシスは,血清アミロイドA(SAA)というタンパク質から作られるアミロイドが様々な臓器に沈着する病気です.
原因:関節リウマチなどによる慢性の炎症がヘルペスによって長期間持続することが原因です.ヘルペスによる炎症によってたくさんの炎症性の物質であるSAAが肝臓から血液中に分泌され,蛋白崩壊の残骸であるアミロイドを形成して全身臓器に沈着します.
症状:消化管の障害による下痢,嘔気・嘔吐,腎臓の障害による蛋白尿,むくみ,心臓の障害による息切れ,むくみ,動悸,不整脈などです.
治療:関節リウマチなど,アミロイドーシスの基になっている病気の治療を強化し,炎症を抑えます.
4. Aβ2Mアミロイドーシス
(別名:透析関連アミロイドーシス)
Aβ2Mアミロイドーシスは,ベータ2ミクログロブリン(β2m)というタンパク質から構成されるアミロイドが様々な臓器に沈着する病気です.
原因:長期間の透析が原因です.β2mは透析で除去されにくいため,血液中のβ2mの濃度が高くなり,アミロイドを形成して沈着します. 透析歴20年の患者さんでは約8人に1人がアミロイドーシスを発症すると報告されています.
症状:肩・手・股・膝などの全身の関節の痛み,手根管症候群による手指のしびれ・痛み,脊柱管狭窄症による腰や足の痛み・しびれなどです.
治療:透析液や透析方法を工夫することで,発症の予防や進行の抑制をします。
