まだPart1をお読みなっておられない方はここを読んで下さい!
恐怖情動の神経回路
大脳辺縁系のうち海馬は主に記憶に関与し、扁桃体は情動に関わると大きく分けられますが、記憶のうちでも情動と強く関連した記憶には扁桃体が重要な役割を果たしています。たとえば両側の扁桃体に限局した変性が認められる稀な遺伝性疾患の患者さんでは短期記憶や認知機能には障害が認められないのにもかかわらず、情動的な事象に関した記憶が選択的に障害されています。扁桃体は特に恐怖や嫌悪のような感情に関連性が強く、とりわけ恐怖情動に関わる扁桃体神経回路に関連した研究は、これまで自然科学的研究の対象となりにくかった情動について、生物学的観点から理解する道を開きました。更に、このような神経回路機能の研究は情動障害のメカニズムの解明にも役立っています。
これまで恐怖情動に関連した記憶は、恐怖条件付けという代表的な実験手法を用いて研究され、情動と記憶を結びつけるモデルとなってきました。実験は簡単で、まず実験動物に音、光のような単純明確な手がかりを条件刺激として与え、それに続いて嫌悪刺激である足への電気ショックを無条件刺激として与え、これを数回組み合わせることにより条件付けが成立します。数日後、条件刺激を提示するだけで、動物は電気ショックが来ることを恐れてすくみ上がる、フリージングという反応を示します。このとき、実験動物の体内では恐怖反応としての自律神経系や内分泌系の変化が起こることも分かっています。このような単純な音や光を条件刺激とするのに対し、場所のような状況(文脈)を条件刺激として使う場合は、海馬も記憶貯蔵の場所となります。
このような条件付けにおいて、音や光のような条件刺激がやってくると、この情報は感覚刺激を大脳新皮質へ伝達する過程の関所ともいえる視床へ到達します。視床は大脳の腹側の奥深くに位置する神経細胞の大きな集団で、情動に関する情報はここで大きく2つに分かれます。一方の経路は大脳皮質に送られ、細かく分析された上で海馬に送られ、長期的に記憶されます。他方の経路では、情報は視床と隣り合った神経細胞の大きな集団である扁桃体へ直ちに送られます。扁桃体では感覚情報が広い意味でわれわれの生存にとって有利であるかどうかの評価、価値判断がおこなわれます。
扁桃体はストレスの情報をどの神経経路で感じ取るのでしょうか?
扁桃体は、特殊感覚である脳神経が支配する特殊感覚である嗅覚・味覚・視覚・聴覚やそれ以外の体性感覚と内臓感覚などすべての感覚情報が直接的、あるいは間接的に入力される。直接的な入力は大脳皮質を介さずに視床や脳幹から直接投射されるルートで、一方、間接的な入力として、視床から大脳皮質を経て偏桃体への入力がある。さらに皮質を介する経路として、すべての感覚連合野、眼窩前頭皮質、内側前頭皮質からの投射があり、直接的な入力に比べより大脳皮質によって高度に処理された情報が偏桃体に伝えられます。
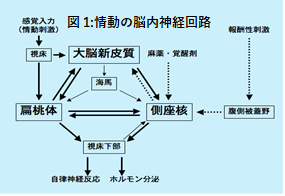
このように扁桃体に伝えられたな情動に関わる情報の処理結果は、まず自律神経機能とホルモン分泌の中枢である視床下部へ伝えられ、自律神経反応を引き起こして心臓の拍動が早くなり胃腸の動きも変化します。恐怖を引き起こすような情報刺激を受けたときは、同時に扁桃体から中脳へ情報が伝達され、すくみ上がるといった恐れて、縮み上がったり、おじけづいて小さくなる恐怖心を示す行動が引き起こされます。更に、扁桃体からは、大脳の帯状回や海馬のような原初的な大脳辺縁系へ刺激が伝わり、長期的な記憶にも大きな影響を及ぼします。このように、扁桃体には原初的で本能的な情動に関連した記憶が蓄えられ、この記憶と関連した情動刺激が偏桃体にやってくると記憶が引き出され、感情的ならびに身体的な反応が強く引き起こされるのです。この神経回路の概略が図1の左半分に示されています。
情動を制御する分子メカニズムを説明しましょう。
脳内には感情が生み出される複数のシステムがあり、特に不快な感情に直接関わる扁桃体を中心とするシステムと、快い感情に関わる側坐核を中心とするシステムが主要な構成要素です。それではこのようなシステムはどのような分子メカニズムでコントロールされているのでしょうか?システムの制御は神経細胞間の興奮伝達と神経細胞内の情報伝達のレベルでおこなわれます。扁桃体におけるコントロールの分子メカニズムは、特に情動にかかわる記憶の形成のメカニズム不明なことが非常に多いのです。
感動する脳
ここまでは情動の中でも恐怖や嫌悪感に関係した情報処理過程を見てきましたが、では心地よい情動はどのようにして生じ、またどのようにコントロールされているのでしょうか?脳内で快情動が生まれるには、報酬系と呼ばれるさらに別の脳内システムが関与していますが、このシステムは扁桃体を中心とするシステムと密接な関係を持っています。扁桃体、視床下部を経由した情動刺激や腹側被蓋野と呼ばれる中脳の特定の領域を経由した快感、満足感を引き起こす刺激が、大脳腹側の深部に位置する神経細胞集団である側坐核で神経伝達物質のひとつドーパミンの放出を促します。この側坐核内でのドーパミン放出がもとになって、脳内に心地良い感情が生ずると考えられています。このシステムは、正常な快感とともに、麻薬や覚せい剤のような薬物による快感や、そのような薬物への依存の形成にも関わることがよく知られています。この快情動の神経回路の概略は図1の右半分に対応します。
それでは、音楽を聴いて快い感動が生まれる、という場合、脳内の仕組みはどのようになっているのでしょうか?音楽によって感動することにはドーパミン放出を伴う報酬系が関わるとともに、強い感動は報酬系からひろがる興奮が、大脳皮質はもちろん、脳の広い領域で同調して強まることによって起こると考えられています。音楽を聴いて快い情動が引き起こされたときに活動の高まる部位についてPETを用いて調べた研究で興味深い結果が示されています。音楽を聴いて“震えるような感動”をおぼえた場合、心臓の拍動、筋肉の緊張や呼吸数が変化し、このような自律神経系の反応が強い場合、側坐核、扁桃体、前頭前野、前頭葉眼窩野、中脳といった報酬・情動系での大きな血流変化が認められることが明らかになっています。これらの領域は、摂食、性交、麻薬・覚せい剤のような快感を引き起こす刺激に反応して活性化されることはよく知られており、音楽と生存本能に関連した刺激が脳内の快感・報酬系回路を共有することは印象的です。
更に、失音楽症という、多くの場合脳血管障害によって音楽に対する認知能力が失われた症例から貴重な知見が得られています。失音楽症の患者さんのうちのある症例では、旋律を分析的に認識する能力を完全に失っても、旋律の感情的要素、すなわち悲しい旋律か、楽しい旋律か、という判断はできます。これに対し、音楽の諸要素についての分析的能力は完全に保たれているにも関わらず、音楽の表現する感情的要素を全く理解できなくなった症例もあります。後者では、まさに左側の扁桃体を含む大脳辺縁系から大脳新皮質にかけた領域が脳梗塞により広く冒されていました。このような二つのカテゴリーに属する症例から、音楽を分析的に聴くことと感情的に聴くことは別のものであることが明らかになっています。
情動と脳について
大脳は精神の座の中心であり、それに連なる間脳、中脳、小脳、脳幹、脊髄は大脳からの命令を円滑に実行し、また一方では私たちの環境についての情報を適切に大脳へ伝えてどのように反応するかという判断を仰ぎます。前頭葉は霊長類で発達し、特にヒトの人たる由縁である思考、判断に基づいた社会行動、創造性、意志の源です。これに対して、食欲、性欲のような本能的行動とともに快・不快、喜怒哀楽のような情動として表出されるような心の働きには、主に大脳辺縁系 (limbic system)と呼ばれる、大脳の中でも系統発生的に古い領域が関与します。この辺縁系は解剖学的には側脳室周辺に位置して間脳を取り囲むように配置した海馬と扁桃体が主要な構成要素で、これに帯状回、梨状葉のような大脳皮質が加わります。
ドパミン作動性神経ニューロン群の分類はドパミン神経細胞群の存在部位によってA8細胞群からA17細胞群までの10種類の細胞群に分類されます。ドパミン作動性ニューロンは神経伝達物質としてドパミンを放出するニューロンであります。ドパミンは、運動調節や快感や多幸感を得るとか、意欲を作ったり感じたりさせる機能を担う脳内ホルモンの一つです。このドパミン作用が達成できれば必ず快楽が得られます。「気持ちが良い」「心地良い」と感じると出るのみならず「この先何かいいことがある」と希望を感じたときにも出ます。このようにドパミンは現在のみならず未来に向かって快楽である幸福のために努力を可能にさせる最高に未来永遠の幸せに繋がる快楽をもたらす化学伝達物質なのです。従ってドパミンは「現在と未来にもつながる快楽ホルモン」と言われるのです。快楽を沿い化させる役割を持っているドパミンは産生されるドパミンの部位によって異なる領域間の情報伝達を担う軸索投射を行うニューロンであるドパミン細胞群の種類によって投射されるドパミンニューロンの神経インパルスを受容するシナプス後神経細胞によって①物事への関心を強めたり、②運動機能を高めたり、③学習機能の効率を促進したり、④性機能作用を強化したりできるのです。要するにドパミンはあらゆる種類の快楽を向上させるのです。にもかかわらず過剰なドパミンが一生治らない病気を作るとはなんと皮肉なことでしょうか!!!「過ぎたるは及ばざるが如しです。」
ドーパミンの分泌が過剰だと、統合失調症や過食症、その他アルコール依存症やギャンブル依存症など様々な快楽をその瞬間だけにもたらす依存症を引き起こします。逆にドパミンの分泌が不足すると、物事への関心が薄れ、運動機能、学習機能、性機能が低下します。一言でドパミンの作用をいうと快楽にかかわる思いや行為や人間の生活の営みの幸せがもたらす快楽を高めるのです。人間は上手に運動することによって快楽を得られますから快楽の神経伝達物質であるドパミンが運動を上手に実行するために大脳基底核の働きにも密接に関わっているのです。
ドパミン作動性の極めて重要なA8からA10までの三つの細胞群の働きを詳しく説明しましょう。
①A8細胞群は脳幹の中脳の赤核後方部 にあり大脳辺縁系に投射する。A10細胞群と共に大脳辺縁系に投射し、中脳から辺縁系に神経が投射する中脳辺縁系を構成しています。ドパミンを投射された辺縁系の働きは本能であり本能は生きる快楽の中枢ですからドパミンが投射されることを常に待ち構えているのです。
②A9細胞群は脳幹の中脳の黒質の緻密部(substantia nigra pars compacta略してSNc) にあり 線条体(尾状核と被穀)へ投射する。「substantia nigra」は「黒質」であり「pars compacta」は「緻密部」です。大脳基底核の黒質線条体系を構成します。黒質線条体系に脳全体のドパミン量の80%を占めます。つまり、黒質のA9細胞群で産生されたドパミンの80%のドパミンは大脳基底核の線条体に投射されて線条体の尾状核と被穀の二つの核にドパミンが利用されているのです。このA9細胞群黒質の緻密部(substantia nigra pars compacta略してSNc)は脳全体のドパミン量の80%を占めるので黒質の緻密部が産生したドパミンが過剰なドパミンを作り出しているのです。この黒質の緻密部が産生した過剰なドパミンがSZの原因となっているのです。
ということは大脳基底核も統合失調症に関りがあることを示しています。大脳皮質下領域に存在する大脳基底核のひとつである淡蒼球の体積が健常者に比べて大きいということと、その健常者との差に左側優位の非対称性が存在することはわかっていますが意味付けができていませんが、大脳基底核は動機づけや意欲などに関わっており、そうした障害により社会生活が困難となりSZの原因のひとつになっているかもしれません。
このA9細胞群の黒質の緻密部で産生された過剰なドパミンが思春期までの15年かけて統合失調症の陽性症状をおこすのです。つまりドパミンは副腎髄質でストレスがかかればストレスに耐えれば報酬として快楽を感じさせるドパミンを増やしますからこのドパミンは頑張ってストレスを乗り越えなさいという励ましの素晴らしい神経伝達物質なのですが乗り越えられないとまたまた繰り返しドパミンが励ましのために出るという悪循環が始まりだすのです。自分の能力以上のすぐ先の欲望を満たしたいという強い欲望を持ちたがる気質の人が最後は統合失調症になりやすいのです。
一方、思春期を超え成人になって社会を構成する人間同士のエゴとエゴとのぶつかりあいの中で飯を自分の力で食べていくために嫌な他人の支配を甘んじて受け入れすぎると副腎皮質から出されるストレスホルモンが常に免疫を抑制してしまうのでヘルペスがA9細胞群黒質の緻密部(substantia nigra pars compacta略してSNc)に感染してしまうこともあり得るのです。つまり食べていくためだけに嫌々、他人の支配を受けて耐え続けたために50歳以上でドパミンが少なくなって起こるパーキンソン病とは全く成り立ちが異なっています。SZは15歳までの自分で働く必要が全くない快楽を求めるだけの贅沢で甘え100%で自分の思い通りに生きて欲望が満たされなくなったので15歳から30歳ころまでにSZなってしまった人です。
一方パーキンソン病はSZとは全く違って、正に必死で自分の命を生き続けさせるために自分の欲望に反して他人の貪欲な欲望に耐えすぎた人生を50年以上やりすぎると免疫を抑えていた間にA9細胞群の黒質の緻密部に感染したヘルペスによってA9細胞群の神経が変性する脱落するとドパミンが作られなくなり減少するとパーキンソン病になってしまうのです。その結果、大脳基底核の線条体に放出される運動調節で快楽をもたらすドパミンが減少して、無動、筋固縮、振戦などの運動症状が生じるのは当然のことなのです。後で詳しく書きますがヘルペスが脳外から脳内に感染するルートは鼻腔の天井にある臭いのレセプターである嗅細胞から大脳にいとも簡単に侵入できるのです。
パーキンソン病に対するドパミン補充療法は、黒質線条体系を刺激してその運動症状を改善しますが、同時に快楽を感じる中脳辺縁系の本能の快楽を満喫してしまう辺縁系の偏桃体も刺激され過ぎるので一時的なSZになってしまうのです。つまりドパミン作動薬による薬物性のSZ症状、自分の思いに反するドパミン作動薬物の血中濃度の高低変化で出現する不愉快な身体症状、人工的なドパミン投与による快楽を味わざるを得ない興奮のために不眠、不安、無理やりの人工的な運動である振戦、発汗、痙攣発作、さらにドパミンによって興奮作用がひどくなると妄想、幻覚、体感幻覚などが副作用として生じるのがパーキンソンのドパミン治療中でも見られるのです。
因みに興味深いことなのですが、通常、交感神経の末端から 出てくる神経伝達物質はノルアドレナリンで、 発汗の場合だけアセチルコリンが分泌されます。これは、ノルアドレナリンが血管を収縮させる作用をもち、血管が収縮すると、血液(血漿)か ら汗がつくれなくなってしまうからです。ストレスがかかると放出されるノルアドレナリンは、自律神経に働きかけて心拍数を上げたり、血液量を増やしたりして、活動しやすい状態を生み出します。 一方、ストレスになるようなツライ状況を乗り越えたときの達成感、うれしい気持ち、つまり快感をもたらすのがドーパミンです。
更にA9細胞群の一部は中脳皮質系を構成しておりA10細胞群と共に前頭前皮質にドパミンを投射します。中脳皮質系とは脳幹の中脳から大脳皮質に中脳のA9細胞群の一部の神経細胞ニューロンが投射しているのです。神経細胞ニューロンが投射している意味は投射ニューロンとは、その所属する神経集団(中枢神経系では神経核や皮質領野、末梢神経系では神経節など)から離れた領域に、長距離の軸索投射を行い、異なる領域間の情報伝達を担うニューロンの一群を指します。
A9細胞群の一部の神経ニューロンは大脳皮質の前頭前野にA9細胞群の神経ニュウーロンはドパミンによって情報伝達を送り大脳皮質の前頭前野の神経ニューロンは高次な中枢神経として重要な精神活動の役割を果たしている以外に、目標を達成して報酬を得よう、あるいは罰を避けようという「意欲」は、前頭前野の働きの一つであるのでドパミンに反応しているのです。
③A10細胞群は腹側被蓋野 (ventral tegmental area略してVTA) にある二つの回路に神経投射を行い一つ目の回路は腹側被蓋野 (ventral tegmental area略してVTA) から 大脳辺縁系の側坐核・海馬・扁桃体・嗅結節・中隔・梨状葉に感情の情報を送る情動回路と二つ目は腹側被蓋野 (VTA) から 不安で活性化される皮質系(前頭前野)の回路に投射する2経路があります。この腹側被蓋野 (VTA) から 大脳辺縁系も腹側被蓋野 (VTA) から 皮質系(前頭前野)への二つの回路はドパミンの過剰投射により行動および情動(感情)に異常をきたし、統合失調症の陽性症状をもたらすのです。いわば覚せい剤や麻薬は一次的には快感をもたらしますが、やりすぎると「人に追いかけられる、囲まれている」「天井裏から話し声がする」などといった知覚過敏、幻覚、被害妄想から強度の不安が生じ、高じるとパニック状態に陥り、使用を継続すると、幻聴や妄想が消えなくなるのと似ています。
Yakovlev(ヤコブレフ)の情動回路とは何でしょうか?
腹側被蓋野 (ventral tegmental area略して VTA) から 中脳辺縁系への投射は快楽を感じると扁桃体が喜んで認識してこの快楽を記憶しておきます。更にこの快感の記憶を思い出すたびごとに扁桃体が A10細胞群を活性化してドパミンが産生されこのドパミンが側坐核を興奮させて、視床内背側核から前頭前野へと投射され いわゆるYakovlev(ヤコブレフ)の情動回路を作動させて、快の情動行動を起こすのです。この側坐核がドパミンによる快楽をむさぼる力が強すぎて統合失調症のドパミン依存症を生み出すのです。側坐核こそ人類の欲望の原点と言えます。ドパミンが側坐核を興奮させて、視床内背側核から前頭前野へと投射され 、いわゆるYakovlev(ヤコブレフ)の情動回路を作動させ過ぎて、異常な感情を抱いたり情動を伴うような、一時的で急激な感情の動きがおかしくなるのです。
感情と情動の違いは何でしょうか?感情(sentiment)とは、気持ちと表現され快と不快を主とする意識のもっとも主観的な側面と言えます。現在の意識できる出来事だけに対する気持ちだけではなく過去の経験の記憶や、未来に対する思いなどのすべての認識可能な出来事や物事や対象に対して抱く気持ちも含まれます。時間を超えた喜び、悲しみ、怒り、諦め、驚き、嫌悪、恐怖、憎しみ,嫉妬、快さ、不安など知覚可能な思いです。
情動(emotion)とは、感情の一種でありますが、急激に生起し短期間で終始する反応振幅の大きい一過性の強い感情状態であります。怒り、恐れ、喜び、悲しみなど強くなった感情で、比較的急速に引き起こされた一時的で急激でしかも強い感情の動きであるので、行動や表情の変化,自律神経反応,内分泌反応などの身体反応も伴います。例えば怒りで顔が紅潮し目を見開くとか,恐怖で身体が震え顔が真っ青になるという強度の自律神経反応が起こります。気分(mood)は、中長期的にゆるやかに持続する感情です。
中脳皮質系とSZの陰性症状について説明します。
中脳皮質系は腹側被蓋野 (VTA)から大脳辺縁系の側坐核を飛ばして直接、大脳皮質の前頭前野へ投射される経路です。不安や心配で活性化される回路で、不安やストレスにより活性化し大脳辺縁系よりも、ドパミンが少ないのでやる気を失う行動を起こしてしまい統合失調症のいわゆる陰性症状が発現してしまうのです。中脳皮質系の経路では、ドパミンの伝達低下により意欲減退、感情鈍麻などの陰性症状や認知機能障害を起こすのです。更にストレス刺激がドパミンを副腎髄質からアドレナリン、ノルアドレナリンをも産生してA10経路の活性化するので、前頭前野のドパミンD1受容体を介して前頭前野の行う認知・思考・ワーキングメモリ(作業記憶)等の機能を抑制し陰性症状が発現してしまうのです。
ここからA11からA17までのドパミン作動性の細胞群について説明します。
④A11細胞群もドパミン作動性神経であり、視床下部後部にあり、不確帯 にある A13、 A14細胞群と共に視床下部、脊髄側角に投射し、視床下部脊髄路を構成する脊髄後角/三叉神経脊髄路核の侵害受容神経細胞に対する抑制に関っている。A11細胞群のドパミン低下による機能の低下により、レストレスレッグス症候群、下肢静止不能症候群、むずむず足症候群の症状が起る。出現症状は、下肢を中心に不快な異常感覚が、特に夕方から深夜にかけて出現。「むずむずする」「じっとしていられない」「痒い」「ピンでなぞられているような」「針で刺すような」「火照るような」「蟻やミミズなどの虫が這っているような」などの異様な感覚が現われ、時には「振動」を感じる場合もある。
レストレスレッグス症候群(restless legs syndrome、RLS、むずむず症候群)は何故起こるのか?RLSは、脊髄に投射する視床下部後部のA11ドパミン作動性細胞群の作用は脳に不必要な信号が入らないようにブロックすることです。このA11ドパミン作動性細胞群にherpesが感染してドパミンが産生できなくなりA11ドパミン細胞群に対する抑制の機能低下により視床下部脊髄路を構成する脊髄後角/三叉神経脊髄路核の侵害受容神経細胞の交感神経系が興奮し、その結果、ノルアドレナリンの増加を介して筋緊張・不随意運動を生じることにより起こる。一方で、求心性のシグナルが、ドパミンの抑制による脱抑制を介して、ドパミンの抑制が出来ず前頭前野における「むずむず感・異常知覚」といった体性感覚(体性感覚とは触覚、温度感覚、痛覚の皮膚感覚と、筋や腱、関節などに起こる深部感覚から成り、内臓感覚は含まない)の増強をもたらすからです。言い換えれば、A11でブロックしていた不必要な信号が脳内に入って過敏状態になり、大したものではない刺激が強い刺激と感じられるようになるのが原因です。
ドパミン神経がヘルペス感染によって減ると体が動きにくくなり、ふるえが起こりやすくなります。ドパミンは、アドレナリン作動性神経ではノルアドレナリンの前駆物質であり、中枢神経系ではドパミン作動性神経の伝達物質である。ドパミンはアドレナリン受容体のうち、アドレナリンβ1受容体刺激作用と、高濃度でアドレナリンα受容体刺激作用を示す。これらによる心臓促進作用と昇圧作用を利用して、臨床的にはドパミンはショックの処置に用いられる。
視床下部に存在するドパミン神経細胞群(A11~15)の中で、A11領域にあるドパミン神経系は脊髄へ投射する唯一の経路として痛覚に関与し痛みを軽減できます。ドパミンの放出は,痛み刺激のみではなく, 快感や報酬の期待によっても起こる. さらに, pleasure-related analgesia(快感関連鎮痛)の科学的根拠が得ら れている.すなわち,痛みは,快感により抑制されます。心地良い匂いやイメージ,好きな音楽, 好きな食べ物等は,明らかに痛みを抑制する効果が認められている.ドパミンの放出は,痛み刺激のみではなく,快感や報酬の期待によっても起こる.痛みが,快感により抑制されるのは何故でしょうか?快感をもたらすドーパミンが脳の側坐核に届くと、鎮痛物質のオピオイドが分泌されて、痛みをやわらげる仕組みが働きだすからです。
⑤A12細胞群は視床下部弓状核にあり、そこから下垂体の一部である正中隆起、下垂体中間葉、下垂体後葉に投射する正中隆起漏斗ドパミン作動系を構成する。弓状核は視床下部と下垂体をつなげる漏斗と呼ばれる部位に存在しており、別名を漏斗核とも呼ばれ下垂体前葉を介してホルモン調節を行い、下垂体前葉ホルモンであるプロラクチン・LH・FSH・TSHにたいする抑制作用を行っている。実はプロラクチン分泌を抑制するA12細胞群のドパミンこそプロラクチン抑制ホルモンそのものです。
⑥A13細胞群は不確帯(zona incerta, ZI)にありA11細胞群の一部と共に視床下部に投射し、不確帯視床下部ドパミン作動系を構成する。
⑦A14細胞群はA11細胞群の一部と共に視床下部に投射し、不確帯視床下部ドパミン作動系を構成する。
⑧A15細胞群は視床下部のドパミン細胞群です。プロラクチン抑制ホルモン(⑤⑥prolactin inhibiting hormone略してPIH)の実体はドパミンです。
⑨A16細胞群は嗅球のドパミン細胞群です。嗅球ドパミン神経変性によって嗅覚異常をおこす。
➉A17細胞群は網膜のドパミン細胞群です。網膜の神経は、目の網膜の中で規則正しく整列し、「網目(あみめ)」を作っている。網膜の網目を規則正しくつくるタンパク質としてDscam(ディーエスカム)が重要な役割を果たしていますが、遺伝的にDscamがないと、このドパミン細胞が網目を規則正しくつくれず、網膜全体にバラバラに広がり、ドパミン細胞の突起の形もおかしくなり、太く束になり、束が、絡まる(からまる)ことになります。
ドパミン受容体について詳しく述べましょう。
D1受容体は中枢神経系で最も豊富なドパミン受容体でドパミン作動性神経細胞の成長を調節しています。D1受容体は線状体背側部(被蓋・尾状核)にも発現が見られ 、黒質自身にも投射できるのですがストレス刺激によって黒質が活性化してドパミンを大量に産生するのでドパミンの分泌が制御できなくなり統合失調症が起こるのです。
一方、D2受容体には、D2L受容体とD2S受容体のサブタイプが存在しております。D2S受容体はドパミン作動性神経自身の自己受容体なのです。D2L受容体は、腹側被蓋野 (VTA) からの大脳辺縁系ではシナプス後部神経細胞、大脳基底核の線条体では線条体中型有棘細胞のシナプス後神経細胞に多く発現している。線条体の抑制性中間有棘ニューロンにherpesが感染すると抑制性中間有棘ニューロンが変性して,抑制性神経伝達物質であるγ-アミノ酪酸(GABA)およびサブスタンスPなどの神経伝達物質が減少すると抑制が効かなくなってドパミンの作用が亢進してしまい統合失調症の症状が悪化してしまうのです。
D2S受容体は自己受容体として黒質、腹側被蓋野の二つの経路のドパミン神経終末(シナプス前部神経細胞)に発現しているのです。ところが、中脳皮質路のドパミン神経においてはD2S受容体の自己受容体が欠如しているため、ストレス刺激によって活性化してしまうとドパミンの分泌が制御できなくなるのです。
いずれにしろD2 受容体は現在の統合失調症の治療薬として使われる抗精神病薬の主要なターゲットとなっているのですがその作用機序についてはよくわかっていないのが実情ですが患者さんはこのような薬を大量に飲まされているのです。
しかし明確にわかっていることはドパミンD2受容体は、ドパミンにより活性化されて情報伝達を行い、ドパミンは、運動調節や意欲・学習などに関わる脳内の神経伝達物質です。 脳内のドパミン量が不足するとパーキンソン病になり、過剰になると統合失調症になります。 統合失調症の治療薬はドパミンD2受容体に結合して不活性化します。報酬が多くすぐもらえると期待できる時には、ドパミン情報がD1、D2受容体の両者を伝わってやる気が高まる一方、労力が必要と分かってもやる気を保って行動する際には、D2受容体を介したドパミン伝達が必須であります。
ドパミン受容体は、D1、D2、D3、D4、D5受容体と5種類あります。ドパミンが受容体と結合するとシナプス後部神経細胞に電位変化が起こったり、細胞内の情報伝達系が動いてさまざまな変化を後シナプス神経細胞に引き起こします。役目を終えたドパミンはまたシナプス前部神経末端にあるドパミントランスポーターに、たんぱく質として取り込まれて再利用されます。受容体は、興奮性、抑制性と2つに分類されていますが、まだ不明点が多くドパミン受容体は複雑で完全な解明はいまだされていません。
・興奮性を担う受容体はD1、D5受容体の二つです。
・抑制性を担う受容体:D2、D3、D4受容体の三つです。
D1受容体は中枢神経系で最も豊富なドパミン受容体で神経細胞の成長を調節します。線状体背側部(被蓋・尾状核)に発現が見られる。腎血管や腸間膜動脈にも存在し、血管拡張をもたらす。そのほかいくつかの人の行動反応にも関わっています。
D2受容体は筋緊張異常や統合失調症に関連しています。ここで疑問があるのはドパミンの作用を抑制する受容体の一つであるD2は統合失調症の治療薬になるはずなのに逆にこのD2が統合失調症に絡んでいるのは不思議ですが実はD2受容体にはD2sという自己受容体があることに答えが潜んでいると考えています。つまりD2受容体全体の働きはドパミンの働きを抑制しますが治療薬のドパミンの抑制効果が過ぎたときは自己受容体D2sはその抑制を外してしまうので統合失調症が悪くなるのです。これが私の答えです。だからこそ研究され過ぎた統合失調症の薬が意図通りの薬効が示さないどころか複雑な副作用を起こしてしまうのです。
D2受容体は線状体背側部(被蓋・尾状核)に発現が見られ淡蒼球に投射する。専門書によって被蓋・尾状核・淡蒼球の三つを線条体と呼んでいます。D2受容体はドパミン作動性神経細胞にも軸索終末部にも存在し、全体の作用としては自己受容体としてドパミンの産生の抑制と放出制御を行っています。自己受容体D2sは抑制を抑制しているのです。ドパミン神経系のA12細胞群のドパミンは、下垂体前葉のプロラクチン産生の細胞のD2受容体に作用し、プロラクチン分泌を抑制するA12細胞群のドパミンこそプロラクチン抑制ホルモンそのものです。
ドパミン D2 様受容体は統合失調症と深くかかわっていますから更に勉強しましょう。
統合失調症や自閉症などの精神疾患の発症には遺伝的な気質要因と生まれ育った環境要因の両方が関与しており,遺伝的な解析からドパミン D2 様受容体は有力な原因遺伝子の一つであると考えられます。ドパミン受容体は 7 回膜貫通型の G 蛋白質共役型受容体であり,アデニル酸シクラーゼを活性化する興奮型の D1 様受容体群(D1,D5 受容体)と,その活性を抑制する D2 様受容体群(D2,D3,D4 受容体)の 2 グループに大別される。D2 受容体と精神疾患との関連は,ほとんどの抗精神病薬がD2 受容体遮断作用を有することは言うまでもないことです。
D2 受容体作用薬を用いた画像診断によると,統合失調症患者では D2 受容体結合能が大脳の帯状回皮質で低下している。細胞内シグナル伝達において,D2 受容体は G 蛋白質の Gi を活性化し,アデニル酸シクラーゼ活性を抑制,cAMP の産生を減少させる。
Gタンパク質はα、β、γの3つのサブユニットから構成されており、Gタンパク質はGαの相違によりGs、Gi、Gqの3つのタイプに分けられる。GsとGiが共役する効果器はアデニル酸シクラーゼであるが、Gsは効果器(AC)を活性化する。Sは「刺激」であり、一方Giは効果器(AC)を抑制する。Iは「抑制」です。
アデニル酸シクラーゼは、細胞内ATPからサイクリックAMP(cAMP)を生成する酵素である。cAMP 量の減少は,プロテインキナーゼ A 活性を低下させ,シナプス伝達を抑制する。D2 受容体には細胞内第 3 ループの 29 アミノ酸残基の有無により,D2L 受容体と D2S 受容体のアイソフォームが存在する。これまでの免疫組織化学的解析から D2L受容体は主に辺縁系,線条体中型有棘神経細胞の後シナプスに発現する。D2LのLは「辺縁のlimbic」です。一方,D2S受容体は自己受容体として黒質 – 線条体系ドパミン神経細胞に発現することから,ドパミン放出に抑制的に働くと考えられる。D2SのSは「自己のself」です。近年の研究において,D2 受容体の遺伝子であるDRD2 には多くの遺伝子多型が存在する。これらの遺伝子多型は D2 受容体の発現に関与し,統合失調症の症状と相関する。
ヒトのSNP(スニップ)と言われる一塩基多型では,D2L 受容体に比べD2S 受容体の mRNA 量が減少し,作業記憶や注意制御に異常をきたすことが報告されている。
SNP(スニップ)とは何でしょうか?SNP(スニップ)は一塩基多型とも呼ばれ、遺伝情報を保つDNA配列を構成する1つの塩基が置き換わる現象です。DNAはアデニン(A)、チミン(T)、グアニン(G)、シトシン(C)という4種類の塩基から成り立っていますが、SNPは例えば、CがTに1か所だけ置き換わっています。ヒトが持つDNAのどこにでもこのような1つの塩基の変更は起こる可能性がありますが、ある集団の1%以上に特定の一塩基の置き換えが見られる場合に、SNPとして分類されます。SNPは平均すると、1,000塩基に1回の頻度で起こります。つまり、合計すると約400万から500万個のSNPが一人のゲノム(遺伝情報の全体)に存在することになります。これまでの研究により世界で6億種類以上のSNPが発見されています。
DNAの中でもタンパク質を作るための遺伝情報が含まれる部分のことを遺伝子と言いますが、SNPの多くは遺伝子の部分ではなく、遺伝子と遺伝子との間に存在しています。SNPが遺伝子の近くに存在する場合、変更された遺伝情報による異常なタンパク質により、病気の発症につながる可能性もあります。つまり、SNPは病気に関連する遺伝子を特定する目印にもなります。
ほとんどのSNPは健康や発育にあまり影響しませんが、一部は人間の健康に重要な意味を持つものもあります。特定の薬物の効果、毒物などの環境因子からの影響の受けやすさや、病気の発症リスクに関連することがあるのです。SNPを利用して、家系内でかかりやすい病気に関連する遺伝子変異の受け継がれ方や、心臓病、糖尿病、がんなど複数の遺伝子が関わる病気とSNPの関連を調べる研究などが進められています
D3受容体は大脳辺縁系に局在しており、認知的および感情的な機能を抑制的に働くことを示し、統合失調症やパーキンソン病の治療薬の標的となり、統合失調症に対してはD3受容体の働きの抑制をさらに強めてドパミンの作用を弱め、他方、パーキンソン病に対しては抑制を解除してドパミンの作用を高めようとする薬剤となります。
D4受容体も認知や情動と関連している大脳皮質にも辺縁系にも多く存在しています。統合失調症やパーキンソン病の治療薬の標的です。統合失調症に対してはD4受容体の抑制の働きを更に抑制し、他方、パーキンソン病に対してはD4受容体の働きの抑制を解除してドパミンの作用を高めようとする薬剤となります。認知したことや感情を行動に表現する型に関っています。統合失調症の患者さんの死後の脳の線条体ではD4受容体が著しく増加していることが示された。
D5受容体は脳の大脳辺縁領域の神経細胞で見られ、D1受容体よりも10倍高いドパミン親和性をもつのが特徴です。
パーキンソン病では、黒質 ・背側線条体(被蓋・尾状核)のヘルペスの感染による神経細胞の変性により線条体のドパミンの枯渇により発生します。また、パーキンソン病ではドパミントランスポーターが顕著に低下しています。ドパミントランスポーターは産生されるドパミンの増減に比例して増えたり減ったりします。
パーキンソン病は、原因は黒質のドパミンを産生するA8,A9,A10神経群にヘルペスが感染した結果、ドパミン細胞が崩壊して生じた神経変性疾患によるドパミン減少症であり運動障害のみならず、運動に関りのない障害、つまりドパミン産生とかかわりのない脳の他の神経細胞に感染したヘルペスによる細胞の崩壊によりも来たす病気である非運動障害の中には、神経精神症状(うつ、幻覚、認知症など)、睡眠症状 (むずむず足症候群、REM(レム)睡眠関連行動異常(寝言、夜驚症など、日中過眠など)、感覚症状 (痛み、締め付け感)があります。これらの病気はすべてヘルペス感染が多かれ少なかれ関わっているのです。
ドパミンは過少でも過剰でも関係なく新たなる病気が生まれるのです。言い換えるとドパミンがもたらす快楽が多すぎても、少なすぎても肉体のみならず、パーキンソン病の根本原因であるherpesにより精神も運動神経も感覚神経も自律神経のすべての神経は様々な障害を受けるのみならず免疫が落とされる限り同時に原因であるherpesがあらゆる神経細胞に増え続け生涯、治らない病気になるということです。つまり人間の幸せと健康(病気)を支配しているのはドパミンとヘルペスなのです。いや現代の人間の病気はherpesがすべて支配しているのです。従って漫然と『医学』と言うよりもすべて明確に『herpes医学』と変えるべきです。何故ならば現代のすべての病気の原因は癌をも含めてヘルペスである。
ここで副腎皮質と副腎髄質の作用の違いについて勉強しましょう。というのはストレスがかかると副腎皮質でコルチゾールという糖質コルチコイドを産生してストレスを乗り越えようとします。一方ストレスを乗り越えた時よく頑張りましたというご褒美として快楽という報酬を感じさせてあげましょうという仕事をしてくれるのが副腎髄質が作るドパミンなのです。それでは副腎皮質と副腎髄質の働きを見てみましょう。
副腎皮質は、コルチゾールとアルドステロンと呼ばれるホルモンを産生します。 コルチゾールはストレスから体を守り、糖利用の調節、血圧を正常に保つホルモンです。 アルドステロンは塩分(塩化ナトリウム)、カリウム、水分のバランスを保つのに重要な役割をします。コルチゾールはコルチコステロイドの一つですがコルチゾールは、主な働きは、肝臓での糖の新生、筋肉でのたんぱく質代謝、脂肪組織での脂肪の分解などの代謝の促進、抗炎症および免疫抑制などで、生体にとって必須のホルモンです。血液にのって身体全体をまわり、肝臓、心臓、肺、脳、腎臓等ほとんどの組織の代謝に作用します。ミネラルコルチコイド(鉱質コルチコイド)といわれるアルドステロンは血圧や体内のナトリウムとカリウムの濃度を制御するホルモンを分泌します。また、男性ホルモンとも呼ばれるアンドロゲンの分泌を刺激します。テストステロンはアンドロゲンの代表です。副腎皮質は以下のホルモンを産生する。①グルココルチコイド(主にコルチゾール)②ミネラルコルチコイド(主にアルドステロン)③アンドロゲン(主にデヒドロエピアンドロステロンおよびアンドロステンジオン)。
グルココルチコイドは,多くの細胞や器官系において遺伝子の転写を促進したり抑制する。よく知られる作用として,抗炎症作用や肝糖新生の亢進などがある。
ミネラルコルチコイドは,細胞膜を介する電解質輸送,特にカリウムと交換でナトリウムを保持する腎臓の働きを調節する。
副腎アンドロゲンの主な生理活性は,テストステロンおよびジヒドロテストステロンへの変換後に生じる。副腎髄質はクロム親和性細胞で構成され,この細胞はカテコールアミン(主にアドレナリン,より少量のノルアドレナリン)を合成して分泌する。クロム親和性細胞は生理活性アミンやペプチド(例,ヒスタミン,セロトニン,クロモグラニン類,神経ペプチドホルモン類)も産生する。アドレナリンおよびノルアドレナリンは交感神経系の主要な作動性アミンであり,「逃走・闘争」反応を司るのです。
「逃走・闘争」反応とは生理学的には何でしょうか?心臓に対する変時作用および変力作用,気管支拡張,末梢血管および内臓血管の収縮とそれに伴う骨格筋血管の拡張,グリコーゲン分解,脂肪分解,レニン放出などの代謝作用などが生まれることです。レニンとは、腎臓の糸球体でつくられるタンパク質分解酵素の一種。 血液中のアンジオテンシノーゲンというタンパク質に働きかけ、アンジオテンシンⅠというホルモンを作る。 ここにアンジオテンシン変換酵素が働くことでアンジオテンシンⅡに変わるが、このホルモンが血管収縮、血圧上昇などの作用をもつことで、「逃走・闘争」反応ができるのです。
心臓に対する変時作用および変力作用とは何でしょうか?心臓の洞房結節に作用して心拍数を変化させる作用を変時作用( chronotropic action)と呼び、心拍数を上昇させるほうを正の変時作用、逆を負の変時作用と呼びます。一方、心筋収縮力を増減させる作用は 変力作用( inotropic action)と呼びます。
ノルアドレナリンは、脳内で神経伝達物質として分泌されるため、恐怖や怒り、不安などの精神的な作用にかかわっています。 一方、アドレナリンは脳内ではほとんど分泌されず、また、副腎髄質で分泌されたアドレナリンは血液脳関門を通過することができないため、精神的な作用には関与していません。
副腎髄質とは副腎髄質はアドレナリンとノルアドレナリンというホルモンを産生します。 これらのホルモンは、心臓や血管をはじめ全身の機能が正常に働くのにいろいろ重要な役割を持っていますが、なかでも非常時に血圧を上昇させたり、心臓から血液を送り出す力を強めたり、エネルギー源としてブドウ糖を血中に増加させたりする重要な働きをします。アドレナリンやノルアドレナリンを分泌し、血圧、心拍数、発汗など、交感神経系によっても調節される身体活動の制御に影響を与えます。
自律神経節の神経細胞体に感染したherpesによる自律神経の機能障害には①骨盤臓器障害 (過活動膀胱・便秘)、②流涎、③嚥下障害、④胃部不快、⑤起立性低血圧、⑥四肢の冷え、⑤網状皮斑、⑥発汗異常、⑦脂漏性顔貌、⑧体重減少などが含まれます。網状皮斑とは、皮膚に赤色や紫色の網目模様がみられる状態で「リベドー」とも呼称される場合もあります。 皮膚に分泌する動脈・毛細血管・静脈には交感神経が常に収縮のために取り巻いています。この交感神経にherpesが感染して交感神経が過剰に刺激されるために血管が常に緊張して血管が正常に拡大できず、血液の循環が悪くなるので皮膚の血管に血流のうっ滞が赤色や紫色の網目模様としてみられるのです。脂漏性顔貌とはパーキンソン患者(PD患者)でよくみられるoily faceであり光沢のある脂っぽい顔貌であり,脂漏性顔貌(seborrheic facies)とも呼ばれていますが原因はherpesが皮膚の脂肪細胞に感染したために起こります。上記のherpesによる自律神経の機能障害の八つの症状はすべてherpes感染による自律神経の機能が障害されたか更に自律神経が変性・脱落・細胞死のいずれかあるいは全ての組織や臓器や細胞は自律神経によって支配されていますからその自律神経に感染したヘルペスによる影響を受けて生じるかの三つです。これが『herpes医学』です。ワッハッハ!!!
末梢神経の軸索は髄鞘を形成するシュワン細胞が覆い、中枢神経は軸索をオリゴデンドログリアが覆っているのですがこれらの髄鞘を形成する細胞にherpesが感染しそれに気づいた免疫細胞が攻撃すると炎症が髄鞘で生じてしまい神経軸索にも炎症が波及してしまい神経細胞の機能が異常になるのです。末梢の髄鞘を形成するシュワン細胞にマクロファージが攻撃するとギランバレー症候群が生じ、中枢の髄鞘を形成するオリゴデンドログリアにミクログリアが攻撃すると多発性硬化症が起こるのです。従ってギランバレー症候群も多発性硬化症も原因は同じherpesなのです。自己免疫疾患ではありません。もとよりこの世に自己免疫疾患と呼ぶ病気は存在しません。何故世界中の医者は知らないのでしょうか?
ギラン・バレー症候群(Guillain-Barre Syndrome, GBS)とはいかなる病気なのでしょうか?末梢神経に障害が生じると、脱力、しびれ、痛みなどの症状が現れます。原因に関わらずこの末梢神経の障害の病状を末梢神経障害(ニューロパチー)といいます。ギラン・バレー症候群は複数の末梢神経が障害される病気なので多発ニューロパチー(ポリニューロパチー)と呼びます。
末梢神経は軸索(じくさく)という電気を伝える中心部分が電気ショートを起こさないように髄鞘(ずいしょう)という鞘で包まれている有髄神経と、髄鞘に包まれていない無髄神経とに分けられます。ショート回路は回路内に電球やモーターなどの大きい負荷がなく、電源の正極と負極が直接導線で結ばれているような状態をいう。ショート回路は回路内に電球やモーターなどの大きい負荷がなく、電源の正極と負極が直接導線で結ばれているような状態をいう。電気はコードの絶縁がはがれてしまうと、裸の銅線(どうせん)と銅線が接触するなどの、決められた道順(回路)を通らずに近道をすることがあり、これをショート回路または縮めてショートで訳して短絡(たんらく)といいます。 ショート(たんらく)が起きると、非常に大きな電流が流れ、電線の過熱や発火が発生して、火災を起こすなど非常に危険なのです。
ギラン・バレー症候群は急性免疫性ニューロパチーの代表的疾患であり、ヘルペス感染によって手足の先にしびれや力の入りにくさが出てきます。herpesはあらゆる神経に感染するのであらゆる末梢神経の障害が出ます。ギラン・バレー症候群の病態は有髄神経の髄鞘がはがれてしまう「脱髄」(だつずい)が主体でしたが、近年、軸索障害が主体のギラン・バレー症候群も発見されました。現在は、脱髄型も軸索障害型も含めてギラン・バレー症候群といいます。脱髄型はAcute inflammatory demyelinating polyradiculoneuropathy(AIDP)と呼ばれ、訳は「急性炎症性脱髄性多発性神経根症」です。Radiculoは「神経根の」と言う意味です。つまりヘルペスは神経根にも感染してしまいあらゆる末梢の神経変性疾患を起こしてしまうのです。
「神経根」とは、中枢の脊髄(せきずい)から脊柱管の左右の椎間孔を通って末梢に枝分かれしていく脊髄から出たばかりの脊髄に隣接する脊髄神経(前根と後根)のことです。全部で31対あります。一方、軸索障害型は、運動神経の軸索が障害されるacute motor axonal neuropathy(AMAN)と呼ばれ、訳して急性運動性軸索型ニューロパチーです。ニューロパチーとは、この末梢神経が壊れ、その働きが悪くなっている状態を示す言葉で末梢神経障害と訳します。感覚神経の軸索も障害されるacute motor sensory axonal neuropathy(AMSAN)と呼ばれ訳して急性運動感覚性軸索型ニューロパチーの2つに分けられています。
脊髄は髄節ごとに前根と後根という神経根線維が、それぞれ前角、後角から左右に伸びている。前根は中枢から末梢へ情報を伝える(遠心性)運動神経や自律神経であり、後根は末梢から中枢に向かって情報を伝える(求心性)の感覚神経である。左右に伸びた前根と後根は、すぐに合流して脊髄神経となる。従って神経根の前根の運動神経や自律神経にヘルペスが感染し、又、後根の感覚神経にもヘルペスが感染すると感覚神経、運動神経、自律神経のあらゆる神経の障害が起こってしまうのです。
ギラン・バレーの典型的な症状としては、手足の力が急に入らなくなってきます。通常、下肢から始まり徐々に上肢に広がっていきます。その他にも顔面の筋肉に力が入らない(顔面神経麻痺)、目を動かせなくなって物が二重に見える(外眼筋麻痺)、食事がうまく飲み込めない、ろれつ(呂律)が回らない(球麻痺)などの症状が出ることもあります。脳の延髄で起こる球麻痺の症状が出るのはherpesは末梢神経の脊髄神経から大脳にまで神経軸索を通じて感染できることを示しているのです。
球麻痺(きゅうまひ、bulbar palsy)とは、延髄を外側から見るとボールのように丸い形をしているので “球”と呼ばれる。そのため、延髄の麻痺のことを球麻痺といいますが、臨床では延髄の運動神経麻痺に限定して用いるので、球麻痺とは延髄全体の麻痺ではなく、延髄にある脳神経核が障害され、口・舌・喉の運動障害によって起こる運動神経の麻痺なのです。従って運動が障害される①構音障害(呂律が回らない)、②嚥下障害(食べ物、飲み物の飲み込みが悪くなる)、③呼吸の障害や④循環の障害などの運動障害が生じるのです。
このような四つの球麻痺の運動障害の発生機序を説明しましょう。
延髄には9番(舌咽神経)、10番(迷走神経)、12番(舌下神経)の運動神経を支配する脳神経核が存在する。脳神経とは何でしょうか?脳から出ていく頚部の末梢神経12対を脳神経といいます。これらの脳神経核が両側性に障害されると、咽頭(鼻腔の終わりから声帯・食道の上まで)、口蓋(口腔上壁)、喉頭(声門上部から下部、気管の上まで)を動かす筋肉の運動が障害されます。その結果、嚥下(食べ物を飲み込む)、構音(言葉を発する)ができなくなる。舌の運動障害をきたす。その他、舌の萎縮、舌のぴくぴくと引きつるような筋収縮(筋線維束れん縮)、咽頭(嘔吐)反射が弱まるのです。
構音とは何でしょうか?構音とは発音のことです。声を出せという指令を脳から受けると、肺から息を出し、喉仏にある声帯を震わせて声を作り、最後に舌の形を変えたり、口を動かすことで、思い通りの音を作ります。 この音を作る過程を「構音(発音)」と呼びます。
嘔吐反射の別名には異常絞扼反射と絞扼反射があります。絞扼(こうやく)はしめつけることです。 組織や血管などが圧迫される状態をいう。管腔臓器が狭窄して締まっている状態です。しかし嘔吐反射と絞扼反射には大きな違いがあります。
絞扼反射は、舌根部、咽頭部後壁、口蓋扁桃部などを刺激により誘発される反射のことで、口の中(舌、軟口蓋、咽頭部、喉頭部、他の部位)の刺激により誘発される吐物を伴わない嘔吐様の反射であります。吐物を伴わないがはきたくなるので絞扼反射は催吐反射などとも呼ばれます。一方嘔吐反射はむかつきを感じて吐物も吐き出してしまうのです。
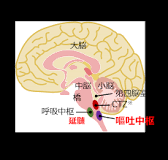
嘔吐が生ずる仕組みは何でしょうか?上図を見てください。嘔吐は嘔吐中枢が刺激されて起こります。嘔吐中枢は延髄の背側毛様体に存在する嘔吐中枢と第四脳室底部の化学受容器引きがね帯(chemoreceptor trigger zone 略してCTZ)により制御され、腸管、咽頭、腹壁腹筋の神経反射により惹起されます。嘔吐中枢は局在のはっきりしたものではなく、一連の嘔吐運動を惹き起こすネットワークです。嘔吐中枢が刺激されると迷走神経、交感神経、横隔膜神経、脊髄神経などを介して、胃噴門部が弛緩し胃幽門部が閉鎖され胃の逆蠕動が起こります。 さらに横隔膜や腹筋が強く収縮することで、胃内容物や胃液が排出される。しかし悪心・嘔吐の原因は消化器疾患とは限らない。 嘔吐は嘔吐中枢を刺激する原因によって中枢性嘔吐と末梢性嘔吐の二つに大別されます。悪心(おしん)、嘔吐(おうと)はいずれも医学用語です。 悪心とは、嘔吐の前に起こるむかつき(吐き気)のことをいいます。 嘔吐とは、胃の中にあるものを吐き出すことをいいます。 これらは同時に起こることもありますし、悪心のみ、または嘔吐のみがみられることもあります。
中枢性嘔吐は脳内にある嘔吐中枢が刺激を受けることによって起こる嘔吐であり、くも膜下出血・脳出血、脳腫瘍、髄膜炎などの脳の病気によって脳圧が高くなったとき、メニエール病や乗り物酔いなど内耳に刺激を受けた場合、抗がん剤やアルコールなどの薬の影響、ホルモン・電解質の異常、腎臓病などで起こります。
末梢性嘔吐(反射性嘔吐)は内臓からの反射により嘔吐が現れます。反射は、反射中枢がどこにあるかによって、大きく脊髄反射、延髄反射、中脳反射などにまず区別される。 さらに、効果器が骨格筋である場合には体性反射とよばれ、効果器が心臓、血管、胃腸などの内臓臓器である場合には内臓神経反射とよばれる。内臓神経反射は自律神経反射ともよばれる。内臓神経反射は自律神経反射とよばれるのは、内臓の働きは内臓自身が自律的に働くしかないので唾液を分泌する反射(唾液分泌反射)や瞳孔の大きさを変化させる反射(瞳孔反射)、くしゃみなどがある。 血圧、発汗、消化、排泄なども自律神経系反射で調節されている。消化器疾患(急性胃腸炎や胃・十二指腸潰瘍、腸閉塞など)や肝臓・胆のうの病気(胆のう炎・胆管炎、胆石、急性膵炎など)、または腎臓(慢性腎臓病、腎盂腎炎など)や生殖器(婦人科系・泌尿器系)の病気の時に見られる嘔吐です。心筋梗塞のときに見られる悪心・嘔吐も反射性嘔吐の一つです。あらゆる種類の神経の中でこっそり縁の下の力持ちでありながら人に意識されることもないので感謝されないし、しかも他の神経よりも遥かに圧倒的な量の仕事量を毎日毎日こなして生命を守り続けているのは自律神経なのです。自律神経の働きがなければ人間の生命はあり得ません。
又、嘔吐は生理的反射と心理的要因の二つに分けられます。生理的反射は口腔内の異物に対する体の反応であり、多かれ少なかれ、口の中や喉の近くに異物を感じると、体がそれを吐き出そうとする作用が働きます。心理的要因は過去にいろいろなトラウマを持ち、同じ場面に出会うと極度の恐怖心から反射的に吐き気に襲われたり、嘔吐感を感じることがあります。
神経系の区分
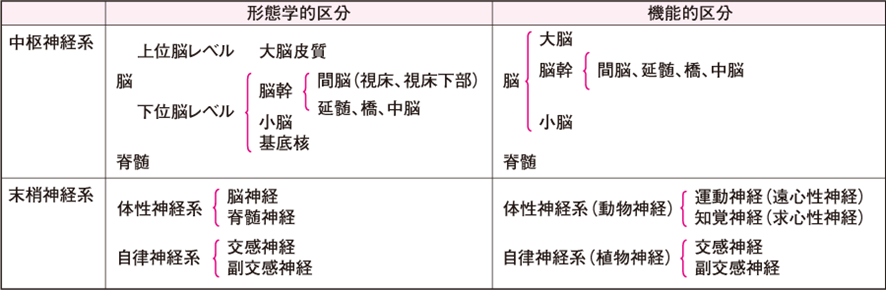
上の表で気を付けてもらいたいのは一つ目は脳幹の中に間脳が入れられていますが間脳は独立した中枢神経の一つのそしきとしてとして取り扱われることもあります。二つ目は末梢神経系の形態学的区分の体性神経系の脳神経は脳と同じで脊髄は脊髄神経と同じと考える人がいますが実はこの脳神経は正しくは脳から末梢から出ていく12対の脳末梢神経であり、脊髄神経は正しくは脊髄から出ていく31対の脊髄末梢神経ですから末梢神経なのです。言い換えると脳の中にある神経は脳神経とは言いません。また脊髄にある神経も脊髄神経とは言いません。混乱しないようにしてください。
また末梢神経系には体性神経系と自律神経系しかありません。何故ならば体性神経は脳神経ではありませんし自律神経は脳に支配されていないので自律神経と名付けられているのです。
自律神経反射は脳に意識されることなく起こる反応で三種類あります。自律神経は様々な脳ではなくて内臓自身が自律神経反射を行います。反射は必ず脳にまで信号が行かないのですが求心路と遠心路から成り立っています。自律神経の病気はすべて自律神経に住みたがるherpesによるものです。筋肉には手足の筋肉のように、自分の意志で動かすことのできる筋肉と、心臓や胃腸の筋肉のように自分の意志では自由に動かせない筋肉とがあります。自分の意志で動かすことのできる筋肉は、一般には横紋筋といって強く縮む力を発揮する筋肉です。動物はこの力強い横紋筋の働きで走って敵から逃げたり、餌に向かって突進したりする事ができます。自分の意志ではコントロールできないし又する必要がない筋肉一般には平滑筋と呼ばれて、ゆっくりと滑らかな動きを一日中続けることのできる筋肉です。平滑筋は主に内臓を動かす筋肉です。
筋肉にはどのような種類があるのか?復習しましょう。
下の表1に示されているように筋肉は骨格筋、心筋、平滑(内臓)筋の3つに大別できます。
表1筋肉の種類
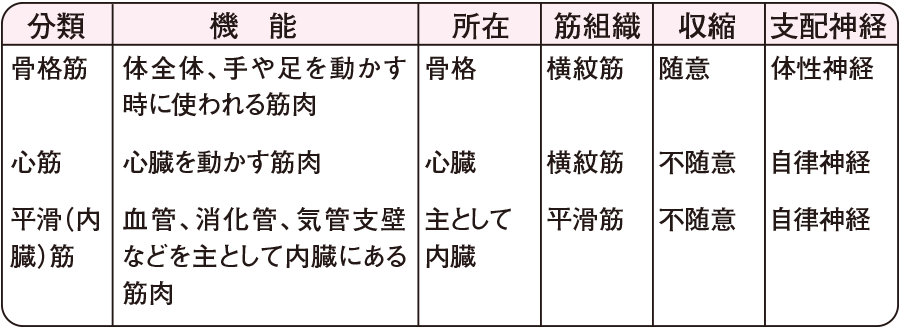
左の筋肉の種類うち、通常「筋肉」と称しているのは骨格筋ですが、心筋、平滑も「筋肉」です。平滑筋は内臓にあるので内臓筋とも言われます。それぞれの三つの特徴を簡単に説明しましょう。
骨格筋は骨と骨をつないで体を動かすための筋肉です。束状に集まった筋線維で構成されており、周囲を筋膜で包まれています。骨格筋は自分の意思で動かすことができるため、随意筋と呼ばれます。骨格筋は、体性運動神経によって支配されています。体性運動神経は通常、運動神経と言われます。組織学的には、縞模様の横紋が見られる横紋筋、迅速で強力な収縮を行うことができますが、運動によって疲労します。
心筋は心臓壁を構成する筋肉です。骨格筋と同じく横紋筋ですが、意思で動かない不随意筋です。いくら動いても疲労しない点も骨格筋とは異なります。心臓のペースメイカーと呼ばれる洞房結節から興奮が生じ、刺激伝導系によって興奮が次々に伝わると、心臓をリズミカルに収縮、拡張させます。洞房結節 は洞結節とも呼ばれ心臓の右心房付近にあり、「自然のペースメイカー」と呼ばれます。 洞結節では、心臓の収縮を指令するための電気的興奮が通常1分間に約60~80回のペースで作られる。この刺激伝導路のなかには中継点として、房室結節と呼ばれる第二の特殊な細胞の集まりがあり、心臓の中央近くに位置しています。この房室結節は、受けとった電気信号をさらに刺激伝導路を通じて心室の壁に送り出します。この一連の電気の流れによって、心臓全体に命令が行きわたり、この命令を受けた心臓の筋肉の運動によって心臓は収縮します。激しい運動をした時には心臓の拍動が速くなり、安静時には拍動が遅くなるように、心筋の運動は自律神経によって調節されています。心筋細胞は分裂する能力を持っていないため、心筋梗塞などで損傷・壊死すると再生することはできません。
平滑(内臓筋)
消化管や気道などの内臓壁、血管壁などを構成するのが平滑(内臓)筋です。骨格筋や心筋とは違い、横紋は見られません。
平滑筋(内臓筋)は意思で動かすことのできない不随意筋です。筋そのものの収縮力は横紋筋に及びませんが、疲労することなく動き続けることができるため、内臓のリズムを保ち続けることができます。実は正確に言うと平滑筋の型は2種類に分類される。 ひとつを「内臓平滑筋」とよび、腸管、気管、卵管、尿管などの特定の大きい内臓の平滑筋であり、活動電位を発して収縮する点が大きな特徴である。 もうひとつを多ユニット「平滑筋」とよび、大動脈などの太い血管や器官、瞳孔散大筋や括約筋が該当して、活動電位を発することなく神経に依存して収縮するのが特徴である。肛門(こうもん)・尿道の周囲などにある環状の筋肉で筋肉の弛緩(しかん)と収縮により、開閉したり内容物を必要に応じて通過させたり止めたりする。括約筋は環状筋のうち,収縮すればその部位を締めつけ閉じる働きをする輪状の筋肉で、 平滑筋も横紋筋もある。 瞳孔(どうこう)をせばめる瞳孔括約筋,胃と小腸の境の幽門括約筋,尿道や肛門を締めておく尿道括約筋,内肛門括約筋,外肛門括約筋などがある。
平滑(内臓)筋は心臓と同じように、自律神経の支配を受けています。
横紋筋と平滑筋の違いは横紋筋には、アクチンという細い筋線維と、ミオシンという太い筋線維が交互に規則正しく並んでおり、縞模様のように見えます。平滑筋は先端が先細りになった細長い細胞の集まりで、縞模様は見えません。
反射の種類には三種類があります。1.内臓感覚-内臓自律神経反射。2.体性感覚-内臓自律神経反射。3.内臓感覚-体性神経反射の三つです。
1.内臓感覚-内臓自律神経反射で内臓感覚を求心路とし、内臓自律神経を遠心路とするのです。内臓自律神経を遠心路とするのです。例として血圧、胃腸運動、排尿の調節などは脳は関わってはいないのです。
2.体性感覚-内臓自律神経反射で体性感覚を求心路とし、内臓自律神経を遠心路とするのです。例として体温調節反射、射乳反射、射精反射などです。
3.内臓感覚-体性神経反射で内臓感覚を求心路とし、体性神経を遠心路とします。例として筋性防御などです。筋性防御(muscular defense)とは、腹部触診時に腹筋の緊張によって抵抗が発生する身体所見である。壁側腹膜の炎症を示唆し、腹膜炎や腹腔内出血などで見られる。腹腔内になんらかの急性炎症が起こると,反射的にその部分の腹壁が緊張して硬くなり,外から触れられるようになります。従って腹腔内の急性炎症にさいしては腹壁反射言うべきです。たとえば急性虫垂炎の場合,この腹壁反射の症状は右下腹部に現れる。これを筋性防御というのは,患部を防衛するという意味から名づけられた。この現象は炎症によって刺激された腹膜と同一の脊髄神経の支配領域の腹壁筋肉が自律神経により反射的に緊張するもので,この緊張の強さは刺激の強さとほぼ一致する。腹腔内の炎症が腹膜に及んでいないときには,この症状は現れない。腹部を触診した際、腹壁の筋肉が緊張して硬くなる内臓体性反射である。
筋性防御が起こる範囲によって、炎症部位を判断する。汎発性腹膜炎の場合には、重症化すると腹筋の硬さが著しく増す。この腹部所見を「板状硬」と呼ぶ。
体性神経系は、自律神経系とともに末梢神経系をなす。体性神経系は随意神経系,脳脊髄神経系ともいう。 末梢神経系の一種。 運動,感覚などの動物性機能をつかさどり,不随意運動を支配する自律神経系に対して体性神経系があるのです。 発する中枢によって脳神経,脊髄神経に分けられる。体性神経系は、感覚神経と運動神経とがある。体性感覚や特殊感覚に基づく骨格筋の反射による運動機能の調節や、大脳皮質の働きに基づく意志による運動機能に関与する。特殊感覚には、視覚、聴覚、味覚、嗅覚、平衡感覚があります。 これらの感覚を担当する感覚器は、眼(視神経)、耳(聴神経)、舌(顔面神経と舌咽神経)、鼻(嗅神経)、内耳(前庭神経)です。 それぞれの神経は、これらの感覚器で得た情報を脳に伝える感覚神経です。 体性感覚は、表面感覚と深部感覚に分けられます。
球麻痺とは、延髄から出ている運動性脳神経に支配される筋が麻痺を起こすことです。球麻痺は、延髄にある脳神経核に障害が起こることで、口や舌、喉に運動障害が起こります。球麻痺で運動機能障害を起こす代表的な疾患は、①筋萎縮性側索硬化症、②ギランバレー症候群、③多発性硬化症、④重症筋無力症、⑤延髄梗塞⑥延髄出血です。症状の程度は人それぞれで、麻痺が軽い方からほとんど手足が動かせなくなる方まで様々です。手足にしびれや痛みが出たりすることはありますが、一般に感覚障害は運動麻痺に比べて軽度です。自律神経が障害されると不整脈、起立性低血圧などがみられます。重症例では呼吸をするための筋肉が麻痺して、人工呼吸器の装着が必要になります。このようにギランバレーを起こすherpesは運動神経、感覚神経、自律神経のすべての神経に感染してあらゆる神経難病を起こしてしまうのです。球麻痺とは何でしょうか? 延髄を外側から見ると一部がボールのように丸い形をしているので延髄を“球”と呼ぶのですが、延髄にある脳神経核が障害され、口・舌・喉の運動障害によって起こる症状であるので、実は延髄球麻痺というべきなのです。球麻痺(bulbar palsy)が起こると、構音障害(呂律が回らない)、嚥下障害(食べ物、飲み物の飲み込みが悪くなる)、呼吸や循環の障害が生じるのです。
ギランバレーの症状はピークを過ぎれば改善します。症状の進行は急速で、神経症状が出てから2週から4週で症状はピークになり、重症例では四肢麻痺が進んで歩行に介助を要し、10数%の患者さんは呼吸筋にも麻痺が及んで人工呼吸器を装着することがあります。また約半数の人は顔面神経麻痺、複視、嚥下障害といったヘルペス性の脳神経障害を生じます。頻脈、徐脈、起立性低血圧、膀胱直腸障害といった自律神経障害を伴うこともあります。
しかし、重症例では回復までに長期間を要します。何らかの障害を残す方が約2割いて、約5%の方は亡くなります。と言われていますが、本当でしょうか?ギランバレーの原因はherpesである限りはギランバレーは死に至る病気では本来、ありえないのです。
元来herpesと免役との戦いでは免役はherpesを殺しきることはできませんが免疫を上げれば上げるほどherpesを感染細胞の奥深い核や脂肪質でエピソームの姿で逃げ込ませたり、あるいは遺伝子にプロウイルスとして逃げ込ませたりして免役を落とさない限り遺伝子にも封じ込めることが出来るのでヘルペスに免役が敗北してヘルペスに蹂躙されて人の命が奪われることはないのです。
エピソームとは何でしょうか?herpesが感染した細胞自身がが本来もっている染色体とは別に,herpesの比較的短い裸の環状DNAが独立して別の染色体として安定的に維持されたherpesの裸の環状DNAのことです。すべてのヘルペスウイルスは自然宿主に潜伏感染を成立させますが潜伏感染しても細胞に感染を気づかれないようにいずれのherpes細胞も同じくエピソームの形態をとるのです。
例えばBリンパ球に潜伏するエプスタイン-バーウイルス( Epstein-Barr virus : EBV )は,Bリンパ球の分裂に伴ってエピソームは娘細胞に分配されて細胞質内に存在し、Bリンパ球の細胞質に遊離の状態と染色体に組込まれた状態の二つの状態をとっているのです。しかし現在の難病や自己免疫疾患の治療はすべてステロイドのみならず最近は生物工学を利用した遺伝子改変による免疫抑制剤どころか、命を守る免疫の遺伝子が作った最高の免疫物質であるサイトカインなどの抗体を作って症状が減って喜んでいる輩の医療ばかりですから人体はherpes天国となり原因不明な実はherpesが原因である難病が増えるばかりです。残念です。免疫を抑制される間、これらの病気の原因であるヘルペスは増殖の限りを尽くそうとしますからギランバレーの治療で、約5%の方は亡くなるのは間違った医療の犠牲者なのです。つまり現代の標準医療の治療の行き先は治るのではなく最後は患者さんの生命中枢の細胞のみならず心臓の拍動のリズムをとる自然ペースメイカーである洞房結節の細胞にもherpesが感染してしまい命取りに繋がることになるのです。かの有名過ぎる「近藤誠先生」が堂堂と言われているように『癌をはじめとする治らないとされている病気で医者に掛かれば殺されてしまうから病医院には行くな』などの書物に書かれている類のherpesによる難病が最後に起こって医療に命を奪われる人は五万といます。何故ならば病気を治すのは医者でもなく薬でもなく自分の免疫しかないのに現代の病気のすべての原因であるヘルペスを増やすために最も優れた免疫抑制剤で症状をとっているだけで愚かで無知な善人の患者さんを無理やり納得させ満足させているだけですからどうにもなりません。残念です。
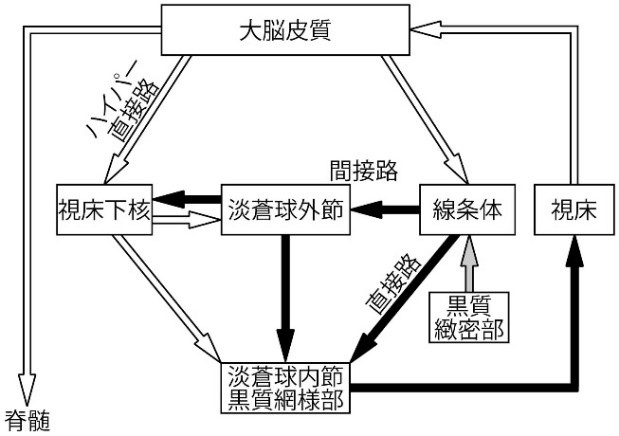
ドパミンの本論に戻りましょう。ドパミンは多様な作用をもつ生体分子であり、主に快楽をもたらす神経伝達物質として人間を支配する王様のように振る舞っています。神経細胞同士の結合部位(シナプス)でのドパミンの情報伝達においては、ドパミンのレセプターには現在 5 種類に分類されてその詳細は既に説明しました。ドパミン作動性神経細胞は脳内で最も多いのは間脳の一つである中脳で視床下部にも多く存在します。ドパミンがもつ脳機能の調節作用や快楽をもたらす作用では中脳にある黒質から大脳基底核の線条体(被殻・尾状核・淡蒼球)へ投射するドパミン神経が特に重要です。黒質-線条体系でのドパミンの減少は黒質に感染したヘルペスによる、難治性の神経変性疾患であるパーキンソン病を引き起こします。下図に大脳基底核を巡る神経回路を示します。
白矢印:グルタミン酸作動性興奮性投射、黒矢印:GABA作動性抑制性投射、灰色矢印:ドパミン作動性投射
一方、線条体や視床下核に感染したherpesにより神経細胞が脱落して細胞死をもたらすと、ハンチントン病というパーキンソンと異なるタイプの神経変性疾患が発症します。上図で示すように視床下核とは、大脳基底核を構成する核のひとつであります。視床下核は大脳皮質から興奮性入力を受け、かつ視床下核は淡蒼球外節から抑制性入力を受けます。更に視床下核は淡蒼球外節と淡蒼球内節・黒質網様部に興奮性投射を送ります。 視床下核が障害を受けるとヘミバリスムを来す。ヘミバリスムとは舞踏運動の一種で、片腕または片脚を投げ出すような激しい不随意運動です。 近年、パーキンソン病に対する脳深部刺激療法(Deep Brain Stimulationの略DBS)のターゲットとして臨床的にも注目されています。通常、DBSのターゲットになるのは視床VIM核、視床下核(subthalamic nucleus,略して STN)、淡蒼球(globus pallidus internus略してGPi)の3カ所です。 その他の部位をターゲットとすることもありますが、まだ一般的ではありません。 それぞれのターゲットによって改善される症状が少し異なります。いずれにしろ脳深部刺激療法(Deep Brain Stimulationの略DBS)は根治治療ではないので治りません。根治治療は原因療法ですからドパミンを減らすしかないのです。
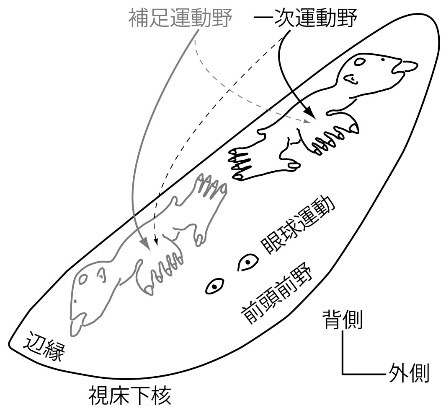
下図に視床下核の機能分化の部位局在化の絵図を示します。つまり大脳皮質からの入力が視床下核のどの領域(部位)で投射されているかを示す絵です。視床下核の大脳皮質からの入力をどの視床下核の領域で受け入れているかを示すものです。左図は大脳の補足運動野と一次運動野と前頭前野と眼球運動と辺縁の五つから入力をどこで受けているかを示しています。視床下核背側部は、大脳皮質運動野から体部位局在を保った入力を受けていることから、大脳の運動領域の信号を受け入れています。大脳皮質一次運動野からは視床下核背側部のうち外側部に、補足運動野からは内側部に大脳から投射している。一次運動野の口腔顔面、上肢、下肢領域からは視床下核外側部において、外側から内側にかけて投射されて終止していることがわかります。これに対して、大脳の補足運動野の口腔顔面、上肢、下肢領域からの投射は、内側部において内側から外側に終止している。すなわち、外側部、内側部それぞれに、互いに鏡像関係にあるような体部位再現がある。この運動領域の腹側には前頭前野から、その一部に眼球運動野から、最内側部には辺縁皮質から入力を受ける領域が視床核に存在する。したがって、視床下核は上下肢や体幹の運動だけではなく、眼球運動、前頭前野の機能である高次機能、辺縁系の機能である情動などにも関わっていることを理解してもらいたいのです。
ハンチントン病とはなんでしょうか?全ての遺伝子には4種類の核酸があります。 正常のIT15遺伝子の一部には核酸3個(シトシン・アデニン・グアニン)の繰り返し配列があります。 この繰り返し配列を頭文字をとってCAG繰り返し配列と呼びます。しかしハンチントン病の患者さんではこの繰り返し配列が異常に繰り返され伸びています。 この異常に伸びた繰り返し配列によって病気が起こることが明らかになりました。ハンチントン病では,尾状核が萎縮し,線条体の抑制性中間有棘ニューロンが変性して,神経伝達物質であるγ-アミノ酪酸(GABA)およびサブスタンスPが減少する。ハンチントン病は,4番染色体上のhuntingtin(HTT)遺伝子の変異に起因し,核内のこのHTT遺伝子に入り込んだherpesウイルスの遺伝子がアミノ酸のグルタミンをコードするDNA配列であるCAGのリピート異常をもたらすと遺伝子異常をもたらし異常なたんぱくを産生してしまうのです。遺伝子を時間経過の中で変えるのはプロ蛋白になれるヘルペスしかいません。遺伝子病は胎児性先天性の遺伝子病と生後性後天的遺伝子病しかありません。両者ともherpes性形質転換(突然変異)が原因です。
CAGのリピートが多くなればなるほど遺伝子の産物はハンチンチン(huntingtin略してHTT)と呼ばれる大きなタンパク質である,ポリグルタミン残基の拡大伸長がみられ,それがニューロン内に蓄積され,ハンチントン病をもたらす。CAGリピートが多くなるほど,発症年齢はより低くなり,ハンチントン病の表現型(症状)はより症状は重度になる。世代を重ねるにつれてリピート数が増すことがあり,時代を経るほど家系内の表現型が重症化する。これを表現促進と呼ぶ。表現促進現象は,継代と共に発症年齢が若年化したり症状が重篤化することを指し,脆弱 X 症候群,ハンチントン病,種々の SCA(脊髄小脳失調症 )をはじめとするトリプレットリピート病に共通 してみとめる現象である.トリプレットリピート病とは、3塩基繰り返し配列(リピート)の異常伸長により引き起こされる疾患の総称で、CAGリピートによるハンチントン病(HD)や脊髄小脳失調症(SCA)、CTGリピートによる筋強直性ジストロフィー1型(DM1)、フックス角膜内皮変性症(FECD)などがある。 その基礎となる分子メカニズムは,ヘルペス感染による継代にともなうリピート数の伸長などです。脊髄小脳変性症(SCD)はどんな病気?
小脳を中心としたherpesによる神経の変性によって生じる疾患を総称して脊髄小脳変性症(Spino‐cerebellar degeneration: 以下SCD)と呼びます。変性とははっきりした原因が不明の神経障害の一群のことですが変性をもたらすのは神経細胞に感染したヘルペスによるものです。神経変性疾患のすべての原因はherpesもたらす形質転換によるものです。遺伝性SCDは、その遺伝形式によって常染色体優性遺伝(AD)、常染色体劣性遺伝(AR)、X連鎖遺伝(XR)、ミトコンドリア遺伝に分けられますが、90%以上が常染色体優性遺伝形式をとります。ミトコンドリア遺伝子は生まれながらにしてミトコンドリアの働きを低下させるような遺伝子の変化を持っていのが原因であり総称してミトコンドリア病と呼んでいます。X連鎖劣性遺伝は、X染色体上の遺伝子の突然変異により、遺伝子突然変異がホモ接合である男性と女性で常に表現型が発現する遺伝形式です。ホモ接合型またはホモ接合体、同型接合体は、遺伝学において、二倍体生物のある遺伝子座が AA, BB, aa, bb などのように同一の対立遺伝子をもつ個体のことである。反対語は「ヘテロ接合」です。脆弱X症候群は、胎児性遺伝性による発達遅滞/知的障害を特徴とする疾患で、その他に大きな耳、長い顔などの身体的特徴や行動異常(自閉傾向、多動、注意欠如など)が知られている胎児であると気に完成したヘルペスによる遺伝性の病気の1つです。
大脳は基底核が大脳皮質の活動性を監視する「門番」としての役割を演じ大脳は判断を下す司令官ですがこの「門番」にヘルペスが感染すると問題が起こるとパーキンソン病やハンチントン病といった神経変性疾患がおこるのです。例えば淡蒼球内節・黒質網様部へ投射する線条体(被殻・尾状核)にherpesが感染すると大脳皮質―基底核回路の直接経路と間接経路の異常な働きが引き金となることで、この経路は運動の開始や増大を引きおこしてしまうのです。
ドパミンは脳内の快楽を生み出す報酬系において極めて重要であり、大脳基底核内でのドパミンの役割として、主に大脳皮質が示す反応の出現確率を偏らせることによる行動選択のメカニズムがあります。報酬に動機づけられた目標志向行動には線条体が関与しており、脳卒中などでこの脳部位に障害を負った場合には、機能回復への関心が薄れてリハビリテーションに対する意欲が低下するケースがあるが回復できた未来の快楽を期待することでドパミンは増えるのです。
ドパミンはまた運動の学習と記憶に関連した神経活動の調節においても成果が上がるときに報酬として快楽を増やすドパミンの増加があるのです。
ドパミンはカテコール核を持つアミンで従ってカテコールアミンと呼ばれるのですが、中枢神経系の伝達物質であり、及び末梢のシグナル分子として働く。生体内のドパミンはチロシンから二段階の酵素反応によって合成され、小胞モノアミントランスポーターによって細胞内の小胞に取り込まれる。開口放出によって放出されたドパミンは放出部位から比較的離れた場所に存在する受容体に結合して標的細胞の生理機能を調節する。ドパミン受容体は全てGタンパク質共役型で、遅い信号伝達もしくは神経細胞機能の修飾を担う。中脳から大脳に投射するドパミン神経が中枢のドパミン神経系の大部分を占め、運動機能、認知機能などの中枢機能の調節に関与する。また、ドパミン神経系は精神疾患の病態生理に対する関与があるのはドパミン神経にherpesが感染しているからであり、抗精神病薬等の治療薬や依存性薬物の標的となるが根本治療ではなく対症療法ですから進行することはあっても完治することはないのです。統合失調症などの精神疾患の進行を止めるには抗ヘルペス剤の大量投与と免疫を上げる漢方煎剤を大量服用することです。
ドバミン神経細胞には、ドパミンを再び取り込み、ドパミン量を調整するドパミントランス ポーターを持っています。したがってヘルペス感染によりドパミン神経細胞が壊れると同じくドパミントランスポーターも減少してしまいます。ドパミントランスポーターは、脳の線条体内に存在する黒質線条体ドパミン神経の終末部に高発現しています。パーキンソン病やレビー小体型認知症では、この発現量が低下することが知られています。レビー小体型認知症では、レビー小体というタンパク質の塊が表面を覆う大脳皮質にヘルペスウイルスが感染した時に現れた場合に、診断されますが症状は深刻です。いっぽう、herpesが脳幹の中脳のドパミン産生神経に感染してレビー小体が脳幹に現れた場合、パーキンソン病と診断されます。従ってレビー小体型認知症とパーキンソン病はよく似た運動症状が現れるのは当然のことなのです。
ドパミントランスポーター(dopamine transporter:DAT)とは,中脳黒質のドパミン作動性神経細胞の線条体の終末部にある構造物で,線条体に放出されたドパミンを再取り込みする働きを有しています。
ドパミンは脳幹の中脳と視床に多いのですが健常対照群に較べると、群の視床のドパミントランスポーターの量は多く、また、統合失調症の重症度が高くなればなる程ドパミントランスポーターの量が増加傾向にあるのです。つまり統合失調症患者の視床ではドパミントランスポーターが増量し、ドパミン神経の活動が過剰になっているのです。統合失調症に関して視床のドパミンD2受容体の量が減少している事が報告されており、これらのことを考慮すると、視床のドパミン神経系のレセプターであるドパミンD2受容体の二種類のD2Lと D2Sの異常活動が、情報の統合に乱れを生じさせ、統合失調症の重大な原因の一つとなっているのです。
ドパミントランスポーター(ドパミンの運び屋)というのは、ドパミン作動性のシナプス前神経細胞から大量に放出されたドパミンをシナプス前神経細胞内に再び取り込む働きをしているのですが、このドパミントランスポーターはドパミンが増えれば増えるほどそれに対応して増えることによってドパミン神経の活動が過剰になります。問題は何故ドパミントランスポーターが増えたのかの理由は「統合失調症の人は快楽の源泉であるドパミンが欲しくてたまらないからです。全ての人間は快楽のために生きているだけなのですが快楽が満たされないときにストレスがかかりそのたび毎にドパミンを出すのですが又満たされずにと言う悪循環を15歳ごろまで続けると最後はドパミン産生過剰症と言う統合失調症になってしまうのです。ただ統合失調症の人は自分が作った自家製の覚せい剤であるドパミン依存症から離脱できない気質の人たち」ですから、統合失調症は内因性ドパミン依存症と名付けてもいいのです。覚せい剤中毒患者は外因性かつ自分で作ったドパミン依存症なのです。
それでは神経伝達物質であるドパミンの本来の働きは何でしょうか?まず「やる気」と「意欲」は、脳の側坐核から分泌される「ドパミン」というによってもたらされているのです。このようにドパミンは快楽を生み出す出発点である「やる気」や「意欲」を人の脳に得させる、人間の楽しみとなるあらゆる過去、現在、未来に関わる楽しい記憶、思い、行動、運動、学習、感情、情動、計画、反省、思考、意識、理解、快楽、幸福感、ホルモンの調節などほとんどすべての生命活動や精神活動に関わり人に快適さを与えているのです。しかし人生は欲しかった快楽だけで成り立っているわけではないのです。特に人間は常に快楽と言う名の幸福を求めて生きています。快楽がこの世で一切感じることが出来なければ人間はすべて自殺していまうでしょう。ドパミンは、心の「命」の根源である快楽を生み出す源泉なのです。あらゆる生まれつきの気質や性格以上に人間を支配できるのは何よりも快楽なのです。快楽を獲得したり快楽の気分を感じるとる方法は人間の生まれつきの気質や性格によって多種あり、他人の快楽を他人を傷つけて奪い取る人も多いのです。まともな人間になるために幸福と言う名のまともな快楽を求めてひたむきな努力によって困難を克服した時に報酬として快楽を獲得させるのが本来のドパミンの仕事です。しかしながら社会は特に資本主義社会は快楽の取り合いを無制限な自由競走を行い自分だけの快楽を最大限に増やすことが人間の努力の最高目標なのです。しかし能力が少なくて貪欲過ぎる人や逆に能力がありすぎてしかも貪欲過ぎて満足することが出来ない人もいます。
脳ホルモンであるドパミンを出して自分の思いが達成された記憶の中の快感を思い描くだけで人体のドパミン産生細胞は増えますが、達成した過去の思いを描くだけで実現できなければ、落胆と失望だけが残りそれが苦痛になりストレスとなり副腎髄質からアドレナリンやノルアドレナリンと同時にドパミンを繰り返し出し続けるので最後は自分が作りすぎた快楽のドパミンの犠牲者になってしまうのです。
気質や性格はやはり生まれたときに遺伝子によって多かれ少なかれ決まっているので、なかなか変えられるものではありません。気質とは、人間や哺乳類などの動物の集団が先天的にもっている遺伝子によって規定されている環境や様々な刺激などに反応する行動特性です。性格と同一視されやすいのですが、性格は気質から作られる各個体の具体的な行動や意欲の傾向であるので少し違います。
気質と違って性格は、生まれつきの部分と、その後の環境や経験や記憶によって作られる部分があります。 体を考えても同じで、生まれつきの体質があり、そのうえに、長年の生活の結果できた体があります。特に性格の中の生まれつきの部分を「気質」といいます。
ドパミンは生まれてから乳幼児期から成長期の人格形成においても努力し、頑張って欲しものを手に入れた快感だけを生み出すだけではないのです。人間として自分の生まれ持った才能を自分自身の力で伸ばして無限に成長する喜びを脳に与えてくれる脳ホルモンこそドパミンでありその最高の報酬である快楽を心に感じさせてくれるのもドパミンなのです。
しかし例えばお酒を飲んで気分が良くなるのは、お酒を飲むことによっていい気持になるとドパミンが放出されて脳内の報酬系という神経系がお酒に酔って活性化するためです。しかし、注意しなければいけないのが、ドパミンが過剰に分泌されると快感が生み出され過食や飲酒、喫煙、ギャンブル等にのめり込んでしまって糖尿病や肥満やアル中になったり肺がんになったりするのです。現代の病気の原因は二つしかありません。化学物質によるアレルギーとヘルペスだけです。現代の私以外の医者の仕事は免疫を抑える薬を投与して病気を永遠に創るだけです。残念至極です。癌も癌ウイルスによっておきます。その癌ウイルスの名は正にherpesウイルスなのです。癌についてはここを読んでください。
ドパミンは、出せば出すほど気持ちを興奮させ快感を感じ取らせる神経伝達物質です。しかし「過ぎたるは及ばざるがごとし」で、作り過ぎたドパミンの働きを遮断するための薬が抗精神病薬で幻覚や妄想や興奮などの統合失調症の陽性症状の治療に効果を示すこと、又、実験的にドパミンの働きを活性化させる薬剤が統合失調症に似た幻覚や妄想を引き起こすことが分かったのだから、統合失調症の陽性症状に脳内のドパミンの過剰が関与していることが証明されたのです。
中脳から大脳に投射するドパミン神経が中枢のドパミン神経系の大部分を占め、ドパミンによって情報を伝達している最大の神経経路が、中脳辺縁系です。情動と快楽を求める欲望の中枢である中脳辺縁系でドパミンが過剰に放出されていると、幻覚や妄想などの陽性症状が引き起こされます。
それでは何故、快楽を求める欲望の中枢である中脳辺縁系でドパミンが過剰に放出されると、幻覚や妄想などの陽性症状が引き起こされるのでしょうか?中脳皮質系の経路では、ドパミンの働きを遮断する抗精神病薬の副作用によるドパミンの伝達低下により逆に意欲減退、感情鈍麻などの陰性症状や認知機能障害がおこるのです。この様な症状はherpesによるヘルペス性脳炎でも起こります。
またドパミンの働きを遮断する作用のある抗精神病薬で陰性症状が改善されない患者さんに、セロトニンの働きを遮断する作用のある抗精神病薬を投与すると、陰性症状が改善することがみられたため、セロトニンが陰性症状の発現と関連しているのですが統合失調症の原因ではないのです。
セロトニンは必須アミノ酸トリプトファンから生合成される脳内の神経伝達物質のひとつで、動植物に広く分布する生理活性アミンで、インドールアミンの一種で、名称はserum(血清)とtone(緊張)に由来し、血管の緊張を調節する物質として血清から発見されたのでセロトニンと名付けられました。現在の統合失調症の治療薬はすべて治すことはできないのですが、最近、ドパミンやセロトニンを同時に抑制する作用を持っている薬が出ましたが副作用も当然あります。又ドパミン以外に興奮を伝えるNMDA型グルタミン酸受容体と抑制作用のあるGABAも統合失調症に関与していると言われだしました。興奮性の神経伝達物質であるグルタミン酸という神経細胞に取り込むNMDA受容体の機能低下や、GABA神経の機能低下異常も、ドパミンの機能亢進などに関わっているらしいのです。
逆にドパミンの働きを遮断する抗精神病薬の副作用によるドパミンの伝達低下により逆に意欲減退、感情鈍麻などの陰性症状や認知機能障害がおこるのです。更に統合失調症の患者さんでは薬の副作用以外に徐々にさまざまな認知機能が障害されていくのです。 そしてこの認知機能は前頭葉や側頭葉を中心として営まれているので、先に述べたfMRIなどの所見とも一致するのです。 ただしこれらの障害は、それだけで診断ができるほど重篤なものではありませんし、統合失調症だけで見られるというのでもありません。 また個人差も大きく、あくまで平均よりも低めに測定結果が出るということが分かったのです。
脳の空間的かつ構造的な情報のみならず脳の機能活動がどの脳の領域で起きたかを画像化できるようになって飛躍的に脳医学が発展しました。CTとMRI とfMRIの画像化装置について簡単に勉強しましょう。CTとは、Computed Tomography(コンピュータ断層撮影)の略です。人体の輪切り画像をコンピュータによって再構成する装置です。CT検査は撮影の仕組みとして放射線を使用します。体の断面を撮影した複数枚の写真をコンピュータで処理して、希望の部位の画像を出力したものがCT検査です。それに対して、MRI検査は磁力と電波を使用して撮影を行います。体の細胞に含まれる水素原子を、磁力と電波によって影響を与えて画像化したものがMRI検査です。MRI装置には磁石の強い力(磁場)が働いていて、中に入った人の頭や体にごく弱い電磁波を当てる仕組みになっています。返ってきた信号を計算することによって、全く人を傷つけないで断面の画像を撮影することが可能です。
CTと MRI との一番大きな違いは何でしょうか?CT検査は撮影の仕組みとして放射線を使用します。従ってCTは体内に放射能を浴びせることになりますからそれが問題になります。それに対して、MRI検査は磁力と電波を使用して撮影を行うので放射能を浴びせることはないのです。CT検査 は体の断面を撮影した複数枚の写真をコンピュータで処理して、希望の部位の画像をしめすことができます。MRI検査は体の細胞に含まれる水素原子を、磁力と電波によって影響を与えて画像化したものです。
fMRIと何でしょうか?fMRIは機能的MRIでfはfunctionalのfであり機能的と言う意味です。磁気共鳴機能画像法(functional magnetic resonance imaging, fMRI)と訳されます。放射能を用いないMRIの検査が示してくれるもたらす空間的構造情報に加えて、脳の機能活動がどの脳の領域で起きたかを画像化できるのがfMRIなのです。脳内のいろいろな所で機能活動が起きると、その神経活動に付随して血流や代謝が増加し、しかもその血流や代謝の変化は神経活動の起きた部位と空間的にほぼ合致しているので、脳の多くの領域でおきる機能活動をfMRIによって空間的に脳のどの部位で機能活動が起こっているかも追跡出来るのです。
代謝(metaboilsm)とはどういう意味でしょうか?代謝とは、生体内で生じる外からは見えない意識できない全ての化学変化とエネルギー変換のことです。 さまざまな栄養素が合成・分解されていく過程を指します。 代謝の過程を物質の面からみた場合を物質代謝と呼び、エネルギー変化の面からみた場合をエネルギー代謝と呼びます。物質代謝には異化と同化の2つの過程があります。
fMRIの原理を詳しく説明します。さて、私たちの体の血液の中にはヘモグロビンと呼ばれる物質があり、酸素を運ぶ役割を果たしています。酸素を手放した後のヘモグロビンは「脱酸素ヘモグロビン」と呼ばれ、ごく弱い磁石のような性質(磁性)をもっています。この性質のため、MRIの磁場はわずかに乱されて、信号は弱められて返っていきます。しかし脳の神経細胞が活動すると代謝が高まり酸素が必要になり、その神経細胞に酸素を供給するために、酸素と結びついた「酸素ヘモグロビン」が流入してきます。そのため、磁場を乱していた脱酸素ヘモグロビンが少なくなって、弱められていた、磁場のMRI信号の強さが回復して強くなります。そこで、たとえば手を握ったりひらいたりする運動神経が活動している時のMRI信号と、何も運動神経が活動していないときのMRI信号を比較すれば、手の運動野が脳のどこにあるのかを画像の上に示すことができるのです。このfMRI検査の原理は日本人物理学者の小川誠二博士が確立しました。そのため小川博士は「fMRIの父」と呼ばれています。MRI装置には磁石の強い力(磁場)が働いていて、中に入った人の頭や体にごく弱い電磁波を当てる仕組みになっています。返ってきた信号を計算することによって、全く人を傷つけないで断面の画像を撮影することが可能なのです。
さてドパミンの話に戻りましょう。
ドパミンの作用を抑制する新しい効果のある抗精神病薬は神経伝達物質であるドパミンの受容体を阻害する働きを持っています。特にドパミン受容体の2型(D2)とよばれる受容体を遮断して効果をもたらす抗精神病薬なのです。つまり、ドパミンが受容体に働いて次の神経細胞に情報を伝えるのを、新しい抗精神病薬は遮断して症状を軽減しているのです。 これは、逆に統合失調症ではドパミンの機能が亢進していることを示しています。 これを統合失調症のドパミン仮説といいます。
「ドパミン仮説」が仮説である根拠を詳しく説明します。統合失調症及び精神病性障害にドーパミン神経系の異常が関与すると示唆されるこのドーパミン仮説は、これらの疾患、障害の治療薬である抗精神病薬にD2受容体の遮断作用があることから提唱されたものでありますが、現在でもD2受容体の過剰な作用が統合失調症の原因であるという直接的な証拠は何もないのです。
一方、ドーパミントランスポーターを主な標的とし、ドーパミン濃度を上昇させてしまう精神刺激薬によって新たに統合失調症の症状が生じることもこの仮説を支持する証拠とされているが、精神刺激薬によって生じる精神症状や行動異常は疾患の症状と必ずしも同一ではなく、精神刺激薬の標的もドーパミン神経系に限定したものではないのです。他にドーパミン仮説を支持する証拠として、統合失調症患者においてドーパミンの放出やドーパミン前駆物質ドーパの取込の増加などが示されているが、ドパミン仮説のレベルで止まっているのはそもそも何故ドパミンがどのようにして統合失調症を引き起こすのかも知られておらず、しかも統合失調症を現代のいかなる抗精神病薬を用いても治すことが出来ないからです。
下の絵図は統合失調症の症状にはドパミンが脳幹の中脳の腹側被蓋野で大量に産生されすぎてこの過剰なドパミンの行き先が二つあり行き先によって症状が陽性症状と陰性症状のふたつが出現するという説明図ですがこの図では、ドパミンを脳幹の中脳の腹側被蓋野でなぜ大量に産生するかを明らかにはなっていないのでこれを明らかにしようとしているのがこの論文なのです。
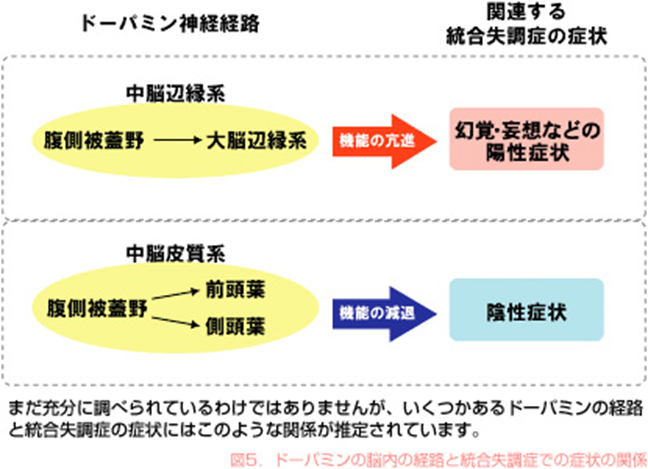
二つの経路の一つは中脳辺縁系の経路です。中脳の腹側被蓋野にある神経細胞で作られたドパミンが大脳辺縁系にある神経細胞に伝えられ大脳辺縁系の神経細胞の機能が亢進しすぎて幻覚や妄想が出るという陽性症状が出ると言われる経路です。二つ目は中脳皮質系の経路です。中脳の同じ腹側被蓋野にある神経細胞で作られたドパミンが大脳皮質の前頭葉と側頭葉の大脳皮質の神経細胞に伝えられてこの前頭葉と側頭葉の神経細胞の機能が減退して陰性症状が出ると言われている経路です。
本来、この二つの中脳-皮質系路と中脳‐辺縁系路が報酬に対する応答を司る快楽報酬系として機能し、特にドパミンを産生して快楽を与える報酬系の中枢と言われる腹側被蓋野から主な投射を受ける側坐核が重要な役割を果たすのです。覚せい剤や麻薬などの依存性薬物は全てこれらのドーパミン神経系に標的を持ち、ドーパミン濃度を上昇させるのです。この二つの神経系は嫌悪刺激に対する反応にも寄与しており、腹側被蓋野に対する入力の違いによって報酬と嫌悪が分かれることが光遺伝学的手法によって明らかにされています。また、黒質-線条体路も報酬としてを生み出すドパミンに関与することが示されています。
光遺伝学的手法とは何でしょうか?光遺伝学(optogeneticsオプトジェネティクス)とは、光によって活性化されるタンパク分子を遺伝学的手法を用いて特定の細胞に発現させ、その機能を光で操作する技術です。光(opto)と遺伝学(genetics)を組み合わせたことから光遺伝学と言われ英語でopto-geneticsと呼ばれる。光遺伝学の開発により、特定の神経の活動を高い時間的経過精度で正確に操作することが初めて可能となった。このことにより神経活動と行動発現とを直接繋げることが可能となったのです。これまでの神経活動の操作手法としては、電気刺激による神経活動の活性化が主に用いられてきた。電気刺激とそれに伴う行動の変化からその電極近傍の神経がになう生理的役割が解析されてきていた。しかし、電気刺激は特異性が低く電極の近傍に存在する軸索や細胞体を非特異的に活性化してしまう。また、脳深部電気刺激(Deep Brain Stimulation略してDBS)では、局所の神経細胞を刺激していることが有効なのか、それとも抑制していることが有効なのかメカニズムが不明であった。一方、作動薬(アゴニスト)や拮抗薬(アンタゴニスト)等の局所投与などの薬理学的手法は、神経の活性化と抑制の両方が可能であるが、時間的精度が低いだけでなく、細胞特異性、シナプス特異性も制御できないという欠点があった。さらに、特定の遺伝子欠損動物の行動解析では、発生過程における影響や他の神経による機能補償などが起こっている可能性を払拭できなかった。
光遺伝学(opto-genetics)はこれらの欠点を全て補っており、マイクロ秒〜ミリ秒オーダーの神経活動の活性化あるいは抑制が可能であり、特定の神経活動のみを制御できる。これによって自由行動下の動物において特定の神経活動のみを制御することを可能にした。光遺伝学は脳神経科学分野の新手法として非常に大きなインパクトを与え、2010年にNature publishing groupによって全分野の中から、最も優れた研究手法としてMethod of the Yearに選定されていることからも、その影響力の大きさが窺える。
光遺伝学は、線虫、ショウジョウバエ、ゼブラフィッシュ、マウス、ラットおよび霊長類において適用例が報告されている。
神経伝達物質トランスポーターは神経終末より遊離された神経伝達物質の再取込みによりその神経伝達を速やかに終結させる役割を担う膜機能タンパクである.このトランスポーター機能の抑制はシナプス間隙での遊離された伝達物質の貯留を招き,初期における興奮の増大とそれに引き続く様々な神経伝達の障害を生ずるのです。
ドーパミントランスポーター(輸送体)は、神経伝達物質であるドーパミンをシナプス間隙からサイトゾル(細胞質)に送り出す膜貫通タンパク質です。サイトゾルでは、他のトランスポーターがドーパミンを小胞に隔離して貯蔵し、後で必要な時に放出します。サイトゾルとは細胞内の部分の呼称で、正確には細胞質から細胞内小器官を除いた部分のことである。
ドパミントランスポーター(dopamine transporter:DAT)とは,中脳黒質のドパミン作動性神経細胞の線条体の終末部にある構造物で,線条体に放出されたドパミンを再取り込みする働きを有する。ドバミン神経細胞には、ドパミンを再び取り込み、ドパミン量を調整する部分(ドパミントランス ポーター)があります。ドパミン神経細胞が壊れると同じくドパミントランスポーターが減少します。ドパミントランスポーターは、脳の線条体内に存在する黒質線条体ドパミン神経の終末部に高発現していますが、 パーキンソン病やレビー小体型認知症では、この発現量が低下することが知られています。
ドパミントランスポーター(dopaminetransporter:DAT)とは,中脳黒質のドパミン作動性神経細胞の線条体の終末部にある構造物で,線条体に放出されたドパミンを再取り込みする働きを有する。ドパミントランスポーターは、脳の線条体内に存在する黒質線条体ドパミン神経の終末部に高発現しています。中脳から大脳に投射するドーパミン神経が中枢のドーパミン神経系の大部分を占め、運動機能、認知機能などの中枢機能の調節に関与する。また、ドーパミン神経系は精神疾患の病態生理に対する関与が示唆されており、抗精神病薬等の治療薬や依存性薬物の標的となります。トランスポーターの役割は遊離された神経伝達物質を再取込みし,神経伝達を速やかに終結させることもある。
パーキンソン病では脳の線条体という所にあるドパミン神経細胞が減少します。ドパミン神経細胞が減少するとドパミンを調整する部分(ドパミントランスポーター)も減少します。
ドパミン産生細胞外に放出されたドーパミンは細胞膜上の膜に存在するドーパミン-トランスポーター(Dopamine transporter, 略してDAT)によって元のドパミン産生細胞内に再び取り込まれる。ノルアドレナリンやセロトニンのトランスポーターと同様にイオンの電気化学的勾配によって駆動される12回膜貫通構造を持つトランスポーターで、ドパミン、Na+、Cl-を1:2:1の比で細胞内に輸送されます。ドパミン神経や腸管、肺、膵臓、腎臓、副腎、リンパ球などに発現しています。何故ドパミン神経以外に腸管、肺、膵臓、腎臓、副腎、リンパ球などに発現しているのでしょうか?それはそれぞれの臓器が頑張ってその臓器の役割りの責任を果たしたら快楽を与えますよと伝えるためにこれらの臓器の遺伝子はドパミンと言う快楽ホルモンをちらつかせているからなのでしょうか?アッハッハ!!!
DAT(ドーパミン-トランスポーター、Dop‐amine transporter)はシナプス直下ではなくシナプス周辺に主に発現しているため、シナプスにおけるドーパミン濃度よりもその周辺の細胞外液における濃度調節に重要なのです。コカインやアンフェタミンなどの精神刺激薬(Psycho-stimulants)はシナプス前直下のDAT( Dop‐amine transporter)を主要なターゲットとしているわけではなく、シナプス周辺に主に発現している DAT(ドーパミン-トランスポーターDop‐amine transporter)をターゲットしているのでドーパミン取込の阻害によったり又は逆輸送によるドーパミン放出を引き起こしてしまうことのなってしまうのです。コカインやアンフェタミンなどは外因性の精神刺激薬(Psycho-stimulants)ですが、一方、ドパミンは自分で作った内因性精神刺激薬と言えますから統合失調症の患者さんはドパミンを多く作りすぎるので自分の作ったドパミンそれ自体が自分のドーパミンの取込の阻害又は逆輸送によるドーパミン放出を引き起こしてしまうのでつねにドパミン過剰の脳になってしまいその蓄積が15歳ころにドパミン過剰症つまり統合失調症になってしまうのです。
ドパミンの放出と取り込みとシナプスにおけるドパミンによる信号伝達については他の神経伝達物質値は違っていることが統合失調症が起こる原因の一つとなっているので更に詳しく説明しましょう。
細胞軸索終末の小胞内に貯蔵されたドーパミンは投射部位であるシナプス前部からの開口放出によって細胞外に放出される。しかしドーパミン神経の投射部位のシナプスのみならず投射部位ではない黒質自身や腹側被蓋野自身の周辺でもドーパミンは放出されるのです。これらの黒質や腹側被蓋野の部位ではシナプスではない細胞体や樹状突起からもドーパミンが放出され、特に黒質ではそれが主であるのです。つまり黒質はドパミンを出しまくっているのです。このようにドパミンの放出がドーパミン神経のシナプスである投射部位のみならずドーパミンを産生する黒質や腹側被蓋野の細胞体や樹状突起の周辺からも行われているのは何故でしょうか?やはりドパミンにより快楽を他の細胞を喜ばすだけではなく自分自身も快楽を貪欲に感じたいからなのでしょう。これをやりすぎると統合失調症になってしまうのでしょう。
軸索終末からのシナプス前部からの放出も又シナプス部位でない細胞体・樹状突起からの放出も共にCa2+依存性でありますが、軸索における放出の方がより高濃度の細胞外Ca2+を必要とする。又、線条体(被殻・尾状核)においてもドーパミン作動性神経からの放出部位と考えられる構造の60-70%は明確なシナプス構造を形成していないのです。また、ドーパミン受容体の大部分はシナプス外の部位に発現している。従ってドーパミンによって担われる信号伝達は、主として放出部位から比較的離れた受容体に作用する拡散性伝達(Volume transmission)によるものです。
ドパミンの受容体の構造と機能と種類と特性に勉強しましょう。「脳のごほうび物質」と呼ばれる神経伝達物質であるドーパミンによって快楽を感じるためにドーパミン受容体と結びつきドーパミン受容体の活性化によって興奮性の変化やシナプス伝達の修飾が起きて快感を感じるのです。ドーパミン受容体にはD1、D2、D3、D4、D5のサブタイプが存在し、ドーパミン受容体は全て7回膜貫通構造を持つGタンパク質共役型受容体である。
ここで7回膜貫通構造を持つドーパミン受容体のGタンパク質共役型受容体とは何か詳しく説明しましょう。受容体とドーパミンがどのようにして細胞内に快楽の情報を伝達しているかについても勉強しましょう。
要約すると情報伝達物質を結合する受容体には①Gタンパク質共役型、②イオンチャネル内蔵型、③チロシンキナーゼ連鎖型、④細胞内型の4つのタイプ(表1)が知られている。
Gタンパク質共役型の代表的受容体にはドパミン受容体やアドレナリン作動性β受容体がある。
Gタンパク質共役型受容体に情報伝達物質が結合すると、Gタンパク質は、効果器タンパクへその情報を伝える転換器の役割を果たす(Gタンパク質を転換器ともいう)。
化学伝達物質(情報伝達物質)を結合する受容体には、実にさまざまなものがある。分子生物学的技術の進歩により、ほとんどの受容体構造は明らかになっている。現在、次の4つのタイプの受容体が知られている。
①Gタンパク質共役型受容体
②イオンチャネル内蔵型受容体
③チロシンキナーゼ連鎖型受容体
細胞膜上、または細胞内にある受容体に情報伝達物質が結合すると、受容体タンパク質の構造が変化し、その変化が細胞内に伝えられ、それぞれ特有の反応を引き起こす。図1で示したようにこの受容体から細胞内反応(応答)にいたる過程を細胞内情報伝達系とよぶのです。
図1細胞外情報の受容から細胞応答(機能変化)に至るまでの流れ概略図
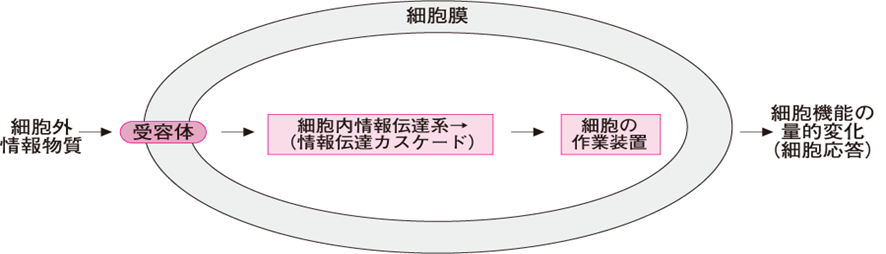
特定の受容体に結合する特定の伝達物質をリガンドという。リガンドが親水性の場合は上記①~③のように細胞膜上の受容体に結合する。リガンドが脂溶性の場合は④のように細胞膜を通過して細胞内の受容体と結合する。代表的な受容体とその細胞内情報伝達系を表1に示す。
表1細胞内情報伝達系と代表的な受容体

Gタンパク質共役型受容体の構造とドパミンの細胞内情報伝達についてですがGタンパク質共役型受容体の構造は、共通して一本鎖ペプチド(アミノ酸が結合したもの)が細胞膜を7回貫通している。Gタンパク質(GTP結合タンパク質:G protein、GTPはグアノシン三リン酸)が共役している受容体に情報伝達物質が結合すると、Gタンパク質は酵素蛋白であり、効果器へその情報を伝える転換器(トランスジューサ)として働くのです。
Gタンパク質は、α、β、γの3つのサブユニットから構成されこの構造をヘテロ三量体Gタンパク質という。この3つのサブユニットのうちβとγは解離することはないが、αは解離する。それぞれをGαとGβγと呼びます。GαにはGDPやGTPを結合する部位がある。GαにはGDPが結合している。このとき、受容体は情報伝達物質を結合する準備状態にある。
すなわち、下の図2に示したようにAでは情報伝達物質は受容体に結合できる状態にありこの状態を情報伝達物質は受容体と親和性が高い状態にあるといいます。
図2 GTP結合タンパク質(Gタンパク質)を介する受容体から効果器への情報伝達図
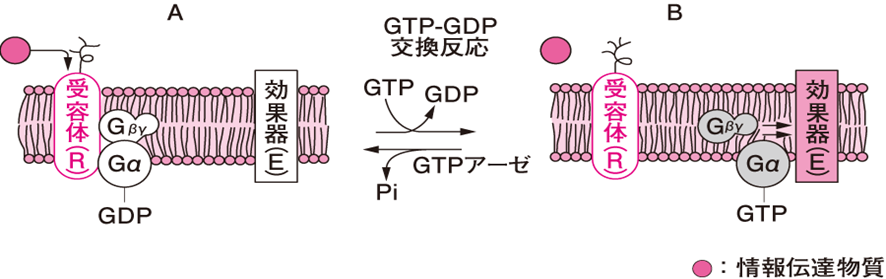
情報伝達物質が受容体に結合すると受容体の構造が変化し、BではGタンパク質が受容体から離れるとともにGDPが遊離し、代わって細胞内に高濃度で存在するGTPがGαに結合する。これをGTP-GDP交換反応という。効果器(effector)とは人間を含めて動物体が、外界に対して能動的な反応を行うために分化した器官や細胞および細胞小器官をいう。実行器または作動体ともよぶ。その放出するエネルギーの種類によって、筋肉、繊毛、鞭毛(べんもう)のような機械効果器、発電器官の電気効果器、発光器官の光効果器、分泌腺の化学効果器に分けられる。
するとGTPと結合したGαは(Gα-GTP)、Gβγと離れ、両者は別々に効果器に情報を伝える(図2)。GαはGTP分解活性(GTPase)をもっているので、GTP結合GαはGTPaseによって、再びGDP結合Gαになる。するとGαはGβγと再び会合して(Gαβγとなる)情報伝達物質結合準備状態に戻る。このようにして効果器が情報を受け取るのです。/p>
Gタンパク質の種類はいくつあるのか?Gβγの種類は実質的には1種とみなすことができるが、Gαにはたくさんの種類がみつかっている。そのため、Gタンパク質の種類はGαの相違による。そのうち代表的なGタンパク質を表2 に示す。
表2主なGタンパク質(酵素)と共役する効果器
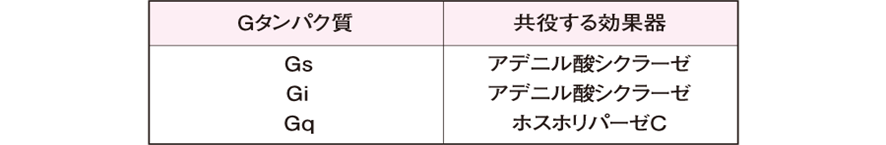
Gs : 効果器であるアデニル酸シクラーゼの活性を促進するもの(s は stimulatory の s)
Gi : 効果器であるアデニル酸シクラーゼの活性を抑制するもの(i は inhibitory の i)
Gq : 効果器であるホスホリパーゼCを活性化するもの
アデニル酸シクラーゼ活性を促進するものをGs(sはstimulatoryのs)、逆に抑制するものをGi(iはinhibitoryのi)、ホスホリパーゼCを活性化するものをGqと名付けた。
Gタンパク質共役受容体(G protein-coupled receptor、GPCR)は、Gタンパク質連結型型受容体(G protein-linnked receptor、GPLR)とも呼ばれ、様々な機能を持ったGタンパク質連結受容体が見られ、既知のタンパク質の中では最大のスーパーファミリーを形成している。Gタンパク質結合受容体(GPLR)は、細胞膜を7回貫通する特徴的な構造からヘビ状受容体とか7回膜貫通型受容体と呼ばれることもある。
Gタンパク質はGTPアーゼに属する酵素であり、Gタンパク質の正式名称はグアニンヌクレオチド結合タンパク質です。グアノシントリホスファターゼともいい、グアノシン三リン酸(GTP)を加水分解してグアノシン二リン酸(GDP)にする反応を触媒する酵素で Gタンパク質などの一部を構成しているにすぎないのです。グアニンヌクレオチド結合タンパク質の略称で、実はグアノシントリホスファターゼという酵素ですから分かり易く「グアニンヌクレオチドに結合する酵素」と訳すべきです。混乱を招きます。
グアノシン-トリ-ホスファターゼはGタンパク質でありこの酵素の役割はグアノシン三リン酸(GTP)を加水分解してグアノシン二リン酸(GDP)にする反応を触媒する酵素です。Gタンパク質は、グアニンヌクレオチド結合タンパク質の略称であり、Gタンパクはグアノシン‐トリ‐ホスフェイト(グアノシン三リン酸で英語で略してGTP)と結合していてGTPをGDPに変えたりGDPをGTPに変えるグアノシントリホスファターゼという酵素であるのでGタンパク質の機能はGTPまたはGDPと結合して受容体の活性のON/OFFを行うことにより活性化したり不活性化したりして、細胞内情報伝達に関与しているのです。
Gタンパク質連結型受容体(G protein-linnked receptor、GPLR)では三量体Gタンパク質が使われる。三量体Gタンパク質とは何でしょうか?上の図で説明したようにGタンパク質連結型受容体(G protein-linnked receptor、GPLR)からの指令がなければα、β、γの3サブユニットは一つの集合体の三量体で存在しています。なおGタンパク質連結型受容体(G protein-linked receptor、GPLR)は、Gタンパク質共役型受容体(G protein-coupled receptor、GPCR)とも言われます。α、β、γの3サブユニットはGα、Gβ、Gγとも書きます。外からシグナルが入ると、受容体はGタンパク質に働いて三量体を開裂させて三量体から切り離されたαサブユニットと呼ばれる活性化G蛋白がエフェクターにシグナをさらに伝えるのです。最後は細胞に変化が生じるのです。
シグナル伝達については極めて複雑であるのでまたの機会に詳しく説明しますが、Gタンパク質共役型受容体が三量体Gタンパク質を介して効果器にシグナルを伝えるまでのプロセスを最後にまとめておきましょう。つまり七つのαサブユニットはGTPase活性(GTPの加水分解酵素活性)をもちGTPをGDPに変換し、不活性なGDP結合型に復帰しシグナルを終結させるのですがその後のさらに難解なシグナル伝達については次の機会までお待ちください。
まず細胞膜受容体には4種類あります。
①Gタンパク質共役型受容体(アドレナリン受容体、アデノシン受容体、ロドプシンなど、神経伝達物質や光、多くのペプチドホルモンの受容体がこれに属する。)
②イオンチャネル内蔵型受容体(イオンチャネル型受容体はリガンド結合により細胞膜にイオンを通過させるチャネルを開閉することでシグナルを伝えるのです。骨格筋の細胞膜にあるニコチン型アセチルコリン受容体等がこのタイプ。)
③チロシンキナーゼ連鎖型受容体(酵素関連受容体とも呼ばれチロシンキナーゼなどの酵素の活性化を介してシグナルを伝えます。)
④細胞内型受容体(ステロイドホルモンやチロキシンなどの甲状腺ホルモンの受容体は細胞質または核などの細胞内にあり、シグナル分子が結合した複合体は、転写やmRNAの安定性を調節する。シグナル分子は細胞増殖因子ともいい、細胞の増殖や分化を制御する働きを持つ分子群のことで なかでも「FGF」は血管を作ったり傷を治したりする働きを持ち、発毛サイクルにも関係している成長因子のひとつです。FGFは「Fibroblast Growth Factor(線維芽細胞増殖因子)」の略で、血管新生、創傷治癒、胚発生に関係する成長因子の一種です。
四つの細胞膜受容体の代表が一つ目の①Gタンパク質共役型受容体です。このGタンパク質共役型受容体は既に説明した三量体Gタンパク質を介して効果器にシグナルを伝えます。三量体Gタンパク質はαサブユニットの機能および遺伝子の相違から、Gs、Gi、Go、Gq、Gt、Golfなどのサブファミリーに分類されている。効果器とは、外界の刺激に対応した反応を引き起こす器官です。刺激に対する反応は運動ですが、筋肉、繊毛、鞭毛などはその運動のための効果器です。
①Gタンパク質共役型受容体は別名7回膜貫通型受容体と言われるように、7つのαへリックス構造が細胞質膜を貫通し、N末端は細胞外にC末端領域は細胞内に位置する。細胞外からの様々なシグナル(神経伝達物質、ホルモン、化学物質、光等)を受容すると、Gタンパク質共役型受容体は構造変化を起こし、細胞質側に結合している三量体Gタンパク質に対してグアニンヌクレオチド交換因子(GEF)として働く。GDP型からGTP型へと変換されたGタンパク質は、つづいて効果器の活性を変化させることで、細胞外シグナルが細胞内へと伝達される。現在使用されている薬剤のおよそ40%がGタンパク質共役型受容体を標的としており3番目の細胞内ループとC末端部分で三量体Gタンパク質と結合するのです。
三量体Gタンパク質はα、β、γサブユニットよりなるヘテロ三量体の調節タンパク質です。αサブユニットはアシル化(ミリストイル化またはパルミトイル化)、βサブユニットはイソプレニル化されたγサブユニットと結合して、細胞膜の裏面に局在している。
αサブユニットはグアニンヌクレオチド結合部位をもち、不活性型ではGDPが結合している。シグナル刺激によるGDPとGTPを交換する反応でαサブユニットがGTP型となりβγサブユニットと解離し、アデニル酸シクラーゼなど効果器)にシグナルを伝える。αサブユニットはGTPase活性(GTPの加水分解酵素活性)をもちGTPをGDPに変換し、不活性なGDP結合型に復帰しシグナルを終結させる。
Gタンパク質連結受容体に属する様々な種類の受容体が何百種類も存在し、細胞外のドパミンのような神経伝達物質やその他のホルモンを受容してそのシグナルを細胞内に伝えるのですが、この受容体の働きが異常になると多くの疾患が生じます。細胞外のドパミンのような神経伝達物質やその他のホルモンを受容してそのシグナルを細胞内に伝えます。細胞膜の膜タンパク質である受容体には極めて多くの種類があるのは数多くの特殊なリガンドとぴったりと結合する何百種類の特殊な受容体が多く必要だからなのです。
GPLR( GPCR)は最大のタンパク質スーパファミリの一つを形成し、細胞外リガンドを細胞内シグナル伝達の活性化へと変換する膜貫通タンパク質群である。スーパーファミリー(superfamily)とは分子進化の類縁関係があることを示す用語です。これまでに市販されている医薬品の作用標的(創薬標的)の30%をGPCRsが占めています。GPLRは体内の組織や細胞に存在する内在性膜タンパク質のスーパーファミリーです。GPLR(GPCR)はあらゆる生体内反応に影響を及ぼすシグナル伝達経路に関係し、様々な疾患や障害に関与するため、医薬品開発において重要な標的となります。
GPLRという受容体は、情報の運び屋であるリガンドを受容(結合)するとその受容体のコンフォメーション(形)を変え、細胞内にあるヘテロ三量体Gタンパク質複合体と結合し活性化し 、下流へのシグナル伝達を行い、種々のリガンドに対する然るべき細胞応答を発現させます。Gタンパク質ヘテロ三量体はGα、GβならびにGγサブユニットで構成され、活性化G蛋白となったGαがGPCRとの相互作用および細胞内のシグナル伝達を制御するのです。
ヒトゲノムには、Gα遺伝子16種類がコードされている。哺乳類のGPCRs(Gタンパク質結合受容体)の、それぞれが一種類以上のGタンパク質と結合する独特のGタンパク質結合の仕方を備えており、それぞれに特有な細胞応答を担っている。
Gタンパク質はGTPアーゼの一つであるグアニンヌクレオチド結合タンパク質の略称です。100k Da前後の高分子量の膜受容体関連ヘテロ三量体Gタンパク質と、RAS の様な20-30k Da低分子量Gタンパク質があり、両者とも情報伝達(シグナル)カスケードに関連している。
低分子量GTPaseの一種であるRASは、不活性型GDP結合型から活性型のGTP結合型へと変換されることにより下流のシグナル伝達経路を活性化される分子スイッチで、細胞増殖などを制御します。
三量体Gタンパク質はαサブユニット(39k – 52k Da)、βサブユニット(約35kDa)およびγサブユニット(約 10kDa)からなるヘテロ三量体で、7回膜貫通型受容体(Gタンパク質共役型受容体、GPCR)に共役(結合)している。 αサブユニットはGDPまたはGTPを特異的に結合することが出来る。三量体(トリマー trimer)とは、3つのタンパク質や、または核酸のような高分子同士が非共有結合し形成した複合体を指す。ホモ三量体は3つの同一の分子によって形成したものを指す。一方、ヘテロ三量体は3つの異なる高分子によって形成したものを指す。例えば、コラーゲンは3つの同一の分子によって形成されたホモ三量体タンパク質である。
GTPアーゼはグアノシン三リン酸(GTP)を結合し加水分解する一群の酵素あるいはタンパク質で、非常に多数の種類がある。グアノシン三リン酸は生物体内に存在するヌクレオチドである。ヌクレオチド とは、ヌクレオシドにリン酸基が結合した物質である。ヌクレオシドは五炭糖の1位にプリン塩基またはピリミジン塩基がグリコシド結合したもの。グリコシド結合とは、炭水化物分子と別の有機化合物とが脱水縮合して形成する共有結合である。ヌクレオシドはDNAやRNAを構成する単位でもある。このヌクレオシドにリン酸基が結合した物質であるヌクレオチドが鎖のように連なりポリヌクレオチドになる。正式名はグアノシン-5′-三リン酸、普通は略称 GTP で呼ばれる。グアノシン二リン酸 からアデノシン三リン酸 のリン酸を受容して生合成されるのがGTP です。ヌクレオチドの一つで生理的に重要な化合物です。RNAやcGMPの材料になるほか,Gタンパク質とよばれる信号伝達系の分子と結合して,細胞内信号伝達に重要な役割を果たします。
三量体Gタンパク質はαサブユニット、βサブユニットおよびγサブユニットからなるヘテロ三量体である。7回膜貫通型受容体(Gタンパク質結合型受容体、GPLR)に結合している。αサブユニットはGDPまたはGTPに特異的に結合することが出来る。通常βサブユニットとγサブユニットは強く結合している。受容体が活性化していない状態では、αβγサブユニットが結合している。リガンドのアゴニストが受容体に結合するとαサブユニットに結合しているGDPとGTPの交換反応がおこり、GTP結合型αサブユニットとβγサブユニットに解離する。アゴニストとは、受容体に結合することでその情報を細胞の内部に伝達する物質のことを言います。 薬では作動薬とも言います。これらの解離したαサブユニットとβγサブユニットは、それらの標的タンパク質と酵素を活性化し、シグナルを下流へと伝達する。その後、αサブユニットに結合したGTPは、αサブユニットのGTPase活性により分解されてGDPとなり、再びβγサブユニットと結合し、不活性型の三量体を形成する。三量体Gタンパク質は、α、β、γの3つのヘテロコンプレックスですが、分子量、約40kDaのαサブユニットだけがGTPase活性を有している酵素なのです。従って三量体Gタンパク質はその中心のαサブユニットの機能および遺伝子の相違から、Gs、Gi、Go、Gq、Gt、Golfなどのサブファミリーに分類されている。GsとGiは、それぞれアデニル酸シクラーゼを促進あるいは抑制する、Goは神経組織に多く発現している。GqはホスホリパーゼCβを活性化します。GtとGolfはそれぞれ視細胞(網膜)と臭細胞のシグナル伝達系に重要な役割を果たしている。
ホスホリパーゼCβとはなんでしょうか?ホスホリパーゼC(phospholipase C, PLC)は、リン酸エステル基の直前でリン脂質を切断する酵素群の総称である。シグナル伝達経路において重要な役割を果たしている。13種類のほ乳類ホスホリパーゼCは構造に従って、6種類のアイソタイプ(β, γ, δ, ε, ζ, η)に分類される。脳においてシナプス後部からシナプス前終末に向けて、通常とは逆向きの情報伝達が行われることが知られている。このような逆行性シナプス伝達を担うのが内因性カンナビノイド(脳内マリファナ類似物質)なのです。内因性カンナビノイドはマリファナに似た作用と構造を持つ物質の総称。Gq共役型受容体を介する内因性カンナビノイドの発生にホスホリパーゼCβ(PLCβ)が必須なのです。神経細胞間のシナプス伝達の強さを抑制する働きを持っています。内因性カンナビノイドの発生 は、(1)細胞内のカルシウム濃度上昇、(2)Gq型の三量体GTP結合蛋白質に共役する受容体の活性化、という2つのシグナルがシナプス後神経細胞で同時に起こると強く誘導される。Gq共役型受容体を介する内因性カンナビノイドの発生にホスホリパーゼCβ(PLCβ)が必須なのです。
脳内マリファナ類似物質の役割りは何でしょうか?乳幼児発達期の脳の過剰興奮を抑制して熱性けいれんを起こさないようにするためです。熱性けいれんとは、生後6か月から5歳くらいまでの子どもにみられるけいれんの1つで、発熱に伴って起こります。
熱性けいれんは発熱をきっかけとして起こります。2〜3分ほどで自然にけいれんは治まりますが、約30分以上持続する熱性けいれんは、熱性けいれん重積状態とみなされます。 けいれん重積状態の小児では、速やかに治療しなければ、脳や他の臓器に損傷が起きたり、呼吸不全に陥ったりするリスクがあるのです。発作の重積状態はけいれんする発作だけでなく、けいれんしない発作でも通常より長く続くか、何度も繰り返す状態です。全般発作でも焦点発作(部分発作)でも起こりえます。
けいれんと癲癇の違いは何でしょうか?痙攣は発生源を問わず手足、体の筋肉に起こる不随意な収縮を指すのに対し、てんかんはherpesが原因で脳に炎症が起こり、不随意な筋肉の収縮のほか、意識消失や音、光、臭いを感じる発作など種々の症状を含みます。
それではけいれんの手足、体の筋肉に起こる不随意な収縮は何故起こるのでしょうか?
脳以外の末梢の筋肉を支配する神経にまずヘルペスが感染しています。その後、他の病原体に感染して熱が出たときなどの免疫があがったときにすでに神経や筋肉に感染しているヘルペスとの戦いが始まりherpesとの戦いによる炎症が起こり筋肉が突然に収縮してけいれんが起こるのです。このherpesとの戦いが脳の中で起こると癲癇となるのです。けいれんと癲癇が同時に起こるのは末梢に神経・筋肉と脳の神経で同時にヘルペスと免疫が戦い炎症が末梢と中枢の脳で同時に起こっているのです。癲癇についてはここを読んでください。
さてどのようなヘルペスが原因であるてんかん発作も通常は長くても数分以内に止まります。しかし、意識の曇りを伴う1回の発作がそれ以上長引いたり(10~15分以上)、1回の発作が終わったあと、意識が戻らないうちに次の発作を起こした場合には、緊急用の薬剤を使用するか、あるいは病院で治療を受ける必要があります。全身のけいれん発作(強直間代発作)が5分以上つづく場合にはすぐ受診を考えましょう。周囲の呼びかけに対して反応はなく、発作を繰り返す場合や5〜10分以上けいれんが続く場合は、緊急受診が必要です。Herpesによる癲癇で死ぬことはないのですが他の原因もあるからです。
人は目、耳、鼻などがとらえた感覚情報、学んで吸収した知識情報など、膨大な情報が脳内の神経回路で正しく処理されています。この神経回路は、神経細胞が軸索と呼ぶ突起を伸ばし、誘導因子や反撥因子の影響を受けながら相手を見つけ相手の神経細胞の樹状突起とシナプス結合を作ります。その後、必要な結合は強化し、不要な結合は刈り込んで、神経回路が成熟していきます。
この神経回路網には、神経細胞を興奮させる興奮性シナプスと、逆に興奮を抑える抑制性シナプスがあり、興奮性シナプスはグルタミン酸、抑制性シナプスはガンマアミノ酪酸(GABA)が主要な神経伝達物質として働き、必要に応じて情報が正しく処理されます。
ところがこの GABA が、出生直後の乳児期の脳では興奮を起こすため、乳児期の脳で何が興奮ので抑えておりかつ何のためにかつどのようにを説明しましょう。脳内マリファナ類似物質である「内因性カンナビノイド」が、発達期の脳で興奮性神経伝達を抑制する働きがあるので、乳児期の発達期の脳では、抑制性シナプスの生育が遅れており、成熟脳で抑制に働く GABA も逆に神経細胞の興奮を引き起こすため、抑制能力がなく熱性けいれんなどの過剰興奮を起こしやすいからです。発達が未熟な脳では、抑制機能が強化されるまでの間、内因性カンナビノイドは、神経細胞(ニューロン)の間のシナプス伝達の強さを調節しているのです。シナプスでは、信号を送る側(シナプス前ニューロン)の神経突起の終末から神経伝達物質が放出され、信号を受けとる側(シナプス後ニューロン)の細胞膜にある神経伝達物質受容体を活性化させることによって情報が伝達されます。一方、内因性カンナビノイドは、シナプス後ニューロンで作られ、神経終末に存在するカンナビノイド受容体に働いて、神経終末からの神経伝達物質の放出を抑えることで、シナプス後ニューロンへの信号の伝達を抑えているのです。この現象は、情報の流れが通常のシナプス伝達とは逆向きなので、シナプス伝達の逆行性抑圧といいます。
GTPアーゼは類義語に①GTP加水分解酵素,② GTP分解酵素, ③グアノシントリホスファターゼ(guanosine triphosphatase)④Gタンパク質⑤グアニンヌクレオチド結合タンパク質の五つがあります。GTPアーゼはグアノシン三リン酸(GTP)を結合し加水分解する一群の酵素あるいはタンパク質で、非常に多数の種類がある。GTPアーゼは正式にはグアノシン三リン酸フォスファターゼまたはグアノシントリフォスファターゼといい、加水分解酵素として分類されるが、一般の酵素のように基質であるGTPが結合後すぐに分解されるわけではなく、GTPおよびその加水分解産物であるグアノシン二リン酸(GDP)が結合した状態が比較的安定に存在し、それぞれが機能を有していろいろな細胞の調節を行う。そのため酵素という名前でなく、GTP結合タンパク質と呼ぶことも多いのです。その働きはグアノシン三リン酸(GTP)を加水分解してグアノシン二リン酸(GDP)にする反応を触媒する酵素で Gタンパク質の一部を構成しています。ややこしいでしょう。さらにこのGTPアーゼという酵素を活性化するGTPアーゼ活性化タンパク質もあります。ここでGTPアーゼ活性化タンパク質についても初めてですが勉強しておきましょう。
GTPアーゼ活性化タンパク質(GTPase-activating proteinまたはGTPase-accelerating protein、略して GAP)は、Gタンパク質 (GTPアーゼ) の機能調節を行うタンパク質のファミリーである。GTPアーゼ活性化因子と呼ばれることもある。GAPはGタンパク質に結合してその活性を促進し、シグナリングを終結させます。とにかくGタンパク質はさまざまな重要な細胞内プロセスに関与しているため、その調節も重要である。例えば、ヘテロ三量体型Gタンパク質は、ホルモンによる情報伝達など、Gタンパク質共役受容体からのシグナルの伝達に関与しており、低分子量GTPアーゼは細胞内輸送や細胞周期などのプロセスに関与している。GAPの機能は、Gタンパク質の活性をオフ状態にすることでシグナリングを終結させるのです。この意味においてGAPの機能は、Gタンパク質によるシグナリングの活性化を開始させるグアニンヌクレオチド交換因子 (GEF) の反対です。
Gタンパク質(GTPアーゼ)は、GPLR (GPCR)のリガンドによって受容体を介して上に説明したように活性化されます。GPLRのリガンドには生理活性アミン類、神経性アミノ酸、生理活性ペプチド類、エイコサノイド類、脂質メディエーター類、ケモカイン類などきわめて多くの種類の人体に必須の重要な化学物質があります。一方、ある種の細菌毒素はGタンパク質に直接悪影響を及ぼします。コレラ毒素はGsαのADPリボシル化(ADPリボース化)をおこし、Gsは受容体刺激無しに活性化状態を維持し、アデニル酸シクラーゼを活性化しつづける。一方、GiとGoは百日咳毒素によりADPリボシル化をうけ、受容体に結合する性質を失う。
アデニル酸シクラーゼ( adenylate cyclase; アデニレートサイクレース)はATPを3′,5′-環状AMP (cAMP) とピロリン酸へ変換する反応を触媒する酵素で、リアーゼである。リアーゼとは脱離酵素であり, 化合物中のある基を脱離し二重結合を生ずる反応を触媒したり、 逆に二重結合にある基を付加する 反応を触媒する酵素です。cAMPはセカンドメッセンジャーと呼ばれる、真核生物のシグナル伝達に重要な分子である。膜受容体に結合してホルモンや他の刺激に反応するGタンパク質を活性化または抑制することができる。9種類のアデニル酸シクラーゼが哺乳類で知られている。
ADPリボース化(ADP-ribosylation)とはタンパク質の翻訳後修飾の一つで、1つまたはそれ以上のアデノシン二リン酸(ADP)リボースを付加する反応である。リボースは五炭糖で核酸のRNAの材料として重要な単糖類の中の五炭糖のひとつで、DNA(デオキシリボ核酸)やRNA(核酸)を構成するヌクレオチドの成分です。この反応は細胞間の情報伝達やDNA修復、アポトーシスなど多くの細胞機能に関わっています。
Gs/olfに結合してアデニル酸シクラーゼを活性化するD1様受容体(D1、D5)とGi/oに結合してアデニル酸シクラーゼを抑制するD2様受容体(D2、D3、D4)に大きく分類される。線条体、前頭前野、海馬、側坐核などにおいて、神経細胞の興奮性やシナプス伝達に対して多様な修飾作用を持つ。GsとGiは、それぞれアデニル酸シクラーゼを促進あるいは抑制する。Gsのsはstimulationの略で「促進する」という意味でGiのiはinhibitionの略で「抑制する」という意味です。Gs/olfのolfの意味はGolfで、その名称は嗅覚系(olfactory system)で主に発現していることに由来する Gi/oのoの意味はGoは神経組織に多く発現しています。
下図にドパミンの二つの脳内の経路と統合失調症との症状の関係を示し詳しく説明していきましょう。
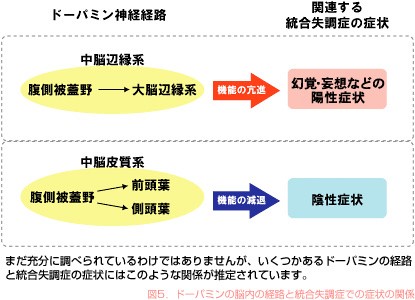
勿論、この二つの経路以外にドパミンにはいくつかの脳内に行く経路があります。この多くの経路のうち、統合失調症の陽性症状と陰性症状の二種類のそれぞれの病態に関連しているのは、陽性症状は中脳辺縁系と陰性症状は中脳皮質系とよばれる経路です。一つ目の陽性症状を起こす中脳辺縁系は腹側被蓋野とよばれる脳幹にある中脳の部位から大脳辺縁系に向かっています。この経路は統合失調症の幻覚や妄想に関連しています。
一方、二つ目の陰性症状を起こす中脳皮質系は、同じ腹側被蓋野から大脳皮質の前頭葉や側頭葉に向かっています。 統合失調症の陰性症状である感情の平板化、意欲の低下、会話内容の欠乏、さらに自発性の低下や社会からの引きこもりなどを起こすのはこの経路です。感情の平板化、意欲の低下とは具体的にはどんな症状でしょうか?感情の平板化とは、外部からの刺激に対して、自然に起こるはずの喜怒哀楽の感情が起こりにくくなることです。 意欲の低下とは、服装や化粧、持ち物など身だしなみへの関心が低くなることです。
因みに脳幹の中脳にある黒質から線条体に繋がる経路は統合失調症の病態と直接の関係はなく癲癇を起こす経路です。癲癇についてはここを読んでください。ただし、この黒質線条体経路はパーキンソン病の病変部位で、黒質に感染したヘルペスが黒質にドパミンを産生させなくなるとパーキンソン病になります。パーキンソン病についてはここを読んでください。とにかく従来からの抗精神病薬はドパミン経路のすべてを抑制するためにドパミンの作用が減少して、黒質線条体の働きが遮断されるのでパーキンソン病様の症状である筋肉のこわばり(固縮)やふるえ(振戦)などの錐体外路症状と言われる副作用として現れます。固縮とは、安静時に四肢、躯幹の関節に他動的屈伸運動を加えたときの筋緊張の亢進をいい、パーキンソン病では、ガクガクと断続的な抵抗を示す歯車様固縮(cogwheel rigidity)や持続的な抵抗を示す鉛管様固縮(lead-pipe rigidity)がみられます。振戦とは、手、頭、声帯、体幹、脚などの体の一部に起こる、不随意でリズミカルな振るえです。 振戦は、筋肉の収縮と弛緩が繰り返されたときに起こります。
覚せい剤やコカインを長期に服用すると、統合失調症の陽性症状といわれる幻覚や妄想が現れますが、それは覚せい剤やコカインも脳内のドパミンを増やし、ドパミンの機能を過剰にする作用を持っているからです。これは統合失調症がドパミン過剰によって人為的に起こせることを証明しています。
統合失調症での認知機能の障害について説明します。
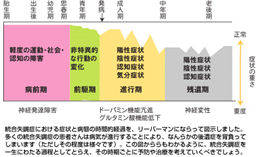
統合失調症の治療目標の一つとして、再発を防ぐということがあります。再発を起こす病気の原因はherpesが関わっています。統合失調症の多くの患者さんは治療に反応して症状は改善しますが、再発も多いのです。再発の数が多いほど、脳に感染したヘルペスが多いのです。また治療までの期間が長いほど、つまり病的な状態にある期間が長いほど、自発性の低下や社会からの引きこもりなどの陰性症状が重くなっていきます。何年も経時的にCTやMRIでこのような患者さん脳の形の変化を見ていくと、症状の重い患者さんほど、大脳が小さくなっていくのです。しかしすべての認知症の原因がヘルペスだけのによる脳委縮と違って、統合失調症目では見て明らかに萎縮していくというのではありません。何故ならば認知症の原因はドパミンは殆ど関わっていないからです。一方統合失調症も進行すればするほどストレスがますますかかり続けるので免疫が落ち続けてherpesが増殖して大脳皮質の神経細胞に徐々に徐々に感染していくので、認知症と同じようなヘルペスによる病的な神経変性過程が統合失調症でも速さの違いはあってもゆっくりと進行していくのです。左上の図に統合失調症における症状と病態の時間的変化と経過の変化の表を掲示します。
また最新の画像研究によって、進行した統合失調症患者さんの脳では上の表でもわかるように、脳の神経変性細胞が増加して神経細胞体が占める灰白質および軸索が占める白質の両方が減少しその結果、脳組織全体の減少も生じたのです。正常な誰もが青年期に、ニューロンの灰白質の正常な減少を経験しますが、統合失調症リスクの高い人では、この減少のプロセスが過度に速くまたは活動的になっており、ヘルペスと脳の免疫細胞であるミクログリアとの戦いで脳が神経変性しさらに神経細胞の脱落が増加して脳組織細胞が減少してしまい白質の発達障害も統合失調症は更に悪化して一生治らない病気となってしまうのです。また、大脳の4つの脳葉につながるミエリンで包まれた長い有髄神経線維が存在する白質の発達異常も、統合失調症の素因がある人では重要な要素となる可能性があります。脳葉(Cerebral lobe)は大脳の解剖学的に区分けされた領域で、目立つ脳溝を境界として、前頭葉、側頭葉、頭頂葉、後頭葉、島葉、辺縁葉(Limbic lobe)の六つの葉があります。この大脳の白質の発達障害も、学習・記憶障害や、無感情および意欲の低下など、病期が進んだ統合失調症患者さんに見られる認知症状に関与しているのです。統合失調症患者さんの灰白質も白質も、共に減少していくのです。
このような脳組織減少の原因は既に述べたように長い長い人生のストレスによって増えたherpesが原因です。多くの脳の神経変性疾患の原因でもありかつ病気の進行悪化要因でもあるherpesとミクログリアと闘いで生ずる炎症が原因なのです。最近の研究で、統合失調症患者さんおよび疾患リスクのある人々の脳において、免疫細胞の活性が高まっていることが発見されました。炎症過程を促進する要因は正にherpesウイルスであり、幼児期に感染したヘルペス感染と統合失調症の発症に関連性があるのです。
多くの統合失調症の患者さんは病気が進行することにより程度はさまざまですがherpesによる後遺症を背負うことになります。何故ならば一度感染したヘルペスは殺しきれないので上の表からもわかるように現代の統合失調症の治療は根本治療ではなく完治させることは不可能である上に副作用も多いので一生にわたるherpes増殖とその後のミクログリアとの戦いが免疫が上昇すると炎症が起こり脳細胞も炎症に巻き込まれ精神を支配する脳細胞の機能低下が様々な精神異常の悪化をもたらし、異常な変化が一生続く統合失調症の進行過程として病気をとらえざるを得ないのです。しかし今まで述べてきたように脳の炎症はherpesによるものですから大量の抗ヘルペス剤を投与すれば進行を阻止できる病気なのです。統合失調症は快楽を欲しがる優しくて傷つきやすい心(気質)とヘルペスが原因ですから病気の進行を抑えることが出来る病気なのです。
人間の成長段階に合わせて思春期の統合失調症発病期を挟んで胎生期、出生後、幼児期、思春期、青年期、統合失調症発病期、成人期、中年期、老後期の八つの脳の発達成長期に分け、更に病気の段階を病前期の神経発達障害期と、進行期のドパミン機能亢進・グルタミン酸機能低下期と、残遺期の神経変性期の三つに分けて表示しておきます。この八つの発達成長期のどの時点で脳にherpesが感染したかで発症の時期が決まるのです。以上の統合失調症の説明を統合失調症の神経変性仮説といいますが正しくは仮説ではなく統合失調症の神経変性は快楽を求める強い欲求とストレスを処理するずる賢さに欠けているので思い通りにならないたびごとに免疫が落ちてherpesが増えて最期はドパミンが過剰に産生されてherpesによる脳組織の崩壊が徐々に徐々に統合失調症の病気を進行させるのは患者さん自身なのです。
以上をまとめると神経変性を起こしやすい統合失調症になり易い人は二つの大きな因子を多く持っている人です。一つ目は生まれつきの快楽を常に欲しがる気質、しかも欲望のレベルが高すぎるので達成されることが少なく成功報酬としてドパミンが十分に出して満足することが出来ないので更に別の快楽を望み過ぎてつねにドパミンを出し続けながらも快楽の欲求が十分に満たされない人がドパミンを本能的に出してしまいドパミン過剰症と言われる統合失調症になり易い人なのです。二つ目は達成不可能な欲求の後に続く失望と落胆が再びストレスとなり副腎皮質でステロイドホルモンが出過ぎて免疫が落ちてherpesが増え、一方ストレスのためにドパミンが副腎髄質で生理的に増えそのたび毎にherpesとドパミンが増えるという悪循環が継続して起こりやすい人です。この様な二つの因子を兼ね備えている人はこの世に生まれて15年~30歳ころまでherpesとドパミンが繰り返し続けると知らぬ間に増えたドパミン過剰症となり同時にherpes増多症となってヘルペス性の脳の神経変性疾患も生じてしまうのです。この二つの因子が統合失調症という病気を作り出してしまうのです。
大脳に存在する約30種類以上の感染しやすい被膜のない神経核内の大量の神経細胞、特に大脳基底核に集中して存在している神経核を構成する神経細胞体にヘルペスが感染していくうちにherpes性神経細胞変性症を起こし神経細胞が変性脱落を起こし大脳の機能が正常に働かなくなるのみならず最後は神経細胞死を招き1000億以上もある神経細胞が徐々に長い長い時間をかけて減少していくから結果、大脳が委縮してしまうのが統合失調症です。このような神経の変性過程を停止させ、かつ大脳の萎縮を防ぐためには、抗ヘルペス剤投与すれば、その後も再発を防ぐことができ、神経変性もそれ以上進行させなくできるのです。
現代の難病の一つ一つの病気の原因はヘルペスでありさらに自己免疫疾患の原因もherpesであることかつ原因不明な病気もすべてヘルペスでありあらゆる癌の原因も癌ウイルスであるherpesウイルスであることを理論的に実証的に証明することが私の唯一の生きがいであります。16歳からヘルペス性海馬炎・ヘルペス性扁桃体炎などの脳炎で苦しんできた私の生きる意味はそれしかありません。最後にすべての難病は治せることをも証明したいのです。
それではなぜ大脳基底核にヘルペスが感染すると精神(脳)が異常になるのでしょうか?
大脳基底核は、大脳半球の基底部にある神経細胞の集合体で、線条体(被殻と尾状核)・淡蒼球・黒質・視床下核の四つからなり立っています。大脳基底核の役割は、主に錐体外路運動である不随意運動の調節、筋の緊張の維持等に関わっています。実は不随意運動の調節以外に、認知機能や感情や動機づけや学習などさまざまな機能を司りますが大脳皮質と連絡を取りながら実行されているのです。
この様な働きは大脳皮質からの情報は線条体(被殻と尾状核)への入力神経線維投射によって開始されこれを皮質線条体投射と呼びます。異なった大脳皮質からの様々な領域に由来する情報は,基底核の四つの線条体・淡蒼球・黒質・視床下核の異なった領域(神経核)で処理された後に,出力核である淡蒼球(内節)・黒質(網網部)から視床を介してもとの皮質領域に戻って再び大脳から新しい情報を得るのです。このように大脳皮質からの情報を大脳基底核で処理して再び大脳皮質に処理した情報のやり取りの回路をループと呼び大脳皮質と大脳基底核の情報のやり取りの回路ですからこれを大脳皮質―基底核ループと呼びます。大脳皮質のどの領域と情報をやり取りする違いによって四種類のループが明らかにされています。その四つは(1)運動系ループは運動プログラム・運動準備・運動遂行を行います。(2)前頭前野系ループは認知・意志発動・行動計画,社会性を司ります。(3)辺縁系ループは認知情報の評価,情動・感情・意欲,精神活動の調節を行ないます。(4)眼球運動ループは主に動くものを目で追う働きをするサッケード(急速眼球運動で)の制御を司るの四つが現在までに突き止められています。
黒質は網様部と緻密部の二つの成分から成り立っており黒質の緻密部が大量のドパミンを産生します。しかも黒質が黒いのは黒いメラニン色素が紫外線から大切な脳を守るために大量に存在しているからです。herpesが一番感染しやすい脳の神経核細胞はメラニン色素を一番多く持っている黒質なのです。メラニン色素と黒質とヘルペス感染についてはここを読んでください。従ってストレスの多い免疫が落ちている人の脳にherpesが感染するとまず感染するのは黒質なのです。この黒質にいったんherpesが感染してしまうと大脳基底核の四つの線条体・淡蒼球・黒質・視床下核のすべてに感染してしまうのです。特に黒質に感染したヘルペスが黒質の細胞群を大量に死滅させればドパミンが作れなくなりパーキンソンになるのです。従ってパーキンソン病をherpesを増やさないように抗ヘルペス剤のアシクロビルを大量投与すればいいのです。パーキンソン病の原因はヘルペスですから治療は極めて簡単なのですが統合失調症は初期は気質が主な原因となりストレスの繰り返しで徐々に病期が進行していくと本格的にherpesが大脳皮質にも大脳皮質-大脳基底核ループの四つの種類のループに乗ってherpesが徐々に大脳皮質にも感染していくと脳はherpesが感染した脳の神経細胞が変性脱落をはじめると委縮し始め大脳皮質の機能も異常になっていき大脳皮質の連合野の情報統合能力も低下してしまうのです。
大脳皮質-大脳基底核ループの四つの種類のループについて詳しく説明しましょう。
(1)運動系ループは運動プログラム・運動準備・運動遂行を行います。一次運動野は中心溝の前方、中心前回(Brodmann 4野)に位置し、随意運動の発現に関わる大脳皮質運動野の一つであり、運動指令を脳幹や脊髄へ出力する主要な拠点である。大脳皮質の一次運動野で運動のコントロールに関与する領域を運動皮質という。 運動皮質の中で運動出力に一番近い領域は一次運動野である。 一次運動野は大脳皮質の中央部にある中心溝の前方の領域で、体の各部分の筋肉の運動を完全に支配できる。
(2)前頭前野系ループは認知・意志発動・行動計画,社会性を司ります。前頭前野は額のすぐ後ろ、脳の前の方にある脳の領域の一つです。 前頭前野は、記憶や感情の制御、行動の抑制など、さまざまな高度な精神活動を司っている、脳の中の脳とも呼ばれている最も重要な場所です。
(3)辺縁系ループは認知情報の評価,情動・感情・意欲,精神活動の調節を行ないます。大脳辺縁系(limbic system)は、大脳の奥深くに存在する線条体(尾状核、被殻)からなる大脳基底核の外側を取り巻くようにある。人間の脳で情動の表出、意欲、そして記憶や自律神経活動に関与している複数の構造物の総称である。生命維持や本能行動、情動行動に関与する。海馬と扁桃体はそれぞれ記憶の形成と情動の発現に大きな役割を果たしている。limbicの語源のラテン語であるlimbusは、edge すなわち「辺縁」の意である。
(4)眼球運動ループは主に動くものを目で追う働きをするサッケード(衝動性眼球運動)の制御を司る。サッケードは,衝動性眼球運動と訳され視覚目標を視力の最も高い網膜中心窩で捉えるための急速な眼球の運動である。 中心窩は小さいためサッケードには高い正確さが求められる。 この正確さを支えるのが,サッケード適応と呼ばれる運動学習の仕組みであり、このサッケードを制御しているのが眼球運動ループの働きなのです。眼球運動の脳部位は大脳皮質に存在する前頭眼野の、眼球運動野である。眼球運動野は 補足眼野や上丘に直接投射し、この領域を電気刺激すると、低い閾値でサッケードとよばれる急速眼球運動や滑動性眼球運動が誘発される。 前頭眼野は眼球運動の認知的制御、空間的注意等、様々な生理機能に関わることが知られる。
滑動性眼球運動とは何でしょうか?まず共同性眼球運動を理解する必要があります。共同性眼球運動とは左右の目を同方向に動かす視線運動です。目の奥にある映像を受け取るスクリーンである網膜には、中心窩という視力が極めてよい部分があります。この中心窩でカバーされる部分は非常に狭く、約1.6度と言われています。この部分からわずか数度ずれるだけで、視力は極端に低下します。視覚情報を適切に取り込むためには、両目を動かして中心窩で目標物を捉えなければなりません。そのために重要な役割を担っているのが共同性眼球運動です。共同性眼球運動は左右の目が同じ方向に向かう動きのことです。さて、共同性眼球運動には二つの種類があります。ひとつは、滑らかにゆっくり動くものを追視する滑動性眼球運動(Pursuit)です。これは動体視力の基礎になる能力で、動いている目標物を見て認識したり、自分が動いているときに目標物を見たりするときに重要な役割を担います。 もうひとつの共同性眼球運動は、あるポイントから違うポイントに視線をジャンプさせる衝動性眼球運動(Saccade)です。これは、視野の中に入ってきた興味を引く目標物が何であるか確認したり、何かを探したりするためにおこなわれる眼球運動です。目の動きは、人間の体の中で最もすばやいと言われています。視線を物に向けるということは、情報を取り込み、それに対応するための第一歩です。この機能に弱さがあると、本を読むときに大きな障害となり、行や文字を頻繁に飛ばして読む、内容が理解しにくいなどの症状がみられることがあります。
認知( cognition)とはなんでしようか?大脳皮質の前頭前野が最も得意とする認知機能は感覚,知覚,記憶など,生体が生得的または経験的に獲得した既存の情報にもとづいて,外界からの情報を選択的にとり入れ,それを処理して新しい情報を生体内に蓄積し,さらにはこれを利用して外界に適切な働きかけを行うための情報処理の過程です。認知とは,何かを認識・理解する心の働きを指す場合や,またその結果を指す場合,あるいはそうした認識を可能にする能力,構造,機構を指す場合などに用いられます。認識cognitionと同義で用いられる。認識とは主体あるいは主観が対象を明確に把握することを言う。知識とほぼ同義の語であるが、日常で使われる知識という言葉と認識とは区別され、知識は主に認識によって得られた「成果」を意味するが、認識は成果のみならず、対象を把握するに至る「作用」のプロセスをも含みます。
人間の心の働きは,早くから知情意という3分類がなされてきた。知は何かを知ることであり知覚,認識,理解などを指し,情は何かを感じることであり感情や情動を指し,意は何かを行なおうとすることであり意図や意志を表わしている。認知とはこの分類でいえば知に該当する。実際にはこの知情意の三つは相互に深いつながりをもっており,多くの場合、認知が情や意と独立に行なわれているわけではない。
人間の心の働きは心理学では,感覚,知覚,認知という三つの区別が行なわれてきた。一般に感覚(sensation)とは,特定の感覚器が受け取る刺激の察知やその強度の把握に用いられ、知覚(perception)は特定の感覚の察知だけではなく,その感覚を与える対象の全体的な把握を含む場合に用いられる。認知(recognition)はさらに知覚内容を関連する他の情報と結びつける活動を含む場合を指す。一般には認識する内容の複雑さに応じて,感覚,知覚,認知を使い分ける傾向があるが、この区分も曖昧であり,どこまでが知覚であり,どこから先は認知であるという明確な線引きができるわけではない。
意識とは何か?心理学における意識とは、個人によって体験され、気づかれていることをいう。体験者自身には直接に把握されているが、他者にはその報告を得ない限り直接的には把握できないものである。意識という用語は多義的で、知っていることの内容を意味することもあり、また、知ったり気づいたりの過程を意味することもあり、いずれにせよ、意識は主観的なものであり、経験や行動はすべて意識されているとは限らない。無意識は意識されない意識かもしれない。
生理学的には、意識は脳幹の網様体から上行する上行性網様体賦活系および視床の非特殊核から上行する広汎性視床投射系を経た感覚性インパルスimpulse(刺激)によって大脳皮質の興奮性が高められ覚醒しているとみなされる。視床には多数の核が含まれるが,感覚の中継核を特殊核といい,それ以外の核を非特殊核という。視床には多数の核が含まれるが,特定の感覚の中継核を特殊核といい,それ以外の核を非特殊核という。特殊核から大脳皮質に上行する線維系は,脳幹網様体から上行する賦活系の一部をなしており,感覚刺激によって大脳皮質を目覚め状態にする。 これに対して,非特殊核から大脳皮質に上行する線維群は広汎性視床投射系と呼ばれ大脳皮質の興奮性が高められ覚醒しているとみなされる。興奮性のレベルは脳波の波形から判定されるが、もっとも低い覚醒のレベルでは睡眠状態となり、睡眠状態では意識は失われています。
意識には多義的な意味があるが,一般的には現在経験している自分の状態や周囲の状況などを感知している心の状態を指す。意識は主観的な現象であり,他の事象に還元することはできない。意識と言う言葉は、注意による気づきawareness(アウェアネス),あるいはその過程を示す場合にも使われる。意識障害(disturbance of consciousness)になると一過性あるいは持続性の思考能力の喪失,昏迷,嗜眠や昏睡などが観察され,脳波などに異常が観察される。直接経験として見たり聞いたりしている自己に気づくのは,外界への気づきによる意識であり,心に問題を抱えているときにその解決の見通しに気づいたりするのは内的な気づきによる意識と考えられる。この意味では,意識は内外の環境への気づきによって,主体としての自己が経験される過程で生まれる志向的な心の状態であるともいえます。
しかし,意識には制約性が伴うので,すべての経験や行動が必ずしも意識されるとは限らない。この制約があるのは,気づきという志向的な心を担う仕組みには制約性と選択性があるためです。
脳と意識は古代,中世,近世を通して哲学の認識論・存在論の中心的テーマであった。存在論(ontology )とは、さまざまな事物について、それが存在するといわれることの意味を問い究め、世界の構造について、さらには一般的に存在そのものの根拠またはその様態について考察し、規定する哲学の基礎的部門。 しばしば形而上学と同義に用いられる。存在論(ontology )は存在学ともいわれる。17世紀にデカルト(Descartes)が心(脳)身二元論を提唱して以来,物理的な脳が主観的な意識をどのように生み出すのかという疑問は近代科学の解くべき大きな問題と考えられてきた。身体と意識を分離させることで,デカルトは,身体を機械論的に説明する一方,意識や心を考える理性的主体としてとらえる実体二元論を唱えた。一方,デカルトは思考する主体としての自己を「われ思うゆえにわれあり」という命題に見いだし,心が自己認識の働きをもつことを示すことで,意識をヒトに固有の心の働きと考え,意識の科学的研究の礎を築いた。チンパンジーに意識はないように思われていますが大脳があるのでもチンパンジーにも意識は存在しているのですが言葉がないので認識できないだけです。意識をヒトに固有の心の働きと考えるのは間違いなのです。言葉があって初めて意識は認識されるのです。
近年,脳の認知神経科学の進展により,意識の働きの一部が機能的磁気共鳴画像法FMRI)などで観察できるようになり,脳は心の主観的状態を表わしていることが分かった。脳の活動と意識のかかわりをどうとらえるかによって,意識を脳の過程に完全に還元できるという極端な心脳同一論から心脳二元論までさまざまな考えがあるが,ある種の意識は特定の脳領域のネットワークの活動とかかわっているのです。つまり意識の働きが脳全体にかかわるのではなく,解決すべき課題によって,異なる脳領域が協調したり抑制し合いながら働いているのです。これは,特定の脳領域がダメージを受けると,対応する意識の働きが変わることを示している。視覚的な意識の障害を例に取ると,たとえばブラインドサイト(盲視)blindsightという「見えていると意識できないのに見えている」の症例では,脳の視覚野がダメージを受けて,対象が見えなくなっても運動刺激の方向などを判断させると的確に言い当てることができる。つまり,見ているものを意識することなしに見ているのである。
記憶とは何か?
記銘,保持,想起という三つの段階からなる心的機能が記憶です。記銘(memorization)とは,符号化(encoding)ともいい,外界の情報を保持できるように変換して取り込むことである。符号化(encoding)された記憶はどこに保持されているのかは未だ不明です。記銘された情報は必要な時点で取り出されるまで蓄えられている必要があるが,こうして情報を保管しておく働きを保持(retention),または貯蔵(storage)とよぶ。そして,保持情報が利用されるためにはこれを取り出す必要がありこの過程を想起(remembering)あるいは検索(retrieval)という。忘却(forgetting)とは,一度記銘された情報が後に想起できない状態を指す。その原因には二つが考えられる。一つは保持の失敗で,その情報が失われてしまったことによって想起できないもの,もう一つは想起過程そのものの失敗で,情報が保持されているのにもかかわらず検索できない場合であるがどのように失敗したのかは分かってはいません。
記憶の働きを調べる場合,記銘,保持,想起という三つの段階を人工的に設定することが多い。まず,実験の参加者に対して覚えるべき材料を提示し,記銘を求める。これを学習段階study phaseという。学習段階から一定の時間の経過後に,なんらかの方法で想起を求める。これをテスト段階test phaseとよぶ。学習段階とテスト段階の間の時間を保持期間retention intervalとよぶ。テスト段階で用いられる課題にはさまざまなものがあるが,再生recallと再認recognitionが代表的な課題である。
再生課題では,学習段階で経験した記銘材料を,口頭,筆記,あるいは行為によって生成することが要求される。とくに,記銘材料を提示された順序で再生することを求める課題を系列再生serial recall課題,順序に関係なく再生する課題を自由再生free recall課題とよぶ。また,たとえば,記銘材料の一部や属性を手がかりとして与えて再生を求める課題を,手がかり再生cued recall課題とよぶ。一般に,数個以上の記銘材料を一つずつ順に提示された場合,これらの材料を再生すると,最初の方に提示された材料と後の方で提示された材料の再生率が高い。前者を初頭効果primacy effect,後者を新近性効果recency effectとよび,さらに,これらの再生成績を提示順にプロットして描かれる系列位置曲線は,上述の系列位置効果serial position effectを視覚的に示すことができる。これらの効果は頑健であるとともに,種々の実験操作の影響を受けることが知られており,長く心理学における重要な研究対象の一つであった。
記憶の種類には,いくつかの種類があり,さまざまな分類方法が存在している。大きくは,「保持の時間」を基準にした分類と「想起の性質」に着目した分類がある。保持の時間による分類においては,保持時間が数秒以下ときわめて短いと考えられている感覚記憶,数秒から数十秒と考えられている短期記憶,そして数分から数時間,数ヵ月から数年(場合によっては永久)という長い期間が仮定されている長期記憶がある。
感覚記憶sensory memoryは,カテゴリー化される前の感覚的情報を保持しておく働きであり,各感覚モダリティに対応した別々の感覚記憶システムがあると考えられている。カテゴリー化とは2つ 以上の異なる対象物を等価であると認識 し,その等価性に基づいて対象のまとまり(カテゴリー)を形成する過程である。そして,カテゴリー化は概念や概念形成を含む認知過程の基礎をなす。
モダリティ(Modality)とは、一般的には「様式」や「様相」という意味で簡単に言うとか「様子」とか「姿」です。視覚情報の保持には数百ミリ秒しか持続しないアイコニックメモリiconic memoryが,聴覚情報の保持には数秒間持続するエコイックメモリechoic memoryがそれぞれ対応している。保持時間は短いが一度に保持されている情報は膨大であると考えられている。アイコニック・メモリーは、視覚情報の感覚記憶で、感覚記憶(知覚された情報)が短期記憶として次の処理を行うため選択されるまでの間、一時的にその情報を保存しておくことです。エコイックメモリーとは何でしょうか?記憶には感覚記憶というものがあります。これは数百~数秒の間だけ保持される記憶です。この感覚記憶とは正確にいえば「受け取った刺激をそのままの形で短時間保存する」というものです。聴覚情報の感覚記憶をエコイックメモリー、視覚情報の感覚記憶をアイコニックメモリーといいます。
短期記憶short-term memoryには,数秒から数十秒という短い時間しか情報を保持できないという制約に加えて,一度に保持できる容量に厳しい限界があるという特徴がある。この短期記憶の容量の限界は,記憶範囲課題memory span taskによって見積もられることが多い。この課題は,多くの場合,数字か単語を記銘材料とし,提示した材料の直後系列再生を求める。最大で何個の項目を正確に再生することができるのかが指標となり,この値が記憶範囲memory spanとよばれる。
長期記憶long-term memoryは,長時間情報を保持できるという特徴に加え,その容量に限界がないという性質をもつとされている。その記憶の内容から,言語的に表現が可能であるとされる宣言的記憶declarative memoryと,言語的な表現が困難である非宣言的記憶non-declarative memoryに分けられる。宣言的記憶declarative memoryさらに,エピソード記憶episodic memoryと意味記憶semantic memoryに分類される。非宣言的記憶の代表的なものは,手続き的記憶procedural memoryであり,たとえば,泳ぎ方,自転車の乗り方,ワープロの入力方法といった行動の方法に関する記憶を指す。
想起の性質に着目した分類によれば,再生や再認のような記憶課題によって測定される,学習エピソードの回想recollectionを伴う記憶を顕在記憶explicit memoryという。これらの課題では,実験参加者は「思い出すように」という教示を受け,学習エピソードの想起を求められる。すなわち,意識的な想起が要求されるのである。一方,学習時のエピソードの意識的想起を伴わない記憶を潜在記憶implicit memoryとよぶ。潜在記憶は,知覚同定課題や単語完成課題といった,「思い出すように」という教示を与えない課題によって測定される。典型的な単語完成課題では,「し□り□く」のような未完成の単語が提示され,この単語が何であるのか,同定するよう求められる。事前に「しんりがく」という単語を見ていた場合には,そうした経験がない場合に比べて,正答できる割合が高くなる。これを直接プライミング効果direct priming effect,または反復プライミング効果repeated priming effectともいいます。事前に「しんりがく」という単語を見たということを想起できなくてもこの直接プライミング効果は見られる。直接プライミング効果とは潜在記憶効果と訳したり知覚表象システム効果とも言われます。これは意識的なエピソードの想起(顕在記憶)と直接プライミング効果(潜在記憶)が別々に独立していることを意味している。直接プライミング効果は,環境から求められる必要な情報処理を効率よく行なうことを可能にしている現象で,知覚表象システムperceptual representation system(PRS)の働きを反映していると考えられています。
想起と記憶の再構成とは何でしょうか?記憶の想起の特徴は,それが能動的であるので,再構成過程reconstruction processからなるというところにある。知覚においても,過去経験や期待によって能動的でトップダウン的な処理が影響を及ぼすが,このことはとくに記憶において顕著である。バートレットBartlett,F.C.(1932)によれば,われわれが想起するのは,過去の出来事についての具体的な経験そのものではなく,その全般的な主題であって,想起を試みる場合には,そうした主題やスキーマに一致する事柄によって細部を補うことになる。スキーマとは、図式、図解、概要、あらまし、物事計画の概略や仕組み、構造、形式などの意味があります。を示したものを意味することが多い再構成過程とは,不十分な記憶を補完するこのような過程を指す。
スキーマschemaとは,経験の積み重ねによって形成された知識の構造あるいは認知的な枠組みのことであり,これは,これまでの経験から逸脱しない日常的な生活においてはうまく機能し,再構成過程を有効なものとする。スキーマの存在によって,われわれの認知システムは膨大な情報を過重に負荷なく処理することができるのである。その一方で,スキーマに一致しない情報は,スキーマに適合するように変容することが多い。スキーマや知識,先入観に基づいた記憶の変容は,目撃者の証言における記憶の歪みや偽りの記憶といった現象にも見られる。
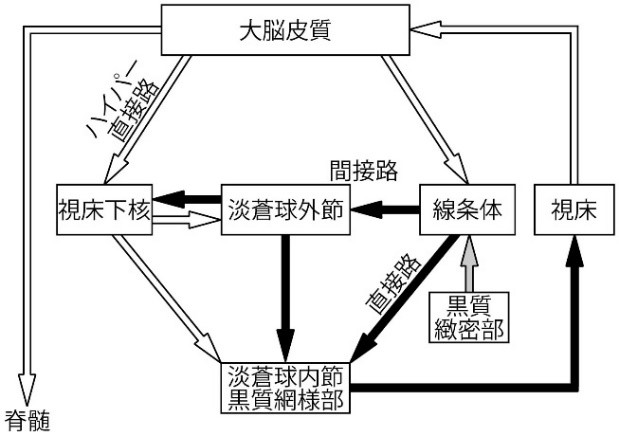
大脳基底核の神経回路
大脳皮質から線条体への入力投射を皮質線条体投射と呼ぶ。異なった大脳皮質領域に由来する大脳からの情報は,下図に示す大脳基底核の異なった領域で処理された後に,出力核である淡蒼球内接・黒質網様部から視床を介してもとの皮質領域に戻ります。このループを大脳皮質一基底核ループと呼び,(1)運動系ループ,(2)前頭前野系ループ,(3)辺縁系ループ,(4)眼球運動ループ四つが同定されている。これらの四つの回路は大脳基底核内の神経回路だけではなく外の大脳皮質まで神経線維が伸びて皮質の細胞とシナプスしてしまったあと再び大脳基底核に戻る輪をループと言いその輪(ループ)の種類が緩いがすぐ上の四つが同定されているのです。それでは下図にループにはなっていない大脳基底核内だけの回路を示しておきます。大脳基底核についてはここを読んでください。癲癇の原因は大脳基底核に感染したヘルペスを免疫細胞のミクログリアが攻撃するから生じるので大脳基底核について詳しく説明しています。
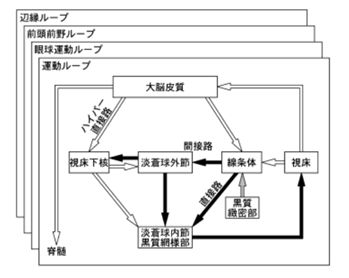
大脳基底核内の三つの神経回路である1)ハイパー直接路、2)直接路、3)間接路より成り立っている。グルタミン酸作動性の興奮性投射を白い矢印、GABA 作動性の抑制性投射を黒い矢印、ドパミン作動性投射を灰色の矢印で示す。
統合失調症の治療薬
3-1抗精神病薬はどのように作用するか
統合失調症の治療の中心になる薬物を抗精神病薬といいます。この抗精神病薬の発見は約50年前にさかのぼることができます。当時特殊な麻酔のために使う薬として開発していたクロルプロマジンという薬物に、統合失調症の症状を改善する効果のあることが発見されたのです。それ以前に使われていた薬物は、たんに興奮を抑えるような鎮静薬にすぎなかったのです。抗精神病薬の発見によって、統合失調症の治療法が大きく変化しました。
抗精神病薬は精神症状の改善だけでなく、再発予防効果もありますから、入院中心の治療から外来での治療へという、現在の統合失調症の治療方針が確立したのもこの薬によるといってもいい過ぎではありません。
さて、このような経緯で見つかった抗精神病薬ですが、その作用の仕組みはしばらくわかりませんでした。
1960年ごろから脳内での神経伝達の仕組みが生化学的に調べられ始めると、抗精神病薬は脳内にある神経伝達物質であるドパミンの情報伝達を抑制するということがわかりました。
図1にドパミンの神経伝達が行われるドパミンのシナプスをやや詳しく示しました。
抗精神病薬はドパミンの受容体(中でもD2とよばれる受容体)を占拠してしまい、ドパミンが受容体に結合するのを阻止するのです(図2)。
実際、カナダのシーマンという研究者は多くの有効とされている抗精神病薬の投与量とドパミンD2受容体の占拠率とのあいだに、強い関係のあることを示しました(図3)。
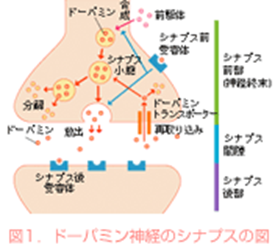
【図1】ドパミンは前駆体からシナプスの前部(情報を伝える側の神経細胞の末端)で合成され、シナプス小胞という小さな袋に蓄えられます。
神経のインパルスが伝わってくると、このシナプス小胞はシナプス間隙側に移動して、中にあるドパミンを細胞外に放出します。
放出されたドパミンはシナプス後部(情報の受け側の神経細胞)にあるドパミン受容体に結合して、シナプス前部からの情報を後部に伝えます。 また、一部のドパミンは分解されたり、再びシナプス前部にトランスポーターを使って取り込まれたりして、不活化されます。
ドパミン受容体はシナプスの前部にもあり、シナプス前受容体とか自己受容体などとよばれています。 この受容体はドパミンの合成や遊離などに対して抑制的に働くために、自己調節機能を持っていることになります。
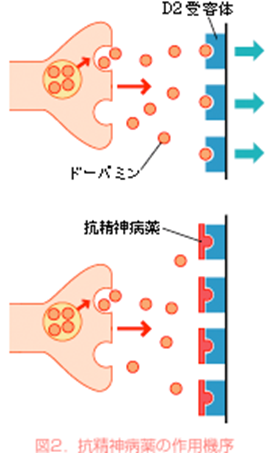
図2】抗精神病薬はドパミン2型受容体(ドパミンD2受容体といいます)を占拠して、ドパミンの結合を阻害します。その結果、ドパミンの神経伝達が抑制されます。
この抗精神病薬の働きから考えると、統合失調症ではドパミンの機能が過剰なのではないかと考えられます。これを統合失調症のドパミン仮説といいます。
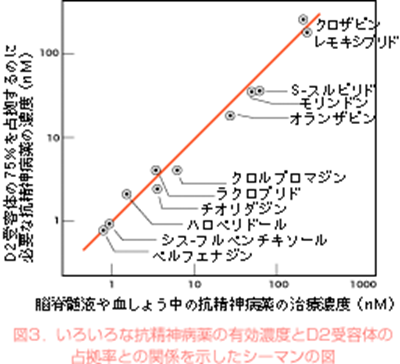
【図3】抗精神病薬の投与量は必ずしも脳内の濃度と比例しないため、ここでは脳脊髄液か血しょう内の濃度で代表しています。
いろいろな抗精神病薬があっても、その抗精神病効果に関連しているのはドパミンD2受容体への遮断作用であることを示す強い証拠の一つです。
これは、抗精神病薬にはいろいろな種類があるにしても、すべて共通してドパミンD2受容体の遮断という薬理作用を持っていることを示しています。 このような抗精神病薬の作用機序から統合失調症のドパミン仮説が生まれてきたことについてはすでにお話ししました。 現在多くの抗精神病薬が使われていますが、どれもD2受容体の阻害作用を持つ薬物の中から見いだされたものです。
3-2-1抗精神病薬はどのように作用するか
現在発売されている抗精神病薬は、みな同じように統合失調症に対する効果を持っています。しかし、副作用は薬によって少しずつ違っています。口渇・便秘・かすみ目などは抗コリン作用といって、抗精神病薬が神経伝達物質であるアセチルコリンの作用を阻害するためです。
また、立ちくらみや眠気は、神経伝達物質であるアドレナリンやヒスタミンの作用の阻害だろうと考えられています。 このような副作用は、薬を飲む統合失調症の患者さんにとってかなり不快なものです。しかし、副作用は薬ごとに多少の違いがあり、また個人差もかなり大きく、あらかじめ予想するのはなかなかむずかしいのが現実です。 これらの副作用はとくに服薬し始めたころに発現しやすく、しばらく服用していくと慣れが生じて、症状は軽減していきます。
もう一つやっかいな副作用として、錐体外路症状やパーキンソン症状とよばれる身体のこわばりやふるえなどがあります。 これは、抗精神病薬が脳内にあるいくつかのドパミン系をすべて抑制してしまうためです。ドパミン経路が遮断されると、抗精神病作用が生じると同時に、黒質線条体ドパミン経路の遮断により、錐体外路症状も引き起こされてしまいます。 とくに従来から使われている抗精神病薬は、投与量が多くなると、多かれ少なかれこの錐体外路症状をひきおこします。
また、プロラクチンというホルモンの分泌にもドパミンは関係しており、抗精神病薬はそこに働いてプロラクチンの分泌を増加させます。そのために、女性では生理が止まってしまったり、乳汁の分泌などが見られたりすることもあります。
何年あるいは何十年と抗精神病薬を服用している患者さんの中には、口をもごもごしている人を見かけることがあります。 この、もごもごした口の動きはジスキネジアとよばれる不随意運動です。本人はあまり自覚していませんが、見た目はあまりいいものではありません。 抗精神病薬の長期投与によって発症することがあり、これを遅発性ジスキネジアとよびます。定型抗精神病薬はこの遅発性ジスキネジアをおこしやすいといわれています。 これも抗精神病薬による錐体外路症状の一つです。
スウェーデンのファルデという研究者は、PETという装置を使って、抗精神病薬を服用している患者さんの脳内のドパミンD2受容体がどれくらい抗精神病薬によって占拠されているかを調べました(図4)。
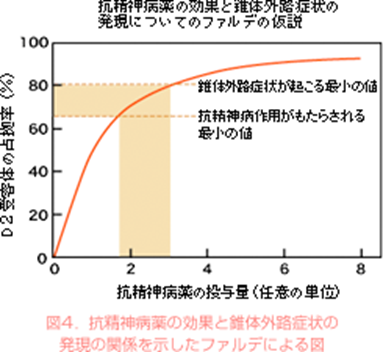
【図4】ファルデらは患者さんの線条体でドパミンD2受容体がどれくらい抗精神病薬によって占拠されているかをPETで調べました。
そこの結果、この部位のD2 受容体が抗精神病薬によって75-80%以上占拠されると錐体外路症状が発生する一方、65-70%以上占拠されていないと、抗精神病効果が表れないことがわかりました。
従来の抗精神病薬ではこの曲線の立ち上がりが急なので、黄色い部分のちょうどよい投与領域(錐体外路症状はでないが抗精神病作用はある)を、個々の患者さんで予想することはきわめて困難です。
そうすると、大脳の線条体という領域(錐体外路の主要な部位です)で75~80%以上のドパミンD2受容体が占拠されると、錐体外路症状が出現することを示しました。
抗精神病薬の投与量を調節して、この占拠率以下になるようにし、同時に少なすぎて抗精神病効果が消えないように、ちょうどよい投与量を見つけられればよいのかもしれません。
しかしそれを実際の治療場面で、個々の患者さんに対して行うことはむずかしかったのです。
このように従来使われてきていた抗精神病薬には、錐体外路症状とプロラクチン分泌という副作用が、程度の差はあっても必ず伴っていました。
これらの抗精神病薬を従来型抗精神病薬とか定型抗精神病薬などとよんでいます。
3-2-2新しい抗精神病薬-非定型抗精神病薬
従来からの抗精神病薬-定型抗精神病薬
錐体外路症状とプロラクチンの増加は、その薬物の抗精神病効果とは直接関係しません。 最近になって、このような副作用の少ない抗精神病薬が日本でも発売されるようになりました。
これらの薬物を従来からの定型抗精神病薬と区別して、非定型抗精神病薬とよんでいます。 アメリカでは抗精神病薬の多くの処方がこの非定型抗精神病薬になっているとのことです。
それではどうして非定型抗精神病薬は錐体外路症状などをひきおこしにくいのでしょうか。 現在はっきりと説明できませんが、一つの可能性として、非定型抗精神病薬は従来の抗精神病薬ほどドパミンD2受容体に固く結合せず、ゆるやかに結合するので、もともと存在しているドパミンの働きを阻止しすぎないからだろうという説があります(図5)。
あるいは、セロトニンとよばれる神経伝達物質にも作用して、セロトニンとドパミンの相互作用から錐体外路症状がひきおこされにくくなっているという考えもあります。
また、一部の非定型抗精神病薬はドパミン以外のいろいろな神経伝達物質の受容体に作用するので、その総合的作用の中から非定型な抗精神病作用がもたらされるのだという人もいます。 非定型抗精神病薬は、従来の抗精神病薬が苦手としていた統合失調症の陰性症状にも効果があるともいわれています。
しかし、これは錐体外路症状がないための見かけの改善なのか、それとも本質的な作用なのかについては、研究者のあいだで意見が一致しません。
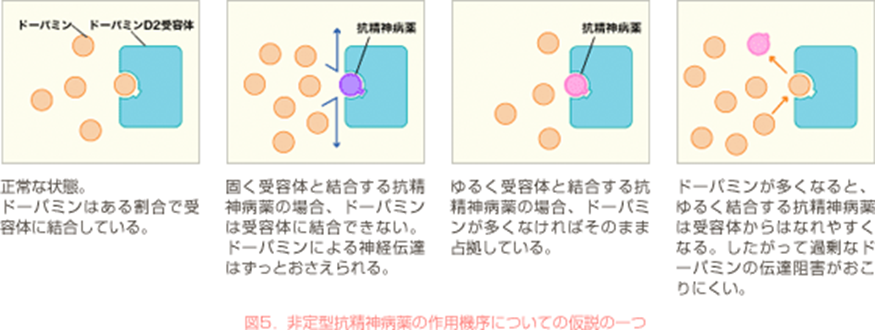
定型抗精神病薬はドパミンD2受容体に固く結合するので、もともとあるドパミンの濃度が変動しても関係なく受容体を遮断し続けます。
非定型抗精神病薬はこの受容体に緩く結合するので、ドパミンが増加した際などには受容体から離れていきます。
その結果、過剰な遮断をひきおこさないので、錐体外路症状もひきおこしにくいのであろうと考えられています。
色々な観点からさらにドパミンのすべてを勉強復習しましょう。
ドパミンは多様な作用をもつ生体分子であり、主に神経伝達物質として振る舞っている。神経細胞同士の結合部位(シナプス)でのドパミンの情報伝達においては、現在 5 種類に分類されているドパミン受容体が活性化し、それぞれが示す生体への影響が異なります。ドパミン作動性神経細胞は脳内では中脳と視床下部に多く存在し、ドパミンがもつ脳機能の調節作用では中脳にある黒質から大脳基底核の線条体へ投射するドパミン神経が特に重要である。黒質-線条体系でのドパミンの減少は、難治性の神経変性疾患であるパーキンソン病を引き起こす。一方、線条体や視床下核の神経細胞が脱落すると、ハンチントン病という異なるタイプの神経変性疾患が発症する。これらの中枢神経疾患はその症状が多様ではあるが、大脳基底核を中心とした神経解剖学的な視点から説明できる。基底核が大脳皮質の活動性を監視する「門番」としての役割を演じるとき、淡蒼球内節と黒質網様部へ投射する線条体からの直接経路と間接経路の働きが引き金となることで、この経路は運動の開始や増大を引きおこすのである。
ドパミンは脳内の報酬系においても非常に重要であり、大脳基底核内でのドパミンの役割として、主に大脳皮質が示す様々な反応の出現確率を偏らせることによる行動選択のメカニズムがある。報酬に動機づけられた目標志向行動には線条体が関与しており、脳卒中などでこの脳部位に障害を負った場合には、機能回復への関心が薄れてリハビリテーションに対する意欲が低下するケースもある。ドパミンはまた、記憶・学習に関連した神経活動の調節においても重要な位置を占めている。海馬や線条体におけるドパミン・システムの活動性に依存した学習行動とその神経基盤を元にして、人間の行動におよぼすドパミンの影響を明らかにしましょう。
脳は「人間」という存在を持ために活動を続けているのである。脳を実体のある「モノ」として扱い、あたかも機械の動作原理を解明するかのごとく、その仕組みに迫ろうとする研究がある一方では、「心」や「意識」といった実体のつかみづらい対象に対して、脳の中に根拠を求めることで、コンピュータのソフトウェアの仕組みに迫る時代になりました。脳の研究は、その対象を神経細胞や神経ネットワークという実体のあるものに絞った神経科学研究の発展とともに大きく進展してきた。
生体機能は生体内物質によって調節を受ける。生理学的な恒常性を保つため、また外部環境の変化に対応するためにも生体はあらゆる調節を受けている。とくに外部環境への適用を図る上では、生体内物質が生じせしめる機能性の変化が重要となる。その中でドパミンは、身体の生理学的活動から精神活動に至るまで、多様な局面で私たちの「本質」に関係している分子である。このドパミンという小さな分子が私たちの行動までも規定するしくみは何でしょうか?
まず分子レベル・細胞レベルにおけるドパミンの性質であります。ドパミンの分子構造と生合成についてはドパミン(dopamine; 3, 4-dihydroxyphenylethylamine)は分子量 153.178 のカテコラミンに属する生体内分子であり、大きなベンゼン核をもちながら親水性の性質をもつ。カテコラミンは、核となるベンゼンにふたつの水酸基がオルト位結合したカテコール分子に窒素を含む官能基であるアミン基を配した構造をしている。生体内では、ドパミンはアミノ酸のチロシンを起点として細胞内で生合成される。ここには二つの生合成酵素による 2 ステップの生合成反応が関与している。ドパミンの前駆体は L-ドーパ(L-DOPA やレボドパともいう)というカテコラミンのファミリーに属する生体内活性物質であるが、L-ドーパは神経変性疾患であるパーキンソン病の治療物質として用いられる薬物です。L-ドーパはそれ自体が薬物としての効果を発揮するわけではないが、パーキンソン病という重篤な疾患に対しても臨床の現場において有用である。その理由は、ここでみたように生体内でドパミンへ変換可能であることが大きく、治療に生体のシステムを利用した好例とみることができる。
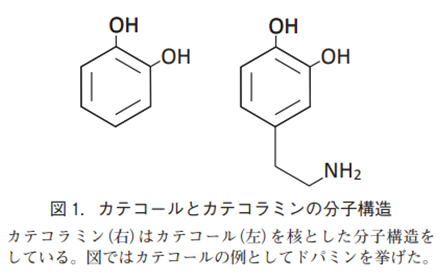
図 1.カテコールとカテコラミンの分子構造OH OHOH OHNH2カテコラミン(右)はカテコール(左)を核とした分子構造をしている。図ではカテコールの例としてドパミンを挙げた。
ドパミンはドパミン作動性神経細胞内において合成が進められる。カテコラミンという同属の分子であるノルアドレナリン(ノルエピネフリン)やアドレナリン(エピネフリン)が貯蔵されるアドレナリン作動性神経細胞とは異なる神経系の細胞であることから、同じチロシンというアミノ酸を材料としながらも、その細胞がもつ酵素の種類により、代謝反応の結果として生合成される物質が異なるのである。そして、これがすなわち生体の調節機能に多様性を持たせる一因となっている。
ドパミンの細胞内での蓄積と放出についてはドパミン作動性神経細胞の細胞質で生合成されたドパミンは、細胞質に存在する分泌小胞(secretory‐vesicle)で蓄積される。ドパミンが合成されてから分泌小胞へ取り込まれるまでには、細胞内の二つのタンパク質が分子ポンプとして働くことが必要である。まず、小胞内のプロトン(「水素イオン」のことで「H+」と表される)を濃縮するためのプロトン ATPase が低 pH 条件で電気的に陽性な小胞内部環境を作る。低 pH 条件とは、すなわちプロトン濃度が高い状態である。そして、このことが電気化学的な勾配を形成し、続くプロトンアンチポーターの動力源となる。プロトンアンチポーターとは、プロトンの輸送体であり、ポテンシャルの低い方(この場合は小胞外部)へプロトンを移動させるとともに、濃度勾配に逆らう方向でドパミンを輸送するものである。この一連の過程を経て、細胞質に存在するドパミンが小胞内へ格納されることになる。神経細胞が刺激を受けて活動した場合、カルシウムイオンの介在のもとにドパミン含有の小胞が細胞膜と融合する。その結果、小胞内膜が細胞外膜と融合することから、ドパミンが細胞外に放出されるのである。
神経細胞のシナプス部における情報伝達は神経細胞同士の結合部位で行われ、情報伝達の場としての構造体をシナプス(synapse)と呼ぶ。神経細胞が情報を伝達する場合には、多くはシナプスにおける神経伝達物質(neuro‐transmitter)と呼ぶ化学物質を介した方法をとる。つまり、ドパミン作動性神経からはドパミンが放出され、放出されたドパミンはドパミン作動性神経自身が結合できる受容体を持っており、その受容体を自己受容体(autoreceptor)と呼び、ドパミンなどのシナプス間隙濃度のモニターとして働いて放出を調節する役割をもつのです。この自己受容体にドパミンが結合するとドパミン作動性神経自身はドパミンの放出を止める「負のフィードバック機構」を持つことになるのです。この「負のフィードバック機構」は、神経機能は他者からの調節により干渉を受けるだけでなく、自身でも活動性の調節を行うことができるのです。受容体はシナプス前部から放出された神経伝達物質を特異的に認識するのであるが、あるひとつの受容体には、それに対応する 1 種類の神経伝達物質しか結合しない。しかし、多くの受容体は類似の性質をもったファミリーとして分類されるので、神経伝達物質の側からみると結合する受容体は多数にのぼることになる。すなわち「1 対多」の関係となっているのである。受容体が神経伝達物質と結合すると、シナプス後部では細胞内で一連の化学反応がひきおこされる。それぞれの受容体は伝達物質が作用する部位以外にも、その作用を修飾する部位をいくつか持っている。例えば、脳の神経細胞における主要な情報伝達物質であるグルタミン酸には数種類の受容体が知られるが、その中で学習の成立に重要な役割を演ずるNMDA 型受容体では、グルタミン酸以外にもグリシン結合部位やポリアミン結合部位、マグネシウムや亜鉛などの金属イオンの結合部位をもつことが知られる。このように受容体は、単に神経伝達物質の情報を受け入れるだけでなく、多くの調節部位を持つことで受容体での神経伝達が修飾されているのである。
1. 4 細胞のもつ受容体の分類
ドパミンに対する受容体についてまとめる前に、まずは一般的な受容体について分類し特徴を挙げていくことにする。シナプス後膜上に存在する神経伝達物質の受容体は、大きく「イオンチャネル型」と「代謝型」に分類される。イオンチャネル型受容体(ionotropic receptor)とは、神経伝達物質が受容体に結合することにより、受容体タンパク質の立体構造が変化し、細胞外と細胞内とを繋ぐチャネルポア(channel pore)を形成するものである。細胞内外に存在するイオン類は、特定のイオンチャネルを通ることにより移動することができるので、これが膜の電位状態を変化させ、そして細胞の機能性を左右することになる。また、代謝型受容体(metabotropic receptor)とは、細胞内の代謝反応を生じせしめることで細胞機能を修飾するものである。代謝型受容体の多くは、受容体タンパク質が細胞膜を 7 回通過するものであり、細胞膜付近において、GTP 結合タンパク質(一般に略して「G タンパク質(G protein)」と呼ぶ)と共役する「G タンパク質共役受容体(G protein-coupled receptor)」である。G タンパク質は、受容体と細胞内情報伝達系との介在構造であり、これを介することによって情報が細胞内部へと伝えられるものである。一般に Gタンパク質は受容体タンパク質の 10 倍以上の数が存在すると考えられており、ひとつの受容体の刺激により数個以上の異なった性質をもつ G タンパク質と相互作用することが知られている。このことにより、細胞外からの複雑な情報を細胞内で処理できる形に変換し、さらに増幅して伝えることができるのである。すなわち、細胞外情報を細胞内情報へ変換し伝達する「スイッチ」のような役目を担っているともいえる。 その他にチロシンキナーゼ受容体(receptor tyrosine kinase)が知られており、受容体の活性化で直接的に細胞内タンパク質のリン酸化を促すことで情報を伝えている。このような受容体の機能と細胞内での情報伝達系とのリンクによって、細胞内で一連の反応系が駆動され、細胞機能の発現や、一部は核内の遺伝子の発現を調節することにより新しいタンパク質の合成を誘発したりしている。そして、このような機構こそが細胞の機能性調節における主要な役割を担っているともいえるのである。
1. 5 受容体に作用する薬物
受容体には絶えず様々な化学物質が接触をくり返しているのであるが、その中で受容体の受け入れ口に合致する構造をもった物質をリガンド(ligand)と呼ぶ。リガンドには、受容体に作用することにより受容体の構造変化をもたらし、細胞内に情報が伝わることで反応を示す薬物があり、これを作動薬(アゴニスト;agonist)と呼んでいる。これに対して、作動薬の作用を遮断する薬物を拮抗薬(アンタゴニスト;antagonist)といい、それ自体では生理学的な作用を持たないものを指している。このような作動薬と拮抗薬により、受容体の薬理学的な側面とそれに関連した生体機構が浮き彫りにされる。ドパミンを例にとれば、抗精神病薬の多くはドパミンの D2 受容体という受容体に対する拮抗薬であることからも、このタイプの受容体と精神機能との深い関連性が伺えるものである。
1. 6 中枢におけるドパミン受容体の分類と役割
ドパミン受容体についての研究は、歴史的には抗精神病薬の作用点として進められてきた。脳内に存在するドパミン受容体は古典的には D1 受容体とD2 受容体とに分類され、D1 受容体はシナプス後膜のみに存在し、D2 受容体はシナプス前膜と後膜の両者での存在が知られてきた。さらに近年の分子生物学的手法によって、新たに D3~ D5 受容体の3 種類の存在が明らかとされたことにより、現在ではドパミン受容体を細分類すると 5 種類となる。これら細分類された受容体は「受容体サブタイプ(receptor subtype)」と呼ばれる。通常、受容体にサブタイプが存在すると、薬物に対する応答性や情報伝達機構がそれぞれ異なるのであるが、ドパミン受容体の場合はサブタイプの全てが代謝共役型(G タンパク質共役型)の受容体である。ドパミン受容体におけるサブタイプの性質で大きな差異は、D1 受容体にドパミンが結合し、その情報を伝達した場合に、細胞内のセカンドメッセンジャー分子である環状 AMP(cyclic adenosine‐mono‐phosphate; cAMP)の生産量が増加するのに対して、D2 受容体の刺激では細胞内 cAMP 量は減少することであろう。この現象は、D3 受容体や D4受容体を刺激した場合に観察されるものと同様である。このような細胞内での反応性の違いにより、ドパミンがもつ生体への影響が変わってくる。以下、これらの受容体サブタイプの特徴をまとめる。
⑴ D1 受容体 G タンパク質のうち、刺激により細胞内の cAMP産生を促す Gs 型と促進的に共役することが知られる。ドパミン作動性神経の作るシナプスでは、その後部側のシナプス部に面した膜に DARPP-32(dopamine- and cAMP-related phosphoprotein-32)と呼ばれるタンパク質が認められる。この機能性を鑑みることによって、D1 受容体が活性化した際の cAMP量の増加に伴った DARPP-32 のリン酸化促進が、細胞内の他のタンパク質のリン酸化を調節していると考えられている。このような D1 受容体は、線条体や側坐核、嗅結節錐体細胞などにその存在が同定されており、その部位特異的な機能発現とその調節への関与が強く示唆されている。
⑵ D2 受容体 D2 受容体は D1 受容体とは異なり、細胞内の Gタンパク質のうち、刺激により cAMP 量を減少させる Gi 型と共役している。その他にも、カリウムチャネルの開口やカルシウムチャネルの活動抑制が知られ、D2 受容体の活性化に伴い細胞機能が抑制される傾向を示すことが知られる。抗精神病薬の D2 受容体に対する親和性と薬の力価との相関性が高いことから、抗精神病薬の作用点は D2 受容体であると考えられている。このことから、医療の現場においても D2 受容体の拮抗薬が抗精神病薬として用いられているのであるが、それ以外にも制吐薬や胃の運動を促進する薬として用いられることもある。
⑶ D3 受容体D3 受容体の薬理学的な性質は D2 受容体と類似している。しかし、一部の薬物、特に自己受容体に選択性の高いリガンドであるパーゴライドやキンピロールに対する親和性が D2 受容体と比較して高く(30~100 倍)、逆に抗精神病薬として用いられるハロペリドールなどの薬物に対する親和性は、D2 受容体よりも 20~30 倍低いことから、D2 受容体とは明確に区別することができる。また、D2 受容体が脳内の線条体や下垂体で多く発現しているのに対して、D3 受容体は大脳辺縁系に多く、下垂体には殆ど存在が認められない。このような脳内分布の差異や薬物に対する親和性の違いなどから、D3 受容体は D2 受容体とは異なる抗精神病薬のターゲットとして考えられている。
⑷ D4 受容体と D5 受容体 これら受容体の薬理学的プロフィールは、D4 受容体が D2 受容体や D3 受容体と類似しているのに対し、D5 受容体は D1 受容体と極めて近いとされている。統合失調症は D2 受容体拮抗薬が有効である場合が多いが、抵抗性を示すものの存在も認められる。このような場合の薬物治療にはクロザピンを用いることが効果的とされるのであるが、この薬物のターゲットとして想定されているのが D4 受容体である。このことから、D4 受容体が D3 受容体と同様に新しい抗精神病薬の作用点であることが期待されている。また、D4 受容体には多型が認められることから、抗精神病薬の効果に個体差が多いことや、統合失調症の罹患率に差異を生ずる理由を説明する分子機構としての期待も大きい。
1. 7 ドパミンの末梢系での役割 ドパミンは中枢神経系における主要な伝達物質であり、中枢での多彩な作用が目を引くものであるが、末梢にも少数のドパミン作動性神経が存在する。本稿は中枢、特に脳機能に対するドパミンの作用を軸とするものであるので、ドパミンの末梢でのプロフィールはここでまとめることにする。末梢でのドパミン受容体は D1 受容体と D2 受容体に分類されている。D1 受容体は主に血管平滑筋に存在し、腎臓をはじめとする内臓の血管を拡張させる作用をもつ。D2 受容体は、交感神経からのノルアドレナリンや副交感神経からのアセチルコリンの遊離を抑制するシナプス前受容体として働く。
ドパミンの末梢での薬理作用としては、腎臓などの内臓の血管に存在する D1 受容体に直接作用して血管を拡張させることで血流量を増大させることが知られている。また消化管では、胃の副交感神経にある D2 受容体に作用することで、胃の運動性や機能性を支配するアセチルコリンの遊離を抑制し、胃の運動を緩和することができる。さらに心臓では、中等量のドパミンが心収縮力を増加し心拍出量は増大するのであるが、その際には心拍数と血圧には変化がみられないことが知られる。これはドパミンが循環器系に大きな影響をおよぼしている交感神経の終末部に作用することで、ノルアドレナリンを遊離させ心臓の拍出量や心拍数の増加、血管収縮による血圧上昇が生じやすい状態にする一方で、同時にD1 作用による腎臓などの内臓の血管拡張を起こすことにより血圧を低下させるからである。すなわち、同時に複数の受容体に作用することでその効果を相殺するのである。また血圧については、大量のドパミンでは血管収縮作用が強くなり血圧が上昇する。これは、血管のアドレナリン受容体へ直接的に作用することで血管の収縮を引きおこすことによるとされている。ドパミンは、末梢での効果を期待して臨床の現場でも用いられている。特に、急性循環不全の際には、血圧を上昇させる昇圧薬としてドパミンを静脈内に持続投与する処置が採られることがある。またドパミンは腎臓の血管拡張作用により昇圧時にも乏尿を伴わないので、出血などにより反射性に血管収縮を起こしたショック症状の際にも汎用されている。治療量のドパミンは副作用が少ないことで知られる。しかし、ときには頭痛や不安といった中枢での症状や、心悸亢進、不整脈、胃腸障害という末梢での副作用が現れることがある。また、まれに末梢虚血などの重大な副作用をひきおこすことがあるので、末梢血管障害の患者には使用を避けることが重要とされるが、概ね薬として安全に用いることができるものとして認識されている。
ドパミンの生体内分布と神経投射については、ドパミン作動性神経細胞群は、主に中脳に認められ、一部は視床下部にあることが知られる。中脳網様体、黒質、腹側被蓋のドパミン神経は線条体および辺縁系へ投射している。線条体は中枢神経のもつ全ドパミン量の約 80%を含み、黒質-線条体系のドパミンの減少がパーキンソン病の主病変として認められる。中脳-辺縁系は動物の行動や情動に関与するといわれ、精神病との関連が想定されている。視床下部弓状核および脳室周辺核から下垂体間葉、正中隆起に投射する漏斗-下垂体系は、下垂体ホルモンの分泌を調節している。網膜のアマクリン細胞および嗅球の寵周囲細胞は近くに関与するドパミン細胞として知られる。
第 2 章 大脳基底核の構造・機能とドパミンの作用の関係
2. 1 基底核を中心とした神経解剖
基底核は尾状核、被殻、淡蒼球、視床下核、そして黒質の 5 つの神経核群で構成され、小脳と並んで運動に大きな影響を持つ皮質下構造である。これらの核は、入力と出力が相互に接続しあって機能的に統合された回路網(ネットワーク)を形成している。また、症状は病変の位置によって相当異なるものの、基底核のいかなる部分の障害も協調運動を損なうことが知られている。これらの障害のいくつかは、基底核を中心とした神経の解剖学的側面から説明することができる。基底核に入る求心性線維は、体性感覚野、運動野、連合皮質を含む大脳皮質の多くの領域から発し、一次求心系からの直接入力は無く、ほとんど全て線条体(尾状核と被殻)に終末する。基底核からの遠心性線維もやはり限定されており、基底核からの出力は淡蒼球内節(internal segment of globus pallidus; GPi) と 黒 質 網 様 部(substantia nigra parsreticulata; SNr)から起始する。GPi の軸索は視床に入り、次に視床から運動野、補足運動野、前頭前野を含む大脳皮質へ投射するので、ループを形成している。一方 SNr の軸索は主に上丘に入り、眼球運動の開始に重要な信号を送る。線条体から GPi/SNrへの投射には直接経路と間接経路がある。直接経路は線条体から GPi/SNr への抑制性直接投射からなり、間接経路もやはり線条体とこれらの出力核を連結するが、途中淡蒼球外節(external segment ofglobus pallidus; GPe) と 視 床 下 核(subthalamicnucleus; STN)を介する。基底核からの出力信号は全て抑制性である。GPi と SNr の神経細胞は常に高頻度発火しており、上丘と視床の標的神経細胞を強く抑制している。最後に黒質緻密部(substantia nigra pars compacta; SNc)から線条体への投射であるが、この経路の神経伝達物質はともにドパミンであるにもかかわらず、直接経路・間接経路に正反対の影響を及ぼす。黒質は線条体のドパミン受容体D1 に作用して直接経路を興奮させ、ドパミン受容体 D2 に作用して間接経路を抑制する。
2. 2 大脳基底核の運動機能への関与 皮質線維の興奮性出力が線条体に入力すると、直接経路によって基底核の出力核(GPi/SNr)にある標的神経細胞は抑制され、その結果視床と皮質運動野を興奮させる。一方、線条体の活動は間接経路を経て出力核を強く興奮させ、結局視床と皮質を強く抑制する。直接経路と間接経路の機能は一見食いちがっているように見える。しかし前述のように、黒質-線条体間の線維は直接経路を増強する一方、間接経路の影響を減弱させるので、間接経路の処理が遅い場合 GPi/SNr は直接経路から弱く抑制された後、間接経路から強く抑制される。つまり視床と皮質は弱く興奮した後、強く興奮するのである。このように、淡蒼球内節と黒質網様部へ投射する線条体からの直接経路と間接経路の働きが引き金となることで、この経路は運動の開始や増大を引きおこし、基底核が大脳皮質の活動性を監視する「門番」としての役割を果たしている。この点から、基底核は運動の開始に決定的な役割を果たしていると考えられる。皮質運動野での処理は、潜在的に候補となっている運動計画が運動器官の制御のために競合している競合過程として見なせる。基底核は競合する複数の候補の中から一つを選択する機能を持つ。定常的な神経活動により通常は運動系が強く抑制され、筋肉を動かすことなく候補となっている運動計画に関わる神経細胞を活動させることが可能である。特定の運動計画が強度を増すにつれ、選択された神経細胞へ向かう抑制信号が減弱する。 ドパミンは報酬系に非常に重要な神経伝達物質であることが古くから知られている。基底核内のドパミンは、特定の反応を生み出すように他のシステムを偏らせているという仮説がある。ある行動が成功すると、線条体でドパミンが放出される。ドパミンは基底核内の入出力チャンネルを修飾して、過去に報酬を得られた刺激と同じパターンが再び入力したときに、成功した行動と同じ反応を開始する確率を高めていると考えられている。
2. 3 基底核障害としての精神神経疾患
⑴ パーキンソン病 パーキンソン病は、基底核が障害される有名な変性疾患であり、筋活動を増強させる陽性徴候と減弱させる陰性徴候によって特徴づけられる。陽性徴候には安静時振戦と筋固縮が含まれる。安静時振戦は遠位効果器に著明な速い震えである。固縮は主動筋と拮抗筋が同時に活動することによって生じ、一旦患者が意図的な運動を開始すると緩和される。上下肢を受動的に動かすと、抵抗と弛緩が交互に反復するのが感じられる。これを歯車様固縮と呼ぶ。パーキンソン病の陰性徴候には姿勢保持反射障害と動作緩慢がある。患者が座っている時は頭部が前方に垂れ下がり、立っている時はしばしばバランスを崩してしまう。パーキンソン病患者は一つの姿勢から動くことができない。このような自発運動の減弱や欠失は寡動症や無動症と呼ばれ、患者が新しい運動を開始しようとするときに特に著明である。歩みは遅く動作緩慢ではあるが、一旦歩き出すと一見正常に見える場合もある。全ての動作は緩慢だが目標物へ手を伸ばすことは可能である。パーキンソン病は 30~80 歳代に幅広く特発性に発症するが、特に 50~60 歳代に多く、基底核障害で最も多い疾患である。脳炎や薬物乱用による基底核の障害で同様の症状を呈することもあり、パーキンソン病と併せてパーキンソン症候群と総称される。常染色体優性・劣性遺伝の家族性パーキンソン病など原因遺伝子はいくつか明らかにされてはいるが、家族性のパーキンソン病のケースは実際は少なく、遺伝的要因との組み合わせで環境要因が重要であろうと考えられている。近年早期発症型パーキンソン病が増加しており、環境毒素の増加も原因として疑われている。詳細は不明だが、環境下で蓄積する未知の毒素によってドパミン作動性神経細胞の細胞死が加速されるのではないかと疑われている。ほとんどの脳組織と同様、SNc のドパミン作動性神経細胞は加齢によって萎縮する。萎縮神経細胞が過多になるとパーキンソン病の徴候が出現する。黒質から線条体へのドパミン作動性投射神経細胞が欠失する結果、直接経路の抑制が減弱する。したがって淡蒼球から視床への抑制は増強し、視床から皮質への興奮は減弱する。皮質興奮の低下は運動減弱の徴候として現れ、運動開始が遅くなる。皮質は一つの運動計画を選択した状態のままであるが、その計画を開始するためには基底核による皮質の抑制を減弱させることが必要である。パーキンソン病では自発運動の柔軟性も減少する。例えば、患者は運動を生み出すための力を変化させることができない。健常者は通常、初期主動筋のバーストの振幅を調整することによって、異なる大きさの運動を生み出す。強いバーストは大きな力を生み出し、運動を完了するために必要な時間の最小限の増加でより遠くへ動かすことができる。対照的に、パーキンソン病患者は、長距離の運動を行うために小さなバーストを連続して発生させる。このように、基底核は運動の開始だけでなく力の調節にも重要な役割を果たしており、いずれも運動計画の適切な賦活に関係している。皮質の活動が抑制されることにより筋肉の賦活が妨げられ、運動の開始が障害される。力の調節の障害は、運動計画は実行されているが硬直した状態であることによる。患者の線条体のドパミンが減少していることから、パーキンソン病と神経伝達物質ドパミンの欠乏が関連付けられた。ドパミンは血液脳関門(bloodbrain barrier; BBB)を通過しないが、その前駆体のL-ドーパは BBB を通過するので、L-ドーパを飲み薬で補充する治療法が開発され、ほとんどの患者に奏効している。多くの患者はほとんど疾患の徴候なく生活でき、パーキンソン病はもはや生命を脅かす疾患とはみなされていないが、L-ドーパの薬効は完璧とは言い難い。症状の急速な日内変動が認められることがある。また、長期的には、重度の運動低下が発現する患者も多い。
⑵ ハンチントン病 基底核の障害で姿勢の安定性と運動の微妙なバランスが崩れたり、抑制できない随意運動が生じたり、急速な随意運動が実行不可能になるような神経内科的疾患がいくつかある。ハンチントン病は中年以降に発症する進行性の変性疾患である。発症の特徴は、短気や、放心状態、日常の営みに興味を失うといった、通常かすかで緩徐な心的態度の変化である。一年以内で運動の異常を認め、不器用になり、平衡感覚が障害され、全般的に落ち着きがなくなる。これらの非自発性運動はヒョレア(chorea)と呼ばれ、次第に正常運動機能より優位になっていく。患者はねじ曲がった姿勢をとり、上肢、下肢、体幹、頭部を絶えず動かしている。ハンチントン病患者は、運動障害が悪化するにつれて皮質下型の認知失調も進行する。この認知失調は、アルツハイマー病のような皮質型の認知失調症に共通した徴候である失行や失語、失認を伴わないが、特に新しい運動技能の獲得に関する記憶が障害され、計算力低下も見られる。不安、抑うつ、妄想や自殺企図など情動変化および人格変化も伴うが、これらの精神症状は病気自体のためかそれとも上記の障害のためかは不明である。 ハンチントン病は第 4 染色体短腕先端部に存在する遺伝子異常が原因で、常染色体優性遺伝である。グルタミンのコドン:シトシン-アデニン-グアニン(CAG)配列は 11~34 回反復するのが正常であるが、患者では 42~86 回である。反復が多いほど低年齢で発症し、進行も速い。通常 30~50 歳で発病し、10~20 年程で感染症、嚥下困難による窒息などで死亡する傾向がある。典型的な患者の脳では皮質および皮質下領域の広範囲に病変が見られる。萎縮は基底核で最も顕著で、線条体の細胞脱落率は 90%にも上り、γ – アミノ酪酸(GABA)作動性神経細胞とアセチルコリン作動性神経細胞が消失する。このため線条体から間接経路への GABAの分泌が低下し、GPe への抑制が阻害される。STNへの抑制が亢進して GPi/SNr の興奮が低下、脱抑制により視床から皮質への興奮が亢進して、発病早期の運動亢進を生ずる。続いて生じる多動障害、つまりヘミバリスムも間接経路の病変と関連するが、この場合の病変は STN に集中している。線条体の細胞脱落と同様に、STN および GPi/SNr の興奮が低下することにより視床および皮質の興奮が亢進する。患者は制御不能な激しい運動を行う。
⑶ 統合失調症 精神障害は統合失調症の主要な症状であるが、一般に覚せい剤として知られるアンフェタミンの乱用が誘因となって引き起こされることがある。また、アンフェタミンはドパミンなどの神経伝達物質の放出を刺激する作用がある。そこでドパミン過剰は統合失調症の症状の原因となっているとする「統合失調症のドパミン理論」が導き出される。抗精神病薬は統合失調症の精神障害やアンフェタミンに誘発された精神障害に関連する妄想や幻覚を緩和する作用がある。代表的な抗精神病薬はドパミン拮抗薬である。しかし近年、興奮性伝達物質グルタミン酸の作動薬も統合失調症の治療に効果を示す可能性があることがわかってきた。統合失調症は、恐らくドパミン系、グルタミン酸系の一方または双方で正常神経伝達物質の機能が障害されることに起因するだろうと考えられている。
第 3 章 ドパミン・システムと動機づけ、学習
3. 1 動機づけの脳内プロセスとドパミンの関与 動機づけは行動を支配する重要な因子である。食物や金銭等の報酬に動機づけられた目標志向行動に線条体、前頭眼窩野、島皮質が関与していることが明らかにされている。その一方で、例えば、試験の合格のために勉強に励むことや、障害の克服のためにリハビリテーションに取り組むことなどは報酬獲得を伴わない目標に動機づけられた目標志向行動であることが知られている。臨床において、線条体や前頭眼窩野の障害を負った患者では、機能回復への関心が薄れ、リハビリテーションに対する意欲が低下することが報告されているが、報酬獲得を伴わない結果に動機づけられた目標志向行動に関与する脳領域は明らかでない。そこで我々は、報酬獲得を伴わない目標志向行動と動機づけに関連する神経領域の関係を解明するために、機能的 MRI を用いて、目標達成を目指して道具を操作する時の脳活動と明確な目標がない動作を遂行する時の脳活動を計測し両者を比較することで、報酬を伴わない目標志向行動の動機づけに関連する脳領域の関与を明らかにすることを試みた。インフォームドコンセントを得た健康な 16 名(男性 8 名、女性 8 名、全員右利き)のボランティアが被験者として実験に参加した。実験課題は、目標志向行動としてドライバーでボルトを締める課題(REAL)と明確な目標がない動作としてボルトを締めるようにドライバーを回す課題(SIMU)の 2種類とし、それぞれ両手で行わせた。脳機能画像は1.5T MR 装置を用い撮像した。解析は、StatisticalParametric Mapping を用い、各被験者の REAL 条件から SIMU 条件を差分した脳活動画像(REAL vsSIMU)を求めた後、被験者集団における REAL vsSIMU の有意な脳活動領域を求めた。右手の REAL vs SIMU は、腹側線条体、前頭眼窩野、島皮質、前帯状回、前頭前野、扁桃体、腹側被蓋野、上側頭溝後部、小脳前部に有意な活動(P< 0.001)を示した。左手の REAL vs SIMU では、背側線条体、前頭眼窩野、島皮質、前帯状回、前頭前野、上側頭溝後部、小脳前部に有意な活動(P <0.001)を示した。これらの結果から、報酬の獲得を伴わない目標志向行動は、明確な目標がない行動に比べ、線条体、前頭眼窩野、島皮質、前頭前野、前帯状回の活動を引き起こすことが判明した。霊長類やヒトの動機づけに関連した先行研究において、線条体、前頭眼窩野、島皮質、前頭前野、前帯状回の各部位は、行動の動機づけに密接に関係することが別個に報告されているが、これら全ての部位をヒトにおいて同時に検出したのは我々が初めてである。従って、これらの脳領域は物質的な報酬の獲得を伴わない動機づけ行動において重要な役割を演じることが示唆され、教育や学習、リハビリテーションを臨床上進める上での有用な基盤的情報となり得ると考えられる。
行動・学習・疾患の神経基盤とドパミンの役割についてはドパミン・システムと学習プロセスとの相互作用から話を始めます。
ドパミンによる脳機能の調節において、学習プロセスに関わる働きは、ヒトを含めた動物個体の活動性に大きく影響を及ぼすものである。これまでにも動物を用いた研究では、ユニット記録法のような電気生理学的な実験から脳破壊実験や薬理学的な実験まで、さまざまな方法でのアプローチが試みられてきた。そしてこれらの成果として、ドパミンが記憶・学習の過程に関連した神経活動を調節していることを明らかにしてきている。 ここでは、記憶・学習に重要な海馬領域およびパーキンソン病などの認知障害を伴う病態と深く関連する線条体を例にとり、まず、動物の学習に対するドパミン・システムの役割をまとめることにする。
3. 3 海馬領域でのドパミン・システム
海馬領域に依存した空間学習の成立は Morris 型の水迷路試験を用いて評価する例が多い。ドパミンが学習に及ぼす影響を調べた報告では、ドパミン神経毒の 6-OHDA を両側の海馬領域へ注入する破壊実験を行うことで、対象となったラットの空間学習課題の成績が悪化することが観察された。このような変化は、他のタイプの古典的な学習試験である受動回避学習課題では観察されなかったという。このような学習に対するドパミンの役割は、ドパミン受容体に対する薬理学的な処置を行うことで、さらに詳細な情報が得られている。D1 受容体と D2 受容体に対する作動薬を海馬領域に注入する実験では、ドパミン受容体が活性化され、先の水迷路学習課題を行ったところ成績の向上が見られた。この処置は、同様に空間学習能を評価するための八方迷路学習課題を行った際にも成績の向上が見られることが報告されている。一方で、薬理学的に D1 受容体の機能を調節しても大きな変化が観察されなかったのに対して、D2受容体が動物の学習に対して重要な役割を演じていることも報告されている。これらは D2 受容体の作動薬であるキンピロールが学習成立を促進することや拮抗薬のラクロプリドが抑制することを基盤として受容体レベルでのドパミン作用を結論づけたものである。D2 受容体の関与は、さらに複雑な学習課題を用いることによって、腹側海馬領域での活性化が動物の学習成立を抑制することが明らかとされていることから、海馬領域に依存した学習の成立には D2 受容体の重要性が大きいものと考えられる。このようなドパミン受容体を薬理学的に操作した研究報告では、海馬領域におけるドパミン神経のほとんどが腹側部に存在していることから、D1 受容体と D2 受容体の作動薬や拮抗薬をこの部位に局所投与した例が多い。しかし、海馬領域における詳細なシナプスレベルでの研究は、その多くが腹側部ではなく背側部で記録されたものであった。海馬体の機能発現には背側部にあるシナプス機能も重要であることから、この領域でのドパミン・システムの役割を明らかにしていくことも必須であり、また逆に、ドパミンを多く含む腹側部での研究報告を積み重ねていくことも重要といえる。さらに、D5 受容体は比較的新しく同定された受容体であり D1 受容体に類似していることから、古典的な D1 受容体ではなく、D5 受容体の学習に対する役割を明らかにすることもドパミンの役割を描ききるためには重要なことであろう。
3. 4 線条体におけるドパミン・システム
パーキンソン病が進行して重度となった場合に現れる認知障害は、線条体でのドパミンが不足することにより運動活動性と学習過程の変調として現れる。パーキンソン病に関連した学習障害を明らかとするためのモデルとしては、脳内のドパミンとその代謝産物を選択的に減少させるドパミン神経毒のMPTP を使ったものが報告されている。報告により若干の矛盾がみられるのであるが、MPTP 処置をしたサルを用いた結果では、学習の一環として行った遅延応答作業と古典的条件づけ課題での成績に障害性が現れることが明らかにされている。そして、これらの動物では、注意欠損などの障害性も同時に発現することが報告されている。これらの報告例を通して、パーキンソン病のモデル動物においては、ほとんどの認知障害が運動障害に先行して現れると考えられるようになってきた。そして、これらに対しては、脳内でドパミン量を増やす L-ドーパによる治療が著しい改善を示すことも報告されていることから、ドパミンの認知機能における役割の重要性が確固たるものとなっている。
ドパミンのもつ機能性を、脳の領域に特化した機能性との関連で考察することは、知的好奇心を擽られるものでもある。特に学習機能と線条体の機能を基盤においた考察では、教育の現場においてまだ勉強する習慣のない児童・生徒に限らず、学生、成人などを対象に応用することが可能であろう。ものごごろついた大学生や成人を対象とする場合は、賛辞、金銭、地位、名誉、などが報酬(インセンティブ)になりうる。また十分に条件づけられている場合は、線条体の作用によって報酬を提示されなくとも習慣的に勉強や勤労する傾向を持っているともいえるのである。過去に条件づけられた行動や報酬が与えられる場面ではなくとも、しっかりとした目標に動機づけられた新たな目標志向行動を行う場合は、明確な目標設定や達成すべき目標の価値を強調して説明することが重要となる。つまり、新たに勉強や作業、訓練、仕事、リハビリテーションなどを行う際に、「行動の成功」をはっきり定義してその意義や効果、利点などを理解した上で取り組めば、目標を達成したというその価値を認識できることにより、金銭的・物質的報酬がなくとも線条体からドパミンが報酬系へと放出されて強化学習が成立し、動機づけが維持されて目標思考行動が継続することが考えられる。以上の手法は教育だけでなく、日常的には運動をしない人や減量の必要のある人に運動やダイエットの動機づけを行い、運動やダイエットの開始、習慣化、そしてモチベーションの維持のために応用することができるだろう。また、上司が部下を如何にしてモチベーションを維持しながら教育・指導するか、などの参考になるかもしれない。
続きはPart3へ行きます。まだまだ中間地点ですが、頑張って着いて来て下さいね!!!
