NF-κBとは何か?ヘルペスとの戦いで中心的な免疫のタンパクを翻訳するための最も重要な転写因子です。NF-κBとヘルペス感染と癌との関係は何かを詳しく解明していきます。
一言で表すとNF-κBは、現代人に最後に残された病原体ウイルスであるherpesに対してまるでヘルペスワクチンであるかのようにふるまう転写因子でありherpesに対する免疫の武器となる遺伝子を蛋白に翻訳できる人類の人体を特別な病原体ウイルスであるherpesから守る最高の転写因子なのです。このような役割を持っているのがNF-κBなのです。NFはNuclear Factorの略で核内で働くタンパク質という意味です。NF-κBは英語で「Nuclear factor kappa B」で日本語で「核内因子κB」と訳します。κは抗体(免疫グロブリン)の構成タンパク質であるκ軽鎖、Bは抗体を作るB細胞を意味します。従ってNF-κB の全体の意味は「B細胞が抗体のκ軽鎖遺伝子を発現誘導する際に機能する転写因子」という意味です。転写因子とは、遺伝子を蛋白質に翻訳する(発現)を制御するタンパク質のことです。DNAに結合し、特定の遺伝子の転写(翻訳)を促進したり抑制したりすることで、細胞の機能や運命を調節します。
最後に残された人類の敵となっているherpesに対処する様々な免役細胞の機能である免疫応答や細胞の生存、増殖、アポトーシスなどの生命現象にズバリかかわる蛋白を作り出す転写因子がNF-κBなのです。今も昔も4億年前に地上に誕生したherpesウイルスの進化には他の生命は太刀打ちできないのです。何故ならば最高に進化した人間の免疫の遺伝子はヘルペスウイルスを殺し切れないので今なおherpesに対してワクチンさえ作れないのです。最後に残った人類の敵である唯一の病原体がヘルペスウイルスなのです。NF-κBという名称は30年ほど前にNF-κBが発見された当初の命名です。
下図は難解ですが①のNF-κBが活性化が始まり①~⑥の遺伝子の発現までの6段階の経路を示したものです。下図の「Ub鎖」はユビキチン鎖の略字で「ポリUb」とも表記されます。K63型ユビキチン鎖とはLys63残基に結合したユビキチン鎖を指します。ユビキチン鎖は、細胞内においてさまざまな働きをする重要なタンパク質修飾です。主な働きとしては、タンパク質の分解、シグナル伝達、DNA修復などが挙げられます。中でも、K63ユビキチン鎖はシグナル伝達やDNA修復に関与しています。
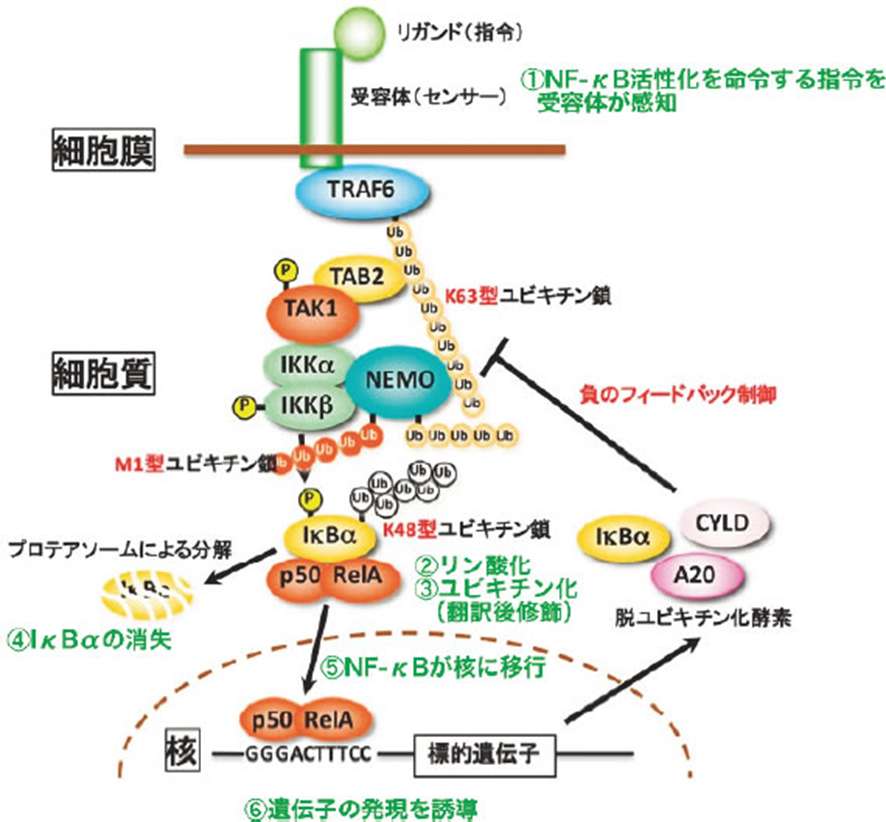
NF-κBは英語で「Nuclear factor kappa B」で日本語で「核内因子κB」であり細胞の核中で指令が伝達されていく意味を詳しく解説します。
人はたった一つの受精卵から卵割を繰り返し10か月余りの後誕生しますが、新生児の細胞数は約3兆~4兆個です。成人ではさらに増えて40兆~60兆に達します。3兆というのは巨大な数ですが10か月の妊娠期間に平均して週に一度分裂する程度の速さです。ただ、ここで大事なことは受精卵がただ42回分裂しても単なる細胞の塊(かたまり)になるだけで人という生命体にはなりません。分裂しながら手足を作ったり、脳を作ったり、胃を作ったり、骨格を作ったりしなければなりません。そのためには細胞は単に増えること①増殖に加えて、新たな機能を持つ別の細胞に変化したり②分化、機能すべき位置に移動したり③運動、自ら消滅したり④細胞死あるいはアポトーシスする4つの仕事が必要です。(図1)。
このような作業を計画的に実行するために細胞はその細胞の外から来る指令(増殖、分化等を細胞に促す命令)を受容体というセンサーで感知し、その指令を細胞内へ伝達させます。さらに細胞内でその指令が複数のシグナル伝達因子(主にタンパク質)間をリレー式に伝わっていき、最終的には転写因子(特定の遺伝子のmRNAの発現を誘導したり逆に抑制したりするタンパク質)の機能をコントロールすることで遺伝子の発現パターンを変化させます。こうして細胞は細胞外から来た指令を実行します(図2)。このような細胞の中での指令の伝達を「細胞内シグナル伝達」といいます。正常な細胞内シグナル伝達は、上記のような胎児の形作りに必須であるとともに生後においても細菌やウイルス感染で誘起される炎症免疫反応、脳神経機能、損傷治癒等においても細胞内シグナル伝達は必須な役割を果たします。
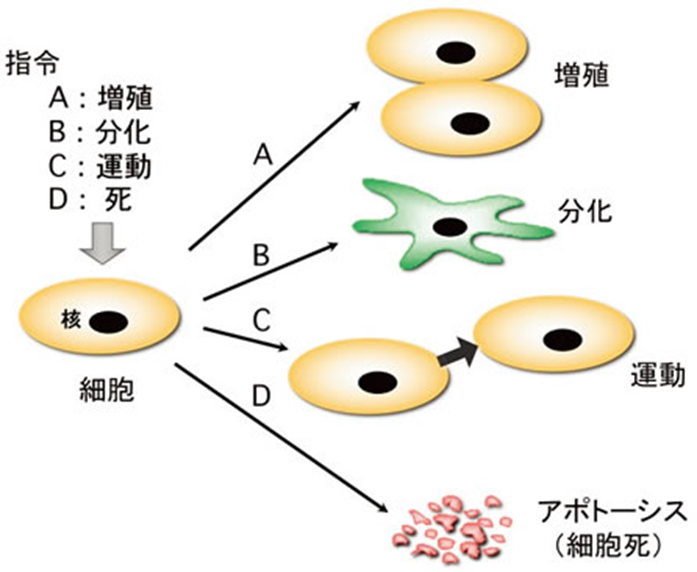
図1 細胞にA増殖、B分化、C運動、D細胞死の各指令が与えられた時の細胞の対応の仕方
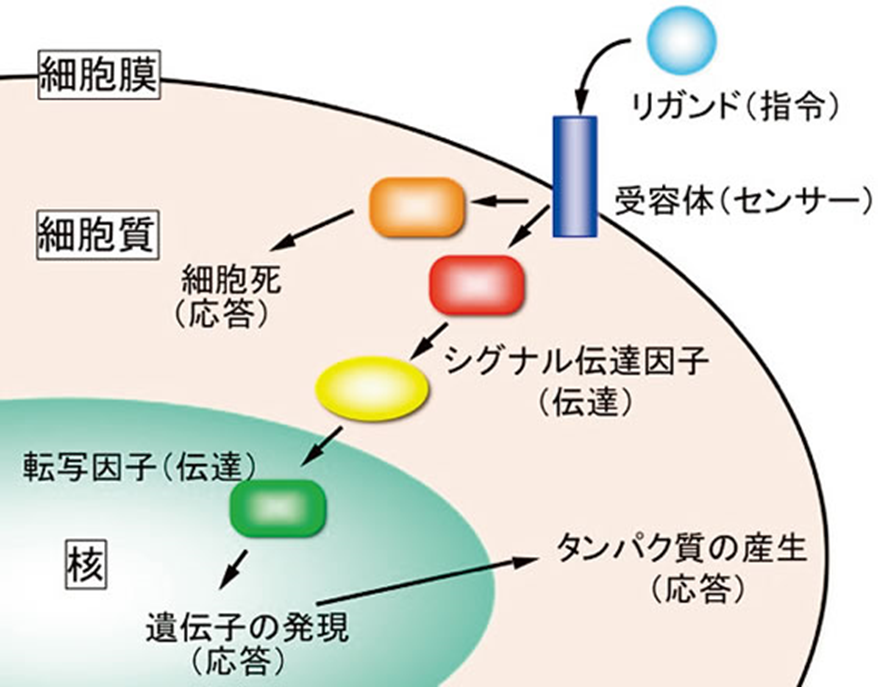
図2 指令が細胞に感知されその指令が細胞内を伝達される(細胞内シグナル伝達)様子
エヌ・エフ・カッパー・ビー(NF-κB)って何?
エヌ・エフ・カッパー・ビー(NF-κB)タンパク質は、核内で遺伝子の発現に関わる転写因子です。NFはNuclear Factorの略で核内で働くタンパク質という意味です。κは抗体(免疫グロブリン)の構成タンパク質であるκ軽鎖、Bは抗体を作るB細胞です。総合すると「B細胞が抗体のκ軽鎖遺伝子を発現誘導する際に機能する転写因子」という意味です。これは30年ほど前にNF-κBが発見された当初の命名です。その後、NF-κBはほぼすべての細胞に存在し、抗体遺伝子以外にも細胞の増殖、分化に関わる遺伝子や細胞死を制御する遺伝子の発現に関わっていることがわかっています。さらにこれまでの研究でNF-κBが休止状態から活性化する仕組みが明らかになってきました。タンパク質の中には、常に機能を発揮する必要がないものや、常に機能を発揮しなければならないタンパク質もあります。
ところがNF-κBは細胞や体に害があるとされていますが大間違いなのです。そもそも生命発生以来、生命を維持進化させてきたNF-κBが細胞や体に害を及ぼすことは絶対あり得ないことなのです。ダーウィンが説いているように進化の原理原則はあらゆる環境に適適応できた遺伝子だけが生き残ってきた進化の歴史が目の前に発現されているので生命を傷つける遺伝子はすべて淘汰されてしまっているのです。
ダーウィンの進化論の本質とは何でしょうか?進化論で有名な、チャールズ・ダーウィンは「種の起源」という著書の中で「最も強いものが生き残るのではない。 最も変化に敏感なものが生き残る」という言葉を残しています。ダーウィンの進化論からよく引用される名言は、「最も強い者が生き残るのではなく、最も賢い者が生き残るのでもなく、唯一生き残り続けるのは変化できる者である」です。この言葉は、時代や環境の変化に適応できる者が生き残り、進化していくという進化論の核心を表現しています。また、「最も強い者」や「最も賢い者」だけではなく、変化への適応力も進化の重要な要素であることを示唆しています。
因みに、ダーウィンは「1時間を無駄に過ごすものは、人生の価値をまだ発見していない」という名言も残しています。これは、時間を大切に過ごし、人生に価値を見出すことの大切さを説いています。
その他、ダーウィンは「変化に敏感なものが生き残る」という言葉も残しており、これは変化に敏感で、それを的確に捉え、変化に対応できる者が生き残ると述べています。
このように、ダーウィンの名言は、進化論の概念だけでなく、人生の価値、時間の大切さ、そして変化への適応力の大切さなど、幅広い教訓を与えてくれます。
ダーウィニズムとは?ダーウィニズムとは、チャールズ・ダーウィンが提唱した進化論のことです。簡単に言うと、生物は自然淘汰によって、より環境に適した形質を持つ個体が増えていき、結果として進化するという考え方が正しいことを証明するのは最も象徴的な出来事は遺伝子を持った生命体の中で自然淘汰の試練を乗り越えて36億年かけて最も進化したのは言わずもがな「我々ホモサピエンス」です。とりわけ病原体との戦いでも自然免疫から獲得免までの遺伝子を進化させて消滅せずにしかも天変地異をも頭脳を進化させて乗り越えて更にあらゆる、自自然やとの人間同士の生存競争に打ち勝って生命界を支配し続けられたのも、あらゆる点でいかなる遺伝子よりも有利な優れた形質を持つ「人」という個体が生き残り、子孫を残すことで、その形質が次の世代に伝えられつつあるのです。しかし残念なことに自己の欲望だけを最大限に満たす欲動の感情だけをとりわけ肥大化させたために近い将来に自滅することになるでしょう。というのはダーウィニズムはダーウィンの進化論からよく引用される名言は、「最も強い者が生き残るのではなく、最も賢い者が生き残るのでもなく、唯一生き残り続けるのは変化できる者である」です。この言葉は、時代や環境の変化に適応できる者が生き残り、進化していくという進化論の核心を表現しています。また、「最も強い者」や「最も賢い者」だけではなく、変化への適応力も進化の重要な要素であることを示唆しています。
ダーウィニズムをもっと詳しく説明すると①生物は多産である。生物は、環境資源が限られているにも関わらず、たくさんの子孫を産みます。②個体間に変異がある。同じ種でも、個体ごとに様々な形質の違い(変異)があります。③自然淘汰がある。環境資源が限られているため、すべての個体が生存できるわけではありません。変異によって有利な形質を持つ個体が、生存競争で勝ち、子孫を残します。④進化がある。この自然淘汰が繰り返されることで、生物の形質は徐々に変化し、進化していくと考えられます。⑤ダーウィニズムは、現在も生物学の主流な考え方であり、生物多様性を説明する上で重要な理論です。
ダーウィニズムの主なポイントは①進化は自然淘汰によって起こる。生物は環境に適応するために、自然に選ばれて進化する。②進化には方向性や目的はない。偶然の変異が環境に適応した場合にだけ生き残る。③すべての生物は共通の祖先から進化した。ダーウィニズムは、すべての生物が共通の祖先から自然淘汰を経て進化してきたという考え方です。
ダーウィニズムは、現在も生物学の主流な考え方であり、生物多様性を説明する上で重要な理論です。が彼が想像することもできなかったので見逃してしまった極めて大切な二つの視点があります。其の一つ目は環境とは関わりのない「自己変革」と自分の優れた脳の大脳皮質が作り出したAIと言われる人間の大脳が作り出した「人工頭脳」が生命が36億年かけて作り上げてきた優れた頭脳を超える人工頭脳を作るということを夢にも思わなかったことです。この二つの特性は遺伝子が規定した脳の遺伝子が作り出した機能を表現化した遺伝子の発現をはるかに超えた事態を生み出したのです。つまり人間自身の持つ優れた脳の知性が抑制不可能な感情が求める快楽の無限大の肥大化と人間が生み出した人工頭脳が自由自在にどこまで肥大化するのを抑止できないことになります。1850年代に活躍したダーウィンはどの生命体よりも優れた人の大脳の知性の働きが欲望を秘めた感情を制止できないというこの二つの事象がいずれ近いうちに人類を自滅させることになるということには全く気が付かなかったのです。つまり過去の人類を含む生命体の過去の進化しか考慮できなかったのです。ということはダーウィンの未来が実現した現代の遺伝子の進化はだれも予測できなかった事態となってしまったのです。つまりダーウィニズムの一部は最終的には避けることができない間違いであったということになります。
それではもう一つの有名な進化論とされている18世紀から19世紀にかけて活躍したフランスのラマルクの進化論を見てみましょう。
ラマルクの進化論は用不用説と獲得形質の遺伝の2つの柱から成り立ちます。用不用説は、生物が特定の器官を多く使うと発達し、使わないと萎縮するという考え方です。そして、この変化がオスとメスで共通であれば、その変化は子孫に遺伝するというのが獲得形質の遺伝です。ラマルクの獲得形質とは、個体が一生の間に習得した、または環境によって生じた形質を指します。ラマルクは、この獲得形質が子孫に遺伝し、進化の要因になると考えました。しかし、現代の遺伝学では、獲得形質が遺伝するメカニズムは存在しないと考えられています。
1. 用不用説とはラマルクは、生物が環境の変化に適応するために、特定の器官をよく使うと発達し、使わないと萎縮すると考えました。有名な実例としては、キリンは高い木の葉を食べるために首を長くした、モグラは土中で生活するために視力を失ったなど、用不用説で説明できる例を挙げました.
2. 獲得形質の遺伝とはラマルクは、個体がその生涯で獲得した形質(例えば、首の長さなど)が、子孫に遺伝すると考えました.
つまり、親が獲得した形質は、子孫にも受け継がれるため、進化が加速すると考えたのです.
3.ラマルクの進化論とダーウィン進化論や現代の遺伝学との違いは何か?ラマルクの進化論は、ダーウィン進化論や現代の遺伝学と比較すると、いくつかの点で異なる点があります。例えば、獲得形質の遺伝は、現在の科学では否定されています.しかし、ラマルクの進化論は、生物進化に関する初期の重要な理論であり、ダーウィン進化論にも影響を与えました。
NF-κBの説明に戻りましょう。
NF-κBは本来核に行って転写を誘起するものですが、普段はIκBα(アイ・カッパー・ビー・アルファー、Inhibitor of NF-κB α, NF-κBの阻害タンパク質α)と呼ばれる別のタンパク質に妨害されて核に移れず細胞質に留まっています(図3)。
すなわち、普段は機能を発揮できない状態になっています。皆さんの体のほとんどの細胞ではこの状態になっています。細菌感染やヘルペスウイルス等で細胞の外からNF-κB活性化を命令する指令が来てそれを受容体(センサー)が感知する(図3①)とその指令が受容体の近くの細胞質のタンパク質に伝達されます。
不活化 NF-κB を活性化へと導くシグナル伝達には、古典的(Canonical)と非古典的(Non-canonical)の二種類の経路が知られています。 これら二種類の経路に共通する制御機構は、IκBをリン酸化する酵素 IκB キナーゼ(IKK)複合体の活性化です。NF-κB活性化を命令するのは、IKK複合体 (IKKβ, IKKα, NEMO) です。IKK複合体は、炎症誘発性サイトカイン、成長因子、抗原受容体などのシグナルによって活性化され、IκBタンパク質をリン酸化します。リン酸化されたIκBはユビキチン化され、プロテアソームで分解され、NF-κB/Rel複合体を遊離させます。遊離されたNF-κB/Rel複合体は核内移行し、標的遺伝子の発現を誘導することができる転写因子となるのです。
プロテアソームは、細胞内でユビキチン化されたタンパク質を選択的に分解する巨大な酵素複合体です。細胞周期、免疫応答、シグナル伝達など、細胞内タンパク質の恒常性維持に中心的な役割を果たしています。
その数段階の指令伝達の結果、IκBαの中のセリンというアミノ酸の側鎖の水酸基(-OH)にリン酸が付加されます(図3②)。次にこのリン酸の付加が原因でIκBαのリジンというアミノ酸の側鎖のアミノ基(-NH2)にユビキチンという76個のアミノ酸から成るペプチドが鎖状(ユビキチン鎖)に多数付加されます(図3③)。ユビキチン鎖とは、細胞内においてさまざまな役割を果たす、ユビキチン分子が連結した鎖状のタンパク質です。特に、ユビキチンのリジン残基を介して連結された鎖(K48鎖、K63鎖など)は、タンパク質の分解、DNA修復、シグナル伝達など、重要な細胞機能に関与しています。
このようにタンパク質の翻訳が完了した後にリン酸やユビキチンのような分子が付加することを「翻訳後修飾」と言い、リン酸が付加することをリン酸化、ユビキチンが付加することをユビキチン化と言います。重要なことに、このような翻訳後修飾はタンパク質の機能を変化させたりタンパク質のその後の運命が決めるのです。例えばIκBαの場合、ユビキチン化されるとプロテアソームというタンパク質分解を担うタンパク質複合体に基質として認識され急速に分解されて消失します(図3④)。その結果、NF-κBはIκBαによる縛りから解放され核に移行することになります(図3⑤)。核に移行したNF-κBは自身が標的とする遺伝子の発現を誘導し(NF-κBはGGGACTTTCCまたはそれに類似のDNA配列に結合します。したがってこの配列を発現制御配列に持つ遺伝子はNF-κBによって発現誘導されます。(図3⑥))、細胞は増殖したり分化したりしてヘルペスウイルスとの炎症免疫反応等の高次な生命現象を引き起こします。
ユビキチン化とは「ユビキチンが多数鎖状につながって付加されること」と書きましたが、実は鎖のつながり方に幾つかの型があり、型によってユビキチン化されたタンパク質の運命や機能が異なってきます。例えば、プロテアソームによって分解されるためにはK48型鎖がタンパク質に付加される必要があります。一方、NF-κB活性化においてはK63型やM1型と言った鎖も活躍します。IκBαがK48型ユビキチン化されるためにはIκBのリン酸化が必要であることを述べましたが、そのリン酸化を起こすのがIκBキナーゼ(IKK)と呼ばれるタンパク質リン酸化酵素複合体でIKKα, IKKβ, NEMOという3種類のタンパク質で構成されます。IKKは通常不活性化状態ですが細胞外からの指令があると活性化されます。このIKKの活性化は指令依存的に合成されるK63型やM1型ユビキチン鎖が足場となってIKKを含む複数のタンパク質を集合させることで起こります。すなわちNF-κBを活性化する細胞内シグナル伝達は少なくとの3種類の鎖型のユビキチンの連携で稼働していることになります(図3)。
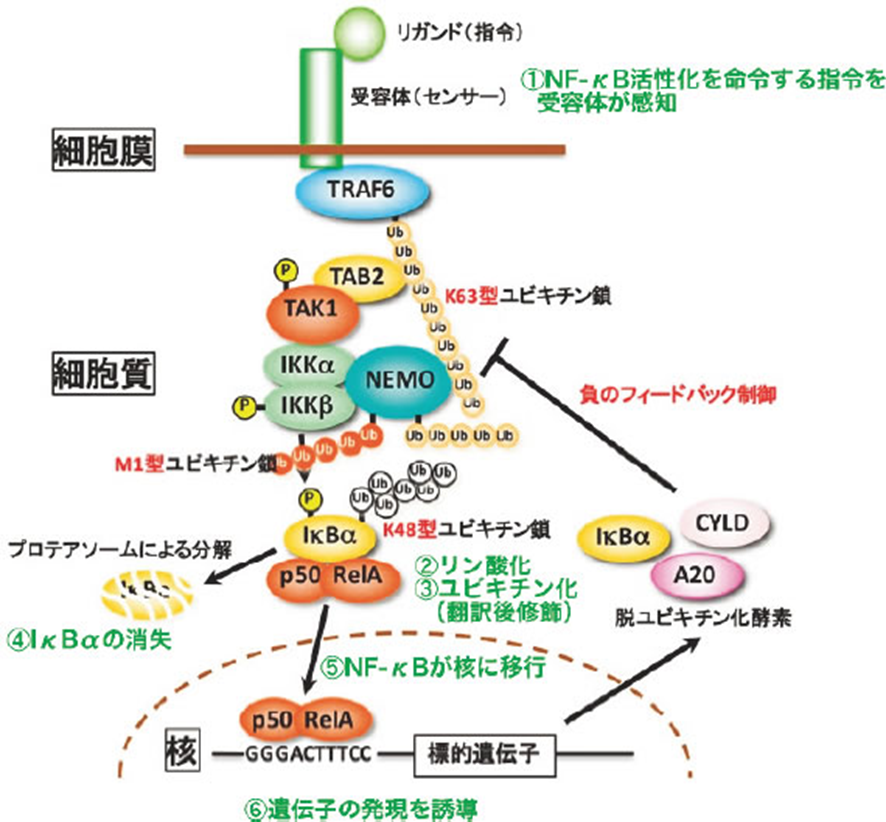
図3 NF-κB活性化シグナルが細胞内伝達される様子。NF-κBはp50とRelAの2量体として描かれている。
翻訳後修飾とは、タンパク質の翻訳完了後に、様々な化学的修飾が加わる過程です。この修飾は、タンパク質の機能、活性、安定性、局在などを調節する重要な役割を果たします。修飾はタンパク質のN末端、C末端、側鎖など、様々な部位で起こりえます。
具体的な翻訳後修飾のタイミングは
①翻訳直後:
多くのタンパク質は翻訳完了直後に修飾を受けます。この修飾は、タンパク質の適切な折り畳み(フォールディング)を誘導したり、特定の細胞領域への輸送に役立ちます。
②折り畳みおよび局在化後:
触媒活性の活性化または不活性化、あるいはタンパク質の生物学的活性への影響など、タンパク質の折り畳みと局在化が完了した後にも、さらに修飾が起こる場合があります。
一般的な翻訳後修飾の種類
- 糖鎖付加:糖鎖がタンパク質に付加されること。
- リン酸化:リン酸がタンパク質に付加されること。
- メチル化:メチル基がタンパク質に付加されること。
- ジスルフィド結合:タンパク質のSH基同士が共有結合を形成すること。
- アセチル化:アセチル基がタンパク質に付加されること。
- その他:翻訳後修飾は多岐にわたり、タンパク質の種類や機能によって様々な修飾が見られます。
翻訳後修飾のユビキチン化とは何か?ユビキチンとは76個のアミノ酸からなる小さなタンパク質で、真核細胞に広く存在します。翻訳後修飾であるユビキチン化とは、ユビキチンという76個のアミノ酸から成り立っている小さなタンパク質が、標的タンパク質に共有結合で付加される反応のことです。この反応は、細胞内で様々なタンパク質の機能や運命を制御するために重要な役割を果たしています。ユビキチン化は、タンパク質の分解、細胞内輸送、シグナル伝達など、多くの細胞内プロセスに関与しています.
ユビキチン化の役割とは①タンパク質の分解:標的タンパク質にユビキチンが結合すると、プロテアソームというタンパク質分解複合体によってタンパク質が分解されるシグナルとなります。②細胞内輸送:ユビキチン化によって、タンパク質の細胞内での移動や輸送経路を変化させることができます。③シグナル伝達:標的タンパク質の機能を変化させることで、細胞のシグナル伝達経路を制御します。
ユビキチン化のメカニズムとはユビキチン化は、E1、E2、E3という3種類の酵素によって触媒される反応です。ユビキチンは活性化酵素(E1)・結合酵素(E2)・リガー ゼ(E3)から構成された複合酵素系(ユビキチンシステム) によって標的タンパク質に共有結合(ユビキチンの C 末端 のグリシン残基のカルボキシル基とタンパク質中のリジン 残基の ε-アミノ基が縮合したイソペプチド結合)する翻訳 後修飾分子(モディファイヤー)です。E1はユビキチンを活性化します.E2はユビキチンを標的タンパク質に結合させます.E3はE2と標的タンパク質の間の結合を促進し、ユビキチン化を制御します.
ユビキチン鎖とはユビキチンがリシン残基を介して連結して形成される鎖状構造で、ユビキチンコードとして機能し、様々な細胞内機能に影響を与えます.モノユビキチンとは一つのユビキチン分子が標的タンパク質に付加された状態.ポリユビキチン鎖とは複数のユビキチン分子が連結した状態.
翻訳後修飾のまとめは翻訳後修飾は、タンパク質の翻訳完了後から、その蛋白の機能発現や活性調節まで、タンパク質の生涯にわたって影響を与える重要な過程です。
NF-κBは”健康”に必須、でも”がん”でも活躍するのは癌はヘルペスが「増殖関連遺伝子」を変異させて「増殖過剰遺伝子」変異させて生まれた細胞であって癌細胞はこの世に存在しません。あくまでもNF-κBはヘルペスを退治するために炎症を起こすのですがヘルペスが細胞内や核のゲノムDNAの自由自在に選んだ部位に特異的に侵入してDNAの組み換えをもたらす変異を起こす組み込みを起こす形で感染してしまうとNF-κBの転写因子の発現によって生まれた蛋白も全く役に立たないのです。
正常細胞では、敵である病原体であるherpesウイルスが前述のように細胞内に隠れてしまうのでNF-κBは常時働く必要もないので、指令が来ない限り活性がなく細胞質に係留されています。指令が来ると活性化されるのですが、正常細胞では指令が無くなれば元の状態(活性がなくNF-κBが細胞質に係留された状態)に戻ります(図4:正常な活性化)。どうやら、がん細胞ではこのようなNF-κBのコントロールが破綻してしまっていて、指令がないのにNF-κBが活性化してしまい(図4:恒常的活性化)、そのためにがん細胞ができたり、またできた存在しない癌細胞が悪性化することもないのでがん細胞ではこのようなNF-κBのコントロールが破綻してしまっているのではないので恒常的活性化という言葉はあり得ないのです。そもそも人間を病原体から守るために36億年かかって進化した免疫の遺伝子によってつくられた転写因子である蛋白質が癌を作ると思いますか?アッハッハ!!転写因子とは転写因子はタンパク質です。遺伝子の発現を制御するタンパク質で、ゲノムDNA上の特定の配列を認識して結合し、転写の開始・停止を調節します.
転写因子はDNA上の特定の塩基配列(プロモーター領域など)に結合することで、RNAポリメラーゼがDNAからmRNAを転写するのを促進したり、阻害したりします. このタンパク質の機能によって、遺伝子の発現が制御され、細胞の様々なプロセスが調節されます. 転写因子は何種類ありますか?ヒトなどの高等動物には、約2,000種類の転写因子が存在しており、多くの場合、転写因子同士は相互作用して複合体タンパク質を形成します。 この複合体は非常に動的で、組織特異的な遺伝子の発現に重要です転写因子は、ホメオドメイン、ジンクフィンガー、塩基性へリックス・ループ・へリックスなどのファミリーに分けられ、それぞれのファミリーに属する転写因子は、異なるDNA結合ドメインの構造モチーフを持っています. NF-κBは、Relファミリーに属する転写因子です。このRelファミリーは、RelA (p65)、RelB、c-Rel、NF-κB1 (p50)、NF-κB2 (p52)の5つのタンパク質で構成されています。これらのタンパク質は、二量体を形成して転写活性化因子として機能します。転写活性化因子と転写活性因子の違いとは「転写活性化因子」と「転写因子」は、どちらもDNAからRNAへの転写を制御するタンパク質ですが、転写活性化因子は、転写を促進する作用を持つ転写因子のサブセットを指します. 転写因子は、より広い概念で、転写を促進(転写活性化因子)または抑制(転写抑制因子)するタンパク質を指します.転写因子 (transcription factor)とはDNAに結合し、転写を調節するタンパク質の総称です. 転写活性化因子(transcription activator)とは転写を促進する作用を持つ転写因子のサブセットです. 転写活性化因子は、DNAに結合することで、RNAポリメラーゼが転写を開始しやすい状態を作り出し、転写を促進します.転写抑制因子 (transcription repressor)とは転写を抑制する作用を持つ転写因子のサブセットです. 転写抑制因子は、RNAポリメラーゼが転写を開始するのを阻害することで、転写を抑制します.NF-κBは、DNA上の標的遺伝子のプロモーターに結合し、遺伝子発現を制御する転写活性化因子として作用します。
NF-κB機能とはNF-κBは、炎症反応、免疫応答、細胞増殖、細胞死など、さまざまな細胞プロセスに関与しています。
NF-κBの活性化は、ストレス刺激、サイトカイン、病原体などによって誘導され、炎症性遺伝子の発現を促進します。NF-κBの異常な活性化はありえません。
癌が起こるのは転写因子であるNF-κBが恒常的活性化するという漫画チックな現象でありあり得ないのです。病原体であるherpesが癌細胞(増殖過剰細胞)に変えない限り癌細胞は生まれることは100%無いのでこれは大きな間違いです。医学論文では「どうやら」とか「~とされています」などのあいまいでかつ、あてずっぽうな曖昧な自信の無い言葉は使うべきではないのです。というよりも癌細胞はこの世に存在しない上にヘルペスが作り上げた「増増殖過剰細胞」にすぎないのです。また、NF-κBが標的とする遺伝子の中には、NF-κBの活性化に重要な役割を果たすK63型やM1型のユビキチン鎖を分解してNF-κB活性化を抑えるタンパク質(脱ユビキチン化酵素)を作るものがあります。このようにあるものが活性化したことでそれを抑える物質作ってその活性化を抑えて制限することを「負のフィードバック制御」(図3)と言いますが、これが何かの原因で機能しなくなると活性化の程度が亢進するとともに持続時間も延長されます。このような状態を過剰な活性化と言いますが、過剰なNF-κBの活性化は過剰な炎症反応を誘起し、がんを含むいろいろな病気の原因と成ります(図4:活性持続性の延長または最大活性の増大)と言われますが嘘です。
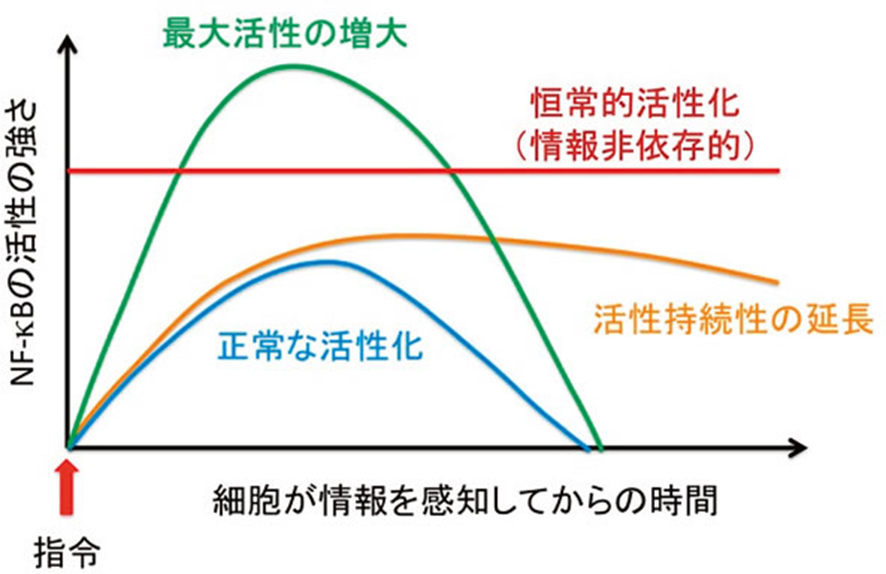
図4 正常なNF-κB活性化シグナルと疾患発症につながる異常なNF-κB活性化シグナル
研究者という仕事に興味がある人へ
NF-κBの主な役割をまとめます。
1、ヘルペスの働きを抑制する免疫応答でありNF-κBは、炎症反応や免疫応答において中心的役割を果たす転写因子の一つです。ヘルペスウイルス病原体や損傷細胞などを認識した時に活性化され、炎症性サイトカインの産生を誘導し、免疫細胞を活性化させることで、体内の防御に関わります.
その他:①ヘルペスを攻撃する炎症反応の亢進②herpesを攻撃する様々なサイトカイン産生③herpesを排除できるヘルパーT細胞やキラーT細胞の活性化とヘルペスウイルスを認識して殺す抗体を作るB細胞などの活性化です。ヘルペスが感染した細胞を生存させ新旧の細胞を入れ替えるための細胞の増殖と分裂の手助けやヘルペスが感染して癌細胞(増殖過剰細胞)をアポトーシスさせたり、腫瘍形成を抑制します。癌細胞は存在しないので癌細胞はヘルペス性増殖過剰細胞というべきなのです。
2、遺伝子の発現であり①herpesを殺す炎症関連遺伝子の発現、②新旧の細胞を入れ替えるための細胞増殖遺伝子の発現、③組織の細胞内で増えたherpesによって細胞集団がばらばらに剥がれないようにしてくれる細胞接着遺伝子の発現も誘導します。
3、NF-κBの活性化①NF-κBは、herpesに対して免疫を上げる細胞内の刺激となるサイトカインや、紫外線照射によって活性化されます。活性化すると、細胞質から核内に移行し、遺伝子の発現を行いherpes制御します。NF-κBとIF-αの両者は免疫応答において連携してherpesを殺すのです。
4、NF-κBとヘルペスが起こす疾患との関連については①最後に残った危険信号となるherpesウイルスを感知した自然免疫はNF-κBの活性化をもたらし、ヘルペスが原因である自己免疫疾患の関節リウマチ、多発性硬化症などの病名となる原因であるヘルペスとの戦いを始めます。②正常な細胞を増殖過剰症(いわゆる癌細胞)を引き起こすherpesの増殖、生存、転移などに関与すると言われますが癌細胞はもともと存在していないので癌細胞の増殖、生存、転移するという現象はあり得ないのです。増殖、生存、転移し続けるのは無数のヘルペスウイルスの子供たち(ビリオン)なのです。しかも「原発性癌」も存在しないのです。癌そのものが存在しないのにどうして「原発性癌」や「癌遺伝子」も「癌死」もあるわけはないでしょう。言うまでもなくリンパ管性に血行性に原発性の癌が転移して転移癌となることもないのです。この世に存在するのはすべてヘルペスウイルスが生み出した現象だけです。まずこの医学界から「癌はない」と宣言するだけ世界中で命拾いする人は無限大になることでしょうに。残念です。
5、感染症については大物のヘルペスウイルスのみならず他の小者の病原体との戦いの炎症反応を治癒させるための症状を出しながら完治させる上で重要な役割を果たします。
NF-κBの活性化
1、古典的経路
転写因子NF-κBの活性化機構(古典的経路)。
NF-κBは、細胞質で阻害タンパク質(IκB)に結合して不活性な状態で存在しています。しかし、細胞内外からの刺激(TNF-α、IL-1β、LPSなど)によって、IκB kinase(IKK)複合体が活性化し、IκBをリン酸化し、分解することで、NF-κBが細胞質から核へと移行し、遺伝子の発現を制御します.
阻害タンパク質であるIκBが外れるとNF-κBは核内へと移行し、DNAと結合することが可能となりNF-κBは転写因子の働きが核に移行することで活性化されます。
不活性なNF-κBは細胞質に優位に存在し、阻害タンパク質であるIκB (Inhibitor κB) と結合することによりその活性を抑制されている。しかし、病原体からの刺激であるリポ多糖(LPS)や、大食細胞からのTNF-αやIL-1や活性酸素によりIκBαのセリン残基をリン酸化する酵素複合体であるIκBキナーゼ (IKK) が活性化されるとIκBαはタンパク質分解酵素複合体であるプロテアソームにより分解を受ける。IKK複合体はIKKα、βおよびγ (NEMO) の各サブユニットから構成されている。この分解によりIκBαによりマスクされていたNF-κB (p50-RelA) の核内移行シグナルが露出し、核に移行できるようになる。その後、NF-κBはDNA上のκBモチーフ (GGGACTTTCC) と呼ばれる配列に結合し、目的遺伝子の転写活性化を行う。活性酸素は、体内に侵入した細菌やウイルスを攻撃する働きがあります。
2、非古典的経路
細胞への刺激により活性化したNIK (NF-κB Inducing Kinase) はIKKαから構成される酵素複合体を活性化し、p100-RelB複合体を限定分解へと導く。これにより産生されたp52-RelB NF-κBを活性化する分子
古典経路ではIL-1、TNF-α、LPS、活性酸素
非古典経路ではCD40L、BAFF、RANKL、LTβはDNAに結合し、転写活性を示す。
3、NF-κBを活性化する分子
古典経路①IL-1②TNF-α③LPS④活性酸素
非古典経路①CD40L②BAFF③RANKL④LTβ
4、NF-κBにより転写が活性化される分子①IL-1②IL-2③IL-6④IL-8⑤IL-12⑥TNF-α⑦COX2⑧VCAM⑨ICAM
5、疾患における役割
NF-κBは真核生物の細胞に広く分布し、細胞の増殖や生存に関与している。腫瘍細胞はヘルペスによって生まれたのでNF-κBが恒常的な活性化を受けて腫瘍細胞を殺そうとしているのです。
NF-κBは、サイトカインやストレスなどの刺激に対する細胞応答に関与する転写因子で、感染に対する免疫応答の重要な役割を果たしています。未刺激の細胞において、NF-κBダイマーは、IκBにより核移行シグナルを覆われることで不活性化され、細胞質に局在しています。IκBキナーゼ(IKK)によりIκBがリン酸化されると、IκBがユビキチン化され、分解されます。これにより、NF-κBの核移行シグナルが露出し、NF-κBは核内に移行できるようになり、遺伝子発現を行う転写因子です。
NF-κB(エヌエフ・カッパー・ビー、核内因子κB、nuclear factor-kappa B)は転写因子として働くタンパク質複合体である。免疫グロブリンκ鎖遺伝子のエンハンサー領域に結合するタンパク質として発見され、動物のほとんど全ての細胞に発現している。
NF-κBはストレスによるherpesの増加や免疫関連サイトカイン、紫外線等の刺激により活性化される。NF-κBは免疫反応において中心的役割を果たす転写因子の一つであり、ヘルペスによる急性および慢性炎症反応や細胞増殖、アポトーシスなどの数多くの生理現象に関与している。NF-κB活性の不良はヘルペスによるクローン病や関節リウマチなどの炎症性疾患をはじめとし、herpesによる癌や敗血症性ショックなどの原因となり、特に悪性腫瘍では多くの場合NF-κBの恒常的活性化が認められる。敗血症性ショックとは、敗血症のために危険な水準まで血圧が低下している状態(ショック)です。 その結果、肺、腎臓、心臓、脳などの内臓に、多くの場合十分な血液が供給されなくなり、結果、内臓が機能不全に陥ります。敗血症とはなんらかの感染症を起こしている細菌やherpesウイルスなどが現代医療の間違った特技であるステロイドなどの免疫を抑える治療訳の投与の結果、ヘルペスや他の病原体が増殖しすぎ、炎症を起こし続けて、臓器に激しい炎症による障害が発生し引き起こされる免疫が敗北した状態でいわば医原病の一つと言えます。
転写因子関連用語集
①転写 – RNAポリメラーゼによってDNA をmRNAにコピーすること
②因子 – 特定の生化学反応や身体過程に係わる物質であるタンパク質を因子と言います。因子は蛋白質です。転写因子の因子も「転写蛋白質」です。
③転写制御 – RNAポリメラーゼのDNAへの結合を促進あるいは阻害して、遺伝子転写の速度を調節すること
④活性化 または 促進 – 遺伝子転写速度を上昇させること
⑤抑制 – 遺伝子転写速度を下降させることであって、遺伝子転写を止めることではないのです。
⑥補助活性化因子 またはコアクチベーター – 転写因子と共役して働き、遺伝子転写速度を上昇させるタンパク質
⑦補助抑制因子 またはコリプレッサー – 転写因子と共役して働き、遺伝子転写速度を下降させるタンパク質
NF-κBを活性化する経路には古典経路と非古典経路の2つがあります。
古典的経路
NF-κBの活性化機構(古典的経路)。IκBが外れるとNF-κBは核内へと移行し、DNAと結合することが可能となる。不活性なNF-κBは細胞質に優位に存在し、RHDを介してアンキリンファミリーに属する分子であるIκB (Inhibitor κB) と結合することによりその活性を抑制されている。しかし、何らかの刺激(リポ多糖、TNF-α等)によりIκBαのセリン残基をリン酸化する酵素複合体であるIκBキナーゼ (IKK) が活性化されるとIκBαはタンパク質分解酵素複合体であるプロテアソームにより分解を受ける。IKK複合体はIKKα、βおよびγ (NEMO) の各サブユニットから構成されている。これによりIκBαによりマスクされていたNF-κB (p50-RelA) の核内移行シグナルが露出し、核に移行できるようになる。その後、NF-κBはDNA上のκBモチーフ (GGGACTTTCC) と呼ばれる配列に結合し、目的遺伝子の転写活性化を行う。
非古典的経路
細胞への刺激により活性化したNIK (NF-κB Inducing Kinase) はIKKαから構成される酵素複合体を活性化し、p100-RelB複合体を限定分解へと導く。これにより産生されたp52-RelBはDNAに結合し、転写活性を示す。
NF-κBを活性化する分子。Herpesや時に細菌との出会いがNF-κBを活性化します。
NF-κBを活性化する経路には古典経路と非古典経路の2つがあります。詳しく説明します。
①古典経路ではIL-1、TNF-α、LPS、活性酸素がNF-κBを活性化する分子の代表です。IL-1とは、最初に見つけられたインターロイキンですからIL-1とよばれます。関節リウマチや自己免疫疾患、炎症性腸疾患、癌など、さまざまな病気の病態形成に関与しているのは関節リウマチや自己免疫疾患、炎症性腸疾患、癌のすべてはヘルペスが原因であるからです。ヘルペスと最初に戦うので一番偉いIL-1と言う名前をもらったのでしょう。IL-1は、マクロファージ、単球、樹状細胞、好中球、T細胞、B細胞、血管内皮細胞など、様々な細胞によって産生されます。特に、マクロファージ系の細胞から多く産生されます。 特に、関節リウマチでは、関節滑膜細胞で高レベルのIL-1が産生され、関節の破壊や炎症を引き起こすことが知られている関節リウマチの原因はヘルペスウイルスであるからです。
TNF-αとは、Tumor Necrosis Factor alpha(腫瘍壊死因子アルファ)の略で、炎症や免疫反応に関わる最も重要なサイトカインの一つです。腫瘍細胞の壊死を誘導する因子として発見されたのがTNF-αなのです。TNF-αは癌細胞つまりヘルペス感染細胞も殺すことができるのです。現在は、ヘルペスは幹細胞を持つあらゆる人体の細胞に感染するので炎症、免疫、細胞死など、ウイルス感染に関わる幅広い生物学的免疫学的プロセスに関わります。TNFαは、マクロファージやリンパ球などから産生され、炎症反応の促進や細胞の死(アポトーシス)を誘導します. 過剰に産生されると、自己免疫疾患である関節リウマチや乾癬などや、敗血症などの炎症性疾患を起こすのはヘルペスなので殺し切れないのでTNFαは過剰に産生されるのです。
TNFαは、ヘルペスは幹細胞を持っている細胞のすべてに感染するので細胞の増殖や分化、脂質代謝などにも影響を与え、様々な疾患に関与しているのです。実は脂質代謝異常もヘルペスが起こした病気なのです。その根拠を述べましょう。血液中には脂質として、コレステロール、中性脂肪、リン脂質、遊離脂肪酸の4種類があります。
これらの脂質代謝異常や炭水化物代謝異常(糖尿病)の真実の原因は何でしょうか?非常に混とんとした現代を犯罪を犯さずに真面目に生き続けるために食べるためのお金を稼ぐためにストレスが毎日かかって生活習慣の乱れが生まれ、ストレスを解消するために気を紛らそうとして、高カロリー、高脂肪の食事、運動不足、肥満、喫煙、アルコールの過剰摂取が脂質代謝異常の主な原因となります。また、ストレスがかかればかかるほど免疫が落ちてヘルペスウイルスが知らぬ間に増えてしまい、すべての細胞に感染できるのであちこちの細胞でherpesが増えてしまいその結果TNFαは過剰に産生されてしまいます。またヘルペスが膵臓のランゲルハンス島のインシュリンホルモンを産生するβ細胞に感染してインシュリン産生が落ちてしまいかつβ細胞が減ってしまうのでインスリン抵抗性を悪化させ高血糖となり糖尿病となってしまうのです。詰まり糖尿病の原因もヘルペスが強いストレスが続いてヘルペスが膵臓のランゲルハンス島のインシュリンホルモンを産生するβ細胞に感染して起こった病気なのです。膵臓のβ細胞とは一体何でしょうか?一般的に幹細胞とは異なる専門化した細胞です。β細胞は膵島でインスリンとアミリンを合成・分泌する細胞であり、糖尿病などの疾患では機能が低下することがあります。しかし、β細胞は幹細胞とは異なり、自己複製能力は持たないと考えられています。膵臓のβ細胞を再生させるための研究は進められており、幹細胞やiPS細胞からβ細胞を生成し、移植することで糖尿病を治療する試みが行われています。しかし、これらは幹細胞を直接的にβ細胞に変換するのではなく、β細胞に分化誘導された細胞を移植する形での治療です。アミリンは、インスリンと共に膵臓のβ細胞から分泌されるペプチドホルモンです。血糖値の調節や食欲抑制に作用し、特に食後の血糖値の上昇を抑制する役割があります。アミリンの作用は、胃からの食べ物の排泄を遅らせ、グルカゴン分泌を抑制し、食欲を抑制する働きがあります。これにより、食後の血糖値の上昇を穏やかにすることができます。アミリンは、インスリンと共に膵臓のβ細胞から分泌されます。インスリン:アミリン比は約100:1です。アミリンと2型糖尿病との関係は2型糖尿病患者では、アミリンの分泌が低下しており、食後の血糖値の上昇がより大きくなる傾向があります。
ヘルペスが感染して生まれた癌細胞(増殖過剰細胞)を壊死させるTNFαの働きを抑制する薬は、この世に存在しない自己免疫疾患である関節リウマチや尋常性乾癬などの治療に用いて、癌を増やし、かつherpesを増やしてしまうので現代医療は癌を作って自己免疫疾患という病気を作ってお金を儲ける世界が現代の医療界なのだと断言できます。悲しですね。抗TNFα抗体製剤は、TNFαの作用を阻害することで、炎症を抑える効果がありますが.癌を作ることになります。
②非古典経路ではCD40L、BAFF、RANKL、LTβが。CD40L(CD40リガンド)とは、主に活性化T細胞に発現するタンパク質で、TNFスーパーファミリーに属します。B細胞がもつCD40に結合することでB細胞の増殖や活性化、抗体産生などを促進し、T細胞依存的な免疫応答に重要な役割を果たします。BAFFとはB細胞活性化因子 (B-cell activating factor) の略で、免疫系で重要な役割を担うサイトカインの一種です。BAFFの主な役割は BAFFは、B細胞の生存と成熟、そしてB細胞から形質細胞への分化を促進します. RANKLとはReceptor activator of nuclear factor-kappa B ligandです。破骨細胞の分化と成熟を促進して貪食作用を持たせるためです。する重要な分子です。破骨細胞は、骨を吸収する細胞であり、骨リモデリング(骨の再構築)において重要な役割を果たします。破骨細胞は、骨を吸収し、壊す役割を担う細胞であり、ヘルペス感染症、特にherpesによる骨髄炎の発症において重要な役割を果たします。破骨細胞はマクロファージの一種であり、骨髄に感染したヘルペスウイルスを貪食する作用があります。破骨細胞は骨を分解するだけでなく、herpesのみならず細菌や死細胞などを貪食消化する機能も持ちます. 破骨細胞は酸を分泌して骨のミネラルを溶かし、加水分解酵素を分泌して骨のコラーゲンを分解することで骨吸収を促進します.と同時にマクロファージと同じく加水分解酵素を分泌してherpesをも殺します。ヘルペス性骨髄炎では、破骨細胞の過剰な活性化が、骨破壊や炎症を進行させ、感染症の悪化を招くことがあるのはヘルペスは破骨細胞のゲノムDNAに隠れてしまうから殺し切れないからです。
NF-κBにより転写が活性化される分子。これらはHerpesとの戦いで用いられる武器です。
IL-1、IL-2、IL-6、IL-8、IL-12、TNF-α、COX2、VCAM、ICAM
疾患における役割
NF-κBは真核生物の細胞に広く分布し、細胞の増殖や生存に関与している。多くのherpesにより生ずる腫瘍細胞ではNF-κBが恒常的な活性化を受けているのは当然です。それはNF-κB は病原体である細菌やウイルスと炎症を起こして殺すためです。しかし残念ながら細胞のゲノムDNAにヘルペスが溶原感染で隠れてしまうと免疫は手も足も出せなくなるのです。NF-κB が活性化されて上のNF-κBにより転写が活性化される分子 IL-1、IL-2、IL-6、IL-8、IL-12、TNF-α、COX2、VCAM、ICAMのすべての炎症性の分子は活性化されても細胞内のゲノムDNAに侵入してしまったherpesには何の役にも立たないのです。
逆にNF-κBを阻害することにより細胞増殖を抑制してもherpesはherpesを殺すわけではなく、かつ細胞増殖もないのでherpesも増殖できないので抗がん剤への感受性が増大するように見えているだけです。このようなことより、NF-κBは癌の化学療法におけるターゲットとして注目されているのは大間違いです。NF-κBはその他にも炎症性腸疾患、関節炎などの自己免疫疾患の病態形成に関与しているように見えるのもNF-κBはヘルペスとの炎症に関わっているからです。NF-κBは敗血症などの疾患にも関わっていると言われるのも敗血症の原因にも殺し切れないヘルペスが関わっているからです。敗血症とは、ヘルペス感染症などによって全身の臓器に障害が起こり、生命を脅かす重篤な病気で、原因は細菌などの病原微生物に感染し、その毒素によって炎症を起こすと言われていますがherpesは毒素によって炎症を起こすわけでもないので、生命を脅かす重篤な病気である敗血症がherpesで生ずるのは何故でしょうか?herpes感染症のことは現代の医学は一切考えないので抗herpes剤を使わないで他の抗生物質を大量に使っている間にherpesビリオンはどんどん増えているので増えた莫大なherpesビリオンが5大栄養素や核酸の材料やエネルギーを細胞から奪い取ってしまいます。しかも増えたherpesビリオン粒子は新たなる細胞にものすごい勢いで感染していくので免役細胞のみならずあちこちの臓器の細胞にもヘルペスが感染してしまい全身の栄養不良状態が起こり臓器不全になってしまうのです。敗血症の症状は大量のherpes感染で見られる①高熱、②悪寒、③ふるえ、④頭痛、⑤全身の疼痛や不快感、⑥冷たく湿潤した皮膚、⑥意識低下、⑦息切れ、⑦頻脈などが出現します。敗血症の臓器障害には①心臓、②肺、③腎臓など生命に関わる主要な臓器の機能が低下する。敗血症の治療は抗菌薬や手術による病原微生物の除去、人工呼吸器や透析などの高度な医療機器を用いた治療が行われます。
NF-κBの言葉の成り立ちについて
NF-κB(エヌエフカッパービー)は、核内で働くタンパク質(Nuclear Factor)で、免疫反応や炎症反応など、様々な生命現象に関わる重要な転写因子です。特に、活性化B細胞のκ軽鎖エンハンサーに結合して発見され、その名で呼ばれています。
NF-κBの主な意味をまとめると、NFはNuclear Factor(核内因子)で 核内で働くタンパク質であることを示します。κはKappa であり κは抗体(免疫グロブリン)の構成タンパク質であるκ軽鎖を指し、B細胞(抗体産生細胞)の関連性を示唆します。BはB細胞 のことで 抗体産生に関与するB細胞と関連があることを示します。
NF-κBは、細胞内シグナル伝達経路を介して活性化され、核内に入って遺伝子の発現を制御します。NF-κBは、様々な刺激(サイトカイン、ストレスなど)によって活性化され、炎症や免疫応答を誘導します。
