ALSとは何か?ALSという病気の名称のいわれについてとALSの意味について。ALSは治る病気です。何故ならばALSの原因もヘルペスウイルスであるからです。癌もherpesが原因です。
ヘルペスウイルスウイルスが運動野にある運動神経細胞(上位ニューロン)の細胞体と脊髄の前角にある神経細胞(下位ニューロン)の中枢の二種類の神経細胞体に感染してヘルペス性の脳変性疾患中枢神経変性疾患となってしまったのがALSなのです。脳変性疾患とは、ヘルペスが長い期間潜伏感染状態で生き続けてかつ分裂増殖し近隣の脳細胞に感染していく間に脳や脊髄の神経細胞体は栄養素やエネルギーを奪われてしまい徐々に疲弊してしまい栄養失調になって神経細胞の正常な細胞小器官も形態も作れなくなり運動機能も失われていくことで、認知症や運動障害などの症状を引き起こす病気です。増えたヘルペスはいつの間にか大脳の連合野にも感染して認知症などのヘルペス性の脳神経変性疾患が拡大していくのです。ヘルペス性の脳神経変性疾患には、次のようなものがあります。
①アルツハイマー病②パーキンソン病③筋萎縮性側索硬化症(ALS)④ポリグルタミン病(ハンチントン病、脊髄小脳失調症)⑤多系統萎縮症⑥進行性核上性麻痺。 ポリグルタミン病とはポリグルタミン病は、遺伝子内のグルタミンというアミノ酸をコードする塩基配列の繰り返し数が増加することで発症する神経変性疾患です。ハンチントン病、球脊髄性筋萎縮症、複数の遺伝性脊髄小脳失調症(SCA2、SCA3、SCA6、SCA7、SCA17)などが含まれます。SCAはSpinocerebellar Ataxia Typeで日本語は脊髄小脳失調症です。 ポリグルタミン病の症状は、脳や脊髄などの特定の領域の神経細胞が徐々に脱落することで徐々に進行していきます。神経細胞が徐々に脱落する症状はヘルペスが感染細胞から栄養素を奪い取ったために変性させ最後は神経細胞を生きられなくしてしまったからです。主な症状には、物忘れ、手足が勝手に動いてしまう(舞踏運動)、手足のふるえ、歩行時のふらつき、 手足の力が入らないなどです。 球脊髄性筋萎縮症とは球麻痺は、延髄にある脳神経核が障害されることで起こる症状で、延髄の外側がボールのように丸い形をしていることから「球」と呼ばれています。 球麻痺の症状には、次のようなものがあります。①構音障害(呂律が回らない)②嚥下障害(食べ物、飲み物の飲み込みが悪くなる)③呼吸や循環の障害
球麻痺の原因としては、次のようなものがあります。①ALS(筋萎縮性側索硬化症)②先天性核上性球麻痺(ウースター・ドロート症候群)
また、脳もしくは口や喉の付近の運動に関わる脳神経の障害によって構音障害が生じた場合は、大脳皮質・皮質下、そして橋に原因がある場合は仮性球麻痺と呼ばれます。
ポリグルタミン病の根本治療法はまだ確立されていませんが、近年病因遺伝子が同定された後その病態解明が急速に進歩していてヘルペスが病因遺伝子を変異させたことに気が付かなければポリグルタミン病の根本治療法は不可能です。
ヘルペスが原因となる神経変性疾患の症状は、上記に述べたように徐々に進行していきます。ヘルペスが感染した脳神経の機能の種類によって様々な症状が見られます。力が入らない、スムーズに体が動かせない、ふらつく、呂律が回らない、 認知機能低下などです。
神経変性疾患の原因はヘルペス感染によるのですが、発症や進行を抑える治療法はほとんど存在していないのは神経変性疾患の原因はヘルペス感染であることを認めないからです。対症療法が行われており、パーキンソン病に対するドーパミン補充が代表的な例ですが私が行っている抗ヘルペス剤投与は根治原因治療ですからで治すことができるのです。私は何人も治しました。
脳で「口や手を動かしたい」と考えると、大脳の運動野の中の運動神経細胞(上位ニューロン)からその運動の命令が神経線維を伝わって下りてきて(この線維の束を延髄の錐体を通るので錐体路といいます)、脳幹あるいは脊髄で次の神経細胞(下位ニューロン)に命令を伝えます。
本来ALSが起こる経路は脳幹とは関係がありません。脳幹と関わる経路は錐体路ではなく錐体外路であり、錐体路以外の運動指令を行うための経路で、脳幹から命令が発生して脊髄に向かって運動線維を伝えることはできます。筋緊張や筋群の協調運動を反射的、不随意的に行う役割を担っているのでALSとは直接関わりがないのです。そしてこの命令は実際に口や手につながっている下位ニューロンの神経線維を伝わって行き、筋肉にも達します。錐体外路症状の原因としては、脳幹(中脳と橋と延髄)にある黒質で作られる神経伝達物質であるドーパミンがやはりヘルペスが黒質に感染して黒質の崩壊脱落によって引き起こされる障害によってドーパミンが作れなくなるとパーキンソン病になります。黒質のドーパミンの不足は運動をスムーズにするための神経回路の調節能力を低下させ、線条体(運動に関係する組織)からの指令が正しく筋肉に伝わらなくなることで症状が現れるので原因は同じヘルペスでかつ病気のメカニズムも同じなので神経変性疾患の一つであるのですがALSとは別の病気です。
ALSで障害される場所は、命令の乗り換えの場所(前角細胞)から始まる下位ニューロンと、脳から下りてくる上位ニューロンの両方です。両方が障害されると、結果的に筋肉を動かすことが出来なくなってしまいます。 ニューロン(神経単位)とは、脳を構成する神経細胞のことで、神経単位とも呼ばれます。細胞体、軸索、樹状突起の3つの部分からなり、それぞれ次のような役割を担っています。①細胞体は核が存在する部分②樹状突起はニューロンの入力部位で、木の枝のように分岐した短い突起が伸びている③軸索は細胞体からの信号を他のニューロンに伝える出力用繊維で、長い一本の突起が伸びている。
ニューロンは、脳と体の伝達を可能にするために、電気信号として感覚情報と運動指令を中継しています。 脳のニューロン(神経単位)は100億から1000億程度あるといわれています。
ALSの意味ですが、Aはアミオトロフィック(Amyotrophic)の略で筋肉が縮むこと(筋萎縮)を云い、一般にこの病気が略してアミトロと呼ばれるのはここから来ています。Lはラテラール(Lateral)の略で側部を意味し、脳から下りてくる上位ニューロンの束(錐体路)が脊髄の左右の側面(側索という場所)を通ることから来ています。つまり側索は、脳から脊髄に運動をするようにという命令が下りてくる通り道のことなのです。Sはスクレローシス(Sclerosis訳して硬化)の略で神経細胞が壊れて脱落したあとが硬くなって働かなくなってしまうという意味です。したがって、ALSは筋肉自身の病気ではないし、手足に行っている細かい神経の病気でもありません。主に脊髄と脳の運動神経細胞が変性し、脱落するために起こるものです。その結果、運動神経の命令が伝達できなくなって手が握れなくなる、舌がしわしわになって呂律が回りにくい、飲み込みにくい、立ち上がりにくい、歩きにくいなどという症状から始まり、筋肉が使えなくなって廃用萎縮となり徐々に手足が痩せていくことになります。 廃用萎縮とは廃用性萎縮とも言われ、寝たきりや安静状態が長期にわたって続くことで筋肉や関節などが使わなくなると萎縮することを意味する医学用語です。また、長期間の安静状態や運動量の減少により身体機能が衰え、心身の様々な機能が低下してしまう状態を「廃用症候群」や「生活不活発病」といいます。
一般的には、はじめに手足が動きにくくなるタイプと、しゃべったり飲み込んだりという、口の中が先に動かなくなるタイプとがあります。手足から先に動きにくくなる場合が4分の3くらい、4分の1くらいの方は口から始まります。最終的には手足と口の両方に障害が進みます。
ALSという病気の概略を続けます。中枢の運動神経の命令は脊髄の側索を伝わって来て、前角で一度神経を乗り換えて手足に行っています。脊髄の真ん中から左右の下側あたりに広がっている部分を前角といいます。ALSの脊髄の頸髄で、側索がかなり白くなるのは、運動ニューロン (神経単位)が壊れて硬くなっているからです。正常な人では脊髄の前角は蝶の羽を広げたように大きく左右に広がって見えますが、患者さんでは白くなって縮んできているのが分ります。脊髄全体の太さも、細くなって小指くらいになってきています。
ALSという病気の筋肉の横断面を染色して比較したものです。正常な方の筋肉は、同じ太さの細い筋肉の束(筋線維)が集まっているのが分かります。ALSの方の筋肉はひとまとまりの筋線維(筋細胞)がグループになって細くなっています。正常なところも残っていますが、集団で細くなったところはさらに細くなって壊れていってしまうので、力が出なくなります。もし、筋肉自身に何か問題があるなら、いいところも悪いところも全体的にバラバラにいろいろな太さの筋線維が見えるはずですが、筋肉に命令を伝えている神経はグループの筋線維を支配しているので、もし神経が壊れるとその先にある筋線維のグループが廃用萎縮して細くなり、筋肉は縮んでいくことになります。
症状の典型的なパターンとしては、どちらかの足の力がだんだん弱くなってきて、反対側の足に広がり、次に手の力がなくなってくるというものと、手から始まって徐々に足に広がるものがあります。しかも手足では、からだから遠い部位の筋肉の力がまず弱くなってきて痩せて来ます。そして、そのうちに食物を飲み込みにくくなってくる、しゃべりにくくなってくる、という症状が出てきて、からだ全体の筋肉の力が2~4年くらいで弱くなるために息苦しさを感じるようになります。さらに進行すると、呼吸が困難になり、人工呼吸器をつけるというのが一般的な経過です。また、手足の力がなくなるのと同時くらいに言語障害、飲み込みが悪くなるという場合もあります。言葉をしゃべる時にも筋肉を使うのですが使えなくなると喋りにくくなり言語障害が出てきます。
ALSは全身が動きにくくなる病気ですが、出にくい症状というものが6つほどあります。そのうち4つを4大陰性徴候といいます。筋肉の問題では、手足やからだ・顔が全く動かなくなっても目を動かす筋肉が最終的にある程度は残ることが挙げられます。また、尿道や肛門をキュッと締める括約筋も筋肉ですが障害は受けにくいのは尿道や肛門の括約筋の筋肉は自律神経支配ですから、尿や便が勝手にもれて、垂れ流しにはなりにくいのも排便のときは運動神経を使っていきむ必要もあるからです。しかし尿や便は運動神経だけで支配されているのではないので尿道や肛門の括約筋の筋肉は自律神経支配ですから運動神経がALSで障害されても自律神経で手助けしているので尿や便が勝手にもれて、垂れ流しにはなりにくいのです。括約筋とは、瞳孔、胃の幽門部、肛門、内尿道口などの部位に存在する輪状の筋肉で、「括(くく)る」の文字が示すように「くくる」しばる」「しめる」という役割をする筋肉が括約筋なのです。人体の場合は骨格筋性の括約筋と平滑筋性の括約筋がみられる。直腸と肛門の周りを取り囲んでいる、肛門を開け閉めする働きをする筋肉が平滑筋です。無意識のうちに働く内括約筋と、自分の意志でコントロールできる外括約筋があります。因みに人の筋肉には骨格筋、平滑筋、心筋の3種類があり心筋は心臓を動かせる心臓の筋肉です。一般には平滑筋に対して横紋筋があります。横紋筋はすべての骨格筋を含みます。横紋筋は随意筋です。平滑筋は不随筋です。骨格筋は横紋筋と同じく随意筋です。
人では骨格筋性の括約筋と平滑筋性の括約筋がありますが骨格筋と平滑筋との違いは?平滑筋と骨格筋は、次のような点で異なります。
①収縮のメカニズムの違いは平滑筋は不随意筋で、自律神経に支配されているため自分の意志で動かすことはできません。骨格筋は随意筋で、運動神経に支配されているため自分の意志で動かすことができます。
②横紋の有無の違いは平滑筋には横紋(しま模様)がありませんが、骨格筋には横紋があります。
③細胞の構造の違いは平滑筋細胞は小さく、長さ約50~400μm、厚さ約2~10μmです。
④収縮の特性の違いは平滑筋は疲労せず、わずかなエネルギーしか消費しないため、長時間持続する収縮に適しています。
⑤働きの違いは平滑筋は血管や内臓の働きを担っています。骨格筋は骨や他の構造を動かして、運動や姿勢保持に役立ちます。
筋肉には、骨格筋、心筋、平滑筋の3種類があり、いずれも人間が生きていくうえで欠かせない重要な筋肉です。
便意を我慢できるのは、なぜ?
肛門周辺には内肛門括約筋(ないこうもんかつやくきん)と外肛門括約筋(がいこうもんかつやくきん)があります。内肛門括約筋は平滑筋で不随意筋(意のままにならない筋肉)です。
それに対して外肛門括約筋は、横紋筋で随意筋(意のままになる)です。排便中枢を通じて副交感神経が刺激されると、内肛門括約筋は反射的に弛緩しますが、外肛門括約筋は排便動作をとらない限り弛緩しません。
つまり、意識的に外肛門括約筋を緊張させれば、便意を一時的に我慢できるわけです。
排便のメカニズム
便の移動によって直腸内圧が40~50mmHg以上になると、刺激が直腸壁の骨盤神経から仙髄の排便中枢に伝わり、視床下部を経て大脳皮質に伝達され、便意を意識することになります。
こうした刺激は、直腸内の内容物より上方の緊張や運動を高め、それより下方の緊張や運動を低下させます。この絞り出すような運動により、便は次第に肛門に向けて送り出されていきます。
一方、排便中枢に刺激が達すると副交感神経が刺激され、反射的に直腸筋が収縮して内肛門括約筋が弛緩します。ここでも、内容物を絞り出すような運動が起こります。
なお随意筋からなる外肛門括約筋は意識的に排便を調節できます。
ですから意識的に排便をしようとして、排便動作をとって努責することにより、腹腔内圧と直腸内圧の上昇、直腸筋の収縮、横隔膜の押し上げなどの運動が協調して起こり、便が肛門から排泄されます。
いきむ時は大きく息を吸い、口を閉じて息を止めます。努責時にかかる直腸内圧は100~200mmHgです。努責を開始すると血圧が急上昇し、体循環、脳循環に影響を及ぼしますから、日ごろから血圧が高い人は要注意です。緩下剤による便の軟化を勧めます。
大腸内の細菌はどんな働きをしているか?
体内の粘膜にはたくさんの微生物が生息しています。これらの微生物の集合体を細菌叢〔さいきんそう〕(フローラ)といいます。腸内にも細菌叢があり、消化を補助する役割を果たしています。細菌叢はビタミンK、B12、葉酸などのビタミンを合成したり、外から侵入した有害な細菌から体を防御する役目があります。ビタミン類は摂取するのみでなく、体内で生み出されてもいるわけです。新生児期にはビフィズス菌や乳酸桿菌など、体にとって有益な細菌が優勢ですが、年齢を重ねるにつれ、有害物質を生成するウェルシュ菌が増えてきます。便の10〜30%にはこうした腸内細菌が含まれており、最も多いのが大腸菌です。大腸菌は便中の食事カスを分解する働きを持っています。
便秘はなぜ起きるか?
便秘は、大腸の中で内容物の移動に時間がかかり、水分が過剰に吸収されて便が硬くなったり、排便そのものが困難になることによって起こります。
便秘は機能性便秘と器質性便秘に分けられます。機能性便秘には、一過性便秘(単純性便秘)と習慣性便秘(慢性便秘、常習性便秘)があります。ほとんどは習慣性便秘で、大腸の機能障害で起こる大腸性便秘と、直腸の排便機能の障害で起こる直腸性便秘に分けることができます。
大腸性便秘は、習慣性便秘の大半を占めます。大腸壁の緊張や、大腸の蠕動運動が低下すると、内容物の通過が遅れて便秘になります。運動不足や長期臥床などで腸管への機械的刺激が不足したり、大腸の粘膜の感受性が低下することで引き起こされます。
直腸性便秘は、直腸に便がたまって便意を感じた時に、排便を我慢することによって生じます。便意を我慢すると肛門括約筋が緊張して排便反射が抑圧され、一時的に便意が遠のきます。これを繰り返していると、直腸は次第に拡張して緊張が低下し、便が送り込まれても直腸内圧が十分に上がらず、便意を感じなくなってしまいます。
大腸そのものの障害によって起きるのが器質性便秘です。直腸癌、腸管の癒着などによって大腸に狭窄や屈曲が生じると、内容物が腸内に停滞して便秘が起こります。
なぜ排泄が必要なの?
私たちの体は、多数の細胞で構成されています。細胞は血液によって届けられた栄養分を燃焼させ、エネルギー源にしています。この時、細胞ですべての栄養分が完全に燃え尽きるわけではなく、いわば燃えカスや燃えさしが生じます。また、細胞が代謝をすることにより、老廃物も生じます。
これらは再び血液に戻され、全身を巡ることになります。 これらの不要物や老廃物は体にとって不必要なものですから、そのままにしておくと様々な悪影響が生じます。そのため、何らかの形で体外に排泄する必要があるのです。腎機能が低下すると不要物や老廃物の排泄がうまく行えなくなり、尿毒症(にょうどくしょう)を引き起こします。
尿毒症とは、腎臓の排泄機能が失われ、血液中に尿素などの尿毒素がたまった状態。倦怠感、貧血、高血圧、浮腫、肺水腫などの症状が現れます。
膀胱直腸障害(bladder and rectal disturbance)とは、膀胱、直腸の機能が傷害され、排尿や排便などに支障がでることの医学的呼称です。 脊髄損傷などで膀胱、直腸の機能は同時に侵されることも多いため、まとめて膀胱直腸障害と呼ばれているのです。直腸膀胱障害とも言われます。一般的に「膀胱直腸障害」と呼ばれるのは、脊髄の障害による神経症状として膀胱、直腸の機能障害が起きている状況です。
脊髄は脳から出る神経の束であり、膀胱や直腸の機能をコントロールする神経も含まれています。それらの神経が障害された時に膀胱直腸障害が出現するのです。排尿や排便に関わる内肛門括約筋は腸の筋肉の一部で、平滑筋という自律神経がコントロールする筋肉です。 内臓の筋肉の一部である内肛門括約筋は、おしりを締めようと意識しなくても、自律神経のはたらきでおしりを締めてくれます。 一方の外肛門括約筋は、体性神経支配の横紋筋です。外肛門括約筋と内肛門括約筋の違いは、内肛門括約筋は平滑筋で意のままにならない不随意筋です。 それに対して外肛門括約筋は、横紋筋で意のままになる随意筋です。 排便中枢を通じて副交感神経が刺激されると、内肛門括約筋は反射的に弛緩しますが、外肛門括約筋は排便動作をとらない限り弛緩しません。外肛門括約筋は横紋筋(骨格筋)で随意筋であり、体性神経である陰部神経に支配される。陰部神経は大脳皮質の働きに基づく意志による運動機能に関与する。 腰髄の損傷では陰部神経が麻痺し外肛門括約筋が収縮できず、自分の意思で排便を我慢できなくなる。体性神経系(somatic nervous system)は、自律神経系とともに末梢神経系をなす。体性神経系は、感覚神経と運動神経とがある。体性感覚や特殊感覚に基づく骨格筋の反射による運動機能の調節や、大脳皮質の働きに基づく意志による運動機能に関与しています。
動き以外では、知覚障害・感覚障害が起こりにくいことが挙げられます。すなわち見たり聴いたり、あるいは冷たさや痛さなどを感じる感覚は最後まで残るのも知覚も感覚も運動神経とは関係がないからです。ですから自分では動けないけれども全て周囲の状況が分かってしまうということで精神的なストレスは大きくなります。ただ、徐々に寝たきりになって行きますが、いわゆる“床ずれ”が出来にくいという特徴もあります。
何故“床ずれ”が出来にくいという理由について考えましょう。床ずれとは褥瘡とも言いますが褥瘡が生じる理由は何でしょうか?ALSの人が褥瘡(床ずれ)が起こりにくいのは、この理由として、患者さんの皮膚のコラーゲンに変化が起こるためではないかという説がありますがその根拠の説明はされてはいません。「褥瘡(じょくそう)」は、寝たきりなどによって、体重で圧迫されている場所の血流が悪くなったり滞ることで、皮膚の一部が赤い色味をおびたり、ただれたり、傷ができてしまうことです。一般的に「床ずれ」ともいわれています。寝たきりの高齢者に多く、また好発部位は尾骨や仙骨の尖った部分です。就寝中や座っているときなどには、皮膚の一部が布団や椅子と接することになります。接触を受けている皮膚には一定の圧力がかかり、血液が流れにくい状態になります。就寝中であっても、私たちは無意識のうちに体位を変えることで圧力が一部の皮膚にかかり続けないようにします。しかし、脳卒中などで寝たきりになっている人や、手術後で体位変換がうまくできない人、筋肉や神経の病気に関連して動けない人などは自分の意識で体位を変えることができません。そのため、一部の皮膚に対し持続して圧力がかかり続けることになり、血流障害をきたすようになります。また、体位変換の際のずれ力も大きく影響しこすれることで皮膚に傷がつきます。
十分な血流が担保されない状態が持続すると皮膚に十分な栄養や酸素が行き渡らなくなり、結果として褥瘡を生じるようになります。寝ている際に床と接する部分は特に圧迫を受けやすく、骨の出っ張りがある部位である仙骨部、踵や臀部や、肘などに褥瘡を認めることが多いのです。
褥瘡が生じやすい状況は褥瘡は脳卒中や脊髄損傷、また手術後など寝たきりの状態や車椅子生活を強いられる場合に誘発されることが多いのです。そのほか、糖尿病では神経障害や血流障害をきたしやすいため、褥瘡の発生がみられやすいのです。
また悪性腫瘍、うっ血性心不全、骨盤骨折、慢性肺疾患なども褥瘡発生のリスクが高いことが知られています。栄養状態も褥瘡の発生に関わります。うっ血性心不全とは心臓のポンプ機能が不十分なために全身に血液を送り出すことができず、血液がうっ滞している状態です。
褥瘡の症状は皮膚の変化として認識されます。初期は丸く赤みを帯びたように見えたり、血豆や水ぶくれができたりすることがあります。1〜2週間ほど経過すると、この状態から治癒に向かうか、さらに進行して慢性化するかに分かれます。
慢性化した場合は皮膚症状がさらに悪化し、浅い褥瘡や深い褥瘡が形成されます。
浅い褥瘡は急性期の皮膚症状と同様、皮膚の赤みや水ぶくれがあります。皮膚の再生に重要な皮膚の奥にある幹細胞はまだ残存している状態であり、より短い時間で治癒を期待することができます。
深い褥瘡は褥瘡が深い状態に進行すると、皮下組織や筋肉にも病変が広がることがあります。皮膚の表面が大きく壊死した組織で覆われることもあり、見た目が崩壊したメラニン細胞から放出した黒いメラニン色素が乾燥してきます。
治療に際しては、死んだ組織を取り除きながら経過を見ることになります。浅い褥瘡よりも治癒までに大幅に時間がかかります。
ALSの推定人数は、今のところ日本で大体6,000名から7,000名くらい、難病登録をしている患者さんの数は、平成16年度末のデータでは7,000名くらいと言われています。発症年齢は平均59歳、男性の方が1.5倍くらいの割りで多いという統計が出ています。以上、ALSの概略を述べました。
2.ALSの診断
ALSは、手足の先の方の筋力が徐々に低下し動かし難くなり、それが他の部位にゆっくり拡大進行する場合に疑われます。これらは下位運動ニューロンの症状です。筋肉の表面が小さく痙攣するのも症状のひとつです。これは筋線維束攣縮といいます。さらに、手足だけでなく、しゃべりにくい、飲み込みにくいと云った、舌や口の中の筋肉の動かしにくさ(球症状といいます)が見られてくるとALSがかなり疑わしくなります。この場合、舌の表面がさざ波のように勝手に動いているのが見られます。これらの下位運動ニューロンの症状に加えて、神経内科医が診察し、手足の反射が正常よりも非常に出やすい状態になっている場合(上位運動ニューロンの障害があると現れるものです)は、ほぼALSと考えられます。つまり、臨床的に、下位と上位の運動ニューロンが障害されている可能性が高い場合にALSが強く考えられます。ただ、早い段階では部分的な症状だけですから、例えば片手の筋力低下のみというような場合は、診察だけでは診断は困難です。
ALSを特異的に診断するための検査法はありません。下位運動ニューロンの障害は、筋肉に細い針を刺して筋肉の電気的な活動を調べる筋電図(針筋電図)で証明できます。また、この検査では、明らかに筋力が低下してきていない筋肉においても、異常があるかどうかを調べることが可能です。ALSの場合は、症状が出ていない手足や舌の筋肉でも異常を認めますから、比較的早期で症状が強くない場合でも異常を検出することが可能です。
ALSの場合、筋電図以外に血液検査、脊髄・脳のMRI、髄液、場合によっては筋生検(筋肉の一部をとって組織を染色して調べます)などを行いますが、これらはいずれもALSと似た病気を除外するために行われます。変形性頸椎症、脊髄空洞症、ミオパチー(筋肉自体の病気)など多くの病気の可能性を検討する必要があります。ALSでは、血液中のCKという物質が多少増える方もいますが、一般的な血液検査や画像所見では明らかな異常が認められないことが特徴です。
したがって、症状、診察所見、検査を組み合わせて診断していくことになります。
初めてのALSの報告と病気の名称についてALSは、1869年に、フランスの脳神経内科医のシャルコー(1825~1893)によって初めて報告された病気です。シャルコーは、運動がしにくくなって筋肉が痩せてくる患者さんのうち、運動に関係する脊髄の部位にだけに病理的な変化を認めた病気にALS(エイ・エル・エス)という病名をつけました。日本語でALSは筋萎縮性側索硬化症と呼ばれています。英語名が「amyotrophic lateral sclerosisで、その頭文字をとり、ALS(エイ・エル・エス)と略称されています。「amyotrophic」とは、筋(myo)の栄養(trophy)が無(a)くなって、筋が萎縮(a-myo-trophy)するということを意味しています。筋肉は大脳の運動神経が働けと命令しない限り“怠け者”で、運動をやる必要がなくなって使わないとすぐに廃用萎縮により衰えるので筋肉はやせ衰えて萎縮していきます。これがALSなのです。大脳皮質の運動野の命令が運動神経から筋肉に伝わらなくなりALSという病気が起こるのです。
それでは大脳皮質の運動野からの運動神経の命令はどのようにして末梢の筋肉に命令が伝わるのでしょうか?私たちの身体は基本的に脳からの指令が脊髄と末梢神経と通して、筋肉へと伝わり、筋肉が伸び縮みすることで運動をすることができます。大脳皮質にあるBetz細胞と呼ばれる運動の指令を出す大元の細胞から運動の指令が発生し、大脳皮質から脊髄へと延びる上位運動ニューロンという道を通って、脊髄にある前角細胞へと指令が伝達されます。このように、上位、下位のシグナルを仲介する位置に前角細胞は存在しているのです。運動の命令を受け取った前角細胞は下位運動ニューロンを伸ばし、筋肉へと電気信号を伝達する運動神経と筋肉のつなぎ目となる部分が神経筋接合部で神経筋シナプスともいわれ、神経線維の末端が、運動神経終板と呼ばれる筋肉の筋膜上の特殊な部位とつながっています。神経信号を筋肉に伝えるため、神経はアセチルコリンという化学物質(神経伝達物質)を神経筋接合部に放出します。 運動神経終板にはアセチルコリンの受容体があり、筋肉はこの受容体を介してアセチルコリンに反応します。このように、上位、下位のシグナルを仲介する位置に前角細胞は存在しているのです。大脳から脊髄前角細胞までを上位運動ニューロンといい、脊髄前角細胞から筋肉までの運動神経を下位運動ニューロンといいます。因みに上位運動ニューロンには、脳幹の神経核から始まるものもあります。下位運動ニューロン神経線維は、筋肉神経筋接合部で化学伝達物質(神経伝達物質)を放出し、神経シグナルを送り、筋肉を収縮させます。体を動かせないために、エネルギーの消費がとても少ない状態が、「身体不活動(physical inactivity)」です。 これによって生じる筋量の減少と筋力の低下が著しいのは、上半身よりも下半身の筋肉です。
筋萎縮性側索硬化症(Amyotrophic(筋肉が萎縮し)Lateral(脊髄側索が)Sclerosis(硬化する)、ALS)は、大脳皮質運動野の運動ニューロンと脊髄、脳幹の運動ニューロンが脱落することによって手足が動かなくなり、会話や飲み込みもしにくくなって、多くは4~5年で呼吸筋が麻痺して、人工呼吸器を装着しなければ生きていけなくなる神経難病です。
ALSとは大脳の第一次(上位)運動ニューロンと脳幹、脊髄の第二次(下位)運動ニューロンが主として障害される疾患です。運動ニューロンが障害されて筋力低下を示す疾患は数多くありますが、ALSは下に記す臨床・病理学的特徴を持つ病気です。
日本全国のALSの患者さんの数はおよそ6600名と推定され10万人あたり5~6人です。そのうち人工呼吸器装着あるいはそれに近い重度の看護を必要とする患者さんは2000名ほどです。
ALSで認められる症状には、多くは中年以後に発症し、2-3年の経過で四肢や顔面、舌などの筋肉の萎縮と筋力低下、嚥下障害が進行します。女性より男性の発症率がやや高いのです。患者さんによっては外傷がきっかけであったとか、風邪をひくと進行が早まった、と言うような、何らかの「ストレス」があります。
発症時は左右差が見られ、一側の上肢に発症することが多いのですが、下肢から発症することもあり、また舌から発症して会話や飲み込みがしにくいことが最初の症状として 気付かれることもあります。しかし急速に両側性となり発症後数年で四肢麻痺となることが多く、やがて呼吸筋麻痺を来します。
一方ALSが進行しても眼球運動や知覚、排尿排便 は保たれることが多いと言われ、ALSでは辱創が脳卒中などで寝たきりの患者さんに比べてできにくいのです。
足底で調べるバビンスキー反射が陽性となり、四肢の筋肉がピクピクする線維束性攣縮が見られることがあります。バビンスキー反射とは足の裏の外側(小指側)を強くこすると足の親指が甲の方に反る脊髄反射の一つ。生後3か月くらいまでの新生児で見られるが、それ以降の健常者には見られない。随意運動を支配する錐体路に障害があるからです。膝蓋腱反射などの深部反射は、発症早期には亢進することが多いのです。膝蓋腱反射とは深部腱反射(Deep Tendon Reflex略して DTR)は腱反射とか、伸張反射とも呼ばれるのですが、太い骨格筋につながる腱を筋が弛緩した状態で軽く伸ばしハンマーで叩くと、一瞬遅れて筋が不随意に収縮する反射であり、人体にみられる生理的な反射の代表的なものである。
反射とは何でしょうか?刺激に対して起きる不随意の筋収縮であり、客観性があるため、神経疾患の局在診断につながります。反射の医学的な定義は,特定の刺激に対して無意識に反応が起こることです。このため反射にはその刺激を感じる受容体とそれを伝える求心路である経路,その刺激に対して反応を起こす反射の中枢,その反応を末梢に伝える遠心路である経路,反応を起こす筋肉などの効果器があります。
そして生理的な反射には,大きく分けて体性反射と自律神経反射があります.このうち体性反射には深部反射と表在反射があり,深部反射は伸張反射である膝蓋腱反射があります。これは膝の腱がハンマーで叩かれることにより,局所的に伸ばされるため,その腱に関係した筋肉(膝蓋腱反射では大体四頭筋)が収縮して足が上がるのです。また表在反射には咽頭反射と言われる喉の奥を触るとオエっとはきそうになるなどがあります.つまりこれらは1種の防御反応といえます.そのほか体性反射の中には屈曲反射,原始反射,病的反射そして姿勢反射などと呼ばれているものもあります.このうち屈曲反射は皮膚や筋肉などが有害な刺激を受けると,刺激を受けた部位を刺激から遠ざけるように屈筋が収縮する反射です。
それから原始反射は新生児期にみられ,中枢神経系の発達とともにやがては消失して見られなくなる反射のことを言います.代表的なものに,脊髄レベルで起こる把握反射と言われる赤ちゃんの手のひらに指を当てると無意識に握ろうとする,生後3ヶ月頃に消失する把握反射や,脳幹レベルの反射である吸引反射と言われる唇をこすると,乳児が乳を飲むように唇が動く反射で,生後4ヶ月頃まで見られるなどがあり,赤ちゃんの神経の発達に障害がないか,あるいはその後に障害が起こっていないかを見るのに使われます。
また病的反射というのは,小児の時には見られていた反射がその後の中枢神経系の障害により再び見られるようになるものを言い,先ほどの把握反射や吸引(飲)反射などに加え先ほど述べた有名なBabinski反射があります.これは足の裏を鍵など少しとがったものでこすると足の親指が足の甲側に反り返るという反射で1種の逃避反射です.大体2歳ころまでの赤ちゃんには普通に見られるのですが,その後の中枢神経系(錐体路という運動神経の経路)の発達により抑制されて見られなくなります.つまり逆にこの反射がまた出現すると言うことは,錐体路の障害を意味するわけです。錐体路とは随意運動を支配する神経の主要経路で、大脳皮質の運動野に始まり、延髄を通るときに大部分の神経線維が交差して錐体とよぶ高まりをつくり、反対側の脊髄に入り全身に伝えられる。これ以外の下行性の運動伝達路を錐体外路といい、随意運動を無意識的に調節する働きをする。
さらに姿勢反射ですが,これは姿勢を維持しようと無意識にコントロールする反射を言います.その代表は立ち直り反射で,これは関節の位置を知る深部感覚や平衡器官,それに視覚の情報などを脊髄,脳幹,小脳などで統合して身体の筋緊張を調節することにより直立姿勢を維持する反射であります。
次に内臓反射とも言われる自律神経反射は,交感神経や副交感神経を介して血圧や脈拍や発汗や胃腸の運動などをコントロールしており全身の状態を保って生きて行くのに必要な反射であります。他に頸動脈洞反射と言われる喉元を圧迫すると脈がゆっくりとなり血圧が下がる自律神経反射や圧迫が加わると汗をかかなくなる圧発汗反射や,眼の瞳孔に入ってくる光の量を調節する反射である対光反射などがあります。
さてそれでは医学的にはどこにも書かれていない反射神経について詳しく書きますと,そもそも神経には中枢神経と末梢神経があり,さらに末梢神経は運動神経,知覚神経,自律神経の三つに分けられますが,反射神経という名前の神経は医学的にはどこにもありません。飛んできたものをとっさによけたり,机の上から落ちかけたものをパッと手でつかんだり出来ると反射神経がよいなどと言われます。あるいは徒競走で素早くスタートを切れたり,テレビゲームをする時,素早く上手に反応出来たりするのも反射神経がよいと言われます。この両者は,同じ反射神経と言っても少し違うのです。すなわちとっさに落ちてくる物からよけたり,物をつかめる方の反射神経とは,刺激を受けた時に脳で意識せずに無意識のうちにその刺激に対して素早く身体を反応させることを意味しており,医学用語の反射に近いのです。これには,視覚を始めとしたいろいろな感覚刺激,各種姿勢反射,脊髄レベルでの屈曲反射などが関係しているのです。
それに対して徒競走のスタートやテレビゲームの操作が上手な方の反射神経は,充分に神経を集中して反応しているので医学用語の反射とは少し意味が異なるのです。この場合,聴覚刺激や視覚刺激(特に動体視力)などに対していかに素早く反応できるか,あるいはいかに上手に反応できるかであり,これには充分に集中していること,筋肉がリラックスして反応しやすい状態にあること,そして動作や操作の技術を高めておくためのトレーニング効果が加味されます。
面白い反射の話が長くなり過ぎましたがALSの神経病理学的所見に戻りましょう。ALSの臨床症状は、下に書き記すALSの神経病理学的所見と密接に関連しています。すなわち、ALSでは、運動ニューロンのヘルペスウイルスの感染細胞体が変性し脱落するのですが、外眼筋を支配する脳幹の動眼神経や脳幹の外転神経の神経細胞、また外肛門括約筋を支配するといわれる仙髄の神経細胞体の集まりであるオヌフ核の神経細胞はALSの末期まで保たれることが多く、脊髄の後角に位置して知覚を脳に運ぶ神経細胞とその軸索である後索も保たれ易いのはこれらの神経細胞にherpesが感染しにくいからです。
オヌフ核(Onuf核)とはオヌフ核の神経細胞とは、仙髄にある神経細胞群で、排尿の際に膀胱内に尿を蓄える役割を担っています。オヌフ核は、Onufrowiczによって見つけられたのでオヌフ核といわれます。ヒトでは第2仙髄を中心に存在し、一部が第1、第3仙髄にのびています。オヌフ核は、外尿道および外肛門括約筋を支配しています。筋萎縮性側索硬化症(ALS)などの脊髄の変性疾患では、前角細胞がほとんど完全に変性消失するのに対し、オヌフ核のみが細胞集団として残存しています。神経疾患における自律神経障害の中で,排尿排便障害は最も多いものの 1 つであるのにもかかわらずオヌフ核の自律神経細胞はALSの末期まで保たれるのはALSは中枢運動神経のヘルペスによる障害によるものであるからです。すでに述べたバビンスキー反射の出現や深部反射の亢進は、第一次運動ニューロンの障害で生じます。第一次運動ニューロンは脳や脊髄の中枢にある上位運動ニューロンの事です。
またALSの患者さんの皮膚と脳の動脈にはヒアルロン酸が多く、これと辱創が出来にくい、脳卒中が起きにくいと論じた報告もありますが、ALSはヒアルロン酸を健常人よりも多く作れるわけはないのです。ヒアルロン酸(hyaluronic acid)は、直鎖状のグリコサミノグリカン(ムコ多糖)の一種です。グリコサミノグリカンはムコ多糖とも呼ばれ細胞と細胞をつなぐ粘液状の物質です。「ムコ」は「粘性のある」という意味です。グリコサミノグリカン(ムコ多糖)にはヒアルロン酸、コンドロイチン硫酸などがあります。多糖は タンパク質と結合してムコ多糖体という形で血管、臓器、骨、関節、角膜、脳、皮膚、粘膜、眼球などの生体内に広く存在し、体の水分保持に重要な役割を果たしています。保水性が高く水分保持により粘性が保たれるのです。
ALSの4大陰性徴候というのは,①感覚障害が無い,②褥瘡が出来ない,③骨盤括約筋障。害が無い,④ 外眼筋麻痺が無い,の四つである。他にも表現がやや異なるALSの4大陰性徴候の書き方があるので示しておきます。
ALSの4大陰性徴候というのは,一般的には末期になっても感覚障害, 眼球運動障害,膀胱直腸障害および褥瘡がみられず,四大陰性徴候として有 名です。
ALSではみられにくい症状には全身の運動神経が障害されますが、眼球を動かす筋肉は保たれます。
何故ALSでは眼球を動かす筋肉は障害されないのでしょうか?眼球運動を支配する動眼神経は末梢神経性の脳神経でありかつ縮瞳と焦点調節は自律神経の副交感性であるので上位運動ニューロンの支配を受けないからです。
感覚神経は障害されないので、しびれ感や感覚低下はありません。自律神経も障害されないので、自律神経支配である排尿障害や排便障害もありません。何故ならばALSは中枢の運動神経の病気でありは自律神経には関りがないからです。
また、皮下組織にはれはできにくくなりますがその根拠については一切説明がありません。皮膚は大きく分けて表皮(ひょうひ)・真皮(しんぴ)・皮下組織(ひかそしき)の3層からできています。つまり皮下組織にALSの病気の変化が起こるので皮膚表面である表皮の傷である床ずれは長期に臥床せざるを得ないのに起こらないとされているのですがその根拠についてはALSは皮膚の病気ではないという根拠以外に説明はありません。というのはALS中枢の上位ニューロンの病気であるので元々臀部の皮膚には関係がないのです。褥瘡は皮膚の3層である表皮から真皮、皮下組織と体の内部に向かって進行していくため、一般的に深さで重症度を分類します。
2023年2月の調査した結果をみると、一般病院での褥瘡患者は2.46%です。療養型病床のある一般病院では2.81%です。病院に入院している患者の100人あたり2.5人に褥瘡があるということになります。
褥瘡(じょくそう)はどうしてできる? どうして治す?褥瘡って何? 発生のメカニズムは?褥瘡は一般的には「床ずれ」と言われます。寝たきり状態などになると、体重によって圧迫されている部位の血流が滞り、皮膚の一部が赤い色味を帯びたり、ただれたり、傷ができてしまいます。これが褥瘡です。重篤なものでは筋肉や骨まで及ぶものもあります。
褥瘡は、以前は「褥創」と表記されていましたが、現在は「褥瘡」の表記が一般的です。「創」は「切りキズ」などの「キズ」を、「瘡」は内部からの要因による壊死や痂皮などの「できもの」を意味します。褥瘡を単なる「創(キズ)」としないで、「瘡」と表記することになったのは、褥瘡の成り立ちに意味があるからです。皆さんが目にしている褥瘡を見るとわかるように、褥瘡はさまざまな形態と状態で成り立っており、その病態は非常に複雑です。的確なアセスメントをして、科学的根拠に沿ったアプローチをしていかないと難治化してしまいます。
褥瘡の定義は 「身体に加わった外力は骨と皮膚表層の間の軟部組織の血流を低下、あるいは停止させる。この状況が一定時間持続されると組織は不可逆的な阻血性障害に陥り褥瘡となる。」となります。つまり、外力がかかることで骨によって圧迫された組織が障害された状態が褥瘡です。さらに、圧迫には垂直方向に圧縮する力だけでなく、「引っ張り応力」「せん断応力」といわれる圧力がかかっています。それらによって組織に「ずれ力」がはたらき、組織障害が助長されるのです。「せん断応力」とは(剪断応力、shear stress、シヤー応力)とは、物体内部のある面と平行方向に、その面にすべらせるように作用する応力のことである。 褥瘡は、単なる阻血にとどまらず、4つの機序が複合的に関与するものと考えられています。それは、①阻血性障害、②再灌流障害、③リンパ系機能障害、④細胞・組織の機械的変形、4つです。
阻血性障害では、外力によって微小血管が閉塞して組織が阻血壊死に陥ります。そして、一度途絶した血流が再開通したときに、生体炎症反応が起こり、組織が障害される再灌流障害が起こります。
図1。さまざまな形態・状態(色・性状)の褥瘡
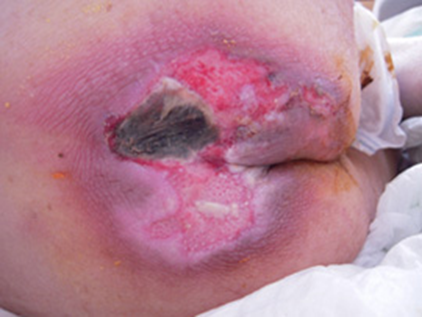
壊死組織を伴う仙骨部褥瘡。滲出液が多く、創縁の浸軟と創周囲の発赤を伴う感染の状態
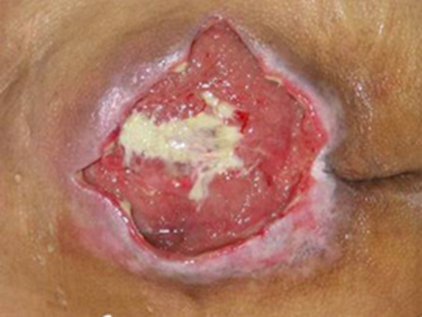
中央に黄色壊死を伴う仙骨部褥瘡。ぬめりを帯びた滲出液と浮腫状の肉芽組織を伴うクリティカルコロナイゼーションを示唆する状態。クリティカル「保菌状態、定着から感染に移行しつつあり、もう少しで感染になりそうな状態」です。クリティカルコロナイゼーションは感染ではないため、感染徴候はありません。しかし、抗菌薬を使用すると治癒速度が向上するなど臨床的改善が認められます。臨床的な症状としては、悪臭や滲出液の増加、それに伴う浮腫状の肉芽形成が見られます。
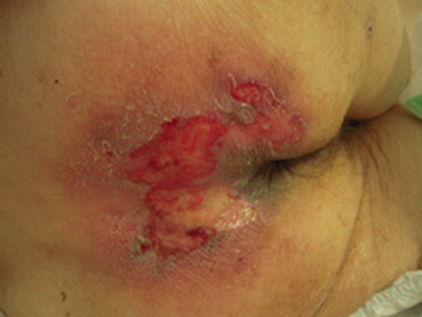
発生後間もない仙骨部褥瘡。一見浅い褥瘡に見えるが、創周囲の発赤や熱感を伴い、障害の深さが特定できない急性期褥瘡
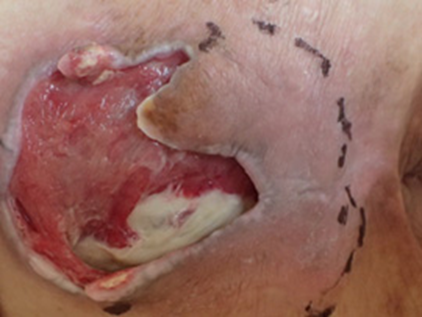
尾側にポケットを伴う仙骨部褥瘡
図2 局所における褥瘡発生の機序
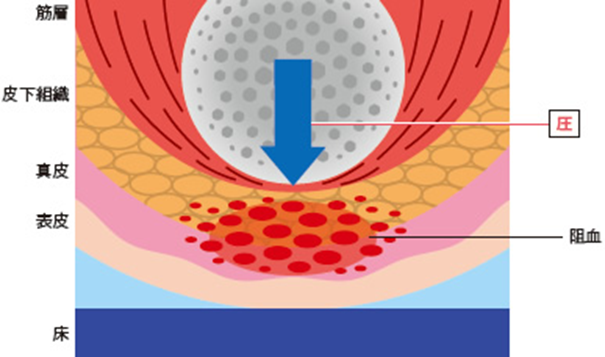
図3 圧迫によるいろいろな力
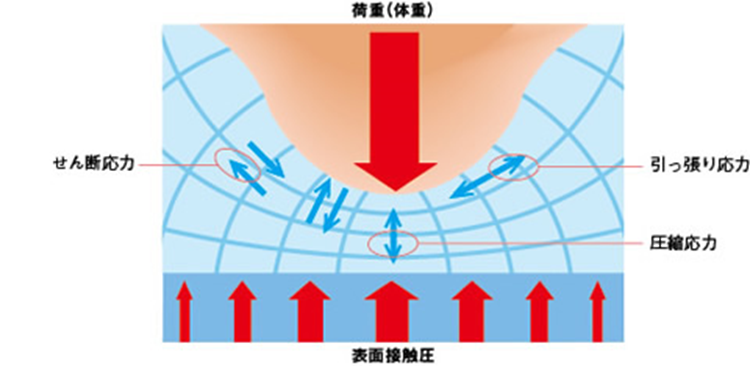
図4 褥瘡発生のメカニズム
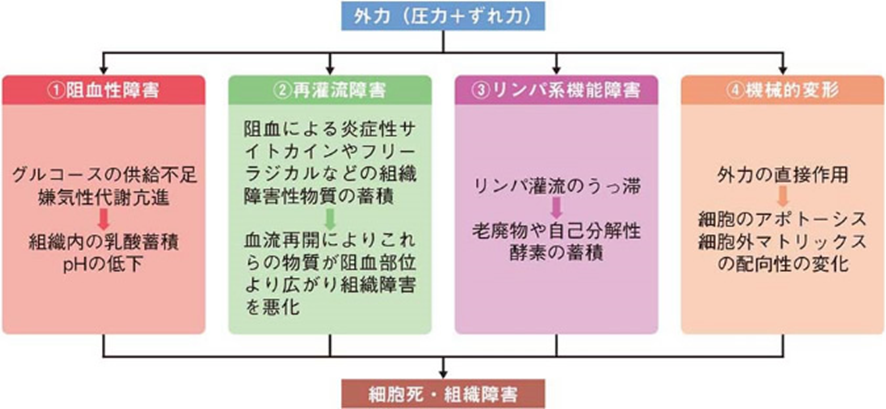
図5 阻血性障害のメカニズム
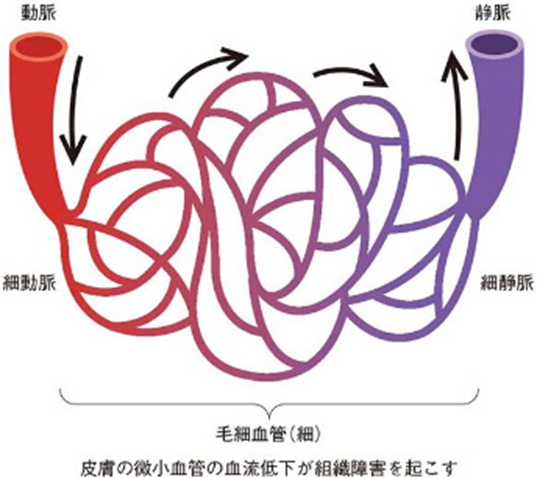
床ずれとは褥瘡とも言いますが褥瘡が生じる理由は何でしょうか?ALSの人が褥瘡(床ずれ)が起こりにくいのは、患者さんの皮膚のコラーゲンに変化が起こるためではないかという説がありますがその根拠の説明はされてはいません。「褥瘡(じょくそう)」は、寝たきりなどによって、体重で圧迫されている場所の血流が悪くなったり滞ることで、皮膚の一部が赤い色味をおびたり、ただれたり、傷ができてしまうことです。一般的に「床ずれ」ともいわれています。寝たきりの高齢者に多く、また好発部位は尾骨や仙骨の尖った部分です。就寝中や座っているときなどには、皮膚の一部が布団や椅子と接することになります。接触を受けている皮膚には一定の圧力がかかり、血液が流れにくい状態になります。就寝中であっても、私たちは無意識のうちに体位を変えることで圧力が一部の皮膚にかかり続けないようにします。しかし、脳卒中などで寝たきりになっている人や、手術後で体位変換がうまくできない人、筋肉や神経の病気に関連して動けない人などは自分の意識で体位を変えることができません。そのため、一部の皮膚に対し持続して圧力がかかり続けることになり、血流障害をきたすようになります。また、体位変換の際のずれ力も大きく影響しこすれることで皮膚に傷がつきます。
十分な血流が担保されない状態が持続すると皮膚に十分な栄養や酸素が行き渡らなくなり、結果として褥瘡を生じるようになります。寝ている際に床と接する部分は特に圧迫を受けやすく、骨の出っ張りがある部位である仙骨部、踵や臀部や、肘などに褥瘡を認めることが多いのです。
褥瘡が生じやすい状況は褥瘡は脳卒中や脊髄損傷、また手術後など寝たきりの状態や車椅子生活を強いられる場合に誘発されることが多いのです。そのほか、糖尿病では神経障害や血流障害をきたしやすいため、褥瘡の発生がみられやすいのです。
また悪性腫瘍、うっ血性心不全、骨盤骨折、慢性肺疾患なども褥瘡発生のリスクが高いことが知られています。栄養状態も褥瘡の発生に関わります。うっ血性心不全とは心臓のポンプ機能が不十分なために全身に血液を送り出すことができず、血液がうっ滞している状態です。
褥瘡の症状は皮膚の変化として認識されます。初期は丸く赤みを帯びたように見えたり、血豆や水ぶくれができたりすることがあります。1〜2週間ほど経過すると、この状態から治癒に向かうか、さらに進行して慢性化するかに分かれます。
慢性化した場合は皮膚症状がさらに悪化し、浅い褥瘡や深い褥瘡が形成されます。
浅い褥瘡は急性期の皮膚症状と同様、皮膚の赤みや水ぶくれがあります。皮膚の再生に重要な皮膚の奥にある幹細胞はまだ残存している状態であり、より短い時間で治癒が可能です。
深い褥瘡は褥瘡が深い状態に進行すると、皮下組織や筋肉にも病変が広がることがあります。皮膚の表面が大きく壊死した組織で覆われることもあり、見た目が崩壊したメラニン細胞から放出した黒いメラニン色素が乾燥してきます。
治療に際しては、死んだ組織を取り除きながら経過を見ることになります。浅い褥瘡よりも治癒までに大幅に時間がかかります。
褥瘡は正常な皮膚が損傷を受けている状態です。なおかつ、栄養状態や免疫状態など全身状態が悪いことが多く、褥瘡部位から細菌感染を起こすこともあります。細菌感染が局所にとどまらずに全身へと広がることもあり、発熱などの全身症状を呈することもあります。
ALSでみられることが少ない症状を、陰性症状といいます。四大陰性症状は、眼球運動障害がなく、感覚障害もなく、膀胱直腸障害もなく、褥瘡もありません。陰性症状とは陰性症状とは、本来あるはずと考えられる症状が出ない状態を指します。何故ALSの四大陰性症状といわれるのでしょうか?
四大陰性症状とは. 「眼球運動障害・膀胱直腸障害・感覚障害・床ずれ」といった4つの症状はみられません。膀胱直腸障害(bladder and rectal disturbance)とは、膀胱、直腸の機能が傷害され、排尿や排便などに支障がでることの医学的呼称。 脊髄損傷などで両者の機能は同時に侵されることも多いため、まとめてこう呼ばれている。直腸膀胱障害とも言う。一般的に「膀胱直腸障害」と呼ばれるのは、脊髄の障害による神経症状として膀胱、直腸の機能障害が起きている状況です。 脊髄は脳から出る神経の束であり、膀胱や直腸の機能をコントロールする神経も含まれています。 それらの神経が障害された時に膀胱直腸障害が出現するのですが、にもかかわらず膀胱直腸のほとんどの神経支配は自律神経ですからALSは中枢の運動神経支配ですから末梢運動神経の影響を受けにくいのです。
例えば排尿に関わる神経系.A. 末梢 – 脊髄 – 脳幹 – 基底核 / 前頭葉の経路.B. 基底核系と排尿系の関係.膀胱は仙髄中間外側核(副交感神経)の支配,内肛門括約筋は腰髄中間外側核(交感神経)支配,外肛門括約筋は仙髄オヌフ核(体性神経)支配を受ける.
3 排便に関わる神経系.A. 消化管壁内神経叢.B. 末梢脊髄/迷走神経脳幹基底核/前頭葉の経路.右側結腸は延髄・迷走神経(副交感神経)の支配,左側結腸/ S 字結腸・直腸は仙髄中間外側核(副交感神経)の支配,内肛門括約筋は腰髄中間外側核(交感神経)支配,外肛門括約筋は仙髄オヌフ核(体性神経)支配を受ける.
もっと具体的に説明しますと内肛門括約筋は腸の筋肉の一部で、平滑筋という自律神経がコントロールする筋肉です。 内臓の筋肉の一部である内肛門括約筋は、おしりを締めようと意識しなくても、自律神経のはたらきでおしりを締めてくれます。 一方の外肛門括約筋は、体性神経支配の横紋筋です。外肛門括約筋と内肛門括約筋の違いは、内肛門括約筋は平滑筋で意のままにならない不随意筋です。 それに対して外肛門括約筋は、横紋筋で意のままになる随意筋です。 排便中枢を通じて副交感神経が刺激されると、内肛門括約筋は反射的に弛緩しますが、外肛門括約筋は排便動作をとらない限り弛緩しません。外肛門括約筋は横紋筋(骨格筋)で随意筋であり、体性神経である陰部神経に支配される。陰部神経は大脳皮質の働きに基づく意志による運動機能に関与する。 腰髄の損傷では陰部神経が麻痺し外肛門括約筋が収縮できず、自分の意思で排便を我慢できなくなる。体性神経系(somatic nervous system)は、自律神経系とともに末梢神経系をなす。体性神経系は、感覚神経と運動神経とがある。体性感覚や特殊感覚に基づく骨格筋の反射による運動機能の調節や、大脳皮質の働きに基づく意志による運動機能に関与しています。特殊感覚とは、視覚、聴覚、味覚、嗅覚、平衡感覚の5つの感覚のことです。この5つの感覚を担当する器官を特殊感覚器と呼び受容器と神経を含む器官です。これらの特殊感覚器官は、頭部に集中しており、受容器は視覚が網膜、聴覚が蝸牛、味覚が味蕾、嗅覚が嗅球、平衡感覚が半規管・前庭などの特殊な形状をした受容器です。
人の感覚は、①特殊感覚、②体性感覚、③内臓感覚の3つに大別されます。①特殊感覚は真上で述べた視覚、聴覚、味覚、嗅覚、平衡感覚の5つの感覚があり②体性感覚には皮膚感覚と筋感覚の2つがあり、③内臓感覚には空腹感、のどの渇き、吐き気、動悸、内臓痛などの感覚があります。
感覚器と受容器の違いは、何でしょうか?受容器とは刺激を電気信号に変える細胞、感覚器は受容器と神経を含む器官であることです。たとえば、視覚の場合、感覚器は「眼」であり、受容器は網膜にある「錐体・桿体細胞」です。錐体細胞とは主に大脳皮質に存在する投射型興奮性神経細胞である。細胞体は錐形で錐体細胞は、網膜にある視細胞の一種で、明るい場所で色を認識する働きがあります。錐体細胞には、次のような特徴があります。錐体細胞には、赤い光を受け取る「L錐体(赤錐体)」、緑の光を受け取る「M錐体(緑錐体)」、青い光を受け取る「S錐体(青錐体)」の3種類があります。
光が目に入ると、光は錐体細胞内の色素にキャッチされ、電気信号として脳に運ばれます。脳ではこの電気信号を元に色を感じます。錐体細胞にはロドプシンという色素があり、オプシンと呼ばれるタンパク質が含まれています。オプシンの種類によって、最も反応する光の波長が異なります。一方、暗いところで物を見るには桿体細胞が働き、色を区別できませんが、わずかな光でも感知することができます。桿体細胞とは桿体細胞(かんたいさいぼう)は、網膜にある視細胞の一種で、暗いところで物を見る際に働く細胞です。桿体細胞には次のような特徴があります。色を区別できない。わずかな光でも感知できる。ロドプシンという視物質が含まれている。ロドプシンはレチナールとオプシンからなる複合体。よく吸収する光の波長は500nmのみ。網膜には桿体細胞と錐体細胞(すいたいさいぼう)の2種類の視細胞があり、動物によって網膜内での量比は異なります。錐体細胞は明るい場所で色を認識する細胞で、中心窩に主に存在します
外眼筋を支配する脳神経核 (動眼神経、滑車神経、外転神経)は大脳皮質からの直接投射線維を受けておらず、外眼筋を支配する脳神経核 (動眼神経、滑車神経、外転神経)は大脳皮質からの直接投射線維を受けておらず大脳皮質による眼球運動のコントロールは上丘、riMLF、Cajal間質核を介して間接的に行われている。
riMLF(rostral interstitial nucleus of the medial longitudinal fasciculus)は、脳幹にある神経核で、垂直方向の急速眼球運動の発現に関与する領域と考えられています。
riMLFに関する特徴は次のとおりです。
1970年代末に単一細胞記録によってその局在が明らかとなった。
垂直運動の発火点となるニューロンが存在する。
両眼の同時上転や下転が制限される可能性がある。
一側riMLFに限局した中脳吻側部梗塞により両側性に垂直性眼球運動障害が生じる可能性がある。
内側縦束(MLF)• 前庭神経核と動眼神経核,滑車神経核・外転神経核を結ぶ経路。内側縦束(MLF)とは、脳幹にある線維束で、左右の眼球の水平方向の運動に重要な役割を果たしています。
内側縦束の特徴
存在位置
脳幹の橋~中脳の高さにある
構成
脳幹ではrapheを挟んで左右相対し、脳室周囲灰白質のすぐ腹側に接して走っている
役割
前庭神経核と第3(動眼神経)および第4脳神経(外転神経)核を連絡し、左右眼球の水平方向の運動に重要な役割を果している
内側縦束の障害によって起こる病態がMLF症候群(One-and-a-half症候群)です。MLF症候群では、片側の眼球の内転ができないが、輻輳(寄り目)は可能という特殊な眼球運動の状態になります。Cajal間質核は全脊椎動物に存在して内側縦束の. 下行路の起始核であり、眼球と頭部の垂直・回旋運動. に関与する
中脳とは間脳と橋の間に位置する脳構造である。中脳水道より背側の中脳蓋と、腹側の中脳被蓋、大脳脚の3つの部分に大別される。中脳蓋には、視覚反射中枢である上丘および聴覚中枢である下丘が存在する。中脳被蓋には、黒質や赤核など、主として運動制御に関与する神経核が存在する。中脳水道の周囲灰白質である中心灰白質には、動眼神経核や滑車神経核など、眼球運動を支配する脳神経核が存在する。また、中脳の中心部には脳幹網様体が分布し、脳幹を貫くカラム構造の最前方部を形成する。
ALSでは、眼球の運動に必要な筋肉は侵されにくいので、目の動きで自分の意思を伝えることができます。それでは眼球の運動に必要な筋肉は侵されにくいのは何故でしょうか?
外眼筋とは何か?6種類の外眼筋から成り立っています。外を見る目(眼)の働きをしている筋肉を外眼筋とよびます。外眼筋の名前は外を見るための眼を動かす筋肉から生まれました。この筋肉は角膜より少しはなれた強膜(しろ目)にしっかりとくっついています。外眼筋には六つの筋肉があり,それぞれの名前と働きは次のとおりです。
(1)上直筋 一 主に上転,わずかに内転して上内方へまわす。
(2)下直筋 一 主に下転,わずかに内転して下内方へまわす。
(3)外直筋 一 外転させる。
(4)内直筋 一 内転させる。
(5)上斜筋 一 主に下転,わずかに外転して外下方へまわす。
(6)下斜筋 一 主に上転,わずかに外転して外上方へまわす。
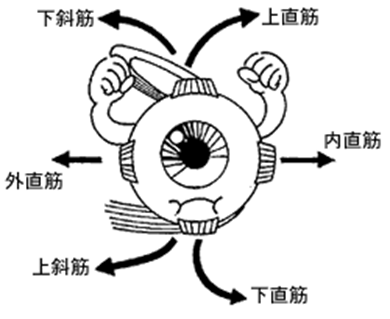
外眼筋を支配する神経は何か?左に目の6つの外眼筋の動き(右目を正面から見た図)を示します。(1)上直筋(2)下直筋(3)外直筋(4)内直筋(5)上斜筋(6)下斜筋の6個の外眼筋です。眼球運動に関与する外眼筋は一側の眼球に6個存在する。 これらの6つの外眼筋の支配には3つの脳神経核が関与する。 滑車神経核(第四脳神経核)は上斜筋を、外転神経核(第六脳神経核)は外直筋を支配し、動眼神経核は、それ以外の4種類の外眼筋(上直筋、下直筋、内直筋、下斜筋)を支配する。
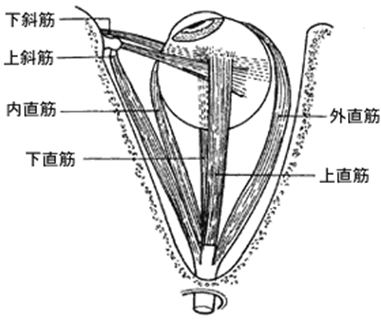
↑左に右の目を真上から見た6個の外眼筋を図示します。目を動かすのに 外眼筋は,脳神経の3番目の動眼神経(Ⅲ),脳神経の4番目の滑車神経(Ⅳ),脳神経の6番目の外転神経(Ⅵ)の3つの脳神経によって支配されています。 4つの直筋(上直筋,下直筋,内直筋,外直筋)は,視神経管を囲む総腱輪から起こります。 実際には,複数の筋が共同して作用するため,眼球運動の方向と筋単独の作用は一致しないのです。
動眼神経(Ⅲ)には大脳皮質からの直接投射はない。
滑車神経(Ⅳ)第4脳神経(滑車神経)麻痺はしばしば特発性である。同定されている原因は少ない。原因としては以下のものがある。閉鎖性頭部損傷(一般的な原因であり,一側性または両側性の麻痺を引き起こす可能性がある)や小血管病による梗塞(例,糖尿病)による。まれに,この麻痺の原因として動脈瘤,腫瘍(例,テント髄膜腫,松果体腫),または多発性硬化症がみられる。
外転神経(Ⅵ)第6脳神経麻痺は外直筋を障害し,眼球外転を妨げる。患者が正面を見たとき,眼球はやや内転していることがある。麻痺は,神経梗塞,ウェルニッケ脳症,外傷,感染症,または頭蓋内圧亢進に続発することもあれば,特発性のこともある。
筋組織は神経からの指令によって収縮するが、随意筋(骨格筋)は体性神経系(運動神経)で 支配されるのに対して、不随意筋(平滑筋及び心筋)は自律神経系に支配されている。
3)筋組織。筋組織は、筋細胞(筋線維)とそれらをつなぐ結合組織からなり、その機能や形態によって、骨格筋、平滑筋、心筋に分類される。このうち運動器官とされるのは骨格筋であり、関節を動かす骨格筋は、関節を構成する骨に腱を介してつながっている。筋組織は筋細胞と結合組織からできているのに対して、腱は結合組織のみでできているため、伸縮性はあまりない。骨格筋は、筋線維を顕微鏡で観察すると横しま模様(横紋)が見えるので横紋筋とも呼ばれる。収縮力が強く、自分の意識どおりに動かすことができる随意筋であるが、疲労しやすく、長時間の動作は難しい。骨格筋の疲労は、運動を続けることでエネルギー源として蓄えられているグリコーゲンが減少し、酸素や栄養分の供給不足が起こるとともに、グリコーゲンの代謝に伴って生成する乳酸が蓄積して、筋組織の収縮性が低下する現象である。xxiii すべての骨の骨髄で造血が行われるわけでなく、主として胸骨、肋ろっ骨、脊せき椎、骨盤、大腿骨などが造血機能を担う。xxiv カルシウムは、生体の生理機能に関与する重要な物質であり、微量で筋組織の収縮、神経の伝達調節などに働いている。未定稿- 35 -随意筋に対して、意識的にコントロールできない筋組織を不随意筋という。平滑筋と心筋は不随意筋である。平滑筋は、筋繊維に骨格筋のような横しま模様がなく、消化管壁、血管壁、膀胱等に分布し、比較的弱い力で持続的に収縮する特徴がある。心筋は、心臓壁にある筋層を構成する筋組織で、不随意筋であるが筋線維には骨格筋のような横縞し模様があり、強い収縮力と持久力を兼ね備えている。筋組織は神経からの指令によって収縮するが、随意筋(骨格筋)は体性神経系(運動神経)で支配されるのに対して、不随意筋(平滑筋及び心筋)は自律神経系に支配されている。
骨盤括約筋とはなにか?
ALSの分類と家族性ALSについてはALSのほぼ90%が遺伝性の無い「孤発性」のALSです。
ほぼ第一次運動ニューロン(上位運動ニューロン)と、第二次運動ニューロン(下位運動ニューロン)の細胞体に感染した運動神経だけが崩壊脱落して見られる症例をびます。これは、100年以上前にALSを世界で最初に報告したと言われるフランスのシャルコー先生の論文の所見に類似しているからです。ヘルペスが分裂しない中枢神経の大脳皮質の運動野にあるにある上位運動ニューロンの細胞体や脊髄の前核細胞の下位運動ニューロンの細胞体に感染すると核の中に潜伏感染してしまいますがヘルペスは増殖することはないのですが生き続けるために最低限の活動をするときに神経細胞体から栄養素やエネルギーを奪い取ってしまいます。ひえいした神経細胞は崩壊して脱落してしまうのです。その結果運動神経の電気信号が伝わらなくなってしまいALSを世界でフランスのシャルコー先生が最初にみつけたALSを「古典型」ALSと呼ぶのです。
生前の症状では主として運動ニューロンの障害が考えられたにもかかわらず、数年間寝たきりのあと、あるいは何年か人工呼吸器をお使いのあと亡くなられた方の神経病理学的所見で、運動ニューロン以外に、脊髄の知覚系の神経細胞や脳幹の神経細胞脱落が見られる症例があり、このような症例を「多系統型」と呼ぶことがあるのは最初は中枢神経の運動ニューロンだけだったのですが長い時間の中で免疫が低下した時にヘルペスウイルスが運動神経から近隣の脊髄の知覚系の神経細胞や脳幹の神経細胞に感染したから運動ニューロンと同じように知覚ニューロンの脱落が見られたのです。このような患者さんでは眼球運動を含め、全ての随意運動が麻痺することがあるのは同じくヘルペスウイルスの感染によるものです。
ALSの患者さんの何割かは痴呆を伴うことが報告されています。このような患者さんでは、ヘルペスウイルスによる古典型ALSの病変に加えて、ヘルペスが大脳の側頭葉や脳幹の黒質にherpesが感染すると神経細胞脱落が見られ、側頭葉病変を伴うALSと呼びます。黒質で神経細胞脱落が見られる病変をパーキンソン病と呼びます。パーキンソン病についてはここを読んでください。ALSについてはここを読んでください。パーキンソン病もALSも脳神経変性疾患であり、すべての脳神経変性疾患の原因ヘルペスウイルスです。
ALSのほぼ10%の症例が遺伝性を示す「家族性ALS」ですが「家族性ALS」が「遺伝性のALS」ではありません。家族に重度のherpes感染している人が多く家族性にALSが起こりやすいことが有るからです。遺伝子異常が分かっているのは、その中の2割程度で、SOD(スーパーオキサイドジスムターゼ)1 という活性酸素を無毒化するという酵素の遺伝子と、ALS2/ALSINという、いまだ機能がよく分かっていない遺伝子の2種類ですと言われますが活性酸素とALSとは一切関係はありません。ヘルペスが原因です。
家族性ALSは比較的進行が遅く、脊髄の後索を障害することがあって、脊髄小脳変性症に類似点が見られることがありますと言われますがALSは遺伝子病ではありません。脊髄小脳変性症も脳変性疾患の一つであり「ヘルペス性脊髄小脳変性症」と病名を変えるべきです。癌の場合も遺伝性の癌と言われるのは間違っています。正しくは「遺伝的になり易い癌」というべきです。何故ならば癌の場合は二つの癌関連遺伝子のうち癌抑制遺伝子の一つだけ遺伝子変異もって生まれてきた人がいますがこの人だけが「癌」になり易いからです。というのは残りのもう一つの癌増殖遺伝子が変異するだけでほんとの「癌」になってしまうからです。つまり良性腫瘍であったものが悪性腫瘍の癌になってしまうのです。
古典型ALSの神経病理学的所見については大脳運動野の皮質ではニューロンが脱落することによって皮質の厚さが薄くなり、これらのニューロンの軸索も脱落して、その通り道(錐体路)である内包後脚が変性します。内包後脚とは錐体路は大脳の運動野から脊髄まで運動の命令が伝わる神経系路です。大脳皮質の運動中枢から内包(後脚)、中脳の大脳脚、延髄の錐体を通り、延髄の下端で左右が交叉し、下降して脊髄(前角細胞)に至る主たる運動神経伝導路をいい、皮質脊髄路とも呼ばれます。延髄の錐体を通るので、錐体路と言われますが大脳皮質から脊髄までの神経系路ですから皮質脊髄路とも呼ばれるのです。大脳運動野のニューロンの脱落によるその軸索の減少、すなわち軸索でつながっている錐体路の変性は、脊髄では側索と前索でも認められます。側索は、脳から脊髄に運動をするようにという命令が下りてくる通り道のことです。前索とはなんでしょうか?脊髄白質は大きく前索、側索、後索に分けられる。それぞれ、前索は前根の間、側索は前根と後根の間、後索は後根の間に概ね相当する。前索には上行路として前脊髄視床路、下行路として内側縦束、前皮質脊髄路、視蓋脊髄路、橋網様体脊髄路、前庭脊髄路、延髄網様体脊髄路がある。側索には上行路として脊髄視蓋路、脊髄オリーブ路、外側脊髄視床路、前脊髄小脳路、後脊髄小脳路が、下行路として赤核脊髄路、外側皮質脊髄路がある。後索には上行路として薄束、楔状束が、下行路として半円束、中間縁束がある。また、前索、側索、後索のいずれの部分でも、灰白質と接した部位は脊髄内の上下の連絡を行う神経線維の通る部分で、ここを固有束という。
脊髄では、灰白質、特に前角が強く萎縮し、中間帯も萎縮を示します。これは長い時間をかけてヘルペスが脊髄のあちこちの神経線維にも感染するからです。脊髄の神経細胞は、ALS発症当初には、運動ニューロンである前角細胞だけが障害されますが、病気が進むと、運動ニューロンではない、中間帯の神経細胞もherpesによって障害されてしまうのです。脊髄前角にありながら、仙髄のオヌフ核は比較的保たれます。
ALSの発症初期の前角細胞では、蛋白質を作っているニッスル物質が細かく破断されて白っぽく見えるようになります(クロマトリーシス)。病気が進むと前角細胞は強く萎縮し、その後脱落して行きます。前角細胞は、その病める経過中に幾つかのALS特徴的な所見を示します。「ブニナ小体」はほぼALSにしか見られない際立った所見ですが、それがどんな物質から構成されているのか、未だに完全には分かっていません。またユビキチンが付着凝集した封入体(ユビキチン化封入体)が見られますが、ユビキチンが「何」に付着したのか、その「本体」がまだ分かりません。ヘルペスウイルスによる細胞変性の初期には、前角細胞の軸索のなかにリン酸化ニューロフィラメントが蓄積して「スフェロイド」という腫大を呈します。これは軸索の中の物質の流れ(軸索流)が障害された結果であるとも言われています。このような所見を呈して前角細胞は脱落して行きます。これらの所見が生じるメカニズムの解明は、ヘルペスが原因であるのでALSの克服には抗ヘルペス剤か抗ヘルペス剤の点滴が良く効きますがヘルペスを殺すことはできません。
脊髄の前角細胞の軸索は、前核細胞からの出口では1本ですが、筋肉に入ると細かく何本かに別れて筋細胞である筋線維にシナプス結合します。ALSの筋肉は、前角細胞が脱落するとこれら軸索が分布した筋線維のかたまり(群)ごとに萎縮していき、これを群性萎縮とか神経原性萎縮といいます。脊髄の前角細胞が脱落すると筋細胞である筋線維に脊髄の神経とシナプス結合が出来なくなって筋肉が廃用萎縮してしまうので筋肉の群性萎縮とか筋肉の神経原性萎縮となってしまうのです。
現在行われているALSの治療はすべて原因治療ではないので無駄です。治療のみならずALSに関する理論もすべて間違っています。ALSの理論も臨床も間違いだらけなのは癌についての理論と臨床と同じです。癌もALSの原因を突き止めるために100年以上も世界中で最も優秀な医学者たちが研究を続けてきたのにもかかわらず原因の解明はもとより従ってまともな治療も今なお存在しないのは原因が両者ともヘルペスウイルスであることを知っていても認めないからです。35億年前に遺伝子の誕生と同時に生命の誕生起こったのですが病気は病原体と免疫との戦いなのです。すべての病原体である細菌とウイルスに対するワクチンができたのですが最後に残ったワクチンが作れない病原体はヘルペスウイルスであることにも誰も気が付いているのですが認めないのです。何故ならばALSも癌も原因はヘルペスウイルスなのですがヘルペスが増え続けるのは医薬業界は免疫を抑える薬で患者の症状を良くしてもherpesは永遠に増え続けてしまうのは医薬業界が一丸となって病気を治さずしてお金儲けにまい進するだけであるからです。しかもすべての病気が治ってしまうと医薬業界は破滅してしまうからです。資本主義は悲しい社会制度ですね。
これまでビタミンE、B12、ニコチン酸+ATP、蛋白同化ホルモン、インシュリン様成長因子など、様々な薬剤が治療薬として試みられました。現在のところリルゾール(促進性神経伝達物質グルタメートの阻害剤)がALSの進行を遅らせる薬剤として、唯一厚生労働省からALS適応が認可されています。患者さんによっては、あるいは病気のある時期には症状が軽減して有効といわれた薬剤でも、残念ながらALSを根本的に治療できる方法は見出されていません。リルゾール(ALS促進性神経伝達物質グルタメートの阻害剤)がALSの進行を遅らせる薬剤として、唯一厚生労働省からALS適応が認可されていますがそのリルゾールがALSに有効である根拠は何でしょうか?
ALS促進性神経伝達物質グルタメートの阻害剤であるリルゾールとは何でしょうか?
薬の効果と作用機序は神経伝達物質のグルタミン酸やフリーラジカルなどに関わり、神経細胞の障害を抑えることでALSの進行を遅らせる薬とされています。グルタミン酸とはグルタミン酸は体内で合成することができる非必須アミノ酸の一種で、リラックス成分であるGABA(ギャバ)を生成します。 アンモニアを解毒し、尿の排出を促進する効果や脳の機能を活性化する効果があります。また、日本で最初に発見されたうま味物質として調味料などに活用されています。フリーラジカルとはフリーラジカルや活性酸素はわたしたちの細胞や体内の代謝活動において作られ、いきるうえで必要なものです。ところが、偏った食事、不健康な生活習慣、心理的要因、何らかの病変などによってフリーラジカルや活性酸素が過剰に作られてしまい、その状態が長く続くと細胞が傷つき、早い老化や病気をもたらしてしまうのは嘘です。酸素を取り込まなければフリーラジカルや活性酸素は生まれません。筋萎縮性側索硬化症(ALS)は筋肉を動かす命令を伝える神経の障害により筋力がなくなり最後は呼吸困難になる。ALSは神経伝達物質のグルタミン酸による過剰興奮やフリーラジカルという物質などが原因でおこるとされているのも嘘です。リルゾールはグルタミン酸に対する阻害作用、フリーラジカル消去作用などをあらわすとされ、その作用は薬剤ごとで大きく異なります。こんなちゃちなリルゾールがALSに効くわけはありません。アッハッハ!!!
リルゾールの詳しい薬理作用については、筋萎縮性側索硬化症(ALS)は筋肉を動かす命令を伝える神経が障害をうけることで、筋肉が痩せていき筋力がなくなり最終的に呼吸ができなくなり呼吸困難となる。この疾患の原因は今もなお詳細には解明されていないが、神経伝達物質であるグルタミン酸による過剰興奮に基づく運動ニューロン(骨格筋を支配する神経細胞)の変性などが考えられていると言われますが運動ニューロン(骨格筋を支配する神経細胞)の変性を起こすのはヘルペスなのです。また、フリーラジカルという物質による酸化作用によっての細胞の障害がALSの発症に関わっていると考えられていると言われていますが癌もフリーラジカルが原因といわれていますが間違いです。がんについてはここを読んでください。
下記の薬剤がどのようにALSの発症に作用するかは解明されていない部分もありますが何故か厚労省は認めています。製薬メーカーからのプレッシャーがあったからです。
(1)リルゾール(主な商品名:リルテック)に関しては、グルタミン酸の遊離を阻害する作用やグルタミン酸の受容体であるAMP型やNMDA型といった興奮性アミノ酸受容体への阻害作用などにより、神経細胞の保護作用をあらわすとされているのも嘘です。グルタミン酸の受容体であるAMP型とNMDA型の違いはAMPA受容体はリガンド結合に対してミリ秒相当の速い応答を示し、速い神経伝達を担う。 NMDA受容体は、静止膜電位状態においてはチャネルポア近傍にマグネシウムが結合し、その活性化を阻害している。 このマグネシウムは膜の脱分極に伴い受容体より解離し、NMDA受容体はイオンチャネル活性を示す。
(2)エダラボン(商品名:ラジカット)はフリーラジカル消去による脂質過酸化を抑える作用により、神経細胞の酸化的障害を抑制する作用をあらわし、ALSの進行を遅らせるとされている。
ALSの克服を目指して行われている国内外の研究について。
- 孤発性ALSの原因の追究。孤発性ALSの原因は今だに不明ですが、ALSの最初の報告以来100年以上を経た現在も懸命の努力が続けられていますがすべてのタイプALSの原因はヘルペスウイルスです。現在のところ孤発性ALSは、内因(複数の疾患感受性遺伝子の存在:多因子)と外因(摂取物その他)との絡み合いで発症するのではないか、と考えられていますがALSは外因であるヘルペスウイルスです。
- 疾患感受性遺伝子の追究も行われていますがALSの原因は遺伝子とは全く関わりのないヘルぺスですからこの遺伝子の追究も無駄です。
- 外因の追究。ウィルス説やグルタミン酸過剰説などが提唱されましたが、これまで確証は得られていません。ただ、世界に3ヵ所ALSの多発地域が報告されており、原因究明について示唆を与えています。それらは紀伊半島、グアム島、ニューギニアで、ほぼ東経140度の線に位置し、土壌が似ていて、不思議なことに3カ所ともパーキンソン痴呆症という病気の多発も報告されています。パーキンソン痴呆症という病気の原因もherpesですから流行っているヘルペス感染症が中枢の大脳の皮質の運動野の細胞と脊髄の前角細胞に感染したからです。 この中で、グアム島では1940-50年代にはALSの発症率は世界平均のおよそ50倍で、当時住民の何分の一かがALSで亡くなるほどの頻度であったということです。しかしその後ALSの発症率は急激に減少し、現在では世界平均と変わらないほどまでになったということです。ヘルペスを大量に持っていた人が死んでしまってヘルペスの感染源が無くなったからです。
- これらのことは重要なことを示唆します。すなわち僅か数十年で激減したというグアム島のALSは「単一遺伝子による遺伝性疾患」では「あり得ない」ということ、つまり「内因」よりむしろ「外因」が原因でALSが多発したことが考えられます。その通りで、「外因」はヘルペスであったのです。この原因については、グアム島でかつて常食にされたというある種のソテツの実に含まれるという興奮性神経毒と、またグアム島の中でも発症頻度の高い村落では低カルシウム、低マグネシウム、高アルミニウムの飲み水を飲んでいたと言われ、摂取ミネラルの異常が原因ではないか、との二つの仮説が提唱されています。二つの仮説はすべて間違いです。
私たちの神経研における最近の研究で、二世代に亘る長期マグネシウム欠乏がラットの黒質神経細胞の脱落を起こすことが見出されましたが、脊髄運動ニューロンの脱落は見られず、カルシウム欠長期マグネシウム乏ラットでは明らかな変化は認められませんでした。つまりこのことは、長期マグネシウム欠乏はパーキンソン病/パーキンンソン痴呆症の原因にはなり得ても、低マグネシウムも、低カルシウムもALSの原因では無さそうであることを示唆しています。しかし長期マグネシウムをパーキンソン病やパーキンンソン痴呆症に投与して治りましたか?と聞きたいところですがパーキンソン病やパーキンンソン痴呆症もALSも抗ヘルペス剤と漢方煎剤で何人も完治させた経験を持っている私、松本は確信をもって原因であることをお伝えします。
ALSの誘因。誘因とは「誘因(ゆういん)」とは、ある事柄を誘い出す原因のことです。 原因と言い換えることもできますが、原因がもとで起こっている事象が誘い出されたきっかけとなるものであるかどうかが異なります。例えば年齢が20歳代以降60歳代までは年齢がかさむほど発症率が増加し、また高齢で発症するほど予後が不良であると言われていますが年取ればとるほどヘルペス感染が増えるからです。また、性別は男性が女性より発症率が高いと言われ、このことから性染色体上の何らかの遺伝子の異常や神経細胞内のホルモン受容体の異常などが推測されていますのは当然なのです。男は外に出れば毎日毎日7人の敵に出会うという諺通りお金を稼ぐための人間関係のストレスが高いので交感神経を刺激させて免疫を落とす機会が多いのでヘルペスが感染しやすくなるからです。
ALSの発症メカニズムの追究。ALSがどのようにして発症するのか、という問題は、a.何故運動ニューロンが選択的に、どのようにして傷害され脱落していくのか、b.運動ニューロンでも、障害されやすいニューロンと、されにくいニューロンとが存在するのは何故か、という事柄そのものです。
ALSで障害されやすいニューロンとされにくいニューロンについて。ALSは運動ニューロンが主として障害される疾患であり、その他のニューロンは比較的障害を免れます。また運動ニューロンでも、脳幹で眼球運動を司る動眼神経や外転神経、また仙髄のオヌフ核などが比較的障害されにくい運動ニューロンです。なぜ運動ニューロンが障害されやすく、感覚ニューロンや自律神経系のニューロンが障害されにくいのか、運動ニューロンのなかでも動眼神経細胞などが障害されにくいのか、と言う点に関しては、ALSで障害されにくいニューロンがカルシウム結合蛋白を多く含む神経細胞であり、神経細胞の過剰な興奮によって細胞内に流入したカルシウムの毒性を弱めることで生存が可能となるのではないか、と言う重大な指摘がなされています(Alexianuら「Ann Neurol」1994)。この研究は、治療法として、すべての運動ニューロンでカルシウム結合蛋白を増やすことができればALSの進行を止めることが出来るのではないか、という考えを抱かせます。また細胞内にカルシウムを流入させる興奮性(促進性)神経伝達物質であるグルタメート(グルタミン酸)がALSでどのような変化をしているのか、という研究とも関連していますが、カルシウムの働きをおさえるリルゾールがALSに著効を示すことは全く見られません。何故高ヘルペス剤を投与しないのか不思議でなりません。
近年、脊髄運動ニューロンへのカルシウムの流入に関連するグルタメート受容体(GluR2)に注目して、ALSでは、GluR2遺伝子からmRNAへの転写後の編集率が低下しているためにGluR2に機能異常がおこり、多量のカルシウムが脊髄運動ニューロンに流入して細胞死がおこり運動麻痺を生じるのではないか、と言われたこともあるのですが間違いです。細胞死がおこり運動麻痺を生じるのは神経細胞体に感染したヘルペスが溶原感染から溶解感染をおこしたりして神経細胞体を殺してしまうから運動麻痺も起こるのです。運動麻痺とは大脳の運動を司る中枢から筋肉に至るまでの神経自体や神経路の障害により、思うように 体を動かす事ができなくなった状態をいいます。これらの間違った所見は、現在唯一厚生労働省から適応が認められているリルゾール(グルタメート阻害剤)の効果とも関連した事項と思われます。グルタメートとはグルタミン酸のことでありグルタミン酸は体内で合成することができる非必須アミノ酸の一種で、リラックス成分であるGABA(ギャバ)を生成します。 アンモニアを解毒し、尿の排出を促進する効果や脳の機能を活性化する効果があります。 また、日本で最初に発見されたうま味物質として調味料などに活用されています。
ブニナ小体とは何でしょうか?ブニナ小体はALSの神経細胞内封入体で、変性する神経細胞体内にはしばしばブニナ小体(Bunina body)、スケイン(skein)などの異常構造物を認め、これらは本疾患に特異的に出現します。これは神経細胞体内に感染したヘルペスウイルスが生き続けるために細胞の栄養素や酸素を盗み続けたために正常な神経細胞体を維持できなくなり変性してしまった神経細胞体内にはタンパク質などが正常な蛋白質の立体構造が崩壊した後に凝縮したアミロイド様物質です。ALSにほぼ選択的に認められ、かつALSで障害される運動ニューロンで認められることが多いことから、ALSの発症と細胞死とに密接に関連した所見と考えられます。その通りですがヘルペスのなせる業です。ブニナ小体がシスタチンCという、システイン蛋白分解酵素阻害剤の一種に対する免疫染色で陽性となるのです。しかし今だにブニナ小体の本質が解明されたとは言い難いと言われていますがヘルペスが生み出したのが神経細胞が変性したために生まれたのがブニナ小体なのです。従ってALSはヘルペス性中枢神経細胞変性症というべき病気なのです。
運動ニューロン内に蓄積した異常蛋白とは何でしょうか?異常蛋白の蓄積と作られ方と、壊され方はどうなっているのでしょうか?運動ニューロン内に蓄積した異常蛋白の一つが上で説明したブニナ小体なのです。ALS運動ニューロンの中には、ユビキチン化されたユビキチンが付着した蛋白が蓄積しています。ユビキチンは、蛋白が細胞内の小胞体で作られる際、キチンとした「三次元構造の折り畳み」がなされなかった不良品蛋白を処理するための機構であるので、ユビキチン化蛋白の蓄積は小胞体の蛋白合成系がヘルペスウイルスにより妨害されて上手く働いていないことを示唆します。また、ユビキチン化蛋白が溜まることは、これを細胞内で壊して処理するといわれるプロテアソームの機能もherpesのために落ちているからです。ユビキチンとは何でしょうか?ユビキチン (ubiquitin) は76個のアミノ酸からなるタンパク質で、他のタンパク質の修飾に用いられ、タンパク質分解、DNA修復、翻訳調節、シグナル伝達などさまざまな生命現象に関わる。至る所にある (ubiquitous) ことからこの名前が付いた。ALSで働くユビキチンの作用は,ヘルペスによって正常なたんぱく質の立体の折り畳み構造を構築できなかったタンパク質の分解に関与するたんぱく質である。因みに オートファジー(autophagy)は,たんぱく質の二次構造を構築する作用も持っていますが同時に飢餓状態では、オートファジーは自食作用とも呼ばれる,たんぱく質を分解する作用も発揮できます。
三次元構造の変化で毒性を持つ蛋白とは何でしょうか?蛋白質についての最近の研究から、蛋白分子の折り畳みなどが変わって三次元構造がヘルペスによっての変性してしまうと、一転して毒性を持つようになる蛋白質が知られるようになってきました。これを分解するのがALS運動ニューロンに蓄積した、ユビキチンが付着した蛋白であり、ALSで働くユビキチンの作用の「本体」はまさにヘルペスによって毒性を持つようになる蛋白質をユビキチンが分解して蓄積したのがブニナ小体なのです。
運動ニューロンの小胞体の変化とは何でしょうか?ALSの前角細胞などのヘルペスによる運動ニューロンの編成の初期変化としてクロマトリーシスが見られます。クロマトリーシスとはニッスル物質、つまり粗面小胞体(小胞体の膜に蛋白を作るリボゾームが付着したもの)の崩壊・破断を意味します。しかし電子顕微鏡を用いた研究では、細胞変性末期の萎縮した細胞でも粗面小胞体が変化していること、それも初期変化とは異なり、小胞体の袋構造が不規則に拡大し、膜上のリボゾームの数が減少しています。このことは、変性末期では小胞体内に異常な蛋白が溜まっていること、すなわちヘルペスによる小胞体ストレスが存在しているからであり、リボゾームでの蛋白合成が不十分となっているのは感染しているヘルペスによって栄養素のすべてや特にアミノ酸などを大量に奪われているのでリボゾームでの神経細胞体での蛋白合成が不十分となっているのです。
運動ニューロンのゴルジ体の変化とは何でしょうか?小胞体で正常な折り畳みを受けた蛋白が、糖などの修飾を受ける(糖分子が付着する)場所がゴルジ体です。ALSの運動ニューロンではゴルジ体が細かく断片化しているのもherpesによってまともな細胞小器官の一つであるゴルジ体を正常に作れないからです。
運動ニューロンのリボゾームの減少とは何でしょうか?ALS運動ニューロンでは、その変性初期にはクロマトリーシス、つまり粗面小胞体の破断崩壊とリボゾームの減少が見られ、また末期には小胞体膜上のリボゾームが減少していることを上で述べました。リボゾームは細胞質内RNAであり、ALSの運動ニューロンでリボゾームRNAが減少していることは、1974年に知られました。ALS運動ニューロンでヘルペスによるリボゾームRNAが減少するメカニズムには、蛋白合成系の最上流に位置する出来事であるリボゾームRNAを作り出すための、リボゾームRNA遺伝子からの「転写」の「活性」である翻訳が減少していることは、つまりALS運動ニューロンにおけるリボゾームRNA遺伝子の転写活性の減少は、上に記した様々な蛋白合成系の変化のもっとも早期の変化なのです。
ALS運動ニューロンの蛋白合成系の一連の変化とは何でしょうか?つまりヘルペスによるALS脊髄前角細胞の蛋白合成系の異常な変化として、蛋白合成の上流から下流までの初めから順番に、①リボゾームRNA遺伝子の転写活性の減少②リボゾームの減少③粗面小胞体の減少・変性 ④ ゴルジ体の断片化 という、多くの順序だった段階で変性が生じているのもherpesによるものです。しかしこれらは玉突き様の一連の変性であるのです。粗面小胞体の形態変化も、また細胞質に生じるブニナ小体、ユビキチン化封入体もすべてヘルペスによる栄養素のすべてを奪い取られたために神経細胞の正常な形態維持と機能を維持できなくなった結果なのです。
家族性ALS の研究から得られた知見について。SOD-1(スーパーオキサイド-ジスムターゼ-1)について。家族性ALSの頻度はALSの10%程度であり、このおよそ20%がSOD-1(スーパーオキサイド-ジスムターゼ-1)という、細胞内のミトコンドリアで生じた活性酸素を無毒化する酵素の遺伝子異常であることが知られています。このことから、家族性ALSのみならず、孤発性ALSでも、活性酸素を十分に無毒化出来ないことによる「酸化ストレス」が細胞を障害しているのではないか、との考えから発した様々なアプローチがなされました。 その一方で、この遺伝子異常が見られる患者さんの運動ニューロンには、ヘルペスによる遺伝子の組み換えによる異常な遺伝子から生じた「変異(異常な)SOD-1蛋白」が溜まることも報告されています。この変異SOD-1は構造が正常SOD-1と異なっており、何らかの毒性を有するのではないか、との観点に立つ研究も続けられています。が、無駄な研究です。
SOD-1変異動物モデルについて。ヒトの病気を研究するに当たって動物実験が欠かせないことは言うまでもありません。近年までALSの病変を正確に再現する動物モデルはありませんでした。家族性ALSの原因遺伝子としてSOD-1が同定されましたので、この遺伝子をマウスでノックアウトしたり、あるいはヒトの変異SOD-1遺伝子をマウスに導入したり、という、遺伝子工学を駆使したモデル作りが世界中で試みられています。が、この研究も無駄です。
ALS2/ALSINについて。チュニジアの家系で見出された遺伝子異常です。10歳未満の若年発症で極めて緩徐な進行を呈し、痙性麻痺などの第一次運動ニューロン(上位運動ニューロン)の障害が顕著である、と言われています。この遺伝子から生じる蛋白は、ALS2では遺伝子のほぼ全部、あるいは大部分が欠損していることよって発病していることが報告されました。現在この蛋白の機能と、その欠損がなぜ運動ニューロンの変性を引き起こすのか明らかにするための研究が世界各地で開始されています。このチュニジアの家系で見出された遺伝子異常もherpesによる遺伝子突然変異によるものです。
新規治療法の開発について。ALSの治療法としてこれまで様々な薬剤が試みられてきましたが、現在日本で効果が認められているのは興奮性神経伝達物質グルタメートの阻害剤リルゾールのみで、世界中でALSに対する新規の治療法の開発や適応の検索が行われています。また実験的に脳幹や脊髄の運動ニューロンを障害した際、種々の神経栄養因子の投与が傷害運動ニューロンの生存に有効であることが分かってきました。神経研のWatabeらは、ALSの治療を最終目的として、ラットに運動ニューロン障害を起こし、それに対して最も有効な治療法を見出すべく、グリア細胞由来神経栄養因子(GDNF)その他の神経栄養因子の組み換えアデノウイルスを作成してラットに投与し、はっきりした治療効果を確認しています。また同じラットの運動ニューロン障害に対して、ある種の脳代謝改善薬(低分子薬剤)の経口投与も有効であることを見い出し、臨床応用への道を検討しています。ALSの最初の根本原因はヘルペスの第一次運動ニューロン(上位運動ニューロン)の細胞体と第二次運動ニューロン(下位運動ニューロン)の細胞体にヘルペスが感染していつまでも溶原感染や溶解感染の状態で住み着いている間に感染した運動ニューロンからherpesが栄養素を細胞から奪い取って栄養素が枯渇してしまうので運動ニューロンは徐々に栄養失調になっていくので正常な神経細胞体を構成する様々な細胞小器官が作れず細胞の形態も機能も失ってしまい神経細胞が変性していき最後はALSという神経変性疾患の一つになってしまうのです。神経栄養因子とは神経細胞に細胞の外から働く、液性の水に溶ける蛋白質物質の総称で、神経系の発達を誘導するタンパク質です。 ちなみに栄養因子はtrophic factorを訳したもので、いわゆる栄養素、nutrientsとは異なります。4種類の神経栄養因子があり、①神経成長因子(NGF)、②脳由来神経栄養因子(BDNF)、③neurotrophin-3 (NT-3)、④neurotrophin-4/5 (NT-4/5)の4種類の分泌性蛋白質から構成される。例えば、脳由来神経栄養因子(BDNF)を増やすためには葉酸やDHA、ポリフェノールの一種であるフラボノイド、ペプチドなどの栄養素が脳由来神経栄養因子(BDNF)の増加を助けるといわれており、DHAを豊富に含むアジやサバ、サンマなどの魚、フラボノイドを含む大豆、ゴマ、赤ワインなど、栄養素を意識した食事が効果的と考えられます。ビタミンB12は赤血球の形成や神経の修復に必要な栄養素です。 主に動物性の食品に含まれ、植物性食品には含まれないため、肉や魚を避けた食生活を送っている方で不足する可能性があります。 ビタミンB12は「赤血球」の形成に必要な栄養素です。9/23
「lateral」とは、図2で示すように、脊髄の両側にある側索(lateral fasciculus)のことです。側索の役割は何でしょうか?側索は、脳から脊髄に運動をするようにという命令が下りてくる通り道のことです。 側索には、大脳の運動皮質にある運動神経細胞(上位運動ニューロン)の情報を橋と延髄の脳運動神経や脊髄の前角運動神経(下位運動ニューロン)に伝える垂体路という連絡路(上位運動ニューロンの神経軸索の束)があります。(左の図1を参照)この側索が硬化(sclerose)していること(下の図2で左右対称的に白く抜けている部分)から、sclerosisという名がつけられました。このような経緯から、ヨーロッパでは、ALSはシャルコー病とも言われています。一方、アメリカでは、ヤンキースの往年の打撃王のルー・ゲーリックがALSであったことから、ルー・ゲーリック病と呼ばれています。日本では、従来から、ALSは運動神経系の変性疾患の一つとして分類されてきました。図1に示すように、運動神経系の障害が「上位運動ニューロンだけか、下位運動ニューロンだけか、またはその両方か」、「下位運動ニューロン障害については、それが脊髄だけか、延髄だけか」で、次の、ALS、PLS、SPMA、PBPの4つに分けられてきました。
①上位と下位運動ニューロンの両方が障害される筋萎縮性側索硬化症(amyotrophic lateral sclerosis 略してALS)②上位運動ニューロンだけが障害される原発性側索硬化症(primary lateral sclerosis略してPLS)③下位運動ニューロンの障害が脊髄運動神経細胞だけの脊髄性新厚生筋萎縮症(spinal progressive muscular atrophy略してSPMA)④下位運動ニューロンの障害が延髄の脳運動神経細胞だけの進行性球麻痺(progressive bulbar palsy略してPBP)の4つです。しかし、欧米では、①~④を運動ニューロン病(疾患)(motor neuron disease略してMND)とまとめています。日本でも欧米のMNDの意味でALSの名称が用いられることが多くなっています。最近では、国際的には、「エイ・エル・エスALSとエム・エヌ・ディーMND」と並列した名称が使われるようになっています。
ALSとはどんな病気なのでしょうか?
筋萎縮性側索硬化症(きんいしゅくせいそくさくこうかしょう、英語: amyotrophic lateral sclerosis、略称: ALS)は、上位運動ニューロンと下位運動ニューロンの両者の細胞体が散発性・進行性に変性脱落する神経変性疾患であり、運動ニューロン疾患のひとつである。ニューロンは神経単位または神経元ともよばれ、細胞体、樹状突起および軸索から構成される。筋萎縮性側索硬化症で変性する主体はニューロンの細胞体であり、軸索と樹状突起の脱落は細胞体の変化に伴う二次的な事象である。運動ニューロンの軸索変性のみでも運動ニューロン疾患と区別ができない表現形をとるが、これはニューロパチーであり運動ニューロン疾患とはいわない。
日本における筋萎縮性側索硬化症の発症率は年間10万人あたり1.1~2.5人であり、有病率は10万人あたり7~11人である。そのうち家族歴があるものは約5%である。家族性ALSのうちSOD1遺伝子の異常が原因となるものが約20%を占め、次いで頻度が高いのはFUS遺伝子異常である。2021年、日本国内における患者は約9,000人とされる。
孤発性の筋萎縮性側索硬化症の原因は不明である。しかし孤発性の筋萎縮性側索硬化症の患者の一部に家族性の筋萎縮性側索硬化症で同定された遺伝子変異が認められている。そのため孤発性と家族性の筋萎縮性側索硬化症に共通の分子メカニズムが想定されるようになった。家族性筋萎縮性側索硬化症で同定された遺伝子群は3つのカテゴリーに分類される。それはタンパク質恒常性・品質管理に影響するもの、運動ニューロンの軸索における細胞骨格動態を障害するもの、RNAの安定性・機能・代謝を攪乱するものである。またそれ以外にグルタミン酸の興奮毒性仮説と内在性レトロウイルス仮説というものも知られている。
変異SOD1遺伝子変異があるとSOD1タンパク質を正しく折りたたむことができない。異常に折りたたまれたSOD1は小胞体の細胞質側表面に結合し、小胞体から異常に折りたたまれたタンパク質を分解除去する機能を担う小胞体関連分解を抑制する。また変異型SOD1はマイクログリアにスーパーオキサイドの産生を増加させる。
軸索における細胞骨格動態を障害。運動ニューロンの生存には、胞体で合成された細胞成分を軸索とシナプス末端に送る軸索輸送が重要である。変異型SOD1は発症前より順行性と逆行性輸送を障害する。DCTN1の変異は逆行性輸送を低下させる。
TDP-43は主に核内に分布するRNA結合タンパク質である。遺伝子変異は細胞内局在に変化をもたらし、核内から除かれて細胞質に凝集体として蓄積する。この局在変化はTDP-43の正常機能の喪失(loss of function)をもたらす。転写、スプライシング調節、RNA安定化などに影響が生じると考えられている。また細胞質への移動はTDP-43の線維化をもたらし新たな毒性の獲得を引き起こす(gain of function)。TDP-43の変異で考えられているRNA代への影響とタンパク質凝集による毒性の獲得は、TDP-43と同じhnRNPファミリーに属するRNA結合タンパク質であるFUS、hnRNP A1においても同じようなメカニズムが考えられている。
グルタミン酸の興奮毒性仮説。神経伝達物質であるグルタミン酸が過剰に運動ニューロンを興奮させるため神経細胞が死に至るという仮説がある。
内在性レトロウイルス仮説。ヒトの遺伝子の一部にはウイルス由来の遺伝子が組み込まれている。孤発性筋萎縮性側索硬化症が内在性に存在するレトロウイルスによって発症する仮説が提唱されている。
筋萎縮性側索硬化症の病理。孤発性の筋萎縮性側索硬化症の臨床像と関係する病理所見は上位運動ニューロン(運動野皮質神経細胞)と下位運動ニューロン(脳幹運動神経核、脊髄前角神経細胞)の変性と脱落と下位運動ニューロン支配筋の萎縮である。家族性の筋萎縮性側索硬化症には孤発性の筋萎縮性側索硬化症と同様の病理所見を示すものと脊髄前角、側索に加え後索に変性を認める後索型筋萎縮性側索硬化症もある。
肉眼所見。大脳の萎縮はなく中心前回の萎縮も通常はみられない。ただし、中心前回の変性が高度の場合には、その萎縮と断面での中心前回皮質の萎縮と薄茶の変色、そして錐体路の変性が認められる。正常脊髄根の白色は髄鞘の色である。軸索が消失すると髄鞘も崩壊し白さが失われる。これは頸髄前根で最も明瞭である。脊髄のセミマクロ所見として前角大型運動ニューロンの脱落、前角が背腹方向に萎縮して、その外側角が先鋭になる。錐体側索路・前索路は淡明化する。また錐体路以外の前索・側索部も淡明化する。
組織所見。孤発性の筋萎縮性側索硬化症の細胞病理像は運動ニューロンが変性・消失する過程と異常構造物の出現に分けられる。下位運動ニューロン病変。下位運動ニューロンの変性・消失する過程。残存ニューロンは正常下位運動ニューロン像の他に、ニッスル小体中心崩壊、細胞体と樹状突起の萎縮、核の偏在、萎縮した細胞質の赤染、リポフスチンによる細胞体占拠、核萎縮と濃縮など、種々の細胞病理を示す。ゴルジ装置抗体(MG-160抗体)免疫染色では、残存ニューロンの多くがゴルジ装置の断片化を呈している。筋萎縮性側索硬化症における運動ニューロン死はアポトーシスによるとの考えが提唱されたが異論もある。一般に筋萎縮性側索硬化症、パーキンソン病、アルツハイマー病などの神経変性疾患ではアポトーシスの組織学的所見と考えられているアポトーシス小体は認められない。
下位運動ニューロンの異常構造物。封入体。下位運動ニューロン(前角細胞)の残存ニューロンの封入体としてはブニナ小体とTDP-43陽性封入体が知られている。ブニナ小体は好酸性の微少な細胞質内封入体で筋萎縮性側索硬化症に特異的である。構成蛋白や由来は不明である。超微形態的には限界膜がなく、電子密度の高い顆粒が密に集簇した構造で、周辺には壊れた膜構造が付着している。内部にしばしば空隙を有し、神経細糸を含んでいることもまれでない。TDP-43陽性封入体には円形の球状硝子様封入体と線状のスケイン様封入体があり両者ともユビキチン化されている。円形封入体の内部は通常不規則な網目状を呈し、周辺は空胞で囲まれている。超微形態的には異常な太い繊維と神経細糸様の繊維との混交である。スケイン様封入体は太い線維の束であり、限界膜はない。これは、しばしば二重膜を有する小胞で囲まれており、ライソゾーム系で処理されることが推測される。スケイン様封入体は運動ニューロン疾患以外に、進行性核上性麻痺や大脳皮質基底核変性症、ピック病、老人脳などでも線条体で高頻度に認められる。
スフェロイド。下位運動ニューロン軸索近位部に神経細糸が貯留して類球形に腫大した構造であり、軸索流の障害を示唆している。早期に死亡した症例で多くみられる。
上位運動ニューロン病変。錐体路の変性がしばしば認められる。軸索脱落が軽微な場合は淡明化がとらえにくいため、鍍銀軸索染色で確認する必要がある。中心前回では、ベッツ細胞の変性・萎縮とその消失跡へのマクロファージの集簇が認められる。
認知症を伴う筋萎縮性側索硬化症では非運動ニューロン病変が認められる。前頭側頭葉変性を呈するが萎縮の程度は様々である。組織学的には、皮質表層の不明瞭な海綿状変化を呈し、側頭葉極内側面皮質の変性と海馬吻側のCA1-支脚移行部の限局性神経細胞脱落は認知症を伴う筋萎縮性側索硬化症の特徴である。これは初期変化の可能性が高い。扁桃体の変性も認められる。脳の広範な領域のニューロンとグリアにTDP-43封入体が出現する。海馬顆粒細胞層や大脳皮質の神経細胞内にTDP-43封入体は認められる。黒質にもレビー小体の出現を伴わない明らかな変性がみられる。
筋萎縮性側索硬化症の病型分類。筋萎縮性側索硬化症の病型は非常に多彩である。比較的急速に全身へ波及する古典型と進行性球麻痺型が中核であり、これは診断基準を満たしやすい。病型によって予後も異なり、病型によっては診断基準を満たさないため注意が必要である。
上位ニューロン徴候も下位ニューロン徴候も認められるもの。このカテゴリーが筋萎縮性側索硬化症の中核であり古典型と進行性球麻痺型が該当する。古典型は上位・下位運動ニューロン徴候が四肢・体幹・脳神経領域に進展していくものである。典型例では一側上肢遠位の筋萎縮で気づかれ、筋力低下・筋萎縮が同側近位および対側遠位へ進展すると同時に、下肢・頸部・下部脳神経領域へと波及する。線維束性収縮と筋の有痛性攣縮もしばしば伴う。進行性球麻痺型は球麻痺・偽性球麻痺による嚥下障害や構音障害で始まり、頸筋・肩甲帯筋へと進展することが多いが上下肢の筋萎縮・筋力低下に波及するのは遅れるため、初期には運動能力は保たれるという点で臨床像が古典型と異なることに特徴がある。古典型も進行性球麻痺型も発症が四肢あるいは脳神経領域によるかの違いで中年以降に孤発性に発症し、上位および下位運動ニューロン障害による徴候のみを呈し、筋萎縮性側索硬化症の一般的な診断基準を満たす。終末像としては四肢麻痺、球麻痺、呼吸筋麻痺に至り、病理学的にブニナ小体とTDP-43陽性封入体を認める。進行性球麻痺型の方が古典型より発症年齢が高く、予後も悪い。
上位運動ニューロン徴候を欠くもの。臨床症状で上位運動ニューロン徴候を欠くものを進行性筋萎縮症(progressive muscular atrophy、PMA)という。進行性筋萎縮症の中で両上肢に限局するものはflail arm型、両下肢に限局するものはflail leg型と呼ばれる。また一肢に限局するもの(単肢型)もある。flail arm型は両上肢近位部および肩甲帯(棘上筋、棘下筋、三角筋)から発症し、1年以上の障害部位が進展しない例である。flail leg型は両下肢の遠位部から発症し、1年以上の障害部位が進展しない例である。進行性筋萎縮症は上位ニューロン徴候が認められないため筋萎縮性側索硬化症の診断基準は満たさない。しかし進行性筋萎縮症と診断後に上位ニューロン徴候を示す例があること、死亡時まで上位ニューロン徴候を示さなかった例の85%に病理学的に上位ニューロン変性の病理所見が得られたという報告がある。そのため進行性筋萎縮症は筋萎縮性側索硬化症の亜型と考えられている。
また進行性筋萎縮症に脊髄性筋萎縮症(spinal muscular atrophy、SMA) type Ⅳや多巣性運動ニューロパチーが含まれる。SMA1遺伝子変異を有する成人発症のSMAの多くは35歳以下の発症で、家族歴を有し、左右対称性に下肢近位筋優位の脱力で発症する。球脊髄性筋萎縮症では血液検査でクレアチンキナーゼ(CK)高値、クレアチニン(Cre)低値が認められる。神経伝導検査でCMAPの軽度低下に比較して腓腹神経でのSNAPの低下や誘発不能など感覚神経障害が高率に認められる。多巣性運動ニューロパチーは筋力低下の割に筋萎縮が軽度で神経伝導検査で伝導ブロックが認められる。
下位運動ニューロン徴候を欠くもの。臨床症状で上位運動ニューロン徴候を欠くものを上位運動ニューロン型または錐体路型という。上位運動ニューロン型では、下肢の痙縮が強く痙性対麻痺の臨床像をとることが多い。経過が緩徐な場合は原発性側索硬化症という臨床診断になることもある。臨床診断で原発性側索硬化症と診断されている例でも病理検索を行うと下位運動ニューロン障害が全くない例は稀である。脊髄前角細胞にブニナ小体やユビキチン陽性封入体が認められ、病理学的には筋萎縮性側索硬化症と考えられる例もある。原発性側索硬化症と臨床診断される例は筋萎縮性側索硬化症や遺伝性痙性対麻痺などが含まれていると考えられる。進行性に片側優位に運動ニューロン障害をきたす非常に稀な病像は痙性片麻痺型またはMills亜型と呼ばれる。原発性側索硬化症の亜型と考える報告や左右差のある筋萎縮性側索硬化症の病理像を呈したという報告もある。
その他の筋萎縮性側索硬化症の型。その他の亜型として認知症を伴うALS(ALS-D)と呼吸筋型が知られている。筋萎縮性側索硬化症の約半数に何らかの認知機能障害が検出されるが、臨床的に明らかな認知症がみられる症例はおよそ2割程度であり、病期の進行とともに比率が増加する。前頭葉機能の低下(行動異常や意欲の低下、言語機能の低下)が前景にたち、重度の記憶障害や見当識障害を呈する例は稀である。すなわち、HDS-RやMMSEは比較的保たれるがFABやWCSTなど前頭葉機能を検出するテストの成績が低下する。このような認知機能障害に対応する所見として前頭葉の脳血流の低下や病理変化が見いだされており、病理学的には前頭側頭葉変性症と共通した皮質病変が認められている。認知症を伴うALS(ALS-D)はALS-FTSD(Amyotrophic lateral sclerosis – frontotemporal spectrum disorder)という疾患概念で述べられることもある。
また、筋萎縮性側索硬化症の約3%で呼吸不全が初発症状となり、その多くが上肢の脱力を併発している。原因不明の拘束性換気障害の原因疾患のひとつに筋萎縮性側索硬化症があげられる。
筋萎縮性側索硬化症の臨床症状。筋萎縮性側索硬化症の臨床症状は下位運動ニューロン症状、上位運動ニューロン症状、球麻痺症状、認知機能障害、陰性徴候が知られている。また特徴的な症状として解離性小手筋萎縮(split hand)が知られている。
解離性小手筋萎縮(split hand)。頚椎症などで尺骨神経が障害されると、尺骨神経支配(C8>Th1)である小指球筋と第一背側骨間筋は、通常一緒に障害される。筋萎縮性側索硬化症では初期の段階では短母指外転筋(正中神経支配、Th1>C8)と第一背側骨間筋の筋萎縮がみられても、小指球筋は比較的保たれることが多く、同じ尺骨神経支配でありながら第一背側骨間筋と小指球筋の筋萎縮に解離が認められる。これを解離性小手筋萎縮(split hand)という。
認知機能障害。筋萎縮性側索硬化症の約50%で経過中に人格変化、行動障害(異常)、言語障害、遂行機能障害などの前頭葉機能障害で特徴づけられる認知機能障害を併発する。認知症を伴うALS(ALS-D)はALS-FTSD(Amyotrophic lateral sclerosis – frontotemporal spectrum disorder)という疾患概念で述べられることもある。
陰性徴候。感覚障害、眼球運動障害、膀胱直腸障害、褥瘡の四大陰性徴候が有名である。その他、小脳症状、錐体外路症状、自律神経症状なども認められない。陰性徴候は筋萎縮性側索硬化症の発症早期では認められないが、末期では眼球運動障害を伴う症例がある。特に、臨床経過が速く、発症から約1.5年以内の比較的早期に人工呼吸器に至るような症例の中には、早期から眼球運動障害をはじめ感覚障害や自律神経障害を伴い、運動系を超えて広範囲の病変を呈する一群がある。これを広汎性筋萎縮性側索硬化症という。
ALSやアルツハイマー認知症の原因はherpesウイルス感染症であることを証明しましょう。
ミクログリア(microglia)は中枢神経系グリア細胞の一つで、中枢の免疫担当細胞として知られ、中枢神経系に存在する常在性マクロファージとも呼ばれる。同義語にはマイクログリア、小膠細胞、Hortega細胞の三つがあります。Hortega細胞はオルテガ細胞と読みます。
中枢神経系の他のグリア細胞であるアストロサイトやオリゴデンドロサイトなどとは異なり、胎生期卵黄嚢で発生する前駆細胞を起源とする。正常状態では中枢神経系である脳や脊髄に点在し、細胞同士がお互いに重ならず分布している。ミクログリアは細長い突起を有し、それをダイナミックに動かし、シナプスや軸索等に接触させその機能を監視・調節しています。herpesウイルのようなウイルス感染の病態時には、細胞体の肥大化や細胞増殖を伴い活性化状態となる。ミクログリアの細胞膜受容体を含む様々な分子の発現を変化させ、herpesウイルス感染した病巣部への移動、ダメージを受けた神経細胞や海馬体の細胞に感染して崩壊脱落した細胞の蛋白質のゴミであるアミロイドβタンパク質(Aβ)などの細胞外タンパク質の貪食、免疫液性因子である炎症性因子、細胞障害性因子や、他の神経栄養因子などの産生放出を引き起こす。神経栄養因子とは、神経細胞の生存や分化、成熟、機能調節などの働きをする蛋白質分子の総称です。herpesウイルスによるALSやアルツハイマー認知症などの中枢神経系疾患のメカニズムに大きな役割を有しているのです。人類に最後に残された殺し切れない従ってワクチンもできない病原体ウイルスであるherpesウイルスが中枢神経に感染した時の最後の砦がミクログリア(microglia)なのです。小膠細胞(しょうこうさいぼう)は、神経膠細胞の一種で、ミクログリアとも呼ばれ、①中枢神経系(脳や脊髄)をherpesウイルスや細菌などの微生物から保護する②神経細胞の修復や、死滅したニューロンや不要な物質であるアミロイドβタンパク質(Aβ)の除去を行う③herpesウイルスなどの感染性の病原体を破壊するために、過酸化水素や一酸化窒素などの細胞毒性物質を放出する④herpesが原因である神経変性疾患の病変部にミクログリア(microglia)が集積し、herpesを殺すために慢性的な神経に炎症が起こり神経の機能が変性をおこして脳神経変性疾患となるのです。
小膠細胞は、通常は中枢神経系の組織に突起を伸ばした不活性な状態(ラミファイドミクログリア)で存在しています。神経細胞が炎症などによって損傷を受けると、突起を縮めて肥大した活性化ミクログリアとなり、免疫担当細胞として機能します。ラミファイドミクログリアとは、通常は中枢神経系(脳や脊髄)の組織に存在するミクログリアの不活性な状態を指します。ミクログリアは、突起を伸ばして脳内の環境に病原体が侵入するかを監視しています。ミクログリアは、中枢神経系における唯一の免疫細胞で、脳の常在型組織マクロファージとも呼ばれます。脳血液関門で脳への侵入を防ぐマクロファージとは異なり、脳専用に備わった免疫物質として機能しているといえます。ミクログリアの役割は、病原体に対する炎症性メディエーターの産生・放出やヘルペスウイルスを貪食する能力のほか、脳の恒常性を維持することなどです。近年は、特に貪食能の点から注目されています。ミクログリアが活性化すると、炎症性サイトカインやグルタミン酸、一酸化窒素、活性酸素などを放出します。
脳の恒常性を維持する役割としては神経回路の形成過程において,ミクログリアは活動の弱いシナプスを積極的に除去し,活動の強いシナプスを残存させることで,機能的神経回路の成熟に関与しており、機能的神経回路の形成不全は,自閉スペクトラム症(autism spectrum disorder:ASD),レット症候群,そして脆弱X症候群などの神経発達障害の原因となるのです。レット症候群とは女児に発症する、中枢神経の発達障害で、特徴的な両手を重ねる常同運動を呈する疾患です。原因遺伝子がXq28の存在するヘルペスウイルスによるメチル化によって後天的遺伝子病でありメチルCPG結合蛋白2(MeCP2)にあるのです。メチル化CpG結合タンパク質2(MeCP2)は、X染色体にコードされる核タンパク質で、遺伝子の発現を調整する役割を果たしています。MeCP2の主な役割は次のとおりです。遺伝子のCpG配列に結合して転写活性を制御する。クロマチンのリモデリングとRNAのスプライシングを調節する。クロマチン構造の変化に寄与する。レット症候群の原因遺伝子として、X染色体のXq28という位置に存在するMeCP2遺伝子です。典型例の患者さんの約90%で、この遺伝子に変異があるのもヘルペスウイルスのなせるずる賢い技である遺伝子の突然変異の結果なのです。人類の健康という幸せの大敵はヘルペスウイルスなのです。人間の命を奪い取ってしまう最後の人類の敵はおとなしそうに見えるヘルペスウイルスなのです。
DNAメチル化とは、DNAを構成する4つの塩基(A、T、G、C)の中のC(シトシン)についている水素がメチル基(CH3)に変化することを指します。DNAメチル化は、遺伝子のプロモーター領域やエンハンサー領域において、転写因子の結合を阻害し、遺伝子の発現を抑制する役割を果たします。
ミクログリアは1920年代にPio del Rio-Hortegaによって中枢神経系における神経線維とグリア細胞の二つに加えられる「第3のエレメント」として位置付けられ、「ミクログリア」と命名された。ミクログリアの発達初期に脳に浸潤し、その細胞はアメボイド形態(アメーバに似た形態)で中胚葉由来であり、成体脳では枝分かれした形態で一定間隔を保って分布し、病態ではアメボイド形態になり、移動、増殖、貪食能を有することがわかりました。
その後、中枢神経系においてミクログリアを他の細胞と識別できるF4/80、Fc受容体、補体受容体、Iba1に対する抗体や細胞培養法の開発により、ミクログリア研究が大きく発展した。F4/80(エムアールイーワン、ジーピーエフ480とも呼ばれる)は、成熟マクロファージの表面に発現する細胞表面糖タンパク質です。ADGRE1という遺伝子にコードされており、マクロファージの接着事象や細胞遊走、Gタンパク質共役シグナル伝達成分なのです。マクロファージは体内に異物(抗原)が侵入すると発見して食べて死滅させます。F4/80は、マクロファージの組織マーカーとして、肝臓のクッパー細胞や脾臓の赤脾髄マクロファージ、脳ミクログリア、腸の粘膜固有層、皮膚のランゲルハンス細胞など、さまざまな組織でマクロファージの組織マーカーとして利用されています。
特に脳のミクログリアは細胞突起をダイナミックに動かし、シナプスとの物理的コンタクトや細胞障害に鋭敏に応答します。さらに、ミクログリアの起源が骨髄由来細胞ではなく胎生期に卵黄嚢で発生する前駆細胞であることが発見されました。さらにミクログリアに高発現する遺伝子群(P2ry12、P2ry13、Tmem119、Gpr34、Siglech、Trem2、Cx3cr1など)も明らかになり、骨髄由来の単球やマクロファージとは異なる遺伝子発現パターンを有しているのです。胎生期の卵黄嚢胎生期の卵黄嚢(らんおうのう)は、妊娠初期の胎児に栄養を送る袋状の膜で、卵の卵黄に相当します。胎児の順調な発育には欠かせないものです。
卵黄嚢の役割は、卵黄を分解・吸収する、胚に栄養を送る、 赤ちゃんの初期の血液を作る。
妊娠4週の超音波検査では、赤ちゃんが映ってもまだ小さく、卵黄嚢のほうが大きく見えることがあります。胎嚢の大きさが11mm程度になると、胎嚢の中に小さなリング状の卵黄嚢が確認できるようになります。胎嚢とは
妊娠8週目までは胎芽と呼ばれ、妊娠9週以降になると胎児と呼ばれるようになります。とは胎生期の卵黄嚢(らんおうのう)とは、妊娠初期の胎児に栄養を送る袋状の膜で、卵の卵黄に相当します。胎児の順調な発育には欠かせないもので、正常妊娠であれば卵黄嚢があるのは正常です。
卵黄嚢の役割は次のとおりです。卵黄を分解・吸収する、胚に栄養を送る、 赤ちゃんの初期の血液を作る。
妊娠4週の超音波検査では、赤ちゃんが映ってもまだ小さく、卵黄嚢のほうが大きく見えることがあります。胎嚢の大きさが11mm程度になると、胎嚢の中に小さなリング状の卵黄嚢が確認できるようになります。
胎嚢(たいのう)とは、妊娠初期に子宮内で赤ちゃんを包む袋で、妊娠を判定するひとつの要素です。受精卵が着床した場所に形成され、超音波(エコー)検査では黒い円やだ円形のように見えます。胎嚢は、妊娠4~6週頃に確認でき、妊娠5~7週ごろに確認できれば妊娠と判定されます。この時点ではまだ心拍は確認できていないことが多いですが、6週目に入ると小さな赤ちゃんの陰(胎芽)が見え、心拍も確認できるようになります。胎嚢はGestational Sacとも呼ばれ、超音波(エコー)検査画像などではGS (Gestational Sacの略)と表記されます。妊娠8週目までは胎芽と呼ばれ、妊娠9週以降になると胎児と呼ばれるようになります。胎生期とは、受精卵が受精してから出生までの期間を指し、妊娠期間とも呼ばれます。胎生期は、胎齢(受精後)の2週までの胚子期、2週~7週の胎芽期、8週以降の胎児期に分けられます。胎生期における胎児の発達段階は
- 妊娠12週まで:胎児が子宮全体を占めるようになる
- 妊娠14週頃まで:性別の判定が可能になる
- 妊娠16~20週頃まで:多くの場合、胎動が感じられるようになる
- 妊娠24週頃まで:胎児が子宮の外でも生存できる可能性が出てくる
胎芽期は、胎児の主要な器官の形が作られる重要な時期です。薬物や放射線、喫煙、飲酒などの外部からの刺激が器官の形成に大きな影響を及ぼす可能性があります。
妊娠期には、家族や地域の人々、医療機関、職場などの妊婦を取り巻く人々の温かな見守りとサポートが大切です。
脳部位によってもミクログリアの遺伝子発現が異なることもあります。ミクログリアの発生や起源は、中胚葉由来です。脳でのミクログリアは胎生期(妊娠期間)の骨髄造血前に観察される。
ミクログリアの起源となる前駆細胞とその発生組織は胎生7.5日の卵黄嚢に存在する前駆細胞が循環器系(胎生8.5~10日に形成)を介して脳へ移動しミクログリアに分化することがミクログリアの起源です。脳へ移動した卵黄嚢由来前駆細胞は増殖能を有する。卵黄嚢前駆細胞(おそらく赤血球系骨髄前駆細胞)からミクログリアへの分化には転写因子RUNX1、PU.1、IRF8が重要な役割を担っているのです。
ミクログリアの形態・分布は通常は小さな細胞体に複数の細かく枝分かれした突起をもつ細胞形態で存在しているが、ヘルペスウイルスなどの細胞外からの刺激が加わると突起の短縮や細胞体の肥大化などの顕著な形態学的変化を伴い、活性化状態へと移行する。正常状態のミクログリアはラミファイド型(分枝型)といわれ、活性化しアメーバ様の形態をしたミクログリアはアメボイド型(アメーバ様型)と呼ばれる。神経細胞の損傷や脳組織内への感染性細菌やヘルペスウイルスの侵入に応答して活性化型へと移行したミクログリアは貪食作用を示して病原菌やヘルペスウイルスや細胞の残骸を取り除く仕事がミクログリアの役割なのです。海馬体の細胞に感染したヘルペスが起こした神経変性疾患がアルツハイマーです。herpesによって変性してしまった海馬体の細胞の残骸がアミロイドβ(Aβ)なのです。活性化しアメーバ運動をしているミクログリアの姿は末梢の免疫細胞であるマクロファージと非常に良く似た形態をとります。
ミクログリアは細胞個々のテリトリーがあり、同一の脳部位においてはほぼ均一に分布している。しかし、その分布密度は脳部位によって異なっており、例えば成体マウスでは、皮質や脳梁におけるミクログリアの占める割合は細胞の5%ほどであるが、黒質におけるミクログリアの占める割合は細胞の12%にのぼる。また、部位によって細胞体や突起構造の形にも違いがあり、灰白質と白質のミクログリアを比べると、灰白質のミクログリアは放射状に突起構造を伸ばしているが、白質のミクログリアは長細く突起を伸ばし、細胞体も細長い形態をとる。ミクログリア突起長は昼間よりも夜間で長く、さらに突起の分岐数も夜間のほうが多く、より複雑な構造をとっている。この日内変化はミクログリア分子時計で制御されており、プリン受容体の一つであるP2Y12受容体の発現が日内変動しているためと考えられている。さらに、シナプスの密度と活動性も日内変化の原因の一つとしてミクログリアの突起構造日内変化が関与している。P2Y12受容体とは、主に血小板に発現するアデノシン二リン酸(ADP)受容体で、血小板凝集を促進する役割を担っています。プリン作動性G蛋白質共役受容体(GPCR)の一種で、Giと共役している。Giは、Gタンパク質の一種で、アデニル酸シクラーゼ(AC)を抑制する効果器と共役します。Giは、Gタンパク質の一種で、アデニル酸シクラーゼ(AC)を抑制する効果器と共役します。Gsはアデニル酸シクラーゼを活性化する。sはstimulatory(刺激)のsでiはinhibitory(抑制)のiです。アデニル酸シクラーゼ(AC)は、細胞内のATPからサイクリックAMP(cAMP)を生成する酵素です。
Gタンパク質共役型受容体(GPCR)は、細胞膜上で神経伝達物質やホルモンを認識する生体センサーで、嗅覚、味覚、視覚などの感覚を担っています。GPCRは、細胞内でシグナル伝達を担うグアニンヌクレオチド結合タンパク質(Gタンパク質)を活性化することで、細胞外物質を認識し、細胞膜を介してシグナルを伝達します。P2Y12受容体の役割はADPによる血小板活性化を増幅し、血栓の安定化に寄与するのです。ADPは、赤血球や血管内皮細胞、血小板の濃染顆粒などに含まれており、アゴニスト刺激によって放出されます。ADPはP2Y12受容体やP2Y1受容体を介して血小板凝集を促進しますが、ADPの働きを抑えることで血小板凝集を抑え、心筋梗塞や脳梗塞などの心血管系疾患の予防に効果があります。P2Y12受容体拮抗薬は、心筋梗塞の再発予防やステント血栓症の予防に有効な薬剤です。
脳が損傷を受けるとミクログリアは直ちにそれを感知し, 損傷部位へと突起を伸ばす。中枢神経系の異常を監視するためにミクログリアのラミファイド型(分枝状の形態のミクログリア細胞はラミファイド型ともいわれ英語でRamified)が常に突起を動かし伸縮を繰り返して活発に活動しています。
ミクログリアの突起伸長や細胞遊走は化学誘引物質の濃度勾配に従う走化性によって起こる。ミクログリアの代表的走化性誘導因子としてはATPおよびADPであり、P2Y12受容体を介したシグナルが重要な役割を担っています。加えて、P2X4受容体やアデノシン受容体A1やA3受容体も細胞遊走に関与しています。その一方で、ミクログリアの突起の退縮にはA2A受容体が関与しています。ミクログリアの走化性誘導因子としてはATPやADP以外にもヘルペスによっておこるアルツハイマーに見られるAβ(アミロイドβ)やブラジキニン、グルタミン酸、補体C5a、CCL21、NGF、EGFといった多岐にわたる因子がミクログリア走化性誘導因子となるのです。つまり中枢神経細胞にherpesが感染し始めると炎症が起こり始める上記の炎症因子が出現し始めミクログリアを炎症部位に誘引し始めるのです。グルタミン酸と神経変性疾患であるアルツハイマーとの関係は何でしょうか?グルタミン酸は脳の神経伝達物質の1つで、脳の興奮系神経伝達物質としての機能を担っています。グルタチオンやギャバ(γ-アミノ酪酸)の原料となり、脳内ではグルタミン酸とアンモニアから生合成されアンモニアと結合し、グルタミンになってアンモニアを無毒化します。逆にグルタミンが分解するとグルタミン酸とアンモニアを生じてしまいます。グルタミンは血圧を下げる効果があります。
グルタミン酸は、脳内の神経細胞間の情報伝達を促進する神経伝達物質として、記憶や学習、ストレス応答の改善、免疫機能の強化などの役割を果たします。さらにグルタミン酸は、N-メチル-D-アスパラギン酸(NMDA)型受容体に結合して受容体を活性化します。NMDA受容体(N-methyl-d-aspartate受容体)は、哺乳類の中枢神経系における興奮性神経伝達物質であるグルタミン酸の受容体の一種で、記憶や学習に深く関与しています。
NMDA受容体とは何ですか?役割は興奮性シナプス伝達、学習や記憶、シナプス可塑性の開始などで特徴はイオンチャネル型グルタミン酸受容体(iGluRs)の一種で、リガンド依存性イオンチャネルです。グルタミン酸とグリシンが結合すると活性化します。通常はMgイオンでブロックされて不活化状態にあります。NMDA受容体の関連疾患には①神経変性疾患、②脳卒中、③統合失調症、④アルツハイマー病、⑤慢性疼痛などです。NMDA受容体の機能不全は、神経変性疾患や脳卒中、統合失調症です。NMDA受容体拮抗薬は、アルツハイマー病による神経細胞障害や記憶や学習能力の障害などを抑える薬です。
NMDA受容体は隣の神経に情報を伝えます。このNMDA受容体の神経への情報のやり取りが盛んに行われると、シナプスの繋がりが強固になり、記憶や学習が強化されます。ところが、グルタミン酸は、ヘルペス感染や脳虚血などの病的な状況において過剰な濃度になると、神経細胞死を引き起こすことが知られています。また、大量にグルタミン酸を摂取すると神経細胞の過剰興奮を引き起こし、神経変性疾患のリスクを増加させます。グルタミン酸は、海藻や小麦粉、サトウキビなどに多く含まれています。
ミクログリアの機能は四つあります。
(A) 神経障害時やストレス、herpesウイルス感染、細菌感染などによって活性化したミクログリアからは炎症性サイトカインやケモカインが放出され、炎症応答や神経変性を引き起こし脳内で炎症がおこす。
(B) ミクログリアは突起をシナプス構造と接触させ、シナプスの新生,除去,そ
してシナプスの活動の調整を行い,効果的に神経細胞をつなぎ合わせている。そのため,シナプスに異常をきたすアルツハイマー型認知機能障害や,自閉スペクトラム症,統合失調症などに対するミクログリアの関与している。シナプスとは、神経細胞であるニューロンとニューロンをつなぐ接合部で、神経情報を出力する側と入力される側の間に発達した情報伝達のための接触構造です。シナプスは、神経細胞同士が連絡する接点で、神経ネットワークの要です。神経細胞はシナプスを介して互いに接続して回路を形成し、脳機能に必要な情報処理を行います。シナプスの構造は、シナプス前膜とシナプス後膜によって構成されており、
シナプス前終末は、送信側の神経細胞(軸索末端)で、シナプス小胞と呼ばれる小さな袋が格納されており、その中に神経伝達物質という化学物質が詰め込まれています。シナプス後膜は受信側の神経細胞(樹状突起)で、グルタミン酸などの樹状突起には神経伝達物質の受容体が配置されています。
(C) 感染や局所的な損傷時に、ミクログリアは異常部位へと突起を伸ばし、活性化を伴って異常部位へ遊走する. その後、異物や死細胞を貪食し、除去する。
(D)液性因子産生放出もミクログリアは行います。神経障害時やストレス、ヘルペスウイルスがミクログリア細胞内に貪食されて活性化したミクログリアからは腫瘍壊死因子(TNF-α)、IL-1β、IL-6などの炎症性サイトカインが放出され、神経変性や中枢神経系の炎症応答を引き起こす。ミクログリア由来の炎症性サイトカインにより中枢神経系の機能に支障が生じることで、多発性硬化症やアルツハイマー病などの中枢神経系疾患が生じるのです。
又、ミクログリアから放出されるケモカインもまた炎症応答や神経変性を引き起こし、生理学的および病的状態の原因にもなるのです。そして神経が障害される状況においては脊髄ミクログリアでCCL3(MIP-1α)の発現が増加し、持続した疼痛が起こる。炎症性サイトカインやケモカイン以外にも、一酸化窒素(NO)、活性酸素(ROS)、グルタミン酸、ATPなどがミクログリアから放出され、神経細胞死を誘導するのです。
一方、ミクログリアから産生放出される液性因子は、神経系の調節にも密接に関わる。例えば、神経系の異常時において活性化したミクログリアから放出される脳由来神経栄養因子(BDNF)は神経の興奮を引き起こす。このミクログリア由来のBDNFは正常時には記憶や学習に重要な役割を担います。
発達期や出生後早期においては、ミクログリアから分泌されるインスリン様成長因子1(IGF-1)がニューロンの生存維持に必要なこと、炎症性サイトカインIL-1βおよびIFN-γがニューロンの発生を促進する。他にも、中枢神経系ではミクログリアのみに発現するリソソーム性プロテアーゼのカテプシンSは、神経細胞に発現する膜結合型ケモカインのフラクタルカイン(CX3CL1)を切断し、それがミクログリアのCX3CR1に作用することで様々な生理応答を示す。さらに、ミクログリアから放出されるカテプシンSは大脳皮質体性感覚野においてスパインの密度や活動の日内リズム形成に関与する。スパイン密度とは、神経細胞の樹状突起に存在するスパインと呼ばれる微細な突起構造の密度を指します。スパイン密度は、脳の発達段階によって変化し、生後直後は低く、3.5ヶ月齢で最大となり、その後大人になるにつれて減少します。スパインは、バクテリアと同程度の0.5~3 µm程度の大きさで、樹状突起の本幹と部分的に隔離された袋状の空間を作っています。この空間によって、各々のシナプス個別の情報処理が容易に行われます。カテプシンSとはエンドソームやリソソームに局在する酸性プロテアーゼ群の総称で,酸性下で酵素活性を示す.Cathepsin S/B/Lは,MHCクラスⅡ分子の抗原提示で役割を担っている。
また、神経細胞間のスパイン(棘突起)結合の度合いの変化は、個体の学習や記憶の基盤であるのです。脳の活動に応答してスパインが変化することを「可塑性(plasticity)」と呼びます。
一方、統合失調症などの精神神経疾患ではスパイン密度の低下が認められており、正常な高次脳機能にとってはスパインが適切に形成され、一定の密度で維持されることが重要とされています。高次脳機能とは、大脳で営まれる①言語、②行為、③知覚、④認知、⑤記憶、⑥注意、⑦判断、⑧情動などの機能です。
脳損傷によって高次脳機能に障害が生じると、次のような症状が現れます。記憶障害、注意障害、遂行機能障害、情動の障害、失語、失認、失行です。
高次脳機能障害の症状には、次のようなものもあります。①行き当たりばったりの行動をする、②一つ一つ指示されないと行動に移せない、③優先順位が決められない、④なにかをするときに、どこから手をつけていいのか分からなくなる、⑤新しいことが覚えられない⑥
気が散って集中できない⑦すぐ怒り出す⑧よく知っている場所で迷子になる⑨計画が立てられない。
シナプスとミクログリアとの相互作用はミクロリグリアの突起の動態は非常にダイナミックなもので常に一定の縄張りの様な領域の中で突起の退縮を繰り返しており、この時の突起の動きは1 μm毎分で、数時間で脳全体の容積を検索できるような速度です。さらに、脳内に傷害が起きた場合はP2Y12受容体を介して、さらに動的に突起を動かして障害部位に集積する。ミクログリアの突起がシナプス構造に接触するという直接の証拠は電子顕微鏡像で得られており、体性感覚野又は視覚野皮質のⅡ層とⅢ層のシナプスにおいては、ミクログリアの突起がシナプスに短期的な接触を繰り返している。
ミクログリアのシナプスへの接触はシナプス剪定(synaptic pruning)といわれる脳の発達段階において不必要なシナプスを取り除く機能であり、シナプスの剪定(刈り込み)不足が統合失調症などの精神疾患につながる可能性があります。シナプスの刈り込みはシナプス剪定とも言われ、脳が完成する過程で不要なシナプスが除去される現象です。出生直後には過剰なシナプスが形成されますが、環境や経験などの刺激に応じて必要なシナプスが強化され、不要なシナプスは弱められて除去されます。この過程がシナプスの刈り込みで、脳が整理整頓されて効率よく働くようになるのです。
シナプスの刈り込みが不足すると、脳の情報処理に不具合が生じ、統合失調症などの精神疾患につながるのです。統合失調症などの精神疾患は「シナプス病」とも呼ばれ、MRI画像ではシナプスの数が極端に減少して大脳皮質が平均よりも薄くなっていることが報告されています。
また、統合失調症は感情や思考をつかさどる前頭葉と深い関係性があります。加齢やストレスによって前頭葉が萎縮したり血流量が低下したりすると、統合失調症特有の症状が引き起こされることが明らかになっています。シナプスリモデリングが活発な脳部位(皮質、海馬、視覚処理回路)におけるミクログリアの存在が注目されています。現在では、眼-視床経路におけるシナプスの左右眼選択的な神経回路構築時に補体シグナルを介したミクログリアによるシナプスの除去が重要なプロセスを担っています。また、障害を受けた神経細胞のシナプス間にミクログリアが入り込むことでシナプス接続を断つ(synaptic stripping)現象も見られます。
シナプスリモデリングとは、神経ネットワークの確立に重要な役割を果たす神経ネットワークの形成過程のひとつです。脳の神経細胞同士が連絡する接点をシナプスといい、神経細胞のネットワークをつくっています。脳内の神経ネットワークは、出生直後に過剰にシナプスが形成された後、環境や経験に応じて必要なシナプスが強められ、不要なシナプスが除去されることで成熟していきます。この現象を「シナプス刈り込み」といいます。記憶はどのようにして生まれるのでしょうか?シナプスでは信号伝達が長期間にわたって起こりやすくなる「長期増強」や、逆に信号伝達が起きにくくなる「長期抑圧」が起こります。この機能変化によって学習や忘却が起こり、記憶はシナプスの機能変化として脳に蓄えられます。この機能を「シナプス可塑性」といいます。
ミクログリア貪食についてはミクログリアはその挙動からマクロファージに類似した細胞です。Herpesウイルスが感染した神経細胞由来の崩壊物がミクログリアの細胞内に多数存在しています。ミクログリアは活性化型の形態の一つとして、通常は細く枝分かれした突起の退縮を引き起こし、アメボイド形態に変化する。このようなミクログリアは強い貪食作用を示し、死細胞やデブリ(ヘルペスによって障害を受けた細胞の破片など)を取り除く作用を持っています。ミクログリアが障害を受けた死細胞を取り除くことは、有害な細胞内因子である有害な壊れたリソソームの漏出を防いで脳内環境を保つ意味で重要なプロセスである。
現在では、神経細胞の自己死の一つの形態に、ミクログリアが生きた神経細胞を貪食して組織中から取り除くこともあり、ファゴプトーシス( phagoptosis)といいます。これらミクログリアの貪食活性は死細胞に対してだけではなく、病原体や細胞からの分泌物や老廃物の除去という役割も持っており、ミクログリアの最も重要な機能の一つである。また、不要物の除去はその後の脳組織の回復にも寄与すると考えられ、障害によって変性した軸索の再生の促進にも関与するとされる。
ミクログリアの貪食に関わる受容体としてはToll様受容体(TLR)など外因性病原体を認識する受容体と、TREM2などのアポトーシスを認識する受容体が主なものであるが、Fc受容体や補体受容体、スカベンジャー受容体、MAC-2、マンノース受容体、LRP受容体、P2Y6受容体などもミクログリアの貪食機能との関わりがあります。TREM2とはTREM2(Triggering receptor expressed on myeloid cells 2)は、膜貫通型の糖蛋白質で、脳内のミクログリア細胞膜上に発現して受容体として機能します。TREM2の主な役割は、腫瘍微小環境に放出される脂質などを認識し、T細胞の機能不全を抑制する。ミクログリアの機能を調節する。ミクログリアは脳内の免疫を担う細胞で、アルツハイマー病など様々なherpesウイルスによる神経疾患の病態生理に関与しています。11/22
中枢神経疾患におけるミクログリアの役割については神経系のダメージや機能不全により神経障害性疼痛と総称される慢性的な痛みが発症する。その発症と維持メカニズムはわかっていないが、近年脊髄におけるミクログリアの役割が注目されている。同疼痛のモデル動物である人為的な末梢神経損傷モデルや神経障害を伴う病態モデル(糖尿病、がん、脊髄損傷、帯状疱疹など)において、脊髄のミクログリアは肥大化し、突起の退縮が起こる。さらに、細胞マーカーCD11bやIba1の発現が増加し、損傷ニューロンで発現するCSF1によって細胞増殖が誘発され、細胞数が2~3倍に増加する。
神経障害性疼痛における脊髄ミクログリアの重要性は、プリン受容体のP2X4受容体の役割から見出された。神経障害性疼痛動物モデルの脊髄後角では、転写因子IRF8とIRF5によってP2X4受容体がミクログリアで特異的に高発現し、その受容体を遮断すること、あるいは遺伝子をノックダウンや欠損させることで、アロディニアが著明に抑制された
ミクログリアのP2X4受容体がATPで刺激されることでBDNFなどの液性因子が産生放出され、それらが脊髄後角ニューロンの機能を変調し、神経障害性疼痛を発症することが報告されている。したがって、ミクログリアとニューロン間の病的連関が神経障害性疼痛の原因であろうと考えられている。ミクログリアにはP2X4受容体以外にも他の機能分子が発現し、神経障害性疼痛に関与している。
複合性局所疼痛症候群(CRPS)の患者の脊髄において、CD68陽性ミクログリアの活性化が報告されている。
アルツハイマー病
アルツハイマー病(AD)モデルマウスやアルツハイマー病患者の脳では老人斑周囲にミクログリアや単球、マクロファージの集積が認められる。ミクログリアには可溶性Aβオリゴマーや線維性Aβが結合するscavenger receptor A、CD36、RAGEなど多くの受容体が発現しているが、これらの発現レベルやAβの分解酵素、オートファジーがアルツハイマー病モデルマウスで低下し、それがAβ蓄積の原因の一つであろうと想定されている。Aβクリアランスにはミクログリアの細胞貪食が重要であるとされている一方で、ミクログリアの除去マウスでAβに劇的な変化が認められないという報告もありその関与は単純ではない。また、三次元電顕解析やミクログリアのin vivoイメージング解析などでも、ミクログリアのAβプラークの貪食やクリアランスを支持する結果が得られていない。貪食関連分子の発現低下やミクログリアの老化などが同細胞の機能低下に関連している可能性も指摘されている。
末梢からの単球の集積にはケモカイン受容体CCR2の関与が報告され、この病態初期の単球の集積を阻害することでアルツハイマー病モデルマウスの死亡率やAβの蓄積の増加がみられることから、脳へ浸潤した単球がアルツハイマー病病態に保護的に働いている可能性が示唆されている。また、Aβの分解は末梢性マクロファージの方がより効率的であるという報告もある。しかし、末梢単球やマクロファージの脳内浸潤については放射線照射による骨髄キメラマウス等が使われているため今後の検討が必要である。Aβの脳血管周囲への沈着はアルツハイマー病患者で高頻度に観察されるが、アルツハイマー病モデルマウスの血管周囲マクロファージの除去により脳血管周囲のAβ沈着が悪化することも報告されている。
ミクログリアやその他のミエロイド系細胞によるAβクリアランスが不十分な場合、AβはミクログリアのCD36やTLR4などに作用することで、NLRP3インフラマソームなどを活性化して炎症因子の産生や放出を引き起こす。炎症性サイトカインはミクログリアのAβクリアランス能などの細胞機能を低下させ、その影響が周辺の他の細胞に波及しタウオパチー、さらには神経細胞死を起こすという説が想定されている。
さらに、アルツハイマー病リスクファクターとしてミクログリアによるAβプラークの貪食に関連するTREM2変異、TREM2と相互作用するTYROBPの変異が報告された。さらにミクログリアのAβ貪食を抑制するCD33の機能獲得変異も孤発性アルツハイマー病リスクファクターとして報告され、アルツハイマー病におけるミクログリアの機能変化の関与が支持されている。しかし、アルツハイマー病モデルマウスでのTREM2の役割については一致した結果は得られていない。その原因の一つとして解析するアルツハイマー病モデルマウスが考えられる。最近、西道らによって、新しいアルツハイマー病モデルマウスが開発され、同マウスでもミクログリアの活性化が認められている。
筋萎縮性側索硬化症
筋萎縮性側索硬化症(ALS)においてミクログリアは、その症状の進行に寄与することが示唆されている。SOD1遺伝子の変異を原因とする家族性ALS患者では、脱落した下位または上位の運動神経細胞周囲にミクログリアやマクロファージの集積が見られている。同様の事象はヒト変異SOD1を強制発現することでALS病態をしめすモデル動物の腰髄においても観察されており、麻痺症状の現れる前においてすでに貪食形態のミクログリアが運動神経の細胞体に接触している像が得られている。
また、SOD1の変異の有無にかかわらずフォールディング異常を示すSOD1の凝集物がミクログリアに集積していることも示されている。ALSモデルマウスのミクログリアで、SOD1を正常型に置き換えると病態発症の程度が軽くなり、ミクログリアで変異型SOD1を発現する動物を作成しても症状は現れないことから、病態の進行時にはミクログリアのSOD1が寄与していると予想される。
また、培養系を用いた研究では、外因的に与えられたSOD1によって活性化されたミクログリアの培養上清が培養運動神経の生存率を低下させることも明らかになっており、ミクログリアの活性化が病態の進行に寄与することを示唆している。変異型SOD1によるALSモデルマウスでは、病巣部でのミクログリアの集積に末梢骨髄由来細胞の浸潤は寄与していないことがパラバイオーシスを用いた実験によって証明されている。
また、CX3CR1欠損マウスでは変異型SOD1発現による生存率の低下が増悪しており、CX3CR1の病態への関与、さらにミクログリアの関与を示唆している。しかしながら、運動神経の細胞死にミクログリアがどのように関与しているかに対しては未だ明確な答えが得られていない。
多発性硬化症
多発性硬化症(multiple sclerosis: MS)の実験モデルとして用いられている実験的自己免疫性脳脊髄炎(experimental autoimmune encephalomyelisis: EAE)は、中枢における自己免疫疾患研究に用いられている。末梢T細胞とミクログリアの相互作用がこの病態に大きく寄与することがわかっており、活性化ミクログリアと浸潤マクロファージによって、脱髄や神経傷害などの組織傷害が惹起される。CD11b-HSVTKマウスはガンシクロビルの投与によってミクログリアを欠失できる実験動物として用いられているが、この実験系を用いてミクログリアが欠失している動物では、EAEの発症の遅れや病態の程度の軽減が観察されている。マクロファージ同様、ミクログリアにもM1、M2といった異なる活性化様式の存在が考えられており、脱髄・寛解の過程においては、M1様ミクログリアがTh1、Th17ヘルパーT細胞からの病態悪化シグナルによって炎症応答・脱髄を引き起こし、M2様ミクログリアは、組織修復・病態の寛解を誘導していると考えられている。ミクログリアの活性化に関わる因子としてマイクロRNAのmiR-124、JAK/STATシグナルの抑制経路に関わるSOCS3についての報告があり、miR-124は病態初期にその発現が抑制されることでC/EBPαやPU.1の発現を介したミクログリアの活性化に関与しており、miR-124の投与によってM2様ミクログリアの出現と病態の改善が見られることが証明されている。SOCS3については骨髄性細胞でのSOCS3欠損の結果、STAT3/STAT4シグナルの過剰な活性化を介してM1様ミクログリアの出現へ繋がるとされている。
