人体に感染したヘルペスvirusを殺す免疫の方法とその作用の順序のすべてについて語ります。ヘルペスと闘う最初の免疫細胞であるnatural killer cell (NK細胞)が敵であるヘルペスを取り込んで産生するインターフェロンγが戦いの狼煙(のろし)となります。ヘルペスウイルスが人体に感染すると組織か血液か細胞に侵入します。ヘルペスウイルスはどのように細胞の内部に侵入するのでしょうか?herpesウイルスは細胞の受容体から侵入するのですが、受容体がヘルペスを認識するのではなくherpesが受容体の糖鎖の部分にまずしがみついてその後は細胞膜融合やエンドサイトーシスで細胞膜に入り込むのです。因みに細菌はファゴサイトーシスという食作用で取り込まれるのです。herpesはDNAゲノムとゲノムを包むキャプシド(カプシド)というタンパク質を持つ粒子で線状二本鎖のDNAを持っています。
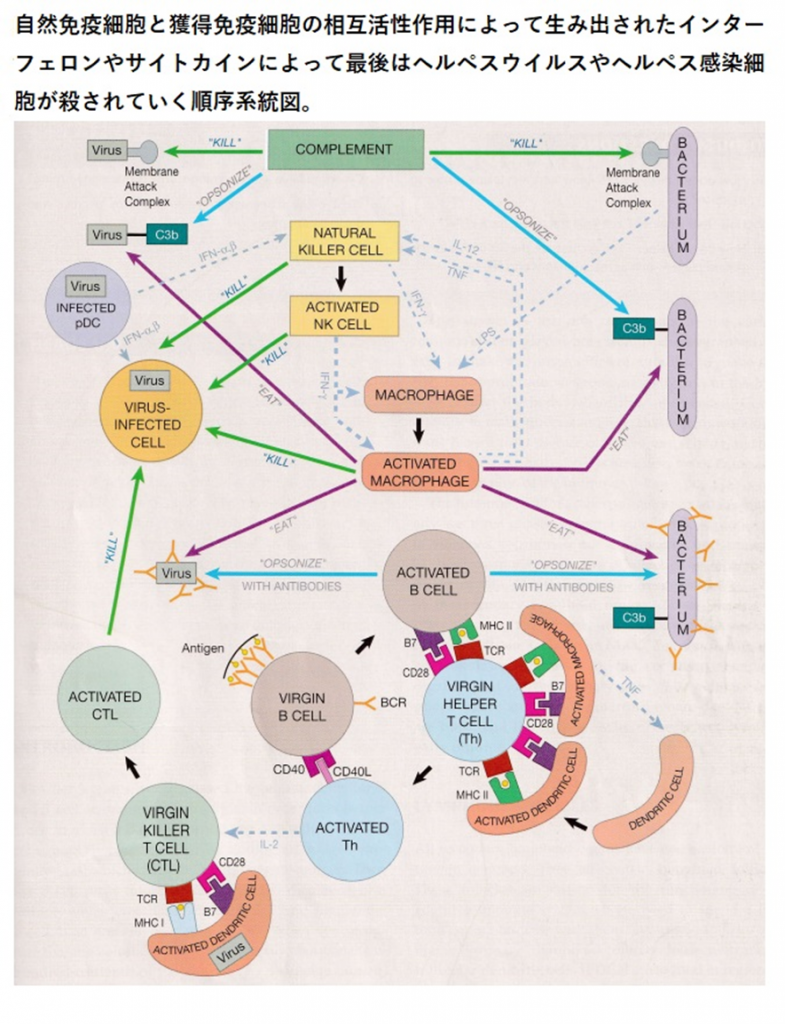
血液や組織に侵入したヘルペスウイルスはまず自然免疫の補体のオプソニン作用で好中球やマクロファージなどの貪食細胞に食われるか、または補体のC5bはC6~C9とともに膜侵襲複合体(MAC)を形成し、herpesの表面にあるエンべロープ(被膜)を破り、直接的にヘルペスウイルス融解作用で破壊します。
次に血液や組織に侵入したヘルペスウイルスに対してナチュラルキラー(NK)細胞とマクロファージの出番となります。NK細胞受容体(NKR)にherpesが結合するとNK細胞はインターフェロンγ(INF-γ)を放出しますと貪食細胞で結合組織に常駐して斥候であるマクロファージをインターフェロンγ(INF-γ)によって活性化されます。活性化したマクロファージはウイルス感染細胞をherpesもろとも殺せます。かつ活性化したマクロファージは抗体や補体でオプソニン(味付け)されたヘルペスを食べてしまいます。更に形質細胞様樹状細胞(Plasmacytoid dendritic cell略してpDC)にherpesが感染するとインターフェロンαとインターフェロンβを放出するとNK細胞と結合してヘルペス感染細胞もろともNK細胞は殺してしまいます。
上の図の説明を続けましょう。ヴァージンB細胞とヴァージンT細胞がどのように活性化されるかの説明となり最後はヴァージンキラー細胞が活性化キラー細胞になる経路の解説となります。
ヴァージンB細胞を活性化(activate)させるためには二つのシグナルが必要です。一つはB細胞のレセプターがそのレセプターにぴったり合うヘルペスの抗原であるが出来る限り数多く結合していることと、二つ目は「共刺激」(co-stimulation)と言うシグナルが必要であるのです。活性化されたT細胞の表面にはCD40Lという蛋白があります。一方B細胞の細胞表面にはCD40という蛋白があります。この活性化されたT細胞のCD40Lという蛋白とB細胞のCD40という蛋白が結合するとヴァージンB細胞は初めて活性化されるのです。
それではヘルパーT細胞はどのようにして活性化されるのでしょうか?又キラーT細胞はどのようにして活性化されるのでしょうか?一緒におなじT細胞なので似ている点があるのでヘルペスを抗原として具体的に説明してしまいます。ヘルパーT細胞もキラーT細胞もそれぞれ三つの条件を満たす必要があります。三つの条件のうち二つは同じですが三つめの条件だけが異なります。二つの条件が同じなのはヘルパーT細胞もキラーT細胞もT細胞の仲間であるからです。
二つの同じ条件の一つ目はヘルパーT細胞もキラーT細胞も樹状抗原提示細胞(APC)が見せてくれる同じヘルペス抗原をヘルパーT細胞もキラーT細胞もまず認識する必要があります。
二つ目の同じ条件はヘルパーT細胞もキラーT細胞も持っているCD28と言う細胞表面抗原にAPCが持っているB7と言う蛋白が結合する必要があります。このB7と言う蛋白分子はCD28と言う細胞表面抗原に結合するとヘルパーT細胞もキラーT細胞を刺激してヘルパーT細胞もキラーT細胞もレセプターに大量の数多くのherpesの抗原と結びつかなくても活性化できるのです。この刺激を英語でco-stimulationと書き「共刺激分子」、「副刺激因子」、「共刺激」と訳されるのです。
最後に三つ目の異なる条件は何かを説明しましょう。しかし同じヘルペス抗原を見せることは同じですがヘルパーT細胞もキラーT細胞のそれぞれにAPCが提示するやり方が異なるのです。ヘルパーT細胞に見せる時にはAPCはヘルペス抗原とMHCⅡ(主要組織適合遺伝子複合体Ⅱ)と言う組織適合抗原複合体の二つを一緒に見せなければならないのです。一方APCがキラーT細胞に同じヘルペス抗原を提示するときにはAPCはヘルペス抗原とMHCⅠ(主要組織適合遺伝子複合体Ⅰ)という組織適合抗原複合体の二つを一緒に見せなければならないのです。つまり主要組織適合遺伝子複合体の種類が異なるのです。主要組織適合遺伝子複合体には二種類あるのです。難解ですが繰り返し読んで理解してください。免疫学の原理的な真実は最高に面白いからついてきてください。
以上を分かり易く簡単にまとめるとヘルパーT細胞もキラーT細胞もT細胞を活性化する際は、まず一つ目はT細胞上のT細胞受容体が抗原ペプチドとまず結合して二つ目は主要組織適合抗原(MHC)複合体を認識すると活性化の主要なシグナルが入ることが必要になるが、それに加えて、三つめにはT細胞上の分子のCD28が、抗原提示細胞上の分子のB7の「共刺激分子」と結合することで、補助的な「共刺激」シグナルが入ってT細胞の活性化を増強することが必須なのです。
すでに述べたようにherpesが様々な細胞に感染してしまうと別のインターフェロンαとインターフェロンβと言われる蛋白で成り立ったインターフェロン系の出番となります。このインターフェロン系の防御システムは極めて強力でherpesウイルスのみならずあらゆる種類のウイルスはインターフェロン系から逃れる方法を編み出したのですが最後はインターフェロン系のインターフェロンαとインターフェロンβによって細胞もろとも殺されてしまうのです。
インターフェロン(IFN)とは何でしょうか?インターフェロン(Interferon 略してIFN)とは、哺乳動物におけるサイトカインファミリーの一種で、当初はウイルス感染を抑制する因子として同定されました。この抗ウイルス特性に加えて、現在までに、増殖抑制、免疫調節および他の多くの活性を示すことが明らかとなっています。インターフェロンの分類は、タンパク質構造および受容体複合体の認識に基づき、I型、II型、III型に分類されます。
I型インターフェロンについては哺乳動物のI型インターフェロンは、IFN-α、IFN-β、IFN-δ、IFN-ε、IFN-κ、IFN-ω、IFN-υ、IFN-τ、IFN-ζ を含む9種類以上の異なるクラスで構成されます。ヒトでは、IFN-α、IFN-β、IFN-ε、IFN-κ、IFN-ω、IFN-υ が見つかっている一方、 IFN-δ、IFN-τ、IFN-ζ は見られません。これらI型インターフェロンは、2つの受容体鎖で構成されるI型受容体(IFNAR1とIFNAR2)に結合します。 I型インターフェロンは、通常、多くのウイルスやいくつかの病原体に応答して、マクロファージ、好中球、樹状細胞および他のウイルス感染体細胞から産生されます。
IFN-α は、ヒトではアミノ酸配列が85% 以上相同なタンパク質のグループから構成されます。ヒトのIFN-αは、N-グリコシル化されており、少数のIFN-α種ではO-グリコシル化されています。一方、マウスでは、ほぼ全てのIFN- α種がN-グリコシル化されています。
IFN-β は、ウイルスの攻撃に応答して種々の細胞によって産生され、天然型ヒトIFN-βは、単一のN-グリコシル化部位を有します。他のI型インターフェロンは、現在までIFN-αおよびIFN-βのようには大規模な研究がなされていません。
II型インターフェロンについては、ヒトII型インターフェロンは、IFN-γ遺伝子のみからなります。IFN-γは、IFNGR1(IFN-γR1)鎖とIFNGR2(IFN-γR2)鎖からなるII型受容体に結合します。IFN-γは、T細胞やNK細胞などの免疫系細胞で産生されます。IFN-γは、哺乳動物細胞においてグリコシル化され、ホモ二量体として機能します。IFN-γは抗ウイルス活性が弱く、IFN-αとIFN- β の方がより強力な抗ウイルス活性を示します。
インターフェロンのシグナル伝達経路については、多くの場合、I型インターフェロン発現は、Toll様受容体(TLR)によって誘導されます。自然免疫系は、TLR受容体を介して「非自己」を認識する能力を進化させました。例えば、TLR3は二本鎖RNA 、TLR4はリポ多糖、TLR9はメチル化CpG DNAモチーフに応答します。TLR活性化細胞により産生されるインターフェロンは、オートクラインまたはパラクライン様式で作用します。インターフェロンが受容体に作用すると、細胞内で速やかにシグナルが伝達し、抗ウイルス状態を生成します。I型インターフェロンは、シグナル伝達カスケードとして JAK1-STAT 経路を活性化します。この経路では、ウイルス感染細胞を防御する種々の遺伝子((2’-5’) オリゴアデニル酸合成酵素、Mx タンパク質、タンパク質キナーゼ R (PKR)など)の発現上昇を誘導します。
複数のIFN-αサブタイプを含めて、なぜこれほど多くの異なるI型インターフェロンが存在するのかは、herpesが細胞に感染すると細胞外でのみ活躍する適応免疫は無力であるから自然免疫の進化ももたらしたのです。インターフェロンは自然免疫の切り札と言われとりわけヘルペスウイルスに対して自然免疫の王者です。「自然免疫」とは、生まれつき持っている応答の速い防御システムです。人体に侵入して細胞に感染する病原体のウイルスの種類に対して、多くの異なるⅠ型インターフェロンは、特に殺しきれないherpesウイルスに感染した情報を核に伝える最適なシグナル伝達カスケードを進化させherpesウイルスに対する武器である種々の蛋白を新たに作るようになったのです。だからこそ、ウイルスに感染したという情報をシグナル伝達カスケードとして JAK1-STAT 経路を活性化しますが、この経路を細分化して、種類が異なるウイルスが感染した細胞を防御する種々の遺伝子を進化させて 2’-5’ オリゴアデニル酸合成酵素や、Mx タンパク質や、タンパク質キナーゼ R (略してPKR)などの異なった発現上昇を誘導して複数のIFN-αサブタイプを含めて、多くの種類のIFNが生まれたのです。2’,5′-オリゴアデニル酸合成酵素とは何ですか?2’,5′-オリゴアデニル酸合成(2-5AS)は,インターフェロン(interferon;IFN)によって細胞内に誘導される酵素であり,IFNの抗ウイルス作用発現に重要な役割を果たしている.血中のIFNは,速やかに消失することから,生体の抗ウイルス状態の把握のためには,2-5AS活性が指標として用いられている.Mx蛋白質とは何でしょうか?気道上皮組織に特異的な炎症応答を制御するウイルス感染のセンサー分子です。タンパク質キナーゼ R (略してPKR)とは何でしょうか?PKRは二本鎖RNA (double stranded RNA, dsRNA) によって活性化されるが、この二本鎖RNAはウイルス感染によって細胞内にもたらされるものである。PKRはN末端の二本鎖RNA結合ドメイン (dsRNA binding domain, dsRBD) とC末端のキナーゼドメインから構成され、キナーゼドメインはアポトーシス促進機能をPKRに付与しています。dsRBDは、保存された二本鎖RNA結合モチーフが2つタンデム(直列)に並んだ構成となっており、それぞれのモチーフはdsRBM1、dsRBM2と呼ばれる。PKRはインターフェロンによって不活性状態で発現誘導される。dsRNAへの結合によってPKRは二量体化し、引き続いて起こる自己リン酸化反応によって活性化される。ヘルペスを含むウイルス感染下では、ウイルスの複製と遺伝子発現によって作り出されたdsRNAがN末端ドメインに結合し、PKRを活性化するのです。活性化が起こると、PKRは真核生物翻訳開始因子eIF2αをリン酸化できるようになる。翻訳開始因子eIF2αがリン酸化されると、細胞内のすべてのmRNAの翻訳は阻害され、したがってウイルスタンパク質の合成も防がれることとなる。eIF2αは一般的な開始コドンとなる三つの塩基のアデニン、ウラシル、グアニン(AUG)コドンからの翻訳開始に関与しているので、eIF2αがリン酸化されているときはAUG以外からの翻訳開始が代わりに行われる。AUG以外からの翻訳開始を利用するmRNAの例としては、熱ショックタンパク質のmRNAなどが挙げられる。活性型PKRは、転写因子NF-κBの阻害サブユニットであるIκBをリン酸化することで、NF-κBを活性化する。活性化されたNF-κBはインターフェロン型のサイトカインの発現を活性化し、局所的な抗ウイルスシグナルの拡散を行う。また、活性型PKRは、細胞周期と代謝を調節するがん抑制遺伝子PP2Aを活性化することができる。がん抑制遺伝子PP2Aとは何でしょうか?炎症と癌の双方で重要な抑制因子として働く protein phosphatase 2A(PP2A)であるPP2A は,細胞内の主要なセリン/スレオニン脱リン酸化酵素であり,多様なシグナル伝達を調節しています。PP2A には I1PP2A(ANP32A),ENSA,Arpp19,CIP2A,PME-1,SET/I2PP2A 等の PP2A 阻害タンパク質が存在し,ほとんどの癌において PP2A 阻害タンパク質の発現上昇による PP2A 活性の低下が認められます。PP2A 阻害タンパク質の中でも SET/I2PP2A は,炎症反応を増強する役割があります。癌抑制遺伝子PP2A活性型PKRは、ウイルスがさらに拡散されることを防ぐために、複雑な機構を通じてアポトーシスを誘導することもできます。何故でしょうか?それは癌細胞には大量のherpesウイルスが感染しているからです。と言うのも正常な細胞の遺伝子が突然変異を起こして癌化させるのはherpesウイルスであるからです。プロテインキナーゼR (protein kinase R, PKR) は、ヒトではEIF2AK2遺伝子にコードされている酵素(キナーゼ)で、ウイルス感染からの保護、とりわけ殺しきれないherpesウイルスから細胞を守るために存在しているのですがやはり守り切れなくて癌になってしまうのです。更にそれらの機能が重複した多機能のI型インターフェロンを持つことによってヘルペスウイルスなどに対して生物学的活性のユニークなセットを持っているのもherpesを細胞もろとも殺せるI型インターフェロンであるからです。I型インターフェロンはまた、免疫調節の役割も果たしているのです。I型インターフェロンは、多くのウイルスやいくつかの病原体に応答して、マクロファージ、好中球、樹状細胞などの自然免疫細胞に加えてherpesウイルスが感染した他のすべての体細胞からも産生されます。対照的に、II型インターフェロンのIFN- γは、自然免疫応答における役割は少なく、主な役割は適応免疫の活性化にあります。
III型インターフェロンについては、III型インターフェロンは、IFN-λ1(IL-29)、IFN-λ2(IL-28A)、IFN-λ3(IL-28B)の三種類からなり、新規のクラスIIサイトカイン受容体リガンドとして同定されました。Ⅲ型IFNファミリーとIL-10ファミリーとは11~13% アミノ酸配列相同性であり、かつI型IFNファミリーとも15~19%アミノ酸配列相同性の遠縁です。これら3つのサイトカインは、抗ウイルス活性とMHCクラスI抗原発現の上方制御を含め、I型インターフェロンと重複する生物活性を示します。3種類のタンパク質は、同じヘテロ二量体受容体複合体であるIL-10 受容体βである(IL-10Rβ および IL-28 受容体 αであるIL-28Rα(IFN-λ R1)を介してシグナルを伝達します。受容体複合体に結合したリガンドは、 JAK活性化およびSTAT1 / STAT2のチロシンリン酸化を誘導します。リン酸化されたSTAT1およびSTAT2は、I-IFN-regulatory factor 9(I-IRF-9) と結合し、IFN-stimulated regulatory factor 3(ISGF-3)転写因子複合体を形成し、核へ移行します。
「樹状細胞」である「ランゲルハンス細胞」とは何でしょうか?ランゲルハンス細胞はメラノサイト(メラニン細胞)と同様、樹状の胞体突起を持つので「樹状細胞」とも呼ばれます。一種のマクロファージ(表皮マクロファージ)で、表皮のみならず、口腔、食道、膣、真皮、毛包、脂腺、さらにリンパ節、胸腺などでも認められます。骨髄に由来し、血行性に運ばれます。赤色骨髄由来の非常に強力な抗原提示細胞で、表皮のどの層にも存在しますが、特に皮膚では有棘層の中~上層に、1平方ミリメートル辺り、400~1000個、表皮細胞の2~8%が孤立性に存在しており、表皮全体では1~3%存在しています。細胞接着構造を持たず、遊走性で、紫外線照射で減少してしまうにもかかわらず、つまり紫外線に対して弱いのにもかかわらずメラノサイトの放出するメラニン小体さえも受け取ることがありません。メラニン小体とは何でしょうか?メラノソームとか、メラニン顆粒ともいう.メラニン細胞や,眼球の色素上皮細胞などにみられるメラニンを含む顆粒が①メラノソームであり、②メラニン顆粒であり、③メラニン小体のことなので三つの呼び方があるのです。メラニン細胞質内の色素顆粒(かりゆう)の種類により動物の体内にみられる色素細胞は①黒色素胞,②赤色素胞,③黄色素胞,④白色素胞の四つに分類される。これらのうち黒色素胞の場合には,メラニン色素を含むメラノソームmelanosomeと呼ばれる黒色素顆粒が細胞の中心部にいっせいに凝集すると体色は白っぽくなる。一方,メラノソームが樹枝状突起の中へ拡散すると黒っぽくなる。メラニン細胞(色素細胞)とメラノソームとの違いは何ですか?メラノサイトは「メラニン」と呼ぶ色素を産生する細胞です。 メラニンはメラノソームで生成され、メラノソームはメラノサイト内でのみ形成されるものです。 したがって、メラノサイトの活性がメラニン生成を基本的に決定しています。 メラノサイトは加齢とともに機能が低下し、数は減少します。メラノサイトとは何ですか?メラニン細胞ともいわれる表皮の基底層にあるメラニン(メラニン色素)を生成する細胞のことで、 色素細胞または色素生成細胞とも呼ばれます。メラノサイト(色素細胞、メラニン細胞)は チロシナーゼという酵素を有しており血液中に存在するチロシンというアミノ酸の1種からチロシンを取り込んでメラニンを生成します。メラノソームとは、何ですか?メラニン顆粒であり、メラニン小体であり小胞というリン脂質でできた多数の袋に、メラニン色素が詰められた多数の顆粒のことです。
ランゲルハンス細胞の核は不規則な形をしており、細胞質はほとんど透明です。細胞体から全ての層の表皮細胞の間に細胞質突起が伸びて、かなり密度の高いネットワークを形成しています。その他の特徴として、ランゲルハンス細胞は「バーベック顆粒」を含む、という特徴を持っています。バーベック顆粒とは何か?別名ランゲルハンス顆粒と呼ばれ、テニスラケット状の特徴的な形態・構造を持っており、観察時、ランゲルハンス細胞特定の指標とされています。バーベック顆粒の役割は?ランゲルハンス細胞は表皮に局在する特殊な樹状細胞であり、侵入してきた病原体を取り込んで活性化するとリンパ節に遊走して抗原提示を行うことで、免疫防御機構において重要な役割を担っている。ランゲルハンス細胞に特異的に発現する。ランゲルハンス細胞は表皮に局在する特殊な樹状細胞であり、侵入してきた病原体を取り込んで活性化するとリンパ節に遊走して抗原提示を行うことで、免疫防御機構において重要な役割を担っている。ランゲルハンス細胞に特異的に発現するレクチンであるランジェリンは病原体表面の糖鎖を認識してエンドサイトーシスを行う。レクチンは、単糖や糖鎖と可逆的に結合するタンパク質の総称である。タンパク質のランジェリンが作るエンドソームは梯子状の細い膜構造に丸い小胞が接続した「テニスラケット」様のバーベック顆粒を形成する。エンドソームはエンドサイトーシスによって細胞内へと取り込まれた様々な物質の選別・分解・再利用などを制御するオルガネラの総称である。オルガネラとは、 細胞内にあって、一定の機能を持つようになった小器官の総称で、細胞内小器官、細胞小器官などとも呼ばれます。このバーベックはヒト免疫不全ウイルス(HIV)の感染を防御できます。そのメカニズムはまずランゲルハンス細胞は免疫不全ウイルス(HIV)の病原体表面の糖鎖を認識してエンドサイトーシスを行い、エンドソームとして取り込んだランゲルハンス細胞は、ランジェリン蛋白が作る梯子(はしご)状の細い膜構造に丸い小胞が接続した「テニスラケット」様のバーベック顆粒を形成するのですが、このバーベック顆粒はクライオ電子顕微鏡で見ると実は「ハチの巣状」になっておりヒト免疫不全ウイルス(HIV)を「ハチの巣」の中に取り込んで閉じ込めることによって感染を防御できるのです。
ランゲルハンス細胞は遊走性で、細胞内の抗原輸送を担う「ハチの巣」であるバーベック顆粒(Birbeck granule)があり、ランゲルハンス細胞は抗原を樹枝状の突起で取り込むとリンパ管を通って特定のリンパ節に移動し、抗原をT細胞に提示しこれを感作します。 感作されたT細胞が皮膚に移行して抗原に出会うとサイトカインを放出し、異物を殺傷したり炎症などを引き起ここともできるのです。
ランゲルハンス細胞の働きはその樹状の細胞質突起で、表皮表面と表皮細胞間の環境をEカドヘリンを介して角化細胞と結合して存在し、常に監視しており、皮膚における細胞性免疫反応を強力に促進します。Eカドヘリンとは何か?E-カドヘリン(epithelial cadherinで略して E-cadherin、)は、上皮カドヘリンと訳します。E-カドヘリンは、ほとんどの上皮組織の細胞表面上に発現する細胞接着分子です。E-カドヘリンは細胞外領域で、2量体を形成し、 隣接した細胞のE-カドヘリンとホモフィリックな結合を形成することによってカルシウム依存性のホモフィリック結合を支持し、隣接する細胞との特異的な相互作用を提供します。ホモフィリック結合とは、例えば 同種の二つのE-カドヘリン分子が結合する様式をホモフィリック結合(Homophilic adhesionまたは同種分子親和性結合)と言います。
E-カドヘリンの細胞内ドメインは、p120-カテニン、α-カテニン、β-カテニンおよびγ-カテニン(Plakoglobin、プラコグロビン)との相互作用を介してアクチン細胞骨格に結合しています。E-カドヘリンは、上皮の完全性の維持に重要な分子であり、上皮細胞の増殖、分化、生存の調節機構に関わります。E-カドヘリンは、ほとんどの上皮組織の細胞表面上に発現します。この細胞は、多くの炎症性の皮膚疾患、特にアレルギー性接触皮膚炎において、活性化された数が増えます。皮膚は体表を包むので、絶えず多くの抗原分子に直接に接触、表皮のこのようなランゲルハンス細胞の樹状の細胞質突起である構造物が自然免疫と獲得免疫に関わり、細胞は皮膚より進入した抗原を効率よく取り組む能力を持っています。このランゲルハンス細胞の多数の細胞突起の働きは、抗原を取り込んだ後は、その突起が縮んで真皮へ遊走し、所属リンパ管へ入ります。ランゲルハンス細胞は、他の臓器で見られる免疫系樹状細胞の働きと同様、抗原を認識し、結合し、細胞内で分解処理した後、T細胞(Tリンパ球)に提示する働きを持っています。これによって活動を停止しているヘルパーTリンパ球を刺激し、一次免疫応答が開始されます。獲得性免疫応答の引き金を引き、戦闘を開始すべきことを伝えるのです。ランゲルハンス細胞は皮膚に侵入した微生物を必ず感知し、免疫反応を引き起こします。他の免疫系細胞(リンパ球や真皮内の免疫系細胞)が侵入した微生物を認識、破壊するのを助けます。ランゲルハンス細胞は機能的には組織球(マクロファージの一種)と類似しています。
ランゲルハンス細胞とマクロファージの違いは何ですか?マクロファージはあくまで細胞性免疫が主な役割であり、抗体産生の惹起能は樹状細胞には劣ります。 一方でランゲルハンス細胞や樹状細胞ではナイーブT細胞から各種のエフェクターT細胞へ分化させる誘導能力があるため、細胞性免疫と体液性免疫の両方の強力な起点となり、マクロファージと比較して強力な抗体産生を誘導することが出来ます。
ランゲルハンス細胞は、皮膚の同種移植における拒絶反応でも重要な役割を果たし、この細胞の活性が表皮腫瘍の進行を阻む作用を示しています。ある種の化学的発がん物質、免疫抑制剤や紫外線の過剰な暴露はランゲルハンス細胞の数の減少や能力の減弱をもたらします。そして皮膚腫瘍を増悪させる要因となります。
抗原提示細胞antigen presenting cell(APC)とは何でしょうか?体細胞外の体液中に存在する外来抗原は外因性抗原と言います。細菌、細菌毒素、寄生虫、吸入された花粉やチリ、細胞内に進入前のウイルスなどです。これを処理し、提示するのが抗原提示細胞と呼ばれる特別な細胞です。抗原提示細胞には活性化されたマクロファージが産生するIL-2で活性化された樹状細胞、マクロファージ、B細胞の三つががあります。これらの抗原提示細胞は活性化された後、戦略上、抗原が自然免疫学的防御を破って体内に進入して来やすい場所、皮膚の表皮と真皮、気道、消化管、尿路、生殖菅などの粘膜、そしてリンパ節などに存在しています。表皮内にいるものはランゲルハンス細胞と呼ばれる一種の樹状細胞です。ヘルパーT細胞に抗原提示する抗原提示細胞は、複雑な免疫応答を誘導・促進するために必須の細胞なのです。樹状細胞は所属リンパ節へ遊走し、抹消組織で補足してきた抗原をT細胞に提示することができます。
一種の樹状細胞と言われるランゲルハンス細胞とは何でしょうか?ランゲルハンス細胞はメラノサイト(メラニン細胞)と同様、樹状の胞体突起を持つので「樹状細胞」とも呼ばれます。一種のマクロファージ(表皮マクロファージ)で、表皮のみならず、口腔、食道、膣、真皮、毛包、脂腺、さらにリンパ節、胸腺などでも認められます。骨髄に由来し、血行性に運ばれます。赤色骨髄由来の非常に強力な抗原提示細胞で、表皮のどの層にも存在しますが、特に皮膚では有棘層の中~上層に、1平方ミリメートル辺り、400~1000個、表皮細胞の2~8%が孤立性に存在しています(表皮全体では1~3%)。細胞接着構造を持たず、遊走性で、紫外線照射で減少してしまうにもかかわらず、メラノサイトの放出するメラニン小体さえも受け取ることがありません。
ランゲルハンス細胞の核は不規則な形をしており、細胞質はほとんど透明です。細胞体から全ての層の表皮細胞の間に細胞質突起が伸びて、かなり密度の高いネットワークを形成しています。その他の特徴として、ランゲルハンス細胞は「バーベック顆粒」を含む、という特徴を持っています。バーベック顆粒は別名ランゲルハンス顆粒と呼ばれ、テニスラケット状の特徴的な形態・構造を持っており、観察時、ランゲルハンス細胞特定の指標とされています。
ランゲルハンス細胞の働きはその樹状の細胞質突起で、表皮表面と表皮細胞間の環境をE-カドヘリンを介して角化細胞と結合して存在し、常に監視しており、皮膚における細胞性免疫反応を強力に促進します。この細胞は、多くの炎症性の皮膚疾患、特にアレルギー性接触皮膚炎において、活性化された数が増えます。皮膚は体表を包むので、絶えず多くの抗原分子に直接に接触、表皮のこのようなランゲルハンス細胞の樹状の細胞質突起である構造物が自然免疫と獲得免疫に関わり、細胞は皮膚より進入した抗原を効率よく取り組む能力を持っています。このランゲルハンス細胞の多数の細胞突起の働きは、抗原を取り込んだ後は、その突起が縮んで真皮へ遊走し、所属リンパ管へ入ります。ランゲルハンス細胞は、他の臓器で見られる免疫系樹状細胞の働きと同様、抗原を認識し、結合し、細胞内で分解処理した後、T細胞(Tリンパ球)に提示する働きを持っています。これによって活動を停止しているヘルパーTリンパ球を刺激し、一次免疫応答が開始されます。獲得性免疫応答の引き金を引き、戦闘を開始すべきことを伝えるのです。ランゲルハンス細胞は皮膚に侵入した微生物を必ず感知し、免疫反応を引き起こします。他の免疫系細胞(リンパ球や真皮内の免疫系細胞)が侵入した微生物を認識、破壊するのを助けます。ランゲルハンス細胞は機能的には組織球(マクロファージの一種)と類似しています。
ランゲルハンス細胞は、皮膚の同種移植における拒絶反応でも重要な役割を果たし、この細胞の活性が表皮腫瘍の進行を阻む作用を示しています。ある種の化学的発がん物質、免疫抑制剤や紫外線の過剰な暴露はランゲルハンス細胞の数の減少や能力の減弱をもたらします。そして皮膚腫瘍を増悪させる要因となります。
メラノサイト(メラニン細胞)とは何でしょうか?ランゲルハンス細胞と同じく樹状の細胞体突起を持つメラノサイトは色素細胞ともいわれます。英語が「melanocytes」で「melano」は「黒い」という意味です。表皮細胞のおよそ8%はメラノサイトで、表皮の約90%がケラチノサイト、すなわち角化細胞です。角化細胞と角質細胞とは違います。角質細胞は表皮細胞の頂上にあり角化しきった細胞を角質細胞と言うのです。表皮細胞の90%以上が角化細胞なのです。言い換えると基底細胞、有棘細胞、顆粒細胞、角質細胞をまとめて角化細胞(ケラチノサイト)と言うのです。英語で[keratinocyte]と書きます。ケラチノサイトと読みます。
角化とは何でしょうか?基底細胞から角質細胞までの角化のプロセスはどうなっているのでしょうか?
表皮の90%以上をしめる角化細胞(ケラチノサイト)が、基底細胞から角質細胞へ至るまでの過程を総称して角化と呼びます。一連の複雑な生物学的反応は、最終的に角化してしまった角質層をつくるための過程で、角化細胞が基底層で分裂し、ケラチンを産生し分化、成熟しながら上層に移行していきます。ケラチンとは何でしょうか?ケラチンとは、細胞骨格を構成する三つの内のタンパク質の一つで、細胞骨格には太い方から順に、微小管、中間径フィラメント、アクチンフィラメントと3種類あるが、このうち、上皮細胞の中間径フィラメントを構成するタンパク質がケラチンです。
細胞骨格とはいったい何でしょうか?骨でもない普通の細胞に骨格とはおどろきです。何故、細胞骨格と言われるのでしょうか?
細胞骨格(cytoskeleton)とは、細胞質内に存在し、細胞の形態を維持し、また細胞内外の運動に必要な物理的力を発生させる細胞内の頑丈変形しにくい繊維状構造を名付けたのです。細胞内には柔らかい変形しやすい動きやすい成分でできている各種膜系の変形や移動や細胞小器官の配置、また、細胞分裂、筋収縮、繊毛運動などの際に起こる細胞自身の変形を行わざるを得ない重要な細胞小器官を細胞質内のタンパク質性の線維系のひとつで細胞全体を支持して安定化させる立体的な繊維状構造の連続した三次元ネットワークが細胞骨格なのです。
すべての細胞は、たとえバクテリア(細菌)でさえ、細胞骨格を持ちます。細胞骨格は、細胞の形状とその機械的特性を発揮してくれます。細胞運動、細胞分裂、細胞内輸送、細胞シグナル伝達等、多くの動的な細胞プロセスの一時的な変化を柔軟に細胞骨格の柔軟性が支えてくれるのです。そのため、細胞骨格は、いくつかの細胞質タンパク質や細胞小器官と相互作用して機能します。
細胞の骨格はどのような働きをしているのでしょうか?細胞骨格ネットワークは、フィラメントと呼ばれる3つの異なるタンパク質構造からなります。それらは、細い順にマイクロフィラメント(アクチンフィラメント)、中間径フィラメント、微小管(チューブリン)の3種類です。これらのタンパク質は、相互に依存して異なる機能を果たす独自のネットワークを細胞内に形成します。中間径フィラメントとは何でしょうか?ケラチン、ビメンチン等の複数のタンパク質からなり、ミクロフィラメント(マイクロフィラメント)より太く微小管より細いので、中間径フィラメントと言われ、約10 nmの外径(外側の直径)をもつ。 強度の強いフィラメントを形成し、機械的ストレスを受ける細胞の部位に見出されることが多い。 また核のような細胞小器官の位置を安定化する役割を持つ。
フィラメント(filament)とは何でしようか? 連続したきわめて長い繊維をさし、毛、筋肉、繊毛などに見られる長い線状のタンパク質の総称です。筋細線維を構成するアクチンフィラメント(マイクロフィラメント)・ミオシンフィラメントや、細胞骨格である細い順にマイクロフィラメント(アクチンフィラメント)・中間径フィラメント類・チューブリンの三種類が含まれる。マイクロフィラメントを何故アクチンフィラメントとも言われるのでしょうか?マイクロフィラメントはアクチンタンパク質が重合した細胞骨格であるからです。
マイクロフィラメント(別名:アクチンフィラメント)は、細胞の形態制御と運動および膜分子の局在制御などの多彩な生理機能を担います。筋細線維を構成するアクチンフィラメント(マイクロフィラメント)・ミオシンフィラメントの違いは何でしょうか?筋線維(筋細胞)には「筋原線維」と呼ばれる、幅約1ミクロンの細長い円筒状のものが多数詰まっています。つまり筋細胞の中に筋原線維があるのです。筋原線維の最重要部は、2種類の紐状の筋細線維であるミオシンフィラメントとアクチンフィラメントです。
アクチンフィラメントとミオシンフィラメントの寸法の単位はマイクロメートルか、ナノメートルで、ミクロ・ナノの世界です。この「超マイクロマシン」とも言うべき筋フィラメントは、恐ろしく微小ですが、天文学的な数が集まって同時に働く時大きな力を出すのです。
筋原線維の太さは約0.5~2μmで、円筒状に縦方向にぎっしりと筋線維の中に配列しています。光学顕微鏡で縦断像を観察すると、1本1本の筋原線維(ミオシンフィラメントとアクチンフィラメント)はその走行に沿って明るくみえる部分(明帯・light band)と暗くみえる部分(暗帯・dark band)とが縞模様を形成しています。縞模様を形成しているのは、2種類のタンパク質の線維(フィラメント)で、ミオシンというタンパク質でできている細い線維をアクチンフィラメント、ミオシンというタンパク質でできている太い線維をミオシンフィラメントと言います。
3種類の細胞骨格(Cytoskeleton)タンパク質のイラスト図を下図に示します。
Microtubules:微小管
Intermediate filaments:中間径フィラメント
Actin filaments:アクチンフィラメント
■ イラストでわかる3種類の細胞骨格タンパク質
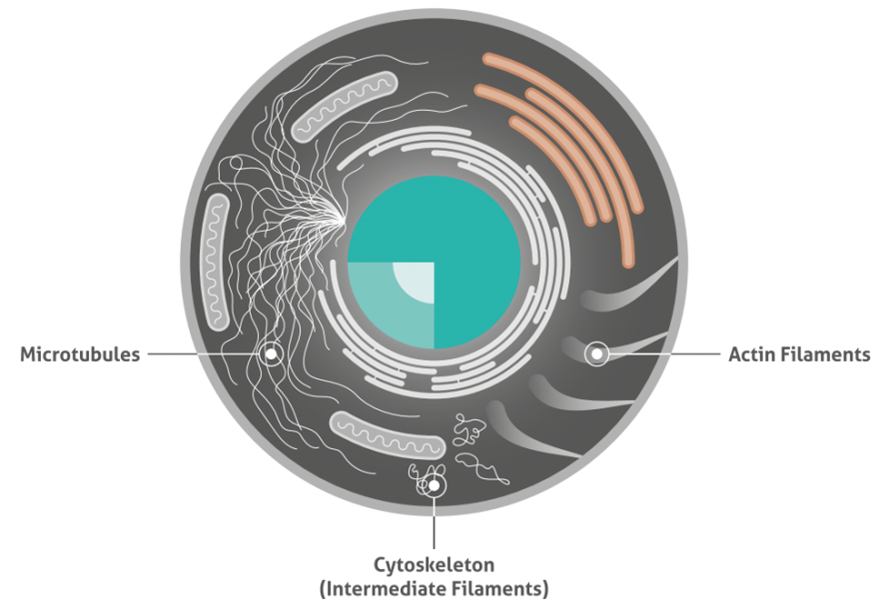
■ アクチンとは?アクチンは、すべての真核細胞で豊富に存在するタンパク質です。球状アクチン(G-アクチン)モノマーは、重合してアクチンフィラメント(F-アクチン)を形成し、長くて細い繊維状の形態を示します。これらの繊維は、約5~9nmの直径を持ち、全ての細胞骨格繊維のうち最も薄い繊維を形成します。そのため、マイクロフィラメントとも呼ばれます。アクチンフィラメントは、非常に柔軟性があり、らせん構造を示します。
アクチンフィラメントは細胞質膜に近い位置にバンドを形成し、いくつかのアクチン結合タンパク質によって独自のネットワークを形成します。細胞の形状や細胞動態に関連する多くの細胞プロセスは、アクチンフィラメントに依存します。アクチンフィラメントは、細胞の機械的強度を担い、細胞質と膜貫通タンパク質を連結します。
■ 中間径フィラメントとは?中間径フィラメントは、異なるタンパク質のポリマーであり、細胞の状況によって構成するタンパク質は異なります。したがって、中間径フィラメントは、アクチンフィラメントや微小管のように明確な構造は規定されていません。組成にかかわらず、中間径フィラメントは約10nmの直径を持ちます。これらのフィラメントは、微小管やアクチンフィラメントよりも柔軟性が低く動的ではありません。ニューロフィラメントタンパク質は、中間径フィラメントファミリーに属します。ニューロフィラメントは、ニューロンに特異的に見出される10nmの中間径フィラメントです。それらはニューロンの細胞骨格の主成分であり、正常な軸索径方向成長を支持します。ニューロンフィラメントは、通常、ニューロフィラメントの維持に関与するL、M、Hの3つの中間径フィラメントタンパク質を含みます。
■ 微小管とは?微小管は、細胞骨格で最も堅固な部分を形成し、細胞小器官やタンパク質の細胞内移動を担います。微小管は直径20nmであり、アルファ(α)チューブリンとベータ(β)チューブリンサブユニットから構成されます。微小管の形成は、温度と利用可能なチューブリンに依存します。微小管関連タンパク質(MAP:Microtubule-associated protein)は、細胞内の微小管の動態を調節します。
皮膚の表皮細胞の基底層から角化細胞が作られていく過程について。基底層で角化細胞がつくられ、表面に上がって角化し、はがれ落ちるというすべての過程には、平均的な厚さ0.1mmの表皮の場合はおよそ4~6週間かかります。
栄養と酸素は、真皮の血管から血管のない表皮へと拡散するため、基底層の表皮細胞はこの血管の最も近くにあり、ほとんどの栄養と酸素を受け取っています。基底細胞は最も代謝的に活発で、絶えず細胞分裂を行って新しい角化細胞を産生します。新しい角化細胞が押し上げられて血管から離れるに従い、基底層より上の表皮細胞に届く栄養が減少し、細胞が不活発となって最終的には角質細胞になって細胞死して角質細胞は脱落していきます。因みに頭皮から脱落した過剰な角質細胞が「ふけ」とよばれています。
なお、顆粒層から角質層への変換を、特に「終末角化」と呼びます。表皮細胞は4層から成り立ち下から基底細胞、有棘細胞、顆粒細胞、最後が角質細胞となります。顆粒層までの角化細胞は生きた細胞であり、角質層への変化は細胞死と関連した急激な変化だからです。その他、生きている顆粒細胞から死んだ角質細胞への変化は、核および細胞内小器官の消失とケラチンパターン(ケラチン模様)の形成、周辺帯の出現など、形態学的にも激しい変化が見られます。ケラチンとは何か?ケラチンパターン(ケラチン模様)とは何か?ケラチンは中間径フィラメント(太さ約10 nm)の一つで、ケラチンには約20種類がある。微小管(太さ約25 nm)およびマイクロフィラメント(太さ約5〜6 nm)とともに細胞骨格の重要な要素で、タイプIの酸性ケラチンとタイプIIの中性ないし塩基性ケラチンに大別され、線維構造を形成するにはタイプIの酸性ケラチンとタイプIIの中性ないし塩基性ケラチンの両者が必要です。一般に皮膚などの上皮細胞に広く分布するが、これらはソフトケラチン(軟ケラチン)とよばれ、毛や爪のハードケラチン(硬ケラチン)と区別されます。
ソフトケラチンでは、ケラチノサイト(表皮角化細胞)は分化とともに異なったケラチン遺伝子を発現することが知られている.基底細胞ではK5およびK14のケラチン遺伝子を、分化した有棘層より上方ではK1およびK10のケラチン遺伝子をペアで発現している.これらはそれぞれケラチノサイトの分化マーカーの一つとして利用されている.角質層ではケラチンパターンという特徴的なパターン配列を示し、角質層細胞の強靭で柔軟な内部骨格を形成しています。
ハードケラチンでは、毛包や爪にあるケラチンは、アミノ酸であるシステインの含有量が多く、システイン間の共有結合によりケラチン線維どうしの結合を強固にし、ソフトケラチンに比べるとより強い丈夫な線維構造をつくり出している.
ケラチンパターンとは表皮の最外層では、ケラチノサイトが死んで細胞形態が消失した扁平な細胞が重なった層状構造となる.核や細胞内小器官が消失し、細胞質内は凝集したケラチン線維とその間を埋める無構造の物質で満たされるようになる.電子顕微鏡で観察すると、ケラチン線維は低電子密度であり、ケラチン間の物質は高電子密度なため、特徴的なパターンが形成される.これをケラチンパターンとよぶ.ケラチンとケラチンの間を埋める物質はフィラグリンであり、角層上層では分解されて、天然保湿因子(Natural Moisturizing Factor略してNMF)のもとになる。フィラグリンとは表皮の顆粒細胞で産生される塩基性タンパク質の1種である。フィラグリンはアミノ酸のヒスチジンが多いので、ヒスチジン・リッチ・プロテインなどと呼ぶ場合もある。ヒトにおいて皮膚のバリア機能に欠かすことのできない角質層を形成するに当たり、フィラグリンはケラチンと共に重要な役割を担っている。周辺帯とは、角化細胞の最終分化の過程で形成される、不溶性できわめて強靭な構造物です。様々な物理的、科学的障害から生体を守り、生体からの水分の過剰な喪失を防ぐバリアともなっています。この膜が未熟であると、皮膚のバリア機能が低下します。
周辺帯は何でしょうか?角質細胞膜、角化肥厚膜とも言います。主に、有棘細胞でつくられるタンパク質(インボルクリン)や、顆粒細胞でつくられるタンパク質(ロリクリン)で構成され、インボルクリンやロリクリンなどのタンパク質が角化の際にトランスグルタミナーゼ( trans‐gltaminase) などの酵素によって触媒されて、リジン残基とグルタミン残基との間にイソペプチド結合が形成されることで周辺帯は生じます。角化細胞の最終分化の過程で形成される周辺帯のタンパク質成分のたったの1%以下ではありますがフィラグリンのごく一部がトランスグルタミナーゼによって他のタンパク質に架橋され、細胞膜上で辺縁帯の一部になるのです。このように細胞膜を内側から裏打ちする強靭な構造となり、親水性の角化細胞とその角質細胞を囲む脂溶性の非極性脂質の間の境界となります。周辺帯を、角質細胞膜、角化肥厚膜と言ったりもします。
さらに周辺帯の外側の分子(インボルクリンなど)にはセラミドなどの特殊な脂質がエステル結合しています。それは、まず有棘層で周辺帯に関連するタンパク質の転写の開始が行われます。この一連の遺伝子発現や酵素反応はCa2+の濃度上昇(細胞死に伴うカルシウムイオンの細胞内への流入で活性化)で促進されます。周辺帯は周辺帯辺縁帯・角質細胞膜・角化肥厚膜(cornified cell envelope略してCE読みはコーニファイドセル・エンベロープ)です。すでに説明したように 周辺帯とは、角化細胞の最終分化の過程で形成される、不溶性できわめて強靭な構造物ですから、様々な物理的、科学的障害から生体を守り、生体からの水分の過剰な喪失を防ぐバリアともなっているので例えば手の表面は毎日毎日様々な化学物質などに知らない内に接触しているにもかかわらず簡単には傷つかないのです。
角質層には通常よりも厚い細胞膜が存在し、さらにその内側には周辺帯と呼ばれる極めて強靭で巨大な厚さ15~20nmで不溶性タンパクの膜が形成され、コルネオデスモソームと言われる細胞の接着斑のアタッチメントプラークと連続して細胞膜の内側を囲まれ角質細胞を包む袋状の構造になっているのです。具体的には細胞膜の内側において形成される架橋されたタンパク質分子からなる10nmの厚さの部分と、層板顆粒由来のセラミドが細胞膜を置換した5nmの厚さの脂質エンベロープ部分からなっています。
細胞の接着斑とは英語でデスモソーム(Desmosome)で、細胞-細胞間の接着構造の1つです。接着を支える細胞骨格である中間径フィラメントに結合しているデスモグレインやデスモコリンといったデスモソームタンパク質によって形成されています。
コルネオデスモソームとは角層細胞のデスモソームはコルネオデスモソームと呼ばれています。デスモソームの角化に伴う発現パターンの変化は、表皮のバリヤ機能の発現には必須です。有棘細胞はデスモソームでお互いしっかり接着し、表皮の物理的な強度を保っています。
セラミドとはスフィンゴ脂質の一種であり、スフィンゴシンと脂肪酸がアミド結合した化合物群の総称です。
細胞の接着斑のアタッチメントプラークとは電子顕微鏡でみると,デスモゾームには細胞質側のアタッチメントプラーク(高密度円板)と呼ばれる電子密度の高い部分に細胞内の中間径フィラメント(ケラチン)が入っている。まるで,大きな引っ張り強度を生み出すロープのように中間径フィラメントが細胞骨格として,アタッチメントプラークに固定されている。デスモゾームの細胞間の構造として架橋結合が観察される 。
表皮を守ってくれる周辺帯の形成はどのように行われるのでしょうか?3ステップで行われます。
1、周辺帯の形成開始段階
有棘層上層で周辺帯に関連するタンパク質の転写が開始されます。この遺伝子発現や酵素反応は、細胞内のカルシウム濃度上昇で促進されます。エンボプラキン、ペリプラキン、インボルクリンが発現します。エンボプラキンとは?ペリプラキンとは?エンボプラキンとペリプラキンは表皮角質細胞(cornified envelope)を構成する蛋白で、デスモプラキ、BP230と類似の構造を持つプラキンファミリー蛋白に属している。デスモソーム部周辺に局在しているため、cornified envelopeとデスモソームを結びつける役割を果たしている。エンボプラキンとペリプラキンは安定したヘテロダイマーを形成します。これとインボルクリンが細胞膜上で結合します。同時にトランスグルタミナーゼ1が発現し、細胞膜上に結合します。細胞内のカルシウム濃度のさらなる上昇によってトランスグルタミナーゼ1はプラキン類のヘテロダイマーとインボルクリンを架橋します。この同じ酵素であるトランスグルタミナーゼ1が細胞膜に結合している他のタンパクやデスモゾーム(接着班)のタンパクにも架橋し、細胞膜内面全体を内張りするタンパク分子の架橋したものからなる1分子の厚さの薄い層が形成されます。
2、脂質エンベロープ(被膜)の形成
顆粒層での層板顆粒からの分泌が行われます。分泌物の1つグルコシルセラミドはβグルコ-セレブロシダーゼの作用でセラミドに分解され、本来の細胞膜のリン脂質がセラミドに置換されます。
これと周辺帯の形成開始段階で架橋されたタンパク分子、主にインボルクリンが、トランスグルタミナーゼ1の働きによって架橋されます。
3、有棘層でできた架橋構造補強段階
顆粒層上層部ではロリクリンが発現します。細胞質内のトランスグルタミナーゼ3がロリクリンとSPRs(small proline-rich proteins読みはスモール-プロリン‐リッチ‐プロテイン)分子を架橋し、ホモダイマー、ヘテロダイマーを形成し、有棘層でできた架橋構造を補強します。プロリンとは 皮膚などの組織を構成するコラーゲンの原料となるアミノ酸の一つです。 プロリンは皮膚に潤いをもたらす天然保湿成分(Natural Moisturizing Factor略してNMF)として最も重要なアミノ酸のひとつで、高い保湿作用があります。 プロリンはカラダに必要な糖を合成する材料としても使われます。プロリンは糖原性のアミノ酸なのです。
そして脂質エンベロープ(被膜)を形成するセラミドとトランスグルタミナーゼ1で架橋することで周辺帯は完成し、角質層で成熟します。トランスグルタミナーゼの作用は?トランスグルタミナーゼは、グルタミンをグルタミン酸に変換する酵素のことで、主にタンパク質とタンパク質をつなぎ合わせる(架橋する)活性を持つ酵素です。具体的には表皮細胞が、皮膚の表皮の奥の基底層からから表面の角質層へと角化するにつれて、細胞の中にあるタンパク質を架橋重合化して、細胞膜に集め、裏打ちして、物理的にも化学的にも強力なバリアを作る酵素なのです。重合化とは一種類またはそれ以上の単位物質の分子が、二つ以上化学的に結合して、もとのものより分子量の大きい化合物をつくることです。
成熟した周辺帯は非常に堅固な構造をとるとともに、脂質修飾により疎水性を獲得し、細胞間脂質が整然と密に配向するための土台(ラメラ構造の土台)を提供しているのです。 物理的化学的刺激に対して非常に安定であり、通常より厚い細胞膜を、さらに補強する役目をはたしています。ラメラ構造とは何でしょうか?「ラメラ」とは「層状」という意味で、細胞間脂質と呼ばれる層状構造の脂質が健康な皮膚の細胞と細胞の間に存在します。これは、油相と水相の繰り返しから成って油も水も通させないバリア機能を発揮し、皮膚が持つ保湿機構の本体となっています。ラメラ構造とは脂質のセラミドの様な油と水両方の性質を持った脂質分子が規則正しく配列して作られています。水相にはNMF(Natural Moisturizing Factor訳して天然保湿成分)と呼ばれる乳酸やアミノ酸等の保湿成分があるので、いっそう皮膚はしっとりします。この構造と機能を持った微粒子が工業的に作られ、これをラメラ構造脂質、あるいはラメラ粒子と呼んでいます。老化による加齢性皮膚や肌荒れ皮膚ではラメラ構造が乱れており、これをラメラ構造脂質で補うことでスキンケアができるというわけです。
このように多数の分子が周辺帯を構成していることは、このうちのいずれかの分子が欠損した場合でも、他の分子がその機能を補完して、重篤な疾患に至りません。例えばインボルクリンや周辺帯質量の70%をも占める主成分であるロリクリンといった主要な成分の完全欠損動物に大きな障害は見られていないのです。
トランスグルタミナーゼ trannsgltaminase(TGase) 表皮ケラチノサイトの分化に伴って産生される。人では6つのトランスグルタミナーゼファミリーメンバーが知られており、そのうち辺縁帯の形成に最も重要な働きをしているのはトランスグルタミナーゼ1(顆粒層で発現)です。細胞膜に結合すると高い活性を表し、細胞質内で可溶性の時は活性が弱い。角層細胞膜周辺に強固な周辺帯を形成するために必須の酵素です。
もう一度周辺帯とは何かについて書き記しておきます。周辺帯は何でしょうか?角質細胞膜、角化肥厚膜とも言います。主に、有棘細胞でつくられるタンパク質(インボルクリン)や、顆粒細胞でつくられるタンパク質(ロリクリン)で構成され、インボルクリンやロリクリンなどのタンパク質が角化の際にトランスグルタミナーゼ( trans‐gltaminase) などの酵素によって触媒されて、リジン残基とグルタミン残基との間にイソペプチド結合が形成されることで周辺帯は生じます。角化細胞の最終分化の過程で形成される周辺帯のタンパク質成分のたったの1%以下ではありますがフィラグリンのごく一部がトランスグルタミナーゼによって他のタンパク質に架橋され、細胞膜上で辺縁帯の一部になるのです。このように細胞膜を内側から裏打ちする強靭な構造となり、親水性の角化細胞とその角質細胞を囲む脂溶性の非極性脂質の間の境界となります。周辺帯を、角質細胞膜、角化肥厚膜と言ったりもします。
角質細胞の表面は、コーニファイド・エンベロープ(cornified envelope略してCEで訳して角化外膜)と呼ばれる有棘細胞でつくられるタンパク質であるインボルクリンや顆粒細胞でつくられるタンパク質であるロリクリンなどの蛋白質からなる堅固な膜に覆われている。CEとは、英語で“cornified envelope(コーニファイドエンベロープ)”の略語で、角化外膜とも呼ばれる角質細胞の周りを覆う、頑丈なたんぱく質の膜状構造のことを言います。「cornified」は「角化した」と言う意味です。 つまり、CEは角質細胞を覆って守る役割を果たしているのです。 CEは、インボルクリンやロリクリンという蛋白質からできているのは前述しました。その最外部にω-ヒドロキシセラミドが結合し、それが土台となり層構造を持つ細胞間脂質が形成される。
角化細胞とは何かについてまとめましょう。
角化細胞はケラチンフィラメントで満たされ、密にクロスリンク結合したタンパク質層である細胞表層に包まれています。クロスリンク結合は訳して架橋です。架橋とは、主に高分子化学においてポリマー同士を連結し、物理的、化学的性質を変化させる反応のことです。
脂質エンベロープは、密に充填された細胞表層で化学的に結合している。この脂質単分子層は、親水性の角化細胞とその角質細胞を囲む脂溶性の非極性脂質の間の境界となる角化細胞とは、角質層の結合のため重要なコルネオデスモリーム(細胞の接着斑)により相互結合している。
脂質の組成と、最終的な分化の間の細胞構造の変化が角質層の密に充填された構造を生む。角化膜の不浸透性は角質細胞間の直接的な物質輸送浸透を助ける。
尋常性魚鱗癬とは、角層の形成にはたらくフィラグリンというタンパク質を作る遺伝子に異常が生じることで発症する常染色体半優性(顕性)遺伝という形式をとる遺伝性疾患です。先天性の疾患である魚鱗癬の原因は妊婦が初めてかかったherpesウイルスが胎児のフィラグリン(FLG)遺伝子を突然変異させたからです。フィラグリン(FLG)遺伝子の両方の対立遺伝子(アレル)に変異遺伝子を持つ患者は症状が強くなるのは当然のことです。すでに述べたように、フィラグリンは皮膚の保湿に関わる重要なタンパク質であり、遺伝子の異常によってフィラグリンがうまく作られなくなると、古くなった角質が新陳代謝できなくなって皮膚から剥がれ落ちにくくなり、皮膚のバリア機能が破綻して乾燥を引き起こします。先天的にトランスグルタミナーゼ欠損あるいは機能不全の病気です。先天的に破綻したバリア機能を補うために角層が肥厚して水分喪失を防ごうと働く為に魚鱗癬になるのです。つまり角層が肥厚して剥がれ落ちにくくなるのです。魚鱗癬の症状は肘や膝、手足の甲といった四肢伸側や背部の皮膚が強く乾燥することで、角質が魚の鱗(うろこ)のように蓄積し、蓄積した角質が少しずつ剥がれ落ちます。加えて、多くの場合で掌紋がより深くなりますが、こうした症状は夏になると軽快するのは汗によって水分が蒸発しやすくなるからです。
インボルクリンとは酸性、可溶性、ロッド状の、グルタミン/グルタミン酸に富む585個のアミノ酸からなる68kDaの蛋白。インボルクリンはすべての重層扁平上皮で発現しています。正常表皮では有棘層上層から発現、初期に辺縁帯に架橋され、その後に他の成分が組み込まれます。インボルクリン分子は、離れた分子同士を架橋するのに適した細長い形をしています。辺縁帯とは周辺帯のことでありmarginal bandとか, cornified cell envelopesが英訳で、辺縁帯は角化細胞の終末分化の過程で形成される極めて強靱な構造物である。その役割はさまざまな物理的、化学的障害から生体をまもることです。辺縁帯の主な構成蛋白はインボルクリン、ロリクリンなどである。形態的には表皮の辺縁帯は顆粒層最表層において形成され始める。
ロリクリンとは表皮の辺縁帯の主成分で、その70%を占めます。ロリクリンはグリシン、セリン、システインに富む、不溶性の塩基性蛋白で、表皮の顆粒層上層で発現する。人では26kDa、315個のアミノ酸からなる。グリシンが並んでループ状に飛び出すグリシンループ構造を持つ。
因みにこの角化と呼ばれる分化はその詳細な制御機構は十分に解明されていませんが、あたかもプログラムされているかのような一連の経過をたどります。また、角化の過程のどこかに質的量的異常があると、正常な角質層ができず、角質層の機能に異常が生じることになります。
怪我をした時の皮膚の再生の経過は擦過傷や熱傷のように、表皮の外層がはぎ取られると、基底層における細胞分裂の速度は、当然増すことになります。この著しい増殖を制御するメカニズムはよくわかってないものの、上皮成長因子(EGF)などのタンパク質が何らかの役割を担っています。
皮膚疾患にも深い関わりのある角化についてはヘルペスによる先天性の遺伝子病である魚鱗癬をはじめとする各種の角化異常性皮膚疾患は、角化に関係する各種のたんぱくの遺伝子異常により生じます。例えば、尋常性乾癬は後天的にherpesウイルスが感染して皮膚の幹細胞の遺伝子を突然変異させたからです。当然、尋常性乾癬も後天的遺伝子病ですから慢性皮膚疾患となるのですが、遺伝子異常によって遺伝子によってプログラムされている角化細胞の分裂と基底層から角質層までの移動が以上になり通常より早くなっている遺伝子性の皮膚疾患です。尋常性乾癬では角化細胞はわずか7~10日で早々と鱗屑となって脱落してしまいます。正常な角化細胞ならば平均28日周期で幹細胞と入れ替わるために脱落するのですが。尋常性乾癬では未成熟な角化細胞は異常なケラチンを産生し、皮膚表面に銀白色の薄片状鱗屑を形成するのです。ケラチンはタンパク質の一種であるのでヘルペスウイルスによって「ケラチン」蛋白の設計図である遺伝子が突然変異を起こしてしまうと異常なケラチン蛋白が作られてしまい、毛髪や皮膚、爪の健康を維持することが出来なくなってしまうのです。尋常性乾癬で見られる鱗屑とは何ですか?白く細かいカサブタのような状態を鱗屑といい、それがフケのようにボロボロはがれ落ちると落屑となります。 乾癬では頭皮や生え際や肘や膝に皮疹がよくみられます。
角質細胞の構造について復習しましょう。角質層は、角質細胞という煉瓦とそれを取り囲むモルタルに相当する角層間脂質から構成される、緻密な層構造(ラメラ構造)をしています。
細胞の煉瓦と角層間脂質のモルタルにたとえられる角質層において、表皮細胞は、おもにフィラグリンが分解して生じるアミノ酸やピロリドンカルボン酸、乳酸などの吸湿性と、それを維持する天然保湿因子を周辺帯に包んだ形で含んでいます。 そして、その周辺を層板顆粒から分泌された角質細胞間脂質が充填しています。ピロリドンカルボン酸(Pyrrolidone Carboxylic Acid 略してPCA)とは、アミノ酸の一種であるグルタミン酸の代謝産生物であり、広義にはアミノ酸の一種です。さらに角化細胞が各種サイトカインを分泌していることが判明し、これらの細胞が角化だけではなく免疫にも深く関与しています。前述したように生体への物理的な刺激に対抗し、容易に細胞が引き離されないような特徴的な接着機構が角化細胞間や基底膜との間に存在しています。
メラノソームとは何でしょうか?表皮のメラノサイトは、光にさらされる場所に多く、例えば臀部より顔に多く存在しています。メラニン色素は皮膚の基底層に存在するメラノサイトと呼ばれる特殊な色素細胞で合成され、メラノソームと呼ばれる袋(小胞)に貯蔵されています。メラノソームは、成熟に伴い樹枝状突起の先端に移動し、複雑なネットワークを通って周囲のケラチノサイトに配送されます。メラノソームはキネシンを介して微小管に沿って運搬され、メラノサイトの樹状突起の先端へ向かうのです。なお、メラノサイトの先端はアクチンに富んでいます。メラノソームとメラニンの違いはメラノサイトは「メラニン」と呼ぶ色素を産生する細胞です。 メラニンはメラノソームで生成され、メラノソームはメラノサイト内でのみ形成されるものです。 したがって、メラノサイトの活性がメラニン生成を基本的に決定していることになります。 メラノサイトは加齢とともに機能が低下し、数は減少します。
どのようにメラニンをケラチノサイトに与えるのでしょうか?メラノサイトの樹状突起の先端がケラチノサイトによって食作用のようなエンドサイトーシスでとりこまれるのです。食した物質はリソソームと融合、その後ダイニンを介してケラチナサイト内の微小管に沿って運搬され、核の近傍へ至り、メラノソームとして放たれるのです。エンドサイトーシスとは簡単にいうと形質膜(細胞膜)が内側へ陥没して膜小胞を形成し、細胞外の物質を細胞内に取り込む働きのことです。この場合、ケラチノサイトはメラノソームごと細胞内に取り込みます。メラノソームの供与をうけたケラチノサイトは、メラノソームを核の上方に集合させ、核帽(メラニンキャップ)を形成して紫外線からDNAを守ります。ケラチノサイトはメラニンの貯留所として働き、メラニンを合成したメラノサイトよりもかえって多くメラニンを含有しています。
黒子(ほくろ)は何故できるのか?
黒子はしみと同じように、肌が刺激を受けて色素細胞であるメラノサイトがメラニン色素を形成しています。 黒子は色素細胞であるメラノサイトそのものが皮膚の一部に集まっているものです。 そのため、しみの場合は努力次第で消すことも可能ですが、黒子の場合は自然に消えることはありません。
日焼けする人としない人の違いは何ですか?色白の人はシミになりやすい?肌が色白の人は一般的にメラニン色素の量が少ないため、紫外線から肌を守るためにメラニンを過剰に生成しやすい特性があります。 そのため色白の人は、日焼けや紫外線への感受性が高まり、シミができやすい傾向があります
アミド結合とペプチド結合の違いはなんですか?アミド結合は「-CONH-」の結合全般のことを指すが、アミド結合のうち「アミノ酸同士が結合してできたもの」をペプチド結合というのです。
皮膚最外層である角質層の構造と役割および角質細胞の天然保湿成分(Natural Moisturizing Factor略してNMF)について下の図を用いて説明します。
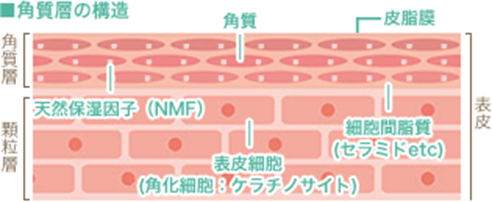
直接外界に接する皮膚最外層である角質層は、水分を保持する働きもつ天然保湿因子(Natural Moisturizing Factor略してNMF)を含み、更に角質と角質の間を細胞間脂質で満たした、建造物のレンガとモルタルの関係と同様の構造になっており、この構造が保持されることによって外界からの物理的あるいは化学的影響から身体を守り、かつ体内の水分が体外へ過剰に蒸散していくのを防ぐとともに一定の水分を保持できます。皮膚が直接空気に接する最も外側の角質層において水分を保持する働きをもつ物質は、天然保湿因子の低分子の水溶性物質であり、天然保湿因子はアミノ酸、有機酸、塩などの集合体として存在しています。下の表に集合体の成分と含量を示します。
| 成分 | 含量(%) |
| アミノ酸 | 40.0 |
| ピロリドンカルボン酸(PCA) | 12.0 |
| 乳酸 | 12.0 |
| 尿素 | 7.0 |
| アンモニア、尿酸、グルコサミン、クレアチン | 1.5 |
| ナトリウム(Na⁺) | 5.0 |
| カリウム(K⁺) | 4.0 |
| カルシウム(Ca²⁺) | 1.5 |
| マグネシウム(Mg²⁺) | 1.5 |
| リン酸(PO₄³⁻) | 0.5 |
| 塩化物(Cl⁻) | 6.0 |
| クエン酸、ギ酸 | 0.5 |
| 糖、有機酸、ペプチド、未確認物質 | 8.5 |
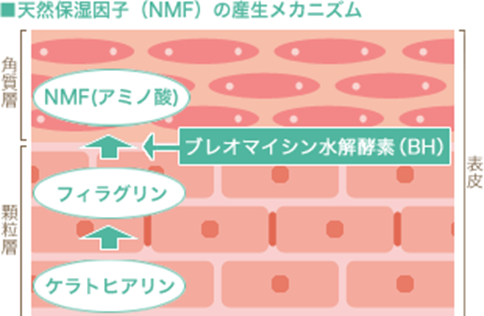
これらのうちアミノ酸は、以下の図のように、表皮顆粒層に存在しているケラトヒアリンが角質細胞に変化していく過程でフィラグリンと呼ばれるタンパク質となり、このフィラグリンがブレオマイシン水解酵素(bleomycin hydrorase)によって完全分解されることで産生されます。ケラトヒアリンとは何でしょうか?ケラトヒアリンの主要な構成成分は、分子量300~1,000kDaの巨大な不溶性タンパク質であるプロフィラグリンであり、プロフィラグリンは終末角化の際にフィラグリンに分解されます。ピロリドンカルボン酸(PCA)は、フィラグリンより産生されたアミノ酸の一種であるグルタミン酸が、さらにプロリンオキシダーゼという酵素によって変換されてできるアミノ酸代謝物ですが、皮膚のpH(5.0-6.0)においてはほとんどがナトリウム塩の形で存在し、ピロリドンカルボン酸(PCA)のナトリウム塩(PCA-Na)として保湿剤の役割を果たしています。
