いよいよ今回で最後です。もうひと踏ん張り、着いて来て下さいね!初めての方は下の①から読んで下さい!
「何故、どのようにして癲癇が起こるのでしょうか?①」
「何故、どのようにして癲癇が起こるのでしょうか?②」
「何故、どのようにして癲癇が起こるのでしょうか?③」
「何故、どのようにして癲癇が起こるのでしょうか?④」
「何故、どのようにして癲癇が起こるのでしょうか?⑤」
「何故、どのようにして癲癇が起こるのでしょうか?⑥」
大脳皮質の抑制性神経細胞の産生および移動メカニズムについて勉強しましょう。
図2.抑制性神経細胞の移動過程
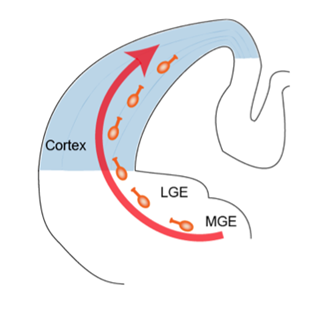
げっ歯類の大脳皮質抑制性神経細胞は終脳腹側の基底核原基(ganglionic eminence)で産生され、脳表に対して接線方向に移動し皮質に至る。
LGE: lateral ganglionic eminence, MGE: medial ganglionic eminence
げっ歯類の大脳皮質抑制性神経細胞はほぼ全てが終脳腹側の基底核原基で産生される。基底核原基は大きく分けて内側部・尾側部・外側部から構成され、内側部では主にパルブアルブミン(parv‐albumin, PV)陽性細胞とソマトスタチン(somatostatin, SOM)陽性細胞が、尾側部では主にカルレチニン(calretinin, CR)陽性細胞が産生され、それぞれ大脳皮質に移動する。外側部では主に嗅球の抑制性神経細胞が産生されることが判っているが、大脳皮質抑制性神経細胞の産生に対してどの程度貢献しているかは不明である。内側部と尾側部で産生された抑制性神経細胞は脳表面に対して接線方向に移動して大脳皮質に進入した後に移動方向を変え皮質の各層に配置される(図2)。
一方、ヒトを含めた霊長類では大脳皮質の抑制性神経細胞のうち基底核原基で産生される割合は35%程度であり、残りの65%は終脳背側の脳室帯と脳室下帯で産生されることが判っている。さらに前者は胎生初期に産生され一酸化窒素合成酵素(nitric oxide synthase, NOS)陽性、ニューロペプチドY(neuropeptide Y, NPY)陽性、SOM陽性細胞へ分化するのに対し、後者は胎生後期に産生されCR陽性細胞へ分化することが判っている。また、基底核原基で産生された細胞はげっ歯類と同様に脳表面に対して接線方向に移動し大脳皮質に進入するのに対し、脳室帯と脳室下帯で産生された細胞は脳表に向かって放射状に移動し、“inside-out”様式の配置を取ることが示唆されている。
抑制性シナプスにおいても、シナプス前膜とシナプス後膜を繋ぐ接着分子が存在する。シナプス前膜にはニューレキシン(neurexin:NRXもしくはNRXN)が局在し、シナプス後膜にはニューロリギン(neuroligin:NLもしくはNLGN)が局在することが知られており、これらの接着分子の結合によってシナプスの安定化に寄与しているのです。
抑制性シナプスにはGABA作動性シナプスとグリシン作動性シナプスがあります。GABA作動性シナプスの働きをまずシナプス前部から見ていきましょう。
GABA作動性シナプスのGABA作動性ニューロンには、グルタミン酸からGABAを合成するグルタミン酸脱炭酸酵素(glutamic acid decarboxylase: GAD)が存在する。GADには、GAD65とGAD67の二つのアイソフォームがあり、GABA作動性ニューロン特異的に発現している。GAD65は神経終末部に限局している一方、GAD67は細胞体などにも存在し、GABA合成において主要な役割を担っている。また、GAD67はパルブアルブミン陽性の介在ニューロンに強い発現がみられる。合成されたGABAは、液胞型ATPアーゼ(vacuolar-type H+‐ATPase: V-ATPase)によってできるH+濃度勾配および電位勾配に従い、小胞抑制性アミノ酸輸送体(vesicular inhibitory amino acid transporter: VIAAT)によって、シナプス小胞に充填される。そして、シナプス間隙に開口放出されたGABAは、ニューロンおよびグリア細胞の細胞膜に存在するGABA輸送体(GABA transporter: GAT)によって回収される。また、Gタンパク質共役型受容体であるGABAB受容体は、K+チャネルを開口させて神経終末を過分極させると共に、Ca2+チャネルを閉口させて伝達物質の放出を抑制する。
次に抑制性シナプスのグリシン作動性シナプスのシナプス前部についてみましょう。
グリシンはセリンヒドロキシメチルトランスフェラーゼ(serine hydroxy―methyl―transferase略して SHMT)によってセリンから可逆的に変換される。GABA同様にグリシンも小胞抑制性アミノ酸輸送体によってシナプス小胞に充填されるが、充填効率はGABAに比べて低い。
シナプスに放出されたグリシンは、ニューロンとアストロサイトの細胞膜上に発現するグリシン輸送体(glycine transporterry略して GlyT)によって回収される。グリシン輸送体の働きはNa+(ナトリウムイオン英語で sodium ion)とCl-(塩化物イオン英語でchloride ion)に依存しており、2つのアイソフォームが知られている。アストロサイト特異的に発現するGlyT1は、グリシンを細胞内外の両方向へ輸送する。一方、グリシン作動性シナプス前終末において特異的に認められる GlyT2は、細胞内外のNa+濃度勾配によって細胞外から細胞内へ一方向性の輸送を行い、シナプス小胞へのグリシン充填に不可欠である。
下図の図2に抑制性シナプスのGABA作動性シナプスとグリシン作動性シナプスを構成する分子の動きを示しましょう。
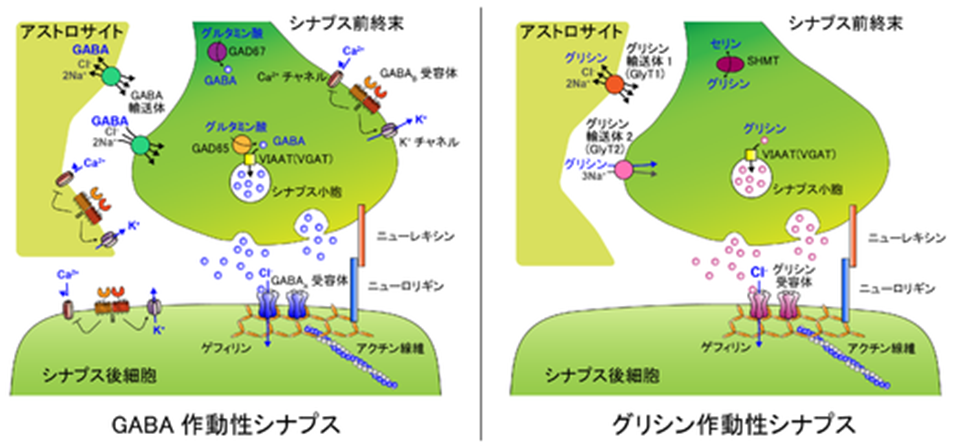
図2.抑制性シナプスを構成する分子
(GABA:γアミノ酪酸、GAD67:グルタミン酸脱炭酸酵素67、GAD65:グルタミン酸脱炭酸酵素65、VIAAT(VGAT):小胞抑制性アミノ酸輸送体(小胞GABA輸送体)、SHMT:セリンヒドロキシメチルトランスフェラーゼ)
シナプス前終末から開口放出されたGABAやグリシンなどの神経伝達物質は、シナプス後膜に存在するGABAA受容体およびグリシン受容体に結合する(図2)。いずれも塩化物イオンチャネルに共役したイオンチャネル型受容体であり、活性化に伴って塩化物イオンの透過性(コンダクタンス)を上昇させる。これらは各々複数のサブタイプを持っている。
これらの受容体は細胞内の粗面小胞体(rER)で合成され、ゴルジ体にて分泌小胞に包まれて細胞質へ移行する。そして、GABAA受容体はGABARAP(GABAA receptor-associated protein)、グリシン受容体は足場タンパク質であるゲフィリン(gephyrin)を介して順行性モータータンパク質であるキネシンスーパーファミリータンパク質(kinesin superfamily protein: KIF)に結合し、微小管(microtubule)に沿って輸送される。その後、受容体はエキソサイトーシス(exocytosis)によって細胞膜へ移行して側方拡散(lateral diffusion)し、ゲフィリンを介してシナプスへ集積すると考えられている。また、シナプスでは受容体の凝集するサブドメイン(ナノドメイン)を形成していることが示唆されている。しかし、細胞膜上の受容体は側方拡散(lateral diffusion)によってシナプス内外を移動すると共に、クラスリン(clathrin)やダイナミン(dynamin)依存的なエンドサイトーシス(endocytosis)によってエンドソームに取り込まれ、細胞内へ移行する。微小管に沿った逆行性輸送はダイニン(dynein)によって行われ、リソソームでの分解、もしくは再度エキソサイトーシスされて再利用される。クラスリン (clathrin) は 細胞外マトリクス の 分子 が エンドサイトーシス により取り込まれる際に形成される、 エンドソーム 外側を形作る 骨格 となる タンパク質 である。ダイナミン(dynamin) は、真核細胞のエンドサイトーシスを担うGTPaseです。
また、シナプス後膜にはGタンパク質共役型受容体であるGABAB受容体も存在している。
イオンチャネル型受容体を介した抑制機構とGABAA受容体/グリシン受容体を介した抑制の生理機能をみましょう。
神経終末から放出されたGABAやグリシンによって、それぞれに対応したイオンチャネル型受容体であるGABAA受容体およびグリシン受容体が活性化し、受容体内部のチャネルが開口する。これによって、塩化物イオン(chloride ion)の透過性が上昇すると、負の電荷をもつ塩化物イオン(chloride ion)が細胞内に流入し、膜電位の過分極作用をもたらす。通常、哺乳類の成体における細胞外塩化物イオン濃度はおよそ150 mMであるのに対し、細胞内はおよそ10 mM程度である。そのため、通常塩化物イオンの平衡電位は-70~-80 mV付近であり、静止膜電位よりも僅かにマイナス側にある。このように、膜電位が静止電位付近の場合には電位勾配が小さく、GABAA受容体やグリシン受容体の活性化によってチャネルの透過性が上昇しても、細胞内へ塩化物イオンの大量流入は生じない。その上、短絡効果(後述)も相まって、膜電位に与える影響は比較的小さい。しかし、興奮性入力によって膜が脱分極している状況では、塩化物イオンの電位勾配が大きくなり、より多くの塩化物イオンが細胞内へ流入することから、膜電位は静止電位付近へ引き戻される。その結果、興奮性の入力によって生じた脱分極が減弱し、活動電位の発生を抑制する。
神経細胞の発達期(成熟過程期)および傷害回復期におけるGABA・グリシンに対する応答変化をみましょう。
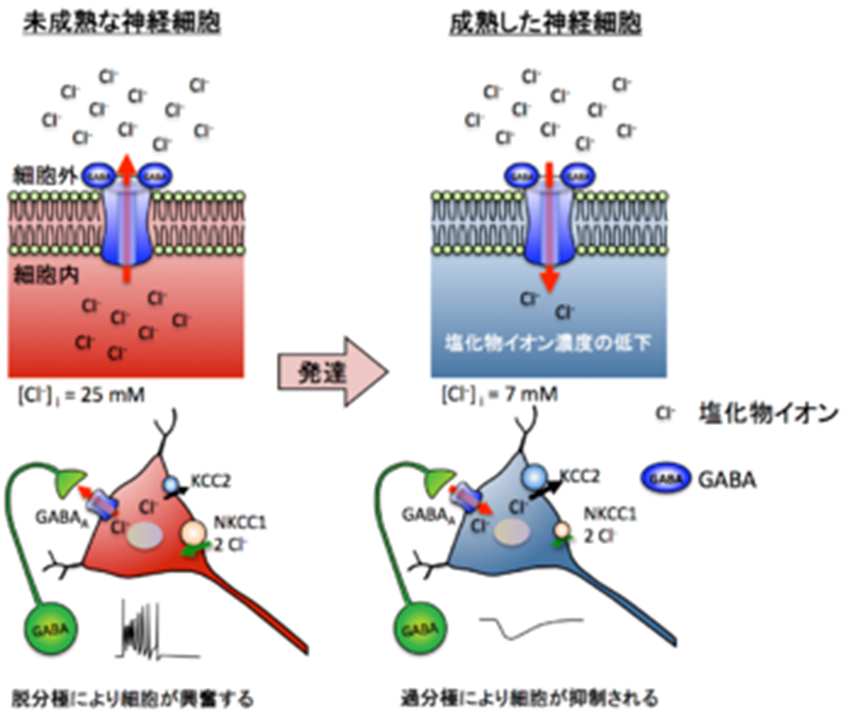
図3.発達に伴う細胞内塩化物イオン濃度とGABA応答の変化
発達に伴ってNa+-K+-Cl-共輸送体1(NKCC1) による塩化物イオン(Cl-)の細胞内汲み入れが減少する一方、K+-Cl-共輸送体2(KCC2) による細胞外への汲み出しが増加する。(NKCC はNa-K-Clコトランスポーターの略で、ナトリウム、カリウム、塩化物の細胞への二次活性輸送を助けるタンパク質です。)そのため、GABAA受容体の活性化は、未成熟な神経細胞において細胞外へ塩化物イオンの流出をもたらし、脱分極応答となる。一方、成熟した神経細胞では細胞内への塩化物イオンの流入を引き起こし、過分極応答となる。
GABAA受容体やグリシン受容体のチャネルを流れる塩化物イオンの向きと量は、細胞内外における塩化物イオンの濃度勾配と膜電位に依存している。そのため、細胞内塩化物イオン濃度が高い状態である幼若期のニューロンでは、GABAA受容体(もしくはグリシン受容体)の活性化に伴って塩化物イオンの流出をもたらし、脱分極する。
こうした細胞内塩化物イオン濃度は、細胞膜上に発現するNa+-K+-Cl-共輸送体(NKCC) 、K+-Cl-共輸送体(KCC) およびCl-/HCO3-交換輸送体など、多数の塩化物イオン輸送体によって制御されている。NKCCは塩化物イオンを細胞内へ汲み入れ、KCCは塩化物イオンを細胞外へ汲み出す働きを担っており、これらのバランスによって細胞内の塩化物イオン濃度が決定される。発達初期はKCC2に比べてNKCC1の機能発現が高く、細胞内塩化物イオン濃度が高い状態である。一方、成熟したニューロンではNKCC1に比べてKCC2の機能発現が上昇することから、細胞内塩化物イオン濃度が低い状態に保たれている(図3)。しかし、成熟したニューロンにおいても、ヘルペスによる神経細胞ストレスや神経損傷を受けると、KCC2の機能が低下することから、GABAA受容体の活性化に伴って脱分極することが報告されている。
つまり、GABAもしくはグリシン作動性入力が標的細胞に対して抑制性もしくは興奮性のいずれの作用をもたらすどうかは、標的細胞内の塩化物イオン濃度に依存している。そのため、GABAやグリシン作動性シナプスであっても、幼若期や傷害回復期においては、必ずしも抑制作用を持つシナプスではない。
ここで後述すると述べていました短絡効果について説明しましょう。
シナプス後細胞の興奮性を抑えるメカニズムとして、短絡効果(シャント効果)があります。抑制性入力によってGABAA受容体やグリシン受容体が活性化すると、それらのチャネルのコンダクタンス(透過性)が大きくなり、膜抵抗が局所的に減少する。すると、オームの法則に従って電流の変化量に対する電位の変化量が低下する。その結果、(仮に塩化物イオンの平衡電位が静止膜電位付近のため、抑制性シナプス入力が過分極をもたらさない場合であっても、)近傍の興奮性シナプスでは興奮性シナプス後電位(Excitatory postsynaptic potential略してEPSP)の振幅が減少し、結果としてシナプス後細胞の興奮性が抑えられる。
GABAB受容体を介した抑制機構をみましょう。
Gi/o共役型受容体であるGABAB受容体は、興奮性と抑制性を問わず、シナプス前終末、シナプス後膜、シナプス外領域のいずれの細胞膜にも存在しており、抑制性シナプスでは特にシナプス後膜に強い発現がみられる。GABAB受容体はGタンパク質を介してK+チャネルを開口させることで、細胞膜を過分極させる。また、Gタンパク質を介して電位依存性Ca2+チャネルを閉口させる。そのため、神経終末では活動電位が到達しても伝達物質の放出が起こりにくくなり、GABA作動性神経終末においては、自ら放出したGABAによってその後の放出を抑制する自己受容体(autoreceptor)として働く。また、GABAB受容体を介した応答は、GABAA受容体やグリシン受容体などのイオンチャネル型受容体よりも遅く、長い時間スケールでの抑制作用を持つことが知られている。Gタンパク質は、Gタンパク質共役型受容体というように、GPCRの名前の由来にもなっている。これは、すべてのGPCRがGタンパク質を介して情報伝達を行うからである。
GPCRとは何でしょうか?GPCR は英語でG-protein-coupled receptors略して GPCRで日本語に訳すとGタンパク質共役型受容体とか、G蛋白質共役受容体です。もっと詳しい正しいGPCRの英語はGTP-binding protein-coupled receptor日本語に訳すとGTP結合タンパク質共役型受容体とか、GTP結合蛋白質共役受容体です。
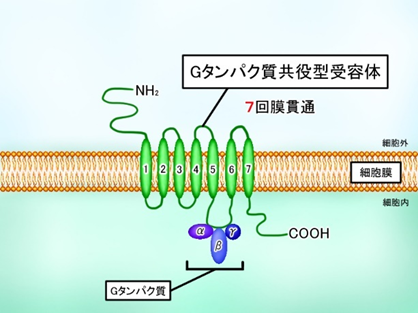
Gタンパク質共役型受容体(GPCR)の図
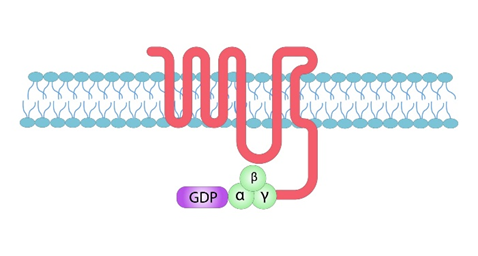
上にGタンパク質共役型受容体(GPCR)の図を示しました。この図を見ながらGPCRのそれぞれの文字(アルファベット)の意味を説明しましょう。
まずGはGDPのGはグアニンヌクレオチドの頭文字のGです。左のα、β、γはタンパク質ですがGDPに結び付いた蛋白ですからGタンパク質と言います。α、β、γはそれぞれタンパク質のサブユニットと言います。
下図のG蛋白共役型受容体(GCPR)を見てください。
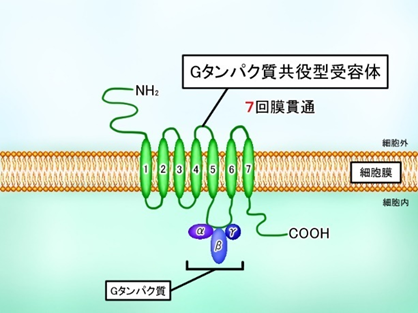
GCPRも膜蛋白ですからN末端であるNH2が細胞外にありC末端であるCOOHが細胞内にあります。疎水性であるαヘリックスからなる膜貫通ドメインが1~7まで7か所ありますがドメインが細胞膜の脂質二重層の部分を七回細胞膜の膜を貫通していることです。一方,G蛋白共役型受容体(GCPR)と共役(協力)しているGタンパク質であるα、β、γの三つのサブユニットは受容体にリガンドであるシグナル分枝が結合していないときはβとγは互いに固く結合しておりGβγ複合体と呼ばれる。他方、GαにはGTPとGDPの二つの結合部位が存在しており、ここにGDPが結合しているときG蛋白は不賦活型として三量体構造であるGαβγを取ってG蛋白共役型受容体と結合している。またここにGDPの代わりにGTPが結合しているときはシグナル分子が受容体に結合している時でありG蛋白は活性型として二量体構造であるGαとなりG蛋白共役型受容体と結合しているのです。
GCPRは真核生物における最大かつ最も多様な膜受容体の集団です。細胞膜受容体は光エネルギー、ペプチド、脂質、糖タンパク質などのメッセージを受け取る受信箱のような役割を果たしています。これらのメッセージは生命維持に必要な光や栄養素が環境中に存在しているのか無いのかを細胞に知らせたり、ほかの細胞から送られてくる無数の情報を細胞に伝達します。Gタンパク質共役型受容体(GPCR)は人体のさまざまな機能に関与しており、市販されている医薬品の3分の1から2分の1は、GPCRに結合して作用するのです。
ヒトゲノムには訳800種類のGタンパク質共役型受容体が遺伝子にコードされておりホルモンや成長因子などの内因性の人のリガンドを認識します。人のGタンパク質共役受容体のい内50%は臭いにかかわる受容体であります。約30種類はまだリガンドや働きが不明なオーファン受容体です。
Gタンパク質共役型受容体GPCRはどんな形をしているのか?
既に絵で示したようにGタンパク質共役型受容体(GPCR)は非常に多様なシグナル伝達分子と結合するが、進化の過程で保存されてきた共通の構造を持っている。多細胞生物では、GPCRはかなり多くの機能に関与している。ヒトは約1,000種類のGPCRが存在し、それぞれが特定のシグナルに対して高度に特異的な働きをしている。
GPCRは、球状に折り畳まれた1つのポリペプチドが細胞膜に埋め込まれてできている。GPCRが「7回膜貫通型受容体」と呼ばれる理由は、この分子の7つの部分が膜の幅全体を覆っており、その間の部分が細胞の内外でループしているからである。細胞外のループは、シグナル分子がGPCRに結合するポケットの一部を形成している。
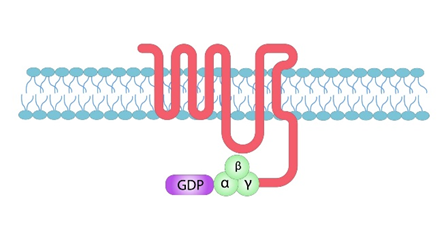
GPCRの役割とは何でしょうか?
Gタンパク質共役型受容体GPCRは、共役(協力)というその名の通り、受容体は細胞膜にあるGタンパク質(α、β、γ)と相互作用する。外部からのシグナル分子がレセプターであるGPCRに結合すると、GPCRの構造が変化する。この変化が、レセプターであるGPCRとその近くにあるGタンパク質(α、β、γ)との相互作用のきっかけとなる。
すでに述べたようにGタンパク質は、ヌクレオチドであるグアノシン三リン酸(GTP)とグアノシン二リン酸(GDP)を結合する能力を持つ特殊なタンパク質である。Gタンパク質の中には、シグナル伝達タンパク質であるRasのように、1つのサブユニットを持つ小さなタンパク質もあるが、GPCRに結合するGタンパク質は、αサブユニット、βサブユニット、γサブユニットの3つの異なるサブユニットを持つヘテロ三量体である。これらのサブユニットのうち、αとγの2つのサブユニットは、脂質アンカーによって細胞膜に結合しています。脂質アンカーはタンパク質に対し膜に繋ぎとめる錨の役割をします。
Gタンパク質αサブユニット(Gpα)は、タンパク質が活性化したときはGTPと結合、不活性化のときはGDPと結合している。つまり、Gpαのリン酸化でGpαは活性化する。
細胞外から活性化するためのリガンド(シグナル分子)がGPCRに結合すると、GPCRの構造変化によってGタンパク質が活性化され、αサブユニットに結合していたGDPに代わってGTPが結合する。その結果、Gタンパク質のサブユニットは、αβγのヘテロトリマーからGTPが結合したαサブユニットと、βγ2ヘテロダイマーの2つのサブユニットに解離する。どちらの部分も細胞膜に固定されたままではあるが、GPCRに結合していないので、横方向に拡散して他の膜タンパク質と相互作用することができるようになる。Gタンパク質は、αサブユニットにGTPが結合している間は活性を維持する。しかし、このGTPが加水分解されてGDPに戻ると、サブユニットは再び不活性なヘテロ三量体の形になり、Gタンパク質全体が不活性なGPCRと再び結合する。このように、Gタンパク質は、細胞表面のシグナルと受容体の相互作用によってオン/オフされるスイッチのような働きをする。
Gタンパク質が活性化すると、GTPと結合したαサブユニットとGTPと結合していないβγ二量体の両方が、シグナル伝達に関与する他の膜タンパク質と相互作用することで、細胞内にメッセージを伝えることができる。活性化されたGタンパク質の具体的な標的としては、セカンドメッセンジャーを産生するさまざまな酵素と、イオンがセカンドメッセンジャーとして働くことを可能にする特定のイオンチャネルなどが挙げられる。Gタンパク質には、これらの標的の活動を促進するものと、抑制するものとがある。人を含む脊椎動物のゲノムには、Gタンパク質のα、β、γの各サブユニットをコードする複数の遺伝子が存在する。これらの遺伝子がコードする多くの異なるサブユニットは、複数の方法で結合し、多様なGタンパク質ファミリーを生み出している。
GPCRシグナルが細胞内で引き起こすセカンドメッセンジャーとはなんでしょうか?
1つのGタンパク質が活性化されると、何百、何千ものセカンドメッセンジャー分子の生成に影響する。セカンドメッセンジャーとは、サイクリックAMP(cAMP)、ジアシルグリセロール(DAG)、イノシトール1、4、5-三リン酸(IP3)など、細胞内のシグナル伝達経路を開始したり調整したりする小分子のことである。活性化Gタンパク質の標的として特によく知られているのがアデニル酸シクラーゼである。アデニル酸シクラーゼは、膜に結合した酵素で、GTPに結合したαサブユニットによって活性化されると、ATP分子からセカンドメッセンジャーであるcAMPの合成を触媒する。ヒトの場合、cAMPは、感覚入力、ホルモン、神経伝達などの反応に関与している。
ホスホリパーゼCも活性化Gタンパク質の共通の標的である。ホスホリパーゼCは、膜脂質のホスファチジルイノシトールからジアシルグリセロール(DAG)とイノシトールリン3酸(IP3)という2種類のセカンドメッセンジャーを合成する。
GPCRのまとめ
GPCRは、さまざまな外部シグナルに反応する細胞表面受容体の1000種類にも及ぶ大規模なファミリーである。シグナル分子がGPCRに結合すると、Gタンパク質が活性化され、その結果、さまざまなセカンドメッセンジャーが産生される。このようにして、GPCRは、感覚、成長、ホルモン反応など、実に多様な生体機能を制御している。
因みにGPCRの元の英語はGTP-binding protein-coupled receptor でこれを日本語で訳すとグアノシン三リン酸結合蛋白質共役受容体です。長くなりすぎるのでGタンパク質共役受容体と訳しているのです。
Gタンパク質は、グアニン‐ヌクレオチド結合タンパク質の略称であり、GTPまたはGDPを結合して活性のON/OFFを行うことにより、細胞内情報伝達に関与する。
Gタンパク質の種類はすでに述べたα、β、γの三つがあるのですが実際にはαはGαとして行動します。一方、βγはGβγとして行動します。従ってGβγの種類は実質的には1種とみなすことができるが、Gαにはたくさんの種類がみつかっている。そのため、Gタンパク質の種類はGαの相違によります。
Gαには多くの組織に分布する4つのサブクラス(Gαs、Gαi/o、Gαq/11、Gα12/13)と、感覚器に特異的に発現するGαolf(嗅覚ニューロン)、Gαt(トランスデューシン;視細胞網膜桿体・錐体外節)、Gαgust(ガストデューシン;味細胞)がある。下記にアドレナリン受容体とヒスタミン受容体の例をあげているが、このように同じリガンドで活性化される同ファミリー受容体においても、共役するGαタンパク質の違いが細胞応答の違いを生み出す。
代表的な主なGタンパク質には4種類(主に3種類:Gs, Gi/o, Gq)あり、それぞれで情報伝達の内容が異なる。次の4種類である。Gs、Gi/o、Gq、Gtの4種類です。Gsの「s」は「stimulate:刺激する、興奮させる」を意味する。Gsは興奮性のシグナル伝達を行う。例えば、アドレナリンβ1受容体はGsと共役しており、作動薬により心臓がバクバクするといった心機能の亢進が見られる。Gsが伝達する情報は「興奮」である。Giの「i」は「inhibit:抑制する」を意味する。GiはGsとは反対のGタンパク質で、抑制性のシグナル伝達を行う。例えば、オピオイドμ受容体はGi/oと共役しており、oはオピオイド(アヘン様の)のoでありアヘンと同じ働きを持つであるモルヒネなどの作動薬により鎮静作用が発現し、痛みを抑えられる。Giが伝達する情報は「抑制」である。Gqの「q」の由来については不明です。Gqはさまざまな調節のシグナル伝達を行う。例えば、血管平滑筋にあるアドレナリンα1受容体はGqと共役しており、受容体刺激により血管が収縮する。GtはトランスデューシンというGタンパク質であり、「t」はトランスデューシンからきている。Gt(トランスデューシン)は、網膜に存在するロドプシン(光受容体)と共役する。そのため、GPCRはロドプシン型受容体と呼ばれることもある。
抑性シナプスにしろ、興奮性シナプスにしろ、機能が長期増強と長期抑圧がありますがここでは抑性シナプスの長期増強と長期抑圧をみましょう。
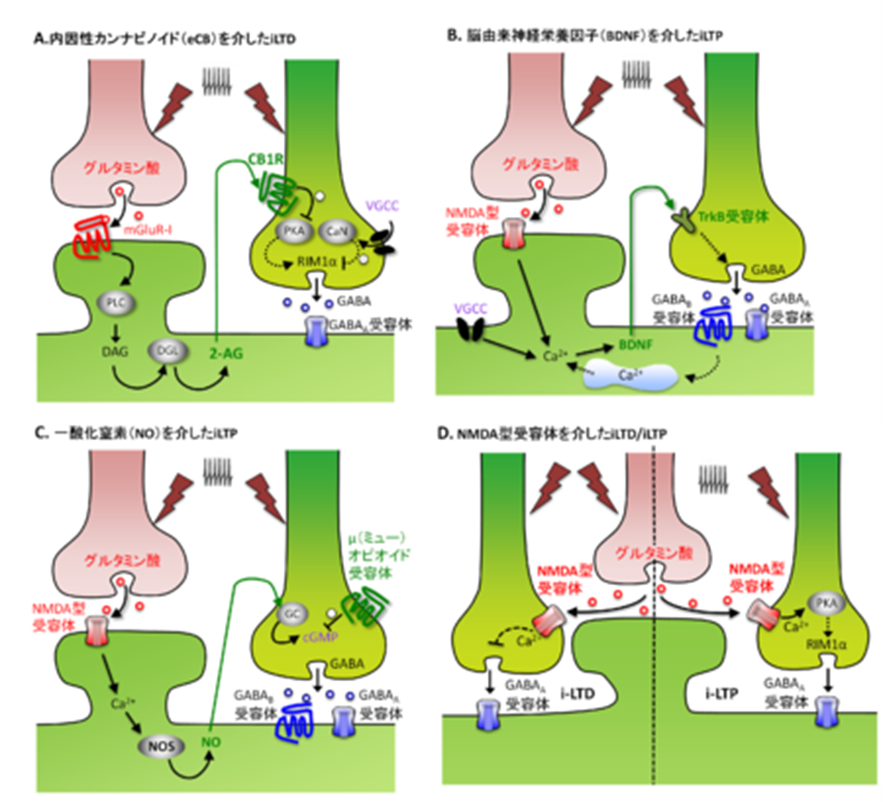
図4.GABAの放出確率調節による抑制性LTP(iLTP)とLTD(iLTD)モデルをみましょう。
長期抑圧long-term depression(LTD) (A)内因性カンナビノイド(eCB)を介したiLTD, (B)脳由来神経栄養因子(BDNF)を介したiLTP, (C)一酸化窒素(NO)を介したiLTP, (D)前シナプスのNMDA型グルタミン酸受容体を介したiLTDおよびiLTP。iLTDは 抑制のlong-term depression of inhibitionで長期抑圧で、iLTPは long-term of potentiationで抑制の長期増強です。
(mGluR-I:グループ1代謝型グルタミン酸受容体、PLC:ホスホリパーゼC、DAG:ジアシルグリセロール、DGL:ジアシルグリセロールリパーゼ、2-AG:2-アラキドノイルグリセロール、CB1R:カンナビノイド受容体I型、VGCC:電位依存性カルシウムチャネル、PKA:プロテインキナーゼA、CaN:カルシニューリン、RIM1α:Rab3相互作用分子1α、TrkB受容体:脳由来神経栄養因子受容体、NOS:一酸化窒素合成酵素、GC:グアニル酸シクラーゼ、cGMP:環状グアノシン一リン酸)。
長期増強(long-term potentiation:LTP)と長期抑圧(long-term depression:LTD)は、刺激の頻度とタイミングによって、その後のシナプス伝達効率の変化が長時間に渡って持続する現象である。前者は伝達効率が上昇する一方、後者は伝達効率が減少する。このLTPとLTDは興奮性シナプスにおいてよく知られているが、抑制性シナプスにおいても生じることが報告されiLTPとiLTDがあります。いずれの現象についても、前シナプスと後シナプスそれぞれにおける様々な機序によって生じます。前シナプスについては、内因性カンナビノイド(eCB)、脳由来神経栄養因子(BDNF)、一酸化窒素(NO)などの逆行性シグナルや神経前終末のNMDA型グルタミン酸受容体を介して、伝達物質の放出確率を調節するメカニズムがあります。。
それでは内因性カンナビノイドを介したiLTD(上の図4A)をみてみましょう。
シナプス後膜のグループI代謝型グルタミン酸受容体(mGluR-I)の活性化によって、内因性カンナビノイドである2-アラキドノイルグリセロール(2-AG)が産生、放出される。これにより抑制性シナプス前終末のカンナビノイド受容体I型(CB1R)が活性化すると、プロテインキナーゼA(PKA)活性が低下し、アクティブゾーンタンパク質であるRIM1α(Rab3相互作用分子1α)のリン酸化が減少する。同時に、細胞内カルシウム上昇によってカルシニューリン(CaN)が活性化すると、RIM1αの脱リン酸化が促進され、結果的にRIM1α依存的なGABAの放出が減弱する。
次に脳由来神経栄養因子を介したiLTP(上の図4B)を見ていきましょう。
細胞内のカルシウムイオン濃度上昇によってシナプス後細胞から脳由来神経栄養因子が放出される。それによりシナプス前終末に発現するTrkB受容体が活性化することで、GABA放出が増加する。また、シナプス後細胞におけるGABAB受容体の活性化は、細胞内カルシウムストアからのカルシウムイオンの放出を誘導する。TrkB ( 脳由来神経栄養因子受容体 )は、神経栄養因子(neurotrophin, ニューロトロフィン) 受容体 の一つである。TrkBはトラックビーと発音します。 ニューロトロフィン は、神経成長因子(NGF)関連 遺伝子ファミリー の総称であり、現在、NGF、 BDNF (脳由来神経栄養因子)、NT-3、NT-4/5が知られている。
次に一酸化窒素を介したiLTP(上の図4C)をみていきましょう。
細胞内のカルシウム濃度上昇によって一酸化窒素合成酵素(NOS)が活性化し、一酸化窒素が産生される。細胞膜を透過したNO(一酸化窒素)は、シナプス前終末のグアニル酸シクラーゼ(GC)に作用して環状グアノシン一リン酸(cGMP)を増加させ、その結果GABA放出を増加させる。一方、NOによるcGMPの上昇は、μオピオイド受容体(μOR)の活性化によって阻害される。
次は前シナプスのNMDA型受容体を介したiLTDおよびiLTP(図4D)を勉強しましょう。
抑制性神経前終末に発現したNMDA型グルタミン酸受容体の活性化は、細胞内カルシウム濃度を上昇させる。これによって、GABA放出の減弱(iLTD)、あるいはプロテインキナーゼA(PKA)の活性化とアクティブゾーンタンパク質であるRab3相互作用分子1α(RIM1α)のリン酸化を介してGABA放出の増強(iLTP)を誘導する。NMDA型グルタミン酸受容体はグルタミン酸受容体の一種で記憶や学習、また脳虚血後の神経細胞死などに深く関わる受容体である。他のグルタミン酸受容体サブタイプである AMPA受容体やカイニン酸受容体と異なり、NMDA(N-メチル-D-アスパラギン酸)がアゴニストとして選択的にNMDA型グルタミン酸受容体に作用します。中枢神経系を中心に生体内に広く分布し、リガンドであるグルタミン酸の結合を経て、陽イオンを透過する、イオンチャネル共役型受容体である。
ところがリガンドであるグルタミン酸を結合した NMDA受容体が透過させる陽イオンには特に選択性がなく、ナトリウムイオン (Na+) やカリウムイオン (K+) の他に、カルシウムイオン (Ca2+) も通すことができるのです。
一方、後シナプスについては、GABARAPなど受容体の輸送に関わる分子やGABAA受容体自体のリン酸化や脱リン酸化によって、シナプスにおける受容体の数や局在、イオン透過性などの構造的・機能的修飾が生じるのです。また、この他にはKCC2やNKCC1などの細胞内塩化物イオン濃度調節機構への作用によって細胞内塩化物イオン濃度が変化し、その結果GABAやグリシンによる応答の振幅が変化します。
次はシナプス外受容体による持続性抑制を勉強しましょう。
GABAA受容体およびグリシン受容体は、シナプスに高密度で集積するだけでなく、シナプス外においても低密度で存在し、持続性抑制(tonic inhibition)に関わります。こうしたシナプス外の受容体は、シナプス間隙から漏出(spill‐over)したリガンドや細胞外に低濃度で存在するリガンドによって活性化することで、細胞の興奮性を調節しています。そのため、脱感作しにくい特徴を持っており、δサブユニットを含むGABAA受容体など、受容体のサブユニット構成によって機能的特徴が異なるのです。脱感作現象(desensitization)とは,受容体作動薬による受容体の感受性低下であり,細胞表面における受容体発現レベルの低下に起因するものですが,特にGタンパク質共役型受容体ファミリーの場合については,Gタンパク質共役型受容体のリン酸化とそれに続く細胞内活性調節タンパク質などとの結合の結果,Gタンパク質共役型受容体の細胞膜内への移行(sequestration)とそれに付随して生じる細胞質内への移動(internalization)が重要なやくわりを持っています。
最後にGABAおよびグリシン作動性シナプスの相違点を見ましょう。
GABA作動性シナプスは中枢神経系全般に広く分布し、大脳新皮質、海馬、視床、小脳などにおいて主要な抑制性伝達を担う。一方、グリシン作動性シナプスは脳幹、脊髄における主要な抑制性伝達を担い、小脳や網膜においても機能している。また、脊髄や脳幹などでは、単一神経終末において、同一のシナプス小胞からGABAとグリシンの共放出も見られます。加えて、これらのシナプスでは未熟期においてGABA優位であった神経伝達が、発達に従ってグリシン優位に変化(スイッチング)することが知られており、シナプス成熟後もGABAとグリシンの共放出が認められます。
GABAA受容体およびグリシン受容体は、いずれも塩化物イオンを選択的に透過させる点で共通している。しかし、GABAA受容体を介した抑制性シナプス後電流(inhibitory post synaptic current: IPSC)は、グリシン受容体のそれに比べて電流の減衰時間が長いのです。また、先述の通り、GABA作動性シナプスではGABAB受容体が自己受容体として働くことも特徴的である。
追加で電気シナプスによる抑制も触れておきます。
今まで述べてきた化学シナプスとは別に、電気シナプス(electric synapse / electrical synapse)を介した抑制も知られてます。電気シナプスの場合、ギャップ結合(gap junction)を介して異なるニューロン同士の細胞質が直接連結しており、細胞間のイオンの移動が容易である。そのため、あるニューロンにおける過分極が、他のニューロンへ瞬時に伝播して過分極させる。ギャップ結合 ( Gap junction )は、隣り合う 上皮細胞 をつなぎ、水溶性の小さい イオン や 分子 を通過させる 細胞間結合 のことであり、 並んだ2つの 細胞 の 細胞膜 には コネクソン と呼ばれる タンパク複合体 の末端が複数並んでおり、橋渡し構造をなしている。 このコネクソンが チャネル となり、ここを通って無機イオンや小さい水溶性分子が隣接細胞の 細胞質 から細胞質へと直接移動することができる。
例えば、マウス小脳皮質に存在する抑制性ニューロンの一種であるゴルジ細胞は、互いにギャップ結合を形成して同期発火している。しかし、苔状線維から興奮性入力を受けると、直接入力を受けた細胞とその周囲の細胞の間で脱同期化が生じることが知られている。これはギャップ結合を介して周囲のゴルジ細胞に後過分極(after-hyperpolarization)が伝播するためであり、ギャップ結合が抑制性の電気シナプスとして機能している例である。
発火(firing)とは何でしょう。また同期発火(Synchronous firing)とはなんでしょう。ニューロン(神経細胞)は連続的な刺激の印加(供与)によって短い時間幅のスパイクを発生させる.印加(いんか)とは、電気専門用語で電気回路に電源や別の回路から電圧や信号を与える事を意味し、「電圧を印加する」「信号を印加する」という様に使われる。 またこの時、印加された電圧、電流はそれぞれ印加電圧、印加電流と呼ばれる。 電圧を印加した瞬間に流れる大電流を突入電流(インラッシュ電流)という。この現象は発火と呼ばれ,脳内の情報処理において発火が重要な役割を担っています。この発火による情報のコーディング方法(読み取り方法)としては,ニューロンの発火頻度,集団(グループ)の発火活動によるコーディング(読み取り),短い時間間隔での発火パターンによる符号化などが考えられている.一方で複数のニューロンが同時(あるいはある一定の間隔を保って)に発火するなどニューロン同士が見せる発火のタイミングの関係性が重要であるとも考えられています。このような発火現象は同期発火(Synchronous firing)と呼ばれています。さらに,同期発火はパーキンソン病や癲癇などの神経性の病症との関連があります。したがって同期発火現象のメカニズムがパーキンソン病や癲癇や統合失調症などの脳の病気の原因を突き止める手がかりを与えてくれるでしょう。原因不明の脳疾患のすべては同期発火の異常がヘルペスによって起こされていると目星をつけていたのでここまでシナプスの勉強を深めてきたのはヘルペスが異常の正常な神経伝達の要であるシナプスの正常な働きをどのように変えるかによってさまざまな脳疾患を起こすのかを解明したいために難しい脳の働きを勉強しているのです。
例えば脳内の神経回路ネットワークの正常な機能発現において,シナプスにおける各種神経伝達物質による神経細胞の興奮と抑制は,その根本となるべきなのですが、無数に存在する神経細胞群の同期した過剰な発火によって引き起こされるてんかん発作を特徴とする慢性の脳疾患「てんかん」では,神経回路ネットワークの興奮と抑制のバランスが障害を受けているのはヘルペスのなせる業だと考えています。癲癇を治した経験があるので理論的に証明します。
さあ、ここで脳の働きの最終的な目標は何だかを考えてみましょう。嗅覚、味覚、痛覚はもとより、視覚や聴覚や平衡覚などの感覚器が受ける情報は脳に伝わると形や色,運動方向やその速度などの細かな情報に分割されそれぞれについて処理されるだけでは不十分です。最後にすべての情報を分析した後に分析結果のすべてを正しく再統合するのですが,細分化された情報をどのようにしてたった一つの正しい反応に凝縮し結びつけ統合しているのかというメカニズムの詳細の答えはいまだ出ていません。この問題を易しく「結びつけ問題(Binding problem)」と言います。ところがこの結びつけ問題(Binding problem)はいまだ解決されていないのです。この問題の解明には同期発火がとくに結びつけ問題(Binding problem)と非常に深い関わりがあると考えられているのです。
結びつけ問題(Binding problem)は脳科学における未解決の主要な問題の一つであるのです。結び付け問題(Binding Problem)は,広義には脳内で並行に行われる様々な情報処理をどのように統合するかの問題であるが具体的に,頻繁に取り扱われるのが,脳内の視覚情報処理において,別々の場所で処理される「色」「形」「動き」などの情報を,どのように結び付けて一つの対象として認識するかという問題である.網膜からの信号は,大脳皮質の視覚野(visual cortex)で処理される.目からの視覚情報は,像の輪郭や位置などの抽出を行う初期視覚野を経由し,「色」「形」「動き」などの高度な特徴を抽出する高次視覚野で脳内の別々の場所で処理される.例えば,青い四角形と赤い円形が同時に示された時,高次視覚野では青,赤,四角と円の特徴を認識する領域が活動する.この時,どのようにして,青と四角を一つの対象とし,赤と四角を別の対象として認識するかが「結び付け問題」である.
結び付け問題の説明には多くの説が提案されている.結び付けの主要な仕組みとしては,神経細胞の同期発火,選択的注意,および短期記憶などがある.近年の研究成果では,これら単一の方法ではなく,複合的に結び付けが行われている可能性を示している.同期発火説(Temporal Synchronization Hypothesis)では,脳の複数の神経細胞が同期的に発火することにより,情報の結び付けを行い,また同期の位相により別の物体との識別も可能とする.オブジェクトファイル理論(Object- file Theory)では,選択的注意(Selected Attention)により,注意の対象のためのオブジェクトファイルと呼ばれる視覚的短期記憶(Visual Short‐term Memory)が用意され,対象に関係する特徴情報が結び付けられる.特徴統合理論(Feature Integration Theory)では,視覚信号から素早く荒い識別が行われ,荒い識別結果を元に注意対象の位置を決定し,その位置に関連する特徴をオブジェクトファイルに結び付けて詳細な認識を行う.
人工知能分野においても,人工ニューラルネットワークによる結び付け問題の研究は積極的に進められている.今後は,「結び付け問題」研究の成果を元に,意識に相関した脳活動 (Neural Correlates of Consciousness)の解明が期待されています。
もしもニューロンの発火にのみ情報がコードされていると考えると複数の入力情報を再統合する際に,元の入力情報とは異なる情報が再現され、その結果として脳は、あるはずがないまぼろしを見ることとなる.同期発火によるニューロン同士の関連性を持った発火現象は分割された情報と情報との関連を持たせる役割もあると考えざるを得ません。
興奮性神経細胞の作用はわかりやすいのですが、わかりにくい抑制性神経細胞についてまとめます。神経細胞のうち、伝達物質としてGABAあるいはグリシンをもち、シナプス後膜においてClイオン透過性を上昇させ細胞膜を過分極させるか、シャント(短絡)効果により膜電位の伝播を抑制するものを抑制性神経細胞という。大脳皮質では約20%の神経細胞がGABAを伝達物質としてもつGABA作動性抑制性神経細胞である。局所回路において作用することから介在神経細胞とも呼ばれ、興奮性神経細胞からの出力を調整し、同期性を制御したり、過剰興奮を防ぐなど重要な機能をもつ。形態や機能やマーカータンパク質の発現などの点からは多種多様であり、大脳皮質では形態的には大型バスケット細胞、小型バスケット細胞、ネストバスケット細胞、シャンデリア細胞、紡錘細胞、ダブルブーケ細胞、マルチノッチ細胞などが存在する。シナプスを形成する部位には、興奮性神経細胞上の樹状突起、細胞体、軸索部分にそれぞれ特化して合う抑制性神経細胞が存在し、その機能と密接に関連する形態を持っている。発生期には終脳腹側の基底核原基で産生され、大脳皮質に移動し回路に組み込まれ介在神経細胞として働く。
私が16歳から罹患しているヘルペス脳炎とは何でしょうか?まず脳炎とは何でしょうか?ウイルス性脳炎とは何でしょうか?
脳炎(のうえん)は、脳の炎症性疾患の総称。急性脳炎は脳実質に生じた炎症によって、発熱、頭痛、意識障害、麻痺などの急性症状を呈した状態をさす。脳炎様の臨床症状が存在するにもかかわらず脳実質に炎症が見られない場合は病理学的に脳炎に含めず脳症に分類する。脳症の病理学的な特徴は炎症ではなく脳浮腫である。
原因が中枢神経と疑われるとき、髄液検査を行い細胞数の増加があれば神経感染症と考える。神経感染症では感染部位によって名称、症状が異なる。
| 名称 | 英語名 | 症状 |
| 脳炎 | Encephalitis | 頭痛、発熱、痙攣、意識障害、神経局所症状 |
| 髄膜炎 | Meningitis | 頭痛、発熱、嘔吐 |
| 髄膜脳炎 | meningoencephalitis | 脳炎症状と髄膜炎症状 |
| 硬膜炎 | Pachymeningitis | 頭痛、発熱、脳神経症状 |
| 脊髄炎 | Myelitis | 発熱、対麻痺、膀胱直腸障害 |
中枢神経系の感染症は早期発見、効率的な方針決定、速やかな治療の開始が生命予後を左右するため医療にとって最も重要な疾患の一つである。これら明瞭な臨床症候群は急性細菌性髄膜炎、ウイルス性髄膜炎、脳炎、局所性感染症である脳膿瘍や硬膜下膿瘍および感染性血栓性静脈炎が含まれる。いずれもそれまで健康であった人々に発熱や頭痛などの非特異的な前駆症状を引き起こし、最初は比較的良性の病態と考えられる。しかし、ウイルス性髄膜炎以外はやがて意識状態の変化、局所性神経症状または痙攣発作が出現する。早期治療のポイントはこれらの病態を早急に鑑別し、病原体を同定し適切な特異的な治療を開始することである。まずは感染部位がくも膜下腔にある(すなわち髄膜炎である)のか、病変は脳組織全体に分布しているのか、あるいは大脳半球、小脳、または脳幹に限局しているのかを確認することが必要である。ヘルペスウイルス感染により脳組織が直接受ける場合は脳炎とよばれ、細菌または真菌または寄生虫による局所性感染が脳組織に及んでいる場合には被膜形成の有無によって脳膿瘍、または脳実質炎とよばれる。
急性脳炎の分類は大きく分けると免疫介在性脳炎と感染性脳炎に分かれると言われていますが免疫介在性脳炎も感染性脳炎もherpesによるものです。
ヘルペス脳炎は、4類感染症定点把握疾患の「急性脳炎(日本脳炎を除く)」を代表する重要な疾患であり、全国約500 の基幹病院定点より毎週報告されている(註:2003比率年11月施行の感染症法一部改正により、5類感染症全数把握疾患の急性脳炎(ウエストナイル脳炎及び 日本脳炎を除く)に変更)。単純ヘルペスウイルス1型(herpes simplex virus type 1:HSV-1)あるいは2型(herpes simplex virus type 2 :HSV-2)の初感染時または再活性化時に発症し、発症年齢(新生児、年長児、成人)によってその病態はかなり異なる。年長児から成人のヘルペス脳炎の ほとんどの症例はHSV-1によるものであり、新生児のヘルペス脳炎においては、森島らの全国調査(1993)によりHSV-1がHSV-2 より約2:1ので多いと報告されている 。HSV が中枢神経系に移行する経路は、上気道感染から嗅神経を介してのルート、血行性ルート、感染した神経節からのルートの3通りが考えられている。新生児の場 合は全脳炎のパターンをとることが多いが、年長児、成人においては、上記のルートを介して好発部位である大脳辺縁系にウイルスが到達し、病変を起こすとされている。
抗ウイルス剤が開発されるまでの予後はきわめて不良で、小児のヘルペス脳炎の致命率は70~80%、成人のヘルペス脳炎においても30%の致命率である と報告されていた。抗ウイルス剤が開発されてからは致命率は10%程度に低下したものの、いまだ3分の1の症例においては重度の後遺症を残す重篤な疾患で あることに変わりはない。
HSV は世界的に広く浸透したウイルスで、感染様式はHSV による皮疹や口唇ヘルペスを発症した患者の唾液との密接な接触、性器ヘルペスからの母子感染あるいは性的感染によると考えられている 。
HSV‐1感染の好発年齢は2歳にピークがあり、6歳ぐらいまでに感染を受ける確率が高い。一方、HSV-2感染はsexually transmitted diseases(STD)としての性質を有し、15歳以下の小児における抗体保有率は1%以下である。感染を受ける年齢は20 ~30 歳代が多く、Johnson ら(1989)によると、米国の若年成人における抗体保有率は20.2%であったと報告されている 。発症に季節的な変動はないが、男女比ではやや男性の方が多く発症している。
森島らの全国調査の結果から、我が国での小児における急性脳炎・脳症の発症数は約1,000~2,000 例/年で(厚生省予防接種研究班、AND 調査)、そのうちHSV によるものは約80 ~160 例と推測されている。成人も含めると、森島、亀井、Kagi らの報告により、年間100万人当たり1人、計300~400 例といわれている。Whitley らによると米国での発症率は年間50万人当たり1人であるが、年齢分布においては、日本の方が10歳以下の発症率が高いようである 。参考のために、筆者らが以前にまとめた、急性脳炎・脳症を生じた例での原因となるヘルペス科ウイルスを示す。
HSV はヒトヘルペス科ウイルスα亜科に属する約152kbp の2本鎖DNA ウイルスで、直径約150~200 nmである。増殖サイクルが速く、その後に神経節で潜伏感染する性質を有する。皮膚、粘膜に感染したHSVは知覚神経の軸索輸送により神経節へと運ばれ、 潜伏感染状態に入る。ウイルス粒子内では線状DNAとして存在し、細胞に取り込まれたあとは、環状構造をとる。再活性化時は前初期遺伝子 (immediate early gene)、初期遺伝子(early gene)、後期遺伝子(late gene)の順に転写が進行し、rolling‐circle 型のDNA複製を行い、envelope をかぶったウイルス粒子として細胞外へ放出される。
HSV にはHSV-1とHSV-2が存在し、この2つのウイルス間のDNA の相同性は約50%である。制限酵素パターンやその他の分子生物学的手法、ならびに免疫学的手法を用いて区別が可能である。HSV‐1は主に顔面に、 HSV-2は主に外陰部に病巣を形成する。そのため、HSV‐1 は三叉神経節領域、HSV-2 は腰髄・仙髄神経節領域に潜伏感染することが多い。しかし、我が国においては欧米に比してHSV-1 による性器ヘルペスの頻度が高く、新生児ヘルペスの原因ウイルスがHSV-1とHSV-2 で約2:1 であることがそれを物語っている。ただし、性器ヘルペスの再発頻度としてはHSV-2の方が高頻度であるため、ウイルスの型別診断を行うことは重要である。HSVの細胞への進入にはenvelope に存在する糖蛋白glycoprotein D(gD)およびgB が関与している。
潜伏期は2 ~12 日(平均6日)である。新生児ヘルペス脳炎と小児期・成人のヘルペス脳炎ではその病態が異なる。その理由として、新生児ヘルペスの場合は産道で感染した HSV が血行性に全身に広がり、血液脳関門を通過して中枢神経系に到達するが、年長児や成人の場合は血液からウイルスが検出されないことから、神経行性にウイルスが脳に進入し、好発部位である側頭葉、大脳辺縁系に病変を呈するためです。小児期と年長児・成人の違いは、小児の場合はHSV の初感染に伴って発症することが多いのに比して、成人や年長児の場合はそのほとんどが免疫が下がって増殖できるようになったためです。増殖できるようになることを再活性化と言っています。
新生児ヘルペス脳炎に関しては、名古屋大学の森島らの詳細な報告がある 。それによると、新生児ヘルペスは全身型、中枢神経型、表在型の大きく3つのカテゴリーに分類され、脳炎の症状を呈するのは全身型と中枢神経型である。頻 度的には全身型が36%、中枢神経型が36%、表在型が28%であり、発症時期は、全身型が生後平均4.6 日、中枢神経型が平均11.0日、表在型が平均6.0日とされている。母親の性器ヘルペスから産道感染することが最も多いが、ヘルペス病変を認めない場合 も多く、家族、医療従事者を含めて、口唇ヘルペスやひょう疽も感染源となり得るため、新生児との接触には十分に注意が必要である。
ひょう疽とは?ひょうそは、指先に炎症とうずくような強い痛みを起こす細菌感染症で爪周囲炎と呼ばれることもありますが実はひょう疽の原因もherpesです。 何故ならば抗生物質を投与して多くは1週間くらいで赤みや水ぶくれが落ち着き、その後はかさぶたができて3週間程度で見かけはよくなるのですが 皮膚症状が治まった後も痛みが残ることがあり、長期間続くからです。
表剤型のヘルペス脳炎の臨床症状は皮疹以外は非特異的で、発熱、哺乳力低下、活気がないなどの症状から始まり、癲癇性痙攣、ヘルペス性肝炎、呼吸障害、出血傾向が認められるようになる。 皮疹がない場合も多く、上記にあげる非特異的な症状をみた場合、いかに早く新生児ヘルペスを疑って治療を開始するかが予後を大きく左右する。
年長児・成人のヘルペス脳炎はHSV-1の再活性化によるものが多く、HSV‐2 は主に脊髄炎や髄膜炎の形をとることが多い。急性期の症状としては、発熱、頭痛、嘔吐、髄膜刺激症状、意識障害、痙攣、記憶障害、言語障害、人格変化、幻視、異常行動、不随意運動、片麻痺、失調、脳神経症状など多彩で、すべてが揃うことは少なく、発熱と不随意運動のみの症例も経験している。まさにherpes性脳炎です。感染症で中枢神経症状を 認める患者を診た場合には、まずヘルペス脳炎を念頭に置いて、迅速診断・早期治療を心がける必要がある。
抗ウイルス剤の開発により致命率は減少したものの、後遺症を残す症例も多く、いまだ重篤な疾患の一つであることと、抗ウイルス剤投与中止後の再燃には十 分な注意が必要である。病原診断とは別に、ヘルペス性脳炎の検査所見として、まず髄液においては髄液圧は高く、髄液中の細胞数は軽度増加を認め、リンパ球・単球優位である。髄液タンパク量も発症1週目をピークに、100mg/dl 程度の増加を認める場合が多い。髄液糖は通常正常範囲内で、病初期には高値であることが少なからず存在する。
血液検査では、新生児ヘルペスの場合肝機能異常(肝炎)、LDH増加を高頻度に認め、herpes感染によるCRPなどの炎症反応は軽度~中等度陽性にとどまる。私はherpes性リウマチ性多発性筋炎でCRPが25の患者さんを完治させたことがあります。又新生児ヘルペスでは播種性血管内凝固症候群(DIC)を合併することも多く、呼吸管理や血漿交換などNICU 管理が必要となる。一方、成人ヘルペス脳炎では肝機能異常の頻度は低く、炎症所見を軽度認める程度で、中枢神経系の症状が主である。
画像検査では、発症の極早期においてはびまん性の脳浮腫が認められる。その後、側頭葉を中心としてCT上低吸収域あるいはmass effect を認め、出血巣が混在するようになる。予後不良の症例においては、その後低吸収域がさらに増加する。MRI はその進歩により、CTに比べて早期診断に有用であると言われている。CT に比して、側頭葉底部や海馬領域など大脳辺縁系の所見がとらえやすいことがその理由と考えられ、片側性の側頭葉下部、島、海馬などの異常所見は、強くヘル ペス脳炎を疑う所見です。脳波所見では、非ヘルペス脳炎に比してherpes脳炎は周 期 性 片 側 性 て ん か ん様 放 電(periodic lateralized epileptiform discharges:PLEDs )の頻度が高い。ヘルペスが癲癇の原因ですからヘルペス性脳炎の中に癲癇を入れるべきです。
病原診断には髄液中のHSV DNA をPCR 法で検出するのが最も迅速かつ有用である。ただし、抗ウイルス剤投与後はウイルス量が減少し、検出感度以下になるため、投与前あるいは投与初期の髄液で診断することが重要である。ウイルス分離は新生児ヘルペスの場合は陽性であることが多いが、年長児、成人のヘルペス脳炎でウイルスが分離されることはきわめて稀であり、PCR 法による迅速診断が必須である。髄液中のHSV 抗体価は森島らによると 、発症後10日から1カ月の間に1週間間隔で繰り返しELISA 法で実施するのが適当であるとのことである。発症後時間が経過した症例や、抗ウイルス剤投与後時間が経過した症例などにおいては、有用な検査方法である。 また、ペア血清で血清中のHSV IgG の有意な上昇、あるいは急性期のHSV IgM 陽性も診断の一助となるが、陰性例も少なからず存在するため、必ずその他の方法を同時に行っておく必要がある。
治療・予防についてはヘルペス脳炎を疑う場合、一刻も早く抗ウイルス剤の投与を開始すべきである。第1選択はアシクロビルで、10mg/kg を一日3回緩徐に点滴静注する。最近では、投与量を15mg/kg~20mg/kg/回に増量した方が治療成績が良いとの報告、投与期間も従来の14 日間より21日間の方が再燃の割合が少ないなどの報告もみられます。また、治療終了時には、必ずPCR 法によるHSV DNA の陰性化を確かめることが重要である。
アシクロビルの作用機序は、HSV の持つチミジンキナーゼによりリン酸化されたアシクロビルがウイルスのDNA 鎖に取り込まれ、DNA 鎖の伸長反応を止めることにより、ウイルス増殖を抑制することにある。ただし、腎機能が低下した患者においては血中濃度が高くなりすぎるため、クレアチニ ンクリアランスに応じて投与量の減量が必要である。発病初期に近い程効果が期待できるため、早期投与開始が望ましい。
第2選択剤はビダラビン (Ara-A)である。アシクロビルの効果が不十分な場合に投与を考慮する。その場合、アシクロビルとの併用が奏効する場合もある。作用機序は、(1)宿 主細胞のチミジンキナーゼにより3 リン酸となり、ウイルスDNA ポリメラーゼを阻害、(2)ウイルス特異的リボヌクレオチドリダクターゼを阻害、(3)非リン酸化体によるアデノシルホモシステイン水解酵素抑制、のいずれか、あるいはそれらの組み合わせによる。ヘルペス脳炎の場合の投与量として、基本的には 1日15mg/kg を2時間以上かけて緩徐に点滴静注する。投与期間は10日間を1クールとする。副作用として白血球、血小板減少、肝機能異常に注意を要する。ペントスタチ ン製剤との併用により、腎不全、肝不全、神経毒性が発現するとの報告があり、併用は禁忌である。
その他、γグロブリン製剤、抗痙攣剤、脳浮腫に対して副腎皮質ステロイド剤、浸透圧利尿剤、濃グリセリンなどが併用して用いられる。癲癇も統合失調症も脳の特定の神経核に免疫低下時にherpes感染がまず存在し免疫が回復した時に脳の免疫を司るミクログリア細胞と戦う際に炎症が起こりそれぞれの病気の症状がみられるのです。
ミクログリアの機能を復習しておきましょう。
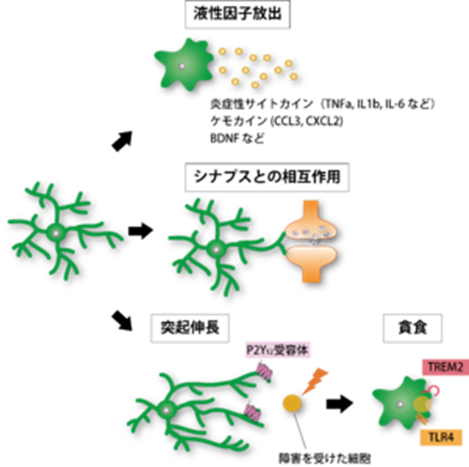
ミクログリアは脳のマクロファージと言われますので末梢でのマクロファージと同じ仕事をします。脳におけるミクログリアの機能は13種類あります。
1) 外傷性神経障害時やストレスやヘルペスウイルス感染などによって活性化したミクログリアからはヘルペスを殺すために炎症性サイトカインやケモカインが放出され、その結果、炎症応答や神経変性を引き起こします。
2) ミクログリアは突起をシナプス構造と接触させ、不必要なシナプスを取り除く機能を持っています。
3) herpesウイルス感染による炎症応答が起こした局所的な損傷時に、ミクログリアは異常部位へと突起を伸ばし、活性化を伴って異常部位へ遊走する. その後、異物や死細胞を貪食し、除去するのです。
4)液性因子産生放出をおこないます。ミクログリアは中枢神経系の機能に様々な影響を及ぼすが、この生理機能への調節機構の手段の一つとして液性因子の産生や放出があります。神経障害時やストレス、herpesウイルスによる細胞内感染などによって活性化したミクログリアからは腫瘍壊死因子(TNF-α)、IL-1β、IL-6などの炎症性サイトカインが放出され、神経変性や中枢神経系の炎症応答を引き起こす。それ故、ミクログリア由来の炎症性サイトカインにより中枢神経系の細胞に感染したherpesとの戦いにより神経細胞の機能に支障が生じることで、多発性硬化症やアルツハイマー病や癲癇や統合失調症やパーキンソン病や筋萎縮性側索硬化症や多発性硬化症などの中枢神経系疾患を起こすのです。
5)ミクログリアから放出されるケモカインもまた炎症応答や神経変性を引き起こすなど、生理学的および病的状態を起こします。培養ミクログリア細胞からはCCL3(MIP-1α)やCXCL2(MIP-2)などのケモカインがプリン受容体であるP2X7受容体の刺激を介して産生および放出される。そして神経が障害される状況においては脊髄ミクログリアでCCL3のケモカインの発現が増加し、持続した疼痛が起こるのはヘルペスが中枢神経に感染したからです。炎症性サイトカインやケモカイン以外にも、神経細胞内で増殖したりするヘルペスと戦うために一酸化窒素(NO)、活性酸素(ROS)、グルタミン酸、ATPなどがミクログリアから放出され、神経細胞死を誘導するのです。
6)一方、ミクログリアから産生放出される液性因子は、神経系の調節にも密接に関わる。例えば、神経系のherpes感染の異常時においてヘルペスを処理するために活性化したミクログリアから放出される脳由来神経栄養因子(Brain-derived neurotrophic factorの略称BDNF)は神経の興奮を引き起こす。一方、ミクログリア特異的に脳由来神経栄養因子(BDNF)を欠損させることで脳のシナプス可塑性に異常が認められるのは、ミクログリア由来のBDNFは正常時には記憶や学習に脳のシナプス可塑性が重要な役割を担っているからです。発達期や出生後早期においては、ミクログリアから分泌されるインスリン様成長因子1(IGF-1)がニューロンの生存維持に必要なことや、また神経障害作用を有する炎症性サイトカインIL-1βおよびIFN-γがニューロンの発生をむしろ促進してヘルペスを殺そうとするからです。他にも、中枢神経系ではミクログリアのみに発現するリソソーム性プロテアーゼのカテプシンSは、神経細胞に発現する膜結合型ケモカインのフラクタルカイン(CX3CL1)を切断し、カテプシンSがミクログリアのCX3CR1に作用することで様々な生理応答を示す。さらに、ミクログリアから放出されるカテプシンSは脳の大脳皮質体性感覚野において樹状突起スパイン(棘突起)の密度や活動の日内リズム形成に関与しています。樹状突起スパインとは何でしょうか?樹状突起スパインは神経細胞の樹状突起にあるトゲ(棘)状の構造であり、シナプス後部を形成する。樹状突起スパインはその表面にある受容体がシナプス前部から放出された神経伝達物質と結合し、シナプス後電位を発生させることにより神経細胞の活動電位の発生に寄与する。スパインが樹状突起本幹から突出した部分的に区画された構造であることは、記憶・学習などの機能を神経細胞が実行する時に、樹状突起スパインの密度などの変異が見られ、脳機能に重要な役割を担っているのです。Cathepsin S(カテプシンS)とは何でしょうか?加水分解酵素であるリソソーム性システインプロテアーゼで,MHC 分子のインバリアント鎖を切断することにより,抗原提示において重要な役割を果たしています。
7)正常時のミクログリアは細かく枝分かれした突起を脳実質内に張り巡らせて脳内環境の異常を待ち構えているのですが、その突起の動態は非常にダイナミックなもので常に一定の領域の中で突起の退縮を繰り返しており、この時の突起の動きは1 μm毎分で、数時間で脳全体の容積を検索できるような速度で非常にダイナミックに動いているのです。
8)さらに、脳内に傷害が起きた場合はP2Y12受容体を介して、さらに動的に突起を動かして障害部位に集積する。ミクログリアのシナプスへの接触はシナプス剪定(synaptic pruning)といった発達段階において不必要なシナプスを取り除く機能を持っています。また、障害を受けた神経細胞のシナプス間にミクログリアが入り込むことでシナプス接続を断つ働きもあります。
9)ミクログリアは貪食作用ももっています。従ってミクログリアはその挙動からマクロファージに類似した細胞と言えるのは、herpesに感染した神経細胞由来の崩壊物がミクログリアの細胞内に多数存在しているからです。ミクログリアは活性化型の形態の一つとして、通常は細く枝分かれした突起の退縮を引き起こし、アメボイド形態に変化する。正常時においては,ミクログリアは小さな細胞体をもち,四方に細かく枝分かれした突起を伸ばした形態をもつラミファイド型をしている。一方,傷害や病態時の活性化したミクログリアは,突起を退縮し,大きな細胞体をもつアメボイド型ミクログリアへと形態的に変化する。このようなミクログリアは強い貪食作用を示し、ヘルペスのために死んだ神経細胞やデブリ(障害を受けた細胞の破片など)を取り除く作用を持っている。ミクログリアが障害を受けた死細胞を取り除くことは、有害な細胞内因子の漏出を防いで脳内環境を保つためです。
10)現在では、神経細胞の自己死の一つの形態に、ミクログリアが生きたherpes感染神経細胞を貪食して組織中から取り除くファゴプトーシス phagoptosisも行っています。これらミクログリアの貪食活性は死細胞に対してだけではなく、病原体や細胞からの分泌物や老廃物の除去という役割も持っており、ミクログリアの最も重要な機能の一つです。
11)また、不要物の除去はその後の脳組織の回復にも寄与し、かつherpesによる障害によって変性した軸索の再生の促進にも関与しています。
12)ミクログリアの貪食に関わる受容体としてはToll様受容体(TLR)など外因性病原体であるherpesの断片を認識する受容体と、TREM2などのアポトーシスを認識する受容体が主なものであるが、Fc受容体や補体受容体、スカベンジャー受容体、MAC-2、マンノース受容体、LRP受容体、P2Y6受容体などもミクログリアの貪食機能を高めています。ミクログリアの受容体であるTREM2 (triggering receptor expressed on myeloid cells 2)とミクログリアのアダプター蛋白である DAP12 (DNAX-activating protein of 12 kDa) として知られるミクログリアの受容体-アダプター複合体の機能は、ヘルペスによって起こされるアルツハイマー病やパーキンソン病など複数の神経変性疾患において重要であるのはミクログリアがヘルペスを貪食してヘルペスを処理していることを示しているからです。受容体であるTREM2(triggering receptor expressed on myeloid cells 2)とアダプタータンパクであるDAP12(DNAX-activating protein of 12 kDa)の相互作用は、食作用と細胞片の除去、炎症性サイトカインの産生と放出の調節、ミクログリアの増殖と生存を促進する転写変化に関連するいくつかの神経炎症応答を仲介しています。TREM2/DAP12の機能の変化は、ミクログリアの活性化のタイミングと大きさに直接影響し、これは神経機能と神経細胞の生存にかかわっていることを示しています。
アダプタータンパクとは何でしょうか?アダプタータンパク質(Adaptor Protein)とはシグナル伝達に関与するタンパク質の一種で、アダプター分子(Adaptor Molecule)とも呼ばれる。アダプタータンパク質自体は基本的に酵素活性を有していないが、他のタンパク質との結合に関与するドメインを複数有しており、SH2ドメインやロイシンジッパー、Znフィンガーなどのドメイン構造がその例である。アダプタータンパク質はこれらのドメイン構造を介してシグナル伝達分子と結合し、そのシグナル伝達分子を寄せ集めて(リクルートして)、受容体とシグナル伝達分子の会合を仲介する役割を持ち、例えばチロシンキナーゼやほかの酵素などのシグナル伝達分子を受容体の近くに集めることでシグナル伝達分子の活性化を促進させているのです。アダプタータンパク質は細胞膜結合型と細胞質に存在する型に大きく分けられ、代表的なアダプタータンパク質としてLAT(=Linker for Activation of T cell、T細胞活性化に関連するリンカー)やSLP-76、Vav、Gab2、Shcなどの分子があります。
14)中枢神経疾患における役割は神経細胞に感染したherpesを殺すことです。 末梢神経の後根神経節に感染したherpesによる後根神経節の損傷がきっかけで中枢の脊髄に侵入したherpesを認識した中枢の脊髄ミクログリアが活性化するのです。それは後根神経節と中枢神経の脊髄とは真横に神経でつながっているからです。
神経系のダメージや機能不全により神経障害性疼痛と総称される慢性的な痛みが発症する。その発症と維持メカニズムはわかっていないが、実はherpesが痛覚神経に感染したからです。
近年脊髄におけるミクログリアの役割が注目されている。同疼痛のモデル動物である人為的な末梢神経損傷モデルや神経障害を伴う病態モデル(糖尿病、がん、脊髄損傷、帯状疱疹など)において、脊髄のミクログリアは肥大化し、突起の退縮が起こる。さらに、細胞マーカーCD11bやIba1の発現が増加し、損傷ニューロンで発現するCSF1によってミクログリアの細胞増殖が誘発され、細胞数が2~3倍に増加するのは損傷ニューロンをherpesもろとも貪食するためです。ミクログリアこそherpesが感染した中枢神経を様々な脳の疾患から守ってくれるのです。すべての脳の疾患はヘルペスによって起こるのです。従って抗ヘルペス剤が根本治療となるのですが現代の医薬業界はヘルペスがすべての病気の原因であることをおくびにも出さず免疫が責任が有るような自己免疫疾患というウソの病気を捏造した理論を作り出していますがすべて間違いです。完璧なヘルペスウイルスに不完全な人間が勝てるわけはないのに誰も気が付かないのです。ヘルペスこそ、この地上に最後に残った永遠に殺しきれない病原体なのです。免疫を抑える治療はヘルペスを増やすだけですから絶対に最悪の毒薬であるステロイドを使ってはなりません。免疫をいじめる薬は絶対にやめましょう。
最後に一言、免疫を抑えない心の在り方は他人の幸せを喜ぶことしかありません。できる限り欲望を捨てどうにもならないことは諦めるしかありません。欲をできるだけなくすことは諦めること同義語です。
