前回の「何故、どのようにして癲癇が起こるのでしょうか?①」の続きとなります!まだ前回の物を読まれていない方は読んできて下さい!!
シナプス結合の選択性は錐体細胞と非錐体細胞には違いがあります。錐体細胞からの興奮性結合の一部には層やターゲットの細胞タイプによる選択性がある一方、抑制性細胞は周辺の細胞にランダムに結合しています。この違いは、本来神経は末梢神経からの興奮を伝えるために生まれたので興奮の神経が抑制の神経よりはるかに多いうえに、むやみに興奮しすぎると過ぎたるは及ばざるが如しですから興奮をさせる神経を慎重に選択する進化で生まれたのが抑制性の神経なのです。一方では少ない抑制神経は多すぎる過剰な興奮の神経があるので抑制を働かすためには周辺の興奮性神経細胞にランダムに結合して初めて抑制の働きが発揮できるからです。
大脳新皮質2/3層内の錐体細胞のうち軸索側枝により直接結合している細胞同士は、直接結合していない細胞同士より、共通の4層の興奮性神経細胞からの興奮入力をより多く受ける傾向がある。一方、5層から2/3層内の錐体細胞への興奮性入力や4層から2/3層内の錐体細胞への抑制性入力に関しては、このような選択的な入力パターンは見られない。さらに、抑制性細胞サブタイプであるパルブアルブミン陽性のFS細胞やソマトスタチン陽性のマルチノッチ細胞では、周囲にある錐体細胞を選択性なく抑制的に神経支配しています。パルブアルブミン(Parvalbumin)は、カルシウム結合性の低分子量のアルブミンである。パルブアルブミンは、抑制性の神経系のGABA駆動性介在ニューロンに存在し、大脳皮質のシャンデリア細胞や籠細胞(かご細胞)では独占的に発現する。小脳ではプルキンエ細胞や分子層介在ニューロンで発現する。
介在ニューロンとは、所属する部位に軸索が限局し、近傍の神経細胞にのみ情報を伝達するニューロンのことを指す。介在ニューロンは形態学的、電気生理学的、神経化学的に多種多様であることが知られており、なかでも神経化学マーカーによる分類が広く用いられている。例えば大脳新皮質では、パルブアルブミン発現細胞、ソマトスタチン発現細胞、その他の抑制性神経細胞の三群に大別することが一般的である。脳と脊髄から構成される中枢神経系には千数百億個ものニューロンが存在すると言われている。膨大な数のニューロンは、その機能や形態に応じて分類がなされてきた。
介在ニューロンとは何でしょうか?比較的短い軸索を持ち、軸索の分布範囲が所属する狭い部位に限局し、近傍の神経細胞のみと情報交換を行うニューロンのことを一般的に指す。因みに、投射ニューロンは長い軸索を持ち、他の脳部位へと情報を伝達する。また、介在ニューロンの定義は、そのニューロンが属する領域の境界線の引き方によって変わるもので研究者によってそのニューロンが属する領域の分け方が異なることがあるので、介在ニューロンと投射ニューロンの意味が少し異なりますがいずれにしろあるニューロンの電気的情報を別のニューロンに伝えることには違いはありません。それでは、大脳新皮質には介在ニューロンが多いので大脳新皮質における介在ニューロンについてもう一度詳しく説明しましょう。大脳皮質と大脳新皮質は同じことです。
大脳新皮質には大別して二種の神経細胞が存在するのはすでにご存じでしょう。グルタミン酸を神経伝達物質として放出する興奮性の錐体細胞/顆粒細胞と、GABAを放出する抑制性神経細胞です。抑制性神経細胞のほとんどは軸索を局所にのみ展開することから、大脳新皮質介在ニューロン(neocortical interneuron)と呼ばれます。大脳新皮質介在ニューロンは、形態学的、電気生理学的、神経化学的に多種多様であり、多くの分類法がありますが、なかでも神経化学マーカーによる分類は、その有用性から広く用いられており、現在では以下の三群に大別されます。① パルブアルブミン(PV)発現細胞、②ソマトスタチン(SOM)発現細胞、③ その他の抑制性神経細胞の三つの代表が血管作動性腸管ペプチド(vasoactive intestinal peptide略して VIP)です。このグループには多くの神経化学マーカーが存在し、実際には様々なサブグループから構成される、複雑な細胞群である。カルレチニン(CR)が主要なマーカーとして長年用いられてきたが最近では血管作動性腸管ペプチド(vasoactive intestinal peptide 略してVIP)が用いられることが多い。
抑制性神経細胞は多様な抑制機能様式が生まれたので、そのために多くの神経化学物質のマーカーが存在し、実際には様々なサブグループから構成される複雑な細胞群です。何故、抑制神経細胞だけが多くの種類の神経化学物質を作り出したのでしょうか?それは本来、大脳のすべての神経細胞は人体の活動を維持するために必要な興奮を伝えるためだけに一貫した統一的な神経として進化したのですが、残念ながら脳の進化の過程の中で興奮性の神経細胞にherpesウイルスというとんでもないウイルスが感染するようになり、それを排除するために脳の唯一の免疫細胞であるミクログリアとの戦いが始まり、興奮細胞を異常に興奮させすぎてしまうようになったので遅まきながらその興奮を抑制せざるを得なくなり、徐々に徐々に興奮神経を抑制する神経を長い年月をかけてその場しのぎの抑制性の神経化学物質の蓄積の結果、複雑で統一性のないまとまりのない多種多様な抑制性神経細胞群が生まれたからです。従ってこうした抑制性神経の化学的分類は、ヘルペスとの戦いのために生まれたその目的に沿うような形態学的分類および電気生理学的分類とよく対応するのは当然なのです。
①PV発現細胞はその軸索の形態学的特徴から、そのほとんどがバスケット細胞(basket cell、籠細胞)であり、一部がシャンデリア細胞(chandelier cell)に対応する。また、電気生理学的には非常に早い発火特性(fast-spiking, FS)を示すことが特徴的である。
②SOM発現細胞はその軸索は第一層まで展開し、マルチノッチ細胞(Martinotti細胞)であり、この大脳新皮質介在ニューロンであるマルチノッチ細胞は比較的高い密度で樹状突起上に棘突起(spine)を持つ。電気生理学的には、non-FS細胞に分類される。一部のマルチノッチ細胞は、カルシウム電流を低閾値で生じ、バースト状に発火するLTS細胞(low-threshold spiking cell)に対応する。抑制性のマルチノッチ細胞(Martinotti細胞)も癲癇発作を止めようとするためにカルシウム電流を低閾値で生じさせるLTS細胞(low-threshold spiking cell)として頑張り、抑制性のバースト状に発火してしまうのですが、この発火は興奮を止めるどころか癲癇発火を強めてしまうのです。知らずして火に油を注ぐという逆効果を招いてしまうのです。
③VIP (vasoactive intestinal peptide略してVIP )発現細胞の多くは、軸索を表層から深層まで縦方向に展開しているダブルブーケ細胞(double bouquet細胞)である。しかし一部のVIP発現細胞は、コレシストキニン(cholecystokinin)を共発現し、大型バスケット細胞に分類される。電気生理学的には、non-FS細胞に属している。
上で説明した①PV発現細胞②SOM発現細胞③VIP発現細胞の三つ以外のその他の大脳新皮質介在ニューロンが存在しますが未だに有用な神経化学物質のマーカーは発見されていないのですがその一つにはlate spiking発火特性を示すニューログリアフォーム細胞(neurogliaform cell)があります。すでに説明したように、ニューログリアフォーム細胞は軸索を細胞体の近傍に蜘蛛の巣状に張り巡らします。また、もう一つ神経化学物質のマーカーが発見されていない第一層に存在する介在ニューロン(layer I interneuron)があります。
大脳新皮質介在ニューロンの役割はなんでしょうか?大脳新皮質介在ニューロン同士のシナプス結合は、密接なネットワークを形成し大脳新皮質介在ニューロンは高次機能を担っています。ヘルペスが感染した大脳新皮質介在ニューロンがグリア細胞の一つであるミクログリアに攻撃されて高次機能が侵されて癲癇やアルツハイマーやパーキンソンや統合失調症や自症等などのすべての各種精神疾患や神経変性疾患が生ずるのです。必ずすべての精神神経疾患が大脳新皮質介在ニューロンや他の大脳基底核や大脳辺縁系の神経細胞や脳幹にヘルペスが感染して生ずることを近い内に発表します。
錐体細胞からの興奮性結合の一部には層のタイプやターゲットの細胞タイプによる選択性がある一方、抑制性細胞は大の皮質介在ニューロンとして周辺の細胞にランダムに結合しているのです。それは抑制性の細胞は興奮性の細胞に比べて圧倒的に少ないからです。大脳皮質に抑制性の細胞が非常に少ない理由は元来、大脳皮質の神経細胞は人体の活動を支える正常な興奮に反応するために存在するのであってその活動を抑制するためではないから抑制神経は少ないのです。ところが病原体のherpesなどが神経細胞に感染した時に免疫細胞であるミクログリアとの戦いで生じた異常な電気信号を抑制するために進化して生まれたのですが殺しきれないヘルペスの感染が多すぎると興奮の信号を抑制遮断できなくて癲癇発作が起きてしまうのです。すでに述べたことがあるのですが、脳の正常な機能は興奮の電気的な神経ニューロンの活動により行われておりますが電気的な活動を担うニューロンは脳のやく20%を占めているにすぎず、残りの80%はグリア細胞により占められています。グリア細胞の中で唯一の免疫細胞はミクログリアだけであり脳内の唯一の万能の免疫細胞です。末梢の好中球やマクロファージや樹状細胞やNK細胞やヘルパーT細胞やキラーT細胞の機能を全て兼ね備えている万能の免疫細胞が脳のミクログリアなのです。
何故ヘルペスは大脳皮質の神経細胞に感染しにくいのでしょうか?また大脳皮質の神経細胞体に隠れ住むことをしないのでしょうか?
Herpesが大脳の神経細胞に感染して隠れ住みたい所は神経細胞が群れを成して集合している場所であり、かつ神経細胞体もぎゅうぎゅうに詰め込まれて寄せ集められている核(神経核)なのです。神経解剖学において核または神経核は大脳や脊髄の中枢神経内で主に灰白質からなり、何らかの神経系の分岐点や中継点となっているので神経細胞が群れを成して集合せざるを得ない東京駅のような人の群れ(神経細胞群)が集合した信号を伝える神経と信号を伝えられる神経の二種類の神経の中継点が神経核なのです。つまり単独ではない群れとなった二種類の神経細胞群のことであり神経細胞体群とも言えるのです。
イメージとしては大脳皮質の灰白質には一本の神経細胞が個々に集まっているのですが神経核の灰白質には何十本のいや何百本の神経細胞が束になって集まっているのです。この神経核の灰白質の神経の集まりと大脳皮質の灰白質の単独の神経とはさらに大きく異なる点があります。例えば大脳基底核は神経細胞体が集まった核が更に集合し核の集合体を成している点です。脳の灰白質は決して群れを成しているのではなく大脳皮質という領域に六層になって神経細胞体が散在しながら集まりを形成しているだけなのです。もちろん言うまでもなく最初に図1の「Minicolumn構造の概略」で示したように大脳皮質の一層から六層にある興奮性の錐体細胞や抑制性の他の非錐体細胞は軸索と樹状突起を出してシナプスするための神経突起を出してつながっています。この層全体を大脳皮質の灰白質になるのですがその下は神経線維だけとなりこの領域を白質というのです。
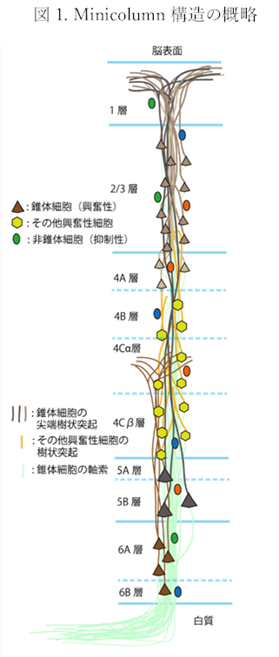
神経線維とは神経細胞(ニューロン)の構成要素で、細胞体から出ている突起のうち、最も長い突起を言います。末端は次の神経細胞の樹状突起とシナプスを介して結合する。末梢神経で軸索が髄鞘 によって包まれているものを有髄神経と言い、髄鞘のないものを無髄神経と言います。軸索が髄鞘 によって包まれているものを有髄神経と言いますが有髄神経は正しくは、有鞘神経というべきで髄鞘のないものを無髄神経と言いますがこれも正しくは無鞘神経というべきです。
神経繊維(しんけいせんい)は医学用語としては神経線維と表記し、英語で nerve fiberとか, axonであり、神経細胞の細胞体から延びる細長い突起で、神経線維は神経細胞の軸索と神経鞘を総称したものである。従って神経鞘を持たない場合は、軸索のみを指す。神経鞘とは神経を包んでいる膜(鞘、さや)のことです。神経鞘 は末梢神経の神経線維(軸索)の最外層にある膜(鞘)で、末梢神経では神経線維である軸索 を包む透明な弾性薄膜で,シュワン細胞というきわめて薄い細胞から成る。従ってシュワン細胞が神経鞘を構成しているのでシュワン鞘ともいう。軸索や神経の栄養補給を担っています。中枢神経組織にはシュワン細胞が存在しないので中枢神経の神経鞘(髄鞘)、つまり髄鞘(神経鞘)を形成するのはオリゴデンドロサイトです。ややこしのでまとめると末梢神経も中枢神経も細胞によって軸索の鞘つまり髄鞘は細胞からなり A) 中枢神経系ではオリゴデンドロサイト、B) 末梢神経系ではシュワン細胞により形成されているのです。更にややこしいのは軸索の鞘(さや)が髄鞘ですが軸索の鞘ですからから軸鞘と言えばいいのにね。しかも髄鞘を神経鞘ともいうのでますます混乱しますね。混乱の追い打ちは更に髄鞘をミエリン(髄鞘)ともいうのでますます混乱しますね。
ミエリン(髄鞘)の役割は何でしょうか?ミエリン(髄鞘)の役割は神経細胞の軸索を取り囲んでいる物質であるので、絶縁体の役割(電気線の絶縁体、ビニールテープのようなもの)を果たしています。さらに ミエリンは神経の電気信号が身体の他の部分へ伝わる速度を速めます。
ついでに神経鞘腫について述べておきましょう。神経鞘腫は末梢神経の神経鞘(髄鞘)の構成細胞であるシュワン細胞由来である良性腫瘍で、良性腫瘍であるので増殖は緩徐です。成人にみられます。多くは皮下組織や筋肉などの軟部組織の末梢神経の髄鞘に発生しますが、脳神経、脊髄神経、稀には消化管など、いろいろな部位に生じます。軟部組織の定義は、骨組織を除く結合組織すなわち線維組織や脂肪組織と、血管、横紋筋、平滑筋、末梢神経組織(神経節と神経線維)を総称する。 軟部組織に対して硬組織という術語があるが、これはほぼ骨組織に対応している。ということは軟部組織とは骨以外の組織のことですね。 また、神経鞘腫に類似した末梢神経から発生する良性腫瘍に神経線維腫があります。神経線維腫は軸索腫瘍のことですね。
大脳の白質はなぜ白いのでしょうか?白質が白いのは、神経線維(軸索)を取り囲むミエリン鞘を形成するオリゴデンドログリアが白色に光る脂肪質が多いからです。顕微鏡で白質の部分の軸索部分が白く見えるので繊維の白さに似ているので白質の部分を「神経繊維」と呼んだのは、神経を顕微鏡で拡大してマクロ的にとらえた表現であり、神経細胞の部位を指す語句としては神経線維という言葉はほとんど用いない。神経繊維は活動電位の伝導に加え、神経終末と細胞体との間の物質交換にも役立っている。肉眼で確認できる「神経」は、一本一本の神経繊維が多く集まった神経繊維の束とその周囲の結合組織から成り立っているのです。因みに中枢神経のシナプスには三種類あります。一つ目は軸索と樹状突起間のシナプス、二つ目は軸索と細胞体間のシナプス、三つめは軸索と軸索間のシナプスの三つです。しかし三つ目の軸索と軸索間のシナプスはまれです。
興奮はシナプス間をどのように伝わるのでしょうか?シナプス前細胞で発生した活動電位は軸索を伝搬しシナプス前終末に到達する。シナプス前終末では活動電位による脱分極で電位依存性カルシウムチャンネルが開きが細胞内に流入シナプス小胞する。カルシウムイオンが引き金となってアクティブゾーンにため込まれていたシナプス小胞がシナプス前膜の細胞膜と融合してシナプス小胞の内容物である神経伝達物質をシナプス間隙に開口放出される。アクティブゾーンまたはシナプスアクティブゾーンとは何でしょうか?
シナプス前終末の中には数百のシナプス小胞(50 nm)が存在する。シナプス小胞がシナプス前終末の細胞膜と融合し、その中の神経伝達物質をシナプス間隙に開口放出する領域がアクティブゾーンです。シナプス間隙に放出された神経伝達物質はシナプス後ニューロンに移動し、シナプス後膜の受容体結びつき受容体を活性化します。神経伝達物質の種類は100種類以上に及ぶが人間の中枢神経ではグルタミン酸が、末梢神経系ではアセチルコリンとノルアドレナリンが主な興奮性神経伝達物質として用いられる。シナプス後膜の受容体であるレセプターがこの神経伝達物質を受容するとシナプス後膜に脱分極が起こり活動電位が生ずる仕方は二通りある。
一つ目はシナプス後膜の受容体がイオンチャンネル共役型受容体の場合は神経伝達物質の結合によって即座にイオンチャンネルが開きナトリウムやカルシウムなどの陽イオンがシナプス後細胞内に流入することによってシナプス後細胞が脱分極する。
二つ目の代謝活性型受容体の場合は受容体への神経伝達物質結合によってG蛋白を介した細胞内シグナルが働く場合は受容体とは別に存在するカリウムチャンネルなどの開口状態が変化することで遅れて脱分極が起こる。シナプス小胞とシナプス前膜との融合により広くなったシナプス前膜は被覆小胞により再び内部に取り込まれ次の興奮で利用するためにリサイクルされます。
それでは抑制神経細胞はどのように興奮を抑制できるのでしょうか?
神経細胞のうち、伝達物質としてGABAあるいはグリシンをもち、シナプス後膜においてClイオン透過性を上昇させ細胞膜を過分極させるか、シャント効果により膜電位の伝播を抑制するものを抑制性神経細胞という。シャント効果とはなんでしょう?短絡効果と訳されるシャント効果はシナプス後細胞の興奮性を抑えるメカニズムの一つであり、抑制性入力によってGABA受容体やグリシン受容体が活性化すると、それらのチャネルのコンダクタンスが大きくなり、膜抵抗が局所的に減少する。コンダクタンス とは、回路における電流の流れやすさのことで、直流回路では電気抵抗の逆数であり、オームの法則に従って電流の変化量に対する電位の変化量が低下する。その結果、仮に塩化物イオンの平衡電位が静止膜電位付近のため、抑制性シナプス入力が過分極をもたらさない場合であっても、近傍の興奮性シナプスでは興奮性シナプス後電位(EPSP)の振幅が減少し、結果としてシナプス後細胞の興奮性が抑えられるのです。
大脳皮質では約20%の神経細胞がGABAを伝達物質としてもつGABA作動性抑制性神経細胞である。すでに述べたように局所回路において作用することから介在神経細胞とも呼ばれ、興奮性神経細胞からの出力を調整し、同期性を制御したり、過剰興奮を防ぐなど重要な機能をもつ神経が介在神経細胞です。しかし大脳基底核の膨大な数の神経細胞体にherpesが感染するとこの抑制の介在神経細胞は上記の抑制の機構などが全く役立たず癲癇発作が起こってしまうのです。
形態・機能・化学的マーカータンパク質の発現などの点から介在神経細胞は多様であることもすでに説明しました。大脳皮質に見られる介在抑制細胞には形態的には大型バスケット細胞、小型バスケット細胞、ネストバスケット細胞、シャンデリア細胞、紡錘細胞、ダブルブーケ細胞、マルチノッチ細胞などが存在する。①大型バスケット細胞の細胞体は、直径20-30 μm程度の大きさがあり、棘突起(spine)があまり見られない樹状突起が多極(樹状突起の周りに)に広がっている。軸索は、水平・垂直方向に~1000μm程度まで広がっている。②小型バスケット細胞は、直径が最大20 μm程度の小さな細胞体を持ち、棘突起があまり見られない樹状突起が多極に広がっている。軸索の走行は局所的に密度が高く、大脳皮質では一つの層に限局される。大型バスケット細胞とは異なり、軸索の走行は水平方向には300 μm程度に留まる。③ネストバスケット細胞は小型バスケット細胞のように局所的に密度が高い軸索走行と長距離を走行する軸索の両方を持つバスケット細胞です。従ってバスケット細胞は三種類に分けられています。
介在抑制性神経細胞は興奮性神経細胞とシナプスを形成する部位は、興奮性神経細胞上の樹状突起か、細胞体か、軸索部分の三つがあるかによってそれぞれの部位にシナプスしやすいように特化した抑制性神経細胞が存在し、その抑制の機能と密接に関連しているのですがヘルペスとミクログリアの戦いによって生じた炎症性の興奮の電気信号が強すぎるので抑制の機能が弱すぎて癲癇発作となるのです。これらの介在性抑制性神経細胞は発生期には終脳腹側の基底核原基で産生され、大脳皮質に移動し興奮を抑制できるように大脳皮質の回路に組み込まれるのです。大脳基底核原基は、胎生期に観察され、構造的に脳室内に隆起しているため基底核隆起とも言われる。終脳(telencephalon)のうち外套 (pallium, 広義の大脳皮質に相当)の腹側に位置する。多くの大脳基底核神経細胞、及び大脳皮質のGABA作動性抑制性神経細胞、希突起膠細胞(オリゴデンドロサイト)を産生する領域である。誕生した介在性抑制性神経細胞は大脳皮質、線条体、淡蒼球、扁桃体、嗅球などの様々な領域に移動するのです。このように介在性抑制性神経細胞は大脳皮質のみならず大脳基底核や大脳辺縁系にも存在しているにもかかわらずherpesが大脳基底核や大脳辺縁系に感染して免疫が落ちてしまうとヘルペスが増殖してしまい免疫が取り戻されたときに脳の免疫細胞であるミクログリアに発見されて炎症が始まり異常な興奮の電気信号が大脳内を駆け巡り癲癇発作になるのです。従って癲癇の根本治療は抗ヘルペス剤投与なのです。
因みに大脳辺縁系に主にherpesが感染すると統合失調症,不安障害,パニック障害,強迫神経症,認知症,アルツハイマー、パーキンソン病,てんかんなど,さまざまな精神疾患や神経疾患の症状がでます。それぞれの病気については詳しく後で述べます。
すでに述べたように中枢神経系には80%を占める興奮性神経細胞の他に20%を占める介在性抑制性神経細胞が大脳皮質、線条体、淡蒼球、扁桃体、嗅球などの様々な脳のすべての領域に存在しているのです。大脳皮質では約20%の神経細胞が抑制性神経細胞であり残りの80%は興奮性の神経細胞ですから興奮の電気信号が強くなりすぎるとそもそも抑制性神経細胞は興奮性の神経細胞には太刀打ちできないのです。だから癲癇発作のような病気が発生するのです。しかも大脳皮質の抑制性神経細胞の大多数は、局所回路において作用することから介在抑制性神経細胞(interneuron)とも呼ばれ、興奮性神経細胞からの出力を調整し、出力の同期性を制御したり、過剰興奮を防ぐなど脳の恒常性(ホメオスターシス)を維持するために極めて重要な機能を持っているのですがヘルペスが感染した大脳基底核や大脳辺縁系の興奮性の神経細胞の過剰な興奮の電気信号を直接抑制はできないのです。というのも抑制性神経細胞は大脳全体の回路ではなく局所回路において作用する介在抑制神経細胞(interneuron)にすぎないからです。癲癇発作は脳に感染したherpes性感染症と言ってもいいのです。脳神経変性疾患はすべてヘルペス性脳感染症なのです。人類は消滅するまでこのherpes感染症に悩まされるでしょう。アッハッハ!!!
抑制性神経伝達物質には中枢神経のGABA及び脳幹や脊髄のグリシンが有るが、中枢神経系においてはGABA作動性神経細胞が広範囲に存在しており、グリシン作動性神経細胞は主に脳幹部及び脊髄に存在しているだけです。またGABA及びグリシンの両者を共放出する抑制性神経細胞も存在しています。また、聴覚中継路核の外側上オリーブ核(lateral superior olivary nucleus, LSO)における内側台形体核(medial nucleus of the trapezoid body, MNTB)からの抑制性入力において、単一神経終末部から放出される伝達物質が未熟期にはGABA優位であったものが、GABA及びグリシン同時放出の時期を経て、成熟期のグリシン優位の状態へと三段階の発達変化を遂げる抑制性神経細胞もあるのです。このように介在性抑制性神経が産生する神経伝達物質内容が徐々に発達変化していく例もあるのですが何故でしょうか?答えはどこを探してもありませんでした。
それでは抑制性神経の作用機序はどのように興奮を抑制しているのでしょうか?
介在性抑制性神経細胞から放出されたGABAやグリシンは、シナプス後膜においてGABAA受容体及び/もしくはグリシン受容体の活性化を介してClイオン透過性を上昇させる。Cl平衡電位が静止膜電位より深い場合には過分極応答を引き起こす。Cl平衡電位が静止膜電位より浅い場合や、あるいは静止膜電位に近い場合においても、Clイオン透過性の亢進によって膜抵抗が小さくなることによるシャント効果(短絡効果)によって、膜電位の伝播を抑制する。GABAA受容体 (GABAAR;ギャバ・エーレセプター或いはギャバ・エーじゅようたい) は、イオンチャネル型受容体およびイオンチャネル内蔵型受容体の一つである。 リガンドは主要な中枢神経系の抑制性神経伝達物質であるγ-アミノ酪酸(GABA)である。
幼若期、あるいは成熟後においてもherpesによって神経が損傷されたときの病態時には、細胞内Clイオン濃度が比較的高いのです。このため、Clイオンの平衡電位は静止膜電位よりも浅い状態にある。このような状態ではGABAA受容体の活性化により、Clイオンは細胞内から外へ流出する形となり、過分極応答ではなく、脱分極応答を示す事があり抑制どころか興奮を促進したりするのはherpesによる炎症のためなのです。だからこそ癲癇発作が起こりやすくなるのです。
抑制の機序のパターン分類については大脳皮質における介在性抑制性神経細胞は樹状突起上に棘突起が乏しい(aspiny)といった共通の特徴を有するものの、形態・機能・マーカータンパク質の発現などの点からは非常な多様性をもつ。例えばすでに述べたように大脳皮質には、形態的には大型バスケット細胞、小型バスケット細胞、ネストバスケット細胞、シャンデリア細胞、紡錘細胞、ダブルブーケ細胞、マルチノッチ細胞などが存在するのはこれらの抑制神経細胞の興奮の抑制の機序にそれぞれ特徴がありその様式や機序に違いがあるからです。
シナプスを形成する部位からは、シナプスを行う興奮性神経細胞上の樹状突起、細胞体、軸索部分の三つにそれぞれ特化した抑制性神経細胞が存在し、その機能とシナプス構造が異なっているのです。実際、興奮性神経細胞の軸索に形成された抑制性シナプスは、興奮性神経細胞からの出力を強力に抑制し、シナプス前抑制と呼ばれる。遠位樹状突起に形成された抑制性シナプスは、近傍の樹状突起への興奮性入力を局所的に微調節するだけです。
抑制性神経細胞が発現するマーカータンパク質からはパルブアルブミン、ソマトスタチン、カルレチキュリン、さらにカルレチニン陽性細胞(calretinin陽性細胞)の中にはニューロペプチドYや血管作動性消化管ペプチド (vasoactive intestinal polypeptide, VIP)などを発現する抑制性神経細胞に分類されるが、抑制性神経細胞が発現するマーカータンパク質の違いが抑制の強さに影響を与えるのかなどやマーカー蛋白が抑制の機能にどのようにかかわっているかはまだ解明されてはいません。神経ペプチドY(neuropeputide Y, NPY)とは何でしょうか?脳と自律神経系で見つかった36のアミノ酸から成るペプチド神経伝達物質で、ノルアドレナリン作動性ニューロンの血管収縮効果を増大させる。脳中のニューロンと体の他の分泌細胞により作られた神経ペプチドYは、エネルギー収支の調整、記憶と学習、そして、てんかんなどの脳の多くの生理学的な過程に関連しています。長時間コルチゾールホルモンが放出された時の作用(苦しみからくるストレスに耐えるために緊張状態にする)を抑制する効果があり、副腎皮質から放出されるデヒドロエピアンドロステロン(DHEA)と共に苦しみの感覚を低下させる効果をもっている。つまり、コルチゾールによって体内の緊張状態が続くと、NPYなどが放出され、苦しみを忘れさせる瞬間が増えてくる。
大脳皮質の介在性抑制性神経細胞の産生および移動メカニズムを見てみましょう。
ヒトを含めた霊長類では大脳皮質の介在性抑制性神経細胞のうち胎生期に基底核原基で産生される割合は35%程度であり、残りの65%は終脳背側の脳室帯と脳室下帯で産生されます。さらに基底核原基で産生される抑制性神経細胞は胎生初期に産生され一酸化窒素合成酵素(nitric oxide synthase, NOS)陽性、ニューロペプチドY(neuropeptide Y, NPY)陽性、SOM陽性細胞へ分化するのに対し、終脳背側の脳室帯と脳室下帯で産生される抑制性神経細胞は胎生後期に産生されCR陽性細胞(calretinin陽性細胞)へ分化します。また、後に大脳基底核になる基底核原基で産生された細胞は脳表面に対して接線方向に移動し大脳皮質に進入するのに対し、脳室帯と脳室下帯で産生された細胞は脳表に向かって放射状に移動します。
免疫が低下している間にherpesが大脳基底核の脳神経細胞の細胞体や軸索や樹枝状突起に感染したり、さらに脳神経細胞膜を被覆している髄鞘や髄鞘を作る希突起膠細胞にherpesが感染すると脳の免疫細胞のミクログリアに発見されて炎症が生じて1)線条体2)淡蒼球3)視床下核4)黒質の四つの大脳基底核の神経細胞が刺激され興奮しすぎて大脳基底核にある抑制性神経細胞の興奮を抑制する働きも発揮できないので癲癇発作が生じることを、もっと具体的に証明していきます。
何故、黒質にherpesは感染しやすいのか?何故、黒質という名がつけられたのか?
中脳の大脳基底核に存在する黒質はメラニン色素を多く含有する緻密部とその外部の網様部から成り立っているので緻密部のメラニン色素のために黒く見えるので黒質と名付けられました。黒質緻密部にメラニン色素があるのは緻密部にメラニン細胞が存在しているからです。ストレスがかかると黒質のメラニンが多く産生されると同時に免疫が下がるので黒質緻密部にherpesは感染しやすくなり、更に感染しているherpesも増えていきます。
癲癇を起こしやすい人はまず大脳基底核にとりわけ黒質にherpes感染があり、次に免疫を落としてそのherpesを増やす必要があり最後は免疫が上がった時にherpesと戦って炎症を起こして癲癇となるのです。パーキンソンは後で詳しく書きますがドパミンが少なくて起こるパーキンソン病は黒質緻密部にいるメラニン色素細胞に感染しやすいherpesが黒質を変性させてドパミンの産生を減らしてしまったからです。治せない病気の原因はすべてherpesなのです。だからこそ抗ヘルペス剤を保険で使わせないのです。医者の責務は病気を治すことですが責任を果たしすぎると医薬業界は必要がなくなります。初めから医者という職業は絶対的矛盾を孕んでいるのです。病気をすべて治してしまえば失業してしまうのです。
私は抗ヘルペス投与による原因治療によって癲癇を治した臨床経験を持っている上に理論的にも癲癇の原因はherpesであることはすべて解明しているので癲癇を起こさせない治療は極めて簡単です。実際的には抗ヘルペス剤でヘルペスを増やさないようにするのと漢方煎じ薬で免疫を上げて神経細胞外に出たヘルペスを脳の大食細胞であるミクログリアに食い殺してもらえばいいだけの話です。もちろんストレスでステロイドホルモンを自分で出しすぎないように心がけるのは言うまでもないことです。それではどのようにしてヘルペスは癲癇発作を起こすのか一つ一つゆっくり説明していきましょう。
先ず癲癇とはどのような病気であるかもう一度原点に戻って復習しましょう。癲癇(Epilepsy)の専門的な定義は『慢性の脳の病気で、大脳の神経細胞が過剰に興奮するために、脳の症状の発作が2回以上反復して起こるものである。発作は突然起こり、普通とは異なる身体症状や意識、運動および感覚の変化が生じる。痙攣があれば癲癇である。』と定義されていますがなぜ癲癇が起こるのかの原因を何も示唆していないので本質的な定義ではありません。しかし神経の病気であることは分かります。何故ならば癲癇では感覚神経、運動神経、自律神経の三つのすべての神経に異常な症状がみられるからです。
正しい癲癇の定義は『脳の大脳基底核の神経細胞に感染したherpesのために大脳皮質の80%を占める興奮の電気信号は圧倒的に強く、それに比べて20%しかない抑制の電気信号の抑制力は弱過ぎるので興奮と抑制のバランスが崩れて癲癇が起こるのではないのです。何故ならばそもそも初めからバランスは崩れているからです。かつ万能の病原体であるherpesが大脳皮質の興奮性の神経細胞が充満している大脳基底核に感染すると万能の免疫細胞のミクログリアとの戦いが始まりだし神経細胞内のみならず細胞外でも炎症が生じ、更に細胞内でのherpesの増殖による神経細胞の細胞小器官を作る働きも落ち、更に異常な刺激やオリゴデンドログリアが作る神経の髄鞘に感染したherpesによっても異常な興奮の電気信号が多くなりすぎてこの異常な電気信号が大脳に伝わって生ずる異常な身体症状や意識、自律神経、運動神経、および感覚神経の変化に痙攣発作が伴う病気が癲癇です』といえます。
抑制の電気信号と興奮の電気信号のバランスが崩れるとは何でしょうか?通常、脳の神経はherpesの感染がない限り興奮と抑制がバランスよく働くことで正常な状態を保っていると言われてきましたがこれは嘘です。初めからバランスは崩れているのでバランスは崩れるかどうかはどうでもよいのです。大脳基底核の神経細胞はすべて興奮の神経細胞なので細胞にherpesが感染してあらゆる炎症反応が出現すると異常な興奮の電気信号があらゆる大脳全体の大脳皮質の神経細胞にまで伝わって癲癇が起こるのです。大脳に20%しかない局所的な抑制性の介在神経の過剰な興奮を止めることは絶対に無理なのです。
次々と神経軸索と脳のシナプスによって過剰興奮の電気信号が直接に或いは間接に伝わると神経細胞の巨大なネットワークである脳は適切に情報を受け取ることや、命令ができなくなり、体の動きをコントロールできなってしまうどころか意識さえ失ってしまうのです。
脳の興奮系と抑制系の神経の種類は興奮系神経はグルタミン神経であり抑制系神経はGABA(γ-アミノ酪酸)神経です。興奮系の神経であるグルタミン神経から分泌されるグルタミン酸が1)NMDA受容体(N-メチル-D-アスパラギン酸受容体、頭文字をとって略してNMDA)や2)AMPA受容体(α-アミノ-3-ヒドロキシ-5-メソオキサゾール-4-プロピオン酸受容体、略してAMPA) や3)カイニン酸型受容体の三つの受容体のどれかに結合することで脳が興奮します。もっと詳しく説明するとシナプス後膜に局在する陽イオンチャネル型グルタミン酸受容体(glutamate receptor略してGluR)には、三種類ありそれぞれにサブタイプがいくつかあります。1)のNMDA型グルタミン酸受容体には3種類のイオンチャネル型グルタミン酸受容体のサブタイプがあり2)のAMPA受容体には4種類のイオンチャネル型グルタミン酸受容体のサブタイプがあり,3)のカイニン酸型グルタミン酸受容体には5種類のイオンチャネル型グルタミン酸受容体のサブタイプがあります。この三つのNMDA型受容体とAMPA型受容体とカイニン酸型受容体のいずれも陽イオン透過性チャネルであるが、機能的に異なり、カイニン酸受容体を介するシナプス応答はAMPA受容体を介するシナプス応答に比べてゆっくりとしており、持続時間が長い。AMPA受容体はリガンド結合に対してミリ秒相当の速い応答を示し、速い神経伝達を担う。NMDA受容体は、静止膜電位状態においてはチャネルポア(穴)近傍にマグネシウムが結合し、その活性化を阻害している。このマグネシウムは膜の脱分極に伴い受容体より解離し、NMDA受容体はイオンチャネル活性を示す。さらに、NMDA受容体はAMPA受容体と異なりカルシウム透過性も示し、シナプス修飾のスイッチの役割を担っています。
カイニン酸型グルタミン酸受容体(カイニン酸受容体)は、AMPA型グルタミン酸受容体、NMDA型グルタミン酸受容体に次ぐ第3のイオンチャンネル型グルタミン酸受容体ですが、AMPA型グルタミン酸受容体やNMDA型グルタミン酸受容体は中枢神経系の興奮性シナプスに広く分布するのに対し、カイニン酸受容体は記憶を司る海馬CA3野の苔状線維シナプスなど特定のシナプスに局在する傾向があり、AMPA型グルタミン酸受容体やNMDA型グルタミン酸受容体は興奮性シナプス伝達に直接的に寄与するのに対し、カイニン酸受容体はまた興奮性および抑制性シナプスのシナプス前終末にも発現し,グルタミン酸濃度に応じてシナプス前部を興奮ないし抑制させ,神経伝達物質放出量を調節することによって興奮性やシナプス伝達の調節因子として機能するのですがherpes感染が大脳基底核におこると手も足もだせないのです。
海馬とは何でしょうか? 下図に海馬における神経回路を示します。海馬は記憶および学習を司る重要な脳の領域であり,海馬は大きく分けて歯状回,CA3野,CA1野の3つの領域に分かれています。
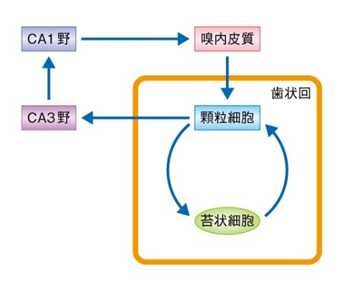
上図に海馬の歯状回,CA3野,CA1野の3つの領域を古典的な3つのシナプス性の神経回路,および,歯状回の顆粒細胞と苔状細胞が形成する正のフィードバックループを示しています。
上図を見てください。古典的な3シナプス性の神経回路においてつまり一回目のシナプスは歯状回の顆粒神経細胞は嗅内皮質からの入力をうけたのち二回目のシナプスはCA3野の神経細胞へと出力し,三回目のシナプスはCA3野はCA1野の神経細胞へと出力するのです。嗅内皮質とは何でしょうか?嗅内野と同義語です。大脳皮質と海馬の間に見られる入出力のほとんどは嗅内野を介して行われる。嗅内野はアルツハイマー病の病変が初期の段階から観察される領域です。海馬と共に記憶に深く関わる脳領域であり、双子のように類似した構造を持つ2つの領域、内側嗅内皮質と外側嗅内皮質から構成されます。 内側嗅内皮質は空間情報を処理する一方、外側嗅内皮質の細胞は匂いや物体の情報処理に関わります。歯状回は嗅内皮質からの入力情報パターンを最初にうけとり,それをCA3野へと情報パターンとして出力することにより空間認知の弁別(パターン分離)に重要な役割をはたす。歯状回のなかでも主要な細胞である顆粒細胞とよばれる興奮性ニューロンは歯状回の入力および出力を担う.また,歯状回門に位置する苔状細胞は顆粒細胞と同様にグルタミン酸作動性の興奮性ニューロンであり,顆粒細胞から入力をうけとり,ふたたび顆粒細胞へと投射することにより正のフィードバックループを形成する。苔状細胞から顆粒細胞への投射は,同側の海馬の長軸にそった方向に投射するだけでなく,対側の海馬にも投射する.したがって,苔状細胞は非常に広い範囲にわたり顆粒細胞の神経活動を制御する。さらに,苔状細胞は顆粒細胞のほか抑制性ニューロンへも投射する.抑制性ニューロンは顆粒細胞と密にシナプスを形成することから,この抑制性ニューロンを介した苔状細胞の出力は顆粒細胞に対しフィードフォワード(予測制御)の抑制を起こすのです。 このように,苔状細胞と顆粒細胞の形成する神経回路は記憶および学習において重要なはたらきをするのです。又、苔状細胞の脱落はフィードフォワード(予測制御)の投射をを失わせ顆粒神経細胞に過剰興奮を招き癲癇を引き起こす原因となるのです。
癲癇の治療薬の種類はてんかん発作時には興奮系の神経(グルタミン神経)が強く働いているために現在使用されている抗てんかん薬には症状を一時的に緩和する三種類の治療薬があります。一つ目は興奮系神経を抑制する薬、二つ目は抑制系神経の働きを亢進させる薬、三つめは一つ目と二つ目の薬を混ぜる混合薬となります。しかしこれらの薬はすべて対症療法であって癲癇の根本原因は大脳基底核に感染したherpesですから原因治療としては抗ヘルペス剤を投与すべきですが世界中の医者は誰もこの根本治療に気が付いていないのです。知っているのですがやらないだけです。残念です。
まだまだ続きます!!続きはこちらです!!詳しく書きすぎて私のところで全て説明されているのでわざわざ調べずにすむほどですよ!!!アハハ!
