まず結論から言ってしまうと免疫チェックポイントとか免疫チェックポイント分子という概念は間違っています。「免疫チェックポイント」の日本語訳は「免疫の働きを阻止する地点」であり「免疫チェックポイント分子」の日本語訳は「免疫の働きを阻止する地点で働く分子」です。その目的は「癌」や「自己免疫疾患」を阻止するためだと言われますがそもそも「癌」や「自己免疫疾患」はこの世には存在しないからです。それでは「癌」や「自己免疫疾患」の症状のすべては何が原因で起こっているのでしょうか?すべてヘルペスウイルスによる細胞のゲノムDNAに潜伏感染したヘルペスウイルスが「部位特異的遺伝子組み換え」とか「部位特異的遺伝子乗り換え」といわれる突然変異をもたらしたからです。ヘルペスウイルスの「部位特異的遺伝子組み換え」という突然変異についてはここを読んでください。
「免疫チェックポイント」の間違いを論証していきます。
免疫チェックポイント分子と言われているPD-1とCTLA-4とは全く異なった機能を持った蛋白であります。PD-1とCTLA-4の二つを同類扱いにして免疫チェックポイント分子とするのが大間違いです。CTLA-4を発現するのはヘルパーTリンパ球と抑制リンパ球(Treg)の二つのTリンパ球だけです。CTLA-4の働きは癌とは100%関わりがなく病原体との戦い勝利の終了を告げるためにナイーブTリンパ球が新たに抑制リンパ球(Treg)となった時に発現する蛋白分子である酵素なのです。従ってCTLA-4は免疫チェックポイント分子と言われるように日本語では免疫が勝利してしまった戦いを終わらせるための「免疫阻止蛋白分子」と言われるのは正しいのです。
CTLA-4 (Cytotoxic T-Lymphocyte-Associated Protein 4)とは、何でしょうか?免疫チェックポイント分子であり、ヘルパーT細胞の活性化を抑制する働きを持つタンパク質です。ヘルパーT細胞は、体内に侵入した病原体でなどの異物を攻撃する免疫細胞ですが、戦いが勝利に終わればヘルパーT細胞は用済みですからヘルパーT細胞の活性化は必要なくなります。自己免疫疾患はこの世には存在し無いのでCTLA-4と自己免疫疾患は何の関係もないのです。また、がん細胞はCTLA-4を利用して免疫細胞からの攻撃を逃れようとすることがありと言われますが、がん細胞は自己免疫疾患と同じくこの世には100%ないのでがん細胞はCTLA-4を利用して免疫細胞からの攻撃を逃れる必要もないのでCTLA-4を阻害する薬剤は、すべておかねもうけのための手段に過ぎないのです。CTLA-4は主にヘルパーT細胞(CD4陽性T細胞)と制御性T細胞(Treg)に発現します。
CTLA-4の主な働きとは: 活性化していたヘルパーT細胞の活性化抑制により病原体との戦いを終わらせることです。CTLA-4は、ヘルパーT細胞の表面に発現し、抗原提示細胞(APC)から情報を受け取っても、T細胞の攻撃力を活性化させないように戦いを終わらすためにブレーキをかける役割を担っています。CTLA-4はキラーT細胞(CD8陽性T細胞)には発現しません。CTLA-4はヘルパーT細胞(CD4陽性T細胞)と制御性T細胞(Treg)に発現します。したがって、CTLA-4の発現は、キラーT細胞には発現しないという点がポイントです。つまりこの世にない癌細胞を殺すわけにはいかないのです。アッハッハッハ!!!
更にチェックポイントという言葉は細胞周期チェックポイントという意味で用いるべき医学用語なのです。細胞周期チェックポイントとは何でしょうか?まず細胞周期細胞が増殖・分裂するときに1個の細胞がたどる一連の順序だった出来事であり、1個の細胞が分裂して2個に増殖すると細胞周期を一回りしたことになります。細胞が増殖するときに最も大事なことは遺伝物質のDNAの「倍加」にして2倍になった染色体という形にして分配しやすい形にします。次に紡錘体という専用の分配装置が必要になります。この二つの「倍加(2倍)」と「分配」の中心になるのです。従ってこの二つが正常に進行しているかをチェックするのが細胞周期チェックポイントなのです。DNAが損傷しているときに働くのが「DNAチェックポイント」であり一本の染色体が2本の姉妹染色分体を二つの分裂した細胞に分ける働きをチェックするのが「紡錘体チェックポイント」なのです。つまり細胞周期チェックポイントには二つあり「DNAチェックポイント」と「紡錘体チェックポイント」のチェックポイントを取り出して間違って流用して「免疫チェックポイント」という言葉を捏造してしまったのです。この「DNAチェックポイント」と「紡錘体チェックポイント」はそれぞれの働きだす地点で問題があれば細胞周期の進行を止める検問所となるのです。ところが「免疫チェックポイント」は免疫が正しく働いているかを監視する地点にはなれないのですが狡賢く既知の「DNA「DNAチェックポイント」と「紡錘体チェックポイント」のチェックポイントを盗み取ったのです。何故ならば癌細胞(増殖過剰細胞)は自己の細胞ですから免疫がただ正しく作用しているかを監視して免疫が正しいかどうかをする能力があるわけはないのです。従って「免疫チェックポイント」の論理は矛盾に満ち満ちているので「免疫チェックポイント」の意味づけの説得力がゼロなのです。残念です。
一方CTLA-4は正しい免疫チェックポイント分子なので、戦い後終了してしまったヘルパーT細胞の活性化を抑制する働きが当然必要なのです。ヘルパーT細胞は、他の免疫細胞の働きを調節する司令塔のような役割を担っており、CTLA-4は、ヘルパーT細胞が過剰に活性化されるのを防ぐことで、病原体との戦いが終わった免疫反応を制御して終わらせることが出来るので癌との関りは一切ないのです。
一方、CTLA-4分子を持っていないキラーT細胞は、ウイルス感染細胞やがん細胞を直接攻撃・排除する役割を担っており、CTLA-4による抑制は必要ありません。
したがって、CTLA-4の発現は、T細胞の種類によって異なり、キラーT細胞には発現しないという点がポイントです。
T細胞には3種類ありキラーT細胞とヘルパーT細胞とiTregの三つです。iTregだけは癌細胞とは関りがなくアレルギー反応を終了させるための免疫寛容を起こすT細胞である特別な細胞でアルトとだけを覚えておいてください。
癌に関わるT細胞はキラーT細胞(CTL)とヘルパーT細胞だけです。キラーT細胞は、ヘルペスウイルス感染細胞やヘルペスの感染により生まれた癌細胞を直接、攻撃してヘルペスもろとも癌細胞を殺すシステムをもっていますがこのような特別な能力を発揮するためにはヘルパーT細胞と抗原提示細胞(APC)がキラーT細胞を活性させるためには絶対に必要なのです。実はヘルパーT細胞も活性化するために抗原提示細胞(APC)が必要なのです。
抗原提示細胞(APC)には3種類あります。1つ目は代表的な抗原提示細胞(antigen presenting cell略してAPC)である活性化した樹枝状細胞細(dendritic cell)と2つ目は活性化したマクロファージ(大食細胞)と3つ目は未熟なB細胞です。なぜ樹枝状細胞細(dendritic cell)が代表となる抗原提示細胞(APC)なのは抗原ペプチドをMHCに乗せてリンパ節まで運ぶことができる唯一の抗原提示細胞(APC)であるからです。従ってリンパ節でT細胞に抗原ペプチドを提示できる抗原提示細胞(APC)は活性化した樹枝状細胞細(dendritic cell)なのです。
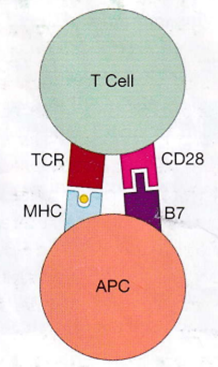
キラーT細胞(CTL)はT細胞受容体(TCR)とCD8という補助受容体とCD28という共刺激分子を持っています。一方ヘルパーT細胞はT細胞受容体(TCR)とCD4という補助受容体とCD28という共刺激分子を持っています。キラーT細胞(CTL)もヘルパーT細胞(Th)も持っている共刺激分子となるCD28は抗原提示細胞(APC)が持っているB7蛋白(B7-1とB7-2)といわれる共刺激分子と結合します。B7-1 (CD80)とB7-2 (CD86)との違いは、T細胞の活性化に関わる共刺激分子であり、それぞれCD80とCD86というタンパク質として知られています。CD28もB7蛋白もどちらも共刺激分子といわれるのですがAPCのB7蛋白がT細胞を刺激してT細胞が活性化しやすくしているのです。実はB7-1 (CD80)とB7-2 (CD86)のどちらもT細胞上のCD28と結合し、T細胞の活性化を促進しますが、発現する細胞や結合する相手に違いがあります。発現細胞の違いはB7-1 (CD80)は主に活性化されたB細胞、マクロファージ、樹状細胞に発現します。B7-2 (CD86)はB細胞、マクロファージ、樹状細胞に加えて、一部のT細胞や上皮細胞など、より幅広い細胞に発現します。
ここでキラーT細胞(CTL)とヘルパーT細胞(Th)との違いは二つありますがその一つ目は機能の違いでありキラーT細胞(CTL)は細胞に感染したヘルペスウイルスなどの細胞内寄生でしか生きられない病原体を細胞ごと殺戮することであり、一方ヘルパーT細胞(Th)はキラーT細胞(CTL)の殺しのヘルプをすることなのでヘルパーT細胞(Th)と呼ばれるのですがヘルパーT細胞(Th)も自分の数多くの同じT cell receptor(TCR)にピッタリ合う多くの敵(抗原)である多数の病原体のペプチドとT細胞receptor(TCR)に結合するだけでは活性化されないのです。下の図にこのほかに下の絵図に示したように他にも細かい装置が必要なのです。
このような抗原ペプチドに出会う前の未熟なバージンT細胞のままではキラーT細胞(CTL)を活性化する手助けはできないのです。現在でも残念なことには今なおキラーT細胞(CTL)がどのように活性化されるのかは不明なのです。
バージンT細胞から敵(抗原ペプチド)を見つけて活性化したT細胞になるためにも、同じ抗原を認識している抗原提示細胞(APC)と出あって刺激してくれるAPCのヘルプが必要なのです。キラーT細胞(CTL)もヘルパーT細胞(Th)も同じ抗原を認識している抗原提示細胞(APC)と出あってはじめて活性化されるのです。ここで下図に左からAPCとCTLとの結合状態と中央にAPCとTh cellとの結合状態とAPCとT cellとの複雑な結合を済ませてやっと初めてAPCはT細胞を活性化可能となるのです。右端のT cellはキラーT細胞(CTL)もヘルパーT細胞(Th)の二つが含まれています。
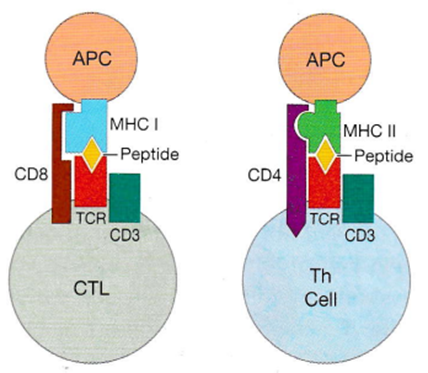
左の三つの絵図には抗原提示細胞(APC)は、細胞のMHCⅠ分子とMHCⅡ分子とMHCに乗せられたヘルペスウイルス由来のペプチドが結合しています。ヘルペスウイルスは、APC細胞内で自己のタンパク質と同様に分解され、ペプチドとしてMHC分子に結合し、ヘルパーT細胞(Th cell)やキラーT(CTL)に提示されています。このように正確にヘルペスウイルスのペプチド抗原がAPCによってT細胞に提示されるとT細胞は初めて活性化されるのはリンパ節なのです。
上記の絵図に示したリンパ節で起こるT細胞とAPCが完璧な結合が生まれるのに厳しい順序があります。1番目はT細胞表面には接着分子があり、樹枝状細胞(APC)の表面にも接着分子がありこの二つの細胞が接着すると離れられなくなります。2つ目は上の中央の図にあるようにTh cellと結合しているCD4の補助ReceptorがAPCのMHCⅡ分子に止め金の様にはまっています。この留め金がT細胞とAPCの相互作用を強めるのです。更にTCR(T細胞)と抗原ペプチドとしっかり結合していることがTh cellの接着分子の蛋白の発現を強めるのです。この3つの働きがT細胞とAPCの結合をマジックテープの様に接着してくれるのでまるで神経シナプスに似ているので「免疫シナプス」といいます。
ヘルペスウイルスに感染した細胞は、APCキラーT細胞によって、ヘルペス感染細胞表面にMHCIと結合したヘルペスウイルス抗原を認識され、キラーT細胞に攻撃されることで排除されます。キラーT細胞は、感染細胞の細胞膜表面に現れるヘルペスウイルスの抗原とMHCIとを認識すると、その細胞を破壊する物質を放出して、感染細胞を死滅させます。ヘルペスウイルスは、感染細胞内で分解され、MHC分子に結合可能なペプチドを生成します。
キラーT細胞は、感染細胞の細胞膜表面に現れるヘルペスウイルスの抗原とMHCIとを認識後、キラーT細胞は、感染細胞を攻撃し始めグランザイムやパーフォリンといったタンパク質を放出します。パーフォリン:感染細胞の細胞膜に穴を開け、細胞を破壊します。
グランザイム:感染細胞の内部に侵入し、細胞死を引き起こす酵素を活性化させます。これらの作用により、ヘルペスウイルスに感染した細胞は破壊され、ウイルスが体内で増殖するのを防ぎます。このように、キラーT細胞は、ヘルペスウイルス感染細胞を直接攻撃し、排除することで、感染拡大を防ぐ重要な役割を果たしています。
MHCとは何でしょうか?
MHCは「主要組織適合遺伝子複合体」と訳されますが、これは英語のMajor Histocompatibility Complexの直訳です。この名前は、移植医療において、臓器移植時の拒絶反応を理解する上で重要な役割を果たす遺伝子群であることを示しています。MHC遺伝子によってコードされるタンパク質は、細胞表面に抗原を提示し、免疫システムが自己と非自己を識別する際に中心的な役割を担うため、組織適合性(移植された組織が拒絶されないこと)と密接に関連しています。しかし他人の臓器を移植されると多かれ少なかれ移植臓器をもらった人の免疫は拒絶反応を起こしてしまいます。それは他人の移植臓器に存在しているMHCタンパクを自己でない異物と臓器をもらった人の免疫は認識してしまうから排除するからです。
MHC (主要組織適合遺伝子複合体) 遺伝子は、免疫システムにおいて重要な役割を果たす遺伝子群です。ヒトではHLA(ヒト白血球抗原)と呼ばれます。MHC蛋白は、病原体抗原のペプチドを乗せて細胞表面にこの抗原ペプチドを提示し、免疫細胞が異物である病原体のヘルペスウイルスや細菌などを認識するのを助けます。MHC遺伝子の役割:MHCは、免疫細胞が自己と非自己を識別し、自己に対しては免疫反応を起きないようにして非自己の病原体にのみ免疫応答を行います。従って自己免疫疾患はこの世には存在しないのです。MHCの種類には:大きく分けてクラスI、クラスII、2つに分類されます。MHCの細胞分布:クラスIはほぼ全ての細胞に存在し、クラスIIは抗原提示細胞(APC)であるB細胞、樹状細胞、マクロファージ3つに存在します。抗原ペプチド提示:MHC分子は、細胞内で分解されたタンパク質の抗原ペプチドを結合し、細胞表面に提示します。T細胞認識:T細胞は、MHCに結合した抗原を認識し、活性化されます。抗原ペプチドを認識できるT細胞にはヘルパーT細胞とキラーT細胞とがあります。MHCの多様性:MHC遺伝子は非常に多様性に富んでおり、個体間で異なる遺伝子型を持つことで、多様な病原体に対する免疫反応を可能にしています。MHC遺伝子の数は、クラスIとクラスIIでそれぞれ複数存在し、個体によって発現する遺伝子型が異なるため、非常に多様性に富んでいます。ヒトにおけるMHC:ヒトでは、MHC遺伝子群はHLAと呼ばれ、移植の際に臓器を「あげる人」と「もらう人」どうしの組織適合性判定にもちいられます。ヒトの場合、MHC遺伝子領域は第6番染色体短腕に存在し、クラスIにはHLA-A, HLA -B, HLA -Cの3つが、クラスIIにはHLA-DR, HLA -DQ, HLA -DPの3つが含まれます。MHC遺伝子の重要性:MHC遺伝子は、免疫システムの中心的な役割を担っており、感染防御、移植拒絶反応などに関与しています。Major Histocompatibility Complex (MHC):この名称は、MHCが免疫システムにおいて重要な役割を果たす遺伝子群であることを示しています。Major:多くの主要な異なる遺伝子が含まれており、免疫反応に大きな影響を与えることを意味します。Histocompatibility:組織適合性、つまり移植された組織が拒絶されないことを意味します。Complex:複数の遺伝子が近接して存在し、機能的に連携していることを意味します。MHCの移植における役割:MHCは、移植された臓器や組織が体内で拒絶されるかどうかを決定する上で重要な役割を果たします。MHCの免疫システムの役割:MHCは、免疫細胞に抗原を提示し、免疫反応において自己と非自己の識別100%正しく区別できる役割を担います。自己と非自己の識別:MHCは、免疫システムが自己の細胞と外部からの侵入者である非自己とを区別する上で重要な役割を果たします。拒絶反応:自分のMHCが異なる型を持つ個体間での移植は、拒絶反応を引き起こすのは臓器移植された免疫は臓器を上げた人のMHCは非自己と判断するからです。
ヒトにおけるMHCは、HLA(ヒト白血球抗原)とも呼ばれます。 簡単に言うと、MHCは、移植された臓器が拒絶されるかどうかを左右する重要な遺伝子群であり、免疫システムが自己と非自己を識別する上で中心的な役割をMHCが担っているため、「主要組織適合遺伝子複合体」と呼ばれています。
正しい免疫チェックポイントであるCTLA-4の働きについて①免疫応答のバランス調整:CTLA-4は、免疫系が過剰に活性化するのを防ぎますが、自己免疫疾患を予防するのに役立津ことはありません。何故ならば自己免疫疾患はない病気であるからです。自己免疫疾患はないについてはここを読んでください。
②がん免疫療法への応用はすべて誤りです。それは癌もないうえに自己の細胞である癌細胞(増殖過剰細胞)を免疫は攻撃できませんからです。
CTLA-4を阻害する薬剤は、T細胞のブレーキを外すことで、がん細胞への攻撃を促すため、がん免疫療法に用いられていますが間違いです。それは癌細胞(増殖過剰細胞)は存在しないうえに勿論ヘルペスによって増やされた増殖過剰細胞は存在します。しかもがん免疫療法もすべて失敗します。何故ならば癌細胞(増殖過剰細胞)自己の細胞ですからいくら免疫細胞が頑張っても自己の細胞は攻撃できないからです。その意味で癌(増殖過剰細胞塊)は間違った自己免疫疾患と同じ病気といってもよいのです。この世には自己免疫疾患も癌もないのですが癌細胞も自己の細胞ですから癌も自己免疫疾患と間違って言うことは皮肉にも許されるのです。アッハッハ!!!!敢えて言葉の遊びをさせてもらうと「自己免疫疾患」を「ヘルペス感染性自己免疫疾患」といい「癌」を「ヘルペス感染性増殖過剰細胞感染症」と言ってもよいのかもしれませんね。アッハッハ!!
CTLA-4と関連するキーワード:①免疫チェックポイント:免疫系が戦いが終わったにもかかわらず過剰に活性化するのを防ぐために、免疫細胞と標的細胞の間で働く分子の総称です。この文章は正しいです。
免疫チェックポイント阻害薬は待った意味のない薬です。CTLA-4などの免疫チェックポイント分子を阻害することで、T細胞の活性化を促進し、がん細胞を攻撃する薬剤ですが正しい答えはこのT細胞はキラーT細胞でありヘルペスが細胞に増えすぎたためにヘルペスを認識する数少ないキラーT細胞は疲れ切って癌細胞つまり「ヘルペス過剰増殖性癌細胞」を殺すことが出来なくなったのです。
制御性T細胞 (Treg)とは:CTLA-4は、制御性T細胞の機能に必須であり、自己免疫疾患の抑制に重要な役割を果たしています。といわれますが間違いです。自己免疫疾患は存在しない病気なので抑制する必要もないのです。
CD28とは:CTLA-4と構造が似ており、T細胞の活性化に関わる分子です。CD28はT細胞を活性化する一方で、CTLA-4は病原体との戦いが勝利で終わったために必要がなくなったT細胞の活性化を抑制するのは当然のことなのです。
CD80( B7-1)/CD86 (B7-2):は、どちらもB7ファミリーに属する共刺激分子で、T細胞の活性化を促進する主要な分子です。これらは「B7-1」と「B7-2」とも呼ばれ、抗原提示細胞(APC)からT細胞へ補助刺激シグナルを送ります。CD80とCD86の主な機能は、T細胞のCD28およびCTLA-4(CD152)リガンドとして働き、T細胞の活性化(CD28と結合)や、免疫応答の抑制(CTLA-4と結合)を制御することです。
CD80とCD86の主な特徴
分子の種類:どちらもB7ファミリーに属する分子です。
CD80とCD86が結合する標的分子: T細胞上のCD28およびCTLA-4(CD152)と結合します。
CD80とCD86の機能: T細胞の活性化と生存をサポートする補助刺激シグナルを送ります。
CD80とCD86が発現している細胞:活性化された抗原提示細胞(樹状細胞や単球など)に発現します。
分子名: CD80はB7-1、CD86はB7-2としても知られています。
CD28とCTLA-4との関係
CD28との結合:CD80とCD86がT細胞上のCD28と結合すると、T細胞は完全な活性化に必要な「補助刺激」を受け、免疫応答が促進されます。
CTLA-4との結合:一方で、CD80とCD86はT細胞上のCTLA-4(CD152)にも結合します。この結合は戦いの終わったT細胞の不必要な活性化を抑制し、免疫応答の過度な活性化を正しく防ぐ役割があります。
T細胞が癌細胞(ヘルペス増殖過剰細胞)に対して疲弊し癌細胞を攻撃しなくなるメカニズムはT細胞に疲弊をもたらす原因となっているNr4aという遺伝子なのです。
Nr4aという遺伝子とは何か?
Nr4a(エヌアールフォーエー)は、核内受容体スーパーファミリーに属する遺伝子群(NR4A1, NR4A2, NR4A3)で、T細胞の活性化を抑制し、免疫応答を制御する働きを持つ転写因子です。自己免疫疾患やアレルギー疾患に関与する制御性T細胞(Treg)の分化に不可欠な役割を果たすほか、慢性的な免疫応答によって引き起こされるT細胞の「疲弊」にも中心的な役割を担っており、この遺伝子の働きを抑えることで、がん免疫療法の強化が期待されています。が、がん免疫療法はすべて無意味です。
主なNr4aの機能と役割①免疫寛容の制御:自己の細胞を攻撃するT細胞が作られないよう、適切な免疫寛容を維持するために、T細胞の分化や細胞死を制御します。
T細胞の疲弊:慢性的な免疫刺激によりT細胞が機能不全を起こす「疲弊」と呼ばれる現象に関与し、T細胞の抗腫瘍効果を低下させます。
がん免疫療法への応用:Nr4aの発現を抑制することで、T細胞の疲弊を防ぎ、抗腫瘍効果を向上させることができるため、がんに対する免疫療法の新たなアプローチとして研究が進められています。Nr4aの働きを抑えたT細胞は、通常のT細胞よりもがん細胞に対する攻撃力が向上し、マウスの寿命を延ばす効果があることが示されました。
制御性T細胞(Treg)との関連:Nr4aは、過剰な免疫反応を抑制する制御性T細胞を誘導する鍵となる分子です。
Nr4aファミリーの核内受容体:Nr4aファミリーは、生理的なリガンド(結合相手の物質)が不明なオーファン核内受容体に分類されます。オーファン核内受容体とはリガンドが同定されていない受容体タンパク質である。孤児受容体ともいう。
がん治療薬としての可能性:Nr4aの働きを抑制する技術が確立されれば、様々ながん種の治療に貢献する可能性があります。
免疫システムと癌に対する免疫療法はすべて価値がありません。
免疫システムは、ヘルペスウイルス感染から身を守るのみならず、ヘルペスウイルスが感染して作った難病に癌、脳梗塞、アルツハイマー病などがあることも明らかになってきました。癌治療においては、患者自身の免疫を強化してがんを殺す免疫療法が脚光を浴びていますが、癌に対する免疫療法は癌細胞(増殖過剰自己細胞)は自分の細胞ですから免疫は自己の細胞を敵とみなすことが不可能ですから癌に対する免疫療法はすべて価値がありません。
しかも癌は癌関連遺伝子のヌクレオチドの塩基アミノ酸を指定する塩基の並びが突然変異で起こったものですから免疫の働きはこの突然変異を気づくことができないので免疫は全く無力なのです。癌は染色体のDNA異常で生じるのではなく増殖関連遺伝子の2種類の突然変異という異常によっておこるからです。つまり自己の増殖関連遺伝子の並びの異常に対しては自己であるとか非自己であるとかをはるかに超えた違いを免疫の細胞が認識することは不可能なのです。従って癌の定義はこれはがん細胞を殺す主力となるヘルペスを認識できる限られた免疫細胞の「キラーT細胞」は、がん細胞との闘いではなく癌細胞にいるヘルペス殺すべき病原体であるとヘルパーT細胞や抗原提示細胞(APC)と教えられてヘルペスが充満している数多くの癌細胞(ヘルペス感染性増殖過剰性細胞)を殺しにかかったのですがあくまでも敵は癌細胞ではなくヘルペス感染細胞のヘルペスなのです。ところが癌になっているわけでもないヘルペス感染細胞も多すぎてやがて疲れ切って疲弊し、ヘルペスを認識できる限られた免疫細胞の「キラーT細胞」は少ないので機能しなくなるのは当然なのです。何故ならば免疫細胞の「キラーT細胞」が認識して殺そうとしているのは癌細胞に感染しているヘルペスであって決して自己の細胞である癌細胞(増殖過剰細胞)ではないからです。しかもヘルペスを敵と認識できる「キラーT細胞」は極めて限られているのでのす。何故ならば免疫細胞である「キラーT細胞」は自己の細胞の一部である増殖過剰細胞(癌細胞)を異物と認識することができないからです。「キラーT細胞」の敵はヘルペスが感染している細胞に過ぎないのです。
キラーT細胞は、攻撃力は高いが相手ががん細胞の場合、一部のがん細胞しか攻撃できず、正常細胞を攻撃してしまうことがあるという弱点があるといわれるのはなぜでしょうか?キラーT細胞が攻撃しているのは癌細胞ではなく、というのは元々がん細胞は存在しないので上で説明したように増殖過剰細胞で増えたへルペスです。従って癌細胞になっていない正常なヘルペス感染細胞をも殺そうとすると誤解されるのです。この事実も癌細胞を攻撃しているのはヘルペスであることを証明しているのです。
がんの遺伝子レベルの定義とは、細胞の遺伝子にヘルペスによって生じた変化が、がんの発生や進行の原因のすべてなのです。具体的には、がん原遺伝子(proto-oncogene)やがん抑制遺伝子(tumor suppressor gene)の異常によって生じた増殖関連遺伝子の変異によって生じた「増殖過剰細胞」の蓄積によって生まれた病気なのです。因みにがん原遺伝子(proto-oncogene)も癌遺伝子(oncogene)もそもそも存在しないのです。癌という言葉は無くすべきなのです。がん原遺伝子は増殖原遺伝子に癌遺伝子は増殖遺伝子に変えるべきなのです。それではがん遺伝子(oncogene)やがん抑制遺伝子(tumor suppressor gene)の異常を生じさせたのは何なのでしょうか?それがヘルペスウイルスなのです。どのようにしてヘルペスは上記の2つの遺伝子を突然変異させることができるのでしょうか?すべての細胞に感染できるヘルペスウイルスが感染して潜伏感染するときに細胞の核のゲノムDNAに自分のDNAを組み込むときに部位特異的遺伝子の組み換えや乗り換えを起こしてしまうからなのです。これらのヘルペスによる部位特異的遺伝子組み換え(乗り換え)による遺伝子変化は、どの部位の違いによる特定の遺伝子組み換えによって様々な遺伝子の突然変異をもたらすので細胞の増殖、分化、生存、アポトーシス(細胞死)、物質代謝やエネルギー代謝などの遺伝子の発現に関わる蛋白の異常が見られるのです。従って様々な種類の同じ癌細胞であっても癌細胞自体は全く同一の組織の癌細胞あっても癌細胞内は多様性が見られるのです。
同一の組織の同じ癌といわれる癌細胞(増殖過剰細胞)であっても、個々の癌細胞を一つ一つ顕微鏡で見ると違いが見られます。これは、ヘルペスが感染して生み出す癌細胞が均一ではないのは、ヘルペスが突然変異を起こすのは癌遺伝子のみならず1個の細胞に23500個もある遺伝子のどの部位にヘルペスが自分のDNAを組み入れてどの部位の遺伝子を組み替えるか又どの部位の遺伝子群を乗り換えるかなどは偶然なので全く同一の癌の塊にある癌細胞はそれぞれが異なる特徴を持つことになるのです。さらにヘルペスが増殖するときに癌細胞の細胞機構を全面的に利用してヘルペスビリオンがどんどん増増殖・分裂していくときに細胞自身も増えるのでヘルペスビリオンと5大栄養素や核酸の材料やエネルギーの取り合いになるに加えてヘルペスが短時間に増殖・分裂する方がはるかに、はるかに速くてかつ多いのでその間に素早く様々な増殖・分裂するための必須の成分をヘルペスに略奪されてしまい癌細胞も正常な癌細胞(?)になれないのです。アッハッハ!!!
同一の癌の塊にあるそれぞれの癌細胞が示すヘルペスの部分特異的遺伝子組み換え(部分特異的遺伝子乗り換え)によって生み出される異なる特徴とは何か?
①異型性:癌細胞は、正常細胞と比較して、核の大きさや形、細胞質の量などが変化している「異型性」という特徴を持っています。同一の組織内でも、異型性の程度は細胞ごとに異なり、顕微鏡で観察すると、核が大きかったり小さかったり、形がいびつだったり、細胞質が少なかったり多すぎたりするなど、様々な違いが見られます.
②増殖状態:癌細胞は、正常細胞よりも活発に増殖するため、細胞分裂の過程や、分裂中の細胞の形態も細胞ごとに異なります。分裂が活発な細胞は、分裂像がより多く観察され、分裂の形態も不規則になることがあります.
③分化度:癌細胞は、正常細胞のように成熟した細胞になる「分化」という過程を経ますが、癌細胞の種類によっては、分化が未熟なものや、分化が不均一なものも存在します。そのため、顕微鏡で観察すると、細胞の形態や構造に違いが見られることがあります.
④組織構築:癌細胞を生み出したヘルペスウイルスは、正常な組織構造を破壊して増殖するため、組織の構造も細胞ごとに異なります。例えば、腺癌の場合、腺構造がきちんと形成されている細胞もあれば、腺構造が不完全な細胞、あるいは腺構造が全く見られない細胞も存在します.
これらの違いは、病理医が顕微鏡で組織標本を観察し、癌の悪性度や治療方針を決定する上で重要な情報となりますが彼らはヘルペスが癌の原因であることを知らないので病理医の診断は無意味です。がん診断で最も大切なのはヘルペスがどのくらいに増えているかを診断することです。異型性:癌細胞の特徴の一つで、核や細胞の形が正常細胞と異なる状態を指します.分化度:癌細胞が成熟する程度を表し、分化が進んでいるほど悪性度が低い傾向があります.組織型:癌細胞の組織構造に基づく分類で、病理診断で用いられます.
なぜ癌細胞の分化度というのは癌細胞が成熟する程度を表し、癌細胞の分化が進んでいるほど悪性度が低い傾向があるのでしょうか?分化が進んでいるほど悪性度が低い、というのは、癌細胞の分化について述べています。癌細胞が正常な細胞の形態や機能をどれだけ維持しているか、という分化度を指します。癌細胞の分化が進んでいる(高分化)ほど、癌細胞は正常細胞に近い形態を保ち、悪性度が低い傾向があります。癌細胞の分化が進んでいる(高分化)ほど、癌細胞は正常細胞に近い形態を保ち、悪性度が低い傾向があるのは正常な細胞が未熟であるときに増えたヘルペスが再び未熟な癌細胞の増殖関連遺伝子を更に変異させたために癌細胞としては未熟な分化し切っていない状態なのですがその原因はヘルペスが増えすぎたためです。悪性度の度合いは細胞に感染したヘルペスの数によって決まるので癌細胞が未熟で十分に成熟していない低分化型であればあるほどヘルペス感染多い証拠となるので悪性度が低くなるのです。同じように進行度が速い癌は正常な細胞を癌化させる速度が速くなるという意味ですから癌細胞の増殖関連遺伝子が変異するのはヘルペスの数が多くなればなるほど変異の速さつまりがんの進行の速さが高まるのは当然なのです。癌とか癌細胞などの人知の理解を超えた病気は存在しません。医者たちがお金儲けのために捏造した架空の病気に他ならないのです。この世に存在する死に至る病ではありません。正しくは「癌細胞」は「ヘルペス性増殖過剰細胞」であり「癌」は「ヘルペス性増殖過剰細胞の集団」に過ぎないのです。
病理医が使用する顕微鏡の倍率は何倍ですか?主に40倍から400倍程度で、組織や細胞の観察を行います。より詳細な観察が必要な場合は、600倍から1000倍程度の高倍率も使用されます。病理検査では、まず病変全体の分布を把握するために、40倍程度の低倍率で観察します。その後、詳細な観察が必要な部分を、100倍、200倍、400倍と段階的に倍率を上げて観察します。さらに、細胞レベルでの詳細な観察や、細胞内構造の観察が必要な場合は、600倍から1000倍の高倍率が用いられます。
病理医が使用する顕微鏡の倍率については、①低倍率(40倍~100倍):病変全体の分布や、組織の構造を把握するのに適しています。②中倍率(200倍~400倍):細胞の形態や、細胞内の構造を観察するのに適しています。③高倍率(600倍~1000倍):より微細な細胞内構造や、細菌などを観察するのに適しています。
100~150ナノメートルレベルのherpesウイルスを観察するのに必要な倍率は?
100ナノメートルレベルのウイルスを子細に観察するには、少なくとも数万倍以上の倍率が必要です。2000倍以上の光学顕微鏡では生きたままヘルペスを観察できますが詳しさには限界があり、死んだウイルスしか観察できませんが電子顕微鏡が必要になります。
ウイルスと顕微鏡の種類について:ウイルスは非常に小さく、一般的な光学顕微鏡では観察できません。例えば、インフルエンザウイルスは約100nmの大きさで、一般の光学顕微鏡ではせいぜい数百倍程度しか拡大できないため、観察は不可能です。ウイルスを観察するのに必要な倍率とは:ウイルスを子細に観察するには、数万倍から数十万倍の倍率が必要になります。具体的には、数万倍の倍率でウイルスの形態を、数十万倍の倍率で内部構造を観察することができます。ウイルス観察に電子顕微鏡の必要性について:ウイルス観察には、電子顕微鏡が不可欠です。電子顕微鏡は、電子線を照射して観察対象を拡大するため、光学顕微鏡よりもはるかに高い倍率で観察することができます。しかし電子顕微鏡では生きたままウイルスを観察することはできません。細胞診とは: ヘルペスが作った癌細胞の有無を調べる検査で、採取した細胞を顕微鏡で観察します. 組織診:癌細胞を含む組織を採取し、顕微鏡で観察する検査で、細胞診よりも詳細な情報が得られます.生検:病変の一部を採取して組織診を行う検査のことです.組織診と細胞診の違いとは組織診と細胞診は、どちらも病理検査の一種ですが、検査対象と方法、そして得られる情報に違いがあります。細胞診は、細胞レベルで異常を調べる検査で、組織診は、細胞が集まってできた組織を観察し、より詳細な情報を得る検査です。
癌転移のメカニズムは今なお完全な解明はまだ難しいのは何故ですか?
がん転移のメカニズム完全解明が難しいのは、がん細胞が多様で複雑な特性を持ち、体内の広範囲に分散したり、薬剤耐性を持ったりするためです。これらの細胞は特定の臓器に定着し、新たな腫瘍を形成する過程が複雑で、また正常な免疫システムを回避する能力を持つこともあります。
癌転移のメカニズムが不明な理由①細胞の多様性と複雑性:がんは単一の疾患ではなく、非常に多様な細胞群で構成されています。それぞれの細胞が異なる増殖速度、浸潤性、転移性を持っているため、単一の治療法で全てに対処することが困難です。②体内の広範囲への分散:転移した癌細胞は血液やリンパ液に乗って体内の様々な臓器に分散するため、全ての細胞を根こそぎ取り除くことができません。また、目に見えない微小転移も存在し、これらを取り除くことが難しいのが現状です。③薬剤耐性の獲得:転移したがん細胞は、抗がん剤など従来の治療法に対する薬剤耐性を持つことが多く、治療の効果が低下することがあります。④免疫システムの回避能力:がん細胞は正常な免疫システムを回避する能力を持っており、体内の免疫システムに認識・排除されにくい状態を作り出すことがあります。⑤各組織での定着と増殖の複雑なプロセス:がん細胞が他の臓器に運ばれても、そこで定着し新たな腫瘍を形成するまでには、周囲の環境への適応や免疫反応への対処など、複雑なメカニズムが必要です。
これらの理由から、がん転移のメカニズムの完全な解明には時間がかかっており、将来的に転移のみをブロックする薬剤の開発が期待されています。がん転移のメカニズムは非常に複雑であり、まだ完全に解明されているわけではありません。がんの種類や原発巣の位置によって転移しやすい臓器が異なることや、転移したがんが薬剤耐性を持つ傾向があることなども、その複雑性を示す例です。
しかも今なお癌細胞の組織構造は不明な点が多いのです。特に転移メカニズムについてはほとんど不明といってもいいのです。がんの転移は、複雑なメカニズムによって起こるため、完全な解明には至っていません。更に間質細胞が癌組織にどのように関与しているかもほとんど不明であることを知っておいてください。従って転移癌は存在せず大量のヘルペスが原発癌の癌細胞膜を破って血行性にもしくはリンパ行性に別の組織の正常な細胞に感染してそこで新たに細胞に感染して増殖過剰細胞である癌細胞を作ると私は考えています。
間質細胞(かんしつさいぼう)とは、上皮細胞など主要な機能を持つ細胞(実質細胞)の周囲を構成し、組織の支持構造を形成する細胞群の総称です。線維芽細胞や免疫細胞、血管内皮細胞などが含まれ、組織の維持、炎症反応、創傷治癒、あるいはホルモン産生など、臓器の機能や微小環境の維持に重要な役割を果たしています。
間質細胞の主な役割と特徴①組織の支持構造:臓器や組織の機能中心である実質細胞を支え、組織に強度と形状を与えます。②多様な細胞の存在:線維芽細胞、免疫細胞(リンパ球、マクロファージなど)、血管内皮細胞、平滑筋細胞、骨髄間質細胞、間葉系幹細胞など、多様な細胞が含まれます。③炎症・創傷治癒への関与:組織の損傷や炎症が起きた際、間質細胞が活性化し、組織の修復や再生に関与します。④細胞間のクロストーク:実質細胞だけでなく、間質に存在する様々な細胞間での情報伝達(クロストーク)が、組織の機能維持や疾患の理解に重要です。
間質の構成要素①線維性成分:コラーゲン線維や細網線維などの線維成分。②細胞成分:上記の線維芽細胞や免疫細胞、血管内皮細胞など。③分泌物:糖タンパク質などの細胞外マトリックス。
間質細胞の例①線維芽細胞:間質細胞の代表的な細胞で、組織の支持に重要なコラーゲンなどの線維成分を産生します。②間葉系幹細胞:骨、軟骨、脂肪、神経など様々な細胞に分化できる幹細胞で、骨髄などに存在します。③間質性細胞:広義の間質細胞全体を指し、特に病態における機能的役割を持つ細胞を指すことがあります。9/2今日はここまで
