免疫システムを抑制するチェックポイント分子であるCTLA-4とPD-1の作用は何か?
免疫系が侵入者を撃退した後は、その侵入者を攻撃するために使用された武器の生産を停止し、それらの武器の大部分を破壊しなければならない。
免疫システムは、侵入してくる病原体に対して迅速かつ圧倒的な反応を示すように進化した。結局のところ、ウイルスや細菌による攻撃のほとんどは、免疫系によって迅速に対処されるか(数日から数週間)、免疫系を圧倒して死に至らしめるかのどちらかである。このシステムには、様々な自然免疫と獲得免疫の二つのシステムのプレーヤーが互いに協力し合い、お互いを奮い立たせるポジティブ・フィードバック・ループが組み込まれている。日本語では「正のフィードバックループ」や「肯定的なフィードバックループ」と表現されます。このシステムは、出力の一部を入力にフィードバックし、その影響がさらに出力を増幅させるような状態を指します。しかし、いったん侵略を撃退したら、これらのフィードバック・ループを断ち切り、システムをオフにしなければならない。加えて、侵入に対する強力な反応が単に適切でない場合もあるような状況では、私たちの身体に回復不能な損傷を与えないために、免疫系を抑制しなければならないといわれるが命を病原体から守る人体で唯一の免疫の働きは長い免疫の遺伝子の突然変異を繰り返して進化して完成した免疫のシステムが過剰になって人体に危害を加えることは絶対にありえないのです。過剰免疫反応を主張する医学者はお金を稼ぐために過剰な反応を抑制する薬を作るための目的がるからです。Herpes以外のあらゆる病原体に対してはワクチンが完成していますから怖い病原体による「死」がなくなってしまったのも免疫が最高の薬であることを証明しているのです。医者という職業は病気を治すためには必要ではなくなったのです。癌が最後の病気になる時代となりましたがそもそも癌という病気も存在しない病気なのです。癌という病気もherpesウイルスによる人の細胞の核のDNAから成り立っている細胞増殖遺伝子の遺伝子組み換えという突然変異で生まれた増殖過剰細胞の集団が間違って癌と言われているだけで何も怖い病気でもないのです。癌についてはロイアルレイモンドライフ博士の「光癌治療」を読んでください。
免疫反応の抑制とは何でしょうか?
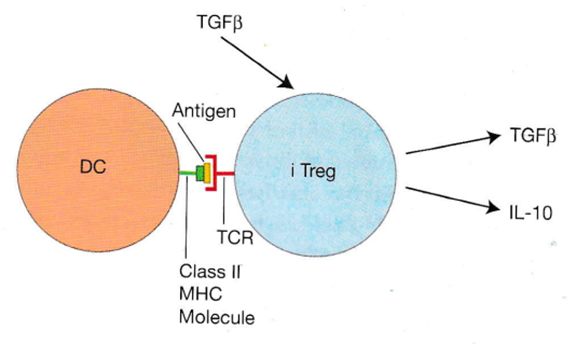
私たちは一般的に、ヘルパーT細胞は免疫系を活性化する上で重要であると考えている。しかし、実際には病原体との戦いの勝利の後で免疫反応を減衰させるCD4+ T細胞の別のタイプが発見されているのは当然のことなのです。これは誘導性抑制性T細胞(iTreg)と呼ばれるものです。これらの誘導性抑制性T細胞が “誘導性 “と呼ばれるのは、ナイーブなヘルパーT細胞がTh1、Th2、Th17細胞になるように戦う病原体の種類によって最も相応しいT細胞に自然に誘導できるのと同様に、上の絵図に見られるように抑制性サイトカインであるTGFβが豊富な環境で活性化されたナイーブなTh細胞も、iTregになるように “誘導 “できるからである。誘導性抑制性T細胞は、免疫系を活性化するTNFやIFN-γなどのサイトカインを分泌する代わりに、免疫系を抑制するIL-10やTGFβなどのサイトカインを産生するため、「抑制性」と呼ばれているのです。
病原体でない有害でない化学物質である排除の戦いは免疫寛容というべきアレルゲンとの共存を目指してiTreg から産生されるIL-10が抗原提示細胞(DC)上のレセプターに結合すると、APCのパターン認識レセプターの発現が低下し、これらのAPCが活性化されにくくなります。また、抑制性サイトカインであるIL-10がAPCに結合すると、APCの表面に発現しているB7共刺激分子のレベルが低下する。そしてこれにより、APCはT細胞を活性化しにくくなる。さらに、iTregsが産生する抑制性サイトカインTGFβはT細胞の増殖率を低下させ、キラーT細胞の殺傷力を低下させる。つまり、iTregsが産生する抑制性サイトカインであるIL-10やTGFβが免疫反応を抑制し、過剰な免疫活性化を防いで無害な化学物質の戦いを停止する共存への道を歩み始めるのです。この共存こそ人体に存在する唯一の免疫寛容なのですが世界中の医学者たちは誰も気が付いていないのです。
免疫の過剰な活性化を防ぐことが極めて重要なのは、腸の粘膜下にある組織である。私たちの腸には何兆個もの無害な細菌が生息しているが、誘導性抑制性T細胞は、腸を守る戦士たちである免疫細胞がこれらの細菌に過剰反応しないようにする上で大きな役割を果たしているので免疫細胞と細菌が共生できるのです。
iTreg(誘導性抑制性T細胞)は、一般的な無生物である環境抗原に対する免疫系の過剰反応によって引き起こされるアレルギーから私たちを守るためにも重要なのです。過剰に化学物質に対してアレルギー反応が起こらないように、iTreg(誘導性抑制性T細胞)は、アレルギー反応の中心となる肥満細胞の脱顆粒を抑制する作用を発揮しているのみならず最後は誘導性抑制性T細胞(iTreg)の作用で免疫寛容を起こして無害な化学物質と共存できるようになるのです。
免疫システムの不活性化はなぜ必要になるのですか?何のために進化したのですか?
侵略者である病原体に対して免疫システムが強く反応することが適切な状況であっても、戦いに勝利した後は、免疫戦士を抑制しなければならない。侵略の最中、免疫系が優勢になり、侵入者が破壊されるにつれ、「侵入抗原」の存在は少なくなっていくので、活性化される自然免疫系細胞の数は減り、自然免疫系細胞の抗原提示細胞(APC)である樹状細胞も成熟して戦いの抗原のペプチドをクラスⅡMHCに積んで二次リンパ器官へ移動する数も減っていきます。つまり、外来抗原が排除され撃退されると、自然系と適応系(獲得系)の両方の活性化レベルが低下します。これが活性化免疫系をオフにする第一歩なのです。
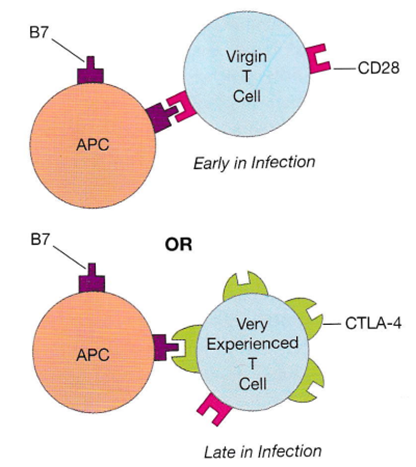
外来抗原の除去が免疫の活性化が最も重要ですが外来抗原の除去が成功するにつれて、他の免疫系のメカニズムもまた、戦いが終わるにつれて免疫の活性化のレベルを低下させるのに役立っているのです。B7共刺激タンパク質については、T細胞の活性化には、T細胞レセプターの抗原とのライゲーション(結合)に加えて、APC表面のB7タンパク質がT細胞表面のCD28分子に差し込まれる必要があります。この共刺激(co-stimulation)シグナルは、T細胞活性化の効率を大幅に高めているのです。CD28分子はT細胞の表面に存在する膜タンパク質で、T細胞の活性化を促進する共刺激分子として機能し、T細胞受容体(TCR)からのシグナルを増強してくれるのです。
しかしながら、APC上のB7タンパク質は、T細胞上の刺激性CD28分子に結合することに加えて、CTLA-4と呼ばれるT細胞上の他のレセプタータンパク質にも結合することができる。ほとんどのヒトT細胞はその表面に共刺激(co-stimulation)分子であるCD28を常に表示しているが、ナイーブT細胞のCTLA-4の大部分は細胞内に貯蔵されている。CTLA-4(Cytotoxic T-Lymphocyte-Associated Protein 4)はCTLA-4 は、T細胞の活性化を抑制する働きがあります。CTLA-4は免疫系が過剰に活性化するのを防ぎそしてバージンT細胞が初めて活性化されてから約2日後より、より多くのCTLA-4が細胞内の貯蔵庫から細胞表面へと移動します。重要なことは、抗原提示細胞上のB7はCD28に対する親和性よりも何千倍も高い親和性でCTLA-4と結合することです。その結果、時間が経つにつれて、CTLA-4分子はB7との結合においてCD28を凌駕するようになる。その結果、感染初期にはB7はCD28に結合し、共刺激因子として働くのですが、その後、戦いがしばらく続いた後、APC上の限られた数のB7タンパク質は、CD28ではなく、主にCTLA-4と結合する。これにより、これらのT細胞は再活性化されにくくなり、適応免疫反応を停止させることができるのです。
もう一つの分子であるプログラム死1(PD-1)もT細胞の不活性化に役立つ。CTLA-4と同様に、T細胞表面でのPD-1の発現は活性化後に増加する。PD-1のリガンドであるPD-L1は、病原体から攻撃を受けている組織(炎症組織)の多くの異なるタイプの細胞表面に現れる。炎症組織上のCが、しばらく働いていたT細胞上のPD-1と結合すると、T細胞は「無気力」になり、うまく機能しなくなる。これにより、感染症に勝利した後に、戦う必要がなくなったT細胞が「無気力」になるのは当然のことであるのですが実は炎症を起こしている組織の多くの異なるタイプの細胞表面に現れるPD-L1の作用なのです。
要約すると、感染後期になると、細胞の内部の貯蔵庫あったCTLA-4は細胞表面へと移動してAPC上のB7共刺激タンパク質を「吸収」し、T細胞の再活性化の効率を低下させてしまうのです。T細胞上のPD-1と炎症組織の多くの異なるタイプの細胞表面に現れているPD-L1のライゲーション(結合)は、以前に活性化されたT細胞の機能を阻害してしまうのです。
何故以前に活性化された経験豊富なT細胞の機能を阻害してしまうのでしょうか?PD-1とは一体何でしょうか?免疫細胞上に発現するタンパク質で、免疫反応を抑制する働きがあります。で、このPD-1とは、PD-1(Programmed cell Death 1)は、活性化T細胞の細胞表面に発現する受容体のひとつです。PD-1は、通常抗原提示細胞(がん細胞)の表面上に発現するPD-L1(Programmed cell Death 1- Ligand 1)と結合してPD-1が活性化されると、キラーT細胞は標的細胞への攻撃を中止します。正常な体内では、このPD-1/PD-L1のシステムを使って、T細胞が誤って自分自身の細胞(自己)を攻撃しないようにコントロールしています。皆さんこの世には癌細胞などという特別に悪性の細胞は存在し無いことを確認してください。しかもいわゆる癌細胞とは増殖関連遺伝子が変異しただけの自己の正常な細胞と同じですから免疫がこの事故の細胞を異物と認識できないのです。言い換えると自然免疫のAPCは絶対に自己の細胞や自己の成分を非自己として認識できないので事故そのものであるいわゆる癌細胞を敵とみなすことは絶対に不可能なのですから免疫が自己の細胞を攻撃することはないのです。従っていわゆる癌の免疫治療はすべて間違っているんです。ですから遺伝子な ところが、ヘルペスウイルスがいっぱい詰まっている増殖過剰細胞(癌細胞)はこのPD-1/PD-L1のシステムを使って、T細胞からの攻撃を巧みにかわしています。つまり、ヘルペスウイルスがいっぱい詰まっている増殖過剰細胞(癌細胞)ですから正常な体内でも細胞にはherpesがいくらでもいるのでD-1/PD-L1のシステムを使って、T細胞が誤って自分自身の細胞(自己)を攻撃しないようにコントロールしているだけなのです。つまり癌細胞は単なる増殖過剰細胞に過ぎないのでキラーT細胞が誤って自分自身の細胞(自己)を攻撃しないようにこのPD-1/PD-L1のシステムを利用しているだけなのです。自分の細胞表面上にPD-L1を出し、T細胞からの攻撃を避けているのです。そこで、PD-1、PD-L1に対する抗体を使って、PD-1とPD-L1が結合するのを妨げ、T細胞ががん細胞を攻撃できるようする薬が、PD-1、PD-L1抗体薬です。現在、臨床使用又は開発が進められている抗体薬は、PD-1抗体が2剤(ニボルマブ、ペムブロリズマブ)、PD-L1抗体が3剤(アベルマブ、アテゾリズマブ、デュルバルマブ)あります。PD-L1やPD-L2というリガンドと結合することで、T細胞などの免疫細胞の活性化を抑制します。このPD-1/PD-L1経路は、がん細胞が免疫細胞による攻撃から逃れるために利用されることがあります。そのため、PD-1/PD-L1経路を阻害する薬剤(PD-1阻害薬やPD-L1阻害薬)は、がん免疫療法に用いられますがPD-1/PD-L1経路は決して免疫反応とはかかわりがない正常な反応なのです。つまり正常な体内では、このPD-1/PD-L1のシステムを使って、T細胞が誤って自分自身の細胞(自己)を攻撃しないようにコントロールしているだけなのです。
キラーT細胞はヘルペスウイルスに感染した細胞を殺すことができますか?
キラーT細胞はヘルペスウイルスに感染した細胞を殺すことができます。キラーT細胞は、ウイルスに感染した細胞を認識し、直接攻撃して破壊する役割を持つ免疫細胞です。
キラーT細胞の役割:キラーT細胞(細胞傷害性T細胞とも呼ばれます)は、体内でウイルスやウイルスが作ったがん細胞などの異常細胞を認識し、排除する役割を担っています。といわれますががん細胞自身は自己の細胞の遺伝子が一部変異しただけですから異物と認識できないので免疫は攻撃できませんが癌細胞内のherpesは確実に非自己の敵として認識できるのに何故癌細胞を殺しきれないのでしょうか?
感染細胞の認識:キラーT細胞は、感染細胞の表面に現れるウイルス抗原を認識します。
攻撃方法:認識した感染細胞に直接結合し、細胞を破壊する物質を放出して、感染細胞を殺傷します。
ヘルペスウイルスとキラーT細胞:ヘルペスウイルスに感染した細胞も、キラーT細胞の攻撃対象となります。キラーT細胞は、ヘルペスウイルスに感染した細胞を認識し、破壊することで、ヘルペスウイルスの増殖を抑制し、感染拡大を防ぎます。
細胞性免疫:キラーT細胞による感染細胞の攻撃は、細胞性免疫の一環です。細胞性免疫は、抗体ではなく、免疫細胞自体が直接異物を攻撃する免疫反応です。
他の免疫細胞:ヘルペスウイルス感染に対しては、キラーT細胞だけでなく、NK細胞やマクロファージなども重要な役割を果たします。家畜感染症学会の資料によると、抗体が結合しない場合、キラーT細胞がウイルス感染細胞を破壊することが知られています。
キラーT細胞は、ヘルペスウイルス感染に対する免疫防御において重要な役割を担っています。
ヘルペスウイルスのペプチドはMHCに乗せることが出来ますか?
はい、ヘルペスウイルスのペプチドはMHC(主要組織適合遺伝子複合体)に乗せることができます。MHCは、免疫細胞が異物(ウイルスなど)を認識するために重要な役割を果たす分子で、ペプチド抗原をT細胞に提示します。ヘルペスウイルスが細胞内で分解された際に生成されるペプチドは、MHCクラスI分子に結合し、細胞表面に提示されます。これにより、キラーT細胞がヘルペスウイルスに感染した細胞を攻撃できるようになります。
MHCとは: MHCは、免疫システムにおいて重要な役割を果たす遺伝子群で、異物を認識して免疫反応を開始するT細胞の働きを支えています。ヒトではHLA(ヒト白血球型抗原)と呼ばれます。
MHCクラスI: MHCにはクラスIとクラスIIの分子があり、クラスI分子は主に細胞内で生成された抗原(例えば、ウイルス感染細胞内で生成されたウイルス由来のタンパク質)をT細胞に提示します。
ペプチド抗原:MHC分子に乗せられるのは、タンパク質の断片であるペプチドです。ヘルペスウイルスのペプチドも、MHCクラスI分子に結合してT細胞に提示されます。
免疫反応: MHC分子に提示されたペプチド抗原を、T細胞が認識することで、免疫反応が起こります。具体的には、キラーT細胞がヘルペスウイルスに感染した細胞を攻撃し、排除します。
簡単に言うと、ヘルペスウイルスのペプチドはMHCに乗せてT細胞に提示され、免疫システムがウイルスを認識し攻撃するのに役立つということです。
PD-1(Programmed cell death protein 1)は、免疫細胞の表面に発現するタンパク質で、免疫反応を抑制する役割を担っています。
PD-1には、PD-L1とPD-L2という2つのリガンドが存在し、これらがPD-1と結合することで、免疫細胞の活性化を抑制します。
PD-1/PD-L1経路は、がん細胞が免疫細胞による攻撃から逃れるために利用されることがあります。がん細胞はPD-L1を発現し、T細胞上のPD-1と結合することで、T細胞の活性化を抑制し、免疫による攻撃を回避します。
PD-1阻害薬やPD-L1阻害薬は、PD-1/PD-L1経路を阻害することで、T細胞の活性化を回復させ、がん細胞を攻撃できるようにします。
PD-1/PD-L1経路は、がん免疫療法において重要な役割を果たしており、PD-1阻害薬やPD-L1阻害薬は、様々ながん腫の治療に用いられています。
CTLA-4とPD-1は共に免疫チェックポイントタンパク質として機能し、戦いの終結とともにT細胞を「退役」させる。これらのチェックポイント・タンパク質は、「負の免疫抑制因子」タンパク質なのです。
外来抗原の除去とそれに続く活性化の停止により、免疫系は追放された侵略者を防御するための武器の生産を停止する。とはいえ、闘争中に作られた武器の多くは戦場に残り、このような時代遅れの武器の備蓄は何とかして排除しなければならない。幸いなことに、この問題の一部は、これらの兵器の多くを短命化することで解決される。
大規模な侵攻の際には、血液中から大量の好中球が動員されるが、これらの細胞は数日後には死滅するようにプログラムされている。同様に、ナチュラルキラー細胞の半減期は1週間ほどしかない。従って、いったん採用が中止されると、好中球とNK細胞の備蓄はすぐに枯渇する。さらに、ナチュラルキラー細胞はIFN-γを供給してマクロファージを活性化させているため、NK細胞が死滅すると、マクロファージは休息状態に戻る傾向がある。
樹状細胞はリンパ節に到達すると1週間ほどしか生きられず、血漿B細胞は5日ほど重労働をすると死んでしまう。その結果、Th細胞やB細胞の活性化が衰えると、侵入者に特異的な血漿B細胞の数は減少する。さらに、形質細胞が産生する抗体の寿命は短く、最も寿命の長いもの(IgGクラス)の半減期はわずか3週間程度である。その結果、一旦血漿B細胞が産生されなくなると、侵入者に特異的な抗体の数は急速に減少する。
免疫系の武器の多くは短命であるが、T細胞はこの “ルール “の重要な例外である。好中球のような細胞は短時間で自己破壊するようにプログラムされているが、T細胞は長生きするように設計されている。その理由は、ナイーブなT細胞は二次リンパ器官を何度も何度も循環し、特定の抗原を探し求めなければならないからである。その結果、T細胞が短命であれば、非常にもったいないことになる。一方、T細胞が活性化され、攻撃に反応して増殖し、侵入者を撃退した後は、T細胞の寿命が大きな問題となる可能性がある。実際、ある種のウイルス感染の最盛期には、全T細胞の10%以上がその特定のウイルスを認識している。もしこれらの細胞のほとんどが除去されなければ、私たちの体はすぐに、過去の侵略者から私たちを守ることしかできない時代遅れのT細胞でいっぱいになってしまうだろう。幸いなことに、この問題は活性化誘導性細胞死(AICD)によって解決される。活性化誘導性細胞死とは、戦いの過程で何度も再刺激された後、死滅したT細胞を排除する方法である。その仕組みはこうだ。
CTLはその表面にFasリガンドと呼ばれるタンパク質を顕著に表示しており、このタンパク質を標的細胞の表面に存在する結合パートナーであるFasに差し込むことによって殺傷するのが一つの方法である。これらのタンパク質が結合すると、標的細胞はアポトーシスによって自殺する。処女T細胞は、自分自身のFasタンパク質のライゲーションに反応しないように 「配線 」されている。しかし、T細胞が活性化され、攻撃中に何度も再活性化されると、その内部配線が変化する。この過程で、T細胞は自分自身のFasリガンドタンパク質、あるいは他のT細胞上のFasLによるFasタンパク質のライゲーションにますます敏感になる。この特徴により、これらの 「疲弊した 」T細胞は、Fasを介した殺傷(自殺か殺人のいずれか)の標的となる。このメカニズムにより、活性化誘導性細胞死は、繰り返し活性化されたT細胞を排除し、私たちを殺そうとする次の微生物から私たちを守ってくれる新しいT細胞のための場所を作るのである。実際、一度侵略者を打ち負かすと、その攻撃に反応したT細胞の90%以上が死滅するのが普通である。
誘導性制御性T細胞(iTregs)はヘルパーT細胞であり、私たちが危険な侵入者に脅かされていないとき、免疫系を “平静 “に保つように設計されたサイトカインを分泌する。そして、現実の脅威に対処した後は、免疫系をオフにし、時代遅れの武器を廃棄することが重要である。システムの継続的な活性化は、外来抗原の存在に依存しているため、侵入者が破壊されると、システムの活性化レベルは低下する。さらに、再活性化を繰り返したT細胞は、その表面にチェックポイントタンパク質を発現する。これらの “負の制御因子 “は、T細胞の再活性化を困難にしたり(CTLA-4)、T細胞の機能を低下させたりする(PD-1)。さらに、多くの免疫戦士の寿命が短いため、もはや必要とされない武器の備蓄を減らすことができ、その努力に「疲れ果てた」T細胞は活性化誘導性細胞死によって排除される。これらすべてのメカニズムが組み合わさって、感染のたびにシステムが「リセット」され、次の攻撃に対処できるようになるのである。
