ヘルペスウイルスは細胞が有糸分裂を行うときにのみ細胞の染色体に感染する機会が2回だけしかないのです。
なのにヘルペスウイルスはどのようにすべての細胞の染色体のDNAに入り込み、細胞のDNAや遺伝子の組み換えを行って突然変異を細胞に引き起こすのか?
一回目は23本の染色体が父の染色体と母の染色体にそれぞれの相同染色体に分かれて合計46本になる時と更に46本がそれぞれ同じ染色体を2本ずつ作りますので合計92本の姉妹染色分体になるときだけです。ところがこの2回のチャンスに1回目は46本のどの染色体のゲノムに自分のゲノムを自由自在に感染させ組み込ませることができます。
しかも92本の姉妹染色分体のなった時には2倍の92本のそれぞれの姉妹染色分体に自分のゲノムを92本の細胞のゲノムのどこの部位にも相同染色体のゲノムDNAに組み込むのと同じように好きなよう組み込ませることが出来ます。ヘルペスウイルスがどのように細胞のゲノムDNAに自分のゲノムDNAを組み込ませその結果細胞のDNAや細胞の遺伝子を遺伝子部位特異的組み替えと言われるやり方で細胞の遺伝子を組み替えてしまうのです。
どのようにヘルペスウイルスが感染細胞のゲノムDNAに侵入して遺伝子DNAの組み換えをも行うのかは基本的にはバクテリアファージと言われる「細菌だけに感染するウイルス」が宿主である細菌のDNAに入り込むときに使う機構はヘルペスウイルスがヒトの細胞のゲノムに入り込む機構と極めて似ているのです。
代表的なバクテリアファージの例は「λファージ」が細菌の大腸菌のDNAに入り込むときに「λインテグラーゼ」という酵素を使って大腸菌のDNAに入り込む時とか、あるいは「P1ファージ」細菌の「loxP部分」に入り込むときにはCreというDNA組み換え酵素を使う例があります。このように細菌だけに感染するウイルスであるバクテリアファージについては極め難解なので詳しくは後述します。
乞うご期待を!!因みにインテグラーゼはウイルスDNAを細胞染色体につなぎ合わせる酵素なのです。さらに転移因子が行う人の細胞のDNA組み換えも部位特異的組み換えと似ているので転移因子についても極めて興味をそそるテーマですので必ず詳しく後述します。乞うご期待を!!
ラムダファージは バクテリオファージラムダとも言われ溶原性DNAウィルスです。溶原性DNAウィルスの溶原性とは、細菌に感染した後に宿主細菌のDNAに取り込まれて、細胞を破壊することなく細胞と共存する性質を指します。バクテリオファージラムダ(lambda phage)は、大腸菌を宿主として感染するウイルスで、遺伝生化学の発展に重要な役割を果たしました。
バクテリオファージ(ファージ)は、細菌に感染してその細胞内で増殖するウイルスで、20世紀初頭に発見されました。小さすぎて光学顕微鏡では観察できず、電子顕微鏡によって初めて見ることができました。
ラムダファージは、ウイルス粒子の中では直鎖2重鎖DNAの形をとっており、両端にcohesive endという部位があります。ファージは、宿主の大腸菌の分泌物を感じ、長い尾繊維で表面を探り当て、細胞壁にスパイクを差し入れてDNAを注入し感染します。
ファージはゲノムが小さく系が比較的単純なため、分子生物学の初期によく使われていたモデル生物です。現在でもDNA複製、遺伝子発現、組換えの基本的な研究に使われています。
溶原性DNAウィルスは、細菌に感染するバクテリオファージ(ファージ)の一種で、テンペレートファージとも呼ばれます。感染後に宿主細菌のDNAに取り込まれたファージはプロファージと呼ばれ、プロファージを持った宿主菌は溶原菌と呼ばれます。
大腸菌は原核生物で、真核生物ではありません。生物は真核生物と原核生物に分類され、大腸菌は原核生物に属します。原核生物は核膜に囲まれた核がなく、細胞小器官も存在しません。一方、真核生物は細胞内に核と呼ばれる膜で囲まれたDNAを含む構造があり、細胞小器官が存在します。原核細胞の大きさは、直径1マイクロ メートルから10マイクロメートルととても小さいのに対して、ほとんどの真核細胞の 大きさは直径約 5 マイクロメートルから100マイクロメートルの大きさです。 そして、 真核生物の細胞小器官と原核生物の細胞とはほとんど同じ大きさです。
核膜があるかないかによって、DNAの構造や細胞の機能などがどのように異なるのか?核膜の主な働きは、細胞核内の遺伝物質を保護し、細胞質との間で物質の選択的な交換を可能にすることです。 この交換は、核膜に存在する多数の核膜孔を通じて行われます。 核膜は内膜と外膜の二重構造を持ち、この二重構造は核膜孔複合体によって貫通されています。核膜がある真核生物と、核膜がない原核生物の違いは次のとおりです。
核膜がある真核生物と、核膜がない原核生物の違いは何ですか?DNAの構造の違いは真核生物では核膜によってDNAが包まれた球形の構造である核内にDNAが存在し、直鎖二本鎖DNAを形成しています。一方、原核生物ではDNAが細胞内に裸で存在しており、環状二本鎖DNAを形成しています。
真核生物と原核生物の細胞の機能の違いは何か?真核生物の核は細胞の司令塔とも呼ばれ、細胞の成長や修復、再生などをつかさどっています。真核生物と原核生物のその他の違いとしては、原核生物は単細胞生物で、細菌などが代表例です。真核生物の細胞は原核生物の細胞よりも大きく、直径は約5マイクロメートルから100マイクロメートルです。真核生物のDNA量は原核生物よりも多く、ヒトの体細胞1つは約2mの長さのDNAを持っています。
細菌の代表例である大腸菌は腸内細菌の一種で、短径0.7 µm、長径2~4 µmの短い棒状の単細胞生物です。細胞分裂によって増殖し、好気条件でも嫌気条件でも生育できます。大腸菌の染色体は、真核生物の染色体のような複雑な構造ではなく、1本のDNA分子が環状につながった単純なものです。
大腸菌などの細菌に感染するウイルスであるバクテリオファージ(ファージ)には、細菌に感染して完全に細菌を殺してしまう溶菌性と、潜伏感染をする溶原性という2つのライフサイクルがあります。溶菌性感染は強毒サイクルで、細菌内で増殖して宿主細菌の細胞膜を破壊して細胞を殺して細菌外に放出されます。一方、溶原性感染は宿主細菌の環状染色体にゲノムが挿入されて組み込まれ、細菌と共生していきます。
λインテグラーゼとは、溶原性のラムダファージのゲノムが宿主DNAに組み込まれる際に、宿主DNA上の特異的な組み込み部位に作用し、DNAの組換えを起こす酵素です。レトロウイルスが感染する際に、逆転写酵素によってDNAに変換されたウイルスゲノムを宿主細胞の核内染色体に組み込む酵素です。元来インテグラーゼは,レトロウイルスが感染を成立する際に,逆転写酵素によりDNAに変換されたウイルスゲノムを宿主細胞の核内染色体に組み込む酵素であり、レトロウイルスのDNA宿主細胞の DNAと「統合する」という英語の「インテグレイション」から来た「統合する酵素」というインテグラーゼが生まれたのです。
勿論λファージはレトロウイルスではありません。λファージはバクテリオファージに分類され、細菌に感染するウイルスです。一方、レトロウイルスはRNA型のウイルスで、動植物細胞に感染します。
レトロウイルスは、ウイルス粒子中に逆転写酵素を持ち、RNA→DNA→RNAの形式で複製します。細胞に感染すると、吸着、侵入、逆転写、宿主染色体への組込み、RNA合成、蛋白質合成、アセンブリー・放出、成熟といった各段階を経て増殖します。
代表的なレトロウイルスはエイズウイルス(HIV-1)、ヒトやマウスに白血病をおこすウイルス(ヒトT細胞白血病ウイルスやマウス白血病ウイルス)などです。
HIVのようなレトロウイルス(retrovirus)は、特にたちが悪いのはほとんどのウイルスは細胞に感染すると、新たなウイルスのコピーを多数作らせ、細胞を使い尽くすと細胞から出て行く。一方、レトロウイルスが特にたちが悪いのは感染するのに長期間に渡る方法を使い、レトロウイルスは細胞に入り込むとまず、ウイルス自身のゲノムDNAのコピーを作る。そして、そのウイルスゲノムを宿主細胞自身のDNAの中へ挿入する。このレトロウイルスのDNAと宿主細胞のDNAが統合されたDNAはすぐにウイルスを作るのに使うこともできるし、休眠状態で待機しウイルス増殖を開始するのに最適な免疫が落ちる時を待つこともできる。これがHIVとの闘いを困難にしている数々ある理由の一つである。レトロウイルスは、長く生きながらえる細胞の中で、何年にも渡って留まり待ち続けることができるのである。
インテグラーゼはウイルスDNAを細胞染色体につなぎ合わせる(統合:integration)する酵素であるのでインテグラーゼと言われるのです。4つの同じインテグラーゼがウイルスDNAの両端をつかみ、インタソーム(intasome)と呼ばれる安定な複合体を作る。インタソーム(intasome)とは、ウイルスがヒトの細胞に侵入した際に形成されるウイルスDNA鎖とHIVタンパク質インテグラーゼで構成された複合体です。ウイルス感染を可能にするウイルスの重要な構造で、ウイルスの遺伝物質を人間のDNAに組み込むために必要な化学反応を実行します。
インタソームの形成は、ウイルスDNAの両端をつかむ4つの同じインテグラーゼが安定な複合体を作ることで行われます。インタソームは、宿主クロマチンと相互作用して、ウイルスの遺伝物質を人間のDNAに組み込みことができます。このインタソームは次に細胞DNAに結合して、ウイルスDNA鎖転移反応を行ない、ウイルスDNAを細胞DNAに組み入れてDNAの統合を行うのです。
バクテリオファージP1ファージがloxP部分に入り込む仕組みとはP1ファージが宿主である大腸菌内で複製される際に自身のゲノムを環状化するための組換えシステムである。Cre/loxPシステムとは、DNA組換え酵素CreとloxP配列という大腸菌のDNA配列の相互作用を利用して遺伝子を組み換える方法です。遺伝子工学や発生工学の分野で、特定の遺伝子を特定の組織や時間、条件で欠失させる(ノックアウト)や挿入(ノックイン)するために使用されています。
Cre/loxPシステムの原理とは大腸菌の遺伝子にloxP配列があり、Cre組換え酵素が存在すると、Cre組換え酵素はloxP配列の両端の逆位反復配列と結合して二量体を形成します。この二量体は他のloxP部位の二量体と結合して四量体を形成します。
続いて、loxP部位の間のDNA配列はCre組換え酵素によって切り落とされ、切り口はDNA連結酵素によって再接続されます。Cre/loxPシステムは、効率が高く、特異性も強いツールです。また、生物の異なる組織や生理条件でも作用するため、応用範囲も広いと言えます。
Cre/loxPシステムは、条件付きノックアウトマウス(conditional gene knock out or knock in)の作成にも広く使用されています。Cre/loxPシステムとはloxP配列と呼ばれるDNA配列に対しDNA組換え酵素Creが働くことにより生じる部位特異的組換え反応を利用した遺伝子組換え実験系である。 本来、バクテリオファージP1が宿主である大腸菌内で複製される際に自身のゲノムを環状化するための組換えシステムである。
Creレコンビナーゼ(組換え酵素)とはバクテリオファージP1に由来し、TypeIトポイソメラーゼに分類される約38kDaのDNA組換え酵素でloxP配列とよばれる塩基配列を認識し組換えを起こす。トポイソメラーゼ(topoisomerase)とは、細胞核内のDNAの立体構造を維持したり変化させたりする酵素です。DNAの複製や転写、細胞の増殖など、DNAに過剰なねじれが生じる核内過程において重要な役割を担っています。トポイソメラーゼにはI型とII型があり、それぞれがDNAのらせん構造を切断する方式が異なります。①I型:DNAのらせん構造を1本切断して結合させる②II型:DNAのらせん構造を2本同時に切断して結合させる。
トポイソメラーゼの働きを阻害する薬剤はトポイソメラーゼ阻害薬と呼ばれ抗癌剤として重要であるといわれていますが、全く意味のない抗がん剤です。がんの原因であるヘルペスウイルスと関りがないからです。トポイソメラーゼとDNAが作る共有結合性複合体を安定化することで、DNA複製装置の進行を妨げ、がん細胞の細胞死を引き起こします。更にトポイソメラーゼ(topoisomerase)は、細胞核内のDNAの立体構造を維持したり変化させたりする酵素で、DNAの複製や転写、細胞の増殖など、DNAに過剰なねじれが生じる核内過程において重要な役割を担っている働きにも異常が出ることになるからです。
大腸菌のloxP配列とはloxP配列は大腸菌のDNAに存在する配列です。loxP配列は、バクテリオファージP1のゲノム中にも存在する34塩基の特定のDNA配列で、遺伝子組換え実験において重要な役割を果たします。バクテリオファージP1ゲノムに由来する下に示した様に全部で34bpのDNA配列で両末端に存在するCre結合部位13は対称に、中心部の8bpの部分は非対称な配列になっている。大腸菌のloxP配列がバクテリオファージP1のゲノムに由来している理由は、バクテリオファージP1が宿主である大腸菌内で複製する際に、自身のゲノムを環状化するための組換えシステムとしてloxP配列を利用しているためです。
loxP(locus of crosssover P1)は、バクテリオファージP1のゲノム中に存在する34塩基からなる特定のDNA配列で、部位特異的組換え反応(Cre-loxPシステム)において標的となります。
Cre-loxPシステムでは、DNA組換え酵素CreがloxP配列を認識し、DNA分子の特定の配列同士の間で組換えを起こします。このシステムは、特定の遺伝子のエクソンを欠損させるなどの目的で使用されています。
5′-ATAACTTCGTATA―GCATACAT―TATACGAAGTTAT-3′
Cre-loxPの英語はCauses recombination – locus of crossover(x) P1です。Creという頭字語は当初、「組換えを引き起こす(Causes recombination)」という言葉に由来していましたが、今日では「環化リコンビナーゼ」という短縮形でも呼ばれています。リコンビナーゼは組換え酵素の意味で、この酵素は、loxPサイトとして知られる大腸菌の特定のDNA配列を認識し、それと相互作用する特有の性質を持っています。
LoxPサイトとは、”locus of crosssover (x) P1 “の略で、crosssoverは「交差」「重複」「X」で示します。中心の8塩基対のコア(中心)配列スペーサー領域で区切られた2つの13塩基対のインバーテッドかつパリンドローム・リピート(逆位反復配列)からなる特定のDNA配列です。インバーテッドは「ひっくり返した」とか「逆さまの」とか「逆位」の意味でありパリンドロームとは「前後どちらから読んでも同じ語句や文」でありリピートは「繰り返し」「反復」の意味です。
Creリコンビナーゼは部位特異的リコンビナーゼであり、13塩基対のインバーテッド・リピートを認識し、コア領域の配列がCre-loxシステムに方向性を与えます。2つのloxPサイトが逆方向を向いていると、Creリコンビナーゼは2つのサイト間のDNAセグメントを反転させます。逆に、2つのloxPサイトが同じ方向でDNAセグメントを挟むと、Creリコンビナーゼはサイト間のセグメントを切除し、遺伝情報を欠失させるのです。ゲノムの異なる場所に同じ方向を向いたloxPサイトを対にすると、転座が可能になります。
CreとloxP配列の反応については 2つのloxP配列が同方向に位置している場合、CreによりloxP配列間の遺伝子は切り出され環状化する(図1)。この反応は平衡反応であるが切り出され環状化した遺伝子断片が元の状態に戻ることは極めて稀である。
また、2つのloxP配列が異なる方向に位置しているときはCreによりloxP間の遺伝子は反転する
loxP配列は大腸菌のDNAに存在する配列です。loxP配列は、バクテリオファージP1のゲノム中に存在する34塩基の特定のDNA配列で、遺伝子組換え実験において重要な役割を果たします。
loxP配列とは、8塩基対のコア配列スペーサー領域で区切られた2つの13塩基対のインバーテッドかつパリンドローム・リピート(逆位反復配列)から構成されています。loxPは「locus of crosssover (x) P1」の略で、loxはlocus of crossing over、PはファージP1に由来しています。
loxP配列とDNA組換え酵素Creを組み合わせたCre/loxPシステムは、部位特異的組換え反応を利用した遺伝子組換え実験系です。Creタンパク質はloxP配列を認識してDNA分子の特定の配列同士で組換えを起こし、特定の遺伝子のエクソンを欠損させることができます。
herpesウイルスが人の細胞のDNAを部位特異的組み換えを行いDNA変異させるやり方は、「転移因子」のやり方にも極めて似ています。「転移因子」とは何でしょうか?
「転移因子」とは転移因子(トランスポゾン)とは、細胞内のゲノム上の位置を移動する(転移する)DNA配列です。宿主ゲノムの他の領域にそれ自身のコピーを挿入する能力を有しており、ゲノム構造の多様性やゲノムサイズに大きな影響を与えています。
転移因子は、その転移機序や転移様式によって分類されます。
転移機序による分類:DNA(型)トランスポゾンとレトロトランスポゾンに分類されます。DNA(型)トランスポゾンはカット&ペースト型の転移を行うのに対し、レトロトランスポゾンはコピー&ペースト型の転移を行います。
転移様式による分類:自律型と非自律型に分類されます。自律型は、その配列自身がコードする転移酵素を利用して転移します。一方、非自律型は転移のための酵素コードしておらず、自律型の転移因子から発現した酵素を利用して転移します。
転移因子は、宿主ゲノムの構造変化を引き起こし、ゲノム進化の原動力となる可能性があります。また、遺伝学的ツールとして用いられる場合もあります。
トランスポゾン(Transposable elements、略語TEs)の同義語:、Jumping genesであり広義には細胞内でゲノム上の位置を移動する(転移する)DNA配列を指し、狭義にはその一種であるDNA(型)トランスポゾンを指す。前者は一般的に転移因子と呼ばれ、時にJumping genesとも呼ばれる。転移因子の中でも特にレトロポゾンはゲノム中で膨大なコピー数が存在し、例えばヒトゲノムの46%を占めるなど、ゲノム構造の多様性およびゲノムサイズに大きな影響を与えている。また、転移という特徴を利用し、遺伝学的ツールとして用いることができる。例えばP elementとよばれる転移因子を生体内で転移させることで変異体を多数作成し、特定の表現型を示す個体を選別してその原因となる転移因子の挿入サイトを特定することができる。ゲノムへの遺伝子導入への応用も広くおこなわれている。
転移因子の発見の歴史
転移因子の存在は、1950年にバーバラ・マクリントック(Barbara McClintock, 1902 – 1992年)によって提唱された。マクリントックは斑入りのトウモロコシの染色体を調べることで、斑の形成に関わる遺伝子座が染色体の異なる位置に移動することを発見し、この現象をトランスポジションと名付けた。しかし、遺伝子が染色体内を移動するといった概念は当時の常識をはるかに越えており、マクリントックの学説はほとんど受け入れられることは無かった。その後1960年代後半から70年代前半にかけて、バクテリアや酵母で「動く遺伝子」が発見されるようになり、それらはトランスポゾンと名付けられた。またマクリントックが発見したトウモロコシの斑の形成に関わる遺伝子座もDNAトランスポゾンの一種であることが明らかにされた。こうしてマクリントックが提唱した学説は認められるようになり、1983年には単独女性として初めてノーベル医学生理学賞を受賞した。
転移因子の分類
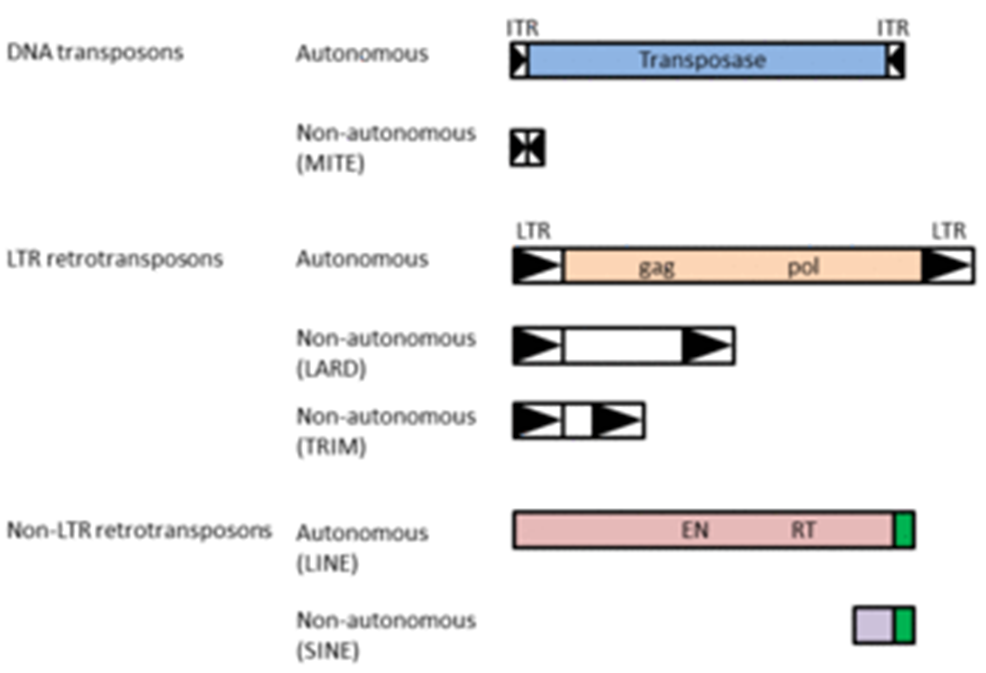
図.転移因子の構造
転移因子は、その転移機序に応じて2つのクラスに分類される。1つはカット&ペースト型の転移をするDNA(型)トランスポゾンであり、その転移機構をトランスポジションと呼ぶ。もう1つはレトロトランスポジション(またはレトロポジション)と呼ばれる転移機序を持つレトロトランスポゾンであり、いわゆるコピー&ペースト型の転移をおこなう。
またそれぞれの転移因子は、その転移様式によって自律型と非自律型に分類できる。自律型の転移因子は、その配列自身がコードする転移酵素(レトロトランスポゾンの場合は逆転写酵素)を利用して転移する。一方で非自律型の転移因子は転移のための酵素コードしておらず、自律型の転移因子から発現した酵素を利用して転移する。そのため、自律型のみならず非自律型の転移因子も、転移酵素や逆転写酵素の認識配列を持つのが一般的である。
DNAトランスポゾンやレトロトランスポゾンは、その転移機序と進化的起源によって細かく分類されている。特に最近は膨大なゲノム情報の蓄積によって、新規の転移因子ファミリーが次々と発見されており、中にはこれまでの分類に当てはまらない転移因子が発見されることもある。
DNA(型)トランスポゾン
クラスIIトランスポゾンとも呼ばれ、トランスポザーゼ(transposase)と呼ばれる転移酵素をコードしている。このトランスポザーゼがトランスポゾンの両末端にある逆向き配列(inverted repeat)を認識してゲノムから切り出し、切り出されたトランスポゾンDNAをゲノム上の別の位置に再び挿入させる。DNAトランスポゾンの種類によって、挿入のターゲットとなるゲノム配列の選好性は異なる。
DNAトランスポゾンは自律性と非自律性の2種類に分けられる。自律性トランスポゾンは上記のように内部にコードするトランスポザーゼを用いて転移する。一方で非自律性の因子は、内部にタンパク質をコードしておらず、自律性因子と類似した逆向き配列を持つ数百塩基対程度の短い因子である。一般にこうした短い非自律性トランスポゾンはminiature inverted-repeat transposable element(MITE)と呼ばれている。非自律性因子は自律性因子がコードするトランスポザーゼを利用して転移する。
レトロトランスポゾン
クラスIトランスポゾンとも呼ばれる。転移の際、まずレトロトランスポゾン配列が内部プロモーターによって転写され、自身がコードする逆転写酵素が翻訳される。逆転写酵素はレトロトランスポゾンRNAを鋳型としてcDNAを合成し、それをゲノム上の別の位置に挿入させる。したがってすべてのレトロポジションはレトロポゾン配列のコピー数の増加を伴い、ゲノムサイズに大きな影響を与えることが知られている。レトロトランスポゾンはlong terminal repeat(LTR)型レトロトランスポゾン、およびLINElong interspersed element(LINE)(非LTR型レトロトランスポゾンとも呼ばれる)に大別され、それぞれ次のように異なる転移機序を持つ。
LTR型レトロトランスポゾンは両末端に数百~数千塩基対の反復配列(LTR)を持ち、内部に逆転写酵素とインテグラーゼをコードしている。レトロウイルスはLTRに加えて内部にenv遺伝子を持つが、分類上LTR型レトロトランスポゾンに含まれることが多い。LTR型レトロトランスポゾンにもLTRのみを持つ非自律性因子が知られており、それらは長さに応じてLARDやTRIMと呼ばれることもある。
LINEは内部に逆転写酵素とエンドヌクレアーゼをコードする。LINEタンパク質はLINE RNAの3’末端配列を認識して結合し、逆転写およびゲノムへの挿入をおこなう。LINEには様々な種類が知られており、生物群ごとにそれぞれ異なる種類のLINEがゲノムの大きな割合を占める。例えば哺乳類ではL1と呼ばれるLINEが主要であり、例えばヒトゲノムの約17%はL1が占めている。一方、ニワトリゲノムではCR1、ゼブラフィッシュではL2がレトロトランスポゾンの中で最も大きな割合を占める。
さらにLINEに関連する非自律性因子として、short interspersed elements(SINE)が知られている。多くのSINEはtRNAに起源を持ち、RNA polymerase IIIによって転写されたSINE RNAが、LINEタンパク質を利用して転移する。そのためSINEの3’末端配列がLINEの3’末端配列と類似している例が数多く報告されている。SINEは進化的に異なる系統で独立に生成する場合が多く見られる。例えば霊長類のAlu、齧歯類のB1やB2など、哺乳類では目あるいは科レベルで独自のSINEを持つ。Aluはヒトゲノムの10%を占めており、そのコピー数は100万を超える。
転移因子のゲノムにおける影響
一般的に転移因子は、ゲノム中を移動するだけの利己的DNAあるいは寄生因子にすぎないと見なされる場合が多い。それでも、膨大なコピー数が存在し転移を繰り返していることから、その影響は無視できないものとなっている。例えば、転移因子が遺伝子内部に挿入されることで血友病や癌などの疾患をもたらす例が知られている。また複数の転移因子の間で非相同組換えが起こり、ゲノム構造を改変することもある。
また進化的視点から考えると、ゲノムサイズの増大、およびゲノム構造の多様化に大きな影響を与えており、ゲノムの重要な構成要素として認識されている。ゲノム中で転移因子の占める割合は、ヒトでは46%、トウモロコシでは80%以上であり、ゲノムサイズを決定する主要因となっている。一方で転移因子の水平伝播が起こっていることも知られているが、その詳細なメカニズムはほとんど明らかになっていない。
転移因子は上述のように有害な影響を及ぼす可能性があることから、一般の細胞内では転移が抑制されていることが多い。例外として、生殖細胞および脳神経細胞では転移が観察されており、特にニューロンのモザイク性を生み出している可能性が指摘されている。しかしなぜこれらの細胞内のみで転移可能なのかは明らかになっていない。体細胞における抑制機構としては、転移因子配列のメチル化やヘテロクロマチン化などのエピジェネティックな制御を受けていることが知られている。また、small RNAによる抑制も受けていることが近年明らかになってきている。
転移因子の挿入は進化的に中立の変異であり、一般にその配列は進化の過程で塩基置換が蓄積し、やがて転移因子であることの検出が困難になると考えられる。しかし例外的に、その過程で転移因子由来の配列が生物の生存に有利な何らかの機能を獲得する場合が知られている(exaptationまたはco-optionとも呼ばれる)。それらの配列は進化的に保存されることが多く、特に有胎盤類では、保存領域の16%が転移因子に由来することが分かっている(編集 林 コメント:この文献はmarsupialとありますので、有袋類ではないでしょうか)。転移因子が獲得した機能としては、遺伝子のエキソン化や選択的スプライシングの生成といったタンパク質コード配列の改変に加え、エンハンサーやインシュレーターなどの調節配列となることが知られている。特に哺乳類の脳において複数のレトロポゾンがエンハンサー機能を有することが報告されており、哺乳類の脳の形成に関与したexaptationの好例として知られている。
転移因子の生物学的利用
また、転移という特徴を利用し、転移因子を遺伝学的ツールとして用いることができる。具体的な利用方法の1つとして、転移因子を用いた順遺伝学的スクリーニングがある。これは転移因子を生体内で転移させることで変異体を多数作成し、特定の表現型を示す個体を選別してその原因となる転移因子の挿入サイトを特定する方法である。代表的なものとして、P element、Sleeping beauty、piggyBac、Tol2などが用いられている。この手法は、ショウジョウバエをはじめ、ゼブラフィッシュやマウスなどの脊椎動物でも幅広く用いられている。
また転移因子を利用したゲノムへの遺伝子導入、すなわち遺伝子組み換え生物の作成も広くおこなわれている。目的遺伝子の両端にDNAトランスポゾンの末端配列を付加したコンストラクトを胚へ導入し、トランスポゼースを利用して転移させることで、効率良くゲノム中に導入することができる。この方法では、piggyBacやTol2がよく利用されている。
最後にherpesウイルスの細胞のゲノムDNAに感染して遺伝子の形質転換をもたらすよく似た挙動を示すプラスミドについて説明しておきます。
プラスミドは適切な宿主内で自律的に複製できるDNAの単位であるレプリコンと見なされる。レプリコンとはし、ウイルスゲノムのようなプラスミドは、一般的に生命として分類されていない。プラスミドは、主に接合を介した形質転換というプロセスにより、ある細胞から別の細胞へと移動しうる。この遺伝物質の宿主から宿主への伝播は、遺伝子水平伝播のメカニズムの1つであり、そのためプラスミドはモバイロームの一種であると言える。モバイローム( mobilome)とは、ゲノム中の可動遺伝因子の総体であり、真核生物、原核生物、ウイルスでみられる。 モバイロームの構成は生命の系統によって異なり、真核生物のモバイロームの中心はトランスポゾンであるのに対し、原核生物ではプロファージやプラスミドが主要な要素である。キャプシドと呼ばれる保護タンパク質コートに遺伝物質を包むウイルスとは異なり、プラスミドは裸のDNAであり、新しい宿主に移すために遺伝物質を包むのに必要な遺伝子をコードしていない。ただし、一部のクラスのプラスミドは、自身の転移に必要な共役性線毛をコードしている。プラスミドのサイズは1-200kbp以上までとさまざまであり、細胞内のプラスミドのコピー数も1から状況によっては数千程度まで増加する。ウイルスと区別するために、プラスミドは染色体の外側に排他的または主に存在し、自律的に複製するという定義がなされた。
自律的に複製したり染色体に組み込まれたりする可能性のある染色体外遺伝物質を指す言葉として、エピソームという用語が生まれたのですが、しかしその後、プラスミドという用語が染色体外の自律的に複製するDNAとして広く使用されるようになった。
今日でも、原核生物の文脈においてプラスミドを見ると、染色体に組み込むことができるプラスミドのことを「エピソーム」と呼称してもよいのです。エピソームは複数世代にわたって細胞内で安定して維持される可能性があるが、ある段階ではそれらは独立したプラスミド分子として存在しているのです。一方で真核生物の文脈でエピソームを見ると、エピソームという用語は、核内で複製される可能性のある、統合されていない染色体外の閉じた環状DNA分子を意味するために使用されています。正にヘルペスウイルス、アデノウイルス、ポリオーマウイルスなどのウイルスがこの最も一般的な例であるので、これらの特色はプラスミドでもあるのでこの観点から眺めるとヘルペスウイルスもプラスミドでもあると言ってもいいのです。他のプラスミドの例としては、人工遺伝子増幅中または病理学的プロセスの一つである、癌細胞の形質転換で発生する二重微小染色体などの、異常な染色体断片が含まれます。
二重微小染色体(Double minute略してDM)とは何でしょうか?二重微小染色体(Double minute略してDM)はダブルマイニュート染色体とも言われ、染色体外DNAの小断片であり、乳癌、肺癌、卵巣癌、大腸癌、そして特に神経芽細胞腫など多数のヒト腫瘍で観察されます。これらは、悪性腫瘍成長の間に複製された異常な遺伝子増幅の兆候であり、ヘルペスによる遺伝子変異によって生み出された癌細胞の成長と生存の勢いに優位を与えている証拠なのです。
癌細胞はどのように異常な二重微小染色体(DM)を生み出すのか?DMは、がん細胞中で遺伝子増幅した癌遺伝子から作られており、数メガ塩基対の巨大な環状DNAからなっておりヘルペスによって過剰でかつ異常な癌細胞の遺伝子の複製を物語っているのです。プラスミドの特徴である環状DNAですからテロメア構造を持たないのです。二重微小染色体(DM)はセントロメアも持たない。セントロメアを持たないから、細胞分裂期に不均等に娘細胞に分配される。しかし、セントロメアを持たないのに安定に娘細胞に伝わってゆく。これは、二重微小染色体(DM)が癌の分裂期染色体に付着することにより分配されるからである。これを、癌増殖のヒッチハイク機構と呼んでいます。この二重微小染色体(DM)もherpesウイルスが生み出した所産であるのです。herpesウイルスがプラスミドであるように二重微小染色体(DM)もプラスミドの一つなのです。
真核生物のエピソームは、DNAが安定して維持され、宿主細胞で複製されるという点で、原核生物のプラスミドと同様に作用しています。ヘルペスウイルスなどの一部のエピソームは、バクテリオファージ(バクテリオファージウイルス)と同様に、ローリングサークルのメカニズムにより複製を行うことができます。他のものは、双方向複製メカニズムを介して複製する。いずれの場合も、エピソームは宿主細胞の染色体から物理的に分離されたままである。
双方向複製メカニズムとはゲノムの2本のDNAの複製が開始されるのは複製起点やまたは複製開始点や、レプリケーターと呼ばれる複製の開始点から始まります。英語でorigin of replication, replication origin, replicatorと言います。ゲノム上の特定の配列である点からゲノムの複製が開始されます。遺伝物質が世代間で伝達されるためには、細胞分裂に先立ってDNAが半保存的複製によって適切な時期に正確に複製され、各娘細胞が染色体を全て受け取ることが必要であるのです。この過程は原核生物や真核生物などの生物ではDNAの複製、ウイルスの場合はDNAまたはRNA(二本鎖RNAウイルスなどの場合)の複製を伴います。娘鎖の合成は複製起点と呼ばれる非連続的な特定の地点から始まり、全てのゲノムDNAが複製されるまで双方向的に進行する。こうしたイベントの基本的性質は共通であるものの、生物は多様な複製開始の制御戦略を進化させているのです。半保存的複製とは新たに、できた2本鎖 DNA のうち、半分はもとの DNA の鎖であるので、半分は塩基配列を保ったまま複製されているので、これを「半保存的複製」と言います。
4番目のヘルペスウイルスのエプスタインバーウイルスや8番目のヘルペスウイルスであるカポジ肉腫関連ヘルペスウイルスを含むいくつかの他の癌ウイルスは、癌細胞内に潜在的な染色体的に異なるエピソームとして維持されており、ウイルスは癌細胞の増殖を促進する腫瘍遺伝子を発現すると言われますがこれは間違いです。これらのherpesの癌ウイルスはヘルペスウイルスの遺伝子の中に癌を起こす潜在的な染色体的に異なる癌遺伝子エピソームとして維持されているのではないからです。元来癌細胞という細胞は存在しないのです。すべての細胞が持っている増殖の遺伝子をヘルペスウイルスが増殖過剰遺伝子に変異させてしまうから増殖過剰遺伝子になってしまっただけなのです。この世には癌細胞は存在しないのです。エピソームとはウイルスが細胞内のゲノムDNAに留まり細胞の遺伝子を簡単に変異させることが出来るのでウイルス潜伏の一形態で,染色体に組込まれずに環状DNAとして安定的に維持されているものを指すとされていますが実は染色体のゲノムDNAにヘルペスウイルスが潜伏感染しているわけですから,染色体に組込まれてしまっているので染色体の遺伝子DNAを簡単に突然変異させてしまうのですべての遺伝子病が生まれるのです。
