現代のガンについての理論と癌標準治療法はすべて間違っている。というよりも現代の癌に対する理論は何もないというべきです。だから癌を治すことが出来ないのです。論理的に正しい癌理論がないので治りもしない副作用が多すぎる「がん手術」をやりたがり「抗がん剤」を投与した最後は「抗がん剤」を投与したがります。その多すぎる間違いがなぜ起きるかの疑問と答えを出していきます。結論から言うと細胞の癌化はヘルペスが増殖遺伝子を変異させて「細胞の過剰増殖」もたらす変異した蛋白質を作っただけなのに「癌だ。癌だ。治療しないと死ぬよ」と脅かして延命治療どころか患者を苦しめて早死にさせてしまう間違ったがん医療が何故世界中で行われているのでしょうか?それはヘルペスウイルスが癌関連遺伝子(正しくは増殖関連遺伝子)を癌化(正しくは過剰増殖遺伝子化)に変異させるのはヘルペスウイルスであることを認めようとしないからです。発がんの正しい根本原因はヘルペスウイルスであることを認めない癌医療のすべてのがん医療の理論と臨床はすべて間違いなのは当然なのです。ヘルペスウイルスが癌関連遺伝子(増殖関連遺伝子)を変異させて癌が生まれたことを一顧だにしないからです。「群盲象を評す」というのが現代のガン医療界です。これからの医療も免疫を落とす医療でヘルペスが無限に増殖して癌患者が増えていくのは確実です。
三人に二人が癌になり、女性の二人に一人が癌になり、しかも癌が治る人が誰もいないという時代になりました。二人に一人が確実に癌で死にます。何故こんなひどい状況になってしまったのでしょうか?現代のガンについての理論と癌標準治療法はすべて間違っているからです。癌はそんなに恐ろしい病気なのでしょうか?
癌は何故起こるのでしょうか?癌は二つの細胞増殖に関する遺伝子の変異がヘルペスによってもたらされることによって発癌が開始されるのです。発がんに寄与する変異遺伝子には癌原遺伝子(癌遺伝子)と癌抑制遺伝子の二つがあります。この二つの癌原遺伝子(癌遺伝子)と癌抑制遺伝子を癌関連遺伝子と言います。
まず癌原遺伝子(癌遺伝子)の特徴は癌原遺伝子(癌遺伝子)が発現した変異した蛋白質産物が高い活性を持つからであり、その変異蛋白質その変異の効果を表すには対立遺伝子一つに変異が現れるだけで十分であるので癌原遺伝子(癌遺伝子)は優性です。一方癌抑制遺伝子の対立遺伝子の二つとも変異遺伝子となって初めて変異した蛋白が発現するので癌抑制遺伝子は対立遺伝子の両方とも変異を受ける必要があるので劣性遺伝子なのです。従って優性遺伝子である癌原遺伝子(癌遺伝子)が変異すると変異した増えた蛋白のために良性腫瘍が生まれるのですが本当の癌は生まれないのです。ところが残りの癌抑制遺伝子は劣性遺伝子なので対立遺伝子の一つだけが変異して変異したタンパク質が生まれても残りの正常な劣性遺伝子増殖を抑制できる正常なタンパク質を産生しているので癌にはならないのです。勿論、劣性遺伝子である癌抑制遺伝子の二つともが変異してしまうとその細胞は「癌細胞」になってしまうのです。多くの場合、癌抑制遺伝子の正常な増殖抑制機能喪失には両方の対立遺伝子の不活化を必要とするには、一つの対立遺伝子の変異ともうひとつの野生型対立遺伝子の欠損(ヘテロ接合性の喪失)によって起こることが多いのです。
実は二つの癌原遺伝子(癌遺伝子)と癌抑制遺伝子を癌関連遺伝子と呼ばれるのですが正常な遺伝子であるときには新旧の細胞を入れ替える時に新しい細胞を増殖するときに発現されるので癌原遺伝子(癌遺伝子)は増殖遺伝子といわれ、癌抑制遺伝子は増殖抑制遺伝子といわれるのです。従って癌原遺伝子(癌遺伝子)が変異したときには過剰増殖遺伝子と呼び癌抑制遺伝子を機能喪失増殖抑制遺伝子と読んだ方がわかりやすいのです。何故ならば癌は特別な事象ではなくヘルペスが感染した細胞の遺伝子の変異によって増殖過剰によって発がんしただけですから。因みに一つの細胞の遺伝子には総計、23500個の遺伝子があり、そのうち100~200個の癌原遺伝子(癌遺伝子、増殖遺伝子)と20~50個の癌抑制遺伝子(増殖抑制遺伝子)があるといわれています。今後さらに増えるといわれています。癌塊の大きさ、癌の悪性度、癌の進行度はヘルペスが人体に感染した細胞のゲノムの遺伝子の変異率で決まります。つまり1匹のヘルペスは全部で15万個の塩基でできたゲノム(DNA)を持っていますから1個の細胞は60億個の塩基でできたゲノム(DNA)を持っていますので60億÷15万で4百万匹のヘルペスウイルスのゲノムで細胞のゲノムをすべてあり得ないことですが入れ替えることができます。もちろんそうなれば細胞のタンパク質を指定する23500個の遺伝子のすべてを変異させることになりますがその時には新しい種が生まれることになるかもしれません。アッハッハ!!!!
癌の成長速度は何によって決まるか?何故癌の成長速度に関するデータが少ないのか?癌はヘルペスによる2種類の癌関連遺伝子(癌原遺伝子と癌抑制遺伝子の2つ)の癌化によって起こるので800個もある癌関連遺伝子の癌化のトータルの数によって決まることを現代の癌学者の誰も知らないのでの癌の成長速度に関するデータを集めようがないからです。仮にヘルペスによる2種類の癌関連遺伝子の癌化の数で癌の成長速度が決まるとわかったところで癌化した遺伝子の数を癌細胞の遺伝子を一つ一つを調べようがないからです。
がんは増大するにつれて成長速度が鈍ると言われているのか?逆に増大するにつれて成長速度が速くなるという人もいます。何故意見が異なるのでしょうか?ヘルペスによってつくられた癌細胞が増えれば増えるほど多くなったherpesビリオン(粒子)も癌細胞も増えていくのでそれだけヘルペスビリオンに奪い取られてしまう大量の栄養や酸素やエネルギーやアミノ酸や蛋白や酵素や核酸の材料が必要なのです。更に正常細胞や癌細胞が生き続けるためにも栄養や核酸が必要です。
癌は新しくできた癌組織なので癌細胞は周囲に新たなる血管を作りながらヘルペスと一緒に分裂増殖していき、ヘルペスが生み出す遺伝子の癌化の数が増えるにつれて癌組織病巣が大きくなり血管新生が間に合わなくなります。その結果、血流が低下すると癌細胞の中には栄養と酸素不足で死滅するものも出てきてヘルペスが増える勢いも癌細胞が増殖するスピードも落ちて癌病巣の成長も鈍ることもあるのです。いずれにしろがんが増大する成長速度はherpesの増える速度によって決められるので癌自身の増大する速度は一定ではないのです。免疫の低下速度に合わせてかつ癌細胞分裂速度に応じてヘルペスの分裂癌増大速度が決まるのです。癌細胞自身が速度を決めるのではなくherpesの増殖速度が決めるのです。言い換えるとヘルペスが人体の40兆個の細胞が持っている核のゲノムの中の23500個の内の癌関連遺伝子(増殖関連遺伝子)の400~800個のどれだけおおくの遺伝子を変異させて癌化させたかによって決まります。
癌の他の臓器に転移する能力は何によって決まるのか?herpesが癌細胞や正常な細胞の癌関連遺伝子をさらに多く癌化させればさせるほど突然変異していく癌関連遺伝子数が増えれば増えるほど癌細胞の転移の可能性が増えるのです。あらゆる癌に関する悪性度は23500個の遺伝子の中の800個の癌関連遺伝子の癌化の数で決まります。この遺伝子を突然変異を起こして癌遺伝子に変異させるのはヘルペスですからヘルペスが何十億個、何百億個、何千億とビリオンも増えていくと癌細胞の800個の癌関連遺伝子の癌化も増え、しかも新しく増えたビリオンが正常な細胞に感染して新たなる癌細胞の癌関連遺伝子の癌化を起こし新たなる癌細胞を生まれるという悪循環を繰り返すのです。細胞を利用し尽くして細胞が溶解感染してネクローシスで殺されてしまうと一挙にその細胞から周辺の組織や血管やリンパ管に大挙して転移し始めます。この増えたヘルペスは永遠に殺し切れないので無限に増えて人体のあらゆる臓器の細胞にヘルペスビリオンは感染転移することを繰り返します。このようにしてあらゆる組織の細胞を癌化させて栄養も酸素もすべて利用されつくされて悪液質になって最後は増えすぎたビリオン粒子どもに栄養を略奪されて最後はカヘキシアといわれる栄養不良で死ぬことになります。この栄養不良で死は特別な死であるのでカヘキシアといわれるのです。
カヘキシア(悪液質)とは、体重減少や食欲不振、炎症状態などの症状を伴う慢性疾患に関連した代謝不均衡です。癌の場合はヘルペスウイルスによる炎症がもたらすカヘキシア(悪液質)です。カヘキシアの原因となるヘルペスウイルス性慢性疾患では、サイトカインの分泌が亢進してherpesビリオンの分裂増殖するための栄養供給のために骨格筋や脂肪の分解が進み、食欲が低下することで体重が減少しやすくなります。サイトカイン(cytokine)は、日本語で「細胞間情報伝達物質」を意味します。
サイトカインは炎症性免疫細胞から分泌されるタンパク質で、細胞間の相互作用に関与し、周囲の細胞に影響を与える生理活性物質の総称です。免疫系細胞から分泌され、細胞間の情報伝達を担っています。カヘキシアは、ヘルペスが起こすがんや慢性心不全、慢性腎不全、自己免疫疾患などのヘルペス性の慢性疾患を背景に発症することが多いのです。特にカヘキシアはがん患者に多くみられる合併症の1つで、特に進行した消化器がんや肺がんで高頻度に発症します。炎症性サイトカインとは、病原体が体内に侵入した際に産生され、炎症反応を引き起こすサイトカインの一種です。合併症とは、ある疾患が原因となって発症する別の病気、または手術や検査が原因となって起こる病気を指します。合併症が発生すると、通常治療期間が延長されるため、後遺症の発生リスクが高くなります。後遺症とは、ケガや病気の急性期が終わった後に残る、あるいは長期間継続する症状を指します。
合併症の例としては、インフルエンザの合併症として細菌性肺炎が発生したり、糖尿病に合併症が発生したりすることがあります。また、手術後の合併症としては、創感染や感染症(特に肺炎)、痛みなどが挙げられます。
炎症性サイトカイン(細胞間情報伝達物質)の例としては、IL-1、IL-6、TNF-αなどが挙げられます。一方、IL-10やTGF-βのように炎症症状を抑制する働きをもつサイトカインは抗炎症性サイトカインと呼ばれます。サイトカインには、免疫細胞を目的部位に集積したり、獲得免疫系の細胞の分化を誘導したり、獲得免疫系および自然免疫系を活性化したりする働きがあります。このように、サイトカインは、病原体が体内に侵入した際に産生され、異物から身体を守るうえで重要な役割を果たしている炎症反応を引き起こします。
カヘキシアは治療抵抗性で、患者の予後や生活の質(QOL)を悪化させることが知られています。栄養療法単独では治療効果を得られないことが特徴なのはカヘキシアをもたらすのはヘルペスウイルスであるからです。又死ぬまでに増えすぎたヘルペスは人体のいたるところに分布しているポリモーダル自由神経終末侵害(痛み)受容体といわれる痛みを感じる受容体にも感染しまくって耐えがたい痛みを引き起こしてしまうので、痛みを止めるための緩和医療で麻薬を使わざるを得なくなるのです。
痛みを止める麻薬とは痛みを止める麻薬には、医療用麻薬(オピオイド鎮痛薬)と呼ばれるものがあります。オピオイドとは痛みを伝える神経に作用して痛みをやわらげる効果があり、がんに伴う痛みや、手術中・手術後の痛み、外傷による痛み、分娩時の痛み(陣痛)などに使用されます。医療用麻薬には、モルヒネ、オキシコドン、フェンタニルなどがあります。医師が処方した用法・用量を守って使用すれば依存性は少ない薬剤とされています。医療用麻薬を使用する際は、少量から始め、痛みに合わせてあった量を決めていきます。投与量を増やしすぎると副作用も強くなってしまうため、鎮痛効果には上限があります。また、オピオイド鎮痛薬ではない「非オピオイド」と呼ばれる鎮痛薬もあります。ロキソニンなどの非ステロイド性抗炎症薬(NSAIDs)や、アセトアミノフェンなどがこれにあたります。非ステロイド性抗炎症薬(NSAIDs)とアセトアミノフェンは、鎮痛や解熱といった効果はありますが、作用の仕組みや炎症を抑える効果の有無が異なります。
非ステロイド性抗炎症薬(NSAIDs)は、プロスタグランジン(PGE2)の合成を抑制することで鎮痛、解熱、抗炎症作用を発揮します。テニス肘や運動による膝の痛みなどの外傷性の炎症による痛みを抑える効果があります。ロキソニンなどが代表的な薬です。
アセトアミノフェンは、COXを阻害することで鎮痛や解熱作用を発揮しますが、その作用は弱く抗炎症作用はほとんどありません。カロナールが代表的な薬です。
NSAIDsとアセトアミノフェンの違いはステロイド性抗炎症薬(NSAIDs)とアセトアミノフェンは機序が異なるため、基本的には同時使用が可能です。ただし、一部作用が似ている部分があるため、別々に使うべきです。NSAIDsには胃腸障害などの副作用が起こる場合があります。副作用を防ぐには、胃薬の併用や決められた以上の量は飲まないなどの対策を心がけましょう。また、腎臓の血流が悪くなって腎障害が起こったり、アスピリン喘息といった呼吸器の副作用にも注意が必要です。
ポリモーダル自由神経終末とは何か?なぜ癌の三大医療を受けた後、癌死の直前に耐えがたい痛みを感じるのはなぜか?ポリモーダル受容器ではその膜上に複数の機械刺激や熱刺激や痛み刺激の受容体が存在しています。ポリモーダルの意味は、「多様な」という意味で ポリモーダルとは、機械的刺激、化学刺激、熱、障害による刺激など、さまざまな侵害刺激や痛み刺激に対して反応する受容体のことです。特にポリモーダル自由神経終末は痛みを感じる主な感覚器官のひとつで、侵害受容器の一種です。怪我をした時やヘルペス感染時になどには、発熱、発赤、疼痛、腫脹は、炎症の4徴候がみられるのは何故でしょうか?損傷した組織を治癒していく過程の初期状態には、損傷した組織からは、発痛物質であるKイオンやATPが、血管からはBK(ブラジキニン)が放出される。細胞膜からは、ロイコトリエンやプロスタグランジン(PG)が産生される。ロイコトリエン(LT)は、プロスタグランジン(PG)と同様にアラキドン酸からつくられる生物活性脂質である。これらは、BK(ブラジキニン)による痛みを増強する作用と血管を拡張する作用があり、血管(細動脈)が拡張すると血流が増大するため、赤い色素を持つヘモグロビンが増加し、皮膚は赤く見える。また血管(細静脈)の透過性が亢進し、血中から白血球やマクロファージなどが透過性が亢進した細静脈から放出される。これらは、損傷された組織の残骸など生体にとって不要となったものを貪食する作用をもつ。これらが血管外へ放出されることで、外からは腫れて見える。血管が拡張し温かい血流が増えることから、発熱がもたらされる。組織温の上昇はポリモーダル受容器の活動性をさらに増強する他、産生される炎症性物質による刺激によってもポリモーダル受容器の興奮性が増す。このようにヘルペス感染の炎症時には、損傷や発痛物質が痛み刺激となってポリモーダル受容器線維を中心とする痛み神経を興奮させるが、神経は脊髄側だけではなく組織側にも複数の神経伝達物質(サブスタンスP、カルシトニン遺伝子関連ペプチドなど)を放出する。これらの物質もまた血管を拡張させたり、血管の透過性を亢進させるので、血管から白血球などが放出されやすくなり、局所性のヘルペスによる炎症反応を引き起こす。この炎症は神経性に生じるので神経性炎症あるいは軸索反射と呼ばれている。軸索反射とは皮膚に引っかき傷をつけるとその後が赤く膨れて見える現象からよく説明されているが、実際のところ神経の興奮による神経伝達物質の放出が引き起こしていた反応である。神経末端から放出されるペプチドはまた線維芽細胞や内臓平滑筋の活動を調節することも知られており、損傷組織を修復するための大事な生体防御反応の担い手である。
癌の三大医療を受けた後、癌死の直前に耐えがたい痛みを感じるのは癌を治せないのにもかかわらず癌の三大医療は圧倒的な免疫低下を患者にもたらしその間にあらゆる細胞で増え続けたヘルペスは感染細胞から全身の組織に行き渡っているポリモーダル受容器を持っている神経線維細胞へと感染してしまい強い痛みとしてポリモーダル受容器が感じてしまうために痛みをとるために麻薬が必要になるのです。
増殖が速いと言われる癌細胞は正常細胞よりも分裂が少ないのか?ヘルペスによって突然変異した遺伝子がすべて「癌」の原因にわけではないのです。ゲノムにある23500個の遺伝子のうち、特定の遺伝子群である癌関連遺伝子の遺伝子のどれかに突然変異が起きた場合に限られるのです。癌関連遺伝子に突然変異のない状態であればこれらの遺伝子にはそれぞれ「正常な役割」があります。これらの遺伝子の役割によって癌関連遺伝子の遺伝子は2種類あります。一つ目は癌原遺伝子です。二つ目は癌抑制遺伝子です。癌原遺伝子は突然変異によって機能を獲得します。癌抑制遺伝子は突然変異によって機能を失うことによって発癌の原因になるのです。癌原遺伝子は突然変異によって増殖するという機能を獲得しますが、逆に癌抑制遺伝子は増殖を抑制させる機能を失ってもいずれも結局は癌が増殖することになります。つまりは癌関連遺伝子多くの因子で制御されていまから増殖しなさいという命令であっても余計な増殖をするなという命令でもいずれも異常になれば癌細胞は増殖することになります。この癌関連遺伝子を細胞の中で果たす大切な役割の順に四つのグループに分けます。第一は「細胞周期に関係する遺伝子」。第二は増殖遺伝子とそのシグナル伝達に関係する遺伝子」。第三はアポトーシス(計画された細胞死)」。四つ目はDNA修復に関係する遺伝子」。の四つのグループにわけます。
それでは2種類の癌関連遺伝子である癌原遺伝子と癌抑制遺伝子とは具体的にはどんな種類の遺伝子なのでしょうか?癌の特色は「異常な増殖」であるのでその大半は増殖に関係する遺伝子です。一つ目の増殖系の癌原遺伝子は多くの因子で制御されています。その中心に①細胞周期のシステムがあり外から細胞に伝わった刺激を受容する②増殖因子の受容体がありその受け入れられた刺激を細胞周期につなげる③シグナル伝達系がこの刺激を制御しています。癌原遺伝子の作用点はこのような三つの増殖制御系のさまざまな増殖にかかわる癌原遺伝子が存在しているところに分布しているのです。
一方、二つ目の癌抑制遺伝子は増殖制御系とは別のカテゴリーに属する抑制系の癌抑制遺伝子の①アポトーシスの癌関連遺伝子です。人体は増殖とアポトーシス(制御された細胞死)のバランスの上に成り立っており癌抑制遺伝子がうまく機能しないと異常な増殖を助長して悪性化した癌細胞を制御された細胞死によって排除できない結果に加えて、さらに癌抑制遺伝子の持つ②DNA修復系が十分に機能しないとDNAの傷である遺伝子の異常を生み出し癌抑制遺伝子にも突然変異がおこってしまうと癌となってしまうのです。
「癌原遺伝子」に共通するのは細胞周期にしろ、シグナル伝達にしろ増殖を促進する遺伝子ですが、この遺伝子が突然変異してしまうと外部からの増殖因子の刺激がないのに増殖シグナルが発信されっぱなしになり増殖の状態になってしまうと、発癌性を獲得した遺伝子になってしまい、「良性腫瘍」を起こしてしまうのです。この「良性腫瘍」でありますが発癌性を獲得した異常な「癌原遺伝子」を「癌遺伝子」と呼ぶのです。「癌原遺伝子」を「癌遺伝子」に変えてしまうのが癌ウイルスであるヘルペスウイルスなのです。
「癌抑制遺伝子」は「癌原遺伝子」とは反対で細胞周期やシグナル伝達を抑制する因子となる抑制する因子が多いのですが「癌原遺伝子」よりもはるかに少ないのです。「癌抑制遺伝子」はDNA修復の遺伝子である「癌抑制遺伝子」に含まれます。「癌抑制遺伝子」として最初に見つかったのはRB1遺伝子は細胞周期の進行の抑制のかかわる遺伝子です。一方TP53という遺伝子は「癌抑制遺伝子」の代表であり細胞周期の進行の抑制因子であると同時にアポトーシス(制御された細胞死)の促進因子でもあるのです。つまり「癌細胞になりそうな細胞を前もってアポトーシスさせて危険な細胞を死なせてしまうのです。この「癌抑制遺伝子」を癌化させるのも癌ウイルスであるヘルペスウイルスなのです。
癌ウイルスとは何でしょうか?癌ウイルスの定義は何でしょうか?癌になる前は正常な遺伝子であった2種類の癌関連遺伝子である癌原遺伝子と癌抑制遺伝子を突然変異を起こして癌遺伝子(癌化遺伝子)に変えてしまうウイルスのことです。現在では100%近くがヘルペスウイルスのことを癌ウイルスというのです。
Herpesウイルスによって癌化させられる癌関連遺伝子の遺伝子は2種類あります。一つ目は癌原遺伝子です。二つ目は癌抑制遺伝子です。一つの細胞にあるこの二つの癌関連遺伝子癌遺伝子が癌化して初めて癌細胞が一個生まれるのです。一つ目の癌原遺伝子だけが癌化すれば良性腫瘍のままでいわゆる故近藤誠さんのいう「もどき癌」です。さらに残りの癌抑制遺伝子も癌化する(癌遺伝子になる)と悪性腫瘍(癌)となるのです。また二つ目の癌抑制遺伝子が癌化しても見かけは何の変化も見られません。しかし一つ目の癌原遺伝子も癌化してしまうと良性腫瘍ではなく二つの癌関連遺伝子とも癌化してしまうので突然に悪性腫瘍になってしまう良のです。良性腫瘍であったものが二つの癌関連遺伝子とも癌化してしまうと悪性腫瘍(癌)になってしまったのです。因みに癌抑制遺伝子は癌増殖抑制遺伝子とも言います。
癌増殖抑制遺伝子が癌化しても見かけは何の異変も起こりません。何故ならば癌現遺伝子が癌化しない限り癌増殖抑制遺伝子は癌の増殖を抑制するしないかはどうでもいいからです。ところが細胞の癌増殖抑制遺伝子が癌化してしまっている場合には残りの癌原遺伝子も癌化してしまうと即座に一個の癌細胞が誕生するのです。因みに23,500個の遺伝子の中にある数百個とか800個あるといわれる癌関連遺伝子には、はるかに増殖する機能を持っている癌原遺伝子の方がはるかに多いので癌ウイルスであるヘルペスウイルスは癌原遺伝子との出会いが多いのでこの癌原遺伝子が癌化しやすいので良性腫瘍がまず生まれるのですべての癌細胞の出発は良性腫瘍から始まるのです。
例えば結腸ポリープは癌ではない良性腫瘍です。ところが上で説明したように結腸の上皮細胞の癌増殖抑制遺伝子だけが癌化してしまった良性腫瘍ですから残りの癌原遺伝子が癌化してしまって二つの癌関連遺伝子が癌化してしまって一個目の癌細胞が生まれたかどうかを確認するために毎年内視鏡検査がされるのです。このような癌ではない良性腫瘍でも癌だと診断されて三大癌医療が行われているのは極めつきの間違いであり三大癌医療はすべて副作用が多くかつ早死にするとまで指摘し続けたのが勇気と正義感に満ち溢れた故近藤誠先生でした。しかし彼でも根拠なしに「癌は治らない」と断言しきった人でした。しかし癌ではないもどき癌は実は良性腫瘍であったので治療する人要はないと彼は言い続けてなくなりました。残念ながらロイアルレイモンド博士の極めて簡単に癌を直す「光癌治療」も「癌ウイルス」であるヘルペスのことも知りながら白を切り続け通して癌は治らないと断言し続けたので彼を信じていた患者さんの多くを更に癌になれば死ぬ以外にないのだと絶望させてしまったことも残念至極でした。
初期癌とは何でしょうか?初期癌には2種類あります。一つは良性腫瘍であったものが癌関連遺伝子の800種の大部分を占める癌原遺伝子が癌ウイルスであるヘルペスによる癌化の進行が遅いとゆっくり成長します。逆にリンパ節にも転移している初期癌ではない実は良性腫瘍であるといわれる中に大きくならないものや消えてしまうものもあるのは癌抑制遺伝子あるp53の働きで良性腫瘍や癌細胞をアポトーシスさせたからです。癌専門医は「癌は放置するとあっと思うままに増大してすぐ遠隔転移して死ぬ」と脅かしますが癌の原因であるヘルペスが増えない限りまたヘルペスを免疫を落として増やさない限りがんは進行しないのです。というのは40兆個もある細胞の中の正常な23,500個の一個だけが2個の癌関連癌遺伝子だけが癌化して一個の癌細胞が生まれてもその癌細胞が増殖するのは実は奇跡的な現象なのです。
癌関連遺伝子とは何でしょうか?がんが増殖するというのは何でしょうか?もともと生体内では正常な細胞でも癌細胞でも「増殖」言う行為は厳しい監視下に置かれよほどのことがないと増殖できないのです。幹細胞の様な無限増殖できる特殊な能力を持つ細胞でも固有の組織内の微小環境(ニッチェ)内の特定の場所に幹細胞があり、となりの細胞と接触し、周囲から分泌シグナルを受け取ことが必須なのです。又、「核の損傷」である「DNA損傷」などの悪条件に置かれた細胞は直ちに増殖をやめてアポトーシスで死滅するのです。
遺伝子の元になるDNA損傷とはDNA分子が化学的に変化して塩基損傷やDNA鎖切断でありDNA損傷は毎日続けられる大切な遺伝情報を守るためにDNA修復を行っているのです。
細胞ではDNA修復機構が常にDNA損傷を監視しているので損傷は最小限に抑えられているのです。このDNA修復機構の一部でもわずかな異常があればDNAの安定性は大きく乱れるとDNA修復の欠陥による重症の遺伝子病になるのです。これがヘルペスウイルスによる遺伝子突然変異によるあらゆる種類の遺伝子病となり癌もその遺伝子病の一つなのです。
アポトーシスを促進する刺激には二種類あります。一つ目は細胞表面のFas受容体からくるか、核のDNA損傷からきます。二つ目はアポトーシスを起こらないように抑制している生存因子が無くなったときです。生存因子は成長因子とか増殖因子とも言います。というのは生まれた赤ちゃんは20歳までは大きく成長する必要がありかつ生まれた時に持っている4兆個の細胞を10倍の40兆個に増やしかつ死ぬまで新旧の細胞を入れ替えるために細胞の増殖を繰り返し生存のために続けなければならないからです。
代表的な増殖因子(生存因子)とその因子の産生場所とその因子の役割を掲げます。
①上皮増殖因子。尿、唾液、汗、血漿などの大半の体液に含まれます。上皮細胞の増殖。
②血小板由来増殖因子。血小板が大量に産生、マクロファージ、血管内皮細胞、平滑筋細胞も産生。組織の間隙を埋める運動性が高い細胞である線維芽細胞、平滑筋細胞の増殖。
③線維芽細胞増殖因子。脳や下垂体に多く存在。線維芽細胞や血管内皮細胞の増殖。
④肝細胞増殖因子。間葉系の細胞である組織の間隙を埋める運動性の高い線維芽細胞、平滑筋細胞の増殖が産生。上皮系の細胞、内皮細胞、ニューロンに作用して肝臓切除後の再増殖。
⑤インスリン様増殖因子(ソマトメジン)。プロインスリンと構造が類似。プロインスリンが切断されて活性型のインスリンになる。プロインスリンとは、インスリンの前駆体で、膵臓のβ細胞で合成されるアミノ酸86個からなるタンパク質です。プロインスリンは、分泌顆粒内で酵素によって分解され、インスリンとC-ペプチド(CPR)に生成されます。
⑥血管内皮増殖因子。マクロファージ、平滑筋細胞などの細胞が産生。血管内皮細胞に特異的に作用して血管の新生に関与。
⑦β型形質転換増殖因子。血小板、胎盤などの細胞が産生。上皮細胞、血球などの細胞に作用して細胞の増殖を抑制。多くの類似タンパクであるがありβ型形質転換増殖因子スーパーファミリ-があり発生で働くモルフォゲのBMPやアクチビンも同じ仲間です。BMPとはアクチビンとはBMP(Bone Morphogenetic Protein)とアクチビンは、ともに細胞の増殖や分化、アポトーシス(細胞死)の制御に関与する因子で、TGF-βスーパーファミリーに含まれています。BMP(Bone Morphogenetic Protein)とアクチビンは、ともに細胞の増殖や分化、アポトーシス(細胞死)の制御に関与する因子で、BMPは骨形成因子とも呼ばれ、骨格形成や骨折の治癒など、骨の形成に必須の役割を担っています。一方、アクチビンは血球分化を促進する因子です。
痛みの神経のない骨に癌が転移した時に何故、骨痛が見られるのでしょうか?骨には痛みの神経はないのですが、骨の表面は神経がある「骨膜」で覆われています。骨膜は関節軟骨と筋がついている部分には存在せず、関節部分では関節を覆う「関節包」につながっています。骨膜には血管や神経、リンパ管が走っており、骨へ血液を巡らせ、刺激や痛みなどを知覚する。すぐ下の骨質とは、シャーピー線維と言われる繊維で強く結合している。「骨膜」は、2つの層に分かれており、外側は結合組織性線維や弾性繊維からなる強固な「繊維層」になっている。そのさらに内側は、結合組織性細胞や血管を多く含む「骨形成層」があり、「繊維層」と比較するとやわらかい。成長期には、「骨形成層」にある骨芽細胞が骨基質を作り出して骨の太さを成長させているが、成人になってからも、骨の損傷時には、骨芽細胞が再生や修復の役割を果たしています。癌細胞は血管やリンパ管を通って癌細胞が骨転移します。癌細胞には癌を作ったヘルペスやヘルペスの子供であるビリオンが満載されています。そこで癌細胞が増殖するとherpesも増えて癌細胞から出たヘルペスが骨膜の痛覚神経細胞に感染します。これが痛みの原因となるのです。
シャーピー線維とは何でしょうか?シャーピー線維は別名を貫通繊維とも言います。シャーピー線維は、全身の骨表面(骨膜)に存在し、筋肉、腱、靭帯は、骨膜に侵入したシャーピー線維を介して骨に強固に結合することができるコラーゲン線維です。歯周組織にも歯と歯周組織をつなぐ歯根膜の強靭な主繊維として存在しているコラーゲン線維で、シャーピー線維は部位に応じて3つの種類に分けられます。具体的には「歯と遊離歯肉を結ぶもの」「骨とセメント質を結ぶもの」「象牙質とセメント質と付着歯肉を結ぶもの」の3つです。これらが存在することによって、歯に加わる咬合圧を分散され、咀嚼運動をスムーズに進めることが可能となります。
乳癌で死ぬ理由は何でしょうか?初発病巣が発生した臓器によって死因が異なります。固形癌では初発病巣が死因となって亡くなるのですが一つだけの例外が乳癌です。乳癌は肺や肝臓への転移でなくなります。それは乳房が生命維持にとっては重要でないからです。乳癌はヘルペスウイルスによる初発病巣である癌原遺伝子だけが癌化した良性腫瘍に過ぎない時に免疫が落ちている細胞が増えすぎたヘルペスビリオンの増殖により良性腫瘍の細胞が崩壊して周囲に組織に出て周りの細胞に感染するのみならず組織のリンパ液(漿液)に出たヘルペスがリンパ液に取り込まれたり又、崩壊したヘルペスが感染した細胞塊からはがれたヘルペス感染細胞がリンパ液に再吸収されて腋下リンパ節にとりこまれてがんの転移といわれるのですが必ずしも悪性腫瘍のみならず良性腫瘍や、正常なヘルペス感染細胞が腋下リンパ節に転移(移動)しているのです。短期間に悪性腫瘍になる確率は奇跡的というほどに極めてあり得ないのです。
乳房のリンパ管と腋窩リンパ節の位置関係は、どうなっているのでしょうか?乳房の外側のリンパ液の多くが腋窩リンパ節に集まっているというものです。乳房には多くのリンパ管が通っており、その多くが脇の下(腋窩)のリンパ節に流れていきます。腋窩リンパ節は、腋窩の脂肪の中に埋め込まれるように存在しており、網目状にリンパ管で繋がっています。乳房から近いリンパ節には、乳房の内側の胸骨の隣にある内胸リンパ節や、鎖骨の上にある鎖骨上リンパ節などもあります。乳がんは、乳房の付近にあるリンパ節に転移しやすいのは二つの理由があります。一つ目は乳房の外側の組織に出たヘルペスウイルス感染細胞を含んだリンパ液がリンパ管に再吸収されたその多くのリンパ液が腋窩リンパ節に集まっているからです。二つ目は乳房には多くのリンパ管が通っており、その多くが脇の下(腋窩)のリンパ節に流れていくからです。良性乳腫瘍や乳癌が腋下リンパ節に転移すると、わきの下のしこりや腫れなどの症状が現れることがあります。また、良性乳腫瘍や乳癌が腋下リンパ節転移によってリンパ液の流れが滞ることで腕のむくみやしびれといった症状が現れる場合もあります。
ほとんどの早期の癌細胞といわれる癌は実は癌原遺伝子だけが癌化する良性腫瘍なのです。早期癌といわれるのは間違いなので、早期良性腫瘍といわれるべきなのです。というのは早期の良性腫瘍が一挙にヘルペスウイルスによって二つの癌関連遺伝子が同時に癌化させられて悪性腫瘍になる可能性は極めて少ないからです。がん細胞に感染しているヘルペスは初めは極めて少ないからです。良性の腫瘍が悪性腫瘍になって増殖するのはもう一つの癌抑制遺伝子も癌化して初めて本当の癌細胞が一個だけ生まれるのです。
ヘルペスウイルスによって正常な細胞や良性腫瘍細胞が例えば早期胃がんなどは胃の良性腫瘍である早期胃がんといわれるものも5~6年放置してもほとんど癌になることはないということは多くの様々なタイプの胃の腫瘍をみてきた胃癌の専門医にとっては常識なのです。言い換えると早期胃がんは癌というべきでなく早期良性腫瘍というべきなのです。つまり幹細胞が乳房組織の乳腺細胞よりもはるかに多い胃の粘膜細胞で見られる早期胃がんは5~6年放置しても癌にはならないということを知っているのです。ちなみには新旧の細胞を入れ替える幹細胞でなければヘルペスが感染して初めて癌細胞になる可能性が生まれるので、ヘルペスが感染できない細胞のゲノムを突然変異させて癌細胞にすることはできないのです。
乳房の毛細リンパ管のすぐ近くにある腋下リンパ節の「しこり」が癌検診で見つかると良性の乳房腫瘍のあるのに乳がんだと断言してすぐに手術しなければ死ぬよと脅かす脅かされることがしばしば見られます。ところが初期の「しこり」がヘルペス感染細胞なのか良性の腫瘍細胞なのか、ヘルペス感染癌細胞かを見分けることはできないのです。因みに現在でも癌死した人の癌細胞の生検検査を行う病理学者も顕微鏡検査では、ミクロン(100万分の1)メートル単位の大きさの癌細胞に住み着いている癌細胞のなかにうようよしているナノ(10憶分の1)メートル単位の大きさのヘルペスウイルを見つけ出すのは不可能であるからです。癌細胞の悪性度や異形度は本当に良性の腫瘍か悪性の腫瘍かはゲノムの癌関連遺伝子の変異を調べて初めて正確に判明するのです。
乳がん検診で初めて触診で「しこり」があるので乳癌の可能性があると言われる「しこり」とは何でしょうか?乳腺の(しこり)は、年齢が高くなるにつれて乳癌の可能性が高くなります。乳がんのしこりは、まずゴリっと硬いこと。 そして、表面がデコボコで境目がはっきりしないこと、形が整っていないこと、周囲の組織に癒着するためあまり動かないなどの特徴があると言われます。「しこり」は 20歳代は、良性の線維腺腫が多く、40~50歳代になると乳腺症とともに乳癌が大半を占め、高齢者の乳房のしこりは殆どが乳癌です。と言われていますが本当でしょうか?癌の癌たる所以は2種類の癌関連遺伝子である癌原遺伝子と癌抑制遺伝子の両方がヘルペスによって変異が起こされ必要があります。未だかって癌の診断でこの2種類の癌関連遺伝子である癌原遺伝子と癌抑制遺伝子の「突然変異」を遺伝子検査で確認した医者がいましたか?近頃はがんの特徴を遺伝子レベルで調べる遺伝子検査も進展しており、少数の特定の遺伝子変異だけでなく、複数の遺伝子変異を一度の検査で調べることができる「がん遺伝子パネル検査」が出てきています。世界中の癌専門医は根拠もなしに癌は絶対治らないと口をそろえて言い張りますが「癌関連遺伝子を癌化させる原因はヘルペスです。」から癌自体が怖くはないのです。正常な細胞を癌化させたヘルペスウイルスが増えて癌関連遺伝子を癌化させ続けない限りは癌は全く怖い病気ではないのです。癌とherpesについてはあちこちに書きまくっていますがロイアルレイモンド博士のここを読んで「癌ウイルス」であるヘルペスウイルスを「光癌治療」で簡単に殺せばすべての癌は根治出来ることを知ってください。
乳腺の「しこり」は大腸(結腸)の「ポリープ」と同じなのです。いわば乳腺の「しこり」は見えない「乳腺のポリープ」と言ってもよいのです。乳腺の「しこり」は目には見えないのですぐに切りたがります。ところが大腸(結腸)の「ポリープ」は良性腫瘍であることはすべての消化器外科医はすべて知っていますから「結腸癌」だと決めつけてすぐにポリープを切除することはしないで年に一回内視鏡検査で経過を見ます。
実は良性腫瘍であるのは2種類の癌関連遺伝子のうち一種類だけが変異しているだけですから癌ではない良性腫瘍なのです。故近藤誠さんが「もどき癌」と名付けたのは「良性腫瘍」のことであり、転移した腫瘍を「本物の癌」と名付けたのは、2種類の癌関連遺伝子の「癌原遺伝子」と「癌抑制遺伝子」の二つともヘルペスウイルスによって突然変異してしまった「本当の癌」であったのです。勿論転移していない「本当の癌」も実際には存在していますが。まことに残念なことだったのですが故近藤誠さんは「癌は治らない」と断言し続けたのはかれが癌の本質に気が付かなかったことです。癌で死んでいく人は「癌死」したのではなく免疫を極度に低下させる「標準三大がん治療」にherpesが無限大と言っても許されるほどにherpesを分裂・増殖させすぎて23,500個のうちの800個以上もある2種類の癌関連遺伝子をherpesが癌化させてしまったからです。「癌死」は「ヘルペス死」というべきなのです。
ここで良性の大腸のポリープがヘルペスウイルスによってどのように悪性の大腸癌になっていくかを説明しましょう。一個の正常な大腸細胞が悪性度の高い大腸がん細胞に変わっていくのはその細胞の2種類の癌関連遺伝子の「癌原遺伝子」と「癌抑制遺伝子」のうち一つがヘルペスによって変異を起こし良性腫瘍になった細胞が分裂・増殖するたびにヘルペスも数十倍もビリオンを増やしてその良性腫瘍細胞の複数の癌関連遺伝子をさらに変異させてしまいます。しかも生まれたビリオンは近隣の細胞に感染して知らぬ間に新しい正常な細胞の2種類の癌関連遺伝子の「癌原遺伝子」と「癌抑制遺伝子」を良性腫瘍にしていきます。ヘルペスが増殖してビリオンを大量に生むチャンスは細胞分裂に歩調を併せます。もっと具体的に述べると細胞周期のS期のDNA複製が行われる時こそ、細胞核のゲノムに侵入することが出来るのです。というのはこの複製開始起点でDNAヘリカーゼという酵素によってDNA二重らせんがほどけ、DNA複製を行う細胞の蛋白質群が入り込むことによって始まるからです。この複製起点は複数の複数起点があり、ゲノムの数千個の塩基~数十万個複製開始起点のそれぞれからDNA複製が始まるのです。DNA二重らせんがほどける前は隙間がなかった対になった23本の染色体が46本になり更に92本のバラバラになった姉妹染色分体になった時にしかヘルペスが細胞のゲノムに自分のゲノムを組み込む可能な唯一のチャンスとなるのです。又細胞核で生まれたヘルペスビリオンが隣近所の正常細胞に感染するチャンスは免疫が下がった時です。というのは生まれた数百のビリオンが免疫が上がっているときに新しい正常な細胞に感染したくても外に出てしまうと細胞外にいる大食細胞や好中球やNK細胞に捕食されて食べられてしまうからです。
正常な大腸細胞は複数の癌関連遺伝子変異がどのような順番でつみかさなって大腸がんになるのでしょうか?大腸がんの初期段階でまずヘルペスによって癌関連遺伝子の癌抑制遺伝子である第一の変異であるAPC遺伝子の変異が起こり明らかに周囲と釣り合いの取れない高い増殖性を獲得した細胞が良性腫瘍であるポリープを作るようになります。このポリープは癌ではなくて良性腫瘍です。二つの癌関連遺伝子の一種だけが変異したものはすべて良性腫瘍であって悪性腫瘍ともいわれる癌ではないのです。癌抑制遺伝子であるAPC遺伝子だけがヘルペスによって変異した細胞はすべて良性腫瘍です。やがて、良性腫瘍であるポリープを構成する細胞のうち一個がさらにヘルペスによってK-rasという癌原遺伝子に第二の変異が起こされるともっと大きな細胞集団であるⅡ型腺腫に成長し、更に大きくなっていきⅢ型腺腫になった時点でそのうちの1個の細胞で二つ目の癌抑制遺伝子であるTP53遺伝子の変異が起こってしまうと、TP53遺伝子が作るp53タンパク質が機能を失ってしまい細胞周期チェックポイントやアポトーシスに異常がきたすので、癌原遺伝子との癌抑制遺伝子の二つとも変異を持つ不良癌細胞がにわかに増えてくると同時に、ヘルペスも増えてしまっているのですがそれを排除することもできなくなって悪性度が一気に加速してしまい本格的な大腸がんになってしまうのです。ヘルペスが増えれば増えるだけ癌化した遺伝子も増えていくので悪性度は減ることはないのです。癌細胞を増やすのも癌の悪性度を高めるのもすべてヘルペスが変異させた癌関連遺伝子の総数で決まります。癌関連遺伝子は一個の細胞には800余りあります。勿論正常な細胞よりも癌細胞も増えたがるのは増える必要がないのに変異した癌関連遺伝子がヘルペスによって無理やり分裂・増殖をさせられているからなのです。癌のすべての異常はヘルペスの責任なのです。癌細胞自身はヘルペスウイルスの奴隷なのです。ロイアルレイモンドライフ博士が「光癌治療」で癌ウイルスであるヘルペスウイルスを極めて簡単にころしてしまうと奴隷である癌細胞も解放されて癌も消えてしまったのです。ヘルペスウイルスを増やさなければ癌は生まれません。癌は何も怖い治らない死に至る病ではないのです。
APC遺伝子とは何でしょうか?APCは(Adenomatous polyposis coli)の略で癌抑制遺伝子の一つです。遺伝性の家族性大腸腺腫(FAP)の癌抑制遺伝子となるのでよく知られています。家族性大腸腺腫症はAPC遺伝子にもともと生まれつき持っている生殖細胞系列の癌抑制遺伝子変異にくわえて、生まれてから新たに体細胞変異である癌原遺伝子変異が加わることで、前駆病変である異常腺窩(せんか)巣がまず発生します。異常陰窩巣(Aberrant crypt foci:ACF)とは、肉眼的には正常に見える大腸粘膜であるが、組織学的には異型を示す腺管が集まって、周囲の腺管とはっきり区別できる病変を形成しているものです。生殖細胞系列の遺伝子変異は、精子または卵子を経由して受け継がれる変異であり、受精卵の時点で変異が存在するため、全身のすべての細胞にある遺伝子がその変異を受け継いでいる。これに対し、体細胞系遺伝子変異は、生殖細胞以外の体細胞に新たに生じる遺伝子変異を指します。異常腺窩巣は、さらに腺腫(ポリープ)を経て、大腸がんに進展するのです。また、大腸がんの発生にはK-RAS遺伝子やTP53遺伝子などの発がんに関連する遺伝子変異も関与しているのはすでに述べました。
K-RAS遺伝子とは癌原遺伝子のひとつで、細胞増殖を促進するシグナルを、細胞内で伝達するという役割を持つK-RASタンパクを作り出す遺伝子です。 がん細胞が増えるメカニズムのひとつとして、細胞表面にある上皮成長因子受容体(EGFR)の関与があります。
TP53遺伝子とは一つ一つの細胞内でDNA修復や細胞増殖停止、アポトーシスなどの細胞増殖サイクル(細胞周期)の抑制をする機能を持ち、細胞ががん化したときアポトーシスを起こさせる癌抑制遺伝子です。
しかしながら乳癌の骨転移は骨転移自体が死因になることはないのですが痛みが出ることが難点です。骨・軟骨・椎間板などにも「痛み専門の神経」はありませんが。骨には「骨膜」という膜に血管や神経、リンパ管が走っており、骨へ血液を巡らせ、刺激や痛みなどを知覚するのです。「骨膜」とはなんでしょうか?「骨膜」とは、骨の表面を覆っている膜のことです。関節軟骨と筋がついている部分には存在せず、関節部分では関節を覆う「関節包」につながっている。関節軟骨とは骨の関節面を覆っている、スムーズかつ強靭で弾力性のある組織で構成成分として70%が水分で、そのほかコラーゲン、グルコサミン、コンドロイチン、ヒアルロン酸が含まれる。骨膜」には血管や神経、リンパ管が走っており、骨へ血液を巡らせ、刺激や痛みなどを知覚する。すぐ下の骨質とは、シャーピー線維と言われる繊維で強く結合している。「骨膜」は、2つの層に分かれており、外側は結合組織性線維や弾性繊維からなる強固な「繊維層」になっている。そのさらに内側は、結合組織性細胞や血管を多く含む「骨形成層」があり、「繊維層」と比較するとやわらかい。
筋肉痛は運動などによって、筋肉が疲労したり、炎症を起こしたりして痛みが生じるものです。一方、神経痛は、神経が圧迫されて痛みが生じます。また、ヘルペスなどのウイルスが神経節(末梢神経で神経細胞が集合している部分)に侵入し、神経痛を起こすこともあります。見分け方は、運動などの後の痛みであれば、筋肉痛の可能性が高いのです。神経痛は、体の片側に痛みやしびれが出るのが大きな特徴です。つまり、骨折したとしても、膝や股関節の軟骨の痛みのために寝たきりになってしまうこともあるのです。骨膜に痛みを感ずる神経があるからです。成長期には、「骨形成層」にある骨芽細胞が骨基質を作り出して骨の太さを成長させていますが、成人になってからも、骨の損傷時には、再生や修復の役割を果たしています。骨折したとしても、膝や股関節の軟骨痛みのために寝たきりになってしまうこともあるのです。骨膜に痛みを感ずる神経があるからです。
ヘルペスによって生ずる乳がんが転移する場合,約30%の患者さんでは最初に骨に転移が起こるのは、血液の流れに乗って乳がん細胞が骨に移り,そこで分裂・増殖するからです。乳がんの術後10年以上経っても骨に転移することがあります。転移の多い部位は,腰椎(よう「つい),胸椎(きょうつい),頸椎(けいつい)といった椎骨(ついこつ)である背骨や,骨盤,肋骨(ろっこつ),頭蓋骨(ずがいこつ),上腕骨(じょうわんこつ),大腿骨(だいたいこつ)などです。乳がんの場合には,肘から先の腕や手,膝(ひざ)から下の脚や足の骨にはほとんど転移は起こりません。
乳癌以外のしこりを作る固形癌が直接死因となる11種類の臓器癌の命を奪う死因を故近藤誠さんがまとめられたものです。①脳腫瘍の死因は脳圧が高くなって脳機能不全。終末分化臓器である脳には癌はありません。②肺癌の死因は呼吸機能が低下して呼吸不全③食道癌の死因は食堂が詰まって飢餓④胃癌の死因は食べ物が通らなくなって飢餓と胃癌からの出血で貧血の二つが死因⑤大腸癌の死因は腸閉塞で飢餓⑥肝癌の死因は肝機能低下で肝不全⑦膵癌の死因は胆道を閉塞して黄疸で肝不全か、十二指腸が閉塞して飢餓⑧胆道癌の死因は黄疸⑨膀胱癌の死因は尿路を閉塞して腎不全➉前立腺癌の死因は尿路を閉塞して腎不全⑪子宮頸癌の死因は尿路を閉塞して腎不全か、癌から出血して貧血。肝不全で黄疸は何故出るのでしようか?進行した肝不全では、黄疸という皮膚や白目が黄色くなる特徴的な症状が表れますが、これは、本来は胆汁に交じって排泄されるビリルビンという色素が、肝臓の機能低下によって血液中に漏れ出てしまうことで起きます。膵がん(膵臓がん)が原因で閉塞性黄疸が起こる原因は、膵がんが大きくなり胆管を圧迫して胆汁の流れを妨げることです。胆汁の流れが滞ると、肝臓が体内の老廃物を胆管を通して腸に排出する機能が働かなくなり、胆汁中のビリルビン(赤血球の老廃物)が体内にたまり、黄疸が起こります。
リンパ節転移の意味とリンパ節廓清とは何の意味があるのでしょうか?
リンパ節転移は、がん細胞が発生した部位から組織に出て組織からリンパ管に吸収されリンパの流れにのってリンパ節にたどりつき、そこでヘルペスと癌細胞が増殖するのです。次々とリンパ節に移動し、ヘルペスと癌細胞が増殖することを繰り返していき最後は心臓に戻るので臓器転移は起こりません。従って広域にできるかぎりのリンパ節を切除することは臓器転移をさせないためにはあまり意味がないのですが、癌の原因であるherpesを除去する意味は大いにあるのです。そのため、癌原発巣や転移した他の癌病巣や癌が転移したリンパ節切除は癌の原因であるherpesを減らすことになるので手術の苦痛や副作用や延命の効果は全くないのですが抗ヘルペス剤を投与すれば私の様に癌も治すこともできるのですが癌病巣を切除することは100害あって一利なしです。ヘルペスを減らしているという意味で無価値ではないのですが、世界中の外科医は癌の原因は癌ウイルスであるヘルペスであることを誰も知らないので現在の支離滅裂な癌の理論とその理論に沿った間違った三大がん治療法は延命効果もなく患者さんを犠牲にしてお金を稼いでいるだけですから故近藤誠先生のような正義感を持った賢い勇気もある人物が現れたのですが彼も、癌の原因はヘルペスであることを知らずに亡くなられてしまいました。故近藤誠先生は死ぬまで「現代の癌治療はすべて間違っている」と激しく論敵を実に論理的に論破されておられましたが癌を治す理論を明らかにせずに亡くなりました。しかも「癌は治らない」と治らない根拠も何一つ触れずに断言されたのは彼を信頼していた癌患者に対して無責任の極みです。実は癌は治すことができる簡単な病気なのです。癌の原因はヘルペスであることがわかっているので癌は根治治療ができるからです。残念です。
癌細胞と正常細胞とは何が違うのでしょうか?一般の人は癌細胞と正常細胞とは大きく異なると考えておられるはずです。ですから「癌」と診断されると「死」と結び付けて恐れおののいてしまうのです。更に病気つくりの大専門家である医者どもは「癌は怖い怖い死ぬ病気や」と脅かして金を巻き上げるために医者をやっているだけで治す心は更々ないのです。だって病気がなくなれば医薬業界は一夜にして崩壊してしまいますからです。しかも癌の専門医は口をそろえて「癌は治せない」と言い続けてきているので癌患者は死ぬことを恐れて苦しまざるを得ないのでいつまでもいつまでも強いストレスがかかり癌細胞に住んでいるherpesはますます増殖を続けるばかりで2種類の癌関連遺伝子を突然変異させながら新たな重要臓器の正常細胞にヘルペス感染癌細胞がヘルペスとともに感染転移して人が死ぬまで間違った治療をやればやるほど癌細胞は増えていく最後は医者に殺されてしまうのです。近頃の文章はますます故近藤誠先生に似てきましたね。ワッハッハ!!!!
癌細胞は正常細胞の800個もある癌関連遺伝子が免疫低下の生活の状況の中で増え続けたヘルペスによって徐々に突然変異してがん遺伝子となりそのような癌変異遺伝子が長い時間かけて蓄積して癌細胞が癌細胞塊となり免疫低下が続く限りその癌細胞塊から癌細胞がはがれ播種して最後は遠隔転移となり死を招いてしまうのです。このような悲劇的な経過をたどるのは癌の根本原因がヘルペスウイルスによって癌関連遺伝子が突然変異が起こったことを認めないからです。現代の癌医療もすべて対症療法で免疫を抑え続けるからなのです。現代の癌医療のみならずワクチンと抗生物質の登場によって死ぬ病気がなくなったにもかかわらず癌で死ぬ人が毎年増えているのはワクチンが作れない文明社会に最後に残った病原体はヘルペスウイルスが癌のみならず自己免疫疾患も含めてあらゆる病気の原因であることを知っているにもかかわらず認めようとしないからです。病気を作って患者を死ぬまで治らないようにしてお金を儲けようとするからです。治療もすべて免疫を抑えるだけですから患者を喜ばすのではなくヘルペスだけが大笑いしています。アッハッハ!!!
資本主義は文字通り金第一主義ですから人の命よりも稼ぐお金が快楽をもたらしますから資本主義がなくならない限り金と様々な権力と権威と優れた頭が 自分の思うように地球が滅びない限り世界を動かし続けることになるでしょう。残念です。少なくとも医療だけでも社会主義であるべきです。病気はお金では治せませんからね。いや一つだけお金で病気を治せる薬があります。抗ヘルペス剤のアシクロビルです。ヘルペスが原因である私が治してきた自己免疫疾患や脳変性疾患やALSなどの他の難病のすべては抗ヘルペス剤のアシクロビルで治りますから健康保険で一週間しか使えないアシクロビルを少なくともこのような病気が治るまで必要な量を健康保険で使えるようになればアシクロビルを自費診療でだす必要がないのに残念です。
50年前にアシクロビルを発明発見したエリオンはこのアシクロビルでノーベル賞を授与されたのですよ。医師会を支配している医師会のボスたちがいかに卑劣であるかがお判りでしょう。何故根拠もなしにアシクロビルの保険投与の期間を一週間と限った理由を理解できますか?医師会は現代の病気のすべての原因はヘルペスであることを知っているからです。私のような15歳からherpes脳炎を患ってきた阿呆が知っていることを頭の良い医学会の大物が知らないはずがないからです。病気を治してしまうと医薬業界は全滅するから知らないふりをしているだけです。アシクロビルを保険で根拠もなしに1週間以上出せない決まりを作ってすべての病気はherpesですから仕方なく自費で出すと混合医療で私の様に罰せられてアシクロビルを使いたかったら自費診療をせざるを得なくなったので「松本漢方(アシクロビル)クリニック自費診療」で79歳になっても頑張っているのです。私の自費診療のクリニックは世界一の一番安上がりの医院なんですよ。すべての病気を治せるからです。すべての病気の原因はherpesウイルスであることを証明し切ったので病気を治せる唯一の根本治療は原因療法であるのでこの世の病気を治しことが可能であるので実際に完治させているのです。
皆さん、この世で最も高い医療は何だと思いますか?実は「国民皆保険なのです。」国民皆保険の制度は18歳から健康であるにもかかわらず死ぬまで毎月強制的に「健康保険料」を払い続けなければならないのは「国民の病気を治すためではなく医薬業界のためにあるのです。何故ならば古来から死に至る病気の原因はすべからく病原体でしたがワクチンと抗生物質とが発明されたので死に至る感染症は消えてしまいました。ただ一つワクチンが作れない例外的な特別な病原体がherpesウイルスなのです。herpesウイルスこそ自己免疫疾患や癌や遺伝子病や脳神経変性疾患や精神病などの「治らない原因不明」とされている現代のすべての難病の原因なのです。herpesウイルスについてはここを読んでください。癌についてはロイアルレイモンドライフ博士の「光癌療法」のここを読んでください。
しかもこの現代の難病のすべても国民皆保険では治らないとされ一生死ぬまで3割負担で「治療」と称しかつ「治せない」と医者が断言している病気の治療代に莫大なお金を病気つくりの専門家でかつ治す責任を放棄した医者の集団たちに吸い取られ続けるのです。だから頭の良い人は誰もかれも医者になりたがるのです。と同時に毎月、国民皆保険料を死ぬまで払いつ続けなければならないので医者はぼろ儲けができる保証があるのが国民皆保険のシステムなのです。ただし病気ではなく例外的に事故に対しては「事故専門家医師」が必要であるのは言うまでもないことです。外科の先生はいつまでも仕事が残るでしょう。
何故、現代には医者がいらなくなったのかを原則論としてまとめましょう。一つ目は病気を治せるのは自分の免疫だけです。二つ目はいかなる症状が出ても人を殺すような病気は何もありません。何故ならば症状は免疫とヘルペスとが戦っている証左なのです。三つめは免疫を抑えて病気の原因を生産しているのは医薬業界です。現代の病気の原因はワクチンが作れないのみならず自分の免疫で殺せない最後に残された病原体であるherpesウイルスだけです。四つ目は免疫を抑える薬は最後はヘルペスが無限大に増えるので無限大に増えたヘルペスは現関連遺伝子を変異され続けて癌細胞を増やしヘルペスにために転移癌も生まれとなって人は医療界に殺されて死んでいくのです。五つ目は現代の病気の原因はワクチンが作れない最後の病原体であるherpesウイルスだけであるにもかかわらず原因不明とされにもかかわらず治療が続行されるのが病気を治さなくても医者はお金がもうかる資本主義医療です。六つ目は病気を治すのに薬はいらないのです。最高の薬は36億年かけて磨きに磨きをかけて進化したすべての人が持って生まれた「免疫」の遺伝子です。七つ目は癌は何も怖い死なざるを得ない病気ではないのです。ヘルペスだけが免疫が征服して殺すことができないので癌細胞が怖い敵ではなくその背後で癌細胞を操り思うように動かしているのは「ヘルペスウイルス」なのです。癌ウイルスであるヘルペスウイルスを確実に金もかからず苦痛も感じないで後遺症もなく簡単に殺せるのはロイアルレイモンドライフ博士の「光癌治療」なのです。ロイアルレイモンドライフ博士の「光癌治療」はここを読んでください。しかも「光癌治療」は現代のあらゆる病気の原因であるヘルペスのすべてのみならずインフルエンザウイルスや手足口病ウイルスややエイズやその他のありとあらゆるウイルスを「光癌治療」で簡単に殺せるのでアメリカ医師会の会長であったユダヤ人のフィシュベインに「光癌治療」の装置のみならずカルテや精細な資料や研究所や一切合切、完膚なきまで破壊しつくし最後はすべてを燃やされてしまったのです。しかも彼のすべての病気を完治できる医療を法律で禁止してしまったのです。恐ろしい残虐極まるにユダヤ人のフィシュベインに潰されてしまったので敢えて言えば癌で死んでいくすべての未来永劫の命まで奪い取ってしまったのがフィシュベインだったのです。悔しくてたまりません。病気を治すことが医者の責任であるのに治してしまうと医薬業界は壊滅してしまうので賢いフィシュベインは人の苦しみを金に換えるために医者としても人間としても最悪の罪を犯したにもかかわらず罰せられることもなかったのです。お金ですべて取り仕切られている資本主義の元では人類はすべてフィシュベインと変わりません。冷酷極まりない人間のモデルがフィシュベインであるにすぎないのです。いずれ人類もAIに絶滅されてしまうでしょう。
何故癌は増大するのか?癌細胞は死なないからです。何故癌細胞は死なないのでしょうか?テロメアとは何でしょうか?正常組織の細胞を培養すると染色体の両末端部にあるテロメアには繰り返されるヌクレオチドの反復配列がありヒトでは6個のヌクレオチドの配列であるTTAGGGでありますが、分裂するたびにヌクレオチドの反復配列が短くなっていくのです。反復配列とはTTAGGGと同じ配列が個人差はあるのですが何十回も繰り返されることです。ところが正常組織の細胞が分裂のたびごとに不可逆的な変化が積み重なりテロメアが短くなったある時点で分裂をやめるのは何故でしょうか?
実は分裂をやめるのはよく言われるようにテロメアの短縮そのものが原因で細胞分裂が止まるのではなく「テロメアの短縮」を異常事態として監視する細胞周期チェックポイントが働いて細胞周期エンジンをストップさせるのです。ここで中心的な役割をするのは転写因子であるp53でありDNA損傷チェックポイントの場合と同じくp21Cip1を介して細胞周期体を停止させるのです。テロメアと老化と癌との関わりは何でしょうか?増殖だけを目指す癌細胞とは反対に増殖性を失った状態の細胞が細胞の老化なのです。老化を病気と考える人が多いのですが細胞の老化そのものは病変ではなく生き過ぎて若さを失い老朽化した細胞に寿命がきたので分裂をさせないための予防措置の一つに過ぎないのです。ところが老化した細胞が間接的に体に及ぼす不具合をもたらすことがあるのです。例えば老化細胞が多量に産生する分泌性のタンパク質が周囲の組織に炎症性の反応を引き起こし動脈硬化のような病変の一因になることが有ります。また組織にherpesによって生じた癌の増殖を促進するという結果を招くことも有るのです。
細胞の老化と個体の老化の違いは何でしょうか?個体の老化と細胞の老化と比べるはずっと複雑でありますが両者にあいだには明らかな相関関係があります。例えば癌抑制遺伝子のp53のタンパク質発現が亢進して発がん率は低下しますが、個体の老化が促進して短命になるのです。またSA-β-gal(老化関連βガラクトシダーゼ)という老化特異的な蛋白質は動脈硬化、関節炎、前立腺肥大、肝臓の肥大のような老化性の組織に多く現れますがこのような組織内で認められるSA-β-gal(老化関連βガラクトシダーゼ)陽性の細胞ではCDK阻害因子であるp16INK4aも増えているのです。CDK阻害因子とは細胞周期エンジンを止めて癌細胞が分裂・増殖させないようにしているのです。
細胞の老化と細胞の癌化とは同じでしょうか?老化と癌とは直接関係がないことを証明しましょう。
細胞の老化とは細胞培養すると細胞分裂がある回数に達した時点で止めることです。子の老化が起こるのは分裂するたびに不可百的な変化が積み重なるからです。この不可逆的な変化とはテロメアの短縮です。どうしてテロメアが分裂をやめてしまうのでしょうか?テロメア自身が勝手に短縮を止めてしまうのではなく「テロメアの短縮」を異常事態として感知する細胞チェックポイントが働いてしまうために細胞周期エンジンのp53ストップするためなのです。それでは何故細胞チェックポイントは「テロメアの短縮」を異常事態として感知するのでしょうか?「テロメアの短縮」がいつまでも短縮し続けると最終的には23本ある染色体構造の維持そのものに支障をきたしてしまい両親からもらった対になった2本の染色体のテロメア同士が癒着きたしたりして物理的に分裂・増殖を行う細胞周期エンジンが一切働かくなるのです。このようなテロメアの短縮が染色体の分裂不能という本当の限界に達する前に、細胞分裂の停止という緊急的な予防措置が取られるのです。テロメアは46本の染色体の両末端部にあり6ヌクレオチドのTTAGGGの反復配列が2000回以上繰り返され分裂・増殖するたびにここが短くなっていくのです。DNA複製のたびに少しずつテロメアは短縮して、ある程度まで短縮が進むと末端を保護する機能が失われてしまいます。これが老化した細胞です。
テロメラーゼとは何でしょうか?テロメラーゼは、染色体末端にあるテロメアと呼ばれる反復配列を伸ばす酵素です。細胞の老化やがん化の鍵を握る酵素として注目を集めていますが癌とは直接関りはないのです。テロメラーゼは、胎児が発達する間や生殖細胞で最も活発に働きます。テロメラーゼの設計図(遺伝子)はすべての細胞に存在しますが、幹細胞や生殖細胞以外の細胞ではテロメラーゼは作られていません。幹細胞のある細胞しか癌にはならないことを意味しています。テロメラーゼの主な役割は①細胞の有糸分裂のたびに累積する損傷を回避する②細胞の寿命を制御する③がん細胞の不死化につながる。
テロメラーゼの働きについて、テロメラーゼは、染色体の末端にあるTTAGGGという反復配列を認識し、これを起点に反復配列を伸ばしていきます。テロメアは細胞分裂のたびに短くなり、テロメアが短縮するとDNA鎖の先端がむき出しになります。これを末端保護問題といい、DNAの複製工場が停止して細胞は分裂できなくなります。テロメアとテロメラーゼと癌については癌細胞の約90%が、短いテロメアを持ちながら高いテロメラーゼ活性を示します。たとえば、口腔癌の75%、肺癌の80%、乳癌の93%、大腸癌の95%が検出可能な微量のテロメラーゼ活性を示します。がん細胞は正常細胞と比較してより頻繁に分裂するため、平均するとテロメア長がより短くなっています。従って、活性型テロメラーゼが存在してテロメア長を維持していなければ、癌細胞は正常細胞よりも速い速度でテロメア長の限界最小値に達することになる前に可能性があると考えられます。テロメア長の限界最小値に達するとは細胞分裂は停止することであり“ヘイフリック限界Hayflick limit”とも呼びます。テロメラーゼは特殊なリボ核タンパク質で、テロメアの反復配列を伸長させる逆転写酵素です。逆転写酵素とは、RNAを鋳型としてDNAを合成する酵素です。逆転写酵素によるRNAからDNAの合成は、RNAとDNAを囲む2本の腕で構成されたポリメラーゼ活性部位で行われます。逆転写酵素は、逆転写を開始する際にプライマーと呼ばれるDNAオリゴヌクレオチドを必要とします。逆転写酵素によって合成されたDNAはcDNA(cは“相補的”を意味する“complementary”の頭文字)と呼ばれ、ゲノムの別の領域に挿入することができます。レトロウイルスの逆転写酵素はDNA合成精度の正確性が高いのです。逆転写酵素とは、RNAを鋳型としてDNAを合成する酵素です。逆転写酵素の主な機能は、二つあり、RNA依存性DNAポリメラーゼ活性と、 RNase H活性の二つを持っています。RNase H はribonuclease H(リボヌクレアーゼH)の略称です。RNase Hは、配列非特異的エンドヌクレアーゼのファミリーであり、RNAとDNAとのハイブリッド基質中のRNAを加水分解による切断を触媒するのが RNase Hです。エンドヌクレアーゼ(Endonuclease)とは、核酸配列の内部で核酸を切断する酵素です。逆転写酵素によるRNAからDNAの合成は、RNAとDNAを囲む2本の腕で構成されたポリメラーゼ活性部位で行われます。逆転写酵素は、逆転写を開始する際にプライマーと呼ばれるDNAオリゴヌクレオチドを必要とします。
逆転写酵素によって合成されたDNAはcDNA(cは“相補的”を意味する“complementary”の頭文字)と呼ばれ、ゲノムの別の領域に挿入することができます。cDNAを用いてPCRを行う手法をRT-PCR法といいます。RT-PCR(reverse transcription PCR)とはRNAに対してPCRを実施する手法である。PCRがDNAを増幅させる技術である。レトロウイルスの逆転写酵素はDNA合成精度の正確性が高く、市販のcDNA合成キットによく含まれています。
テロメラーゼとは特殊なリボ核タンパク質で、リボ核タンパク質とはリボヌクレオタンパク質であり、RNAを含む核タンパク質、即ちリボ核酸とタンパク質の複合体です。テロメラーゼ逆転写酵素(TERT)、内在性RNA鋳型(TR)、および数種の関連タンパク質からなります。テロメラーゼは、染色体末端にあるテロメアを伸長させる酵素で、次のような特徴があります。テロメラーゼ逆転写酵素で英語でTelomerase reverse transcriptaseで略して, TERTです。
テロメアは細胞が分裂するたびに短くなるため、細胞の寿命時計として機能しています。テロメラーゼは、RNA成分と複数の蛋白質からなる巨大な複合体です。テロメラーゼは、胎児が発達する間、細胞分裂が何度も行われるときに最も活発に働きます。その後、ほとんどの細胞でのテロメラーゼの活性は低下し、テロメアは歳とともにだんだん短くなってきます。テロメラーゼの設計図(遺伝子)自体は、すべての細胞にありますが、分裂、増殖する幹細胞や分化していく生殖細胞以外の細胞では、テロメラーゼは作られていないのです。
テロメラーゼは、多くのがんで発現が上昇し、がん細胞の不死化につながります。
主な機能はテロメアの安定化で、これにより染色体の組み換えと末端間融合(end-to-end fusion)が防止されます。テロメアはDNA損傷を認識し、細胞の複製能を制御します。細胞分裂のたびに、DNAの一部が染色体の末端から失われます。これは、従来型のDNAポリメラーゼでは、直線状DNA分子のラギング鎖の3’末端の完全複製が不可能なためです。
テロメア長が限界最小値に達すると、細胞は分裂不能となって細胞の老化やアポトーシスが誘発され、これに伴って細胞内ではp53, p21, およびp16が活性化されます。ヒト体細胞の分裂可能回数は約60~70回で、これを超えると増殖が停止し老化段階に入ります。
テロメラーゼは、染色体の末端に6塩基からなる反復配列(TTAGGG)を追加して幹細胞、生殖細胞およびがん細胞中のテロメア長を維持し、これにより細胞の有糸分裂のたびに累積する損傷を回避します。テロメラーゼは、既存のテロメア反復配列のG連続部分を認識し、これを起点に反復配列を5′-3’方向に伸長していきます。幹細胞、生殖細胞、癌細胞、およびある種の体細胞はテロメアの短縮をテロメラーゼの発現により克服しています。テロメラーゼの発現により、細胞はテロメア長を維持し、老化を回避することができます。
通常の細胞と比べてより高い増殖能をもつ胚性幹細胞は、細胞分裂を重ねてもテロメア長を維持する機構を発達させてきました。胚性幹細胞のテロメラーゼ活性は、潜在的に大きな増殖需要への対応能力の保証となるもので、組織を維持し修復する能力の保存に役立っています。テロメラーゼ活性値は、方向付けされた造血前駆細胞など急速に増殖している幹細胞中や分裂・増殖している活性化リンパ球中では、テロメラーゼ活性値は低値なのです。癌を起こす新旧の細胞を入れ替える時にヘルペスによって癌が起こされる成体幹細胞は低いテロメラーゼ活性を示します。この事実も癌とテロメラーゼが関わりがない証拠の一つであり逆にヘルペスが癌と関りがあることを示しています。何故ならばヘルペスは分裂している細胞のゲノムに侵入して、ゲノムの部分特異的組み換えを起こして初めて細胞を癌化すことができるからです。
左の図に青色の2本の染色体の絵が示されています。2本の染色体の両端にテロメアが短縮するとDNA鎖の先端がむき出しになっていく様子が描かれています。ついでに反復配列の塩基の並びのTTAGGGまで描かれています。左の染色体のEmbryonic stem cellは「胚性幹細胞」であり右のAdult stem cellは「成人の幹細胞」です。
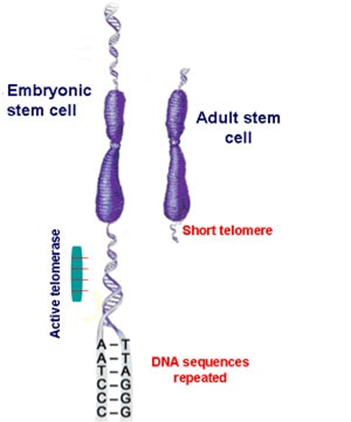
がん細胞の約90%が、短いテロメアを持ちながら高いテロメラーゼ活性を示します。たとえば、口腔癌の75%、肺癌の80%、乳癌の93%、大腸癌の95%が検出可能なテロメラーゼ活性を示しながらテロメアは長くはなりません。逆にがん細胞は正常細胞と比較してより頻繁に分裂するため、平均するとテロメア長がより短くなっています。従って、活性型テロメラーゼが存在してテロメア長を維持していなければ、癌細胞は正常細胞よりも速い速度でテロメア長の限界最小値に達する可能性があると考えられるよりも癌細胞に感染したヘルペスの分裂・増殖によって癌細胞はあらゆる生化学機構を利用されつくされて癌細胞自身が疲弊して飢餓状態になり崩壊脱落しまいます。テロメア長の限界最小値とはさらに核から2本の染色体の両端にテロメアが短縮して遺伝子配列のDNA鎖の先端がむき出しになっている仕事は一体どんな仕事ができるのでしょうか?これを末端保護問題といい、DNAの複製工場が停止して細胞は分裂できなくなりますから分裂不可能になった癌細胞で癌細胞ではなくなるのでテロメアと癌とは全く関係がない証拠の一つとなります。
DNA鎖末端保護問題とは何でしょうか?テロメア(telomere) はギリシア語で「末端」を意味する「テロ(telos)」と「部分」を意味する「メア(meros)」から作られた単語です。テロメアは特徴的な繰り返し配列をもつDNAと、様々なタンパク質からなる染色体の末端にある構造です。細胞が分裂する過程でDNAの複製が行われますが、直鎖状染色体DNAが複製されるとき、新生DNA鎖の5’端は鋳型に比べて短くなります。これは末端複製問題とよばれており、DNA複製がプライマーとよばれる核酸の断片から一方向にDNAを合成していく反応であるために鋳型鎖の3’最末端(新生鎖の5’末端)が合成されないことが原因で起こります。また、鋳型鎖の5’端も複製後に分解されるため、新生鎖と鋳型鎖はともに複製の度に5’末端が50~150塩基ずつ短縮していきます。TTAGGGの反復配列が2000回以上もあるつまり5’末端から遺伝子が失われていくことになりますが、テロメアが付いているためテロメアが短縮していくことになります。そして、テロメアがある一定の短さに達すると分裂は起こらなくなります。しかし、テロメアは細胞分裂のたびに短縮するのではなく、テロメラーゼと呼ばれる酵素によって伸張が行われます。この酵素がない細胞では、細胞分裂のたびにテロメアが短くなります。テロメラーゼはヒトの癌細胞が生まれる体細胞では発現していないか、弱い活性しかもちません。従ってテロメラーゼとテロメアとがんの分裂・増殖とは関わりはないのです。
テロメラーゼ阻害剤は癌細胞や正常な細胞の老化とアポトーシスを加速することができるものの、正常に増殖している細胞や幹細胞を破壊するおそれもあります。
テロメラーゼの主な機能はテロメアの安定化で、これにより染色体の組み換えと末端間融合(end-to-end fusion)が防止されます。テロメアはDNA損傷を認識し、細胞の複製能を制御します。細胞分裂のたびに、DNAの一部が染色体の末端から失われます。これは、従来型のDNAポリメラーゼでは、直線状DNA分子のラギング鎖の3’末端の完全複製が不可能なためです。
テロメア長が限界最小値に達すると、必ず細胞は分裂不能となって細胞の老化やアポトーシスが誘発され、これに伴って細胞内ではアポトーシス誘発因子であるp53と,細胞周期エンジンに対するブレーキとして働くCDK阻害因子である p21, およびp16とが活性化されます。ヒト体細胞の分裂可能回数は約60~70回で、これを超えると増殖が停止し老化段階に入ります。テロメア(telomere)は染色体両腕の末端部分で染色体の形態を保持するために必須な領域であり、また、テロメアは細胞分裂に伴って起こるDNA末端の短縮が、遺伝子領域にまで及ぶのを防ぐ役割も持つ。細胞分裂に伴うテロメアの短縮が、一定の長さにまで達するとテロメア長が限界最小値に達することになり細胞分裂は停止し、このことを“ヘイフリック限界Hayflick limit”と呼びます。
細胞周期チェックポイントは何でしょうか?細胞周期チェックポイントとp53との関わりは何でしょうか?p53は細胞周期チェックポイント機構の一部として機能します。p53は転写因子の一種で、細胞が受けたストレスの強さに応じてさまざまな遺伝子の転写を活性化します。また、p53は細胞周期チェックポイント機構のほかにも、DNA修復、老化、血管新生、アポトーシス誘導など、細胞のさまざまな機能に関与しています。
細胞周期チェックポイント機構では、DNA損傷などの異常を感知したATMなどのキナーゼがp53タンパク質をリン酸化して活性化し、p21タンパク質の発現を誘導します。p21はサイクリン-CDK複合体に結合してCDKを不活性化し、DNA合成などを抑制して細胞周期を制御します。ATM とはATMはセリン/スレオニンキナーゼであり、DNA損傷応答において中心的な役割を担うがん抑制遺伝子である。DNA二本鎖切断に反応してTP53をはじめとする多くの下流の分子をリン酸化することで活性化し、DNAの修復反応、細胞周期の停止およびアポトーシスの誘導を引き起こす。生殖細胞系列バリアントは悪性腫瘍を高頻度で合併することで知られる常染色体劣性遺伝の疾患である毛細血管拡張性運動失調症 (A-T)や、常染色体劣性遺伝の疾患である遺伝性乳癌と関連することが知られている。ATMの機能喪失は相同組み換え修復異常をきたす。
細胞周期で大切なのは細胞分裂を完成するまでの正確な順番であります。例えば細胞のDNAがダメージを受けた場合、細胞周期エンジンがこのままDNAの複製や分裂に入ってしまうと正常な細胞を作ることはできません。このような異変に対応してくれるのが細胞チェックポイントでありこのような異常な事態が解決されるまで細胞周期の進行を一時的に止めておく仕組みが細胞チェックポイントなのです。細胞チェックポイント系には細胞周期エンジン系とは独立したタンパク質が関与しており、「非常事態」に備えての待機要員の役割があるのです。ところが「非常事態」であるDNAのダメージなどは細胞の中では日常的な出来事であるので細胞チェックポイント系は毎日フル稼働しているのです。
DNAがダメージを受けた時に働くのが「DNA損傷チェックポイント」なのです。このシステムで中心的な働きをしているのがATM(Ataxia-telangiectasia mutated訳して毛細血管拡張性運動失調症変異)とATR(Ataxia telangiectasia and Rad3-related protein)という二つのタンパク質なのです。ATMとATRはどちらもDNA損傷を細胞に知らせるが、その損傷の種類は異なっている。ATMは細胞に重大な危険をもたらす二本鎖切断に注目するが、一方ATRは一本鎖DNAを識別する。この場合、未修復の鎖が1本あるだけで細胞の死につながることがある。一本鎖領域は通常、DNAを複製するときにできるが、DNAポリメラーゼが停止すると、ヘリカーゼが二重らせんをほどき続け、危険なほど長い一本鎖区間がつくられてしまう可能性がある。一本鎖DNAは、修復の過程で切断されたDNAの末端にもできる。これは、DNAを再接続する前に末端が切り取られるからである。ATMとATRはDNAの損傷を見つけると、細胞周期の管理とDNA修復に関わる何百ものタンパク質をリン酸化し活性化する。この対象となるタンパク質には、p53腫瘍抑制因子(p53 tumor suppressor)や、相同組換え経路に関わるRAD51のようなタンパク質が含まれる。なお、相同組換え経路とは、無傷の染色体コピーを使って損傷した染色体を修復・復元する忠実度の高いDNA修復過程のことです。
それではATMは(Ataxia-telangiectasia mutated訳して毛細血管拡張性運動失調症変異で「mutated」は「突然変異した」は、毛細血管拡張性運動失調症(ataxia telangiectasia、AT)の原因遺伝子であります。因みにataxia telangiectasiaの日本語の訳についてはataxiaは運動失調(症)でtelは末端でangiは血管でectasiaは拡張(症)でまとめて前から訳すと「運動失調(症)-末端血管拡張」となるのですが「末端血管」は「毛細血管」のことですから医学用語的に訳すと「毛細血管-拡張性-運動失調症」となるのです。
癌とヘルペスとテロメラーゼとテロメアの関りはどうなっているのか?
細胞の若返りと癌の悪性化は表裏一体であるのはどんな意味を持つのでしょうか?
p21Cip1とは何でしょうか?p21Cip1はCDK阻害因子でCKIと書きます。阻害因子(CKI)とは、細胞周期エンジンであるサイクリンーCDKに結合してその活性を抑制するタンパク質で細胞周期エンジンに対するブレーキとして働きます。人では7種類の阻害因子(CKI)があり大きく2タイプに分かれます。一つ目はCip/Cファミリーでp21Cip1とp27Kip1とp57 Kip2の三つがありサイクリンとCDKの両方にまたがる形で結合してCDK活性を阻害します。二つ目はINK4ファミリーでp16 INK4a,p15 INK4b、p18 INK4c、p19 INK4dの四つがありCDK(CDK4と CDK6)の部分だけと結合する性質をもっているのです。
転写因子のp53は癌抑制遺伝子でありヘルペスによって癌化してしまうと、異常なp53は癌抑制遺伝子の機能である癌細胞が分裂して増殖することを抑制できなくなります。p53とは何でしょうか?がん抑制遺伝子として最も重要な転写因子で、がん化リスクを断つ働きがあります。p53の主な働きは①細胞周期を止めて過剰な増殖を防ぐ②DNAの損傷を修復する③アポトーシスと呼ばれる細胞死プログラムを活性化してがん細胞を根絶する。p53はヒトの癌において最も高頻度に変異が認められる遺伝子で、多くのヒトがん患者で機能が喪失しています。また、p53の変異を検出する抗体である「P53抗体」を用いて、早期がんの検出を行うことができます。食道がん、大腸がん、乳がんなどの腫瘍マーカーとして利用されており、血液検査で調べられるため身体的負担が小さいという特徴があります。
具体的なp53の正常な機能の一つは幹細胞、どんな細胞が分裂して増殖(分裂・増殖)させるかどうかを決定する細胞周期チェックポイントの働きをも失ってしまい、p53の正常な細胞周期チェックポイントの機能を失われなかったら癌細胞が分裂増殖することを止めることができるのです。つまり癌細胞が分裂を続けることを決定するのはテロメアが短いとか長いとは全く関係ないのです。「テロメアの短縮」を異常事態として感知した細胞周期チェックポイントが分裂は細胞分裂をストップさせたのです。
染色体はなぜ凝縮するのですか?
私たちの体は約40兆個の細胞からできていて、その1個1個の細胞に全長約2メートルにも達するゲノムDNAが収められています。 ゲノムDNAは、細胞が分裂する際に切れたり、絡まったりするのを防ぐために凝縮し、染色体と呼ばれる46本のDNAの束になるのです。
全長約2mの染色体を凝縮して顕微鏡で見えるようにさせるのは何か?1つのヒト細胞に含まれるゲノムDNA染色体は、全長約2mに達する。分裂の過程で複製したDNAを正確に分配するには、規則正しく折りたたんで染色体へと「凝縮」させる必要がある。人の染色体DNAはヒストンを主成分とする蛋白質に巻き付いたクロマチンという構造をとっています。S期で複製されたDNAがM期で分配されるときには高度に凝縮されて染色体(クロモソーム)という形態をとるのを染色体凝縮なのです。1個の細胞に全長約2メートルにも達するゲノムDNAがばらばらに散在していたにもかかわらずゲノムDNAが染色体(クロモソーム)に凝縮できるのでしょうか?
染色体(クロモソーム)の凝縮で中心的な働きをするのはコンデンシンという蛋白です。コンデンシンとは何でしょうか?コンデンシンは、染色体の構造形成において中心的な役割を果たすタンパク質複合体で、染色体の凝縮を促します。コンデンシンの役割は①染色体の高次構造を形成する②染色体の中心付近でクロマチンドメイン同士を結びつけるヌクレオソーム(染色体を構成するクロマチンの単位構造)の揺らぎを抑える。クロマチンドメインはChromo (Chromatin Organization Modifier) ドメインのことであり30–70アミノ酸残基からなるタンパク質モジュール(組み立てユニット)で、クロマチン上へのタンパク質複合体の集合に関与する多くのタンパク質でみられます。クロマチン(染色質)とは、真核生物の細胞核にあるDNAとヒストンタンパク質との複合体で、染色質とも呼ばれます。DNAの配列と構造を保ちながら核に効率的にDNAを収納する役割があります。クロマチンの構造は4種類のヒストン(H2A、H2B、H3、H4)の各2個が形成した8個のタンパク質複合体に約146塩基対のDNAが巻き付いたヌクレオソームが、数珠状に連なっています。ヌクレオソームとは、ヒストンと呼ばれるタンパク質とDNAが結合した構造で、染色体を構成する基本単位です。真核生物の核に存在し、DNAを収納する役割や遺伝子の発現制御などに関わっています。ヌクレオソームとは、ヒストンと呼ばれるタンパク質とDNAが結合した構造で、染色体を構成する基本単位です。真核生物の核に存在し、DNAを収納する役割や遺伝子の発現制御などに関わっています。ヌクレオソームの構造はヒストンH2A、H2B、H3、H4の各2分子ずつが集合したヒストン八量体(円盤状)の周りにDNAが巻き付いた構造でDNAはヌクレオソームを架橋する形(化学結合によって結ばれること)で数珠状につながり、クロマチン線維を形成する。隣接するヌクレオソームはリンカーDNAと呼ばれる拘束されていないDNAによって連結されている。ヌクレオソームの機能は①DNAを安全に包む機能と蓄積している遺伝子の活動を部分的に変更する機能と転写や複製の制御など幅広い役割をはたします。②ヌクレオソームはヒストンの化学修飾を介したエピジェネティックな制御など、細胞において幅広い機能をもちます。③ヌクレオソームは、電子顕微鏡によって得られた像が、ひもでつながったビーズ(beads-on-a-string)のような形状をしており、分裂期における染色体の構造形成に寄与しています。④セントロメア領域(染色体のくびれたの部分のDNA)の構造的な安定性や動原体の機能にも寄与しています。
染色体の凝縮を促すコンデンシンの特徴は①バクテリアからヒトまで広く保存されている②高等真核細胞ではコンデンシンIとコンデンシンIIの2種類が存在する③DNA依存性のATP加水分解活性をもつ③クロマチンの空間配置を再構築することにより染色体を凝縮する。コンデンシンによる染色体凝縮の仕組みは①コンデンシンは巨大なリング状の構造をしており、クロマチンをリングにとらえてたばねることにより染色体を凝縮する。②コンデンシンは染色体の中心付近でクロマチンドメイン同士を「クリップ」のように結びつける③コンデンシンはヌクレオソームの揺らぎを抑える。
老化した細胞が増殖しなくなるのは何故か?細胞の老化仕組みとは何か?細胞老化(さいぼうろうか)とは細胞が分裂を停止し、増殖できなくなった状態が不可逆的に引き起こされること。ゲノムの不安定化などによって引き起こされ、細胞ががん化することを抑制する防御反応であると考えられている。個体の老化になぞらえて名付けられたが、個体老化と細胞老化の直接的な関連については議論が続いている。
ヒトの初代培養細胞に「ヘイフリック限界」と呼ばれる分裂回数の制限があることが発見され、細胞老化は狭義にはこの限界に達した細胞の状態を指した。後の研究で、生体内 (in vivo) の細胞でも、自己防御のための積極的な細胞老化が起こることがわかってきた。この現象は未成熟細胞老化と名付けられたが、人工的な条件下 (in vitro) で起こるヘイフリック限界よりも、生物学的な意義が認められ、「細胞老化」が未成熟細胞老化を指す場合もある。
未成熟細胞老化はさまざまな生物学的ストレスにより引き起こされる。例えばテロメアが短縮すると染色体が不安定になり、がん化の原因となる。このため、テロメアの長さを監視する機構があり、一定以上短くなると一時的な細胞老化が誘導される。またDNAの切断が生じた場合も、細胞周期を停止させ細胞分裂が起こらないようにし、その間に染色体の修復を行う。それでも復旧できなかった場合は不可逆的な細胞老化状態に入るか、アポトーシスによって排除されるが、これらの機構を逃れた細胞はがん化する。このように細胞老化の多くの原因はDNA損傷によって誘導される。DNA損傷は放射線や変異原、酸化ストレスによって引き起こされる。
正常な細胞の癌抑制遺伝子である転写因子p53の働きの一つは、異常事態として「テロメアの短縮」を監視する細胞周期チェックポイント機能を働かせて細胞周期エンジンをストップさせるのです。細胞周期チェックポイント機構では、DNA損傷などの異常を感知したATMなどのキナーゼがp53タンパク質をリン酸化して活性化し、p21タンパク質の発現を誘導します。p21はサイクリン-CDK複合体に結合してCDKを不活性化し、DNA合成などを抑制して細胞周期を制御します。細胞周期チェックポイント機構では、DNA損傷などの異常を感知したATMなどのキナーゼがp53タンパク質をリン酸化して活性化し、p21タンパク質の発現を誘導します。p21はサイクリン-CDK複合体に結合してCDKを不活性化し、DNA合成などを抑制して細胞周期を制御します。
細胞老化とは細胞の分裂のたびに不可逆的な変化であるテロメアの短縮が積み重なるから50~60回で細胞分裂が停止してしまって細胞老化が起こるとされていますがこれは間違いなのです。細胞分裂が停止してしまうのは「テロメアの短縮」を「DNAの損傷」と同じように異常事態として感知する細胞チェックポイントが働くために細胞周期がストプするので細胞分裂が止まるのです。
細胞老化の経路には二つの経路があります。p53経路とp16INK4a経路です。まずp53経路では「DNAの損傷」や「テロメアの短縮」によって活性化する転写因子であります。「DNAの損傷」や「テロメアの短縮」ではp53による転写活性化の標的はp21Cip1で、p21Cip1を介して細胞周期を停止させます。細胞周期が停止するとp53の働きが抑えられてテロメアが短くても細胞はさらに分裂を続けるようになります。
二つ目のp53とは別に老化が起こる場合がp16INK4a経路であり老化している細胞ではp16INK4aの発現が亢進するのです。p16INK4aはCDK阻害因子でありサイクリン-CDKに結合してその活性を抑制するタンパク質細胞周期エンジンに対するブレーキとして働きます。癌抑制遺伝子でもあります。p16INK4aはCDK4を阻害することによってpRBの活性を抑え細胞をR点の手前で止めることのよって分裂を停止させるのです。
R点やpRBとは何でしょうか? 分裂増殖中の細胞は分裂の初めから分裂のおわりまでの間が細胞周期一回分です。細胞周期の順序はG1期→S期→G2期→M期の4つで細胞周期一回分になります。G1期の中には目に見えないのですが一つの重要なポイントであるR点(restriction point 訳して制限点)があって、このR点より前にいる限りは細胞は静止していて細胞周期には入らないのです。ところがいったんR点を通過すると元には戻らず自動的に自律的にG1期→S期→G2期→M期と進み始めるのです。
それではR点前後では何が起こっているのでしょうか?実は細胞周期をR点の前で止めているのはRBタンパク質(RB protein,略してpRB)であり、R点を通過させるにはそのpRBの制止(ブレーキ)を解除する必要があります。pRBはかの有名な網膜芽細胞腫(retino blastoma 10月)という小児癌の原因遺伝子である癌抑制遺伝子から発現した蛋白質であり、他のタンパク質と結合してその活性を調節する機能を持っているのです。細胞がR点の前にある段階ではpRBはE2Fという転写因子と結合してE2Fの働きを抑えているのです。転写因子とは遺伝子の転写を調節するタンパク質です。pRBがリン酸化されてE2Fから乖離すると、自由になったE2Fは増殖の開始に必要な一群の遺伝子の転写を活性化して細胞周期の進行をスタートさせるのです。
E2Fは転写に対して二通りに働きます。転写を活性化する転写活性化型と、転写を抑制すると転写抑制型です。転写活性化型はG0期にはpRBと結合して活性が抑えられていますがpRBが離れると転写活性因子として働きます。転写抑制型はG0期には遺伝子プロモーターに結合して転写を抑えていますが、増殖刺激があると活性型のE2F(E2F1~E2F3)と入れ替わってしまうのです。
G0期とは何でしょうか?G0期とは増殖能力は保ちつつも細胞分裂を停止している状態のことを指します。 実は、体内に存在する細胞のほとんどはG0期にとどまっており、増殖を停止しています。細胞は決まった周期で分裂と増殖を繰り返していますが、その周期から外れて休止している状態をG0(ジーゼロ)期といいます。 筋肉、心臓、神経など、ヒト体細胞の90%以上はこのG0(ジーゼロ)期の状態にいるのです。G0期とは増殖能力は保ちつつも細胞分裂を停止している状態のことを指します。実は、体内に存在する細胞のほとんどはG0期にとどまっており、増殖を停止しています。これは細胞が接触しているために生じる性質として考えられておりコンタクトインヒビション(細胞の接触障害)と呼ばれています。これによって臓器が過剰に大きくなったりすることを防止しています。接触阻害(Contact inhibition)とは、細胞がお互いに接触するまでに増殖した場合に起こる細胞の増殖が停止する細胞の性質のことである。接触阻止とも言われます。
何故細胞培養では細胞が培養皿にいっぱいに増えるとそこで細胞の増殖が止まることを接触阻止と言います。何故細胞の増殖が止まるのでしょうか?血球系の細胞を除く多くの細胞は培養皿の底に接触した状態でないと増殖できないのです。これを培養細胞の足場依存性と言います。接触阻止と足場依存性は細胞間接着や細胞-細胞マトリックス接着による増殖制御がきちんと働いている証拠なのです。
接触阻止がきちんと働くようであれば細胞周期を同調させ細胞周期の足並みをそろえる必要があるので都合がよいのです。細胞周期を同調させる最も単純な方法は細胞培養液から必ず培養液に加える血清を除くことによって血清飢餓の状態にすればよいのです。何故ならば血清に含まれる増殖因子がないと細胞培養に細胞を増やせという増殖シグナルが細胞に伝わらないからです。従って血清に含まれている増殖因子が無くなれば細胞はG1期のR点の手前で止まってしまいどんな細胞の増殖も休止状態になってしまうのです。その後すぐに増殖因子が含まれている血清を加えてやれば細胞周期を一斉にスタートさせることが出来るのです。
ところがヘルペスによって癌関連遺伝子が癌化されてしまった癌細胞のような増殖性の高い細胞では接触阻止や血清飢餓が十分に効かなくなっておりこの時に用いられている薬剤もすでに開発され、DNA複製の阻害剤はS期で細胞周期を止めます。さらに細胞を二つに分ける仕事をしてくれる微小管重合の阻害剤は細胞周期のM期で停止させてくれます。このDNA複製の阻害剤と微小管重合の阻害剤はよく使われる薬剤です。
再びテロメアの続きに戻ります。
ヘルペスによって突然変異を起こされ癌化してしまった癌細胞は「テロメアの短縮」を異常事態からできたとして監視する細胞周期チェックポイント機能がp53の異常のために働かくなり細胞周期エンジンを停止させることができなくなって癌細胞は無限に分裂増殖を続けるのです。「テロメアの短縮」は直接には癌細胞が無限に分裂増殖を続けることとは無関係なのです。
テロメアとは何でしょうか?真核生物の染色体の末端部にある構造で、染色体末端を保護する役目をもっているだけです。テロメアによって染色体末端を保護されていても「テロメアの短縮」のために最終的には染色体構造の維持そのものに支障を起こしてしまうとたとえば2本の染色体同士やテロメア同士がテロメアによって染色体末端が癒着をきたしたりして物理的に分裂不能となるのですがこれもテロメアの短縮が原因ではないのです。つまりテロメアの短縮が本当に限界に達して問題が起こる前に分裂の停止という予防措置が取られるのです。これも細胞周期チェックポイントの大切な役割の一つなのです。
癌細胞の不死化はテロメアやテロメラーゼに関わりがありますか?全く関係ありません。
細胞が分裂増殖するには自身のDNAを複製する必要がありますが、通常のDNAポリメラーゼを介した仕組みではDNA鎖の両端(テロメアDNA)が完全には複製されず、徐々に失われていきます。これを末端複製問題(end replication problem)といいます。テロメアはもともと染色体の末端を保護する役割を持っていますので、その短縮が限界に達しますと、DNA鎖の先端がむき出しになってしまいます。がん細胞ではたいてい、テロメラーゼ(telomerase)と呼ばれるテロメア合成酵素が活性化しており、この酵素の働きによってテロメアが安定に維持されます。がん細胞が無限に分裂出来るのはこのためですといわれますがウソです。すでに説明したようにがん細胞が無限に分裂出来るのはヘルペスによって突然変異を起こされ癌化してしまった癌細胞は「テロメアの短縮」を異常事態として監視する細胞周期チェックポイント機能がp53の異常のために働かくなり細胞周期エンジンを停止させることができなくなって癌細胞は無限に分裂増殖を続けるのです。「テロメアの短縮」は直接には癌細胞が無限に分裂増殖を続けることとは無関係なのです。要するに異常なp53が細胞周期エンジンを停止させることができなかったからです。
テロメアとがん細胞の不老不死性とテロメラーゼによるテロメアの再生と細胞の不老不死化とは何でしょうか?細胞が分裂増殖するには自身のDNAを複製する必要がありますが、通常のDNAポリメラーゼを介した仕組みではDNA鎖の両端(テロメアDNA)が完全には複製されず、徐々に失われていきます。これを末端複製問題(end replication problem)といいます。テロメアはもともと染色体の末端を保護する役割を持っていますので、人の細胞は60~70回の分裂でその短縮が限界に達してしまうので、DNA鎖の先端がむき出しになってしまいます。DNAの複製工場は操業停止となり、細胞はもはや分裂することが出来なくなります。細胞も老化してしまうのです。テロメアは細胞老化のいわば時限爆弾装置として働いており、つまり自動的にDNAの複製工場は操業停止となりこれは、私たちの身体の中で、異常な増殖性を持った細胞ががん化するのを未然に防ぐ仕組みのひとつとなっています。
ところが実際は人が老化する前に癌がいくらでも起こっているのは何故でしょうか?テロメアは細胞老化だけの時限爆弾装置として働いているのでしょうが異常な増殖性を持った細胞ががん化するのを未然に防ぐ仕組みのひとつとなっていると言われている論理とは結び付かないのです。この論理は癌は老化とは直接かかわりがないのです。老人に癌が多いのは長生きすればするほど生きるためのストレスがそれだけ多くなり免疫が低下して無限大のヘルペスが増え続けて最期にヘルペス感染症の最終段階が癌死なのです。癌は特別な病気ではないのです。癌はあくまでもヘルペスが正常な癌関連遺伝子の癌原遺伝子と癌抑制遺伝子を一般には長い長い時間をかけて突然変異をさせたために生じたヘルペスウイルス感染症によって生じた病気であるにすぎないのです。
既に論理的に説明したようにテロメアは染色体の末端を保護するために存在しているだけで癌とは全くか変わりはないのです。また癌細胞になれる正常な体細胞にはテロメラーゼはほとんど存在していないのも癌とテロメラーゼとは関係がないという証拠のひとつです。
癌細胞と正常細胞との実際的な違いはどこにあるのでしょうか?病理医が顕微鏡で見て「癌」と診断するとその病変はがんと診断されます。理論的には二種類の癌関連遺伝子のワンセットがヘルペスウイルスによって癌化すれば癌であると定義されますが病理医が顕微鏡で見てわかるはずもありません。ましてや良性腫瘍と悪性腫瘍の違いを正確には病理医が診断するのは不可能です。しかも二種類の癌関連遺伝子は1個の細胞の23500個のうち800個もありますが癌化した変異遺伝子の組み合わせ多数あるかどうかや初期の癌では知る由もありません。すでに述べてようにリンパ節転移がどのように起こるのかも誰も説明していません。さらに転移があるかどうかも正確には知ることはできないのです。遠隔転移が起こった時には莫大な数のヘルペス癌細胞に潜んでいるので癌細胞の数がどんなスピードで成長していくかもわからないのです。癌の転移能力の有無やスピードはヘルぺスが増える度合いによって決まります。ヘルペスを増えない方法は免疫を落とさない道しかありません。現代の三大標準がん治療は対症治療にすぎないので免疫が低下するだけですから誰も癌を治すことが出来ないのです。免疫を低下させない生き方が癌にならない唯一の予防法です。免疫を下げない生き方は個人によって千変万化します。自分自身しか最良の答えを出せません。しかしながら癌にならないヘルペスを増やさない根本的な生き方は「欲をかき過ぎないこと」「幸せという名の快楽を求めすぎないこと」「他人の喜びを自分の喜びに感じ取れる心の在り方を身に着ける」ことに尽きます。実行可能ですよ。癌で死にたくなければ簡単に実践できますよ。
癌関連遺伝子の一つである癌原遺伝子だけでも悪性腫瘍ができるか?もう一つの癌関連遺伝子の癌抑制遺伝子が正常であれば良性腫瘍のままか又は悪性腫瘍の癌と誤診された良性腫瘍が正常な癌抑制遺伝子のアポトーシス(良性腫瘍細胞の自殺)の働きによって消滅することもあります。これが故近藤誠先生の言う「もどき癌」なのです。
癌細胞はどの様に分裂増殖していくのでしょうか?ヘルペスによる癌関連遺伝子変異の蓄積は、最終的に細胞のDNAを複製して染色体を二つの分裂した細胞に分け癌細胞が増えていきます。細胞周期チェックポイント調節に必要とされるサイクリンD1の遺伝子は元々癌原遺伝子でありこれがヘルペスにより癌化してしまうと多くの正常な増殖因子の標的となり癌化してしまったサイクリンD1の遺伝子が過剰に発現している細胞は増殖刺激を自ら発信しているような状態となります。実際にサイクリンD1の過剰発現が多くの癌細胞に認められるのは細胞周期に密接にかかわるサイクリンD1の遺伝子が癌化してしまったからです。本来、正常な状態では、増殖シグナルの産生および伝播ならびに細胞増殖が高度に調節されて正常な細胞周期が維持されているのです。このように増殖プロセスの厳密な制御は、健全な組織の構造および機能の維持をサポートします。増殖に関連するシグナル伝達経路は、通常、必要になると活性化され、不要になると不活性化されているのです。
細胞周期調節不全について。
悪性細胞のホールマーク(特徴)の一つは、恒常的調節の喪失および持続的、あるいは制御不能な増殖です。正常なホメオスタシスを維持するために、細胞分裂周期は厳密に制御されています(図2.1)。ヒトがんでは、細胞周期のG1期に調節不全が生じ、そこで細胞は増殖を開始するか、細胞周期から逸脱しG0期の静止状態に入ることになります。
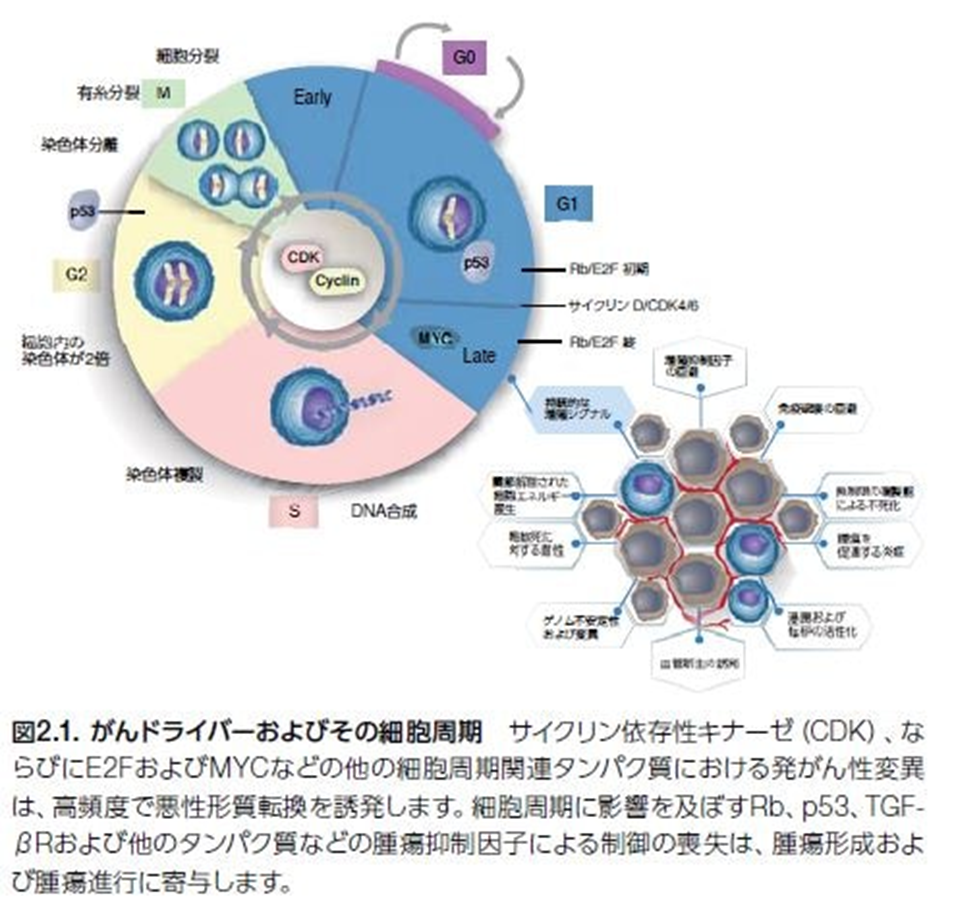
細胞増殖の検出について。
腫瘍抑制因子TP53をコードする遺伝子における体細胞変異は、ヒトゲノムの他の既知のドライバー遺伝子に影響を及ぼす変異よりも高頻度で発生します。p53シグナル伝達の調節不全は、無制御な細胞増殖を引き起こします。また、TP53における生殖細胞系列の異常は、リ・フラウメニ症候群(さまざまながんの早期発症の素因がある状態)を生じます。ドライバー遺伝子とは癌原遺伝子のことでありそれにたいしてパッセンジャー遺伝子は癌抑制遺伝子のことです。二つの遺伝子がヘルペスによって突然変異してしまうと癌細胞が生まれるのです。
増殖因子シグナル伝達について。
正常細胞および多くの腫瘍において、G1初期は、マイトジェン依存性で、増殖因子の存在を必要とします。マイトジェンとは何でしょうか?分裂促進因子(mitogen)のことで、細胞分裂(有糸分裂ともいわれ英語でmitosis)の開始を誘導する低分子量タンパク質などの物質である。有糸分裂促進因子、有糸分裂誘発因子、マイトジェンなどの名称で呼ばれることもある。一方、G1後期はマイトジェン刺激に依存せずに継続します。しかしながら、一部の腫瘍はリガンド依存性の増殖因子シグナルの非存在下における増殖能を獲得します。腫瘍細胞増殖に関与すると考えられる増殖因子経路の多様性を図2.2に示します。
上皮成長因子受容体(EGFR)を介する腫瘍細胞シグナル伝達は、リガンド依存性およびリガンド非依存性の受容体活性化機構を介して機能します。例えば、特定のタイプの神経膠芽腫は、EGFRの細胞外ドメインの欠失を抱えているにもかかわらず、構成的活性化型のシグナル伝達を介して発現します。
がん増殖および成長の調節不全については、以下の①~⑤に示すように多くの点において明らかにされ実証されています。
①腫瘍による増殖因子産生増加
②悪性細胞表面における増殖因子受容体数増加
③形質転換細胞における受容体構造変化
④腫瘍微小環境において産生した増殖因子に対し、がん性細胞が不適切に反応する
⑤増殖因子受容体のタンパク質下流の調節不全
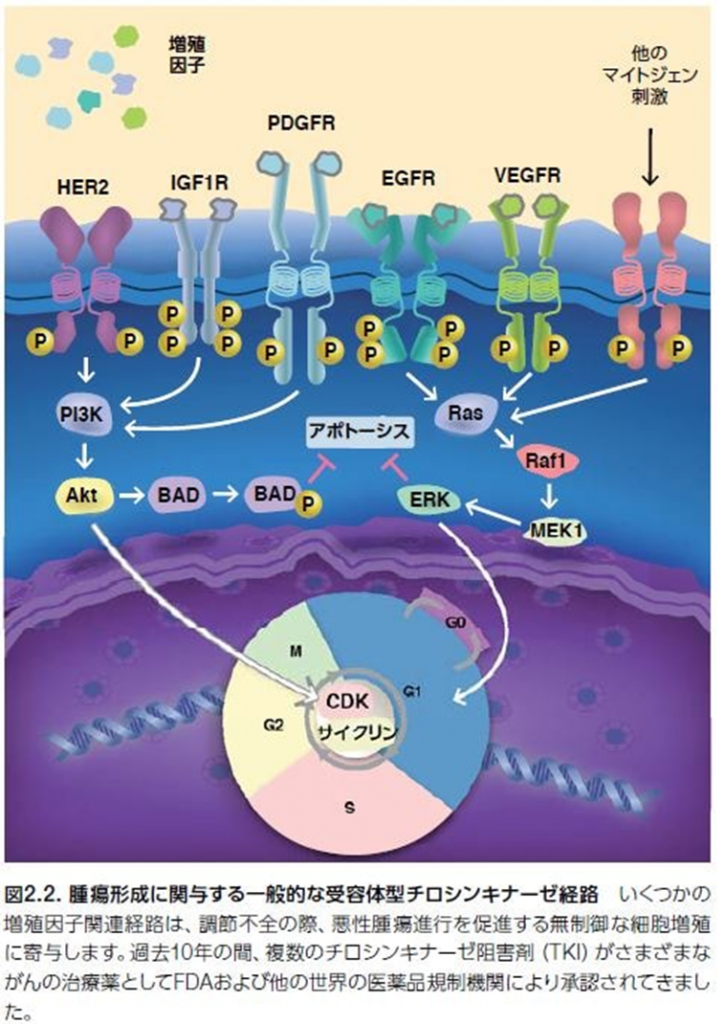
受容体型チロシンキナーゼ(RTK)について。
通常、増殖因子受容体型チロシンキナーゼの活性化は、リガンドの受容体細胞外ドメインへの結合から始まります(図2.3)。続いて、受容体の細胞質側末端のキナーゼドメインのチロシン残基の自己リン酸化が生じ、細胞増殖および他のプロセスに重要な遺伝子を制御する下流シグナル伝達タンパク質のためのドッキングステーションとして機能します。
上皮成長因子(EGF)は、上皮腫瘍において高発現するタンパク質であるEGFRに結合します。EGFR経路は標的治療のモデルで、実際にがん治療薬の標的としての最初の増殖因子受容体として提唱されました。腫瘍細胞増殖に関与する一般的な増殖因子経路の代表例を表2.1.に示します。がん治療薬として承認されたチロシンキナーゼ阻害剤(TKI)の標的とされている増殖因子受容体は太字で表示しています。
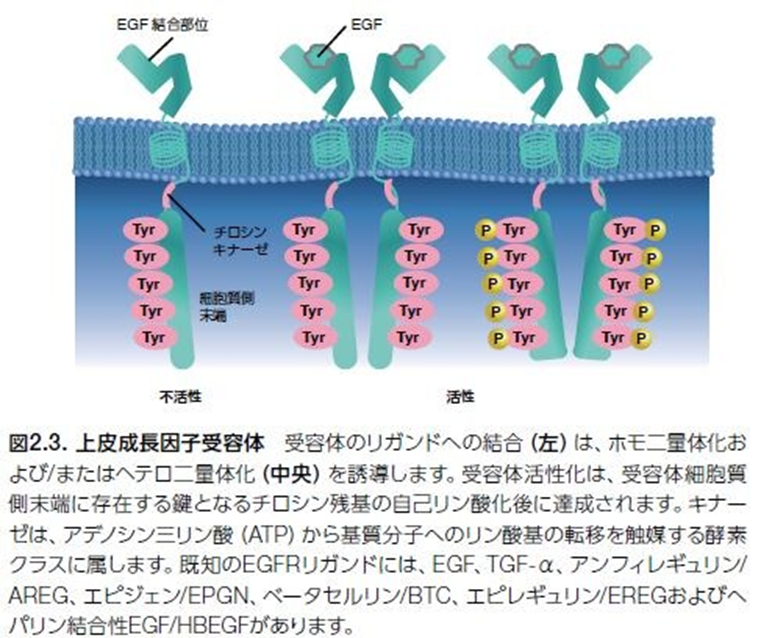
癌の定義は何でしょうか?臨床においては定義されてはいません。しかし確実なことは「ヘルペスウイルスによって遺伝子に異変が起きた細胞です。」がんになった細胞には通常では起こりえない遺伝子の突然変異が生まれ、突然変異によって生じた異常細胞が増殖してこの細胞集団に次々と第二、第三の突然変異が生じてこつ然と現れたのが癌細胞なのです。ゲノムに含まれている2万3500個の遺伝子のうち特定の遺伝子である併せて800個近くの癌関連遺伝子である癌原遺伝子と癌抑制遺伝子の二つが突然変異をherpesが起こした遺伝子病なのです。
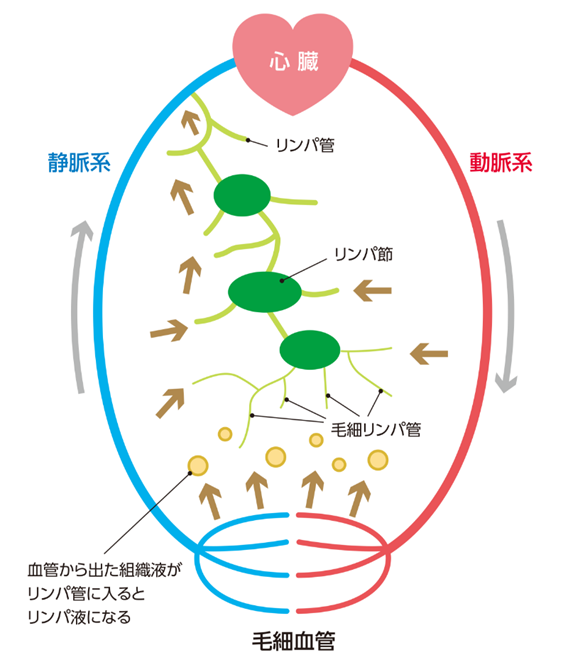
リンパ廓清は何故行われるのか?何故リンパからリンパ節から臓器に癌細胞は転移しないのもかかわらずリンパ節転移、転移と騒ぐのか?リンパ系はリンパ管、リンパ節などの組織で構成されており、リンパ管の内部には、リンパ液という液体が流れています。全身をめぐる血液の一部は、全身の細い血管(毛細血管)から染み出して体の隅々(末梢組織)まで酸素や栄養素を届けた後に、一部は再び血管に戻ります。組織から毛細静脈に戻らなかった水分(組織液)やさまざまな老廃物や癌細胞などは毛細リンパ管に入り、リンパ液となります。毛細リンパ管は集まってリンパ管となり、最終的に静脈に流入します。これがリンパ管のネットワークでリンパ系と呼ばれます。
がんはなぜリンパ節転移をするのか?リンパ液とは何か?末梢組織液であるリンパ液は毛細リンパ管からリンパ管内を流れるのですが、人間のリンパ系には心臓のようなポンプがありません(両生類や爬虫類にはあります)。筋肉の動きによってリンパ液が心臓へとリンパ系を通じて流れていきますが心臓から動脈のような高い圧力で流れてきた酸素と栄養素を細胞に送った残りの組織に溜まった水分(組織液)がリンパ液なのです。このリンパ液はいったん組織に出てしまった血液の残りとして毛細リンパ管に吸収されるので動脈の圧が無くなっています。そのこともあり、リンパ管の内壁は薄く、がん細胞などの細胞も侵入しやすくリンパ管に吸収されやすくなっています。このため、近隣の原発巣で生じたがん細胞がリンパ管に侵入し、ゆっくりした流れのリンパ液に乗ってリンパ節にやってきます。リンパ節の第一の役割は何でしょうか?骨髄で作られたTリンパ球は胸腺でナイーブCD8十キラーT細胞とナイーブCD4十ヘルパーT細胞とに最初に分けられてから血管を通って更にリンパ節の細静脈であるHEVと言われる高内皮細静脈(high endothelial venule略して HEV)から700個もある最初のリンパ管にあるリンパ節に入ります。このリンパ節ではじめてAPC(抗原提示細胞)に運ばれてきたナイーブCD8十キラーT細胞とナイーブCD4十ヘルパーT細胞は初めて外敵を認識する教育を受けるのです。リンパ節の第一の役割は抗原と出会ったことがない未熟で初心なT細胞を成熟させる初等の免疫教育を行う学校にすぎないのです。決してT細胞が外敵である病原体や癌細胞と戦う戦場ではないのです。つまり多くの場合、がん細胞はリンパ節で免疫機構との出会いがあっても攻撃を受けることはできないのです。リンパ節は全身で700ヶ所あり、生き残ったまま心臓に戻るだけで他の臓器に転移することもないのです。さらに別の組織まで転移していくこともあると言われこれをリンパ行性転移と呼ばれますが間違いです。リンパ行性転移はあり得ないのです。つまりリンパ節やリンパ管を通じて臓器に転移することはないのです。というのは動脈圧が無くなっているのでリンパの流れは極めて緩やかであるのでリンパ癌細胞も組織に押し出されることもないからです。なお、動脈の内壁は厚いため、更に動脈の流れも速いので臓器がある組織に出にくいのです。従って血行性転移の出口は毛細血管である細動脈か細静脈である酸素と栄養素を漏らす部位から組織に出ていくことになるのです。毛細血管の構造はどのようになっているのでしょう。 毛細血管は、細動脈と細静脈を結ぶ、太さは5〜10μmと細い網目状の血管です。 血管壁は単層の内皮細胞からなっています。 この血管壁の細胞間隙を通して、血液中と組織で、酸素と二酸化炭素の受け渡しや、栄養素の供給と老廃物の回収など物質交換を行っています。
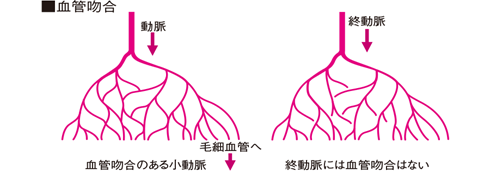
血管吻合とは何でしょうか?
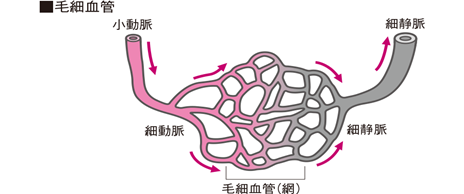
血管同士の連絡を血管吻合といいます。小動脈と小動脈との吻合では、片方の動脈が閉塞しても、他方から血液が送られるため血流を維持することができます。部位によっては、毛細血管を通らずに動脈と静脈が直接連絡することがあります。これは動静脈吻合と呼ばれ、指先や腸絨毛などで見られます。
毛細血管とは何でしょうか?何故毛細血管は、細動脈と細静脈を結ぶ、太さは5〜10μmと細い網目状の血管なのに癌細胞は20μmeterという大きな太さなのに毛細血管から組織に出て血管転移が可能になるのか?癌が人類最大の死因である原因は、がん細胞は血管を移動路として使用して活動の場を全身に広げる、いわゆる「血行性転移」を行う性質によるものです。血液中を循環するがん細胞の多くは毛細血管から血管の外へと遊出することは知られていましたが、毛細血管からの遊出が起こりやすい原因は、血中を流れる細胞が血管の外への遊出を行うために、毛細血管のところで「ブレーキ」をかける転移の仕組みがあるからです。血行性転移細胞が血中で硬くなることで細い血管に「挟まって(つまって)」しまうことで細胞が血管の外に遊出する場所を確保するために、細胞が自身の「硬さ」を「ブレーキ」として用いているのです。
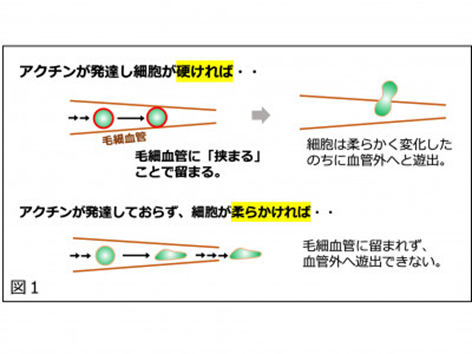
転移可能な細胞では細胞膜直下に繊維状アクチンが発達しており、このため高弾性である(硬い)。この硬さゆえに細い流路(毛細血管)にて「挟まって」移動を停止する。停止した細胞はこの血管領域から遊出する(左図)。一方で繊維状アクチン形成を阻害した場合、細胞は柔らかくなり毛細血管にて「挟まる」ことができなくなり、結果として血管外遊出ができなくなるのです。
終動脈とは何でしょうか?これに対して、小動脈どうしの吻合が見られないものを終動脈といいます。心臓や肺、脳、腎臓などに見られ、血管に閉塞が起こると、虚血性壊死(梗塞)になります。つまり終動脈 とは動脈の終わりです。この終わりの動脈は右下の図では枝になった小動脈の終わりは他の動脈の小動脈とは一切つながっていないのです。一方、左下の図の小動脈は別の動脈の小動脈とつながっています。
血管吻合
何故免疫療法は癌には効かないのか?免疫は自己である癌細胞を敵であると認識できないからです。
以下の疑問は一つずつ答えを詳しく後述していきます。乞うご期待を!
何故、癌末期に痛みに襲われ痛みを緩和するために麻薬を使うのは何故でしょうか?「痛み」は体内で「危険」が生じていることを知らせてくれるシグナルです。痛みには侵害受容器であるポリモーダル自由神経終末受容体が全身の組織に分布しており、機械的な刺激による「機械侵害」や熱いという痛みによる「温度侵害」や刺激物質に触れた痛みのよる「化学感受性侵害」などを感ずることが出来るのです。癌末期の痛みはヘルペスによる癌細胞に増えすぎたヘルペスは最後に数多くのポリモーダル自由神経終末受容体に感染してしまうので激痛に耐えられなくなって麻薬が必要になってしまうのです。癌の三大医療はすべて免疫を抑制してしまうのでこの痛みも医者が作った病気なのです。因みに原因不明な「慢性頭痛」も血管内皮細胞に感染したヘルペスが血管周辺にある体内の「侵害受容器」であるポリモーダル自由神経終末受容体を刺激するためにおこるのです。
APCである抗原提示細胞は何処で抗原を貪食して活性化されてどのようにリンパ節に行ってT細胞やBリンパ球にその抗原を提示するのですか?抗原となる非自己であるherpesウイルスも細菌も組織から侵入しますから樹枝状細胞もマクロファージも人体のあらゆる組織で敵を待ち構えています。そこで病原体であるヘルペスウイルスや細菌を貪食して活性化されたAPCは組織には毛細リンパ管が多いので組織液から毛細リンパ管に吸収されてリンパ液となり一番最初に出会ったリンパ節の輸入リンパ管からリンパ節に入り込んでTリンパ球やBリンパ球にその抗原を提示してリンパ球を活性化するのです。勿論組織から毛細リンパ管に直接毛細リンパ管に吸収され病原体も直接リンパ節に侵入するのです。
リンパ節はリンパ液の濾過装置と言われるのは何故でしょうか?リンパ節の入り口の辺縁洞にはリンパ節にリンパ管を通って侵入する病原体を貪食するために多くの待ち構えているマクロファージがヘルペスウイルをはじめとする病原体を貪食してくれるのでリンパ液の濾過装置と言われるのです。
癌は遺伝子の突然変異が複数蓄積されて起こります。その突然変異の遺伝子は癌関連遺伝子に限られています。活性酸素、放射線、紫外線、発癌物質、タバコ、アルコールが癌関連遺伝子のDNAを損傷が蓄積して癌関連遺伝子の突然変異が正常組織に浸潤し、別の部位に転移して最後は個体を死に至らしめる病気です。
ここで大きな疑問が出ます。個体である人の遺伝子は総計23500個で、そのうち癌関連遺伝子は800個あります。残りの15000個の遺伝子に対しては活性酸素、放射線、紫外線、発癌物質、タバコ、アルコールが何故突然変異を起こさないのかという疑問です。
そもそも突然変異はめったに起こらない現象である上に細胞にとっては不利に働くのでその細胞は元気がなくなり死滅するはずなのに個体にとって迷惑千万な変異であるにも関わらず非常に低い確率である特別な一生かかっても一回だけでも突然変異が起こりえない突然変異が何回も繰り返し積み重なって変異細胞や新たな正常細胞にも奇跡的に偶然に偶然が重なって起き続け、最後は人の個体の生存に最も不利な突然変異の蓄積によって人が死んでしまうのは当然であると考える現代のガン発生理論は理解を超えています。
ここで閃くのは癌は細胞にとっては不条理極まる事象ですが他の生命体が人の細胞を最大限に利用してその生命体が無限に増殖し続けるために人の細胞を利用しまくっているのではないかという疑問が頭をもたげるのです。その生命体こそヘルペスウイルスなのです。
細胞チェックポイントとは何でしようか?細胞周期エンジンで染色体の複製と細胞分裂によって細胞が増殖するのを制御し進行させるのですが、例えば染色体のDNAが損傷を受けた時に細胞周期エンジンはこのような事態を点検することができないのでここで細胞周期チェックポイント(点検阻止)の仕組みの出番となります。つまりDNAの損傷がある異常な染色体を複製することを一時的に止めてこの異変に対して事態が収拾するまで細胞周期エンジンの進行をおくための仕組みが細胞周期チェックポイント(点検阻止)なのです。
成人の体では何故細胞の分裂・増殖が必要なのか?成人の体は皮膚や小腸の内壁や血球の細胞などの使い捨ての消耗品が多くあり新しい細胞を分裂・増殖によって補給しなければならないからです。このように分裂・増殖が日常的に行われている組織には幹細胞という特殊な細胞があってこれが分裂しながら死ぬまで新しい細胞を補給しているのです。
一個の細胞は人が死ぬまでの細胞の人生コースの選択肢には何がありますか?4つあります。①細胞周期のG0期での休止期。細胞の多くはこの状態です。②分化。筋肉や神経の様な細胞が特殊に分化して死ぬまで同じ形や機能を持ち続けるのです。このように分化してしまうと増殖できないので分化と増殖はお互いに排他的でどちらか一つしか選べないのです。③細胞老化。細胞分裂がある回数に達してしまうとつまり年取りすぎるとその細胞はそれ以上に分裂できないのです。テロメアが短縮してしまうからです。細胞老化にはP53やp16ink4aが関与しています。④アポトーシスによる細胞死です。カスパーゼ、ミトコンドリアのシトクロームcなどが関与しています。アポトーシスが起こる時にはp53、E2F、サーバイビンなどが細胞周期とアポトーシスとが関わるのです。
P53とは何でしょうか? p53はヒトの癌において最も高頻度に変異が認められる癌抑制遺伝子です。転写活性化因子であるp53は様々なストレスを受けて活性化し、標的遺伝子を転写誘導する事によって、癌化を抑制しているのです。DNAの損傷が検知されると濃度が上昇して、上昇したp53腫瘍抑制因子はゲノム上にある様々な制御部位(regulatory site)に結合し、損傷が修復するまで細胞分裂を止めるタンパク質を作り始めます。あるいは、そのDNAの損傷が深刻すぎる場合、p53腫瘍抑制因子はプログラムされた細胞死(アポトーシス)の過程を開始します。これにより細胞は自殺してしまい、損傷は恒久的に除去されてしまうのです。
P16ink4aとは何でしょうか?7つのCDKI(サイクリン依存性キナーゼ1)のなかで、p16INK4a遺伝子のみが多くのヒトの癌において不活化(失活)しており、癌抑制遺伝子として機能を失ってしまっているのです。細胞周期の進行に最も重要な役割を担っているRBファミリー蛋白は主にサイクリン依存性キナーゼ(CDK)によるリン酸化によってその活性が制御され不活化されています。
哺乳動物には7つのCDK阻害因子(CDKI)が知られており、RBファミリーを脱リン酸化状態に保つことによってCDK阻害因子が活性化します。7つのCDKIのなかで、p16INK4a遺伝子のみが多くのヒトの癌において失活しており、癌抑制遺伝子として機能を失っているのです。増殖能を有する正常な細胞においては通常p16INK4a遺伝子の発現は極めて低く、p16INK4aはほとんど機能していませんが、正常細胞が分裂できなくなる寿命に達したり(Replicative Senescence)、癌遺伝子の活性化など癌化の危険性がある異常なストレスが細胞に与えられた場合(Premature Senescence)には、p16INK4a遺伝子の発現が著しく上昇し、不可逆的な増殖停止が起こります。これらは正常細胞が有する癌化を防ぐための自己防御機構なのです。従ってp16INK4aはp53遺伝子と同じく腫瘍増殖抑制遺伝子(がん抑制遺伝子)なのです。
E2Fとは何でしょうか?E2Fファミリーは細胞増殖を制御している転写因子で,その発現量や活性は「がん」と密接な関係がある。転写因子は、遺伝子発現を転写レベルで制御する役割を担う タンパク質です。転写因子の同義語として転写調節因子、転写制御因子があります。転写制御因子のE2Fは、高等真核生物で転写因子ファミリーをコードする遺伝子ファミリーであり、そのうち3つはアクチベーターであり、他の6つはリプレッサーであり、哺乳類の細胞ではこれら3つのアクチベーターも、他の6つのリプレッサーも全て、細胞周期の調節とDNA合成に関与しています。アクチベーターと、6つのリプレッサーの違いは何でしょうか?転写レベルでの遺伝子発現調節に関与する転写因子にはすべて、アクチベーターとリプレッサーの2種類があります。アクチベーターはDNA中のエンハンサー領域に結合し、RNAポリメラーゼがプロモーターに結合するのを促進する。リプレッサーはサイレンサー領域に結合し、RNAポリメラーゼのプロモーターへの結合を阻止する。転写の制御は、原核生物、真核生物のいずれにおいても、遺伝子発現の調節に不可欠です。転写因子はDNA中の転写制御エレメントに結合する。転写制御エレメントには転写を促進する正と転写を抑制する負の転写制御エレメントの二つがあります。正の転写制御エレメントは、任意の遺伝子発現の誘導には核内転写制御因子として特定の制御蛋白質を必要とするが、それら蛋白質が結合するDNA上の特定の配列の呼称。TATAボックス、CAATボックス、CRE(組換え酵素:Cyclization Recombination Enzyme)、SRE(ステロール調節配列:Sterol regulatory element)などが代表的なものである。
転写制御とは、DNAからRNAが合成される過程である転写を制御する仕組みです。転写制御には、転写因子やシグマ因子と呼ばれる転写制御因子が関与し、DNAとの相互作用を通して働きます。転写制御因子は、DNA結合部位(DNA-binding domain略 DBD)と転写活性化部位(transcription activating domain略TAD)を持ち、特有の配列(応答エレメント)を認識してトランスに作用します。シグマ因子とはシグマ因子の役割は、RNAポリメラーゼとDNAを結合させることである。RNAポリメラーゼが結合する部分のDNAをプロモーターと呼ぶ。そして、RNAポリメラーゼがDNAに結合したのち、転写が開始する。この転写を開始させるのもシグマ因子の役割である。転写開始後は、シグマ因子は外れて、コア酵素だけで進んでいき、RNAが合成されていく。
転写制御因子は、標的遺伝子の調節配列に結合することで、その遺伝子の発現を正もしくは負に制御します。転写を促進するものを転写活性化因子、抑えるものを転写抑制因子といいます。環境変化に応じて、これらの転写制御因子の活性が変化することで、それぞれの役割に応じた制御下遺伝子群の発現が変化し、細胞が環境に応答できるようになります。転写制御因子(転写因子)をコードする遺伝子は、ヒトゲノムにおいて約2000個の遺伝子が存在する。転写制御因子は、ゲノム DNA上の特定の塩基配列に結合し、RNAポリメラーゼによる転写を促進あるいは抑制するタンパク質の一群である。構造上の特徴により、いくつかのファミリーに分類される。転写制御因子はリン酸化などの様々な調節を受け、個体発生から脳高次機能までの転写が必要な多くの過程を制御する。転写因子は、その機能により、活性化因子と抑制因子に分類される。星の数(2000個)の遺伝子ほどある転写因子は、それぞれに特徴的な塩基配列を認識してDNAに結合し、直接または間接に基本転写因子群を含む転写装置に働きかけて、転写を正または負に調節する。
サバイビンとは何でしょうか?サバイビンは、inhibition of apoptosis familyに属するヒト遺伝子である。サバイビンのサバイブの意味は「生き残る」であるのでサバイビンタンパクとは、カスパーゼの活性化を阻害しアポトーシスを抑制するので生き残れるのは癌細胞であります。サバイビンは癌細胞で高度に発現しているのに対し、完全に分化した細胞ではほぼ発現が見られない。
分化(differentiation)と成長(growth)との違いは何ですか?発生の過程では、細胞の数を増やし、 それぞれの細胞をその位置に応じて適正にはたらくように分化(differentiation)させる過程です。分化の過程は転写調節系によって特定の遺伝子だけが転写・ 翻訳されるように決まっていく過程です。一方成長(growth)は分化(differentiation)した後で分化しきった細胞の数を増やして体積を大きくしてゆく過程が成長(growth)なので特定の遺伝子だけが転写・ 翻訳する必要はないのです。
癌細胞の細胞周期は正常細胞の細胞周期とはどこが違うのでしょうか?又どのようにして癌細胞が生まれるのでしょうか?
多細胞生物では細胞の分裂・増殖は厳しく規制されています。染色体の複製と細胞を2倍にする細胞周期エンジンとその制御系が完璧でかつ栄養素と燃料が十分あればあっても細胞は増殖できないのです。何故でしょうか?それは細胞の外部から増殖してよろしいという増殖因子からの信号(シグナル)が細胞表面の受容体に結合しないと増殖はできないからです。実は細胞を増殖させる作用のある物質は増殖因子以外に多くの種類があります。まさに増殖させる作用のある物質の遺伝子が突然変異を重ねて遺伝子の不可逆的な変化が何回も続けて起きるのが癌細胞になるのです。
ここで最も大きな疑問は何が細胞を増殖させる作用のある物質の遺伝子を突然変異させるかの問いに対しては世界中に癌学者は答えを誰も出していないのです。この問いに対してはすでに間違った曖昧模糊としたな答えはいくつかあります。
一つ目の間違いは活性酸素がDNAを傷つけるといわれる間違いに対する答えは、酸素を吸わなければ活性酸素は生じませんから癌にならないためには「酸素を吸うな」というべきでしょう。
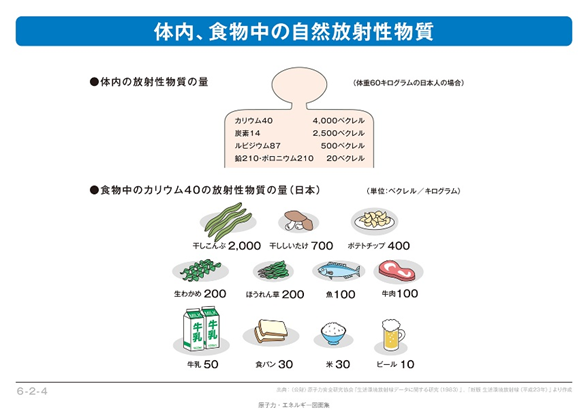
二つ目は放射能がDNAを傷つけるからといわれていますが人体の中で1秒間に7000個の放射線が出ているのですよ。平常時でも、左図に示すように多くの食品にもともと放射性物質が含まれているため、私たち人間の体の中にもつねに放射性物質が存在しています。代表的なものは、カリウム40という放射性物質で、放射能が半分に減るまで約13億年かかります。カリウムは筋肉や神経の機能を正常に保つなど人間に欠かせない成分で、そのなかにはわずかにカリウム40が含まれています。このほかにも、体内には炭素14、ルビジウム87、鉛210、ポロニウム210、セシウム137などの放射性物質が存在しています。その放射能は、体重60キログラムの日本人の場合で7000ベクレルほどになります。これは、体の中で1秒間に約7000個の放射線が出ていることを表します。
放射線というと電波や紫外線のようなものも含めていうこともありますが、一般的には物質と反応して「電離を起こすもの」を放射線と呼んでいます。この電離を起こす放射線にはアルファ線やベータ線、ガンマ線、X線、中性子線などがあります。わたしたち人類は、誕生したときからずっと放射線を受けながら生きてきました。宇宙からはいつも宇宙線といわれる放射線が降りそそいでいます。地球を構成している物質には放射線を出す性質をもったものが数多くあり、大地からも放射線を受けています。さらには食物にも放射線を出す物質が含まれていますし、人間は自分の体内にも放射線を出す物質をもっています。わたしたちはこうした「自然放射線」と常に共存しながら生きているのです。放射線とは、放射性物質から放出される粒子や電磁波のことです。放射線を出す物質を「放射性物質」、放射線を放出する能力を「放射能」といいます。放射線には、粒子の流れであるアルファ線、ベータ線、中性子線などと、電磁波であるガンマ線、エックス線などがあります。放射性物質は放射線を出しながら壊れていき、放射能の強さは時間とともに弱くなっていきます。放射能の強さが半分になるまでの時間を半減期といいます。放射性物質から放射線を受けることを放射線被ばくといいます。放射線は細胞の遺伝子を傷つけ、少量であればすぐに傷が修復されて人体に影響は出ませんが、大量に放射線を浴びると、傷の修復が追いつかず、細胞が分裂できず死んでしまったり、がん化したりします。放射線は物質から放出されるエネルギーです 「放射線」は、放射性物質から放出される粒子や電磁波のことです。にもかかわらず放射線、放射能が癌の原因とさわぐのでしょうか?何故 癌にならないために放射線を生生活からシャットアウトしないのですか?
三つ目は紫外線が遺伝子のDNAを傷つけて癌を起こすとも言われていますが何故太陽光を遮断しないのでしょうか?暗闇で生活すべきですね。
四つ目は発がん物質となる可能性のある化学物質は一切禁止にすれば癌になりにくくなるでしょう。まずは製薬メーカーの化学薬品は抗がん剤を含めて禁止すべきでしょう。
五つ目はアルコールが癌の原因であるといわれているのですが、ヘビードリンカーが飲みすぎるのは思い通りに生きられない不満から生まれるストレスから逃れるためでしょう。ストレスのために免疫が落ちて癌の原因であるヘルペスが増えるから癌が生まれやすくなるのであって、大量のアルコールが癌を起こしたわけではないのです。ヘビードリンカーが酒を飲みすぎるのはストレスから逃れるためでしょ。ストレスが癌の一番大きな原因なのです。ストレスに耐えるために自分で勝手にストレスホルモンを出しすぎて知らぬ間にヘルペスも長い時間をかけて増やしすぎたためにヘルペスが感染した細胞のゲノムに侵入して部位特異的組み換えによって遺伝子を癌化させた結果に過ぎないのです。従って癌の発生をめったに何百万に一回も起こりえない突然変異が何千万回に一回も起こりえない積み重なった突然変異によって生じることは絶対にないのです。ヘルペスウイルスはすべての人に感染しておりすべての臓器に簡単に感染できるので細胞の遺伝子を癌化することなどお茶の子再々なのです。従って癌医学会は「癌」は本来あり得ない起こりえない遺伝子の突然変異癌になったので癌を治せない病気にしてしまっていますが「自己免疫疾患」と同じく原因はヘルペスですから間違った医療をしない限り100%完治可能な病気なのです。この世に治せない原因不明な病気は何一つありません。あらゆる病気の原因はヘルペスウイルスでありこのヘルペスウイルスを朝から晩まで増やして嘘八百並べてお金を稼ぐ以外に興味がない人でなしは世界中の医者集団です。病気で苦しんでいる人たちを苦しみから解放する喜びを何一つ経験したことのない人非人なのです。資本主義を人本主義にしない限り人間が人間を苦しめて楽しむ世の中は永遠に変わらないでしょう。残念です。
六つ目はヘビースモーカーのタバコのニコチンが癌の原因といわれますがヘビースモーカーもヘビードリンカーと同じく生きることのストレスから逃れるためにお酒をあるいはニコチンを大量に自分の体に投与して交感神経を高めるためなのです。生きるストレスに対抗している間に免疫が下がり癌の原因であるヘルペス増やしすぎたために癌になっただけでニコチンが癌を生み出したのではないのです。
癌の真実を語れば「癌は偶然に偶然が重なってそれこそ奇跡が起こって生じた細胞が癌ではないのです。」3人に一人が奇跡的に癌になるわけはないどころか誰もがいとも簡単に癌になるのは癌になる原因がすべての人に感染しているherpesウイルスであるからです。Herpesウイルスは免疫から逃れるためにかつ感染した細胞が作るインターフェロンαやインターフェロンβという時限爆弾からのがれるために核にあるゲノムDNAにかくれるときにDNAの塩基の配列を自然に変異させてしまうのです。この時にたまたま変異させたDNAに「癌関連遺伝子」であれば癌になるだけなのです。すべてに人の体の中のどこかの細胞に潜んでいるのがherpesウイルスなのです。もっと適切な表現をすれば人体の組織のあらゆる種類の細胞にこっそり入り込んで病気を作っている最後に残ったワクチンが作れない病原体がherpesウイルスなのです。
ヘルペスが「癌関連遺伝子」を癌化させるということに気が付けばあらゆる癌に関するすべての疑問が一挙に氷解してしまい「癌は完治する簡単な病気」に過ぎないとわかってしまうのです。しかも古来から人類の敵は「病気」であり「病気」の原因は目に見えない病原体であったのは未開人も薄々知っていたのです。私が何万人にも上る「自己免疫疾患」のすべて患者を完治させ今も完治させ続けているのは「自己免疫疾患」という存在しない病気であったのを見抜きさらにその病気の原因もherpesであることを看破してしまったからです。しかもヘルペスウイルスだけが免疫で殺せない従ってワクチンも作れないこともヘルペスについてはそれこそ世界の医者の中で一番よく勉強していたのでしかも自分自身が自己免疫疾患患者であったので、難病とされている自己疫疾患というあらゆる組織の器官や臓器に見られる症状は何故出るのかの答えもヘルペスであることはすでに知っていたのです。「自己免疫疾患」の原因と症状の答えはヘルペスと免疫との戦いだったのです。
ところが「癌」は2種類の癌関連遺伝子である癌原遺伝子と癌抑制遺伝子の上にあげた六つのあいまいな原因で遺伝子が突然変異してしまったために生じたわけはないので実はこの癌関連遺伝子を突然変異させたのはヘルペスウイルスであると確信していたからです。ところが抗ヘルペス剤を保険で使えないので自費で使うと混合医療だと冤罪を近畿厚生局から吹っ掛けられてひどい目にあったのですがこの混合医療の件は中央から別の担当者が穏便に済まそうとなったのです。しかしすべての難病は自己免疫疾患も癌を含めてヘルペスであることは理論的にかつ臨床的にも証明していたのですが保健医療では抗ヘルペス剤であるアシクロビルは使えなくなったので自費診療の「松本漢方(herpes)クリニック」を開設したのです。世界で合法的に抗ヘルペス剤であるアシクロビルを出せるのは残念ながら自費診療の「松本漢方クリニック」しかありません。アシクロビルを保険で使えれば患者さんの負担も減るのに医師会は認めようとしません。しかし難病のすべてを治せるので世界で一番負担の少ない医院は言うまでもなく自費診療の「松本漢方(herpes)クリニック」なのです。何故ならば国民皆保険の医療は保険料を毎月毎月税金と同じように徴収されかつ難病になると一生治らないと病気だと宣告され死ぬまで治らない医療のために三割負担を続けなければならないからです。しかも治る病気を治らない病気にさせて患者を苦しめ大金を盗むという犯罪医療が現代のアメリカの医療を標準医療とされているのは悲しいですね。近藤誠先生がなくなられてから近頃はまるで口ぶりが故近藤先生に似てきたと患者さんに言われています。真実を語っているだけなのですがね。ワッハッハ!!!!しかし故近藤先生は「嘘つき」なのですよ。癌は死ぬ病気であるというのは嘘なのです。それでも彼は類まれなる正義感を持っていたのです。現代がん医療の重鎮を相手に「癌治療はするな。苦しむだけだ。」と死ぬ直前まで主張し続けた彼の勇気には頭が下がります。
リンパ系についてはかなり詳しく書いてきたのですが更にリンパ系に関わる疑問や新事実について解説していきます。
HEVはあらゆるリンパ節に存在する毛細静脈からリンパ球だけリンパ節に通過できる通路です。このHEVをリンパ球が、1秒間に1万個も大量に入っていきます。高内皮細静脈(HEV)とは一体何でしょうか?高内皮細静脈(high endothelial venule略して HEV)は,血流中を循環するリンパ球と特異的に接着し,リンパ球を免疫応答の起こる場であるリンパ節へ移行させる特殊な血管である。高内皮細静脈は背の高い内皮細胞や厚い基底膜を持ち、 接着分子 PNAd、MAdCAM-1 やケモカインを発現するという特徴を示します。ナイーブリンパ球は、胸腺あるいは骨髄から成熟した形で血液に放出され、全身を循環する。
血中のナイーブリンパ球は、高内皮細静脈(high endothelial venule; HEV)という特殊な血管を介してリンパ節実質に移行し、そこで然るべき抗原に出会えばリンパ節内で増殖、分裂し、抗原に出会わなければsphingosine-1-P(S1P)受容体を介したシグナルにより輸出リンパ管、胸管を経て血中に戻り、再循環する。これまで、HEVにおけるリンパ球の移動制御機構として、接着分子、ケモカインを介した多段階カスケード反応が提唱され、その初期段階のリンパ球のローリングや接着に関してはその分子的基礎が明らかになった。後期の血管外移動の過程においてはリンパ節のHEV内皮細胞に特異的に発現する分子としてautotaxin(ATX)が働きます。ATXは、血中に豊富に存在するリゾホスファチジルコリン(LPC)に働き、局所的にリゾホスファチジン酸(LPA)を生成します。ATXが細胞表面に結合してLPAの産生に関わり、LPAシグナルを惹起します。
ATXはHEV周囲およびリンパ節実質で産生され、内皮細胞上および線維芽様細網細胞上に固相化されて存在する。内皮細胞上のATXは、血流中のLPCを局所的にLPAに変換し、LPAがHEV内皮細胞上のLPA4受容体に働く。一方、リンパ節実質の線維芽様細網細胞上のATXは局所的にLPAを産生し、産生されたLPAはリンパ球上のLPA2受容体に働く。このように、LPAが特定のLPA受容体を介してオートクライン、パラクライン的に働くことにより、リンパ球トラフィキングの制御が行われるのです。
胸管とは何でしょうか?胸管は最大のリンパ管です。 胸管は鎖骨下静脈に接続し、リンパ液を血液中に戻します。 またリンパ液は、組織中の異物(細菌など)、がん細胞、死んだ細胞などを廃棄するためにリンパ管やリンパ節に運ぶ役割も担っています。リンパ液には多くの白血球が含まれています。胸管はリンパ管の主幹であり、下半身および左上半身のリンパを集め最後は胸管、右リンパ本幹と呼ばれる2本にまとまって、静脈に注ぎ心臓に戻ります。
ヒトを含め哺乳類の胸管リンパ内の細胞の85-95%以上がリンパ球で,血液リンパ球の主要な供給源でありなす。1日に胸管から血液に放出されるリンパ球数は,血液リンパ球総数の約2-5倍であります。いいかえると,血液リンパ球は日に2-5回入れかえられるのです。正常な人の血液リンパ球が一定しているのは,胸管から血管系に放出されるリンパ球数が一定しているからなのです。胸管リンパ球は色々な因子で制御されていますが,すぐに強い影響を示すのは副腎であり,下垂体なのです。副腎を摘出すると,胸管リンパ球数は不規則に増加するのはすでに述べました。
副腎皮質ホルモンにリンパ球の増殖抑制作用がありますが,とりわけCD4+Tリンパ球を減らしてしまいます。逆に副腎摘出によって副腎皮質ホルモンが産生されなくなるとリンパ節などのリンパ組織に足どめされていたリンパ球の足かせが外れるので胸管リンパ球数は不規則に増加するのです。副腎皮質ホルモンも日内変動があるので血液リンパ球数の日内変動も同じような機序で増減が見られるのです。
胸管リンパ球の主な供給源は三つあります。(1)リンパ節やパイエル板などのリンパ組織で,血液-組織-リンパへと再循環するもの,(2)リンパ節や胸腺,脾臓などのリンパ組織で新たに運ばれてきたもの(3)すべての器官,臓器の毛細血管から組織に遊出した組織液から吸収物がものが加わる。
まず(1)の再循環するリンパ球は胸管リンパ球の60-70%を占める。再循環が行われる場所はリンパ節やパイエル板の高内皮細静脈(HEV)である。胸管リンパ球の80-85%はTリンパ球で,10-20%がBリンパ球で,その比率は血液と殆ど変わらない。そして,Tリンパ球もBリンパ球42)もHEVで再循環する。HEVを通って再循環する細胞は殆んどが抗原にまだ出会ったことがないnative Tcell(ナイーブTcell、バージンTcell)です。再循環が起る細静脈の内皮細胞はなぜ丈が高いのだろうか?いまだ完全に解明しつくされてはいません。高内皮細静脈(HEV)とは高内皮細静脈(high endothelial venule略して HEV)は,血流中を循環するリンパ球と特異的に接着し,リンパ球を免疫応答の起こる場であるリンパ節へ移行させる特殊な血管である。
次の(2)のリンパ節や胸腺,脾臓などのリンパ組織で新たに作られたリンパ球は胸管リンパ球の重要な供給源となる。胸腺も胸管リンパ球の供給源として大きな役割を担う。胸腺はTリンパ球の産生母地として知られており,ここで産生されたリンパ球は直接静脈系に入ると解されてきたが,胸腺にリンパ管の分布が分って以来,リンパ行性放出に新たな意義を見出すようになった。哺乳類と違って,鳥類ではTリンパ球は胸腺で,Bリンパ球はファブリキウス嚢と分れて産生されるが,ファブリキウス嚢にもよく発達したリンパ管の分布が見出され,ここで産生されたBリンパ球もリンパ行性に放出されることが分ってきた。次に胸管リンパ球の供給源としての脾臓であるが,脾臓で産生されたリンパ球もリンパ行性に放出されることが示唆された。
最期の(3)のリンパ球は,顆粒白血球と違って,炎症がなくても,すべての器官,臓器において血管から組織に遊出し,パトロールした後末梢リンパ管に入る。組織で抗原情報を得たリンパ球は所属リンパ節で免疫応答を惹起する。血液-組織-リンパへの循環路としては,(1)と同じく再循環に違いないが,そこに高内皮細静脈(HEV)は存在しない。腸絨毛の血管から遊出したリンパ球は粘膜上皮細胞間に進出し,ここで抗原情報を得て腸絨毛のリンパ管に帰り,所属リンパ節で免疫応答を惹起すると考えるのが通常の概念であるが、ところが,粘膜上皮間に進出した無数のリンパ球は引き返すことなく腸管に突入してしまう。リンパ球にとって腸管はまさに墓場である.腸管に突入したリンパ球はすぐ壊されるが,その核成分は腸管から吸収され,リンパ節,胸腺,脾臓,骨髄などで細胞構成要素として再利用される。さらに母親の腸管から吸収されたリンパ球の核成分は胎児の造血幹細胞をはじめリンパ節,胸腺,脾臓などの細胞に再利用されます。その核成分はヌクレオシド,ヌクレオチドのレベルで吸収されるだけでなく,DNAレベルで血液およびリンパに吸収される。
血液や脾臓には主にヘルペスウイルスを殺すためのナチュラルキラー(NK)細胞がいます。このナチュラルキラー(NK)細胞は腫瘍細胞あるいはherpesウイルス感染でトランスフォーム(形質転換)され遺伝子を突然変異された細胞を非特異的に障害し殺すのがナチュラルキラー(NK)細胞なのです。NK細胞はアズール顆粒をもつ大型リンパ球(large granular lymphocytes, LGL, 末梢血リンパ球の5-10%を占める)の一部としてリンパ球の範疇に入れられている。
アズール顆粒とはリンパ球であるNK細胞が持っている大顆粒のアズール顆粒にはパーフォリン、グランザイム、などの細胞傷害性の物質が含まれており、細胞性免疫機能を発揮して腫瘍細胞やウイルス感染細胞を破壊するのです。ところが,NK細胞は胸管リンパやリンパ節に出現しないのは何故でしょうか?そもそもリンパ球はリンパや,リンパ組織に多くみられる細胞なるが故に名づけられたものであるにも関わらずNK細胞をリンパ球と呼ぶのは間違っているのです。
それではNK細胞とはどんな役割を持っているのでしょうか? NK細胞の働きは主に二つあります。一つ目はNK細胞はインターフェロンαやインターフェロンβに活性化されて腫瘍細胞、ウイルス感染細胞、細菌、寄生虫、カビを殺すことができます。殺し方はこの5つの細胞をパーフォリンとグランザイムBによって自殺させることができるのです。二つ目はインターフェロンαやインターフェロンβやリポポリサッカライド(LPS)によって活性化されて最も大切な炎症性サイトカインであるインターフェロンγを産生して自然免疫の王者であるマクロファージ(大食細胞)をインターフェロンγで活性化してTNFやインターロイキン12を産生させ腫瘍細胞、ウイルス感染細胞、細菌、寄生虫、カビのすべての病原体から他の免疫細胞とも協力して炎症を開始させて人体をすべての外敵から守ってくれるのです。ところがここで大きな疑問が起こります。それは自然免疫も獲得免疫も外敵と出会いそれを自己でない病原体と認識して初めて活性化されてなければ炎症性サイトカインは産生されません。NK細胞はインターフェロンαやインターフェロンβに出会って活性化されます。それでは何がインターフェロンαやインターフェロンβを産生するのかという難問が生まれます。しかもインターフェロンαやインターフェロンβはあらゆる細胞が産生するサイトカインであり、本来の役割は自爆テロに細胞が用いている爆弾なのです。その答えはあらゆるウイルスはとりわけ癌を作るヘルペスウイルスや人パピローマウイルスは人体に感染した後、必ず細胞に侵入しなければ生き続けることはできません。殺しきれないヘルペスウイルスに対して4~5億年前にherpesが生まれ脊椎動物が生まれたのも5億年前で、人間が誕生したのは20万年前ですが人間はその時にはすでにherpesが細胞に感染したら脊椎動物である人間が進化させた獲得免疫でも殺しきれないことを知っていたのでヘルペスが細胞に感染したら増殖して次々と新しい細胞に感染していき最後は細胞が支える個体も殺されるのを知っていたので仲間の細胞のためにherpesもろとも自分の細胞の命を惜しまず一緒に死ぬために自爆テロを行うための武器がインターフェロンαやインターフェロンβなのです。自分の欲望のために他人を簡単に殺す人間と比べて人間の細胞はなんて慈悲深いのでしょうか!!!細胞には心(頭)がないのでこんな阿呆なことが出来るのでしょうか???
単球はヒト末梢血白血球の5%,胸管リンパ内の細胞の3%を占める.ところが,末梢リンパでは30-50%に上昇する。顆粒白血球と違って,単球はリンパ球と同じく炎症がなくても血液-組織-リンパへと循環している。単球は生体防御機構の原点である.強い貪食機能をもち,組織に侵入した異物,抗原を取り込み処理する他,細胞内のライソゾームを細胞外に放出し,組織の修復,再建を促すものがある.胸腺に遊走した単球は細胞外に放出したライソゾームによって,ハッサル小体を破壊し,胸腺細胞の成熟分化を助ける.ハッサル小体とは胸腺小体(きょうせんしょうたい、Hassall’s body)とも呼ばれ胸腺髄質において胸腺細網細胞(胸腺上皮細胞)が同心円状に配列した領域です。胸腺小体は30~100μm程度の大きさであり、中心には1個あるいは数個の変性度の高い大型細胞が位置します。髄質は,皮質と比べて細胞密度が低いが,皮質との本質的な差異は不明である。ただ髄質のところどころにハッサル小体Hassall’s corpuscleとよばれる小細胞集団がみられるが,変性しかけた上皮性細網細胞が扁平化し同心円状に重なったもので,中心部の細胞は核を失っている。胸腺小体(きょうせんしょうたい、Hassall’s body)が詳細な役割は不明です。
更に単球の重要な機能は抗原の取り込み分解によって抗原提示細胞となり,末梢リンパ管を経て,所属リンパ節で免疫応答を惹起することである.
樹状細胞(dendritic cells, DC)と呼ばれる単球より遥かに数は少ない(1-3%)が,組織から末梢リンパ管を経て,リンパ節に抗原情報を運ぶ細胞がいる.この細胞は樹枝状の突起をもっているので樹状細胞(dendritic cells, DC)と呼ばれる.その代表な細胞が皮膚の表皮の間に樹枝状の長い突起をのばしたLangerhans細胞である.ランゲルハンス細胞は口腔,咽頭,食道などの粘膜重層扁平上皮にも存在する.表皮のランゲルハンス細胞は表皮を離れ真皮のリンパ管に入ると,さすがここでは長い突起を縮めて,ヒラヒラとリンパの中を泳いで所属リンパ節に入る。それでヴェール状細胞(veiled cells)とも呼ばれる.ヴェール状細胞は抗原提示細胞として知られているが,新しいランゲルハンス細胞に交代するために皮膚を去るものも含まれていると思われる.「真皮」は表皮の内側にあって、肌(皮膚)組織の大部分を占めており、肌(皮膚)の本体ともいえます。部位などによって異なりますが、皮下組織を除くと平均で約2ミリの厚さがあります。
ヴェール状細胞(veiled cells)とは、皮膚に侵入した抗原は,ランゲルハンスLangerhans細胞(樹状細胞の一種で抗原提示を行う)に取り込まれ,リンパ管を介して所属リンパ節へ運ばれる。リンパ管を移動中のLangerhans細胞は,その細胞質を薄く伸ばした形態からベール細胞veiled-cellと呼ばれる。日本語に訳すと「被り物をかぶった細胞質突起を持った細胞」となります。ベール細胞がリンパ節の傍皮質に至ると細胞質突起を樹枝状に伸ばし互いにかみ合うように連結することから,指状嵌かん入細胞(かみ合い細胞)interdigitating-cellとも呼ばれる。指状嵌入細胞はクラスⅡ MHC分子上に抗原ペプチドを提示する。つまり従来から知られているランゲルハンスLangerhans細胞とベール細胞とかみ合い細胞に姿を変えるのです。
真皮とは何でしょうか?「真皮」は表皮の内側にあって、肌(皮膚)組織の大部分を占めており、肌(皮膚)の本体ともいえます。部位などによって異なりますが、皮下組織を除くと平均で約2ミリの厚さがあります。真皮(Dermis)は、表皮と皮下組織の間にある皮膚の層です。乳頭層と真皮網状層から構成される皮膚の層で、繊維性結合組織から構成される。真皮の約70%をコラーゲンで占め、他に弾性線維(エラスチン)、細胞外マトリックス(以前は基質と呼ばれていた)、ヒアルロン酸といった線維から構成される「コラーゲン」という線維状のタンパク質がその大部分を占めています。そして、その間を「ヒアルロン酸」などのゼリー状の基質が水分を抱えながら満たしています。これに「エラスチン」という線維状のタンパク質も加わって、肌に弾力を与えています。これらの線維や基質を生成する細胞を、線維芽細胞(せんいがさいぼう)といいます。さらに、真皮には、血管やリンパ管、汗腺などがあります。
DCは腸粘膜や気管支粘膜からの末梢リンパ管の中にも存在する.また肝リンパにも存在する.骨髄からのDC前駆細胞は肝臓の類洞を出,ディッセ腔を流れて小葉間組織に始まる肝リンパ管の中に樹状細胞(DC)として姿を現わし,肝リンパ節に達して免疫応答を惹起する.ここにも疑問があります。DCはリンパ節の輸入リンパ管に存在するが,輸出リンパ管には存在しない.DCは所属リンパ節の傍皮質(T細胞域)に入り,ここに分布する嵌合(かみあい)細胞(interdigitating cells, IDC)に抗原または抗原情報をわたした後消滅するのか.あるいはIDCとして定住し,リンパ球を活性化し続けるのだろうか?末梢リンパは少なくとも1個のリンパ節を経て胸管に入るという原則があるので,輸出リンパ管に含まれないDCは胸管リンパに出現しないのです。
リンパ節転移癌は存在しない。この真実を証明しましょう。まず「悪性リンパ腫」と「骨髄性リンパ腫」を取り上げて説明しましょう。「悪性リンパ腫」とは血液中のBリンパ球が癌化した病気で、リンパ節やその他のリンパ組織に発生します。リンパ節が腫れるのが最もよくみられる症状です。
悪性リンパ腫の種類とはリンパ球のがん細胞の形態や性質によって、B細胞リンパ腫、T細胞リンパ腫・NK細胞リンパ腫、ホジキンリンパ腫などに分けられますがリンパ節で発生するB細胞リンパ腫が圧倒的に多いので、悪性リンパ腫とは悪性Bリンパ種のことです。進行のスピードがゆっくりなものから速いものがあり、低悪性度リンパ腫、中悪性度リンパ腫、高悪性度リンパ腫に分けられます
何故リンパ節に「悪性Bリンパ腫」が発生しやすいのでしょうか?
がんを攻撃する細胞は?獲得免疫システムの一部であるキラーT細胞です。英語でCytotoxic T lymphocyteで略して、CTLで訳して細胞障害性T細胞です。CTLはリンパ球で、がんやウイルス感染細胞などの異常細胞を攻撃・破壊する細胞と言われますが間違いです。
CTLの働きは細胞表面にCD8という分子を持つT細胞の一種で、ヘルパーT細胞からの指示を受け、herpesウイルスなどの感染ウイルスの成分を認識しているのです。癌細胞の変異した癌関連遺伝子の変異によってつくられた変異蛋白はあくまでも自分の一部ですから癌細胞胞表面のMHCクラスⅠ分子に提示される自己の抗原ペプチドを敵と認識することができません。CTLが持っている顆粒中に含まれるパーフォリンやグランザイムなどのエフェクタータンパク質を放出してヘルペスが感染した癌細胞という標的細胞のアポトーシスを誘導します。エフェクタータンパク質とは、細胞内外のシグナルを伝達する際に中心的な役割を担う蛋白質です。CTLの役割はherpesが原因であるがん免疫において重要な役割を果たすのは癌細胞にはherpes粒子であるherpesビリオンが充満しているのでがん細胞を漠然と認識しているのではなくherpesの明確な異物である成分を敵として認識しているのです。この世に癌細胞という特別な細胞は存在していません。もっとはっきり述べると「癌」はこの世にはないのです。CTLの役割はヘルペスウイルスや細菌、寄生虫などの細胞内病原体を排除することだけです。
何故自己の一部である癌細胞は免役に敵と認識されないのか?
何故herpesウイルスはヒトの2重鎖DNAに感染したがるのでしょうか?
「骨髄性リンパ腫」とは骨髄性白血病は骨髄で異常増殖する白血病で、リンパ腫はリンパ球ががん化した血液がんの一種です。骨髄性白血病とは骨髄内で造られる血球(白血球、血小板、赤血球)の分化細胞が異常増殖する白血病であり骨髄系細胞と呼ばれる白血球、血小板、赤血球が異常増殖するのです。リンパ腫とはリンパ球という血液の細胞ががん化し、リンパ節やその他の臓器などで増加し、腫瘤をつくる血液がんです。
リンパ節に腫れやしこりがあらわれることがあります。リンパ腫の病変は全身のあらゆる臓器に出現する可能性があります。リンパ腫には、ホジキンリンパ腫と非ホジキンリンパ腫の2種類に分けられます。非ホジキンリンパ腫は、リンパ腫のもととなるリンパ球の種類によって、B細胞リンパ腫とT/NK細胞リンパ腫に分かれます。
悪性リンパ腫とは、Bリンパ球を多く含むびまん性大細胞型B細胞リンパ腫などの種類があります。悪性リンパ腫は、血液中の白血球の成分である主にBリンパ球が異常に増殖してがん化した血液腫瘍です。リンパ球には、T細胞、B細胞、ナチュラルキラー(NK)細胞などがあり、B血中のリンパ球全体に占める割合は、T細胞が約75%、B細胞が20%、NK細胞が5%です。B細胞は細菌やウイルスなどの病原体が侵入すると抗体を作り、T細胞は病原体を記憶して排除する働きがあります。
悪性リンパ腫には、日本人に多い非ホジキンリンパ腫と、日本人には少ないホジキンリンパ腫があります。
ホジキンリンパ腫とはがん化したリンパ球が無制限に増えることで発症します。がん化したリンパ球がリンパ管を通じて全身に散らばり、リンパ節などのリンパ系組織に集まってかたまりをつくることで、リンパ節などの腫れ(しこり・こぶ)がみられるようになります。ホジキンリンパ腫は、よく治る悪性腫瘍の代表的な疾患です。5年生存率は最近では90%を超えています。
非ホジキンリンパ腫とは悪性リンパ腫の一種で、ホジキンリンパ腫とは特徴的な細胞や組織像が異なります。
非ホジキンリンパ腫とホジキンリンパ腫の違いとはホジキンリンパ腫にはホジキン細胞などの特徴的な細胞が認められるのに対し、非ホジキンリンパ腫には特徴的な組織像がありません。ホジキンリンパ腫は主に連続したリンパ節に広がるのに対し、非ホジキンリンパ腫はランダムに体のさまざまな部位に病変ができることがあります。ホジキンリンパ腫は発症数が少なく、非ホジキンリンパ腫とは治療も異なります。
非ホジキンリンパ腫の分類はリンパ腫のもととなるリンパ球の種類(B細胞リンパ腫とT/NK細胞リンパ腫)によって分類されます。臨床分類は、低悪性度を「インドレントリンパ腫」、中悪性度を「アグレッシブリンパ腫」、高悪性度を「高度アグレッシブリンパ腫」の3つに分類されます。
日本人の悪性リンパ腫の9割以上は非ホジキンリンパ腫で、多くの異なる細胞のタイプが存在します。そのため、治療方法もさまざまで、治療の成功には正確な診断が大切です。
いずれにしろあらゆる血液癌の原因はherpesウイルスです。
ガンは免疫療法では絶対治らないのはなぜですか?
癌細胞はインターフェロンαインターフェロンβを作れないのですか?
癌原遺伝子とは何か?癌抑制遺伝子とは何か?まず正常な細胞の分裂・増殖がどのように制御されているかを説明します。正常細胞は体に傷ができたり古い細胞が老化して死滅した場合などに、欠損部を補充するため、幹細胞が分裂しはじめ新しい細胞を増やして元の正常な組織の細胞に戻します。この時「増殖因子」と呼ばれる「細胞分裂を促すシグナル因子」が細胞膜にある増殖を開始しなさいというシグナル因子のレセプターに結合すると、細胞内に分裂のシグナルの情報が伝達されてDNAが複製され、さらに細胞の分裂が起こります。しかし、無制限に分裂がおきてはまずいので、十分な数の分裂がすむと「もう十分だよ」という分裂を抑制するシグナルが外から入ってきます。このようにして細胞の数が過不足なく調節されています。
このように、細胞分裂情報を伝達するシグナル分子は細胞の生存に極めて重要なものです。発ガン遺伝子とよばれているものはこれらの増殖の許可のシグナル分子が突然変異により羽状になり「常に増殖しなさいというスイッチがON」の状態になったものです。そのため細胞は無制限に分裂し増殖を続けます。これが癌の本体です。代表的な「増殖しなさいというスイッチ」が癌関連遺伝子の一つなのです。他の癌関連遺伝子には「増殖しなさいというシグナル」の伝達に関わる遺伝子と細胞周期に関わる遺伝子と転写因子に関わる遺伝子と最後に「細胞の増殖」を抑制するアポトーシスに関わる遺伝子と癌抑制遺伝子が癌関連遺伝子なのです。つまり癌関連遺伝子には二種類の遺伝子があり遺伝子が変異してしまうと「異常に増殖する」だけの癌原遺伝子とこの増殖するだけの癌原遺伝子の働きを抑制してしま癌抑制遺伝子があります。この癌抑制遺伝子の代表としてP53がありP53にも変異が起きてP53の機能が無くなるとその細胞は増殖するだけの完全な癌になるのです。
アトポーシスと癌とP53と癌細胞の不死化の関わりについて?何故癌細胞は死なないのか?なぜ癌細胞は異常な細胞であるのにアトポーシスが起こらないのでしょうか?癌細胞は異常な増殖能力は優れているのにアトポーシスが起こらないために無制限に増殖するのでしょうか?答えはヘルペスのよって癌細胞が無理やり作られてしまい、かつP53もherpesによって働かなくなってしまったからです。それではherpesを一切介入させないアポトーシスがどのようにして起こるのかを完璧に徹底的に理解しましょう。完全無欠なの機構が解明されるとこのアポト-シス機構を人為的に制御すれば癌細胞の治療などにも応用できる可能性があると考えている癌学者もいますがそれは無理であることも証明しましょう。アポトーシスに最も関係が深いタンパクはp53であります。DNAが損傷を受けて積み重なって遺伝子が癌化すると言われていますが間違いです。アポトーシスにおいてはp53の目的はミトコンドリアからのシトクロムcの流出を抑制するBcl-2ファミリーの蛋白に働いてシトクロームcの流出を促してアポトーシスを誘導することです。
ここで同時にアポトーシスを抑制する増殖因子からのシグナルがあるのです。増殖因子はアトポーシスに対しては最も強い抑制力を持っているのです。アトポーシスに対して細胞が死んではいけないという対抗できる作用を持っている因子を「生存因子」と言います。生きている細胞は酸素や栄養を取り込むとか、細胞同士が離れないで接着するとか、執拗に応じて動くとか、様々な活動をしていますがその中で最も基本的な需要な営みは分裂して細胞の数を増やすこと、つまり「増殖」なのです。しかもこの増殖は細胞が勝手に決めることはできないのです。増殖のスイッチが入らないと細胞は分裂して増殖することはできないのです。生体内ではこのスイッチが簡単に入らないように制限されているのです。増殖のスイッチは「オフ」が標準であるので、このスイッチを何かが「オン」にしなければ増殖が始まらないようになっているのです。この「何か」が「増殖因子」なのです。この「増殖因子」は「成長因子」とも言います。成長因子(Growth factor)とは、動物体内において、特定の細胞の増殖や分化を促進する内因性のタンパク質の総称である。増殖因子、細胞増殖因子などともいう。様々な細胞学的・生理学的過程の調節に働いており、標的細胞の表面の受容体タンパク質に特異的に結合することにより、細胞間のシグナル伝達物質として働き最も強力な生存因子が作用している限りアポトーシスが生じないのです。癌の場合はヘルペスウイルスが無理やり「増殖因子」が異常に働かざるを得ないp53遺伝子の突然変異を起こされて正常なp53タンパク質の働きを失ってしまったのでアポトーシスで死ぬべき癌細胞は生存を続けてしまい癌患者が死ぬまで不死化を続けるのです。
神経成長因子(Nerve growth factor:NGF)は増殖ではなく、神経細胞としての成長・成熟を促進する。エリスロポエチンは一種のサイトカインであるが、特定組織(腎臓)から分泌されて他の組織(骨髄)に影響を与えるのでホルモンとしても扱われる。
表的な成長因子(増殖因子)には次のようなものがある。成長因子(増殖因子)は生存因子とも言われます。生存因子の遺伝子変異は癌細胞の増殖を高め続けるのです。生存因子の遺伝子変異を起こすのもherpesウイルスなのです。
①EGF: 上皮成長因子 (Epidermal growth factor)
②IGF: インスリン様成長因子 (Insulin-like growth factor)
③TGF: トランスフォーミング成長因子 (Transforming growth factor)
④bFGFまたはFGF2: 塩基性線維芽細胞増殖因子 (basic fibroblast growth factor)
⑤NGF: 神経成長因子 (Nerve growth factor)
⑥BDNF: 脳由来神経栄養因子 (Brain-derived neurotrophic factor)
⑦VEGF: 血管内皮細胞増殖因子 (Vesicular endothelial growth factor)
⑧G-CSF: 顆粒球コロニー刺激因子 (Granulocyte-colony stimulating factor)
⑨GM-CSF: 顆粒球マクロファージコロニー刺激因子 (Granulocyte-macrophage-colony stimulating factor)
➉PDGF 血小板由来成長因子 (Platelet-derived growth factor)
⑪EPO: エリスロポエチン (Erythropoietin)
⑫TPO: トロンボポエチン (Thrombopoietin)
⑬HGF: 肝細胞増殖因子 (Hepatocyte growth factor)
⑭G-CSF: 顆粒球コロニー形成刺激因子(Granulocyte Colony Stimulating Factor)
⑮GM-CSF:顆粒球マクロファージコロニー刺激因子(Granulocyte Macrophage colony-stimulating Factor)
がんと栄養不良 – がん悪液質とは何か?癌で死ぬのは癌の原因であるヘルペスウイルスが増殖しすぎて癌細胞や正常細胞から栄養素をはじめエネルギーや核酸の原料などのすべてを奪い取るからです。癌細胞が正常細胞から栄養素をはじめエネルギーや核酸の原料などのすべてを奪い取るからではないのです。莫大な数のヘルペスウイルスのビリオンを増やすために極端な栄養失調になってしまうとがん悪液質になって死んでしまうのです。がん患者が食事を適切に取っているにもかかわらず、体重の減少が認められるケースは古くから知られています。実にがん患者の31~81%が低栄養状態であり、そのような状態下においては治療効果が弱められてしまったり、QOL(生活の質)が低下します。この低栄養状態は「がん」の進行を増やすばかりの影響がすべてです。この「がん悪液質」は、重くなると低栄養状態が元に戻らずに死に至ります。これは「なぜ、がんで人が死ぬのか」という問いに対する一つの答えにもなり得るため、この「がん悪液質」が癌の原因であるherpesが患者の栄養を全て奪い取ってしまうからです。この「がん悪液質」を治療する最高の方法はherpesをロイアルレイモンドライフ博士の「光癌療法」で殺すことです。ロイアルレイモンドライフ博士の「光癌療法」はここを読んでください。
がん悪液質とは?がんの進行に伴い、生体内の代謝異常と食欲不振により体重が減少し、さらに低栄養になり体力が徐々に衰えていきます。「がん悪液質」とは「がん」が体の栄養を奪い取ってしまってしまい、体の栄養状態が悪化していく様態のことを言います。「がん悪液質」の発生メカニズムはherpesウイルスが増えすぎてherpesの増殖する勢いが癌細胞よりもはるかに超えているためにherpesウイルスすべての栄養物やエネルギーを奪い取られてしまうからです。
「悪液質」の正しい定義とは「癌の原因である人が死ぬまで永遠に生き続け増殖し続けるherpesビリオンに栄養のすべてをかつエネルギーであるATPを全て略奪されてしまうので従来の栄養サポートで改善することが不可能で、進行性の機能障害をもたらし、(脂肪組織の有無にかかわらず)著しい筋組織の減少を特徴とする複合的な代謝障害症候群です。病態生理学的には食べる元気もなくなり経口摂取の減少とエネルギー不足による代謝異常による負の蛋白、負のエネルギーバランスが特徴です」
がん悪液質の原因はherpesウイルスの無限大の増殖のために患者の食欲不振による経口摂取の減少とエネルギー不足による生体内の代謝異常によるものです。
がんに罹ると、体内ではがん細胞を増やし続けるherpesウイルスの抑制なき増殖のために、エネルギーや栄養が消費されます。それを補うために体内のたんぱく質や脂肪が分解されなど代謝異常が起こり、結果として体力を消耗します。つまり「がん悪液質」とは、「がん細胞」を産生し続けるherpesウイルスが代謝異常を引き起こし、結果として吸収した栄養素を体が適切に使うことが出来なくなっている状態です。
