パターン認識受容体、英語でPatternrecognitionreceptorで略してPRRは、自然免疫系の病原体が特有にもつ分子のパターンを認識して、人体に危険が侵入したというシグナルを自然免疫のみならず、獲得免疫(適応免疫)に伝える重要な機能を持っています。とりわけ現代の病原体は世界中の78億人が感染しているヘルペスが人体に存在していることを知らせるdangersignalです。
PRRは、病原体に典型的な分子を検出できる38億年かかって生殖細胞に記憶されて遺伝子に刻み込まれた(encode、訳してエンコード)感染宿主である人体のセンサー(hostsensor)です。PRR(Patternrecognitionreceptor)は主に、樹状細胞、マクロファージ、単球、好中球などの自然免疫細胞や、上皮細胞などによって発現されるタンパク質であり、病原体関連分子パターンと言われる病原体の持つPAMP(pathogen-associatedmolecularpattern、訳して、病原体関連分子パターン)とヘルペス感染細胞が崩壊した後のDAMP(damage-associatedmolecularpattern、訳してダメージ関連分子パターン)の2つのクラスの分子を認識するのです。
PAMP(pathogen-associatedmolecularpattern)は、微生物病原体、とりわけ現代は全ての人類に感染しているヘルペスウイルスの分子パターンを言い、これを認識するのがPRRであります。2つ目のDAMP(damage-associatedmolecularpattern)は、細胞の損傷または細胞死に至るまでに放出される宿主の細胞の成分が持つ、とりわけヘルペスが感染した細胞の成分の分子パターンであり、これをPRRで認識するのです。この自然免疫細胞の持つPRRは、適応免疫の前に進化したため、原始的なパターン認識受容体であります。大食細胞や樹状細胞などの抗原提示細胞(APC)が持つPRRは病原体に対しては病原体である敵と戦って殺すための炎症性サイトカインを放出し、自然免疫で殺しきれなければ抗原特異的な適応免疫応答につないでくれます。現代の最後に残る病原体は、99%がヘルペスウイルスであります。自己免疫疾患もヘルペスが原因です。自己の免疫は自己の成分を異物と認識できないので、自己免疫疾患は絶対にありえないのです。つまり、自己の成分は38億年かかって確立したPRRには認識されないので、自己免疫疾患はありえないのです。しかも、自己の成分はPAMPにも特別に異物として認識されるDAMPにも絶対になれないのです。
特定のPRRによって認識される微生物やヘルペスウイルスだけが持つ独特な特異的分子は、病原体関連分子パターン(PAMP)と呼ばれ、細菌の炭水化物(リポ多糖(LPS)やマンノース)と、核酸(細菌またはウイルスのDNAやRNA)と、フラジェリン(flagellin)と言われる細菌の鞭毛を構成するタンパク質の1種であるペプチドや、ペプチドグリカンとリポテイコ酸(グラム陽性菌由来)と、N-ホルミルメチオニンと、リポタンパク質および真菌グルカンとキチンなど数多くありますが自己の成分は含まれません。一方、内因性ストレス信号と言われたり、細胞障害性信号(屑)はダメージ関連分子パターン(DAMP)と呼ばれ、他の多くの化合物の中でも尿酸や細胞外ATPが含まれることは既に述べました。
PRRにはいくつかのサブグループがあり、リガンド特異性、機能、局在化、および進化的関係に従って分類されます。それらの局在に基づいて、PRRは、膜結合PRRおよび細胞質PRRに分類できます。膜結合型PRRには、1)Toll様受容体(TLR)と2)C型レクチン受容体(CLR)が含まれ、細胞質PRRには、3)NOD様受容体(Nod-like-receptor略してNLR)および4)RIG-I様受容体(RIG-I-like-receptor略してRLR)が含まれます。この4つのPRRについてもう一度詳しく復習しましょう。
1)Toll様受容体(Toll-like-receptor、略してTLR)として知られる膜貫通タンパク質によって媒介されて認識できるのは、細胞外またはエンドソームの病原体関連分子パターンです。TLRは現在知られているもので13種類あり、このTLRが最多のPRRです。TLRは、典型的な構造モチーフであるロイシンリッチリピート(LRR)を共有しており、特定の外観を持っています。TLR(Toll-like-receptor)は、サイトカインの合成と分泌を行い、病原体に対して自然免疫応答または獲得免疫応答の両方に必要な他の免疫防御のための細胞を活性化します。TLRファミリーの13種類の各々のTLRは、特定のPAMPをそれぞれ認識できます。
自己抗体は全てヘルペス感染細胞によって引き起こされたDAMP(細胞傷害関連分子パターン)を認識したPRR(パターン認識レセプター)によって生成されたmolecules(分子)によるものです。
受容体TLRや他のPRRによって認識される微生物と微生物成分と細胞の局在部位一覧表
| PRR(Pattern recognition receptor) | 局在部位 | 微生物成分 | 微生物 |
| TLR1/TLR2 | 細胞表面 | トリアシルリポペプチド | バクテリア |
| TLR2/TLR6 | 細胞表面 | ジアシルリポペプチド | マイコプラズマ |
| リポタイコ酸 | グラム陽性菌 | ||
| TLR2 | 細胞表面 | リポタンパク質 | さまざまな病原体 |
| ペプチドグリカン | グラム陽性菌と グラム陰性菌 | ||
| リポアラビノマンナン | マイコバクテリア | ||
| ポリン | ナイセリア | ||
| エンベロープ糖タンパク質 | ウイルス(例、はしかウイルス、HSV、サイトメガロウイルス) | ||
| GPI-ムチン | 原生動物 | ||
| ホスホリポマンナン | カンジダ | ||
| ザイモサン | 菌類 | ||
| β-グリカン | 菌類 | ||
| TLR3 | 細胞表面/ エンドソーム | dsRNA | ウイルス |
| TLR4 | 細胞表面 | LPS | グラム陰性菌 |
| エンベロープ糖タンパク質 | ウイルス(例、RSV) | ||
| グリコイノシトールリン脂質 | 原生動物 | ||
| マンナン | カンジダ | ||
| HSP70 | ホスト | ||
| TLR5 | 細胞表面 | フラジェリン | べん毛虫 |
| TLR7/TLR8 | エンドソーム | ssRNA | RNAウイルス |
| TLR9 | エンドソーム | CpGDNA | ウイルス、バクテリア、原生動物 |
| RIG-I | 細胞質 | dsRNA(短い)、5′-三リン酸RNA | ウイルス(例、A型インフルエンザウイルス、HCV、RSV) |
| MDA5 | 細胞質 | dsRNA(長い) | ウイルス(ピコルナウイルスおよびノロウイルス) |
| NOD1 | 細胞質 | ジアミノピメリン酸 | グラム陰性菌 |
| NOD2 | 細胞質 | MDP | グラム陽性菌とグラム陰性菌 |
| NALP1 | 細胞質 | MDP | グラム陽性菌とグラム陰性菌 |
| NALP3 | 細胞質 | ATP、尿酸結晶、RNA、DNA、MDP | ウイルス、バクテリア、およびホスト |
| DAI | 細胞質 | DNA | DNAウイルス、細胞内細菌 |
| AIM2 | 細胞質 | DNA | DNAウイルス |
| PKR | 細胞質 | dsRNA、5′-三リン酸RNA | ウイルス |
PRRの代表はTLRでありますが、上の一覧表には見慣れないTLR以外のPRRがあります。RIG-I、MDA5、NOD1、 NOD2、NALP1、NALP3、DAI、AIM2、PKRの9個のPRRについて順に説明しましょう。
1)RIG-Iはリグ-アイと読み、英語でretinoic acid-inducible gene-Iで、略してRIG-I(リグ-アイ)で、訳してレチノイン酸誘導遺伝子I(アイ)です。ヒトの自然免疫系で働くタンパク質の分子で、ウイルスが細胞内に進入した時にウイルス由来のRNAを認識し、抗ウイルス作用を示すI型インターフェロンであるIFN-αとIFN-βの産生を誘導します。自然免疫の中で細胞に感染したインフルエンザウイルスを細胞もろとも殺すことができるのはIFN-αとIFN-βだけであり、いかにRIG-Iの遺伝子の働きが極めて大事なのです。
2)MDA5、英語でMelanoma differentiation-associated gene 5で、略してMDA5で、訳してメラノーマ分化関連タンパク質遺伝子5です。様々な細胞内ウイルスセンサーであるMDA5タンパク質は、ウイルスが様々な細胞に感染した際にウイルスに由来する2本鎖RNAをこのPRRであるMDA5が認識して自然免疫応答を誘導するのです。MDA5はRIG-I様受容体(RIG-I like receptor、略してRLR)ファミリーの一部であり、RIG-IおよびLGP2も含まれており、ウイルスを検出できるパターン認識受容体として機能します。LGP2は、RIG-I様受容体3(RLR-3)としても知られ、RIG-IおよびMDA5によって認識される多くのウイルスに対して効果的な抗ウイルス応答を生成するために不可欠なのです。つまり、RIG-Iが作るIFN-αとIFN-βを作るためにはLGP2の手助けが絶対に必要なのです。
RIG-IとMDA5は、互いに相同性の高いヘリカーゼドメインを有していますが、認識できるRNAの構造や配列(pathogen-associated molecular pattern、PAMP)が異なっており、HCV(C型肝炎ウイルス)はRIG-IとMDA5いずれにも認識されます。ヘリカーゼドメインは、一本の鎖でできているRNAが入り組んだ構造をとり、部分的に結合して2本の鎖になっている構造のRNAの部分を紐解いて、本来の一本の鎖に戻す働きを持つタンパク酵素をヘリカーゼと呼びます。ヘリカーゼの活性のある中心部分をヘリカーゼドメインといいます。
I型インターフェロンのかかわる自然免疫応答は,外部から侵入したヘルペスウイルスなどの微生物を自然免疫受容体により感知し,その排除に働く一方、細胞の表面やエンドソームにはToll様受容体(Toll-likereceptor、略してTLR)が存在し,病原体関連分子パターン(pathogen-associated molecular pattern、PAMP)を認識することにより抗ウイルス応答、抗ヘルペスウイルス応答を起こして、細胞もろともヘルペスウイルスを殺してしまうのです。
3)NOD1は英語でNucleotide-binding oligomerization domain-containing protein 1で、略してNOD1で、訳してヌクレオチド結合オリゴマー化ドメイン含有タンパク質1です。oligomerization は何でしょうか? 日本語もオリゴメライゼーションで、oligomerization によって生ずるオリゴマー化は、有限の重合度(ポリマー化)によってモノマー(単量体)を高分子複合体に変換させる化学プロセスです。簡単に言えば、オリゴメライゼーションはモノマー(単量体)をオリゴマー化することです。
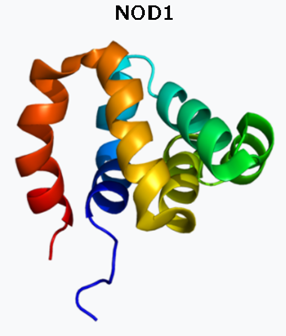
ヌクレオチド結合オリゴマー化ドメイン含有タンパク質1(NOD1)は、ヒトではNOD1遺伝子によってコードされるタンパク質受容体です。細胞内のバクテリアの分子をPRRで認識し、バクテリアを殺すための免疫反応を刺激するのです。NOD1タンパク質には、カスパーゼ動員ドメイン(CARD)が含まれています。カスパーゼ動員ドメイン(CARD)とは何でしょうか? CARDは英語でCaspase recruitment domainsで、さまざまなタンパク質、炎症およびアポトーシスに関連するプロセスに関与するタンパク質に見られる相互作用モチーフです。カスパーゼ(Caspase)は、システイン-アスパラギン酸プロテアーゼや、システイン依存性アスパラギン酸指向性プロテアーゼとも言われ、プログラムされた細胞死に不可欠な役割を果たすプロテアーゼ酵素のファミリーです。個々のCARD間の直接的な相互作用を介して、より大きなタンパク質複合体の形成を仲介します。CARDドメインは、ヘリカーゼ、キナーゼ、ミトコンドリアタンパク質、カスパーゼ、その他の細胞質因子など、驚くほど広範囲のタンパク質に見られます。
NOD1はNOD様受容体タンパク質ファミリーのメンバーであり、次に説明するNOD2の親戚と言えます。NOD1は細胞内パターン認識受容体であり、植物の耐性タンパク質と構造が類似しており、細菌ペプチドグリカンを含む細菌のD-グルタミル-メソ-ジアミノピメリン酸(iE-DAP)分子を認識することにより、自然免疫と獲得免疫を仲介します。植物の耐性タンパク質とは、植物は、生育に適した環境では最大限に生長する一方、周辺環境が悪化すると生長を抑え、環境ストレスに耐えるためのタンパク質を持っており、これを耐性タンパク質といいます。
NOD1はRIPK2と相互作用します両方の分子のCARDを介して。iE-DAPを含む分子によるNOD1の刺激は、転写因子NF-κBの活性化をもたらします。RIPK2とは、英語でReceptor-interacting serine/ threonine-protein kinase 2で、日本語で分かりやすく訳すと「受容体と相互作用するセリンもしくはスレオニン-プロテインキナーゼ2です。ヒトではRIPK2遺伝子によってコードされる酵素です。酵素キナーゼタンパク質は、C末端カスパーゼ動員ドメイン(CARD)を含み、自然免疫経路と適応免疫経路の両方におけるシグナル伝達複合体の構成要素で、自然免疫と獲得免疫を仲介します。NF-κBの強力な活性化因子であり、さまざまな刺激に応答してアポトーシスを誘導します。
NF-κBとは何でしょうか? NF-κBは英語でnuclear factor-kappa Bで、訳して核内因子κBで、読み方はエヌエフ・カッパー・ビーです。NF-κBは1986年に、David BaltimoreらによりB細胞で選択的に発現する免疫グロブリンのκ軽鎖のエンハンサーに結合する転写因子として同定されました。DNA上の塩基配列領域にあるエンハンサーは遺伝子の発現制御において中心的な役割を担っており、このエンハンサーに転写因子が結合すると、標的遺伝子の発現にスイッチが入り、タンパク質を生成するのです。エンハンサーは、遺伝子活性化因子である転写因子と結合することで遺伝子の転写量を大幅に増大(enhance)させることから、エンハンサーと命名されました。
発見当初はB細胞に特異的なものだと考えられていたのでNFにB細胞のBと、B細胞の軽鎖の1つであるκ(カッパー)が付け加えられたのです。ところが後にB細胞のみならず動物のほとんど全ての細胞に発現していることがわかりました。しかも高等生物に限らずショウジョウバエやウニなどの無脊椎動物の細胞においてもNF-κBが発現しています。NF-κBはストレスやサイトカイン、紫外線等の刺激により活性化されます。言うまでもなく、NF-κBは免疫反応において中心的役割を果たす転写因子の一つであり、急性および慢性炎症反応や細胞増殖、アポトーシスなどの数多くの生理現象に関与しています。転写因子というのはタンパク質の設計図である遺伝子であるDNAやRNAをタンパク質の合成の指示書であるmRNAの遺伝子に移し替える(転写する)ことです。NF-κB活性制御の不良はクローン病や関節リウマチなどの炎症性疾患をはじめとし、癌や敗血症性ショックなどの原因となり、特に悪性腫瘍では多くの場合NF-κBの恒常的活性化が認められると言われていますが、これらの病気にはとりわけヘルペスウイルスが絡んでおり、その結果、免疫の要であるNF-κB活性制御の不良が起こるからです。人類最後に残る病原体はヘルペスウイルスであり、ヘルペスウイルスを増殖させるようなNF-κB活性制御の不良は免疫の低下によってもたらされ、免疫の低下が改善される時に増殖したヘルペスウイルスとの戦いが始まることによってあらゆる原因不明の病気やありえない自己免疫疾患が増え続けることになるのです。NF-κBの働きが人為的に抑制されてヘルペスウイルスによる自己免疫疾患がどのように起こるかについては別のタイトルで説明しましょう。
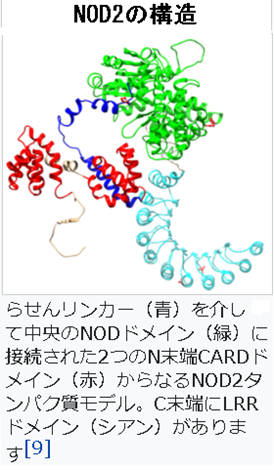
4)NOD2は、英語で Nucleotide-binding oligomerization domain-containing protein 2 (NOD2)カスパーゼ動員ドメイン含有タンパク質15(CARD15)または炎症性腸疾患タンパク質1(IBD1)としても知られるヌクレオチド結合オリゴマー化ドメイン含有タンパク質2(NOD2)は、細胞内のバクテリアの分子のペプチドグリカンを認識するPRRであり、認識したのちに免疫反応を刺激する重要な役割を果たしています。NOD2は細胞内パターン認識受容体であり、植物の耐性タンパク質と構造が類似しており、特定の細菌に見られるムラミルジペプチド(MDP)と呼ばれる特定の構造を含む分子を認識します。ムラミルジペプチド(Muramyl di-peptide、略してMDP)は、グラム陽性菌とグラム陰性菌の両方に存在するペプチドグリカンの一つです。
タンパク質のC末端部分には、タンパク質間相互作用で役割を果たすロイシンリッチリピートドメインが含まれています。NOD2のタンパク質の中央部分は、タンパク質の自己オリゴマー化に関与する特徴的なNODドメインを持っています。N末端部分は、アポトーシスおよびNF-κB活性化経路において役割を果たす2つのCARDドメインが含まれています。上左図にNOD2の構造を示しておきます。ここでのリンカーというのは、2つのドメインを結びつけているタンパク質です。
このNOD2の遺伝子は、NOD1 / Apaf-1ファミリーと知られているNOD様受容体ファミリーで、2つのカスパーゼ動員ドメイン(CARD)と11のロイシンリッチリピート(LRR)を持つタンパク質をコードします。このタンパク質は主に末梢血白血球で発現し、グラム陽性菌とグラム陰性菌の両方に存在するムラミルジペプチド(MDP)部分を有する細菌分子を認識し、NF-κBタンパク質を活性化することにより、免疫応答に関与します。この遺伝子の変異は、関連付けられているクローン病、ブラウ症候群、重度の肺サルコイドーシス 及び移植片対宿主病に関与しています。ブラウ症候群は、皮膚と関節そして眼にサルコイドーシスと呼ばれる病気によく似た 肉芽腫 ができる病気です。
NOD2はNLRC4と相互作用することが示されています。NOD2は、ssRNAまたはウイルスRNA処理に応答してMAVSに結合し、ヘルペスウイルスに対してIFN-αやIFN-β産生を活性化できます。

5)NALP1は英語でNACHT leucine-rich-repeat protein1で、略してNALP1です。HACHTとは、その名前の由来は、NAIP(NLPファミリーアポトーシス阻害タンパク質)のNAと、CIITA(つまり、C2TAまたはMHCクラスII転写活性化因子)のCと、HET-E(カビの一種である糸状菌のPodospora anserinaから見つけられた非互換性遺伝子座タンパク質)のHと、最後のTはTEP1(TP1またはテロメラーゼ関連タンパク質)のTから生まれました。NLRP1は、主に上皮細胞や造血細胞に発現していますが、他に、小腸、胃、気道上皮の腺上皮構造内に見られます。NLRP1の遺伝子は、プログラム細胞死であるアポトーシスに関与しています。NLRP1は、抗菌または抗ヘルペスウイルス免疫応答を活性化します。
6)NALP3は英語でNACHT leucine-rich-repeat protein3で、NLRP3は、マクロファージで主に発現され、インフラソームの成分として見られます。インフラソームとは、英語でinflammasomeで、主に自然免疫細胞を中心に発現し、複数のタンパク質からなるタンパク複合体です。病原微生物成分や尿酸結晶などの細胞質内の異物をすでに説明したNOD-like receptors(NLRs)に分類されるNLRC4(NLR Family CARD Domain Containing 4)、NLRP1(NLR Family Pyrin Domain Containing 1)、NLRP3(NLR Family Pyrin Domain Containing 3)などを介して宿主細胞に対するdanger signal(危険信号)として認識するPRRであり、シグナル伝達分子apoptosis-associated speck-like protein containing a CARD(下線の頭文字を採用して略してASC)を介して、非活性型のprocaspase-1を活性型のcaspase-1にし、casepase-1はpro-IL-1βやpro- IL-18を炎症性サイトカインとして実際に働くIL-1βやpro- IL-18にし、炎症反応の誘導や進展に重要な役割を果たしています。NLRP3は細胞外のATPや結晶化した尿酸のような、傷害された細胞の産物を見つけ出すことができます。
NLRP3の遺伝子は、ピリン(pyrin)ドメインやヌクレオチド結合部位(nucleotide-binding-site、略してNBS)ドメインやロイシンリッチリピート(Leucine-rich repeat、略してLRR)モチーフの3つを含んでいるピリン様プロテイン(Pyrin like protein)をコードしています。このNLRP3タンパク質は、ASCと言われるapoptosis-associated speck-like protein containing a CARD、日本語で「CARDを含むアポトーシス関連スペック様タンパク質」と訳すのですが、このASCというタンパク質とピリンドメイン(Pyrin domain、略してPYD)は相互作用します。カスパーゼ動員ドメインであるCARD(caspase recruitment domain、訳してカスパーゼ誘導ドメイン)を含むタンパク質は、炎症と免疫応答とアポトーシスとに関与します。ピリンドメイン(PYD)とは、ピリンドメインがあるタンパク質ドメインと、アポトーシスに関わる三次元の立体構造であるdeath domain(死のドメイン)と言われるサブクラスタンパク質モチーフから成り立っています。ピリンドメインを持つタンパク質には、NOD様受容体と呼ばれる細胞内微生物センサーや、ASC(apoptosis-associated speck-like protein containing a CARD)の機能に関連するタンパク質が含まれます。
NLRP3(NOD-,LRR- and pyrin domain-containing protein 3)は、病原体関連分子パターン(PAMP)を認識するパターン認識受容体(PRR)として機能する自然免疫系の成分です。NLRP3はPRRであるNOD様受容体(NOD like receptor、NLR)サブファミリーに属しています。NLRP3 はアダプターASCタンパク質であるPYCARDと共にカスパーゼ-1活性化複合体を形成します。この複合体はNLRP3インフラソームと呼ばれます。アダプタータンパク質とは何でしょうか? アダプタータンパク質、英語でAdaptor ProteinとかAdaptor Molecule といい、シグナル伝達に関与するタンパク質です。アダプタータンパク質自体は基本的に酵素活性を有していないが、他のタンパク質との結合に関与するドメインを複数有しており、SH2ドメインやロイシンジッパー、Znフィンガー、ASCタンパクなどがあります。アダプタータンパク質はこれらの構造を介してシグナル伝達分子と結合し、そのリクルート(招集)を行うと共に、受容体とシグナル伝達分子の会合を仲介する役割を持ち、チロシンキナーゼや酵素などのシグナル伝達分子を受容体の近くに集めることでシグナル伝達分子の活性化を促進させるのです。インフラソームとは何でしょうか? 炎症は生体に傷害をもたらす病原体に対する防御の戦いの反応です。この生体防御反応に対して炎症性サイトカインが作られ、とくに重要な炎症性サイトカインの1つがインターロイキン1β(IL-1β)であり、このIL-1β産生を制御する細胞内のタンパク質複合体をインフラソームと言います。それではIL-1βとは何でしょうか? インターロイキン1ベータ(IL-1β)は、1)白血球パイロジェン、2)白血球内因性メディエーター、3)単核細胞因子、4)リンパ球活性化因子などの他の4つの名前で知られるサイトカインタンパク質です。このIL-1βサイトカインは、活性化されたマクロファージによってプロタンパク質(protein precursor、訳してタンパク前駆物質)として産生され、カスパーゼ1(CASP1、別名Interleukin-1 converting enzyme、略してICE)によって活性型にプロセシングされます。このIL-1βサイトカインは炎症反応の重要なメディエーターであり、細胞増殖、分化、アポトーシスなどのさまざまな細胞活動に関与しています。中枢神経系(Central nervous system、略してCNS)におけるこのIL-1βサイトカインによるシクロオキシゲナーゼ-2(cyclooxygenase 2、略して COX2と別に Prostaglandin-endoperoxide G synthase 2 、略して PTGS2とも言います。)の誘導は、炎症性疼痛過敏症に寄与することは分かっていますが、疼痛そのものを起こすわけではありません。インターロイキン-1(IL-1)ファミリーサイトカインは、11種の遺伝子 によってコードされる11種のタンパク質(IL-1Family1~IL-1Family11)から成り立ち、炎症性サイトカインの複雑なネットワークを誘導し、白血球と内皮細胞でのインテグリンの発現を介して、炎症反応を調節および開始します。インテグリンとは、細胞間および細胞外マトリックスの接着を促進する膜貫通型受容体です。
さまざまなインフラソーム複合体(細胞質ゾル分子複合体)が存在し、それぞれのインフラソームは危険信号を認識し、炎症誘発性プロセスとIL-1βおよびIL-18の産生を活性化します。 NLRP3(ピリンドメイン、ヌクレオチド結合ドメイン、ロイシンリッチリピートの3つのドメインを含んでいます。)タイプのインフラマソームはさまざまな刺激によって活性化され、2型糖尿病、アルツハイマー病、肥満、アテローム性動脈硬化症など、NLRP3の活性化に関連する疾患があります。しかしながら、NLRP3(NOD-like receptor )もDAMPを認識するPRRの1つですからこれらの病気の原因にはならないのです。
IL-1αとは何でしょうか? ヘマトポエチン1としても知られるインターロイキン1アルファ(IL-1α)は、ヒトではIL1A遺伝子によってコードされる11種類あるインターロイキン1ファミリーのサイトカインの1つです。一般に、インターロイキン1は、炎症の発生、および発熱と敗血症の促進に関与しています。IL-1α阻害剤は、これらのプロセスを中断し、病気を治療するために開発されています。しかしこのようなIL-1αは病気の原因になるのではなくて IL-1αは、IL-1α阻害剤を治療薬に用いても根本的な治療にはならないのです。なぜならば全ての免疫のサイトカインは病原体を処理するために作用しているだけですから、どんな病原体がIL-1αを活性化しているかをまず考える必要があります。現代社会において最後に残る病原体はヘルペスウイルスであることを知っておく必要があります。だからこそIL-1αはヘルペスウイルスを処理するために、主に活性化マクロファージ、好中球、上皮細胞、血管内皮細胞によって産生されるのです。それは、代謝的、生理学的、造血活性を有し、免疫応答の調節において中心的な役割の1つを果たしています。インターロイキン-1受容体(Interleukin-1 receptor、略してIL-1R)に結合します。腫瘍壊死因子-αを活性化する経路上にIL-1Rが存在しています。
インフラマソームは、カスパーゼ1の活性化を調節し、ヘルペスウイルスなどの感染性微生物やDAMPの産物として宿主タンパク質に由来する分子に応答して炎症のクズを処理するための自然免疫系の受容体およびセンサーがインフラソームであって、決して炎症性疾患を起こすものではなくて掃除屋であるということはすでに述べました。
外敵との戦いがない時には、活性化シグナルが生まれない場合にはNLRP3は、細胞質内でHSP90はSGT1と複合体を形成した不活性状態に保たれています。HSP90とは、Hsp90(熱ショックタンパク質90)は、他のタンパク質が適切に折りたたまれるのを助け、熱ストレスに対してタンパク質を安定させ、タンパク質分解を助けるシャペロンタンパク質です。シャペロンタンパク質とは、すべての哺乳類タンパク質の半分以上の折り畳み(fold)に関与しており、高分子構造の組み立てまたは分解を支援するタンパク質です。SGT1とは、英語でsuppressor of G-two allele of Skp1、略してSGT1で、複数の生物学的機能を持つアダプタータンパク質です。SGT1はNod1の活性化に不可欠です。
NLRP3インフラマソームは傷害した細胞などから放出された結晶尿酸と細胞外ATPなどを異物信号として検出します。これらのシグナルは、インフラソーム複合体からHSP90とSGT1を放出させ、かつインフラソーム複合体へASCタンパク質とカスパーゼ-1を動員します。活性化されたNLRP3インフラソーム複合体の中にあるカスパーゼ-1は、炎症性サイトカインであるIL-1βを活性化し、炎症後のゴミの処理をします。
7)DAIは、英語でDNA-dependent activator of IFN-regulatory factors、略してDAI、訳してDNA依存性IFN調節因子のアクチベーターです。DAIはZ-DNA結合タンパク質1(Z-DNA-binding protein 1、略してZBP1)やIFN調節因子やDLM-1やDNA依存性活性化因子としても知られており、ヒトではZBP1遺伝子によってコードされるタンパク質です。したがって、DAIにはトータルで5つの名称があります。別の4つの名称は、1つ目がZ-DNA結合タンパク質1(ZBP1)、2つ目がIFN調節因子、3つ目がDLM-1、4つ目がDNA依存性活性化因子となり、DAIを含めて5つの名称があります。
DAIは、細胞質内のウイルスDNAを認識します。ウイルスのライフサイクルには、多くの場合、ウイルスのDNAやRNAが細胞質に露出するステップが含まれますが、細胞のDNAは通常、細胞の核に含まれているため、細胞はウイルス感染の指標としてDAIなどのタンパク質を利用して、ウイルスの遺伝子を認識するのです。DAIが活性化されると、インターフェロンβ(IFN-β)やインターフェロンα(IFN-α)などの抗ウイルス性サイトカインの産生が増えます。細胞内のヘルペスウイルス感染やA型インフルエンザウイルス感染を感知し、細胞死をもたらします。この細胞死が後で説明するようにネクロプトーシスとかネクロトーシスとか言われるのです。
ネクロトーシスやネクロプトーシスとは一体何でしょうか? ZBP1(DAI)がA型インフルエンザウイルス(IAV)感染中に生成されたZ型RNAを感知し、ネクロトーシスと呼ばれるカスパーゼ非依存性の炎症性細胞死が起こることが最近、発見されました。ZBP1(DAI)がA型インフルエンザウイルス(IAV)のリボ核タンパク質複合体を感知して細胞死を誘導するのです。リボ核タンパク質とは、リボ核酸タンパク質ともいい、リボ核酸というのは英語でribonucleic acidといい、RNAのことです。このリボ核酸(RNA)とタンパク質が結合した複合体をリボヌクレオタンパク質、英語でRibo-nucleo-proteinといい、略してRNPと呼ばれるのです。転写因子であるIRF1(Interferon regulatory factor 1、訳してインターフェロン制御因子1)がZBP1(DAI)発現の上流調節因子である転写因子です。
Z型RNAとは何でしょうか? ちょうどDNAの二重らせん構造の取り方に3種類のA-DNA、B-DNA、Z-DNAがあるように、RNAにもDNAと同様にらせん構造があり、その構造の取り方の1つにZ-RNAがあるのです。リボ核酸は英語でribonucleic acidで、略してRNAは、単一の(モノマー)のリボヌクレオチド(RNA)が何個もホスホジエステル結合で重合して鎖状に繋がった核酸です。ちょうどDNAは2個のDNAのヌクレオチドをリン酸がホスホジエステル結合で結びつけることを繰り返して何個も結びつけて鎖状にしたのがDNAなのです。1個のRNAヌクレオチドはリボース、リン酸、塩基の3つの成分から構成され、基本的に核酸塩基としてアデニン (A)、グアニン (G)、シトシン (C)、ウラシル (U) を有していますが、DNAはウラシル (U) がチミン(T)になっている違いがあるだけです。RNAポリメラーゼによりDNAを鋳型にして転写(合成)されてmRNAになります。RNAは生体内でタンパク質合成を行う際に必要なリボソームの活性中心部位を構成しています。現在、新型コロナウイルスワクチンのmRNAはリボゾームで新型コロナウイルスのスパイクを作らせ、このウイルスのスパイクのタンパク質に対して人間の免疫がIgM抗体を作っているのですが、IgG抗体はmRNAワクチンでは作れないのでせいぜいワクチンとしての効果が続くのは6か月以内でIgMが消えてしまうので本当のワクチンではないのです。
RNAには色々種類があり、生体内での挙動や構造により、RNAには、伝令RNA(メッセンジャーRNA、mRNA)、運搬RNA(トランスファーRNA、tRNA)、リボソームRNA (rRNA)、ノンコーディングRNA (ncRNA)、リボザイム、二重鎖RNA(dsRNA) 等の様々な分類があります。
DNAのらせん構造の3種類のA-DNA、B-DNA、Z-DNAについて説明しましょう。 A-DNAは、B-DNAに似た右巻き二重らせんですが、B-DNAよりも短くコンパクトならせん構造であり、塩基対はらせん軸に対して直交していません。A型とB型のDNA構造は本当はワトソンとクリックと一緒にノーベル賞をもらうべきであったロザリンド・フランクリンによって発見されました。彼女こそがDNAは二重らせん構造が遺伝子であることを証明したのです。さらにロザリンド・フランクリンは脱水条件下でA型のDNA構造となることも示しました。こうした条件はDNAの結晶の形成の際によく利用され、多くのDNAの結晶構造がA型構造です。同様のらせん構造は、RNAの二重らせんやDNA-RNAハイブリッドの二重らせんでもみられるのです。
ネクロトーシスとは、プログラムされた形態の壊死、または炎症性細胞死です。従来、壊死は、アポトーシスを介した秩序だったプログラム細胞死とは対照的に、細胞損傷または病原体による浸潤破壊によって起こるプログラムされていない細胞死です。ネクロトーシスの発見は、細胞がプログラムされた方法で壊死を実行できるのみならず、アポトーシスが必ずしも細胞死の好ましい形態であるとは限らないのです。さらに、ネクロトーシスの免疫原性(免疫を活性化する性質)は、免疫系による病原体に対する防御を助けるなど、特定の状況でのネクロトーシスの関与に有利に働きます。なぜならば、ネクロトーシスによって感染した細胞はウイルス(ヘルペス)と共にネクロトーシスしてしまうのですが、新しい細胞に感染させないので生体細胞に対する感染拡大を防ぐからです。ネクロトーシスはヘルペスウイルス防御メカニズムとして明確に定義されており、ウイルス複製を制限するウイルスカスパーゼ阻害剤の存在下で、細胞がカスパーゼ非依存的に「細胞自殺」を起こすことが可能なのがネクロトーシスなのです。ネクロトーシスは、疾患への反応であることに加えて、クローン病、膵炎、心筋梗塞などの炎症性疾患の構成要素としても特徴づけられています。つまりこのような病気にはヘルペスが絡んでいることを示唆しているのです。言い換えると、クローン病のような腹痛をもたらす自己免疫疾患もヘルペスが関与していると考えるべきです。このようなネクロトーシスの代表はヘルペス感染細胞が自らIFN-αやIFN-βを産生し、自らの細胞もろともヘルペスを博愛主義的な細胞自殺に追い込むカスパーゼ非依存的な殺し方と言えます。
ヘルペスウイルスがネクロトーシスをもたらすシグナル伝達経路について説明しましょう。 その経路はまず体内にヘルペスウイルスが感染し、大食細胞に貪食され、大食細胞のToll like receptorに認識されるとTNFαが作られ、血中に放出されるとあらゆる細胞の細胞膜に存在するその受容体TNFR1(Tumor necrosis factor receptor 1)を刺激します。TNFR1(Tumor necrosis factor receptor 1)結合タンパク質TNFR関連死タンパク質であるTRADD(Tumor necrosis factor receptor type 1-associated DEATH domain)およびTNF受容体関連因子TRAF2(TNF receptor-associated factor 2)はRIPK1(Receptor-interacting serine/threonine-protein kinase 1)にシグナルを送り、RIPK3(Receptor-interacting serine/threonine-protein kinase 3)を動員してネクロソームを形成します。ネクロソームはリポプトソームとも呼ばれます。ネクロソームとは、ネクローシスを誘導するシグナル伝達複合体であります。ネクロソーム複合体に含まれているタンパク質にはRIPK1(receptor-interacting protein kinase 1)と, RIPK3(receptor-interacting protein kinase 3)と, MLKL(mixed lineage kinase domain-like protein)です。リポプトソームは、ネクロプトーシスとアポトーシスによる細胞死を活性化するのです。リポプトソームによるMLKL(mixed lineage kinase domain-like protein)のリン酸化は、MLKLのオリゴマー化(MLKLがいくか繋がること)を促進し、MLKLが細胞の原形質膜および細胞小器官に挿入され、MLKLが自由に透過できるようになってしまい、MLKLが細胞の原形質膜および細胞小器官と一体化することにより、炎症を起こしている状態となり、様々のダメージ関連分子パターン(DAMP)が放出され、後始末のための免疫応答が誘発されます。免役応答には敵との戦いによって正常な細胞が崩壊したあとの屑であるDAMPも処理する仕事も含まれているのです。
8)AIM2、英語でabsent in melanoma 2で、略してAIM2です。AIM2は細胞質内で二本鎖DNAを認識する受容体であり,PRRの1つであり、カスパーゼ1の活性化を介して戦いの後の処理をする炎症性サイトカインの産生や炎症性プログラム細胞死を誘導します。
IFN-αやIFN-βなどのインターフェロン誘導性タンパク質であるAIM2は、ヒトではAIM2遺伝子によってコードされます。AIM2は、インフラマソームの一部であり、細菌のDNAおよびヘルペスウイルスのDNAに対する防御に貢献しています。AIM2は、アミノ酸1〜87個から成り立っているN末端のDAPIN(またはピリン)ドメインとアミノ酸138〜337から成り立っているC末端のHIN-200ドメインを持つ343個のアミノ酸から成り立っているタンパク質で、2つのオリゴヌクレオチドと結合してる皺襞(ひだ)を持っているのがAIM2というPRR(Pattern recognition receptor、訳してパターン認識受容体)です。病原体や腫瘍を認識すると、その病原体や腫瘍を駆逐するために様々な機能を発揮するのです。
AIM2は、IFN-γ(インターフェロン-ガンマ)によって発現が誘導され、腫瘍形成を起こす細胞増殖を制御するのです。インターフェロンガンマはAIM2の発現を誘導します。タンパク質AIM2のC末端のHINドメインは、ヘルペスウイルスや細菌や宿主の二本鎖DNAに結合し、細胞質ゾルのdsDNAセンサーとしてdanger signalとして機能します。これにより、インフラマソーム複合体がオリゴマー化されます。AIM2のN末端ピリンドメインは、別のタンパク質ASC(Apoptosis-associated speck-like protein containing a CARD、訳してCARDドメインを含んでいるアポトーシス関連スペック様タンパク質)のピリンドメインと相互作用します。ASCには、プロカスパーゼ-1を複合体まで動員するCARDドメイン(カスパーゼ活性化ドメインと動員ドメイン)を含んでいます。ASCのこの働きにより、カスパーゼ-1が自動活性化されます。このカスパーゼ1は炎症性サイトカインであるIL-1bおよびIL-18を加工する酵素です。核膜の正常な状態が薬理学的破壊によって。AIM2インフラマソームは活性化されます。というのは、核膜が破壊されると核内の様々な成分がDAMPとしてAIM2に認識されるからインフラソームが活性化されるのです。AIM2発現レベルの上昇は、ヘルペスによって生ずる乾癬患者の皮膚細胞に見られます。乾癬(かんせん)とは、ヘルペス感染細胞がヘルペスに破壊されると皮膚から少し盛り上がった赤い発疹(ほっしん)の上に、銀白色のフケのような垢(あか)が付着し、ポロポロとはがれ落ちる病気です。全身性エリテマトーデス(SLE)において見られるヘルペスによるリソソーム機能不全は、核内から漏れ出たDNAが細胞質ゾルへ漏れ出て、AIM2を活性化させてしまい、その結果1型のインターフェロン(IFN-α、IFN-β)が増えてしまうのです。増えた1型のインターフェロンはヘルペスが隣接する細胞に感染しないようにPRRであるAIM2が働きだすのです。リソソームとは、酸性に保たれた細胞内小器官(オルガネラ)の一つであり,複合糖質や脂質などの細胞内基質の分解に関わり、リソソーム内部には酸性pH条件下で働く種々の加水分解酵素(リソソーム酵素)が存在し,エンドサイトーシスやオートファジーにより細胞内外から取り込まれた生体分子を加水分解します。分解されて生成したアミノ酸,糖そして脂質は再利用されるので、リソソームは細胞内の「リサイクル工場」なのです。しかし、ヘルペスによってリソソームも破壊されると、リソソーム機能不全が生じるのです。
全身性エリテマトーデス(SLE)は、自己免疫疾患の代表ですが、そもそも自己免疫疾患は絶対にありえない病気です。それではどのようにして自己免疫疾患の証拠である抗核抗体が生まれるのでしょうか? ヘルペスによって破壊された核内から漏れ出たDAMPの一分子である核の成分をたまたま認識したBリンパ球がヘルパーT細胞に依存せず認識し作りだして血中に放出した分泌IgMクラスの抗核抗体がSLEの患者に見られた時、自己免疫疾患の証拠と言い張っているのが現代の自己免疫論者の間違った主張なのです。あくまでもヘルペスによって核が破壊されたDAMPの分子にすぎない核の成分が全ての自己免疫疾患の原因であることに気がつかないのです。言い換えると、原因と結果を逆にしてしまっているのです。例えばアルツハイマーの病気の原因もヘルペスが海馬の細胞に感染した時にヘルペスの増殖と共に傷ついたり破壊された後に細胞から漏れ出た残骸、つまりDAMPがアミロイドβであるのにアミロイドβ自身がアルツハイマーの原因であると言っているのと同じなのです。
このように自己免疫疾患や原因不明の病気は全てヘルペスによるものであることを認めない限り永遠に現代の病気を治す切ることは不可能でしょう。病気を治すことほど簡単なことはないのに。残念です。
9)PKR(Protein kinase R) プロテインキナーゼR(PKR)は、セリン-スレオニンキナーゼであり、 mRNAの翻訳、転写制御、アポトーシスの調節、および細胞増殖のような主要な役割を果たしています。そのようなPKRの働きの調節不全は、癌や、神経変性、炎症、および代謝障害に関わっています。
PKRはインターフェロンを誘導することによって、ウイルス感染から細胞を保護します。
プロテインキナーゼR(Protein kinase R、略してPKR)は、ウイルス感染によって細胞に導入されたウイルスの二本鎖RNA(dsRNA)によって活性化されます。PKRには、N末端のdsRNA結合ドメイン(Double-stranded RNA-binding domain、略してdsRBD、訳して二重鎖のRNAに結合するドメイン)とC末端の キナーゼドメインが含まれており、アポトーシス促進(計画された細胞死)機能を持っています。dsRBD(Double-stranded RNA-binding domain)は、保存された二本鎖RNA結合モチーフの2つのタンデムコピー(tandem copy)であるdsRBM1とdsRBM2の2つのモチーフで構成されています。dsRBM1は英語でdouble-stranded RNA-binding motif 1であり、dsRBM2はdouble-stranded RNA-binding motif 2です。タンデムコピー(tandem copy)とは、dsRBM1とdsRBM2の2つのモチーフの末端に、突出末端部の配列が同じ酵素部位を付加し2個のモチーフが結合して縦列に並ぶことによって、コピー同士が切り離せないフラグメントになることです。
ヘルペスなどのウイルス感染の状況では、ウイルス複製と遺伝子発現によって作成されたdsRNAがN末端ドメインに結合し、タンパク質を活性化します。活性化すると、PKRは真核生物の翻訳開始因子eIF2α(Eukaryotic Initiation Factor 2)をリン酸化することができます。これはさらなる細胞のmRNA翻訳を阻害し、それによってウイルスタンパク質合成を防ぎます。ElF2α(Eukaryotic Initiation Factor 2、略してeIF2)は複製開始コドンであるAUGコドン(メチオニン)からの一般的な開始翻訳に関与しているため、代わりに代替の非AUG開始が行われます。非AUG開始を使用するmRNAの例は、熱ショックタンパク質のmRNAです。活性化PKRは、その阻害サブユニットであるIkBをリン酸化することにより、転写因子NFkBの活性化を仲介することもできます。活性化されたNFkBは、インターフェロンサイトカインの発現をアップレギュレートします。インターフェロンサイトカインは、抗ウイルスシグナルを局所的に拡散する働きをします。活性化PKRは、細胞周期と代謝を調節する腫瘍抑制因子PP2Aを活性化することもできます。複雑なメカニズムを通じて、活性化PKRは細胞アポトーシスを誘発し、さらなるウイルスの拡散を防ぐこともできます。 PKRストレス経路の中で、PKRは、病原体、栄養素の不足、サイトカイン、照射、機械的ストレス、小胞体ストレスなどのさまざまなストレスシグナルに対する細胞応答の中心にあります。PKR経路は、JNK、p38、NFkB、PP2A、eIF2αのリン酸化などの他のストレス経路の活性化を通じてストレス応答を引き起こします。折りたたまれていないタンパク質の過剰によって引き起こされる小胞体ストレスは、炎症反応を引き起こします。PKRは、IKK、JNK、ElF2α、インスリン受容体などのいくつかの炎症性キナーゼと相互作用することにより、この応答に寄与します。この代謝的に活性化された炎症性複合体は、代謝インフラマソームまたはメタフラマソームと呼ばれます。PKRは、ミトコンドリアの小胞体ストレス応答(UPR mt)にも関与しています。ミトコンドリアの小胞体ストレス応答では、PKRは転写因子AP-1を介して誘導され、PKRを活性化できるPACTとは独立して活性化されます。ヘルペスウイルスはPKRが炎症により殺されないための様々な機構を身に付けました。ヘルペスなどは、デコイdsRNA、分解、ウイルスdsRNAの隠蔽、二量体化ブロック、基質の脱リン酸化、または偽基質によってPKRの働きから逃れることができるのです。 たとえば、エプスタインバーウイルス(EBV)は、自分の遺伝子EBER1を使用しておとりdsRNAを生成します。これが、バーキットリンパ腫、ホジキン病、鼻咽頭癌、およびさまざまな白血病などの癌を作り出してしまうのです。おとりdsRNAとは何でしょうか? プロテインキナーゼR(PKR)は、自然免疫経路の重要な抗ウイルス成分であり、EBウイルスなどのウイルスの二本鎖RNA(dsRNA)によって活性化されます。他にアデノウイルスが作り出すRNA1は、PKRに結合することによっておとりとして機能しますが、PKRの活性化は誘導せずに、逆におとりRNA1(VAI)によってPKRの抗ウイルス応答を阻害します。RNA1は多く存在する非コードウイルスRNAです。おとりRNA1(VAI)では、高親和性PKR結合を仲介する拡張ヘリックスが生成されますが、PKRを短すぎてアクティブ化できません。アデノウイルスと同様に、エプスタインバーウイルスは高濃度の非コードRNA、EBER1を生成します。PKRとおとりRNA1(VAI)およびEBER1との相互作用を比較しますと、両方のRNAは、dsRNAを介したPKR活性化の阻害剤として機能します。ただし、EBER1はPKRを弱くアクティブにしますが、VAIはアクティブにしません。PKRはVAIよりも弱くEBER1に結合します。生理学的イオン濃度でのアッセイは、両方のRNAが2つのPKRモノマーに対応し、PKR二量体化を誘導できます。
PKRに対するウイルス防御メカニズム
| 防御タイプ | ウイルス | 分子 |
| デコイ(おとり)dsRNA | アデノウイルス | VAI RNA |
| エプスタインバーウイルス | EBER | |
| HIV | TAR | |
| PKRの劣化 | ポリオウイルス | 2A pro |
| ウイルスのdsRNAを隠す | ワクシニアウイルス | E3L |
| レオウイルス | σ3 | |
| インフルエンザウイルス | NS1 | |
| 二量体化ブロック | インフルエンザウイルス | p58 IPK |
| C型肝炎ウイルス | NS5A | |
| 疑似基質 | ワクシニアウイルス | K3L |
| HIV | Tat | |
| 基質の脱リン酸化 | 単純ヘルペスウイルス | ICP34.5 |
リン酸化PKRおよびeIF2α(Eukaryotic Initiation Factor 2、略してeIF2)がアルツハイマー病(Alzheimer’s disease、略してAD)患者の海馬および前頭皮質の変性ニューロンで活性化しています。それはアルツハイマーの原因は海馬がヘルペスウイルスに感染して傷つき崩壊した時に、細胞内から放出されたDAMP moleculesを処理するためにPKRが活性化されるためです。さらに、これらのニューロンの細胞周辺に見られる、リン酸化タウタンパク質に対するIgM抗体が見られるのはDAMP molecules(細胞傷害関連分子パターンの分子)に対してBリンパ球が一時的に作った抗体がIgM抗体であります。活性化されたPKRは、細胞質および核に特異的に見られ、ニューロンのアポトーシスマーカーと共に局在していたのはDAMPの処理をするのがPKRであるからなのです。血中および脳脊髄液中にPKRよりもリン酸化PKRが多いのはPKRを活性化してDAMPの処理をする必要があるからです。 ADの患者では、異常な高さの総PKRおよびpPKRレベルが見られるのは神経細胞である海馬の細胞に感染したヘルペスが脳細胞を崩壊させた後のDAMPによって生まれた分子(molecules)を処理するために、PKR-eIF2αアポトーシス促進経路が活性化してヘルペスウイルスのみならずヘルペス感染細胞を殺したり、傷つけたりした結果、海馬の神経細胞が変性し、神経病理学的病変を引き起こすにも関わらずPKRがアルツハイマーの責任の一端を担っているなどというアホなことをいう医学者が多すぎます。原因と結果をさかさまにしているからです。いくら結果を原因だと思い込んで研究しても全て無駄です。
PKRの活性化は、アルツハイマー病患者のBACE1(β部位APP切断酵素)発現の抑制解除を介してアミロイドβペプチド(Aβ)の蓄積を引き起こされるのはヘルペスが海馬の細胞に感染したために正常な働きが出来なくてBACE1が発現できなくなるからです。APPとは、英語でamyloid precursor proteinで略してAPPで、訳してアミロイド前駆体タンパク質です。BACE1とは、β-secretase(β- セクレターゼ)とも言い、BACE1 の英語はbeta-site APP cleaving enzyme 1です。BACE1は、ニューロンでアミロイドβペプチドを生成するための主要なベータセクレターゼ(酵素)の役割を果たしています。つまり酵素であるBACE1(β-secretase)が活性化するとアミロイドペプチドが産生されてアルツハイマーが生ずると言われていますが、これは大間違いです。アミロイドβはアルツハイマーの原因ではないからです。通常、BACE1プロモーターの5’非翻訳領域は英語で5’untranslated region、略して5’UTRは、BACE1(β-secretase)遺伝子の発現を基本的に阻害します。なぜかというと、ヘルペスが感染している神経細胞がDAMPの moleculesになることは絶対にないからです。ところが実際にヘルペス感染が起こってしまうとBACE1の発現が必要となってしまうのです。BACE1の発現によってeIF2a(Eukaryotic Initiation Factor 2a)がリン酸化されて活性化され、BACE1の5’UTRによって発揮される阻害効果が逆転し、阻害効果がなくなってアルツハイマーが生ずると言われていますが、これは大間違いです。なぜならばeIF2aのリン酸化はヘルペスウイルスが感染した海馬の細胞の処理のためにはPKRの活性化が必要であり、PKRが活性化するとBACE1の阻害効果がなくなります。まさに単純ヘルペスウイルス(HSV)や酸化ストレスなどを起こすヘルペスウイルスによる細胞感染は、PKR-eIF2a経路の活性化を通じてBACE1の発現を増加させ、傷ついた細胞をPKRによって処理するのです。さらに、BACE1の活性の増加はAPP-βCTFの合成につながります。APP-βCTFは英語でC-terminal fragment of APP, βCTF、別名C99 AD(Alzheimer’s disease)のエンドソームのβ-アミロイド前駆体タンパク質の非常に活性の高い(APP-βCTF)誘発性機能障害を起こすβ部位を切断されたカルボキシ末端フラグメントを生み出すのです。エンドソームは、非常に活性の高いβ-アミロイド前駆体タンパク質β(APP-βときにβ-APPとも書く)のプロセシング部位(処理部位)であり、β-アミロイド前駆体タンパク質のβ部位を切断してしまいC-terminal fragment of APPを作ってしまうのです。ヘルペス感染細胞の傷害により異常になったエンドソームは、初期のエンドソーム抑制因子であるrab5というタンパク質の発現のアップレギュレーション(増加)を起こしてしまいます。以上は、AD(Alzheimer’s disease)における最も初期の既知のアルツハイマーに特異的な海馬のニューロン応答です。まずBACE1の活性の増加は、APP-βCTFの合成につながり、次にβCTFのレベルが上昇すると、rab5の過剰活性化が引き起こされ、βCTF(C-terminal fragment of APP、別名C99)は、APPL1は英語でAdaptor Protein, Phosphotyrosine Interacting With PH Domain And Leucine Zipper 1といい、アダプタータンパクとして様々なタンパク質を集め、様々な役割があり、APPL1はrab5があるエンドソームに動員され、そこでAPPL1はrab5をGTPに結合させて活性化します。GTPは英語でguanosine triphosphateで、訳してグアノシン三リン酸で、略してGTPで、細胞内シグナル伝達やタンパク質の機能の調節に用いられ、Rab5タンパク質は、GTPと結合することによって活性化され、GDP結合によって非活性化される状態を交互に繰り返すのです。GTP-rab5は病理学的に加速されたエンドサイトーシス、エンドソームの腫れ、およびrab5エンドソームは神経の軸索輸送を選択的に障害され、神経細胞の働きに異常が起こるのです。これも元はと言えば、神経細胞に感染したヘルペスウイルスが原因なのです。
GTPとGDPとは何でしょうか? GTPは、英語でguanosine tri-phosphateで、訳してグアノシン三リン酸、略してGTPは、ヌクレオチド(核酸)であり、正式名はグアノシン-5′-三リン酸です。グアノシン二リン酸 (guanosine di-phosphate、略してGDP) からアデノシン三リン酸 (ATP) のリン酸を受容して生合成されます。類似した構造を持つ ATP が生物体内で高エネルギーリン酸結合のエネルギーを利用して、様々な生合成や輸送、運動などの反応に用いられるのに対し、GTP は主として細胞内シグナル伝達やタンパク質と結合してタンパク質の機能の調節に用いられます。GTPは、GTPアーゼの作用によってグアノシン二リン酸(GDP)に変換されるセカンドメッセンジャーメカニズムにおいて、特にGタンパク質を用いたシグナル伝達に不可欠です。
GTPが関わる生合成反応ではRNA合成やその他ヌクレオチドの合成に用いられ、多糖の生合成では中間産物であるGDP-グルコース、GDP-マンノースなどグアノシン二リン酸-糖とも言われるGDP糖の合成に用いられます。言うまでもなく、GDPはグアノシンヌクレオシドのピロリン酸エステルです。つまり、GDPはピロリン酸基、五炭糖のリボースそして核酸塩基のグアニンから構成されています。
GTPと結合するタンパク質を下に掲載しておきます。これらは各機能の1サイクルごとに GTP 1分子と結合し、GDP に加水分解したのち解離します。
