父親と母親のうち、どちらのHcの対立遺伝子が使われるかどうかについて、もっと詳しく述べましょう。もちろんBリンパ球は骨髄で作られますから、HcもLcも当然骨髄で作られた後、成熟リンパ球として末梢血に出て行きます。それではどのようにBリンパ球が骨髄で作られ、かつHcやLcが作られるかを詳しく勉強しましょう。
専門的になりますが、造血幹細胞から血球が作られていく系統図を下に掲げますから、それを見ながら説明していきましょう。あらゆる血球は、図の一番左にある骨髄の多能性造血幹細胞(HSC)から作られていきます。次にその右の多能性前駆細胞(MPP)になります。さらにBリンパ球とTリンパ球に分化するには、インターロイキン7(IL-7)というサイトカインを増殖因子として受け取る必要があります。IL-7に刺激された多能性前駆細胞(MPP)が右下のリンパ系共通前駆細胞(CLP)になり、それがさらにB前駆細胞(Pro B)になります。Pro Bは、さらにIL-7と幹細胞因子(SCF)というサイトカインに刺激されてプレB細胞(Pre B)になり、最後はインターロイキン4(IL-4)というサイトカインの刺激で成熟B細胞になって骨髄から末梢血に出て行くのです。ところが今問題にしているHcやLcがどのレベルで出来上がるかについての研究は、私の知るところではまだされていません。
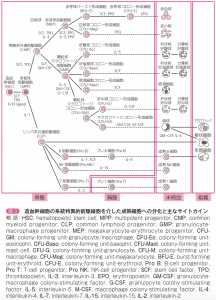
いずれにしろ成熟B細胞になるまでに、骨髄にあるサイトカインのインターロイキン7(IL-7)とSCFやインタロイキン4(IL-4)などのシグナルをいち早く受け取って、それをHcに変えた対立遺伝子が勝利を収めるのです。。
このようにして父と母のHcの対立遺伝子の一方が勝利を収める可能性も実は9回のうち1回しかないということがわかっています。この1回を“productive rearrangement”といいます。“productive rearrangement”は、日本語では、Hcの「生産的再編成」と訳せば良いでしょう。このようにしてHcが価値ある生産的再編成を終えると、このHcがBリンパ球の膜に輸送され、細胞膜に固定されます。いわばBCRの赤ちゃんみたいなものですね。そうすると負けた側の対立遺伝子に「Hcのタンパクを決める支配は終わりましたよ」と伝えることになります。
Hc(Heavy chain)の生産的再編成が終われば、いわば、次にLc(Light chain)の対立遺伝子が父親のものであるか母親のものであるかを決めるゲームが始まります。この戦いもHcの対立遺伝子の選択と全く同じ戦い方をやります。Hcと同じく勝った方のLcがBリンパ球の細胞膜に運ばれ、既に膜にあるHcと結びつきます。もちろんLcとHcをうまくつなぎ合わせることができなければ、正常な抗体ができないので、この時にはB細胞は自殺(アポトーシス)するようになっているのです。
毎日毎日10億もの多くの抗体(B cell receptor)をこのような複雑でかつ難しい遺伝子の組み合わせを行うことによって、あらゆる異物に対してピッタリ合う抗体を作っているにも関わらず、免疫の働きを抑えて作らせないようにするのは間違いだと思います。
遅まきながら、軽鎖のλ(Lambda)とκ(Kappa)の違いは何によって区別されるか述べていなかったので、今説明しておきます。軽鎖にも重鎖と同じく定常領域があります。この定常領域の違いによって、λ鎖とκ鎖の2種類に分けるのです。もちろんこの軽鎖の定常領域は抗体のクラスの種類とは関係ないことを確認しておいてください。残念ながら軽鎖の定常領域の意味付けは誰もしていません。この疑問もいずれ私が出すつもりです。アッハッハ!
さて、どのようにしてHcとLcが作られるかプロセスを説明した後で、それではなぜ多発性骨髄腫においてはLcがたくさん作られてしまうのか考察してみましょう。逆になぜHcが多過ぎる多発性骨髄腫はないのでしょうか?これについても考えてみましょう。まず最初に抗体(B cell receptor)は、Hcが作られ、B細胞の膜にまず運ばれることは既に説明しました。1個のBリンパ球に“B cell receptor”は少なくとも5万個はあるといわれています。従って5万個のHcが作られれば、それで十分でありますが、それ以上多くのHcが作られたとしても、膜にひっつかない過剰なHcは作られないようになっています。もし無限に過剰に作られることになれば、Hcが血中に出るはずです。必要な分だけ作られたHcが膜についた後にLcが作られ、B細胞の細胞膜にLcがつけられるわけですから、Hcと結びつく以下の過少な数ではなくて、過剰なLcが作られる可能性は当然だと考えられます。従って作られすぎたLcは、多発性骨髄腫ではない全ての人の血中にも見られるのは当然なのです。だからLcが多いからといって多発性骨髄腫とは言えないのです。ところが平均よりもたくさん作られるときに、Mタンパクという軽鎖が過剰に血中に出流のも当然のことなのです。さらに血中からこのMタンパクが尿に漏れ出て、ベンスジョーンズ蛋白(Bence Jones Protein:BJP)として尿に出るのも不思議ではないのです。
このように考えていくと、何を基準として多発性骨髄腫と診断すべきかどうか、難しい問題となります。ここでもう一度多発性骨髄腫の臓器障害の診断について振り返ってみましょう。5つの臓器障害があります。
①高カルシウム血症[C](血中カルシウム値>11mg/dlまたは基準値より1mg/dlを超える上昇)、“calcium”に関わる障害なので[C]として表します。
②腎機能の低下[R](血清クレアチニン>2 mg/dl)、腎臓は“renal”と言いますから[R]で表します。
③貧血[A] (ヘモグロビン値10 g/dl未満または基準値より2 g/dl以上低下)、貧血は英語で“anemia”と言いますから[A]で表します。
④骨病変[B]、骨は“bone”ですから[B]で表します。
⑤その他[O](過粘稠度症候群,アミロイドーシス、年2回以上の細菌感染)、その他は“others”ですから[O]で表します。
①〜⑤の障害の英語の頭文字を並べて[CRABO]と覚えやすくまとめることができます。[CRABO]のうち1つでも障害がある場合には症候性骨髄腫と診断されていますが、このような症状は滅多に出るものではないのです。
多発性骨髄腫の現在の治療は、従来用いられてきたメルファランなどの細胞障害性抗がん剤とステロイド剤に加えて、さまざまな薬剤(ボルテゾミブ、レナリドミド、サリドマイド、ポマリドミドなど)が保険承認され、色々組み合わせた薬物療法が行われています。しかし、これらの薬の添付文書を読んでもらえばわかりますが、元の多発性骨髄腫の病気そのものよりも大変に重い副作用が出るのみならず、どんな薬の組み合わせをしても多発性骨髄腫を治すことはできないので、余計な薬物療法をやるよりも何もしないで経過観察が最高の治療法だと私は考えています。生死を分かつ時にはステロイドは治療薬ではなくて蘇生薬として使うべきものです。
私は既に述べたように、某有名大学で多発性骨髄腫と8〜9年前に診断されて「治療しなければ生命が危ない」と言われたある1人の患者さんを漢方煎じ薬だけで診ていますが、元気モリモリで生命には全く異常はありません。またもう1人別の患者さんは、ある医院で多発性骨髄腫の疑いがあると言われ、Mタンパクも多く軽鎖のλ鎖やκ鎖や尿タンパクも見られますが、何十年も経過を見ているだけで、健康や生命に何の異常もない方もいらっしゃることを伝えておきましょう。
