免疫グロブリンの中に含まれているIgAが腸管免疫の中でどのように腸管にいる200兆個の細菌と共存しているかという話をしましょう。
まずIgGとIgAはどこが違うのでしょうか?いつもいつも言っていますように、IgGは生きた敵を殺すための武器であります。従って殺し合いになるので炎症が起こります。医者も患者も炎症という言葉を気軽に使っていますが、残念ですが実は深い意味があることを十分に理解していない節があります。まず、IgAの性質や一般的な役割についてまず説明しましょう。
人体の中で一番多いのは実はIgGではなくてIgAなのです。確かにIgGは血液中では最も多い抗体でありますが、IgAは残りの4つの抗体であるIgD、IgG、IgM、IgEを合わせた抗体の量よりもたくさん作られているのです。なぜそんなにたくさんIgAを作る必要があるのでしょうか?それは人体の腸管の粘膜を守るための抗体であるからです。もちろん他の粘膜を守ってくれるのは言うまでもないことです。既に書きましたが、人間は腸管の粘膜表面を400㎡も持っているので、その全てを守る武器はまさにIgAであるからです。粘膜というのは消化器官、呼吸器官、泌尿生殖器官が含まれます。従って、IgAは血管に流れているのではなくて、粘膜を持っている器官の下に配置されているのです。何回も言いますが、粘膜の表面で作られるのではなくて、粘膜の下のリンパ節で作られていることを忘れないでください。実際に粘膜下に、例えばlamina propria(粘膜固有層)にいるB細胞の80%がIgAだけを産生しているのです。もちろん残りの20%のB細胞は、IgGやIgMやIgEを作っているのです。B細胞というよりもB細胞が分化した形質細胞が作っているのです。
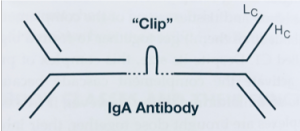
それではなぜIgA抗体は粘膜の防壁を超えて粘膜下に侵入した敵に対して腸管を守るのに、IgGよりも上手に仕事ができるのでしょうか?IgA抗体について図を見ながら説明しましょう。粘膜下組織(例えばlamina propria)で作られたIgA抗体は、2つが結びつけられています。それは図のように“clip”で結びつけられて二量体になっています。この“clip”は“J chain”といいます。“J chain”は“Joint chain”という意味で使われています。IgA抗体はもちろん血中にもあるのですが、血中にあるときには“J chain”で結びつけられてはいなくて、単体で行動します。“J chain”で結びつけられた二量体は、粘膜の上皮細胞によって取り込まれ上皮細胞の中を通り抜けて、粘膜の表面に出ることができるのです。これをトランスサイトーシスといい、英語で“transcytosisと書き、日本語ではまだ訳されていません。例えばこのトランスサイトーシスで腸管の上皮細胞をくぐり抜けて腸管腔まで出てしまうと、腸管腔にいる敵である莫大な細菌と結びついてしまうと、その細菌どもは腸管の上皮細胞にひっつくことができないのです。ひっつかない限りは上皮細胞に入り込んで、粘膜下まで侵入することはできないのです。しかもIgGよりも両手が2倍ありますから、数多くの細菌と結びつくことができるので効率がいいのです。4つの手で結びついた細菌を粘液や便と一緒に人体から排除することできるのです。
さらに“J chain”で結びついた二量体のIgA抗体は腸管腔にある様々な酵素や酸に対して極めて強いので溶かされることがないのです。皆さん、お母さんの母乳にたくさんIgA抗体が含まれているのを知っていますか?この二量体のIgA抗体はミルクとともに、赤ちゃんの腸の粘膜に引っついて、赤ちゃんが取り込む様々な細菌に対して防御の仕事もしてくれるのです。なぜならば赤ちゃんの体に入る細菌のほとんどが口から侵入するからです。ところがIgGの方がIgAよりも抗体として勝っている点があります。それは“J chain”は上の図を見ればおわかりのように、2つのIgAのしっぽ(Fc部分)に引っ付いているので、補体が引っ付くことができない点であります。補体について思い出してもらいたいのですが、補体の活性化経路で古典的経路のことを覚えておられますか?C1(C1qC1rC1s)は、IgMとIgGでしか活性化されないのです。IgAは補体の活性化とは全く関係ないのです。
もちろんIgAは腸管で補体と結びつくと炎症が起こるので、目的的に補体と結びつかないようになっているので、粘膜以外で作られることがないのです。つまり補体と結びつかないということが二量体のIgAの長所であり、二量体でなければならない理由であります。というのは、炎症を起こす好中球や大食細胞やNK細菌は、IgAのしっぽの引っ付くことがないので炎症が起きないからです。もしIgAのしっぽに補体がついたり、炎症細胞である好中球や大食細胞やNK細菌が引っ付いてしまえば、それこそ毎日腸管は炎症を起こし続け、食べたものが吸収されないどころか、慢性炎症性腸疾患を起こして人類は滅びてしまうでしょう。もちろん、炎症性腸疾患といわれる自己免疫疾患は、細菌と戦っている病気ではないのですよ。戦わないようにIgA抗体がいつも腸管の粘膜のみならずあらゆる人体の粘膜を守っているからですよ。従ってクローン病や潰瘍性大腸炎は細菌との戦いで生ずる病気ではないのです。いつも言っているように、化学物質とIgGで戦っているだけです。IgGをIgEにクラススイッチしてアレルギーに変え、最後は免疫寛容で化学物質と共存できるようになっているのです。
にもかかわらず、消化器の専門家の先生方は、一切IgAの話もクラススイッチの話も免疫寛容の話もしませんね。私のようなアホでもわかっていることが、どうして最優秀の先生方が気づいていないのか、私は不思議でなりません。この世にIgGをIgAにクラススイッチする意味は、まさに腸管腔に死ぬまで1000種類の200兆といわれる腸内細菌と炎症を起こさないために生命発生以来38億年の免疫の進化の賜物であるのです。要するに細菌を腸管の粘膜組織であるlamina propria(粘膜固有層)に入り込まさないためにIgGやIgMをIgAに変えてしまうという離れ業を高等免疫が演じる舞台が、まさに腸管の粘膜であるのです。
ちなみに、抗体の働きを現代医学は液性免疫という言い方をしますが、これは実は間違っているのです。IgGやIgMは確かに血液やリンパ液という液体を通じて運ばれ、炎症を起こしている組織の戦場で活動しています。ところがIgAはほとんど血液やリンパ液を通じて仕事をすることはありません。ただし腸間膜リンパ節で作られた抗体やT細胞は血管やリンパ管を少しだけ利用することはありますが。さらにパイエル板のM細胞で運ばれた抗原が腸間膜リンパ節に運ばれるときに、リンパ管を少しだけ利用することがありますが。いずれにしろ、あくまでもIgA抗体は粘膜下で作られ、粘膜の表面に分泌される抗体でありますから、IgAのことを分泌抗体ということがあります。しかもこの分泌抗体であるIgAの方がはるかにIgGやIgMよりも大量に作られているわけですから、抗体の働きは本当は量からいくと分泌免疫というべきではないでしょうか?アッハッハ!この事実も私が世界で初めて見つけたのですが(??)、ノーベル賞はもらえるでしょうか?アッハッハ!
以上をまとめながら、さらに腸管免疫におけるIgAの働きをもっと具体的に補足しながらお話しを続けましょう。lamina propria(粘膜固有層)にいるB細胞(形質細胞)によって生み出された抗体がIgA抗体であります。IgAは特別にあらゆる粘膜の表面を守るために、粘膜の下の結合組織で作られた抗体であります。二量体になったIgA抗体は、トランスサイトーシス(transcytosis)という働きによって上皮細胞を通りぬけ、腸管腔に放り返されます。放り返された二量体のIgAは腸管腔にいる敵と戦って炎症を起こすのではなくて、便に排除するという平和的な受身的な仕事をするのです。これはちょうど殺しきれない化学物質をIgE抗体で排除するのと非常に似ていると思いませんか?もっと似ているのは、私が世界で初めて見つけた真実でありますが、アレルギーも最後はアレルゲンと免疫寛容をTGFβによって起こすことによってアレルゲンと共存できるという最終段階は、分泌抗体であるIgAもTGFβによって免疫寛容を起こすことによって腸管の常在菌と共存しているのです。この意味でも、IgAとIgEは同じ仲間といえます。
IgA分子が単に腸管腔のみならず、あらゆる人体の腔にいる細菌が腔を覆っている粘膜上皮細胞を超えて、実質細胞でできている粘膜下に入ることを防御するのみならず、わざわざ粘膜下から上皮細胞を通り抜けて、腔にまで出て、その腔の中にいる細菌を粘膜下に入れまいとするのみならず、さらに粘膜下(lamina propria)に入ってくる敵をも、二量体のIgAと結びつけて、細菌という荷物を再び粘膜上皮細胞を通り抜けて腸管腔まで追い返して、最後は便として排除するという涙ぐましい平和的な防御作戦をとっているのです。あくまでもIgA抗体は炎症を絶対に起こさないという涙ぐましい戦いを一生やってくれるのです。繰り返しになりますが、最も重要な分泌IgAの働きは、絶対に炎症を起こさないということです。このIgA抗体のFc部分は、いわゆる免疫系の細胞が持っているどんな受容体とも結びつくことができないようになっており、従って炎症反応は絶対に起きないようになっているのです。反対にIgGが炎症を起こすことによって人体を本当の細菌から守るために生まれてきたのとは、まさに対照的ですね。
皆さんレチノイン酸をご存知ですか?レチノイン酸とはビタミンAの代謝産物ですね。このレチノイン酸が腸管の樹状細胞から作り出され、Bリンパ球からIgAの産生を促進するということがわかりました。さらにレチノイン酸がIgAを分泌する形質B細胞に「お前の家は腸管である」ということを刻印させ、たとえ腸管のリンパ節から血管やリンパ管を通って人体をあちこち動き回っても、必ず最後は腸管の周辺の組織に戻るということがわかっております。さらにIgGやIgMからIgAにクラススイッチするためには、CD4+のヘルパーT細胞に発現しているCD40LがB細胞の細胞膜に発現しているCD40に引っ付く必要があるごとはご存知ですね。このT細胞のCD40Lの働きが共刺激(Co-stimulation)であることは既に述べたことがあります。
腸の免疫システムではB細胞はこのT細胞の共刺激の働きがなくてもIgAを作るクラススイッチが可能であるのです。それがCD40Lの働きに変わる他のタンパク質が腸管の環境の中にあるのも分かっております。その他のタンパク質が腸管のB細胞に発現しているCD40 というタンパク質に結びついて共刺激の役割を果たしているということも分かっております。これについては次回さらに詳しく書きます。
とにかく先ほども述べたように、現代の免疫学は腸管の免疫がいかに特殊であり免疫寛容を起こしやすいかということを全く理解していないのです。残念です。私はアホですが、勉強すればするほど、自己免疫疾患はあり得ないどころか、永遠に治らないと宣告されているクローン病や潰瘍性大腸炎などの炎症性腸疾患も、患者の免疫で炎症性腸疾患の原因である化学物質に対して、最後はTGFβを作って免疫寛容を起こして必ず治るということを理論的に証明するために勉強し続けています。
いくらでも難しい免疫の真実と理論を書き続けることができますが、次回乞うご期待!単に理論を勉強しているわけではないのです。毎日の臨床で患者の免疫で治させる仕事をしております。何が一番楽しいかと言いますと、世界中の医者が絶対に直せないと断言する病気を治すことほど楽しいことはありません。世界中の医者が私の真似をしてくれることを念じながら今日の仕事はここで終わります。
